一种低共熔溶剂提取鱼鳞中羟基磷灰石和胶原蛋白的方法与流程
本发明涉及一种使用低共熔溶剂从鱼鳞中提取羟基磷灰石和胶原蛋白的方法,属于提取工艺技术领域。
背景技术:
在中国的鱼类加工和生产过程中,产生了数万吨的鱼鳞。鱼鳞的构造可以分为两层:上层主要为羟基磷灰石等无机成分,下层主要为蛋白质的纤维板层。鱼鳞中主要含有羟基磷灰石和胶原蛋白。从鱼鳞中将这些物质提取出来,不仅可以增加鱼类的附加值,还可以减少环境污染。羟基磷灰石和胶原蛋白还可以用于许多领域,例如食品领域、生物医药领域、电化学领域和化妆品领域。如提取后的胶原蛋白,可以制成可食性的蛋白膜,也可制成片状或粉状的胶原止血剂,还可制作胶原蛋白面膜等化妆品。鱼鳞中的羟基磷灰石可以作为重金属、染料的吸附材料以及药物载体、骨修复替换材料等。对鱼鳞中羟基磷灰石和胶原蛋白的提取,不仅可以提高鱼体的经济价值,促进水产加工产业的发展,还可以减少环境污染,从而创造良好的经济与社会效益,有利于可持续发展。
羟基磷灰石的制备方法包括化学合成法以及天然羟基磷灰石制备法。天然羟基磷灰石制备法包括高温煅烧法和溶剂提取法。溶剂提取法包括酸法、碱法、酶法以及酸酶复合法等。化学合成羟基磷灰石有反应温度高、反应时间长、产物活性小、尺寸分布范围宽、不均匀、污染环境、安全性差等问题。因此,近年来,研究者开始从各种生物废料,如蛋壳、珊瑚、猪骨、牛骨、鱼鳞等中制备天然羟基磷灰石。相对于化学合成法,后者具有生物安全性高、成本低等优点。此外,所含天然羟基磷灰石资源丰富、价格低廉,因此从天然物质中提取羟基磷灰石成为近年研究的热点。然而,在极高的温度下煅烧制备羟基磷灰石,会引起ha晶格中的羟基分解脱落,形成缺氧羟基磷灰石,生物活性也会随之降低;酶法提取的成本较高;酸碱提取法中,大量酸碱的使用会损坏仪器设备。同时也会污染环境。因此采用新的方法来提取羟基磷灰石具有很大的发展前景。胶原蛋白的提取方法包括碱法、盐法、酸法、热水法、酶法和离子液体提取法。热水提取法,在加热时胶原蛋白肽链由右手螺旋分解为单链形式,轻微变性。酸提取法,迅速并且彻底,但会破坏部分丝氨酸和酪氨酸。且前处理的时候不能采用酸,否则杂蛋白难以除去。碱提取法,操作简便,迅速彻底,但是会破坏一些氨基酸,如羟脯氨酸、强赖氨酸。此外,还会产生消旋作用,会引起所提取的胶原蛋白有致畸致癌性。此外,该法提取的胶原蛋白相对分子量较小,应用价值并不高。酶法提取胶原蛋白温度较低,可以控制对胶原蛋白分子的破坏性,但需要的时间长。升高温度会一定程度地破坏胶原蛋白三螺旋结构,会降低其热稳定性。此外,酶法提取成本高。低共熔溶剂可以作为胶原蛋白的直接溶剂,可以维持胶原蛋白的结构,胶原蛋白溶解再生前后结构不会发生变化,从而保持其良好的生物活性。
低共熔溶剂是由两种或三种组分按照比例,通过氢键的相互作用形成的低共熔混合物。其具有与传统离子液体相似的性质,且原料价格低廉,制备简单,安全,无毒或毒性很低。低共熔溶剂的阴阳离子可以破坏蛋白质肽链间和肽链内的氢键并与之形成更强的氢键,从而使蛋白质溶解在低共熔溶剂中。将蛋白质溶解后,加入沉淀剂使蛋白质再生,经纯化后得到胶原蛋白。将蛋白质溶解后,将其他物质纯化得到羟基磷灰石。最后,通过旋转蒸发去除沉淀剂回收低共熔溶剂。
技术实现要素:
本发明的目的是提供一种低共熔溶剂提取鱼鳞中羟基磷灰石和胶原蛋白的方法。该方法操作简单,成本低,可以综合提取羟基磷灰石和胶原蛋白。同时避免了化学合成羟基磷灰石所存在和安全性问题、高温煅烧法所导致的羟基磷灰石生物活性降低的问题;避免了酸碱酶法提取胶原蛋白所存在的氨基酸被破坏、成本高、污染环境的问题。避免了咪唑类离子液体价格昂贵的问题。该发明提取的羟基磷灰石和胶原蛋白纯度高,并提供了一种高效利用资源的新方法,有利于可持续发展。
本发明的技术方案如下:
1)将从农贸市场收集的新鲜鲫鱼鱼鳞用自来水清洗后,用蒸馏水反复洗涤。将清洗后的鱼鳞自然风干或者放置烘箱中吹干(只开风机)。将干燥后的鱼鳞进行粉碎,过筛80-150目之间,转移至容器中,用封口膜密封,放入干燥器中储存备用。
2)将上述鱼鳞粉与低共熔溶剂按照比例在1:5-25之间,温度在25-100℃之间,时间在2-5h之间,于圆底烧瓶中加热搅拌进行提取反应。
3)反应结束后,离心,沉淀用蒸馏水反复洗涤后,去除低共熔溶剂。
4)用5%的氢氧化钠溶液在70℃下反应5h时间,去除鱼鳞中的油脂。离心,沉淀用去离子水反复洗涤,去除氢氧化钠,在70-105℃下干燥后得到羟基磷灰石。
5)步骤2离心后的上清液加入沉淀剂,沉淀剂与低共熔溶剂的体积比为5-15:1,沉淀12-24h后离心。沉淀用沉淀剂反复清洗后,加入0.5mol/l的醋酸溶液,在4℃下透析用蒸馏水透析。
6)离心,上清液冷冻干燥24-48h后得到胶原蛋白。
7)步骤3中离心后的上清液为低共熔溶剂和沉淀剂的混合物,通过旋转蒸发去除沉淀剂后,回收得到低共熔溶剂。
8)所用低共熔溶剂可以是氯化胆碱/甘油、氯化胆碱/1,4-丁二醇、氯化胆碱/三甘醇、氯化胆碱/乙二醇等。
9)所用沉淀剂可以是乙醇和去离子水。
本发明与先有技术相比具有的优点如下:
所用低共熔溶剂为合成法法简单,原料价格低廉;提取工艺简单无污染,避免了传统方法对设备的腐蚀和对环境的污染以及成本高的问题;低共熔溶剂可以循环使用。
附图说明
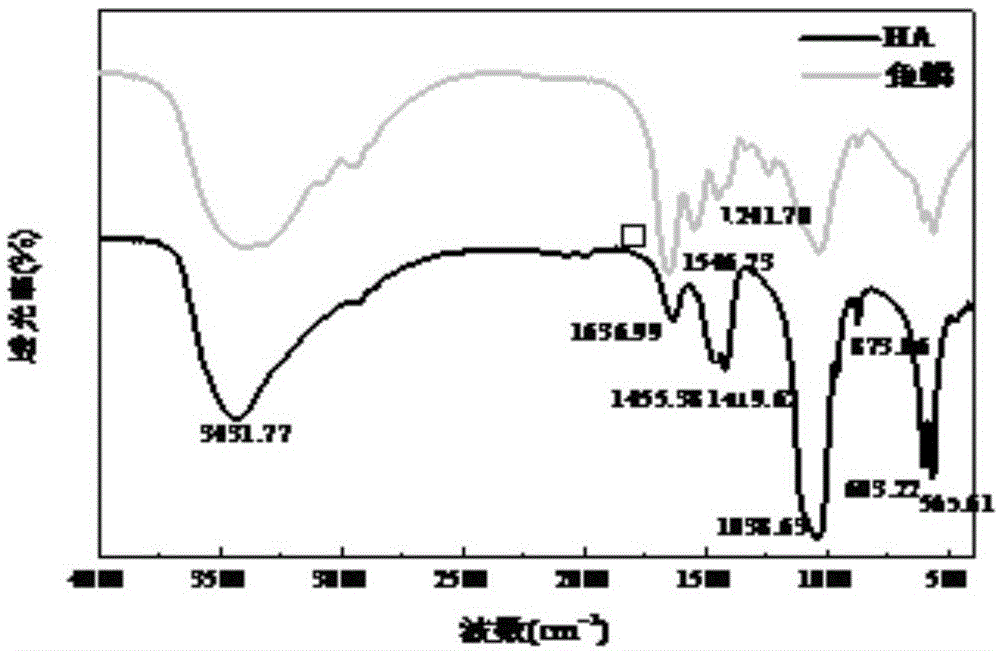
图1是鱼鳞粉和提取的羟基磷灰石的傅里叶红外光谱图
图2是提取的羟基磷灰石的x射线衍射分析图
图3是提取的胶原蛋白的傅里叶红外光谱图
图4是提取的胶原蛋白的紫外分析图
具体实施方式
本发明通过一下实施例进一步详述,但本实施例所叙述的技术内容是说明性的,而不是限定性的,不应以此来局限本发明的保护范围。
实施例一
1)将从农贸市场收集的新鲜鲫鱼鱼鳞用自来水清洗,以去除鱼鳞表面的灰尘、鱼银和黏蛋白等杂质。用去离子水反复洗涤,以去除自来水中的矿物质和氯化物杂质。将清洗后的鱼鳞自然风干或者放置烘箱中吹干(只开风机)。将干燥后的鱼鳞进行粉碎,粉碎后过80目筛,转移至容器中,用封口膜密封,放入干燥器中储存备用。
2)取3g鱼鳞粉,6g氯化胆碱/三甘醇加入到圆底烧瓶中,在80℃下磁力搅拌2h。完成后,将圆底烧瓶中的液体转移至离心管中进行离心。
3)沉淀物用蒸馏水洗涤干净(可以用硝酸银溶液进行鉴定至无白色沉淀),得到羟基磷灰石的粗提物。用5%的氢氧化钠按照比例1:7在70℃搅拌溶解5h,用去离子水洗至中性,干燥,得到纯的ha。
4)上清液为蛋白质和低共熔溶剂的混合物,按加入40ml乙醇沉淀剂,沉淀24h后离心。
5)离心后,沉淀用无水乙醇洗涤得到胶原蛋白粗提物,再用0.5mol/l的醋酸溶液将其溶解后转移至透析袋中,在4℃的冰柜中用去离子水进行透析。每天换水3-4次,至透析液为中性。将透析袋中的溶液转移至培养皿中,预冻后真空冷冻干燥24h,获得纯的胶原蛋白。
6)步骤5)离心后的上清液在80℃下旋转蒸发去除乙醇得到氯化胆碱/三甘醇。
对各附图的解释说明
图1是鱼鳞粉和提取的羟基磷灰石的红外光谱图。鱼鳞粉在1546.23cm-1、1241.70cm-1处出现的吸收峰对应酰胺ⅱ和酰胺ⅲ的吸收峰,提取的羟基磷灰石中不存在上述吸收峰。在3431.77cm-1出现的吸收峰对应-oh的伸缩振动峰。出现在1636.99处的吸收峰为-oh的弯曲振动峰。出现在1455.38cm-1和1419.62cm-1处的吸收峰对应co32-的非对称伸缩振动峰。出现在873.86cm-1处的吸收峰对应co32-的弯曲振动峰。说明co32-进入了羟基磷灰石晶体内部。取代了部分oh-和po43-,为ab混合型碳羟基磷灰石。1419.62cm-1和873.86cm-1处出现的强吸收峰,表示co32-对-po43-的取代,为b型羟基磷灰石。1560cm-1出现了极弱的吸收峰,是co32-对oh-的取代,为a型羟基磷灰石。1455.38cm-1出现的吸收峰为co32-联合取代oh-和po43-的吸收峰。表明提取的羟基磷灰石主要为b型羟基磷灰石。在1038.63cm-1、603.22cm-1、565.61cm-1处出现的吸收峰对应po43-的伸缩振动峰、对称弯曲振动峰和非对称弯曲振动峰。在603.50cm-1和565.61cm-1处出现了尖锐的振动峰,说明提取的羟基磷灰石具有良好的晶体结构。羟基磷灰石的傅里叶红外光谱图中没有出现蛋白质的特征吸收峰,证明提取的羟基磷灰石不含蛋白质。光谱图中含有co32-和po43-的吸收峰,证明提取的ha是碳酸型和磷酸型的混合型钙盐。提取的混合型钙盐羟基磷灰石更加接近人体硬组织无机组分,可以更好地应用在骨修复替代材料等领域。同时,co32-的进入增加了羟基磷灰石的溶解度和对重金属离子的吸附性。
图2羟基磷灰石的x射线衍射分析图,市售羟基磷灰石的主强峰在32.13°处,次强峰在25.91°处,晶面在49.46°处。提取的羟基磷灰石的主强峰和次强峰分别在32.08°、25.94°,晶面在49.45°处,与市售羟基磷灰石基本一致。无明显杂峰,表明提取的羟基磷灰石纯度较高。
图3是提取的胶原蛋白的傅里叶红外分析图。在3423.65cm-1处出现了一个吸收峰,对应酰胺a带中n-h的伸缩振动峰,氢键缔合使该峰向低频移动。在3096.63cm-1和2959.37cm-1处出现的吸收峰分别对应酰胺b带中c-h的不饱和伸缩振动峰和饱和伸缩振动峰。1654.41cm-1处出现的吸收峰对应酰胺ⅰ带的c=o伸缩振动峰,对应蛋白质的二级结构-α螺旋。因为该c原子与n-h相连,降低了c=o双键的特性,使其键力常数变小,振动频率向低频移动。1650-1640cm-1为无规则卷曲,在这个范围内没有出现吸收峰。1546.19cm-1处出现的吸收峰对应酰胺ⅱ带的n-h弯曲振动峰。1454cm-1处出现的吸收峰对应-ch2的弯曲振动峰。1239.72cm-1对应酰胺ⅲ带的c-n弯曲振动峰,对应蛋白质的β折叠。与文献报道的ⅰ型胶原蛋白结构一致。同时1240cm-1与1450cm-1处吸光度的比值为1.02,在1-1.2之间,结构完全破坏时比值下降至0.6,说明胶原蛋白没有变性。此外,ha的特征吸收峰没有出现在提取的胶原蛋白傅里叶红外光谱图中,说明提取的胶原蛋白纯度高。因此提取的胶原蛋白具有良好的纯度和完整性。
图4是提取的胶原蛋白的紫外分析图。在230nm处有一个强吸收峰,与ⅰ型胶原蛋白的特征相符合。在250-400nm范围内没有吸收峰,该物质中没有出现酪氨酸或色氨酸中共轭双键的吸收峰,没有角蛋白等其他蛋白质。表明提取的胶原蛋白是典型的ⅰ型胶原蛋白,纯度较高。
- 还没有人留言评论。精彩留言会获得点赞!
- 制备至少一种水溶性n-乙烯基内酰胺和至少一种疏水性共聚单体的水溶性非混浊共聚物 ...的制作方法
- 生产至少一种水溶性n-乙烯基内酰胺和至少一种疏水性共聚单体的水溶性非浑浊共聚 ...的制作方法
- 生产至少一种水溶性n-乙烯基内酰胺和至少一种疏水性共聚单体的水溶性非浑浊共聚 ...的制作方法
- 一种水溶性氧化胺型树脂及其制备方法和应用的制作方法
- 制备至少一种水溶性n-乙烯基内酰胺和至少一种疏水性共聚单体的水溶性非混浊共聚物 ...的制作方法
- 水溶性氧杂单酰胺的合成方法
- 水溶性氧杂双酰胺的合成方法
- Ca4的前体化合物水溶性水杨酰胺磷酸铵盐及合成方法
- 水溶性葡糖胺及其用途和制备方法
- 新型光学纯水溶性二胺和衍生物及其制备方法和用途的制作方法