一种形貌可控的铁、锌离子共掺杂的氧化亚铜晶体的制备方法与流程
本发明涉及纳米材料的制备技术领域,尤其涉及一种形貌可控的铁、锌离子共掺杂的氧化亚铜晶体的制备方法。
背景技术:
cu2o是一种禁带宽度为2.17ev的p型半导体,有一个很大的激发能140mev,被预测为一种很有前景的基质材料。在过去的这些年来,大量的文献报道了在cu2o晶体中掺杂金属离子或非金属离子可以使其成为p型或n型半导体。因此,研究掺杂对cu2o晶体物理、化学性质的影响是非常必要的。由于掺杂离子与cu+离子的自旋态接近、离子半径相似、在晶体结构中可能占据相同的位置,因此,这些掺杂的离子可以修饰cu2o晶体的磁学、光学、电学等性质。目前,采用在cu2o晶体中掺杂过渡态金属离子的方法制备稀磁半导体已经引起了人们的广泛兴趣。已有文献报道的cu2o纳米棒掺入磁性元素fe、co、ni、mn元素,cu2o晶体能从抗磁体转变为铁磁体,而且随着掺杂元素浓度的增加,磁性逐渐增强。cu2o晶体表现的室温铁磁性不仅与制备方法有关,与掺杂的离子种类也有一定的关系。有关纳米cu2o掺杂磁性元素的制备方法主要集中在水热法或者热氧化法,这种方法需要高温或者高压环境下进行,工艺相对复杂,极大的制约了材料的大规模制备。
因此,开发一种低成本和可控性良好的模板法,能够实现cu2o纳米材料形貌结构的有效调控,对提高cu2o纳米材料的磁学性能和扩展其应用具有重要的意义。因此,本领域的技术人员致力于开发一种形貌可控的铁、锌离子共掺杂的氧化亚铜晶体的制备方法。
技术实现要素:
有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是提供一种形貌可控的铁、锌离子共掺杂的氧化亚铜晶体的制备方法,使得该制备方法能够实现对cu2o纳米材料形貌结构的有效调控,从而提高cu2o纳米材料的磁学性能,并拓展其应用范围。
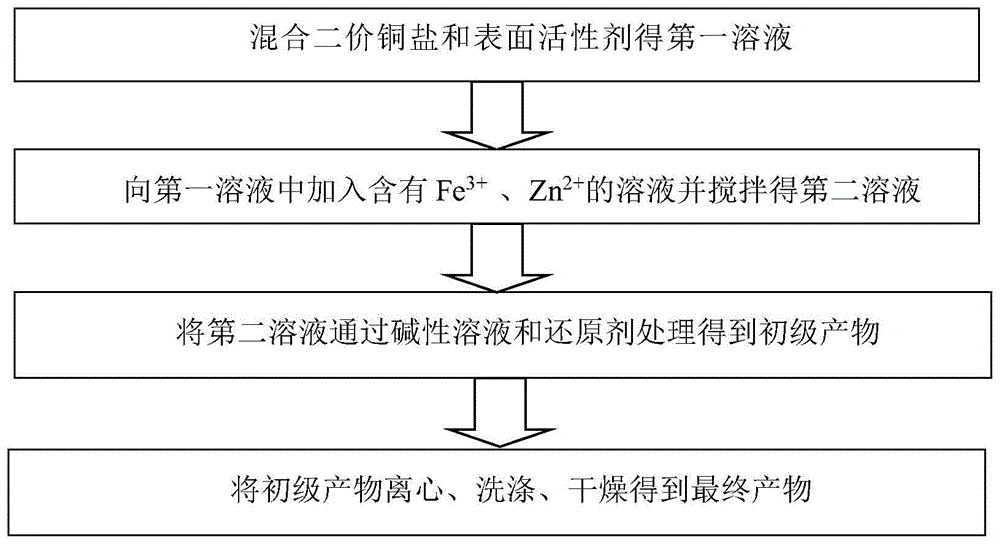
为实现上述目的,本发明提供了一种形貌可控的铁、锌离子共掺杂的氧化亚铜晶体的制备方法,包括以下步骤:
s100、将二价铜盐和表面活性剂溶解在去离子水中,充分搅拌得到第一溶液,其中,所述表面活性剂为乙二胺四乙酸;
s200、向第一溶液中加入含有fe3+和zn2+的溶液,并在室温下搅拌得到第二溶液;
s300、将第二溶液通过碱性溶液和还原剂处理得到初级产物,其中,所述还原剂为葡萄糖溶液;
s400、将初级产物离心、洗涤、干燥得到最终产物fe、zn掺杂的磁性氧化亚铜粉末。
本发明的制备方法与现有技术相比,具有以下优势:
(1)本发明提供的fe、zn掺杂的纳米氧化亚铜粉末的制备方法制备工艺简单、成本低廉,并且通过调节反应时间以及离子掺杂浓度可以实现纳米cu2o晶体的形貌调整;
(2)本发明提供的fe、zn掺杂的纳米氧化亚铜粉末的制备方法适于大规模化的工业生产,并且得到的fe、zn掺杂的纳米氧化亚铜粉末具有良好的磁学性能,具有良好的应用前景。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1为本发明一个较佳实施例的制备方法流程图;
图2(a)-图2(e)为本发明的较佳实施例制备的纳米cu2o粉末的sem图,其中,图2(a)为实施例1制备的纳米cu2o粉末的sem图;图2(b)为实施例2制备的纳米cu2o粉末的sem图;图2(c)为实施例3制备的纳米cu2o粉末的sem图;图2(d)为实施例4制备的纳米cu2o粉末的sem图;图2(e)为实施例5制备的纳米cu2o粉末的sem图;
图3为fe掺杂和fe、zn共同掺杂的cu2o晶体的磁滞回线;
图4为fe掺杂和fe、zn共同掺杂的cu2o晶体的epr图谱;
图5为zn掺杂和fe、zn共同掺杂的cu2o晶体的磁滞回线;
图6为未掺杂和fe、zn共同掺杂的cu2o晶体的光催化降解甲基橙降解率图。
具体实施方式
以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
如图1本发明的一个较佳实施例的制备方法流程图所示,包括以下步骤:
s100、将二价铜盐和表面活性剂溶解在去离子水中,充分搅拌得到第一溶液,其中,所述表面活性剂为乙二胺四乙酸;
s200、向第一溶液中加入含有fe3+和zn2+的溶液,并在室温下搅拌得到第二溶液;
s300、将第二溶液通过碱性溶液和还原剂处理得到初级产物,其中,所述还原剂为葡萄糖溶液;
s400、将初级产物离心、洗涤、干燥得到最终产物fe、zn掺杂的磁性氧化亚铜粉末。
其中,步骤s100中所述的二价铜盐为硝酸铜、氯化铜、硫酸铜、乙酸铜中的一种;
步骤s200中所述含fe3+的溶液为硝酸铁、氯化铁、硫酸铁中的一种;所述含zn2+的溶液为硝酸锌、氯化锌、硫酸锌中的一种;
在一个较佳的实施例中,步骤s200中所述含fe3+的溶液的摩尔浓度比为0.%~3%;步骤s200中所述含zn2+的溶液的摩尔浓度比为0%~5%。
在一个较佳的实施例中,步骤s300中所述碱性溶液为氢氧化钠、氢氧化钾的一种。
在一个较佳的实施例中,所述步骤s300还包括:
s301、将第二溶液在水浴中加热并向其中逐滴滴入5~6ml3m的碱性溶液并搅拌得到第三溶液;
s302、向第三溶液中逐滴滴入10~11ml摩尔浓度为0.11m的葡萄糖溶液,在50~60℃下反应0.5~1.5h,得到初级产物。
在一个较佳的实施例中,步骤s400中所述最终产物的形貌为纳米截角立方体或纳米截棱立方体。
以下结合附图和实施例对本发明的技术方案做进一步说明。
实施例1
1)将2mmol的cuso4与1mmol的乙二胺四乙酸(edta)粉末溶解在40ml去离子水中,充分搅拌,溶解完全,得到澄清溶液;
2)本溶液不做掺杂处理;
3)在水浴中加热,待反应温度为55℃时,分别将5ml摩尔浓度为3m的naoh溶液逐滴滴入溶液。再剧烈搅拌5min后,将10ml摩尔浓度为0.11m的葡萄糖溶液分别滴加进上述反应溶液中,在55℃的条件下反应1h,得到含有红色沉淀物质的混合溶液。
4)将所制备的含有红色沉淀物质的混合溶液离心洗涤数次,并将红色的沉淀物质置入真空干燥箱中干燥12h,得到最终产物纳米氧化亚铜粉末。
实施例1得到的纳米氧化亚铜粉末的形貌如图2(a)所示,当没有fe3+和zn2+存在的情况下,该产物为大小均一的cu2o立方体,由6个{100}晶面组成,尺寸在1.2μm左右。
实施例2
1)将2mmol的cuso4与1mmol的乙二胺四乙酸(edta)粉末溶解在40ml去离子水中,充分搅拌,溶解完全,得到澄清溶液;
2)所得溶液中加入摩尔浓度比例为3%的fe(no3)3溶液,在室温下搅拌3h,得到相应溶液。
3)在水浴中加热,待反应温度为55℃时,分别将5ml摩尔浓度为3m的koh溶液逐滴滴入溶液。再剧烈搅拌5min后,将10ml摩尔浓度为0.11m的葡萄糖溶液分别滴加进上述反应溶液中,在55℃的条件下反应1h,得到含有红色沉淀物质的混合溶液;
4)将所制备的含有红色沉淀物质的混合溶液离心洗涤数次,并将红色的沉淀物质置入真空干燥箱中干燥12h,得到最终产物fe离子掺杂的纳米氧化亚铜粉末。
实施例2得到的纳米氧化亚铜粉末的形貌如图2(b)所示,可以看出当添加一定量的fe3+离子时,产物仍然为立方体,但尺寸在2μm左右,这说明fe3+离子主要影响产物的尺寸,不改变产物的形貌。
实施例3
1)将2mmol的cuso4与1mmol的乙二胺四乙酸(edta)粉末溶解在40ml去离子水中,充分搅拌,溶解完全,得到澄清溶液;
2)所得溶液中加入摩尔浓度比例为3%的fe(no3)3,1%的zn(no3)2溶液,在室温下搅拌3h,得到相应溶液。
3)在水浴中加热,待反应温度为55℃时,分别将5.5ml摩尔浓度为3m的naoh溶液逐滴滴入溶液。再剧烈搅拌5min后,将10.5ml摩尔浓度为0.11m的葡萄糖溶液分别滴加进上述反应溶液中,在55℃的条件下反应1h,得到含有红色沉淀物质的混合溶液;
4)将所制备的含有红色沉淀物质的混合溶液离心洗涤数次,并将红色的沉淀物质置入真空干燥箱中干燥12h,得到最终产物fe,zn离子掺杂的纳米氧化亚铜粉末。
实施例3得到的纳米氧化亚铜粉末的形貌如图2(c)所示,可以看出zn2+离子摩尔比例为1%时,产物为大小均一的截角立方体,新增的晶面是8个{111}晶面。
实施例4
1)将2mmol的cuso4与1mmol的乙二胺四乙酸(edta)粉末溶解在40ml去离子水中,充分搅拌,溶解完全,得到澄清溶液;
2)所得溶液中加入摩尔浓度比例为3%的fe(no3)3,3%的zn(no3)2溶液,在室温下搅拌3h,得到相应溶液。3)在水浴中加热,待反应温度为55℃时,分别将5ml摩尔浓度为3m的naoh溶液逐滴滴入溶液。再剧烈搅拌5min后,将10ml摩尔浓度为0.11m的葡萄糖溶液分别滴加进上述反应溶液中,在55℃的条件下反应1h,得到含有红色沉淀物质的混合溶液;
4)将所制备的含有红色沉淀物质的混合溶液离心洗涤数次,并将红色的沉淀物质置入真空干燥箱中干燥12h,得到最终产物fe,zn离子掺杂的纳米氧化亚铜粉末。
实施例4得到的纳米氧化亚铜粉末的形貌如图2(d)所示,可以看出当zn2+离子的摩尔比例为3%时,产物为截角截棱立方体,即在原来的形貌基础上,出现了12个{110}晶面。
实施例5
1)将2mmol的cuso4与1mmol的乙二胺四乙酸(edta)粉末溶解在40ml去离子水中,充分搅拌,溶解完全,得到澄清溶液;
2)所得溶液中加入摩尔浓度比例为3%的fe(no3)3,5%的zn(no3)2溶液,在室温下搅拌3h,得到相应溶液。3)在水浴中加热,待反应温度为55℃时,分别将5ml摩尔浓度为3m的naoh溶液逐滴滴入溶液。再剧烈搅拌5min后,将10ml摩尔浓度为0.11m的葡萄糖溶液分别滴加进上述反应溶液中,在55℃的条件下反应1h,得到含有红色沉淀物质的混合溶液;
4)将所制备的含有红色沉淀物质的混合溶液离心洗涤数次,并将红色的沉淀物质置入真空干燥箱中干燥12h,得到最终产物fe,zn离子掺杂的纳米氧化亚铜粉末。
实施例5到的纳米氧化亚铜粉末的形貌如图2(e)所示,可以看出当zn2+离子的摩尔比例进一步增大到5%时,产物的形貌没有明显明显变化,但是具有较大尺寸,而且{110}晶面在整个晶体中的比例明显增大。
综上所述可知,fe3+离子掺杂主要影响了产物的尺寸,而zn2+离子的掺杂则引起尺寸和形貌的一系列变化。
图3为fe掺杂和fe、zn共同掺杂的cu2o晶体的磁滞回线,可以看出在室温情况下,所有的样品都具有一定的铁磁性。当只有3%的fe3+离子掺杂的时候,样品展示出室温的铁磁性,饱和磁化强度为0.0125emu/g。值得注意的是,微量的zn2+离子的添加将会引起磁性的明显变化,当fe3+离子的含量保持不变,随着zn2+离子含量的增加,产物中fe的掺杂量增加,导致其磁性逐渐增强。当分别添加摩尔比例为1%、3%和5%的zn2+离子的时候,饱和磁化强度分别提高到0.0237,0.0525和0.1008emu/g,这种变化趋势和先前报道的al、cu掺杂zno是一致的。同时我们注意到磁滞回线在最大磁场的时候并没有达到饱和状态,表明此时还有许多的铁磁磁矩和顺磁磁矩共存。从上面的结果可以推断出zn2+离子的浓度对fe、zn共掺杂cu2o晶体的磁学性能起着重要作用。
图4展示了掺杂样品在室温条件下的epr图谱,从图中可以看出,在纯净的cu2o晶体中没有不配对电子的信号,这也进一步表明了该样品对外不显示磁性。当只有fe掺杂的情况下,该样品显示了一个弱的共振信号,g值为2.0041,这和先前的文献报道是一致的。当fe、zn共同掺杂的条件下,epr都显示出了很明显的共振信号,并且随着zn2+离子的浓度增大,共振信号越强。其中fe3%zn1%,fe3%zn3%和fe3%zn5%掺杂的cu2o晶体的g值分别为2.0064,2.0083和2.0083,这些值都接近2.0,表明这些共振信号起源于vo空穴,这是由于其低的形成能,导致阳离子的缺陷浓度足够高,这些高于所需阈值的浓度可以进一步的调节其铁磁长程有序。
图5为掺杂的zn2+离子浓度不变时,不同浓度的fe3+离子掺杂的cu2o晶体的磁滞回线,可以看出zn2+离子浓度不变,随着fe3+离子浓度的增加,磁性也是逐渐增强的,其中fe1%zn5%,fe2%zn5%,fe3%zn5%和fe4%zn5%掺杂的cu2o晶体对应的饱和磁化强度分别为0.00453,0.04983,0.07729和0.0954emu/g。同时在最大磁场的时候,磁化强度也没有达到饱和状态,表明还处于顺磁和铁磁共存的状态。实验结果充分说明了fe3+离子的浓度对最终产物的磁性也起着一定的作用。
图6为未掺杂和fe、zn共同掺杂的cu2o晶体的光催化降解甲基橙降解率图,从图中可以看到,当光催化反应2h时,fe、zn共掺杂的cu2o晶体降解了甲基橙88%,而未掺杂的纯cu2o晶体只降解了甲基橙59%,表明fe、zn共掺杂的26面体cu2o晶体比未掺杂的纯cu2o晶体具有更好的光催化降解活性。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!