一种高纯硫酸锰的制备方法与流程
1.本发明涉及新能源三元锂电池正极材料技术领域,尤其涉及一种高纯硫酸锰的制备方法。
背景技术:
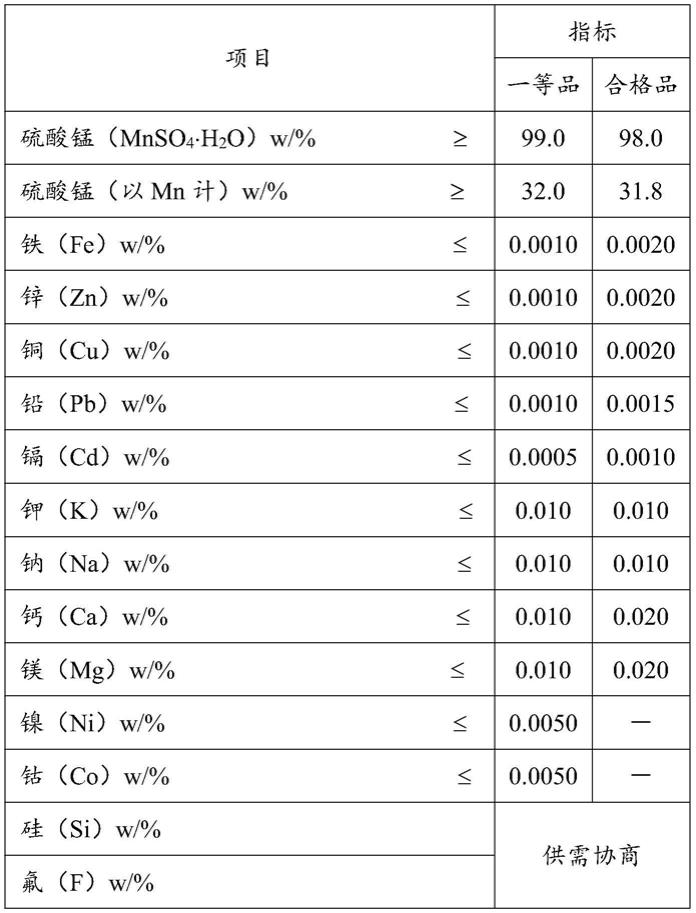
2.高纯硫酸锰(电子级硫酸锰)是三元锂电池和锰酸锂电池的阳极材料的生产原料之一。高纯硫酸锰对杂质的要求很高,例如工信部的产品质量标准(hg/t 4823-2015)对高纯硫酸锰中各种杂质的要求如表1所示:
3.表1.工信部关于电子级硫酸锰的纯度要求(hg/t 4823-2015)
[0004][0005]
因为对杂质含量的要求很高,所以目前高纯硫酸锰生产工艺的难点就在于杂质的去除工艺。而所有杂质中,以钙和镁的去除尤其是钙的去除最为艰难。其他金属杂质如铁、
锌、铜、铅、镉、镍、钴都可以通过调节ph值(除铁)、加入福美钠或者其他硫化剂(除重金属)达到很好的去除效果,钠和钾则可以以形成黄钾矾等难容沉淀的形式除去。因此,除了钙、镁以外,其他杂质的去除工艺都比较简单而且成熟,基本上能满足需方的要求。
[0006]
在除钙、镁的工艺中,目前沿海一带普遍采用的工艺是选用钙、镁含量很低的软锰矿,在用炭或二氧化硫将其中的四价锰还原为二价锰后,用硫酸浸出,得到钙、镁含量非常低的硫酸锰溶液,然后经过反复重结晶,得到电子级硫酸锰。但这种工艺有以下不足之处:(1)、钙、镁含量低的软锰矿目前只产在非洲个别国家,来源非常有限。加之目前海运费用增加,使得高纯硫酸锰的生产成本大幅增加。(2)、在重结晶过程中,随着水分的蒸发,溶液中钙和镁的浓度也逐渐增大,达到一定的程度,硫酸钙和硫酸镁与产品硫酸锰形成共晶析出,从而降低了产品的纯度。为了使得产品达到需方的要求,则必须控制结晶量,使得溶液中钙、镁不至于析出。如此,高纯硫酸锰的收率偏低,使得产品综合成本比较高。另外一些除钙、镁的工艺,比如用碳酸氢铵将硫酸锰转化为碳酸锰,然后再用硫酸进行溶解的方法(公开号cn101704555a)。理论上,用碳酸氢铵沉淀锰的时候,原来硫酸锰溶液中的钙镁离子因为生成碳酸氢钙或者碳酸氢镁,将保留在溶液中而不会随碳酸锰一起沉淀,但事实上碳酸氢钙的溶解度非常有限(1.6g/l),且碳酸氢铵加入后造成局部ph值过高,会引起钙镁和碳酸锰形成共沉淀,所以这种方法在实践中不可能达到目的。
[0007]
公开号为cn 102674467a的专利中采用电解锰为原料,经过硫化锰除重金属,过氧化氢氧化除铁等工艺得到电子级硫酸锰。因为采用的原料电解锰纯度本身就非常高,虽然能顺利得到电子级硫酸锰,但因为电解锰的价格高,所以该工艺的成本居高不下。
[0008]
公开号为cn101508467的专利中使用氟化锰除钙镁。理论上计算,用氟化锰或者其他氟化物(如氟化铵)除钙镁能达到非常理想的效果,但实际上,由于硫酸锰溶液的浓度高而导致溶液离子强度大,促进了氟化钙和氟化镁的溶解,因此,除了工艺上难于过滤外,在钙镁杂质浓度方面也达不到要求。此外,带进去了杂质氟离子。一方面,氟离子的去除成本比较高,另一方面,对杂质氟离子浓度的限制越来越高,因此该工艺生产不出满足要求的高纯硫酸锰产品。
[0009]
综上所述,目前已经公开的高纯硫酸锰生产技术,除了采用电解锰或者低钙镁含量的软锰矿作为原料外,其余工艺都存在钙镁难以去除,硫酸锰纯度难以满足要求的问题。
技术实现要素:
[0010]
有鉴于此,本发明提供了一种高纯硫酸锰的制备方法。本发明提供的方法步骤简单、成本低、能够有效去除钙镁离子,可以得到满足要求的电子级硫酸锰。
[0011]
为了实现上述发明目的,本发明提供以下技术方案:
[0012]
一种高纯硫酸锰的制备方法,包括以下步骤:
[0013]
(1)将粗锰盐溶液和ph值控制剂混合,向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将所得反应混合物依次进行陈化和固液分离,得到碳酸锰;
[0014]
(2)将所述碳酸锰溶于电子级硫酸中,向所得溶解液中加入硫化铵,依次进行搅拌、静置和固液分离,将所得滤液蒸发,得到高纯硫酸锰;
[0015]
或包括以下步骤:
[0016]
(a)将粗锰盐溶液和硫化铵混合,依次进行搅拌、静置和固液分离,得到精锰盐溶
液;
[0017]
(b)将所述精锰盐溶液和ph值控制剂混合,向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将所得反应混合物依次进行陈化和固液分离,得到高纯碳酸锰;
[0018]
(c)将所述高纯碳酸锰溶于电子级硫酸中,将所得溶解液蒸发,得到高纯硫酸锰;
[0019]
其中,所述ph值控制为氯化铵和硝酸铵中的至少一种;所述ph值控制剂将体系的ph值控制在5~6;所述步骤(1)和步骤(b)中混合液与碳酸氢铵溶液反应时控制温度高于100℃。
[0020]
优选的,所述粗锰盐溶液中的粗锰盐为饲料级硫酸锰、农用级硫酸锰、粗氯化锰或粗硝酸锰;所述粗氯化锰和粗硝酸锰的纯度为工业级纯度或低于工业级纯度。
[0021]
优选的,所述步骤(1)中粗锰盐溶液和ph值控制剂混合所得混合液中ph值控制剂的浓度为150~300g/l;
[0022]
所述步骤(b)中精锰盐溶液和ph值控制剂混合所得混合液中ph值控制剂的浓度为150~300g/l。
[0023]
优选的,所述步骤(1)和步骤(b)中混合液与碳酸氢铵溶液反应时的温度独立地为102~110℃。
[0024]
优选的,所述步骤(1)和步骤(b)中,碳酸氢铵的加入量为锰离子摩尔量的2.2~2.6倍。
[0025]
优选的,所述步骤(1)和步骤(b)中碳酸氢铵溶液的浓度独立地为0.5~2mol/l;
[0026]
所述步骤(1)和步骤(b)中碳酸氢铵溶液在搅拌条件下缓慢加入混合液中,所述碳酸氢铵溶液每分钟的加入量不超过反应池内溶液总体积的1/50。
[0027]
优选的,所述步骤(1)和步骤(b)中陈化的时间独立地为1~2h。
[0028]
优选的,所述步骤(2)和步骤(a)中硫化铵的加入量独立地为2~4g/l。
[0029]
优选的,所述步骤(2)和步骤(a)中搅拌的时间独立地为1~6h,静置的时间独立地为2~10h。
[0030]
优选的,所述步骤(2)和步骤(c)所得溶解液中锰离子的浓度为130~180g/l。
[0031]
本发明提供了一种高纯硫酸锰的制备方法,本发明的方法利用氯化铵和/或硝酸铵控制体系的ph值,在高于100℃条件下将粗锰盐溶液和碳酸氢铵溶液混合,溶液中的锰离子生成碳酸锰,同时高温条件下氯化铵或硝酸铵能尽快把生成的碳酸钙沉淀溶解而使钙重新进入溶液中,且溶液中残留的碳酸(氢)铵在高温下会尽快分解为氨气和二氧化碳,从而减少钙离子沉淀的机会,镁的溶解度比较大,在本发明的ph值控制条件下,可以保留在溶液中不被碳酸氢铵沉淀;得到碳酸锰沉淀后,本发明将碳酸锰沉淀溶于电子级硫酸中,并加入硫化铵去除其中的重金属杂质离子,过滤后将所得滤液蒸发,即可得到高纯硫酸锰。
[0032]
此外,本发明的方法还可以先通过加入硫化铵将粗锰盐溶液中的重金属杂质离子去除,然后再通过碳酸氢铵沉淀将钙镁离子去除,得到高纯碳酸锰,之后通过硫酸溶解、蒸发即可得到高纯硫酸锰。
[0033]
本发明提供的制备方法通过控制沉淀条件,可以方便的去除钙镁离子,所得高纯硫酸锰满足电子级硫酸锰的要求,且运行成本低,步骤简单,容易工业化。实施例结果表明,本发明制备的高纯硫酸锰中各项杂质离子的指标均优于工信部发布的电子级硫酸锰产品
质量标准。
具体实施方式
[0034]
本发明提供了一种高纯硫酸锰的制备方法,本发明提供的方法可以先去除钙镁离子,再去除重金属离子,也可以先去除重金属离子,再去除钙镁离子,下面将先去除钙镁离子,再去除重金属离子的方法记为方法一,将先去除重金属离子,再去除钙镁离子的方法记为方法二,分别进行介绍。
[0035]
在本发明中,所述方法一包括以下步骤:
[0036]
(1)将粗锰盐溶液和ph值控制剂混合,向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将反应混合物依次进行陈化和固液分离,得到碳酸锰;
[0037]
(2)将所述碳酸锰溶于电子级硫酸中,向所得溶解液中加入硫化铵,依次进行搅拌、静置和固液分离,将所得滤液蒸发,得到高纯硫酸锰;
[0038]
本发明先将粗锰盐溶液和ph值控制剂混合。在本发明中,所述粗锰盐溶液中的粗锰盐优选为饲料级硫酸锰、农用级硫酸锰、粗氯化锰或粗硝酸锰;所述粗氯化锰或粗硝酸锰的纯度为工业级纯度或低于工业级纯度;所述粗锰盐溶液中的镁离子浓度优选不大于3g/l,钙离子浓度优选不大于2g/l,本发明将粗锰盐溶液中的镁离子浓度控制在3g/l以下、钙离子浓度控制在2g/l以下,有利于避免后续沉淀碳酸锰的过程中产生钙、镁沉淀;在本领域中,粗锰盐中的钙、镁含量一般为几百到两千ppm,粗锰盐溶液中的钙、镁离子浓度基本不会达到2g/l以上,因而绝大部分粗锰盐都可以作为本发明的原料。本发明对所述粗锰盐溶液中的其他杂质离子的浓度没有特殊要求。
[0039]
在本发明中,所述粗锰盐溶液和ph值控制剂混合所得混合液中锰离子的浓度优选为100~180g/l;在本发明的具体实施例中,优选先将粗锰盐溶解,然后向溶解液中加入ph值控制剂,ph值控制剂完全溶解后再将溶液中锰离子的浓度调节至要求浓度。
[0040]
在本发明中,所述ph值调节剂优选为硝酸铵和氯化铵中的至少一种;所述混合液中ph值控制剂的浓度优选为150~300g/l,更优选为200~250g/l;本发明向粗锰盐溶液中加入足够量的硝酸铵和氯化铵,可以将体系的ph值控制在5~6;由于原料锰盐中钙镁离子的含量较小(一般小于2000ppm),在该ph值条件下钙镁离子理论上不会发生沉淀。
[0041]
粗锰盐溶液和ph值控制剂混合后,本发明向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将所得反应混合物依次进行陈化和固液分离,得到碳酸锰。在本发明中,所述碳酸氢铵溶液中碳酸氢铵的摩尔量优选为锰离子摩尔量的2.2~2.6倍,更优选为2.3~2.5倍;所述碳酸氢铵溶液的浓度优选为0.5~2mol/l,更优选为1~1.5mol/l;所述碳酸氢铵溶液优选在搅拌条件下缓慢加入混合液中,所述碳酸氢铵溶液每分钟的加入量优选不超过反应池内溶液总体积的1/50。
[0042]
在本发明中,所述混合液与碳酸氢铵溶液反应的温度为100℃以上,优选为102~110℃,在本发明的具体实施例中,优选使用带有导热油夹层的反应釜,将粗锰盐和ph值控制剂的混合液放置于反应釜中,利用导热油夹层将混合液加热至100℃以上,然后利用蠕动泵向反应釜内加入碳酸氢铵溶液。在本发明的具体实施例中,本发明优选在加入碳酸氢铵溶液的过程中补加适量沸水以补充因蒸发而损失的水分,避免体系中剩余的粗锰盐因溶液蒸发而析出。
[0043]
本发明在100℃以上的条件下加入碳酸氢铵溶液,其一是能使氯化铵或硝酸铵尽快把生成的碳酸钙沉淀溶解从而使钙重新进入溶液;其二是让溶液中残留的碳酸(氢)铵尽快分解为氨气和二氧化碳,从而减少钙离子沉淀的机会。由于碳酸锰的溶度积(ksp=3
×
10-9
)比碳酸钙(ksp=3
×
10-8
)小,所以锰离子先沉淀,且碳酸锰比碳酸钙更难溶解于热的氯化铵或硝酸铵中。利用两者溶解速度不同,可以很方便地把可能沉淀的碳酸钙从碳酸锰中除去,从而保证碳酸锰的高纯度。此外,在生成碳酸锰的过程中,因为镁的溶解度比较大(ksp=6
×
10-5
),因此可以保留在溶液中不被碳酸氢铵沉淀。
[0044]
碳酸氢铵溶液加入完毕后,本发明将所得反应混合物进行陈化;所述陈化的时间优选为1~2h,所述陈化的温度和加入碳酸氢铵溶液时的温度相同,即碳酸氢铵溶液加入完毕后进行保温陈化。
[0045]
陈化后,本发明将陈化后的体系进行固液分离。本发明对所述固液分离的方式没有特殊要求,使用本领域技术人员熟知的方式即可,具体如过滤。本发明优选将体系自然降温至室温,然后再进行固液分离;固液分离所得固体产物为碳酸锰,液体为含有钙镁离子的滤液;本发明优选将所得滤液进行再生,所述再生的方法优选为:向滤液中加入碳酸铵沉淀其中的钙镁离子,过滤后将滤液加热使剩余的碳酸铵分解,得到再生滤液;所述再生滤液优选用于溶解粗锰盐,从而实现滤液的重复利用,避免大量废液的排放。
[0046]
过滤后,本发明优选对所得碳酸锰进行洗涤,所述洗涤用水优选为高纯水或超纯水;所述洗涤的次数优选为5次。
[0047]
得到碳酸锰后,本发明将所述碳酸锰溶于电子级硫酸中,向所得溶解液中加入硫化铵,依次进行搅拌、静置和固液分离,将所得滤液蒸发,得到高纯硫酸锰。在本发明中,所述电子级硫酸的浓度优选为5mol/l;在本发明的具体实施例中,可以直接向碳酸锰滤饼中加入电子级硫酸,也可以先将碳酸锰配制成碳酸锰-超纯水悬浮液,然后向碳酸锰-超纯水悬浮液中缓慢加入电子级硫酸,直至碳酸锰完全溶解;所述溶解液中锰离子的浓度优选为130~180g/l,更优选为140~160g/l;若溶解液的ph值低于5,本发明优选使用锰粉(调节ph值时锰粉一般用量很小,对最终的锰浓度影响不大,溶解液中锰离子浓度能够保持在上述范围内)将溶解液的ph值调节至5~6.5,然后再加入硫化铵。在本发明中,溶解液的酸度过大可以导致加入硫化铵产生硫化氢气体,污染工作环境,且硫化铵生成硫氢根或者硫化氢,降低沉淀重金属的能力;同时ph太高又会造成锰被空气氧化,生成黑色氧化锰,本发明将溶解液的ph值调节至5~6.5,可以避免上述问题。
[0048]
在本发明中,所述硫化铵的加入量优选为2~4g/l,更优选为3~3.5g/l;即每升溶解液中加入2~4g硫化铵,在本发明的具体实施例中,可以用超纯水将溶解液的体积调节至整数,以方便硫化铵加入量的计算。
[0049]
在本发明中,所述搅拌的时间优选为1~6h,更优选为2~5h,所述静置的时间优选为2~10h,更优选为3~8h。本发明通过加入硫化铵后搅拌、静置使体系中的重金属离子形成沉淀,进而通过固液分离除去。
[0050]
本发明对所述固液分离的方式没有特殊要求,使用本领域技术人员熟知的方式即可,具体如过滤。过滤后,本发明将所得滤液蒸发,即可得到高纯硫酸锰。本发明对所述蒸发的方法没有特殊要求,采用本领域常见的蒸发方法即可。蒸发得到高纯硫酸锰晶体后,本发明优选将高纯硫酸锰晶体进行真空干燥;所述真空干燥的温度优选为100℃,本发明对所述
干燥的时间没有特殊要求,以充分干燥为宜。
[0051]
在本发明中,所述方法二包括以下步骤:
[0052]
(a)将粗锰盐溶液和硫化铵混合,依次进行搅拌、静置和固液分离,得到精锰盐溶液;
[0053]
(b)将所述精锰盐溶液和ph值控制剂混合,向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将所得反应混合物依次进行陈化和固液分离,得到高纯碳酸锰;
[0054]
(c)将所述高纯碳酸锰溶于电子级硫酸中,将所得溶解液蒸发,得到高纯硫酸锰。
[0055]
本发明将粗锰盐溶液和硫化铵混合,依次进行搅拌、静置和固液分离,得到精锰盐溶液。在本发明中,所述粗锰盐的种类、粗锰盐溶液中锰离子的浓度以及钙、镁离子的浓度均和上述方案一致,在此不再赘述;所述硫化铵的加入量和上述方案一致,在此不再赘述;所述硫化铵加入前优选使用锰粉调节粗锰盐溶液的ph值,具体的调节方法和上述方案一致,在此不再赘述;所述搅拌、静置和固液分离的具体条件均和上述方案一致,在此不再赘述。
[0056]
得到精锰盐溶液后,本发明将所述精锰盐溶液和ph值控制剂混合,向所得混合液中加入碳酸氢铵溶液进行反应,碳酸氢铵溶液加入完毕后,将反应混合物依次进行陈化和固液分离,得到高纯碳酸锰。在本发发明中,所述步骤(b)和方法一中步骤(1)的各个操作条件完全一致,仅将粗锰盐溶液替换为了精锰盐溶液,在此不再赘述。
[0057]
得到高纯硫酸锰后,本发明将所述高纯碳酸锰溶于电子级硫酸中,将所得溶解液蒸发,得到高纯硫酸锰。在本发明中,所述步骤(c)和方法一中步骤(2)的各个操作条件完全一致,仅省略了加入硫化铵的步骤,在此不再赘述。
[0058]
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。
[0059]
实施例1
[0060]
取饲料级硫酸锰1公斤(ca、mg浓度分别为135ppm和406ppm),溶解于2l水中,加入400g氯化铵,搅拌溶解后,将溶液的锰浓度调节至100g/l。取1.5l溶液于一个10l玻璃反应釜中,用导热油夹层加热至102℃。在保持溶液温度≥102℃并不断搅拌的条件下,用蠕动泵以每分钟30ml的流量加入6l浓度为1mol/l的碳酸氢铵溶液(碳酸氢铵:硫酸锰摩尔比2.2:1)。在必要时加入适量沸水以补充反应釜中因蒸发而损失的水分。碳酸氢铵溶液加完以后,保持102℃陈化1h,然后自然降温到室温。过滤,滤饼用高纯水洗涤五次。将滤饼分批次转移到烧杯中,慢慢加入5mol/l的电子级硫酸溶液,直到碳酸锰完全溶解,用锰粉将溶液的酸度调节到ph值为5,体积调节到3l,然后加入6g硫化铵(每升溶液2g硫化铵),搅拌1h后,陈化10h。过滤,收集滤液,蒸发得到硫酸锰晶体,真空100℃烘干以后送样品分析。
[0061]
实施例2
[0062]
操作步骤和实施例1完全一致,仅将氯化铵换成硝酸铵,得到的硫酸锰产品在真空100℃烘干后送样分析。
[0063]
实施例3
[0064]
将粗氯化锰溶于水中,然后加入氯化铵,得到氯化锰料液,氯化锰料液中:锰:180g/l;钙:220ppm;镁:330ppm;氯化铵:300g/l。
[0065]
取氯化锰料液3l,导入一30l夹层反应釜中,用导热油将温度升至轻微沸腾(实测
110℃)。然后泵入13l 2mol/l碳酸氢铵溶液,泵入流速每分钟60ml,碳酸氢铵与氯化锰的摩尔比2.6:1。碳酸氢铵溶液加入过程中,继续用导热油加热维持体系为轻微沸腾状态(110℃)。碳酸氢铵溶液加完后,保温陈化1小时,然后自然冷却至室温。过滤,滤饼用超纯水洗涤五次。然后将滤饼转移至烧杯中,慢慢加入5mol/l的电子级硫酸溶液。待碳酸锰溶解完以后,用锰粉将溶液ph值调节至5,体积调节至4l,加入16g硫化铵(每升溶液4g硫化铵),搅拌1h,陈化2h,然后过滤。滤液蒸发,得到硫酸锰晶体产品,将产品在100℃真空干燥,送样分析。
[0066]
实施例4
[0067]
将粗硝酸锰溶于水中,然后加入硝酸铵,得到硝酸锰料液,硝酸锰料液中:锰:160g/l;钙:200ppm;镁:410ppm;硝酸铵:300g/l。
[0068]
取硝酸锰料液4l,导入一30l夹层反应釜中,用导热油将温度升至轻微沸腾(实测108℃)。然后泵入13升2mol/l碳酸氢铵溶液,泵入流速每分钟70ml,碳酸氢铵与氯化锰的摩尔比2.2:1。碳酸氢铵溶液加入过程中,继续用导热油加热维持体系为轻微沸腾状态(108℃)。碳酸氢铵溶液加完后,保温陈化2h,然后自然冷却至室温。过滤,滤饼用超纯水洗涤五次。然后将滤饼转移至烧杯中,慢慢加入5mol/l的电子级硫酸溶液。待碳酸锰溶解完以后,用锰粉将溶液ph值调节至5,体积调节至4.5l,加入9g硫化铵(每升溶液2g硫化铵),搅拌1h,陈化2h,然后过滤。滤液蒸发,得到硫酸锰晶体产品,将产品在100℃真空干燥,送样分析。
[0069]
实施例5
[0070]
取一公斤饲料级一水硫酸锰配成2l溶液,溶液锰、钙、镁的浓度分别是mn:162.7g/l、钙:784mg/l、镁:1147mg/l。向硫酸锰溶液中加入6克硫化铵(每升溶液3g硫化铵),搅拌1.5小时后陈化2小时,然后过滤。过滤后向硫酸锰溶液中加入氯化铵900克,并用蒸馏水把溶液体积调节到3l,然后将溶液转移到一个10l的夹层玻璃反应釜内。用导热油将反应釜内溶液的温度加热到103℃以后,以60ml/min的流速泵入7.1l 2mol/l的碳酸氢铵溶液(碳酸氢铵的摩尔数和硫酸锰的摩尔数比为2.4:1)。反应过程中,维持温度103~105℃。碳酸氢铵加完后,陈化2.5小时,然后过滤。滤饼用超纯水洗涤到用钡离子检测不出硫酸根。将滤饼转移至一个5l的大玻璃烧杯内,用4mol/l的电子级硫酸溶液溶解碳酸锰,制备成硫酸锰溶液。蒸发后得到硫酸锰晶体产品。将产品在100℃真空干燥,送样分析。
[0071]
实施例1~5所得产品的分析结果如表2所示:
[0072]
表2实施例1~5所得产品的分析结果
[0073]
元素硅锌铅镉镍钙铬钠铁钾镁铜钴锰单位μg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/gμg/g%实施例144.20.967.10<0.02112.833.3<0.214.2<92.4019.2<0.5<0.232.2实施例232.30.059.05——28.5<0.210.1—3.1020.6——32.4实施例318.1—6.01—2.0223.0—1.01—1.0510.3——32.5实施例436.3—10.5—3.3218.6<0.25.31—2.149.82——32.5实施例524.5—4.53—8.2120.3<0.213.7—3.2215.6——32.5
[0074]
(“—”表示未检出)
[0075]
根据表2的结果可以看出,本发明制备的高纯硫酸锰均优于工信部发布的电子级硫酸锰产品质量标准。
[0076]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1