可控放氢材料、其制备方法及水解制氢的方法与流程
本发明总体涉及制氢技术领域。更具体地,本发明涉及一种可控放氢材料、其制备方法及水解制氢的方法。
背景技术:
能源是人类生存发展的根本保证,随着世界人口的不断增长,人们对能源的需求量也在与日俱增。化石燃料的大量使用对生态环境造成了严重污染。全世界都在探寻和开发新能源。氢能是完全无污染的可再生能源,也是最理想的绿色可再生资源。氢气资源丰富,目前被广泛用于有机化学产品制造、化石燃料加工和半导体工业等能源行业。
目前的制氢技术中,电解水技术发展成熟,但是电解水技术需要使用电解槽等装置,装置结构复杂且需要外用电源。spe质子膜电解法一定程度上可改善上述问题,但spe质子膜价格昂贵,使得产品定位为高端消费,并不能惠及普通民众。近年来,水解制氢作为一种新型实用的安全制氢技术,因其具有原料来源广泛、产氢量大、氢气纯度高、对环境没有危害等优点,受到了极大的关注,逐渐成为了各国学者争相研究的热点之一。nabh4的水解制氢工艺相对成熟,已经实现了为燃料电池快速提供氢气。但由于nabh4高昂的成本、催化剂易失效、水解产物nabo2回收再生率低等缺点,极大的限制了nabh4的商业化应用。
相比于硼氢化物,轻金属及其氢化物的发展则较为落后。al虽然是地壳中储氢最丰富的金属元素,但受限于“al循环”的能源效率问题,al/h2o制氢技术无法完全实现商业化。而一些氢化物如lih,cah2等,虽然与水反应可快速放氢,但放氢过于猛烈、反应不可控、且价格昂贵,因此逐渐地淡出人们的视线。并且在一些应用场景中,需要缓慢且少量的获得氢气,而在另一些应用场景中,需要快速且大量的获得氢气。因此,在安全制氢的同时研究可控放氢技术成为当前的热点和难点问题。
技术实现要素:
鉴于上面所提到的技术问题,本发明的技术方案在多个方面提供了一种可控放氢材料、其制备方法及水解制氢的方法。
根据本发明的第一方面,提供一种可控放氢材料,包括氢化镁以及水解促进剂和水解抑制剂二者中的至少一种,其中所述氢化镁、所述水解促进剂和/或所述水解抑制剂的质量配比为:所述氢化镁为1~50份,所述水解促进剂为1~50份,所述水解抑制剂为1~30份。
根据本发明的一个实施例,所述水解促进剂包括固体有机酸和过渡金属中的至少一种;并且所述水解抑制剂包括非金属材料。
根据本发明的另一个实施例,所述固体有机酸包括乙醇酸、丙二酸、柠檬酸和苹果酸中的至少一种。
根据本发明的又一个实施例,所述过渡金属包括铁、钴和镍中的至少一种。
根据本发明的一个实施例,所述非金属材料包括硼、石墨烯、硅和麦饭石中的至少一种。
根据本发明的另一个实施例,所述氢化镁和所述非金属材料的质量配比为:所述氢化镁为1~50份,所述非金属材料为1~10份。
根据本发明的又一个实施例,所述非金属材料为5份。
根据本发明的一个实施例,所述氢化镁与所述固体有机酸的质量比为1:4~1:5。
根据本发明的另一个实施例,所述氢化镁与所述固体有机酸的质量比为1:5。
根据本发明的又一个实施例,所述氢化镁的粒径为微米级。
根据本发明的一个实施例,所述氢化镁的粒径尺寸为100μm以下。
根据本发明的另一个实施例,所述氢化镁的粒径尺寸为45~75μm。
根据本发明的又一个实施例,所述氢化镁具有以镁为核心的核壳结构。
根据本发明的一个实施例,所述可控放氢材料具有以所述氢化镁为核心的核壳结构。
根据本发明的另一个实施例,所述可控放氢材料为片剂。
根据本发明的又一个实施例,所述可控放氢材料还包括成型剂和稳定剂中的至少一种,所述氢化镁与所述成型剂和/或所述稳定剂的质量配比为:所述氢化镁为1~50份,所述成型剂为1~70份,所述稳定剂为1~20份。
根据本发明的一个实施例,所述成型剂包括乳糖、麦芽糊精和聚乙二醇中的至少一种;所述稳定剂包括淀粉、硬质酸镁和微晶纤维素中的至少一种。
根据本发明的另一个实施例,所述氢化镁在所述可控放氢材料中的质量比例为1%~10%。
根据本发明的又一个实施例,所述氢化镁在所述可控放氢材料中的质量比例为5%。
根据本发明的第二方面,提供一种用于制备根据本发明的上述可控放氢材料的制备方法,包括:在氩气或高压氢气环境中,将氢化镁、水解促进剂和/或水解抑制剂按照配比进行球磨,以得到粉末状或者颗粒状的所述可控放氢材料;或者将镁和/或镁合金加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的所述氢化镁以及所述水解促进剂和/或所述水解抑制剂按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料。
根据本发明的一个实施例,所述制备方法进一步包括:对粉末状或者颗粒状的所述可控放氢材料进行压制成型。
根据本发明的另一个实施例,所述可控放氢材料还包括成型剂和稳定剂中的至少一种,并且所述制备方法还包括:将球磨后得到的混合物与所述成型剂和/或所述稳定剂混合均匀;或者在所述搅拌混合的过程中加入所述成型剂和/或所述稳定剂一同进行搅拌。
根据本发明的又一个实施例,所述球磨的球料比为20~60:1,球磨时间为0.5~40小时。
根据本发明的一个实施例,所述球磨的球料比为40:1,球磨时间为6小时。
根据本发明的另一个实施例,所述氢化的温度为200~450℃,氢压为0.3~5mpa。
根据本发明的又一个实施例,所述氢化的温度为350℃,氢压为3.0mpa。
根据本发明的一个实施例,所述氢化的时间为1~30小时。
根据本发明的另一个实施例,所述氢化的时间为4小时。
根据本发明的又一个实施例,所述搅拌混合的搅拌转速为5~400转/分钟,搅拌时间为5分钟~1小时。
根据本发明的第三方面,提供一种利用根据本发明的第一方面中任一项所述的可控放氢材料来进行水解制氢的方法,包括:将所述可控放氢材料放入氯化盐溶液中进行水解。
根据本发明的一个实施例,所述氯化盐溶液包括氯化镁溶液、氯化钠溶液、氯化锰溶液、氯化镍溶液、氯化铝溶液中的至少一种。
根据本发明的另一个实施例,所述氯化盐溶液的浓度为0.1~1mol/l。
根据本发明的又一个实施例,水解的温度为5~100℃。
根据本发明的一个实施例,水解的温度为20~40℃。
根据本发明的另一个实施例,水解的温度为35℃。
通过上述对本发明的技术方案及其多个实施例的描述,本领域技术人员可以理解本发明的可控放氢材料中可以包括水解促进剂和/或水解抑制剂,能够对氢化镁水解反应起到促进或抑制作用,从而实现放氢材料的可控放氢的目的。
附图说明
通过参考附图阅读下文的详细描述,本发明示例性实施方式的上述以及其他目的、特征和优点将变得易于理解。在附图中,以示例性而非限制性的方式示出了本发明的若干实施方式,并且相同或对应的标号表示相同或对应的部分其中:
图1-图2是示出根据本发明实施例的用于制备可控放氢材料的制备方法的多个流程图;
图3是示出不同氢化镁纯度的可控放氢材料的水解放氢动力学曲线对比图;
图4是示出不同氢化镁目数的可控放氢材料的水解放氢动力学曲线对比图;
图5是示出包括不同固体有机酸种类的可控放氢材料的水解放氢动力学曲线对比图;
图6是示出氢化镁与固体有机酸不同质量比的可控放氢材料的水解放氢动力学曲线对比图;
图7是示出不同氢化镁含量的可控放氢材料的水解放氢动力学曲线对比图;
图8是示出添加不同成型剂的可控放氢材料的水解放氢动力学曲线对比图;
图9a-图9d是示出根据本发明实施例的可控放氢材料在不同温度的氯化镁溶液中水解的动力学曲线对比图;
图10a和图10b是示出根据本发明实施例的可控放氢材料在不同温度的氯化钠溶液中水解的动力学曲线对比图;
图11是示出根据本发明实施例的添加非金属材料的可控放氢材料的水解动力学曲线对比图;以及
图12是示出氢化镁在去离子水和不同氯化盐溶液中水解的动力学曲线图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
应当理解,本发明的权利要求、说明书及附图中的术语“第一”、“第二”、“第三”和“第四”等是用于区别不同对象,而不是用于描述特定顺序。本发明的说明书和权利要求书中使用的术语“包括”和“包含”指示所描述特征、整体、步骤、操作、元素和/或组件的存在,但并不排除一个或多个其它特征、整体、步骤、操作、元素、组件和/或其集合的存在或添加。
还应当理解,在此本发明说明书中所使用的术语仅仅是出于描述特定实施例的目的,而并不意在限定本发明。如在本发明说明书和权利要求书中所使用的那样,除非上下文清楚地指明其它情况,否则单数形式的“一”、“一个”及“该”意在包括复数形式。还应当进一步理解,在本发明说明书和权利要求书中使用的术语“和/或”是指相关联列出的项中的一个或多个的任何组合以及所有可能组合,并且包括这些组合。
如在本说明书和权利要求书中所使用的那样,术语“如果”可以依据上下文被解释为“当...时”或“一旦”或“响应于确定”或“响应于检测到”。类似地,短语“如果确定”或“如果检测到[所描述条件或事件]”可以依据上下文被解释为意指“一旦确定”或“响应于确定”或“一旦检测到[所描述条件或事件]”或“响应于检测到[所描述条件或事件]”。
本发明针对现有技术的不足,提供了一种可控放氢材料,其可以包括氢化镁以及水解促进剂和水解抑制剂二者中的至少一种,通过调节成分和配比可以实现可控放氢的目的。通过下面的描述,本领域技术人员可以理解的是,根据本发明的可控放氢材料还可以包括例如成型剂、稳定剂等成分,以改善可控放氢材料的成型性、放氢平稳性等方面的性能。进一步地,根据本发明的可控放氢材料中的氢化镁可以是微米级,从而能够有效降低材料的生产成本,并且有利于产品的商业化发展等。下面将对根据本发明的可控放氢材料的具体实施方式进行描述。
根据本发明的第一方面,提供一种可控放氢材料,可以包括氢化镁以及水解促进剂和水解抑制剂二者中的至少一种,其中所述氢化镁、所述水解促进剂和/或所述水解抑制剂的质量配比为:所述氢化镁为1~50份,所述水解促进剂为1~50份,所述水解抑制剂为1~30份。
上文中所述的氢化镁的来源可以是市售的氢化镁成品,也可以是镁单质经过氢化处理后得到的产物。根据本发明的一个实施例,所述氢化镁可以具有以镁为核心的核壳结构,该核壳结构可以包括由氢化镁包覆在镁表层形成的外壳。具有核壳结构的氢化镁有利于控制水解速率。根据本发明的另一个实施例,所述氢化镁的纯度可以为90%以上。在一个优选实施例中,氢化镁的纯度可以为98%以上。
根据本发明的一个实施例,所述氢化镁的粒径可以为微米级或者纳米级。根据本发明的另一个实施例,所述氢化镁的粒径尺寸可以为100μm以下。根据本发明的又一个实施例,氢化镁的粒径尺寸可以为45~75μm。微米级的氢化镁相比于纳米级的氢化镁而言,具有价格低廉、原料易得等特点,因此采用微米级的氢化镁能够有利于降低可控放氢材料的生产成本。
上文中所述的水解促进剂可以对氢化镁水解时产生促进作用。例如,在一个实施例中,水解促进剂可以提高氢化镁水解放氢的速率。在另一个实施例中,水解促进剂可以提高氢化镁水解放氢的转化率,以便获得更大的放氢(或称产氢)总量。根据本发明的一个实施例,所述水解促进剂可以包括固体有机酸和过渡金属等中的至少一种。根据本发明的另一个实施例,所述固体有机酸可以包括乙醇酸、丙二酸、柠檬酸和苹果酸等中的至少一种;所述过渡金属可以包括铁、钴和镍等中的至少一种。根据本发明的又一个实施例,所述水解促进剂为固体有机酸,所述氢化镁与所述固体有机酸的质量比可以为1:4~1:5,该质量比范围可以达到较好的促进氢化镁水解的效果。根据本发明的一个优选实施例,所述氢化镁与所述固体有机酸的质量比可以为1:5,有利于同时提高可控放氢材料的水解速率和转化率。
上文中所述的水解抑制剂可以具有抑制氢化镁水解反应的作用,例如可以降低氢化镁水解放氢的速率,或者还可以降低氢化镁水解放氢的转化率,以减少放氢量(或称产氢量)等。根据本发明的一个实施例,所述水解抑制剂可以包括非金属材料等。例如,在一个实施例中,所述非金属材料可以包括硼、石墨烯、硅和麦饭石等中的至少一种。在另一个实施例中,某些传统意义上的水解促进剂(例如钴)可以在一定条件下转变为水解抑制剂,或者具有水解抑制剂的作用和效果。根据本发明的一个实施例,所述氢化镁和所述非金属材料的质量配比可以为:所述氢化镁为1~50份,所述非金属材料为1~10份。在另一个实施例中,所述非金属材料可以为5份。
当可控放氢材料中同时存在水解促进剂和水解抑制剂时,本领域技术人员可以根据需要设置二者的配比等,以满足例如快速且少量的放氢,或者缓释且长期的放氢等应用需求。例如提高水解促进剂或者氢化镁的比例,有利于提高水解反应的放氢速率或者转化率等;提高水解抑制剂的比例,有利于抑制可控放氢材料水解反应的放氢速率或转化率等。
根据本发明的一个实施例,所述可控放氢材料可以具有核壳结构,该核壳结构可以包括一部分所述氢化镁为核心,以及另一部分所述氢化镁与所述水解促进剂和/或所述水解抑制剂形成的外壳。氢化镁与水解促进剂和/或水解抑制剂形成的外壳有利于控制水解速率。例如,氢化镁和某些水解促进剂形成的外壳可以降低氢化镁的致密度,使氢化镁颗粒相对疏松,从而有利于水解反应的进行;而氢化镁和水解抑制剂形成的外壳可以包覆氢化镁表面,从而减慢水解反应的速率。在一个实施例中,具有核壳结构的可控放氢材料可以通过球磨的方法制得。在另一个实施例中,具有核壳结构的可控放氢材料中的氢化镁也具有核壳结构。
根据本发明的另一个实施例,所述可控放氢材料可以为粉剂、片剂、丸剂等中的一种,其中相比于其它形状,片剂的可控放氢材料的放氢更加平稳可控。可控放氢材料的形状和尺寸可以根据需要进行调整。在一个实施例中,根据本发明的可控放氢材料可以设置为直径18mm,厚度5mm的圆片型,以用于例如沐足片等。在另一个实施例中,根据本发明的可控放氢材料可以设置为直径8mm,厚度5mm的片剂,以用于例如营养品、泡腾片等。在又一个实施例中,片剂的可控放氢材料可以适用于例如燃料电池的反应剂等。片剂的形状可以不限于圆片型,可以根据需要设置为例如心形、三角形、五角星型等规则或者不规则的形状。
根据本发明的又一个实施例,可控放氢材料为片剂时,片剂的优选尺寸为:直径在25mm以下,厚度在8mm以下。根据这样的设置,可以保证在正常压力范围内压制的片剂具有较好的结实度,如果超过这个尺寸范围,则需要更大的压力进行压制,不仅增加能耗,还会增加设备损耗和生产成本等。
根据本发明的又一个实施例,所述可控放氢材料还可以包括成型剂和稳定剂中的至少一种,所述氢化镁与所述成型剂和/或所述稳定剂的质量配比可以为:所述氢化镁为1~50份,所述成型剂为1~70份,所述稳定剂为1~20份。
上文中所述的成型剂能够增加可控放氢材料中的各成分之间的相互作用,从而有利于可控放氢材料的成型。例如,在一个实施例中,可控放氢材料中的氢化镁的粒径可以为微米级,成型剂的添加能够有效提高可控放氢材料的成型率。根据本发明的一个实施例,所述成型剂可以包括乳糖、麦芽糊精和聚乙二醇等中的至少一种。乳糖和麦芽糊精具有调节口味的作用,适用于对可控放氢材料口感有需求的应用场景中。聚乙二醇不仅可以具有成型剂的作用,还可以具有在压片时的润滑作用。
上文中所述的稳定剂能够防止可控放氢材料在水解时发生崩解,从而保证水解的平稳放氢。特别是对于已经成型的可控放氢材料而言,如果在水解时发生崩解,可能出现放氢量和放氢速率快速变化的情形,不利于对放氢过程的控制。在一个实施例中,所述稳定剂可以包括淀粉、硬质酸镁和微晶纤维素等中的至少一种。
根据本发明的一个实施例,所述氢化镁在所述可控放氢材料中的质量比例可以为1%~10%。根据本发明的一个优选实施例,所述氢化镁在所述可控放氢材料中的质量比例可以为5%,该比例的可控放氢材料的放氢速率不会太快或者太慢,更有利于控制可控放氢材料的放氢速率。相比于氢化镁在可控放氢材料中的质量比例为5%而言,氢化镁在可控放氢材料中的质量比例为10%时能够显著提高可控放氢材料水解反应时的放氢速率。
上面总体上对根据本发明的可控放氢材料进行了描述,本领域技术人员可以理解的是,根据本发明的可控放氢材料不仅具有可控放氢、防止崩解、成本低等特点,还可以根据需要设置形状或者结构。为了便于理解本发明的可控放氢材料的形状或者结构的设置以及制备过程,以下将结合图1和图2对用于制备本发明的可控放氢材料的多个制备方法实施例进行描述。
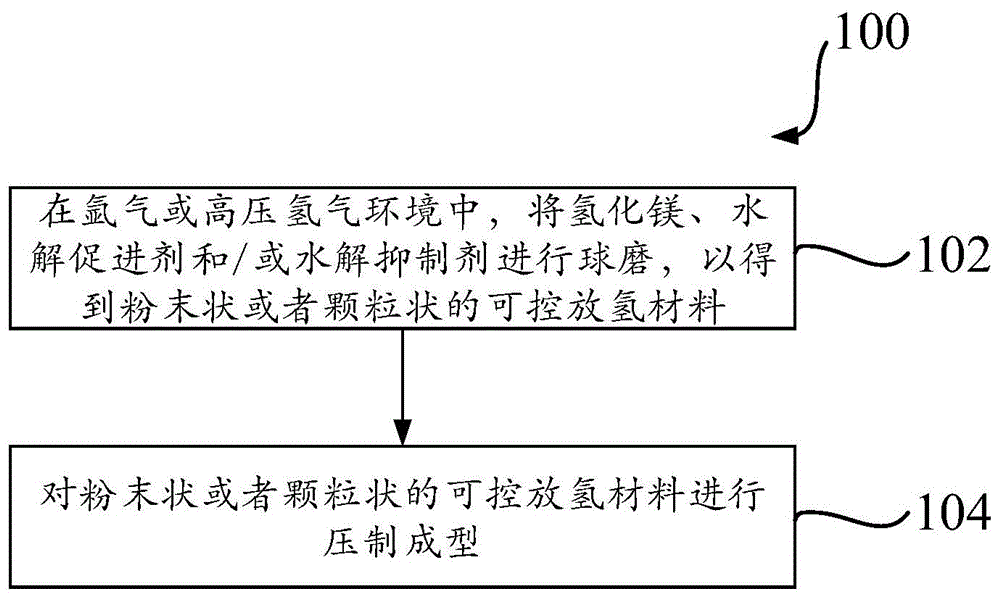
图1是示出根据本发明实施例的用于制备可控放氢材料的制备方法流程图。如图1中所示,提供一种制备本发明的可控放氢材料的制备方法100。在步骤102处,方法100可以在氩气或高压氢气环境中,将所述氢化镁、所述水解促进剂和/或所述水解抑制剂按照配比进行球磨,以得到粉末状或者颗粒状的所述可控放氢材料。这里的高压氢气环境一般为1-10mpa压力下的氢气环境,在一个优选实施例中,高压氢气环境为3-5mpa的压力下的氢气环境。
上文中所述的球磨能够细化各成分颗粒尺寸和晶粒尺寸,增大氢化镁的比表面积,还能够使例如水解促进剂等成分的颗粒弥散分布在氢化镁基体中,达到分散氢化镁的作用,增大氢化镁基体与水的接触面积,同时减少水解产物氢氧化镁对水解的抑制作用,从而有利于改善水解性能。在一个实施例中,所述球磨的球料比可以为20~60:1,球磨时间可以为0.5~40小时(“h”)。在另一个实施例中,球磨的球料比可以为40:1,球磨时间可以为6小时(即6h)。
可选地,在步骤104处,方法100可以对粉末状或者颗粒状的所述可控放氢材料进行压制成型。在一个实施例中,方法100执行步骤104可以在室温且湿度低于40%的环境中进行。在另一个实施例中,方法100可以将混合粉末压制为片剂。方法100对混合粉末进行压制的压力大小可以根据片剂直径的不同而不同,只需将片剂压实即可。例如,在一个实施例中,方法100可以将混合粉末压制为一个或多个直径18毫米、厚度5毫米的片剂,压制时的压力可以为6吨。在另一个实施例中,方法100可以将混合粉末压制为一个或多个直径8毫米、厚度5毫米的片剂,压制时的压力可以为3吨。
根据本发明的另一个实施例,所述可控放氢材料还可以包括成型剂和稳定剂中的至少一种,并且所述制备方法100还可以包括:将球磨后得到的混合物与所述成型剂和/或所述稳定剂混合均匀。即在图1中所示的步骤102之后,方法100可以将成型剂和/或稳定剂与球磨后得到的混合物按照配比进行混合,以得到包括成型剂和/或稳定剂的可控放氢材料。成型剂和稳定剂在前文关于可控放氢材料的成分中已经进行了详细描述,此处不再赘述。
以上结合图1对根据本发明的可控放氢材料的一种制备方法进行了示例性的描述,本领域技术人员应该理解的是,以上描述是示例性的而非限制性的。例如,在步骤104处,方法100可以不限于将混合粉末压制为片剂,在一个实施例中,方法100可以通过模具将混合粉末压制为丸剂或者其他形状。用于制备根据本发明的可控放氢材料的制备方法可以不限于图1中所描述的物理方法,还可以根据需要采用化学方法进行制备。以下将结合图2对根据本发明的制备方法的另一个实施例进行描述。
如图2中所示,在步骤202处,方法200可以将镁和/或镁合金加热蒸发。在一个实施例中,方法200可以将镁和/或镁合金电感加热蒸发(或称电磁感应加热蒸发)。在另一个实施例中,方法200可以将镁和/或镁合金电弧加热蒸发。电弧蒸发可以包括例如将镁单质和/或镁合金作为电极材料,在外加电压的作用下,电极间依靠等离子体导电产生弧光放电,从而使电极材料被蒸发。镁的沸点(1100℃)不高,采用电感或者电弧加热,高温下容易蒸发成镁蒸气。并且由于镁气化温度较低,在镁能够蒸发的温度下,镁合金中的其他杂质不会蒸发,因此方法200也可以采用镁合金加热蒸发。
接着,在步骤204处,方法200可以对蒸发后得到的镁蒸气进行降温使其凝结沉降。这里的降温可以是降至例如室温,或者其他可以使镁蒸气凝结沉降的温度。由于镁和/或镁合金加热蒸发后得到的是镁蒸气,因此方法200对镁蒸气降温沉降后可以得到镁粉。可以看出,步骤202和步骤204的加热蒸发和降温沉降可以具有对镁的提纯作用,能够得到纯度较高的镁粉,从而有利于后续制备步骤形成具有核壳结构的氢化镁。
进一步地,流程前进到步骤206处,方法200可以对凝结后的产物(例如镁粉)进行氢化,以得到具有核壳结构的所述氢化镁。在不完全氢化的情况下,可以得到以镁为核心,氢化镁包覆镁表层形成外壳的氢化镁核壳结构。根据本发明的一个实施例,所述氢化的温度可以为200~450℃,氢压可以为0.3~5mpa。根据本发明的另一个实施例,所述氢化的温度可以为350℃,氢压可以为3.0mpa。氢化时间可以通过在设定的温度和氢压下判断样品的吸氢量不再增加来确定。例如在一个实施例中,氢化的时间可以为1~30h。在另一个实施例中,氢化时间可以为4小时。
如图2中进一步示出的,在步骤208中,方法200可以将具有核壳结构的所述氢化镁以及所述水解促进剂和/或所述水解抑制剂按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料。从微观结构上看,水解促进剂和/或水解抑制剂可以包覆在具有核壳结构的氢化镁表面,或者可以分散嵌入到具有核壳结构的氢化镁内。搅拌混合可以通过例如搅拌桨、搅拌器等设备实现。在一个实施例中,所述搅拌混合的搅拌转速可以为5~400转/分钟,搅拌时间可以为5分钟(即5min)~1小时(即1h)。
根据本发明的一个实施例,可控放氢材料还可以包括成型剂和稳定剂中的至少一种,则在步骤208中,方法200可以在所述搅拌混合的过程中加入所述成型剂和/或所述稳定剂一同进行搅拌,以得到混合均匀的粉末状或者颗粒状的所述可控放氢材料。成型剂和稳定剂在前文关于可控放氢材料的成分中已经进行了详细描述,此处不再赘述。
根据本实施例的制备方法,可以先批量制备出具有核壳结构的氢化镁,然后按照配比通过添加例如水解促进剂、水解抑制剂、成型剂、稳定剂等并进行混合工艺即可得到可控放氢材料。这样的工艺简单易操作、能耗低且安全性高,有利于工业化大规模生产。
以上结合图1和图2对根据本发明的用于制备可控放氢材料的制备方法进行了描述,本领域技术人员在本公开的基础上,可以根据需要进行调整。例如,根据本发明的一个实施例,可以将图1所示制备方法与图2所示制备方法相结合,例如在图2所示的步骤208中,可以采用图1所示的球磨方法对水解促进剂和/或水解抑制剂与具有核壳结构的氢化镁进行混合,可以得到以氢化镁为核心,水解促进剂和/或水解抑制剂与氢化镁球磨形成为外壳的核壳结构可控放氢材料。根据本发明的另一个实施例,图2中所示的制备方法200可以进一步包括:对粉末状或者颗粒状的所述可控放氢材料进行压制成型。该步骤与前文中结合图1的步骤104的描述相同或相似,此处不再赘述。根据本发明的又一个实施例,当可控放氢材料还包括成型剂和稳定剂中的至少一种时,图1中所述的制备方法100将球磨后的混合物与成型剂和/或稳定剂混合时可以采用如图2的步骤208中所述的搅拌混合方式。
根据本发明的第三方面,提供一种利用根据本发明的第一方面中任一项所述的可控放氢材料来进行水解制氢的方法,可以包括:将所述可控放氢材料放入氯化盐溶液中进行水解。相比于纯水作为水解溶液,氯化盐溶液中的c1-的存在可以使生成的mg(oh)2层相对疏松,使得h2o可以持续地与mgh2接触并进行反应,从而能够显著提高水解动力学性能,以加快水解速率。在一个实施例中,可控放氢材料可以是片剂或者其它形状的成型材料。氯化盐溶液的使用量可以满足成型的可控放氢材料完全溶解即可,一般用量在50ml以上为宜。
根据本发明的一个实施例,所述氯化盐溶液可以包括氯化镁溶液、氯化钠溶液、氯化锰溶液、氯化镍溶液、氯化铝溶液等中的至少一种。根据本发明的另一个实施例,所述氯化盐溶液的浓度可以为0.1~1mol/l。根据本发明的又一个实施例,水解的温度可以为5~100℃。根据本发明的一个实施例,水解的温度可以为20~40℃。根据本发明的另一个实施例,水解的温度可以为35℃
下面将结合附图对根据本发明的可控放氢材料的具体实施例进行描述。附图中的水解放氢动力学曲线图的横坐标表示水解时间,纵坐标表示放氢量(ml)/片剂中氢化镁的质量(g)。
图3是示出不同氢化镁纯度的可控放氢材料的水解放氢动力学曲线对比图。图3是对实施例1和实施例2的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温可以为室温。
实施例1:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份(纯度为90%),柠檬酸为25份,麦芽糊精为50份,聚乙二醇为20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例2:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份(纯度为98%),柠檬酸为25份,麦芽糊精为50份,聚乙二醇为20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例1和实施例2的区别在于氢化镁的纯度不同,其中实施例1中的氢化镁的纯度低于实施例2中的氢化镁的纯度。如图3中所示,实施例2的可控放氢材料的放氢速率和放氢量均明显高于实施例1的放氢速率和放氢量。由此可知,可控放氢材料中的氢化镁纯度越高,越有利于水解反应的进行,其水解速度越快,水解放氢量越多。
图4是示出不同氢化镁目数的可控放氢材料的水解放氢动力学曲线对比图。图4是对实施例3和实施例4的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温可以为室温。
实施例3:本实施例中的可控放氢材料的成分和质量配比分别为:200目氢化镁(粒径为75μm)为10份,柠檬酸为40份,麦芽糊精为45份,聚乙二醇为5份。本实施例的可控放氢材料的制备方法为:在高压氢气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例4:本实施例中的可控放氢材料的成分和质量配比分别为:320目氢化镁(粒径为45μm)为10份,柠檬酸为40份,麦芽糊精为45份,聚乙二醇为5份。本实施例的可控放氢材料的制备方法为:在高压氢气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例3和实施例4的区别在于氢化镁的目数不同(即氢化镁的粒径不同),其中实施例3中的氢化镁目数小于实施例4中的氢化镁目数(即实施例3中的氢化镁的粒径大于实施例4中的氢化镁的粒径)。如图4中所示,在水解进行的前两分钟内,二者水解速度接近,随后氢化镁的目数越大(即氢化镁的粒径越小),可控放氢材料的水解速度越快,且水解放氢量越大。
图5是示出包括不同固体有机酸的可控放氢材料的水解放氢动力学曲线对比图。图5是对实施例5和实施例6的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温为室温。
实施例5:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,柠檬酸为25份,麦芽糊精为50份,聚乙二醇为20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例6:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,苹果酸为25份,麦芽糊精为50份,聚乙二醇为20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和苹果酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例5和实施例6的区别在于固体有机酸的种类不同,其中实施例5中的固体有机酸是柠檬酸,实施例6中的固体有机酸是苹果酸。如图5中所示,在水解进行的前四分钟内,二者水解速度接近,随后含柠檬酸的片剂(即实施例5)水解放氢速度和水解放氢量均高于含苹果酸的片剂(即实施例6),这是由于柠檬酸的酸度比苹果酸的酸度强,对提高mgh2反应动力学性能的作用更加显著。
图6是示出氢化镁和固体有机酸不同质量比的可控放氢材料的水解放氢动力学曲线对比图。图6是对实施例7和实施例8的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温为室温。
实施例7:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为10份,苹果酸为40份,麦芽糊精为50份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和苹果酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例8:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为10份,苹果酸为50份,麦芽糊精为40份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和苹果酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例7和实施例8的区别在于氢化镁与固体有机酸的质量比不同,其中实施例7中的氢化镁:苹果酸的质量比为1:4,实施例8中的氢化镁:苹果酸的质量比为1:5。如图6中所示,实施例8中的可控放氢材料的水解速度和水解产氢量均高于实施例7中的可控放氢材料,说明当提高可控放氢材料中水解促进剂(例如固体有机酸)与氢化镁的质量比时,有利于提高可控放氢材料的水解速度和水解产氢量。
图7是示出不同氢化镁含量的可控放氢材料的的水解放氢动力学曲线对比图。图7是对实施例9和实施例10的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温为室温。
实施例9:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为10份,苹果酸为50份,麦芽糊精为40份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和苹果酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例10:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,苹果酸为25份,麦芽糊精为70份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和苹果酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例9和实施例10的区别在于氢化镁在可控放氢材料中的含量(或称质量比例)不同,其中实施例9中的氢化镁在可控放氢材料中的含量为10%,实施例10中的氢化镁在可控放氢材料中的含量为5%。如图7中所示,当可控放氢材料中氢化镁含量为10%(即实施例9)时,其水解放氢速度高于氢化镁含量为5%的可控放氢材料(即实施例10)。说明提高可控放氢材料中氢化镁的含量,有利于提高可控放氢材料的水解速度,本领域技术人员可以根据所需放氢速率调整氢化镁的含量。由于实施例9和实施例10的可控放氢材料中的固体有机酸与氢化镁的比例相同,因此最终水解放氢量接近。
图8是示出添加不同成型剂的可控放氢材料的水解放氢动力学曲线对比图。图8是对下面所述实施例11和实施例12的可控放氢材料进行水解放氢测试所得的结果,其中水解放氢测试中均采用排水法收集氢气,水解反应过程中的水温为室温。
实施例11:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,柠檬酸为25份,麦芽糊精为50份,聚乙二醇20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与麦芽糊精和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例12:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,柠檬酸为25份,乳糖为50份,聚乙二醇20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与乳糖和聚乙二醇混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。
实施例11和实施例12的区别在于可控放氢材料中的成型剂不同,其中实施例11中的成型剂为麦芽糊精和聚乙二醇,实施例12中的成型剂为乳糖和聚乙二醇。如图8中所示,实施例12中的可控放氢材料的水解放氢速度和放氢量均明显高于实施例11中的可控放氢材料。这说明成型剂的种类会影响可控放氢材料的水解速度和放氢量,并且在可控放氢材料中添加乳糖比添加麦芽糊精更有利于提高可控放氢材料的水解速度和放氢量。
以上结合图3-图8对根据本发明的添加固体有机酸的可控放氢材料的多个实施例及其水解性能进行了示例性的描述,本领域技术人员可以理解的是,氢化镁的含量、固体有机酸的种类、固体有机酸与氢化镁的比例、成型剂的种类等因素均会对可控放氢材料的水解性能产生影响,本领域技术人员可以根据实际应用中所需的水解效果对本发明的可控放氢材料中的成分及配比进行选择或调整。另外,本领域技术人员应该理解的是,上述描述是示例性的而非限制性的,例如水解促进剂可以不限于固体有机酸,还可以是过渡金属等。本发明的可控放氢材料中可以不限于添加水解促进剂,还可以根据需要添加水解抑制剂等。为了便于理解,以下将继续结合多个实施例进行示例性的描述。
实施例13:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,铁单质为10份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及铁单质按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为200转/分钟,搅拌时间为30min,氢化的温度为450℃,氢压为0.3mpa,氢化时间30h。
实施例14:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,钴单质为5份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及钴单质按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为300转/分钟,搅拌时间为5min,氢化的温度为400℃,氢压为1.0mpa,氢化时间20h。
实施例15:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,镍单质为3份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及镍单质按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为400转/分钟,搅拌时间为20min,氢化的温度为300℃,氢压为4.0mpa,氢化时间10h。
为了更好的理解添加过渡金属的可控放氢材料的水解性能,以下将结合图9a-图9d以及图10a-图10b的水解测试结果进行说明。为了便于分析测试结果,在以下测试过程中加入了对比测试,即将纯镁氢化后得到的氢化镁与实施例13-实施例15的可控放氢材料在同等条件下进行水解测试。
图9a-图9c是示出实施例13-实施例15的可控放氢材料在不同温度的氯化镁溶液中水解的水解动力学曲线对比图,其中水解溶液均采用0.1mol/l的氯化镁水溶液。图9a是示出20℃时水解测试的水解动力学曲线图。如图9a中所示,实施例13(即添加了铁)和实施例15(即添加了镍)的可控放氢材料在水解测试初期的水解动力学性能均超过了对比测试的样品,其中实施例13的可控放氢材料的水解动力学性能略优于实施例15的样品。而实施例14(即添加了钴)的水解动力学性能在包括对比测试的样品在内的所有样品中表现最差。因此,相比于对比测试的样品,在20℃的水解测试中,添加了铁和镍的样品水解性能较优,而添加了钴的样品水解性能略差。换言之,在一些应用场景中,钴也可以作为水解抑制剂使用。
图9b是示出35℃时水解测试的水解动力学曲线图。与图9a和图9c相比,图9b中各样品的水解性能表现最好。具体地,如图9b中所示,在35℃水浴中水解时,实施例13(即添加了铁)的可控放氢材料的水解动力学性能总体上是最好的,其能够在5min内水解产生超过1000ml/g的氢气,并在10min内产生1364.93ml/g的氢气,接近达到饱和值。实施例15(即添加了镍)的可控放氢材料在水解初始阶段的水解动力学性能是在所有样品中最好,其能够在2.5min内产生557.38ml/g的氢气,然而在2.5min后,被实施例13的可控放氢材料超越。实施例14(即添加了钴)的可控放氢材料的水解动力学性能也超过了对比测试的样品,其能够在10min内产生1323.81ml/g的氢气并在15min时达到水解产氢的饱和值。
图9c是示出40℃时水解测试的水解动力学曲线图。如图9c中所示,当水浴温度升高到40℃时,各样品的水解相对性能与图9b中的类似。即在水解反应初始阶段,实施例13-实施例15的样品的水解动力学性能均超过了对比测试的样品。
图9d是示出各样品水解动力学曲线对应的阿伦尼乌兹公式lnk~1000/t拟合直线。拟合得到实施例15的可控放氢材料的水解激活能为68.60kj/mol,实施例13的可控放氢材料的水解激活能为79.96kj/mol,对比测试的样品的水解激活能为81.79kj/mol,而实施例14的可控放氢材料的水解激活能最大,为87.89kj/mol。
通过上面结合图9a-图9d的描述可以看出,在0.1mol/l的氯化镁水溶液的水解放氢测试中,总体上实施例13(即添加了铁)的可控放氢材料的水解动力学性能最好,实施例15(即添加了镍)的可控放氢材料次之。另外,水解温度对各样品的水解动力学性能具有一定的影响,在一定范围内,随着水解温度的上升,各样品的水解动力学随之增强。
根据本发明的水解制氢的方法,可控放氢材料可以在氯化盐溶液中水解制氢,所述氯化盐溶液可以不限于图9a-图9d中所描述的氯化镁溶液,还可以根据需要采用其他氯化盐溶液。以下将以氯化钠水溶液为例进行水解测试。
图10a和图10b是示出实施例13-实施例15的可控放氢材料在不同温度的氯化钠水溶液中水解的水解动力学曲线对比图,其中水解溶液均采用3.5wt.%的氯化钠水溶液。
图10a是示出20℃的氯化钠水溶液中水解测试的水解动力学曲线图。如图10a中所示,实施例13(即添加了铁)的可控放氢材料的水解动力学性能表现最好,其能够在10min内产生氢气接近500ml/g,60min内产生1086.96ml/g的氢气。其次是实施例15(添加了镍)的可控放氢材料,其能够在10min内产生421.94ml/g的氢气,并在60min内达到饱和值1054.85ml/g氢气。实施例14(添加了钴)的可控放氢材料与在0.1mol/l的mgcl2水溶液中水解性能表现类似,差于对比测试的样品。
图10b是示出35℃的氯化钠水溶液中水解测试的水解动力学曲线图。如图10b中所示,当水解温度升高到35℃时,实施例13(即添加了铁)的可控放氢材料的水解性能仍为最好。但是,对比测试的样品的水解性能随温度的提升最大,并在该温度下表现为优于实施例15(添加了镍)的可控放氢材料的水解性能。而实施例14(添加了钴)的可控放氢材料的水解速度和产氢量等均表现的最差。换言之,在一些应用场景中,钴可以作为水解抑制剂使用,或者在水解条件发生一些改变时能够起到抑制水解的作用。
进一步地,相比于如图9a-图9c中所示的在0.1mol/lmgcl2水溶液中的水解测试结果,各样品在氯化钠水溶液中的水解性能均表现为不同程度的下降。此外,在0.1mol/l的mgcl2水溶液中各样品的水解性能表现的十分接近,然而在图10a和图10b的nacl水溶液中的水解测试结果中可以看出,各样品水解性能的差异比较明显。
以上结合多个实施例和测试结果对添加水解促进剂的可控放氢材料的水解性能进行了示例性的描述,通过上面的描述,本领域技术人员可以理解的是,水解溶液的种类、水解温度等条件对可控放氢材料的水解性能都会产生影响,甚至在满足一定条件时,某些传统意义的水解促进剂(例如钴)能够起到抑制水解的作用。因此,本领域技术人员可以根据需要,通过控制可控放氢材料的成分和配比等,来满足在不同应用环境中对于放氢速率和放氢量等的不同需求。以下将结合多个实施例对添加水解抑制剂的可控放氢材料进行示例性的描述。
实施例16:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,硼单质为5份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及硼单质按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为400转/分钟,搅拌时间为50min,氢化的温度为350℃,氢压为3.0mpa,氢化时间6h。
实施例17:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,石墨烯为5份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及石墨烯按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为400转/分钟,搅拌时间为50min,氢化的温度为350℃,氢压为3.0mpa,氢化时间6h。
实施例18:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,硅单质为5份。本实施例的可控放氢材料的制备方法为:将镁单质电感加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁以及硅单质按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料,其中搅拌混合的搅拌转速为400转/分钟,搅拌时间为50min,氢化的温度为350℃,氢压为3.0mpa,氢化时间6h。
为了能够更好的理解添加非金属材料的可控放氢材料的水解性能,下面将结合图11的水解测试结果进行说明。为了便于分析测试结果,在以下测试过程中加入了对比测试,即将纯镁氢化后得到的氢化镁与实施例16-实施例18的可控放氢材料在同等条件下进行水解测试。
图11是示出实施例16-实施例18的可控放氢材料的水解动力学曲线对比图,其中水解溶液均采用0.1mol/l的氯化镁水溶液,水解的温度为20℃。如图11中所示,实施例16-实施例18的可控放氢材料的放氢速度和产氢量均明显小于对比测试的样品,说明添加非金属材料能够显著抑制可控放氢材料的水解性能。
如图11中进一步示出的,在实施例16-实施例18中,实施例17(即添加石墨烯)的可控放氢材料样品在0.1mol/lmgcl2的水溶液中初始产氢速率最好,能够在20min内产生689.19ml/g的氢气,但是最终的产氢饱和值只有932.43ml/g,是在所有样品中最低的。实施例18(即添加硅)的可控放氢材料的初始放氢性能虽然表现的不好,但随着水解反应的继续,实施例18的可控放氢材料的水解速率逐渐加快,在30min内接近达到水解产氢饱和值896.86ml/g,之后缓慢水解直到60min时其水解产氢量可达1035.87ml/g,其是在实施例16-实施例18中最终的产氢量最大的。实施例16(即添加硼)的可控放氢材料的水解速率在前40min内都保持稳定,并在60min内水解产生980.65ml/g的氢气。
根据上面的描述可以看出,实施例17的可控放氢材料的初始产氢速率高于实施例16和实施例18的可控放氢材料,但是随着水解反应的进程,实施例17的可控放氢材料的水解速度逐渐被实施例16和实施例18的可控放氢材料超越,且实施例17的可控放氢材料水解达到的最终产氢量是最少的。这可能是由于在发生水解反应时,b或si与镁形成的相能够伴随mgh2一起水解,同时其能释放h离子,降低周围水溶液的ph值,使生成的mg(oh)2沉淀溶解,因此添加硼或硅的可控放氢材料的最终产氢量能够大于添加石墨烯的可控放氢材料。
在上面多个实施例的水解测试中采用了氯化盐溶液作为水解溶液,不仅可以加快可控放氢材料的水解进程,从而便于观察和对比水解测试的结果,还可以进一步证明根据本发明的第三方面中所提供的的水解制氢的方法的可行性。根据本发明的第三方面,提供了一种利用本发明的可控放氢材料来进行水解制氢的方法,可以包括:将所述可控放氢材料放入氯化盐溶液中进行水解。为了进一步说明氯化盐溶液对水解反应的影响,本发明还进行了氢化镁分别在氯化盐溶液和去离子水中水解的测试,测试结果如图12所示,下面将结合图12进行描述。
如图12所示,分别示出氢化镁在0.1mol/lmgcl2水溶液、1mol/lnacl水溶液以及去离子水(图示中的diwater)中水解的水解动力学曲线,可以看出氢化镁在0.1mol/lmgcl2水溶液中的放氢量最大,可以达到1360ml/g;在1mol/lnacl水溶液的放氢量次之,可以达到1000ml/g;而在去离子水中的放氢量最小,仅为330ml/g。这是由于氯化盐水溶液中的cl-离子能够对致密的mg(oh)2保护层具有一定的破坏作用,并且cl-离子能够增加溶液的导电性,可能会对水解反应的速度具有一定的促进作用。如图中进一步示出的,溶液中的mg2+对氢化镁水解具有显著的促进作用。这是由于溶液中mg2+的存在使得水解生成的oh-优先与溶液中的mg2+结合形成mg(oh)2悬浮颗粒,而不是在mgh2表面形成mg(oh)2保护层,而且溶液中失去的mg2+可以由mgh2水解产物补给,因此mg2+的总量并未减少。相比于去离子水中的水解反应,nacl对mgh2的水解同样具有明显的促进作用。因此根据本发明的水解制氢的方法能够显著提高可控放氢材料的产氢速度和产氢量。
实施例19:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为1份,柠檬酸为4份,乳糖为1份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和柠檬酸按照配比进行球磨;将球磨后得到的混合物与乳糖混合均匀,以得到粉末状或者颗粒状的可控放氢材料。球磨的球料比为20:1,球磨时间为40h。进一步地,利用本实施例的可控放氢材料来进行水解制氢的方法包括:将所述可控放氢材料放入到0.6mol/lnic12水溶液中进行水解,水解温度为50℃。
实施例20:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为5份,丙二酸为1份,硬质酸镁为1份。本实施例的可控放氢材料的制备方法为:在高压氢气环境中,将氢化镁和丙二酸按照配比进行球磨;将球磨后得到的混合物与硬脂酸镁混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。进一步地,利用本实施例的可控放氢材料来进行水解制氢的方法包括:将所述可控放氢材料放入到0.5mol/lmncl2水溶液中进行水解,水解温度为5℃。
实施例21:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为50份,乙醇酸为20份,麦芽糊精为50份,微晶纤维素为20份。本实施例的可控放氢材料的制备方法为:在常压氩气环境中,将氢化镁和乙醇酸按照配比进行球磨,球磨的球料比为60:1,球磨时间为0.5h;将球磨后得到的混合物与麦芽糊精和微晶纤维素混合均匀,以得到粉末状或者颗粒状的可控放氢材料;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。进一步地,利用本实施例的可控放氢材料来进行水解制氢的方法包括:将所述可控放氢材料放入到0.3mol/lalc13水溶液中进行水解,水解温度为100℃。
实施例22:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为10份,钴为5份,硼为1份。本实施例的可控放氢材料的制备方法为:在高压氢气环境中,将氢化镁、钴和硼按照配比进行球磨,以得到粉末状或者颗粒状的可控放氢材料,球磨的球料比为40:1,球磨时间为6h;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。进一步地,利用本实施例的可控放氢材料来进行水解制氢的方法包括:将所述可控放氢材料放入到0.2mol/lnacl水溶液中进行水解,水解温度为25℃。
实施例23:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为1份,麦饭石为10份,淀粉为9份。本实施例的可控放氢材料的制备方法为:在高压氢气环境中,将氢化镁、麦饭石按照配比进行球磨;将球磨后得到的混合物与淀粉混合均匀,以得到粉末状或者颗粒状的可控放氢材料,球磨的球料比为30:1,球磨时间为20h;并可以将粉末状或者颗粒状的可控放氢材料压制成片剂。进一步地,利用本实施例的可控放氢材料来进行水解制氢的方法包括:将所述可控放氢材料放入到0.2mol/lnacl水溶液中进行水解,水解温度为25℃。
实施例24:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为1份,苹果酸为20份,柠檬酸为29份,乳糖为30份,淀粉为20份。本实施例的可控放氢材料的制备方法为:将镁合金电弧加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁与柠檬酸、苹果酸、乳糖和淀粉按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料;其中搅拌转速为5转/min,搅拌时间1h,氢化的温度为350℃,氢压为3.0mpa,氢化的时间为4h。
实施例25:本实施例中的可控放氢材料的成分和质量配比分别为:氢化镁为1份,苹果酸为19份,麦饭石为10份,硅为20份。本实施例的可控放氢材料的制备方法为:将镁单质电弧加热蒸发;对蒸发后得到的镁蒸气进行降温使其凝结沉降;对凝结后的产物进行氢化,以得到具有核壳结构的所述氢化镁;以及将具有核壳结构的氢化镁与苹果酸、麦饭石和硅按照配比进行搅拌混合,以得到粉末状或者颗粒状的所述可控放氢材料;其中搅拌转速为150转/min,搅拌时间20min,氢化的温度为200℃,氢压为5mpa,氢化的时间为1h。
通过以上结合多个实施例对根据本发明的可控放氢材料的详细描述,本领域技术人员应该理解的是,根据本发明的可控放氢材料以氢化镁为基础,可以通过添加水解促进剂和水解抑制剂中的至少一种,以促进或抑制可控放氢材料的水解反应,从而实现可控放氢的目的。根据本发明的可控放氢材料可以根据不同的应用环境进行调节,以适应不同的产氢需求,例如添加钴的可控放氢材料可以在不同的水解条件下,产生不同的水解产氢效果。根据本发明的可控放氢材料还可以根据需要添加成型剂、稳定剂等,以改善可控放氢材料的成型和放氢平稳性等性能。本发明的可控放氢材料可以选用微米级的氢化镁作为原料,不仅不会影响可控放氢材料的放氢性能,还能够有效降低产品的生产成本,使其具有广阔的应用前景。
进一步地,本发明还提供了多种用于制备可控放氢材料的制备方法,例如包括物理混合方法和化学制备方法,本领域技术人员可以根据需要进行选择或调整。例如,在一些应用场景中,本领域技术人员可以将两种制备方法结合使用,以制备出具有核壳结构颗粒的并且能够成型的可控放氢材料,以便在保证可控放氢材料性能的同时方便用户使用。本发明还提供了利用可控放氢材料来水解制氢的方法,可以通过将可控放氢材料放入到氯化盐水溶液中进行水解,并且能够有利于实现平稳持续的放氢效果。氯化盐溶液能够有效破坏可控放氢材料水解产生的致密的氢氧化镁层,从而能够维持可控放氢材料的持续放氢效果。
另外,与现有技术相比,根据本发明的可控放氢材料的原料来源广泛、容易获得、价格相对较低,且具有水解产量高、反应条件温和、水解产物对环境友好、水解产物易回收等优点。通过对本发明的可控放氢材料的成分、结构等的控制,以及还可以对水解环境条件等进行控制,从而能够实现可控放氢的效果,使其具有广泛的应用前景和应用价值,下面将示例性的列举一些应用场景。
(1)能源供氢:本发明的可控放氢材料的水解反应可以在室温下进行,其放氢量可以是高温热分解反应的两倍。本发明的可控放氢材料的水解理论放氢量为15.2wt%,是纯镁水解的理论产氢量(8.2wt%)的两倍。此外,本申请的可控放氢材料还具有自身无毒、水解产物无毒、不会给环境造成污染等优点,是一种非常有潜力的产氢材料,可以作为氢源用于氢能无人机、氢燃料电池、氢能源汽车等。
(2)医学保健领域:经过十几年的研究发现,氢气具有选择性清除自由基、抗炎症和抗细胞凋亡的作用,氢分子对人类70多种常见疾病均有显著的防治作用,包括心脑血管疾病、消化道疾病、呼吸道疾病、老年痴呆等神经退行性疾病、皮肤修复以及肿瘤等。
目前医学保健领域主流制氢技术为电解水技术。电解水技术由电解槽组成,结构复杂,需要外用电源。另外,普通电解法技术并不适用于国内水质,存在余氯与臭氧的问题,若采用纯净水电解,则由于纯净水导电性不足导致制氢能力大大减弱。spe质子膜电解法一定程度上可改善上述问题,但spe质子膜价格昂贵,使得产品定位为高端消费,并不能惠及普通民众。此外,电解法要求水温控制在40度以下,否则会破坏spe质子膜,制备的富氢水不符合国民喜欢热饮的习惯。本发明的可控放氢材料无需外用电源,水解制氢所需器件结构简单,具有小型化和轻量化的特点,且采用本发明的可控放氢材料制备氢气的成本低,制备的氢气纯度高。因此,采用本发明的可控放氢材料制备出的富氢水可以适用于多种富氢饮品,且饮用温度不受限制。
此外,本发明的可控放氢材料中包括氢化镁,因此可以实现镁离子和氢气的共补。镁是人体必需的常量元素,镁离子是人体内一种重要的离子。镁离子与生物活性密切相关,是生物体内多种酶系统的重要辅助因子,在人体新陈代谢中发挥着重要的生理功能。在医学上,镁离子有着举足轻重的作用:在治疗肺心病心衰、心率失常、头痛、脑梗塞等方面有着显著的疗效,此外镁离子对哮喘、妊高症、颅脑损伤、重症胰腺炎也有很明显的效果,同时镁离子还具有高渗、消肿、止痛等药理作用。镁离子湿敷还可以治疗外伤水肿、肌肉内注射引起的硬结、静脉注射引起的静脉炎等。因此本发明的可控放氢材料在生物医学领域具有广阔的发展前景,值得临床医学和健康保健领域的重视和研究。
(3)农业领域:氢气还具有非常可观的农业效益。近些年,通过对固氮放氢作用的研究和根际微生物的分析,人们提出了“氢肥理论”,即不含吸氢酶的根瘤菌在固氮过程中释放的氢气能够促进根际氢氧化细菌的生长并进一步促进植物生长。研究发现氢气能够提高植物抗逆性、调节植物激素的作用、调节植物生长,因此认为氢气是潜在的农药化肥的替代品。由于水中氢的溶解度很低,其饱和溶解度为1.6ppm,因此如果快速释放氢气,氢气会以气体方式从水或者土壤中逃逸,达不到氢肥的作用。本发明的可控放氢材料可以实现缓释放氢的效果,使得土壤中较长时间保持高浓度氢含量的效果,因此可以适用于农药化肥等领域。
- 还没有人留言评论。精彩留言会获得点赞!