一种镍掺杂钙铁石型氧载体及其制备方法和应用
1.本发明属于化学链燃烧氧载体技术领域,具体涉及一种镍掺杂钙铁石型氧载体及其制备方法和应用。
背景技术:
2.氢是一种能量密度高的理想清洁能源,发展氢能经济能够减少温室气体和细颗粒物的排放。全球各国家地区纷纷将氢能源视为未来新能源的战略发展方向,积极构建氢能低碳社会。我国是世界最大的制氢国,工业氢气产量领跑全球,煤制氢是我国主要的制氢技术之一。但煤制氢技术存在设备结构复杂、运转周期相对低、脱硫投资高、配套装置多、碳排放严重、制氢成本过高等缺点。因此,开发新型的制氢技术对我国发展氢能经济具有重大意义。
3.近年来,基于化学链燃烧技术原理,研究人员开发了一系列制氢技术,如化学链重整、化学链制氢技术。化学链重整技术是利用氧载体(mexoy)中的晶格氧将燃料部分氧化,通过控制氧载体与燃料的比例来调控h2和co的比例。化学链重整目标产物是合成气,但仍需要进一步转换、分离才能获得高浓度氢气。而在化学链制氢技术中,晶格氧与燃料完全燃烧产生co2和h2o,还原后氧载体在水蒸汽反应器中与水反应制取h2,最终通过冷凝即可制备高纯氢,同时还能捕捕获co2。
4.将化学链重整以及化学链制氢技术相结合,可在一个流程中实现了高浓度氢气与合成气的共制备,也即是化学链共制氢与合成气工艺。该工艺综合了化学链重整以及化学链制氢技术的诸多优点,极大的提高了能源利用效率,并能得到较为纯净的合成气与高浓度氢气(纯度达98%以上),极具发展潜力。
5.选择合适的氧载体对于实现上述化学链共制氢与合成气极其关键。研究表明钙铁石(ca2fe2o5)氧载体可在不需要空气反应器的条件下实现氢与合成气的共制备,但是,钙钛矿氧载体该工艺中面临诸如fe3c形成、碳沉积、释氧能力弱、易烧结等问题,需要对其进行优化改进,而镍掺杂钙铁石型氧载体成为重要的改进路线。
6.cn101802495a公开了使用固体氧载体来燃烧碳质燃料的方法和设备,具体公开了将颗粒状氧气选择性吸着剂引入到该燃烧设备的吸附反应器中,来在该吸附反应器中形成第一颗粒床,进而通过氧气选择性吸着剂燃烧燃料,该技术方案的氧气选择性吸着剂包含钙铁石氧化物,并且用促进所述材料的氧气吸附性能的物质进行改性,促进剂物质选自cu、ag、fe、ni、rh、pt或者这些的混合物。虽然该技术方案公开了一种镍掺杂钙铁石型氧载体,但并没有给出其制备方法,也没有给出其在化学链燃烧领域的应用。
7.综上所述,现有技术仍缺乏能够使用于化学链燃烧的镍掺杂钙铁石型氧载体的制备方法。
技术实现要素:
8.针对现有技术的以上缺陷,本发明了提供了一种镍掺杂钙铁石型氧载体的制备方
法,通过将ni掺杂进入到ca2fe2o5中,借助氧化镍的c
‑
h解耦能力,以及ca2fe2o5在制氢方面的独特优势,将化学链重整制合成气技术与化学链制氢技术耦合,实现在一个流程内同时获取高品质的合成气以及纯净的氢气,由此解决ca2fe2o5氧载体活性低、碳转化效率低、稳定性差等问题。本发明详细技术方案如下所述。
9.为实现上述目的,按照本发明的一个方面,提供了一种镍掺杂钙铁石型氧载体的制备方法,将钙盐、镍盐、铁盐和有机酸加水溶解后混合均匀获得前驱体,将前驱体干燥后,在900
‑
1200℃煅烧10h,即可获得镍掺杂钙铁石型氧载体。
10.作为优选,所述镍盐的物质的量mol
ni
、所述铁盐物质的量mol
fe
与所述钙盐的物质的量mol
ca
,满足下列关系式:(mol
ni
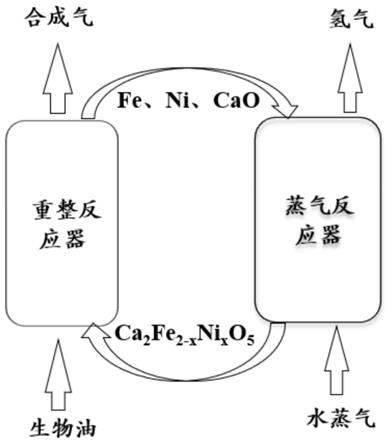
+mol
fe
):mol
ca
=1:1,mol
ni
:mol
fe
=(1
‑
2):(1
‑
0.5)。
11.作为优选,所述有机酸的物质的量mol
acid
,满足下列关系式:(mol
ni
+mol
fe
+mol
ca
):mol
acid
=1:(2
‑
4)。
12.作为优选,所述钙盐为硝酸钙、氯化钙和磷酸二氢钙中的一种,所述镍盐为硝酸镍、氯化镍和磷酸二氢镍中的一种,所述铁盐为硝酸铁、氯化铁和磷酸二氢铁中的一种,所述有机酸为柠檬酸、酒石酸和苹果酸中的一种。
13.作为优选,所述混合均匀是将钙盐、镍盐、铁盐和有机酸的混合物在油浴加热环境下进行搅拌,油浴温度为80
‑
100℃,搅拌时间为6
‑
10h,所述干燥是在100
‑
120℃,干燥12
‑
24h。
14.按照本发明的另一个方面,提供了一种镍掺杂钙铁石型氧载体,根据前面所述的制备方法制备而成。
15.按照本发明的另一个方面,提供了一种镍掺杂钙铁石型氧载体的应用,所述应用为基于化学链技术耦合制高纯氢与合成气的应用,所述合成气为一氧化碳和氢气的混合气体,所述高纯氢指的是纯度为96%以上的氢气。
16.作为优选,包括以下步骤:
17.(1)将镍掺杂钙铁石型氧载体与生物油混合,获得还原态氧载体和合成气;
18.(2)还原态氧载体与水蒸气反应,获得氢气,还原态氧载体再生为镍掺杂钙铁石型氧载体。
19.作为优选,所述步骤(1)在重整反应器中进行,所述步骤(2)在蒸汽反应器中进行,所述重整反应器和所述蒸汽反应器均采用流化床反应器。
20.作为优选,所述步骤(1)中还加入了水蒸气,所述水蒸气与生物油中炭的摩尔比(s/c)为0.1
‑
0.5,所述步骤(1)和步骤(2)的反应温度为800
‑
1000℃。
21.本发明的有益效果有:
22.(1)本发明制备出的镍掺杂钙铁石型氧载体,ni掺杂引起的晶格畸变,使得钙铁石掺杂后产生了相变,有助于促进晶格氧的释放,增加晶格氧的释放速率,改善钙铁石氧化还原活性较低的特点,提高碳转化率以及水蒸气氧化阶段的产氢能力。
23.(2)本发明镍掺杂钙铁石型氧载体具有活性高,目标产物选择性强,制氢能力突出等优势,实现了生物油化学链氢与合成气的共制备;通过工艺参数的优化,可高效率将生物油重整为高品质合成气,碳转化率可达97.20%;在蒸汽氧化阶段氢气的纯度也可高达98%,完全满足工业化应用要求。
24.(3)本发明的镍掺杂钙铁石型氧载体共制备氢与合成气方法与现有的化学链技术
相比,克服了生物油在化学链技术中应用缺陷,能够促进生物油更加高值化利用,得到更丰富的能源产品;经济性更好,实用性更强,具有更广阔的应用前景。
附图说明
25.图1是应用本发明镍掺杂钙铁石型氧载体共制备氢与合成气示意图。
26.图2是对比实施例1制备的氧载体的xrd测试图。
27.图3是实施例1制备的氧载体的xrd测试图。
28.图4是实施例2制备的氧载体的xrd测试图。
29.图5是实施例3制备的氧载体的xrd测试图。
30.图6是实施例4制备的氧载体的xrd测试图。
具体实施方式
31.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。此外,下面所描述的本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
32.实施例
33.实施例1
34.一种镍掺杂钙铁石型氧载体,通过以下方法制备而成:
35.称取0.20mol的硝酸钙ca(no3)2,0.175mol的硝酸铁fe(no3)3,0.025mol硝酸镍ni(no3)2,1.20mol的柠檬酸置于烧杯中,向烧杯中加入1000ml去离子水,将烧杯转移至95℃油浴锅中加热搅拌8h获得前驱体。将前驱体在105℃的恒温干燥箱内,干燥12h,然后放入马弗炉内,在1000℃下煅烧10h,即可获得镍掺杂钙铁石型氧载体,记为ca2fe
1.75
ni
0.25
o5氧载体。
36.实施例2
37.一种镍掺杂钙铁石型氧载体,通过以下方法制备而成:
38.称取0.20mol的硝酸钙ca(no3)2,0.150mol的硝酸铁fe(no3)3,0.050mol硝酸镍ni(no3)2,1.20mol的柠檬酸置于烧杯中,向烧杯中加入1000ml去离子水,将烧杯转移至95℃油浴锅中加热搅拌8h获得前驱体。将前驱体在105℃的恒温干燥箱内,干燥12h,然后放入马弗炉内,在1000℃下煅烧10h,即可获得镍掺杂钙铁石型氧载体,记为ca2fe
1.50
ni
0.50
o5氧载体。
39.实施例3
40.一种镍掺杂钙铁石型氧载体,通过以下方法制备而成:
41.称取0.2mol的硝酸钙ca(no3)2,0.125mol的硝酸铁fe(no3)3,0.075mol硝酸镍ni(no3)2,1.20mol的柠檬酸置于烧杯中,向烧杯中加入1000ml去离子水,将烧杯转移至95℃油浴锅中加热搅拌8h获得前驱体。将前驱体在105℃的恒温干燥箱内,干燥12h,然后放入马弗炉内,在1000℃下煅烧10h,即可获得镍掺杂钙铁石型氧载体,记为ca2fe
1.25
ni
0.75
o5氧载体。
42.实施例4
43.一种镍掺杂钙铁石型氧载体,通过以下方法制备而成:
44.称取0.20mol的硝酸钙ca(no3)2,0.100mol的硝酸铁fe(no3)3,0.100mol硝酸镍ni(no3)2,1.20mol的柠檬酸置于烧杯中,向烧杯中加入1000ml去离子水,将烧杯转移至95℃油
浴锅中加热搅拌8h获得前驱体。将前驱体在105℃的恒温干燥箱内,干燥12h,然后放入马弗炉内,在1000℃下煅烧10h,即可获得镍掺杂钙铁石型氧载体,记为ca2fe
1.00
ni
1.00
o5氧载体。
45.对比实施例1
46.称取0.20mol的硝酸钙ca(no3)2,0.20mol的硝酸铁fe(no3)3,1.20mol的柠檬酸置于烧杯中,向烧杯中加入1000ml去离子水,将烧杯转移至95℃油浴锅中加热搅拌8h获得前驱体。将前驱体在105℃的恒温干燥箱内,干燥12h,将所得凝胶放入马弗炉内,1000℃下煅烧10h,即可获得钙铁石型氧载体,记为ca2fe2o5氧载体。
47.测试实施例
48.xrd测试。将实施例1
‑
4和对比实施例1制备的氧载体进行xrd测试,测试结果如图2
‑
6所示。其中,图2是对比实施例1制备的氧载体的xrd测试图。图3是实施例1制备的氧载体的xrd测试图。图4是实施例2制备的氧载体的xrd测试图。图5是实施例3制备的氧载体的xrd测试图。图6是实施例4制备的氧载体的xrd测试图。
49.从图2可以看出,未掺杂的氧载体主要由ca2fe2o5构成,采用ni掺杂后,由图3
‑
6可以看出,ni掺杂的氧载体主要由nio、ni
0.6
fe
2.4
o4、ca2fe2o5构成。
50.应用实施例
51.应用本发明镍掺杂钙铁石型氧载体共制备氢与合成气示意图,如图1所示。
52.1.第一组应用实施例。将氧载体在固定床管式反应器中,先后通入生物油模拟物甲苯制备合成气,然后通过水蒸汽制备氢气,具体如下所述。
53.应用实施例1.1
54.(1)将ca2fe
1.75
ni
0.25
o5氧载体放置于流化床反应器,在空气氛围下升温至900℃,然后再用氮气吹扫反应器,排净管内空气。
55.(2)注入甲苯制取合成气,利用在线气体分析仪测定产气中组分含量,待在线气体分析仪中各气体组分浓度降至0.5%以下视为反应结束。合成气纯度为产气中co与h2浓度之和。
56.(3)通入水蒸气制取高浓度氢气,利用在线气体分析仪测定氢气浓度,待在线气体分析仪中各气体组分浓度降至0.5%以下视为反应结束。氢气纯度为产气中氢气浓度。
57.应用实施例1.2
58.本应用实施例与应用实施例1.1不同之处在于,氧载体不同,氧载体为ca2fe
1.50
ni
0.50
o5。
59.应用实施例1.3
60.本应用实施例与应用实施例1.1不同之处在于,氧载体不同,氧载体为ca2fe
1.25
ni
0.75
o5。
61.应用实施例1.4
62.本应用实施例与应用实施例1.1不同之处在于,氧载体不同,氧载体为ca2fe
1.00
ni
1.00
o5。
63.应用实施例1.5
64.本应用实施例与应用实施例1.1不同之处在于,氧载体不同,氧载体为ca2fe2o5。
65.2.第二组应用实施例
66.本应用实施例与第一组实施例不同之处在于,反应温度不同,具体为以
ca2fe
1.50
ni
0.50
o5为氧载体,在不同的反应温度下反应,具体如下所述。
67.应用实施例2.1反应温度为800℃。
68.应用实施例2.2反应温度为850℃。
69.应用实施例2.3反应温度为950℃。
70.应用实施例2.4反应温度为1000℃。
71.3.第三组应用实施例。本应用实施例与第一组应用实施例的区别在于,以ca2fe
1.50
ni
0.50
o5为氧载体,在步骤(2)中通入了水蒸气,具体如下所述。
72.应用实施例3.1水蒸气与甲苯中碳的摩尔比(s/c)为0.14。
73.应用实施例3.2水蒸气与甲苯中碳的摩尔比(s/c)为0.28。
74.应用实施例3.3水蒸气与甲苯中碳的摩尔比(s/c)为0.42。
75.应用实施例3.4水蒸气与甲苯中碳的摩尔比(s/c)为0.56。
76.测试反应结束后的氢气和合成气产率,汇总后如表1、表2、表3所示。其中,表1是第一组应用实施例测试结果表,表2是第二组应用实施例测试结果表,表3是第三组应用实施例测试结果表。
77.表1第一组应用实施例测试结果表
[0078][0079]
表2第二组应用实施例测试结果表
[0080][0081]
表3第二组应用实施例测试结果表
[0082]
[0083]
结果与讨论
[0084]
从表1可以看出,ni的掺杂量越多,燃料的碳转化率越低,重整阶段气体产率越低。ca2fe2o5掺杂ni后合成气纯度降低,这是由于掺杂后ni后提高了ca2fe2o5中晶格氧的活性,导致产气中更多的还原性气体与晶格氧反应,从而降低了合成气纯度。但是,掺杂较少量的ni时,可以显著改善氢气产率,总体上来说,掺杂ni对氢气纯度的影响不大,综合分析认为,ca2fe
1.50
ni
0.50
o5的综合性能较好,但是在应用实施例中,存在碳转化率低、合成气纯度低、氢气纯度低等缺点。
[0085]
从表2可以看出,升高温度有利于提高燃料的转化率、气体产率,氢气纯度。这是由于升高温度有利于甲苯的重整,同时也增强了氧载体的反应活性,还原性气体更容易与晶格氧发生完全氧化反应,产生了较多的co2,导致合成气纯度较低。随着温度的升高,氢气产率降低、氢气纯度升高,这主要是由于重整阶段碳转化率升高,因此在水蒸气反应器中积碳含量降低,因此氢气产率降低但纯度升高。综合分析认为,温度为900℃时制备比较有利于氢气的制备。
[0086]
从表3可以看出,适当增加水蒸气量可以显著的改善燃料碳转化率、提高气体产率、提高合成气纯度,这是由于水蒸气的加热促进了碳与水蒸气的反应及有机物的重整反应,产生更多的co和h2。同时,在重整反应器中加入水蒸气对于氢气产率的影响较大,氢气产率随着水蒸气的加入而递减。在水碳比为0.28时效果最佳,过多的水蒸气会抑制氧载体在重整反应器中的还原,从而导致氢气产率的降低,水蒸气量较少则会导致重整反应器中碳转化率较低,未反应的碳在水蒸气反应器中与水反应虽然提高了氢气产率,但是氢气纯度较低。
[0087]
总的来说,在反应温度为900℃,水碳比为0.28时,ca2fe
1.50
ni
0.50
o5氧载体在化学链耦合制氢与合成气中的效果较好,氢气纯度达98%以上,满足工业应用要求,同时还能制备合成气。
[0088]
本领域的技术人员容易理解,以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1