通过脉冲电化学嵌入方法进行锂提取
通过脉冲电化学嵌入方法进行锂提取
1.相关申请的交叉引用
2.本技术要求2020年3月16日提交的第62/990,144号美国临时申请的优先权的权益,其全部内容通过引用并入本文。
3.关于在联邦资助的研究和开发下作出的发明权利的声明
4.本发明是在政府支持下根据由能源部授予的第de-ac02-76sf00515号合同进行的。政府享有本发明的一些权利。
发明领域
5.本公开内容涉及从卤水中提取锂,尤其涉及获得用于电池工业的锂(li)。
背景技术:
6.全球气候变化和能源危机引起了用锂离子电池供电的电动车辆代替化石燃料类车辆的巨大需求。因此,在未来几十年里,对锂元素的需求将显著增加。海水含有超过2000亿吨的锂,这是基于陆地和卤水的资源的组合的5000倍。开发直接从海水中提取锂以确保锂供应的有效方法是非常有吸引力的。然而,海水中化学上相似的钠(na)比锂的浓度高4个数量级,对锂提取选择性提出了相当大的挑战。因此,需要改进的从卤水中获得锂的方法。
技术实现要素:
7.在一个方面,本发明涉及使用嵌入化学从海水中提取锂的电化学方法和系统。
8.在第一方面,所述方法和系统利用配置为提高锂选择性和降低嵌入超电势的电极对。在一些实施方案中,系统利用fepo4电极。虽然本文描述了fepo4的使用,但应理解,可使用可以被配置用于锂选择性的任何合适的材料。电极可以涂覆有亲水材料,例如tio2,尽管可以使用任何合适的亲水材料。在一些实施方案中,所述方法和系统使用tio2涂覆的fepo4电极。当li/na摩尔比高于10-3
时,锂与钠之间的热力学嵌入势以及扩散势垒的差异可以提供对与锂相互作用接近100%的选择性。针对如在真实海水的情况下更低的li/na比,开发了脉冲电化学嵌入方法,包括脉冲-休止和脉冲-休止-反向脉冲-休止电化学方法,以降低嵌入超电势,并且被证明成功地提高了锂选择性。
9.在另一方面,所述方法和系统利用脉冲嵌入来促进锂提取期间的电极晶体结构的稳定性。在一些实施方案中,脉冲嵌入方法包括脉冲周期和休止周期。在一些实施方案中,脉冲方法包括脉冲周期、休止周期、反向脉冲周期和休止周期,这进一步促进了锂和钠的共嵌入期间电极晶体结构的稳定性并且延长了电极的使用寿命。脉冲循环可以重复多次循环(例如数百至数千次)以促进锂的快速、有效的提取。本文详述的实验证明了从真实海水中成功且稳定地提取锂的10次循环,锂/钠回收率为1:1,这相当于~1.8
×
104的选择性。同样,在具有为1.6
×
10-3
的较高的初始li/na比的湖水的情况下,以大于50:1的li对na回收率实现锂提取。因此,本文所述的方法和系统可以实现以快速且有效的方式从具有高溶解的钠盐(na)的水溶液(例如海水、湖水)中提取锂。
10.在一个方面,本发明涉及从具有锂和溶解的钠的水溶液中提取锂的方法。在一些实施方案中,所述方法涉及:提供与水溶液接触的电极对,所述电极对被配置用于锂选择性;通过电化学嵌入将锂从水溶液中提取到所述电极对中的第一电极中;以及将提取到所述第一电极中的锂回收到淡水溶液中。在一些实施方案中,电极对包括fepo4。在一些实施方案中,第一电极具有外部亲水层,例如tio2涂层。在一些实施方案中,所述方法允许50:1的锂对钠的回收率。
11.在另一方面,所述方法包括各种电化学嵌入方法,其可以在施加的恒定电流下进行或者可以循环脉冲。脉冲电化学嵌入可以包括脉冲-休止周期,或者可以包括脉冲-休止-反向脉冲-休止周期。在一些实施方案中,脉冲可以为1秒(s)至30s(例如,10s),休止可以为1s至30s(例如,10s),并且反向脉冲可以为1s至30s(例如,2s)。在一些实施方案中,任何脉冲、反向脉冲和/或休止周期可以是0.5s至5分钟、0.5s至2分钟、0.5s至1分钟的任何持续时间。在一些实施方案中,反向脉冲的持续时间小于脉冲。应理解,脉冲方法可以包括上述时序和持续时间的变化。
12.在另一方面,在电化学嵌入中施加的电压在用于锂提取和回收的水溶液的水稳定窗内。在一些实施方案中,水溶液是钠浓度为约10mg/l或更高的海水溶液。在一些实施方案中,水溶液是初始li/na比为1.6
×
10-3
的湖水。
13.在另一方面,本发明涉及制造用于从含有锂和钠的水溶液中提取锂的电极的方法。所述方法可以包括以下步骤:通过以下步骤制造在锂提取中用作工作电极的第一电极:通过将包含lifepo4的糊料涂覆到导电基底上形成lifepo4电极;将lifepo4电极脱锂,获得fepo4电极;以及在fepo4电极上形成亲水材料的外层以降低用于锂通过嵌入掺入电极中的超电势。在一些实施方案中,通过原子层沉积来沉积亲水涂层。在一些实施方案中,亲水材料是tio2。
14.在另一方面,本发明涉及制造在通过电化学嵌入进行锂提取中用作反电极的第二电极的方法。所述方法可以包括:制造用作第二电极的nafepo4电极。制造第二电极可以包括以下步骤:通过将包含lifepo4的糊料涂覆到导电基底上形成lifepo4电极;将lifepo4电极脱锂,获得fepo4电极;以及在包含na的溶液中对fepo4电极进行嵌入,形成nafepo4电极,以提高在第一电极与第二电极之间电化学嵌入期间的锂选择性。
15.在另一方面,本发明涉及用于从含有锂和钠的水溶液中提取锂的系统。所述系统可以包括与水溶液接触的电极对,所述电极对被配置用于锂选择性,使得用所述电极对进行的电化学嵌入从水溶液中提取锂。电极对包括第一电极和第二电极。在一些实施方案中,第一电极是fepo4电极,并且第二电极是nafepo4电极。在一些实施方案中,第一电极还包括亲水材料(例如,tio2)的外层。所述系统还可以包括容纳水溶液的导管或容器,使得第一电极和第二电极设置在容器或导管中与水溶液接触,以允许通过电化学嵌入从溶液中提取锂。导管或容器可以与导管或管道的网络流体联接,以便于更换水溶液用于另外的循环,并用淡水溶液更换水溶液用于随后的锂回收。
16.在另一方面,所述系统包括控制单元,所述控制单元可操作地联接第一电极和第二电极,以便用作为工作电极的第一电极和作为反电极的第二电极进行电化学嵌入。控制单元被配置为:在将电极对设置在水溶液中的同时通过电化学嵌入将锂从水溶液中提取到电极对中的第一电极中;以及通过使用另一个反电极将提取到第一电极中的锂回收到淡水
溶液中。在一些实施方案中,控制单元被配置为在电化学嵌入期间施加恒定电流。在其它实施方案中,控制单元被配置成使得电化学嵌入循环脉冲。脉冲嵌入可以包括脉冲-休止周期,或者可以包括脉冲-休止-反向脉冲-休止周期。脉冲、休止和反向脉冲周期的持续时间可以如本文所述或根据任何期望的持续时间来定义。
17.附图简述
18.图1a至图1f示出了根据一些实施方案使用电化学嵌入从海水中提取锂的示例性过程和相关方面。
19.图2a至图2d示出了根据一些实施方案的嵌入电势曲线和选择性结果。
20.图3示出了根据一些实施方案的选择性和法拉第效率结果。
21.图4示出了根据一些实施方案的单个颗粒映射。
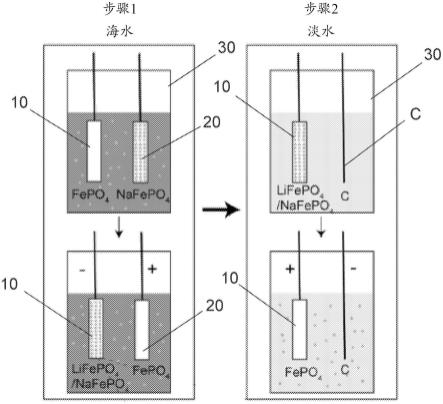
22.图5示出了根据一些实施方案的锂选择性结果。
23.图6示出了根据一些实施方案的电势曲线。
24.图7示出了根据一些实施方案的lifepo4电极的电化学阻抗谱。
25.图8示出了根据一些实施方案的3nm tio2涂覆的fepo4电极的电化学阻抗谱。
26.图9示出了根据一些实施方案的3nm tio2涂覆的fepo4电极的sem图像。
27.图10示出了根据一些实施方案的3nm tio2涂覆的fepo4电极的xrd图像。
28.图11描述了根据一些实施方案的提取锂的示例性方法。
29.图12示意性地描述了根据一些实施方案的形成工作电极的示例性方法。
30.图13示意性地描述了根据一些实施方案的形成反电极的示例性方法。
具体实施方式
31.全球气候变化和能源危机引起了用锂离子电池供电的电动车辆代替化石燃料类车辆的巨大需求。因此,在未来几十年里,对锂元素li的需求将显著增加。海水含有超过2000亿吨的锂,这是基于陆地和卤水的资源的组合的5000倍。因此,开发直接从海水中提取锂以确保锂供应的有效方法将是非常有吸引力的。然而,海水中的化学上相似的钠盐(na)比锂的浓度高4个数量级,这对锂提取选择性提出了巨大的挑战。为了克服这种挑战,已经开发了使用嵌入化学从海水中提取锂的电化学方法,其使用具有亲水涂层的fepo4电极,具体地,tio2涂覆的fepo4电极。当li/na摩尔比高于10-3
时,锂与钠之间的热力学嵌入电势以及扩散势垒的差异可以提供对与锂相互作用接近100%的选择性。对于较低的li/na比,例如在真实海水的情况下,开发了脉冲电化学方法来降低嵌入超电势。具体而言,开发并测试了脉冲-休止和脉冲-休止-反向脉冲-休止,并被证明成功地提高了锂选择性。此外,脉冲-休止-反向脉冲-休止方法还可以提高锂和钠共嵌入期间的电极晶体结构的稳定性,并且延长电极的使用寿命。最终,实验证实了从真实海水中成功且稳定的提取锂的10次循环,锂/钠回收率为1:1,这相当于~1.8
×
104的选择性。此外,在具有为1.6
×
10-3
的较高的初始li/na比的湖水的情况下,实现了大于50:1的li对na回收率的锂提取。
32.能量存储技术和电子设备的快速发展推动全球锂需求从2015年的~180,000吨碳酸锂当量,预计到2030年高达160万吨,其中140万吨的需求将用于电动车辆(ev)和插电式混合电动车辆(phev)的锂离子电池。到2030年,28%的轻型车辆可以是ev和phev,其中~80%的ev,并且到2040年,销售的大多数新轻型车辆将是ev。这种远离内燃机车辆的转变部
分地由关于由于全球温室气体排放引起的气候变化的关注以及对于低于2.5μm(pm)的颗粒物和来自车辆的no
x
排放的健康关注的上升来驱动。因此,有许多动机来开发成本有效的技术以开发从更广泛的资源集合中经济地提取锂的方法。
33.陆地资源估计有4360万吨的锂,包括矿石中的1670万吨和卤水中的2690万吨。从通常具有100ppm至1,000ppm的锂浓度的卤水中提取锂的当前方法是基于蒸发和化学沉淀,这由于用于浓缩锂离子的预处理过程而是高度耗时的。通过蒸发提取可能需要数月至数年,并且由于其需要大的蒸发池而具有巨大的环境影响。相比之下,海水中存在的锂是其5000倍,估计超过2000亿吨,但锂浓度仅为0.180ppm。最近,还考虑了由油气提取中采出的水获得的锂。在美国,在采油过程中每年产生25亿加仑的水。假定采出水中的锂浓度为100ppm,则每年采出水中有35万吨的锂可以被回收。
34.除了锂矿石的精炼以及卤水的蒸发和化学沉淀之外,还进行了开发诸如mno2或h2tio3的吸附剂材料以吸附锂的研究工作。此外,已经进行了开发用于锂提取的透析膜的工作。然而,这些方法的性能仍然需要大大改善。因此,直接从海水或从采出水或卤水湖资源中提取锂而不需要耗时的蒸发过程的更有效的锂提取技术将大大增加锂生产能力,以满足未来几十年对锂的预期需求。
35.根据本文所述的方法,使用涂覆有亲水材料(例如,tio2涂覆)的lifepo4电极结合脉冲电化学方法允许通过嵌入化学以高选择性提取锂。由于锂可以在fepo4中提供更高的结构稳定性并且具有更快的离子扩散率,因此嵌入化学自然地提供锂对钠的高选择性。tio2涂层用于增加工作电极与海水之间的界面接触。脉冲电化学方法降低了驱动锂嵌入到fepo4晶体结构中的超电势,因此增加了选择性和结构稳定性。从在加利福尼亚的半月湾获得的真实海水样品开始,实验证明了稳定的提取锂的10次循环,li/na比为1:1。这相当于摩尔选择性高达1.8
×
104。除海水之外,实验还证明了,使用电化学嵌入方法从较高的初始锂/钠摩尔比溶液以及湖水中提取锂,从li/na比为5.4
×
10-5
、5.0
×
10-4
、4.0
×
10-3
的溶液和天然盐湖水分别实现了50.2
±
0.78%、94.3
±
4.0%、~100%和98.1
±
1.0%的li/(li+na)回收率。
36.在图1a至图1f中例示了使用电化学嵌入从海水中提取锂的过程和相关方面。图1a示出了在海水中由h2和o2析出反应标记的水稳定性窗。图1b示出了锂提取步骤。在第一步骤中,在海水中分别使用fepo4电极和nafepo4作为工作电极和反电极用于li嵌入,相对于钠对锂具有高选择性偏好。然后,在步骤2中,在淡水溶液中再生工作电极以回收所提取的锂。图1c示出了使用fepo4电极计算在初始锂/钠摩尔浓度下的锂和钠嵌入电势差。图1d示出了可以用于不同电化学方法的可能的电压曲线a、b和c(a:连续接通,b:脉冲-休止,和c:脉冲-休止-反向脉冲-休止)。图1e示出了在步骤1期间锂嵌入到工作电极的晶体结构中。图1f示出了示例性工作电极10的横截面细节图。
37.如图1b中可以看到,该系统和方法利用设置在导管或容器30中的工作电极10和反电极20,所述导管或容器30包含具有锂和溶解的钠盐(na)的水溶液,如步骤1中(左上)所示。然后对电极通电以允许锂嵌入到工作电极10的晶体结构中,如步骤1中(左下)所示。然后除去水溶液并替换为淡水,如步骤2中(右上)所示,用工作电极10和碳反电极c。然后对电极通电以促进锂从晶体结构回收到淡水溶液中,所述淡水溶液可以容易地进行处理以获得其中浓缩的锂,而没有高浓度的溶解的钠盐。可以理解,导管容器可以是导管/容器网络(未
示出)的一部分,以促进来自外部来源的水溶液的恒定或间歇流动,以及周期性地替换为淡水,以促进从提取后的工作电极回收锂。图11描述了如上所述的提取锂的示例性方法。
38.如图1b中所示,在第一步骤中,使用主体材料作为工作电极,以允许锂嵌入到电极的晶体结构中,如图1e中所示。选择和配置主体材料选择,使得在锂化和脱锂期间,其电势应在水稳定窗内(参见图1a)。在该实例中,主体材料是fepo4。海水具有8.2的ph,其将水稳定窗设定为相对于标准氢电极(she)的-0.48v以避免h2析出,并且设定为相对于she的0.75v以避免o2析出,如图1a中所示。应理解,水稳定窗可以基于将从中提取锂的水溶液的性质而变化,并且可以相应地调节参数(例如,电流/电压)。在这些实验中,使用来自脱锂的lifepo4的fepo4作为工作电极。对于fepo4,用1m li盐溶液锂化和脱锂的电势平台为相对于li金属的~3.4v,其为相对于she的0.36v,并且在海水中是稳定的。
39.此外,在锂提取循环期间还存在对配对的反电极的选择标准。首先,由于以下几个原因需要排除o2析出电极:a)o2析出电极会引起海水环境的显著ph变化。锂离子(~25μm)与氢氧根离子(~1μm)相比在海水中具有更高的浓度,即使提取了10%的锂,也会对海水环境产生显著的酸化作用。b)溶解的o2会扩散到负极并还原成过氧化物类物质。当考虑到180ppb的真实海水锂浓度时,海水中的o2还原反应(相对于she的0.20v)在比锂嵌入略高的电势下发生,使得o2还原反应会降低负极上的锂提取的法拉第效率(如图6中所示)。c)过氧化物类物质会永久损坏fepo4电极。
40.因此,选择nafepo4用作反电极。通过使用nafepo4反电极,在步骤1的锂提取循环期间钠将被释放到海水中。由于从电极释放的钠的量与背景钠水平相比浓度低得多,这有效地最小化了对海水的环境影响。在锂提取步骤期间,将两个电极设置在海水中,并将系统保持在n2气氛中(参见图1b)。fepo4是允许锂离子嵌入到晶体结构中的负极。在第二步骤中,将填充有锂的fepo4电极置于基于淡水的回收溶液中,并且通过反向偏压在再生fepo4电极的同时将锂释放到溶液中。
41.从海水中提取锂的挑战在于钠离子的背景。锂具有与钠类似的化学性质,但在海水中的浓度低得多。fepo4具有相对于she为~0.36v的锂嵌入电势,而其具有相对于she为~0.19v的钠嵌入电势。这种对锂嵌入的热力学偏好可以补偿~0.0012li/na的摩尔浓度差。在卤水或盐湖水(其中锂与钠的浓度比为~0.0018至0.3)中,根据如图1c中所示的计算,嵌入化学将预期为接近100%的选择性。
42.在海水的情况下,锂的浓度为~0.180ppm,而钠的浓度为~10,800ppm。5
×
10-5
的li/na的低浓度比不会补偿对锂嵌入的热力学偏好,因此钠嵌入会与锂竞争以被嵌入到电极中。另一方面,锂和钠嵌入的动力学提供了对锂的另一种偏好。锂扩散与钠扩散之间的活化势垒差为~0.05ev至0.2ev,钠具有较高的活化能势垒。考虑到锂与钠之间的竞争,采取不同的策略促进锂嵌入。
43.首先,为了增加电极和电解质(海水)接触,将亲水涂层引入主体材料(例如,fepo4)的表面。在此,选择无定形tio2作为通过原子层沉积进行沉积的涂层材料。应理解,可以使用任何合适的、相容的亲水材料,并且可以通过各种其它方法(例如,替代的沉积技术、覆膜或膜内包装)将亲水材料结合或施加到电极上。结果表明,锂在无定形tio2中的扩散率与在fepo4中的扩散率处于同一数量级,因此薄的涂层不会增加锂扩散的活化势垒。
44.图1f示出了具有包括晶体结构的主体材料12(例如,fepo4)的工作电极10的详细
图,所述主体材料12设置在导电基底11上并且被亲水层13(例如,tio2涂层)包围。与裸fepo4电极相比,研究了两种厚度(3nm和5nm)的tio2涂层。如电化学阻抗谱(参见图7)所示,tio2涂层的薄层没有显著改变电极电导率。虽然在此测试了3nm和5nm的外层,但应理解,可以使用任何合适的薄层,例如,1nm至100nm的层,典型地1nm至20nm的层,更典型地1nm至10nm的层。0nm、3nm和5nm的tio2涂覆的fepo4的电极电阻为1.53ω、6.08ω和4.65ω。在海水锂化循环期间,从图2a中所示的电势曲线可以看出,3nm和5nm的tio2涂层均降低了锂嵌入的超电势。然后实验测试在淡水溶液中通过脱锂过程从电极回收的li和na。如图2b中所示,对于具有0nm、3nm和5nm的tio2涂层的fepo4电极,锂/(li+na)摩尔比为30.2
±
2.1%、48.0
±
1.9%和44.9
±
7.4%。由于3nm tio2涂层具有最高的选择性,因此将该条件用于所有之后的电化学方法选择测试。涂层测试表明,钠嵌入的活化势垒高于锂嵌入的活化势垒,因此降低超电势有助于促进锂嵌入。
45.用于改善锂提取的选择性的另一个策略是优化电化学锂化方法。不同的电化学嵌入方法将产生不同的超电势来驱动锂提取过程。将恒定电流锂化方法(例如,图1d:a)与脉冲-休止方法(例如,图1d:b)和脉冲-休止-反向脉冲-休止方法(例如,图1d:c)进行比较。对于脉冲-休止方法,测试了10s锂化与10s休止(p
10s
)和1s锂化与1s休止(p
1s
)。电势曲线在图2c中示出。对于相同容量的锂提取,脉冲-休止方法p
10s
和p
1s
均示出比恒定电流方法小~0.05v的超电势。电极阻抗在所有测试中均是类似的(如图8中所示)。因此,在脉冲电化学方法p
10s
和p
1s
中回收的锂/(li+na)摩尔比为49.7
±
0.35%和47.4
±
5.1%,高于在恒定电流方法中回收的锂/(li+na)摩尔比(31.4
±
1.7%)(图2d)。脉冲锂化方法为电极提供了休止周期,用于锂和钠在电极中在所有颗粒之间再分布,并且确保了在所有颗粒中更均匀的li/na含量,这降低了嵌入的超电势。除脉冲-休止方法之外,还对脉冲-休止-反向脉冲-休止方法进行了测试。在该方法中,在一个循环中,存在正向脉冲和反向脉冲两者。正向脉冲及其休止周期均为10s,而相同幅度的反向脉冲及其休止周期分别为2s和10s(p
10sr2s
)。反向脉冲被认为产生更均匀的浓度锋面(front)。这种脉冲-休止-反向脉冲-休止方法的选择性为50.2
±
0.78%,如图2d中所示。它也高于恒定电流方法。脉冲电化学方法的引入成功地促进了锂嵌入而不是na嵌入。在三种脉冲方法中,第一循环选择性与~1:1的li/na的提取比相似,这相当于从海水中li对na的选择性为1.8
×
104。虽然以上描述了特定的脉冲、反向脉冲和休止周期,但应理解,以上描述的优点仍然可以在脉冲方法中以不同的持续时间来实现。例如,在脉冲-休止方法中,脉冲和休止周期可以是相同或不同的持续时间。尽管描述了10s脉冲,但在一些实施方案中,脉冲或休止中的任一个可以具有1s至1分钟的任意持续时间,典型地为5s至30s,或者为5s至20s。在脉冲、休止、反向脉冲、休止方法中,可以理解每个周期可以为1s至1分钟,典型地1s至30s、或者1s至20s的相同或不同的持续时间。在一些实施方案中,反向脉冲的持续时间比正向脉冲更短。
46.图2a至图2d示出:a)具有0nm、3nm和5nm的tio2涂层的fepo4电极在海水中的嵌入电势曲线;b)使用具有不同厚度的tio2涂层的fepo4电极的li选择性结果;c)在海水中使用具有3nm的tio2涂层的fepo4电极用不同的电化学方法(恒定电流、p
10s
、p
1s
和p
10sr2s
)得到的嵌入电势曲线;以及d)使用具有3nm的tio2涂层的fepo4电极用不同的电化学方法得到的li选择性结果。
47.还研究了三种脉冲电化学方法(p
10s
、p
1s
和p
10sr2s
)的循环稳定性。对于每种脉冲电
化学方法,相同的电极循环10次。每次循环包括锂提取和回收过程。测量锂选择性和法拉第效率两者。在循环测试期间,这三种方法显示出稳定性的明显差异,如图3中所示。在脉冲方法p
10s
和p
1s
两者中,选择性和库仑效率均表现出下降的迹象。在p
1s
的情况下下降更快。选择性在第5次循环时开始下降,li/(li+na)摩尔比从50%下降至31.9
±
0.40%。在第7次循环时,li/(li+na)摩尔比仅为13.5
±
0.68%。在p
10s
中,选择性在第6次循环时开始下降,到第10次循环之前,选择性为30%至36%。在第10次循环中,选择性降低至10.8
±
0.97%。然而,对于p
10sr2s
方法的情况,没有电极不稳定的迹象,并且对于10次循环的选择性为~50%。p
10s
和p
1s
方法中电极循环稳定性的下降可能是锂和钠的共嵌入行为所导致的。在共嵌入期间,锂和钠的扩散率不同,这可能由于钠扩散较慢而导致局部阻塞。相比之下,反向脉冲和休止周期将允许锂和钠重新分布并降低电极的局部压力。而且,由于钠脱嵌比锂脱嵌具有更低的电势,所以反向脉冲可以帮助从电极中除去钠。这有利于提高电极的长期稳定性。
48.通过将电极直接浸泡在海水中24小时并通过溶出测量电极锂和铁(fe)的含量,在tio2涂覆的lifepo4上进行稳定性测试。根据锂和铁的浓度,反过来计算lifepo4质量负载,其与测量的原始质量负载相似,误差分别为~2%和+4%。
49.图3示出了使用不同电化学方法的稳定性测试的锂选择性和法拉第效率结果。图4示出了使用p
10sr2s
电化学方法进行10次li提取和回收循环后的fepo4颗粒的tem表征。从左到右的图:fepo4颗粒的tem图像、fe edx元素映射、na edx元素映射和li eels元素映射。使用扫描电子显微镜(sem,参见图9)和透射电子显微镜(tem,图4)表征p
10sr2s
方法中的fepo4颗粒。在第10次循环之后进行另一次嵌入用于电极表征。根据sem图像,电极形态仅有轻微的变化。在sem成像之后,将fepo4颗粒从电极上超声处理掉,用于tem表征。在图4中示出了单颗粒映射。示出三个颗粒代表电极上的颗粒。用电子能量损失谱(eels)对锂元素进行映射。通过能量色散x射线谱(edx)对钠元素和铁元素进行映射。将铁映射用作lifepo4的参考。
50.锂eels信号表明,该嵌入遵循类似于仅锂嵌入的相变,在电池阴极的边缘具有较高的锂浓度。钠映射没有给出边缘具有较高浓度的相同特征。然而,从映射中可以清楚地看出,钠均匀地存在于颗粒表面,这指明了锂和钠共存于结构中的事实。使用x射线衍射(xrd)也证实了共嵌入,如图10中所示。lifepo4和nafepo4电极均显示出峰。从形貌方面看,颗粒在循环后仍保持其完整性,但在颗粒上观察到小裂纹,这可能由于嵌入后的电极膨胀。
51.最后,证实了电化学嵌入对于具有不同锂/钠摩尔比的人工卤水和对于从犹他州盐湖得到的盐湖水都是有效的。对锂/钠比为5.4
×
10-5
、5.0
×
10-4
和4.0
×
10-3
的人工溶液进行了测试。5.4
×
10-5
的li/na比与海水的情况相似。如图5中所示,使用相同的p
10s
电化学方法,选择性分别为50.2
±
0.78%、94.3
±
4.0%和~100%(na低于检测限)。这指明在嵌入到fepo4材料中时锂对钠的热力学偏好,如图1c中所示。还收集了来自犹他州盐湖的湖水。通过电感耦合等离子体质谱(icp-ms)测量,湖水含有21.4ppm的li和4.26
×
104ppm的na。锂和钠的浓度均高于海水中的浓度,并且li/na比为1.6
×
10-3
。在电流为c/5的相同p
10s
电化学方法中,回收的li/(li+na)摩尔比为98.1
±
1.0%。还测试了1c的较高电流倍率的p
10s
电化学方法。回收的li/(li+na)摩尔比为90.6
±
4.7%。较高的电流测试代表了需要较高生产率的情况,并且选择性结果表明电化学li提取在卤水开采中既具有选择性又具有高产率的巨大潜力。在现实的应用中,在当前的回收步骤之后,可以添加类似于卤水开采中的附加步
骤,以将锂沉淀成li2co3,用于进一步的使用。
52.图5示出使用p
10s
电化学方法和具有3nm tio2涂层的fepo4电极在具有不同的初始li/na摩尔比的溶液和真实湖水中的锂选择性结果。对于湖水,测试两种不同的电流倍率。c/5电流倍率结果在左边第四条中示出,而1c电流倍率结果在最右边的条中示出。
53.总之,这些实验已经证明了使用电化学嵌入方法用fepo4电极从海水和盐湖水中均成功地提取锂。已经表明,通过经由亲水涂层以及脉冲电化学方法嵌入降低嵌入电势,可以提高锂选择性。通过使用脉冲-休止-反向脉冲-休止方法,实现了从海水中稳定的提取锂的10次循环,li/na回收率为1:1,这相当于1.8
×
104的高选择性。尽管这证明了从海水中进行电化学锂提取的巨大潜力,但该方法的开发将需要在替换电极之前的数百至数千次电化学循环需保持高的法拉第效率。因此,即使在重复循环之后少量的钠嵌入到电极材料中也会导致应力裂纹和电化学容量的损失。在一方面,本发明利用亲水界面涂层,其将用作防止钠侵入电极的屏障。此外,提供对存在于海水(或者替代地盐湖水或采油的采出水)中的微米、纳米和分子材料的过滤以防止电极的长期结垢将是有益的。这些障碍是可克服的,并且本文描述的构思提供了确保锂的充足供应以允许电动车辆的大规模应用的前景。
54.制造方法
55.电极合成和电化学方法:通过将含有80%lifepo4(mti)、10%聚偏二氟乙烯(pvdf,mti)、10%导电炭黑(mti)的糊料涂覆在1cm2碳毡基底(99.0%,3.18mm厚,alfa aesar)上来制备lifepo4电极。使用原子层沉积(ald)在200℃、0.4/循环下在o2等离子体(fiji 2,cambridge nanotech)中用在75℃加热的四(二甲基酰胺基)钛(iv)前体将tio2涂覆到lifepo4电极上。为了获得用于li提取的tio
2-fepo4电极,首先在mgcl2溶液中以c/5倍率将电极脱锂至相对于饱和甘汞电极(sce)的0.2v的截止电压。图12示意性地描述了如以上所述的形成工作电极的示例性方法。
56.在加利福尼亚的半月湾(half moon bay,california)收集海水并通过0.2μm过滤单元(corning)过滤以除去颗粒和微生物。在300ml过滤的海水中,在n2气氛中,使用直流或脉冲电化学方法,以c/5的电流倍率,用sce作为参考电极且nafepo4作为反电极,进行锂提取。通过在1m nacl溶液中使用fepo4电极进行嵌入过程来获得nafepo4电极。图13示意性地描述了如以上所述的形成反电极的示例性方法。在循环稳定性测试中,对于每次循环,所使用的嵌入容量是20%,以确保海水中的锂浓度不降低到低于其初始浓度的60%。
57.li提取选择性:在海水中完成li提取后,将电极在mgcl2溶液中以c/5倍率脱锂至相对于sce的0.2v的截止电压,用石墨棒(sigma-aldrich,99.995%)作为反电极。收集脱锂过程之前和之后的溶液进行电感耦合等离子体质谱(icp-ms)用于锂和钠浓度测量。
58.表征:将具有5kv束能量的扫描电子显微镜(sem,fei nova nanosem 450)用于成像。所有tem表征使用在300kv下操作的fei titan环境(扫描)透射电子显微镜(e(s)tem)进行。显微镜在成像(物)镜中配备有像差校正器,其在每次样品分析之前被调谐。使用cu kα辐射进行xrd(panalytical material research diffractometer)。
59.图6至图10示出了补充图。图6示出了在暴露于不同气氛(o2和n2)的海水中,在恒定还原电流(c/5倍率)下运行的具有类似质量负载的两个3nm的tio2涂覆的fepo4电极的电势曲线。当存在o2时,还原反应主要是o2还原反应,而不是锂嵌入。图7示出了具有0nm、3nm和5nm的tio2涂层的lifepo4电极的电化学阻抗谱。图8示出了在使用不同电化学方法的选择性
研究中3nm tio2涂覆的fepo4电极的电化学阻抗谱。图9示出了sem图像,其示出了在使用脉冲-休止-反向脉冲-休止方法进行的10次循环稳定性测试之前(a)和之后(b)的3nm tio2涂覆的fepo4电极。图10示出了使用脉冲-休止-反向脉冲-休止方法进行10次循环稳定性测试后的3nm tio2涂覆的fepo4电极的xrd图像。lifepo4参考(jcpds 040-1499)。nafepo4参考(jcpds 029-1216)。
60.在前述说明书中,参考本发明的具体实施方案描述了本发明,但本领域技术人员应认识到本发明不限于此。上述发明的各种特征、实施方案和方面可以单独地使用或联合地使用。此外,在不背离本说明书的较宽的主旨和范围的情况下,本发明可以适用于除本文描述的那些环境和应用之外的任意数量的环境和应用。因此,说明书和附图应视为说明性的,而非限制性的。应认识到,如本文所用的术语“包含”、“包括”和“具有”特别旨在被理解为开放式的技术术语。本文引用的每篇参考文献出于所有目的通过引用并入本文。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1