未触及的活神经元的分离的制作方法与工艺
本发明总体涉及细胞分离领域,具体地涉及分离未触及神经元细胞的方法。
背景技术:
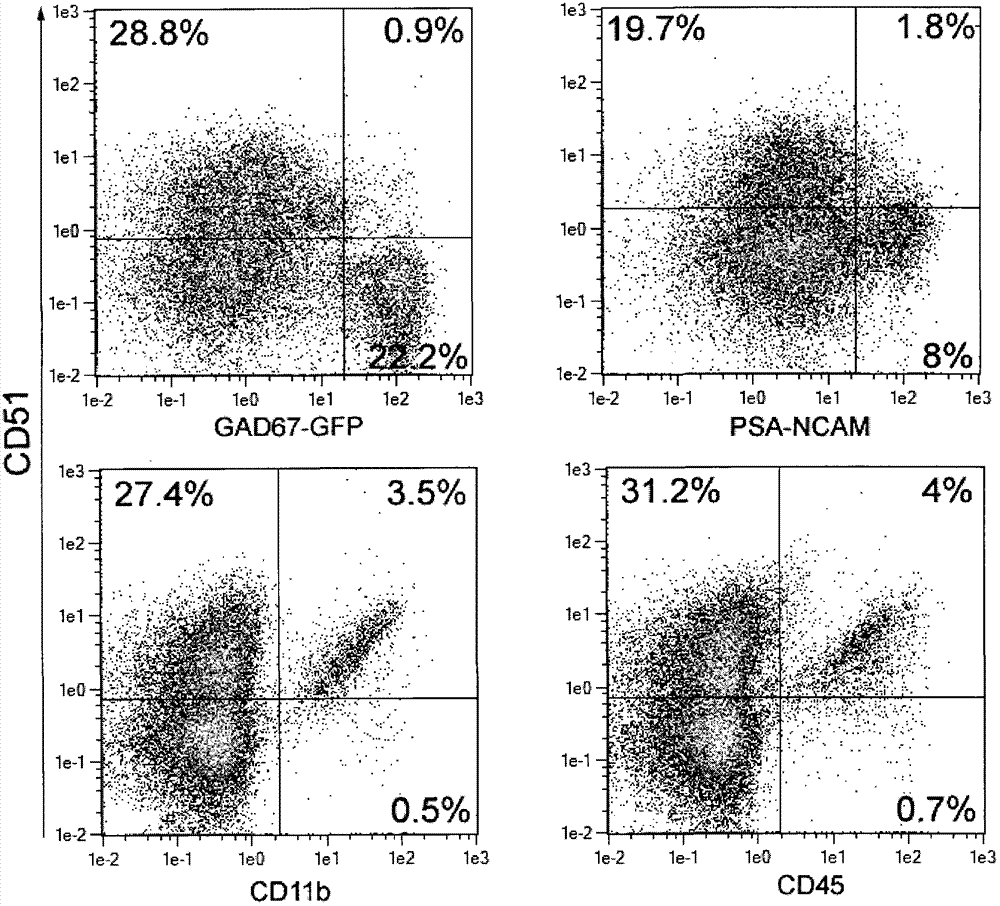
神经组织离解后获得的细胞悬浮液包含多种多样的不同细胞类型。但是,特定细胞类型的选择性靶向和分离通常是这些细胞上的实验性体外研究的先决条件。相对容易的技术如活细胞通过培养条件的密度梯度离心或分离导致低纯度和大量细胞损失。神经生物学领域所广泛使用的方法为在细胞类型特异性启动子控制下表达荧光蛋白质的转基因小鼠和促进特定细胞群分离的荧光激活细胞分选的联合使用(Nolte等,2001:Glia33:72-86;Tomomura等,2001:EurJNeurosci14:57-63;Tamamaki等,2003:JCompNeurol467,60-79;Zuo等,2004:JNeurosci24:10999-11009)。但是,除需要转基因小鼠和昂贵设备之外,该过程非常麻烦并耗时。对于非转基因动物,也描述了在用神经元特异性标记物NeuN标记细胞之后神经元的荧光激活细胞分选(Guez-Barber等,012:JNeurosciMethods203,10-18)。然而,该方法不允许分离活神经元,因为其需要标记细胞内标记物。导致神经元细胞分离的另一种技术由Barres等描述(1988:Neuron1:791-803)。该称为免疫抗体包被筛选(immunopanning)的方法使用抗体介导的细胞粘附。最初描述的是使用Thy-1作为视网膜神经节细胞的特异性标记物来分离视网膜细胞,该方法也通过随后少突胶质细胞、小胶质细胞和星形胶质细胞的贫化而用于分离神经元(Cahoy等,2008:JNeurosci28:264-278)。但是,至今未描述使用该技术一步分离神经元。一种用于分离期望细胞类型的简单方法为细胞的磁性分离,例如磁性激活细胞分选(MACS技术,MiltenyiBiotecGmbH,德国;US5411863、US5543289、US6020210、US6417011)。该技术需要允许通过连接至磁性微珠的抗体直接分离目标细胞的标记物。然而,迄今未知通用的神经元特异性细胞表面标记物,因此活神经元的直接磁性细胞分选是不可行的。然而,可应用负性分离策略来分离不能直接处理的细胞群。在该方法中,非靶细胞被磁性标记并贫化,从而分离未标记的目标细胞。本发明的目的是提供一种改进的用于从衍生自神经组织的细胞悬浮液中分离活神经元细胞并去除非神经元细胞的方法。发明概述发明人令人惊讶地将CD51(整合素αV(IntegrinαV))鉴定为由大多数非神经元细胞表达的标记物,所述非神经元细胞存在于由神经组织例如星形胶质细胞、星形胶质细胞前体、小胶质细胞、少突胶质细胞、少突胶质细胞前体、内皮细胞、成纤维细胞、和淋巴细胞获得的细胞悬浮液中。此外,发明人也将CD51鉴定为通过大多数存在于自然分化的多能细胞中的非神经元细胞表达的标记物。因此,该标记物可用作用于贫化非神经元细胞的泛非神经元细胞表面标记物。CD51代表整合素α链V(UniProtKBacc.no.P43406(小鼠)、P06756(人))。其与包括β1(CD29)、β3(CD61)、β5和β6的整合素家族的β亚单位非共价连接以形成功能信号复合物。整合素αV在发育期间和在成人中通过多种组织表达。其在血管发生、血管生成、伤口愈合、肿瘤发生、神经形成、和炎症中扮演至关重要的角色(Takada等,2007:GenomeBiology8:215.1-215.9)。CD51也被报道通过成纤维细胞表达(Treese等,2008:CytometryA73A:351-360)和通过骨骼肌细胞表达(Hirsch等,1994:DevDyn201:108-120)。在脑中,发现其对于大脑皮层中神经元迁移期间的神经元-神经胶质胶粘相互作用是至关重要的(Anton等,1999:Neuron22:277-289)。本发明提供抗原CD51作为神经元细胞的负性选择标记物的用途。一种用于富集、分离和/或检测活神经元细胞的方法,包括步骤a)使包含神经元细胞的样品与连接至固相的对CD51抗原特异性的抗原结合片段例如抗体或抗体片段接触,从而标记所述样品的CD51阳性细胞,和b)分离所述样品的非标记细胞,即未被对CD51抗原特异性的抗原结合片段结合的细胞。这些为未触及的靶细胞,即基本上不含非神经元细胞的富集神经元细胞。如果除CD51之外使用星形胶质细胞特异性细胞表面标记物以贫化CD51阴性残留星形胶质细胞亚群,可进一步提高纯度。附图简要说明图1离解的出生后小鼠脑组织中CD51表达的流式细胞仪分析。图2A和图2B通过CD51与对不同神经亚群特异性的标记物的共染色,对离解的出生后小鼠脑中不同神经元细胞类型中CD51表达的流式细胞仪表征。图3通过使用直接(A)或间接(B)标记策略分离磁性细胞来贫化CD51阳性细胞。图4A和图4B通过CD51-生物素和抗生物素微珠有效贫化非神经元亚群。图5通过与CD51联合使用星形胶质细胞特异性标记物来提高纯度。图6使用CD51-生物素和抗生物素微珠从不同脑部区域分离神经元。发明详述出乎意料地,发明人发现CD51由大多数非神经元细胞表达,包括例如星形胶质细胞、星形胶质细胞前体、小胶质细胞、少突胶质细胞、少突胶质细胞前体、内皮细胞、和淋巴细胞,但不被神经元表达(参见实施例2)。因此,令人惊讶地,细胞表面标记物CD51非常适合作为神经元细胞的负性选择标记物。在本发明的主要方面中提供CD51作为神经元细胞的负性选择标记物的用途。在本发明的一个方面中提供一种用于富集、分离和/或检测神经元细胞的方法,包括步骤a)使包含神经元细胞的样品与连接至固相的对CD51抗原特异性的抗原结合片段接触,从而标记所述样品的CD51阳性细胞,b)分离所述样品的非标记细胞。非标记或未触及细胞为未被对抗原CD51特异性的抗原结合片段结合的细胞。如果除CD51之外使用星形胶质细胞特异性细胞表面标记物以贫化残留星形胶质细胞亚群,可进一步提高纯度。因此,在本发明的一个实施方案中提供了一种用于富集和分离神经元细胞的方法,包括步骤a)使包含神经元细胞的样品与连接至固相的对CD51抗原特异性的抗原结合片段和连接至固相的对星形胶质细胞特异性细胞表面标记物特异性的抗原结合片段-例如ACSA-2(ACSA:星形胶质细胞的细胞表面抗原)或GLAST(ACSA-1)-接触,从而标记所述样品的CD51阳性细胞和表达星形胶质细胞特异性细胞表面标记物的细胞,b)分离所述样品的非固定细胞。包含神经元细胞的样品与对CD51抗原特异性的抗原结合片段和对星形胶质细胞特异性细胞表面标记物特异性的抗原结合片段例如ACSA-2或GLAST(ACSA-1)的接触可同时或相继进行。在本发明的进一步方面中提供可由本文所公开的方法获得的基本上纯的神经元细胞组合物。本发明允许分离存在于混合神经元细胞悬浮液中的全部神经元。该细胞组合物仅显示被非神经元细胞最低程度地污染并包括多种不同的不能通过现有技术的其它方法获得的神经元亚类型。在本发明的其他方面中提供一种用于富集、分离和/或检测神经元细胞的试剂盒,包括a)连接至固相的对CD51抗原特异性的抗原结合片段;和任选额外地b)连接至固相的对星形胶质细胞特异性细胞表面标记物-例如ACSA-2或GLAST(ACSA-1)-特异性的抗原结合片段。通过本发明方法获得的细胞可根据本领域技术人员已知的任何方法进行富集后的培养和/或分析(表征)。定义除非另有定义,本文所用的技术和科学术语具有与本发明所属领域技术人员所通常理解的相同的含义。如本文所用,术语“样品”是指以任意比例含神经元细胞和非神经元细胞的样品。优选地,这些细胞是活的。但是,这些细胞也可为可用于随后的核酸或蛋白质提取物的固定细胞。样品可来自动物,特别是哺乳动物,例如小鼠、大鼠或人。可使用衍生自神经系统,例如全脑组织、特定脑部区域、脊髓、外周神经组织、胚胎干(ES)细胞来源的或诱导多能干(iPS)细胞来源的神经元细胞的组织、或任何含神经元细胞的组织。本发明主要举例说明了从离解的小鼠脑组织分离神经元细胞。然而,其一般性地涉及使用检测CD51抗原的抗体从任何哺乳动物组织分离神经元细胞。实施例9中示例性地描述了人类中CD51表达谱是相同的。本发明实施方案的全部过程和可通过该方法获得的组合物也可来源于人或小鼠之外的任何其它物种。如本文所用,术语“靶细胞”指是通过本发明分离的期望细胞。规则地,该靶细胞为通过本发明方法产生的非标记的CD51阴性神经元细胞。如本文所用,术语“非靶细胞”是指被连接至固相的一个抗原结合片段特异性结合的非神经元细胞。如本文所用,术语“阴性部分”是指未被连接至固相的一个抗原结合片段结合并为期望靶细胞的神经元细胞。如本文所用,术语“阳性部分”是指被连接至固相的一个抗原结合片段结合并为不期望的非靶细胞的非神经元细胞。如本文所用,术语“初始部分”是指细胞分离之前的混合神经元细胞悬浮液,其含有期望的神经细胞以及非神经元细胞。如本文所用,术语“贫化”是指一种负性选择过程,其使期望的神经元细胞与通过连接至固相的一个抗原结合片段标记的不期望的非神经元细胞分离。如本文所用,术语“非标记”或“未触及”是指未被连接至固相的一个抗原结合片段结合的神经元细胞。该非标记、未触及的细胞部分含有期望的靶细胞。如本文所用,术语“纯度”是指阴性细胞部分中CD51或CD51/ACSA-2阴性细胞的百分数。如本文所用,术语“神经”是指衍生自神经系统组织的全部不同亚群细胞,其含有神经元细胞和非神经元细胞。如本文所用,术语“标记物”是指由某一细胞类型特异性表达的细胞抗原。优选地,标记物为细胞表面标记物,以致可进行活细胞的富集、分离和/或检测。如本文所用,术语“固相”是指抗原结合片段如抗体与其它分子-例如颗粒、荧光团、半抗原如生物素、或较大表面如培养皿和微量滴定板-的连接。在某些情况下,该连接导致抗原结合片段的直接固定,例如如果将抗原结合片段连接至培养皿的较大表面。在其它情况下,该连接导致间接固定,例如抗原结合片段直接或间接(通过例如生物素)连接至磁性珠,将磁性珠保持于磁场中时被固定。在进一步情况下,抗原结合片段与其它分子的连接不导致直接或间接固定,但是允许根据本发明富集、分离、分出、和检测细胞,例如如果将该抗原结合片段连接至随后允许通过例如流式细胞仪方法(如FACS分选)或荧光显微镜来辨别标记细胞和非标记细胞的荧光团。如本文所用,术语“颗粒”是指固相例如胶质颗粒、微球、纳米颗粒、或珠粒。用于产生这种颗粒的方法是本领域所熟知的。该颗粒可为磁性颗粒。在用于本发明前,该颗粒可处于溶液或悬浮液中或它们可处于冻干状态。随后,在接触待根据本发明处理的样品之前,将该冻干颗粒在便利的缓冲液中重构。如本文所用,“磁性颗粒”中的术语“磁性”是指全部亚类型的磁性颗粒,其可用本领域技术人员所熟知的方法制备,其特别是铁磁性颗粒、超顺磁性颗粒和顺磁性颗粒。“铁磁性”材料非常易受磁场影响并当移除磁场时能够保持磁性。“顺磁性”材料仅具有弱的磁化率并当移除磁场时迅速丧失它们的弱磁性。“超顺磁性”材料非常易受磁性影响,即当置于磁场中时它们变得强磁性,但是,如顺磁性材料,其快速丧失它们的磁性。如本文所用,术语“抗原结合片段”是指优先结合期望的细胞靶分子如抗原的任何部分。术语“部分”包括,例如,抗体或抗体片段。如本文所用,术语“抗体”是指可通过本领域技术人员所熟知的方法产生的多克隆或单克隆抗体。该抗体可为任何物种的,例如小鼠、大鼠、羊、人。为了治疗目的,如果要使用非人类抗原结合片段,这些片段可通过本领域已知的任何方法人源化。该抗体也可为修饰抗体(例如低聚物、还原、氧化和标记的抗体)。术语“抗体”包括完整分子和抗体片段两者,例如Fab、Fab′、F(ab`)2、Fv和单链抗体。另外,术语“抗原结合片段”包括除优先结合期望的细胞靶分子的抗体或抗体片段之外的任何部分。合适的部分包括,但不限于,结合期望的靶分子的被称为适体的低聚核苷酸(Hermann和Pantel,2000:Science289:820-825)、碳水化合物、凝集素或任何其它抗原结合蛋白(例如受体-配体相互作用)。抗体和颗粒之间的连接可为共价或非共价的。共价连接可为,例如连接至聚苯乙烯珠上的羧基、或连接至修饰珠上的NH2或SH2基团。非共价连接为例如通过生物素-抗生物素蛋白或荧光团连接颗粒连接至抗荧光团抗体。连接抗体与颗粒、荧光团、半抗原如生物素或较大表面如培养皿的方法是本领域技术人员所熟知的。对于富集、分离或选择,原则上可使用任何分选技术。这包括例如亲和色谱或任何其它本领域已知的抗体依赖性分离技术。任何本领域已知的配体依赖性分离技术可与取决于细胞的物理性质的正性和负性分离技术一同使用。一种特别有效的分选技术为磁性细胞分选。磁性分离细胞的方法为可商购的,例如购自Invitrogen,StemcellTechnologies,inCellpro,西雅图或AdvancedMagnetics,波士顿。例如,可将单克隆抗体直接连接至磁性聚苯乙烯颗粒如DynalM450或类似的磁性颗粒并用于例如细胞分离。磁珠(Dynabeads)技术不是基于柱子的,相反,这些吸附了细胞的磁性珠具有样品管中的液相动力学,并通过将该管置于磁性架上来分离细胞。然而,在用于根据本发明由包含神经元细胞的样品富集、分选和/或检测神经元细胞的优选实施方案中,单克隆抗体与具有有机涂层(例如多糖)的胶质超顺磁性颗粒一同使用(磁激活细胞分选(MACS)技术(MiltenyiBiotec,贝吉施-格拉德巴赫,德国))。这些颗粒(纳米珠或微珠)可直接结合至单克隆抗体或与抗免疫球蛋白、抗生物素蛋白或抗半抗原-特异性微珠联合使用。MACS技术允许通过用涂覆有针对特定表面抗原的抗体的磁性纳米颗粒培养细胞来将其分离。这导致表达该抗原的细胞吸附至该磁性纳米颗粒。然后,将细胞溶液转移至置于强磁场中的柱子上。在该步骤中,细胞吸附至(表达该抗原)的纳米颗粒并留在柱子上,而(不表达该抗原)的其它细胞流过。以这种方法,该细胞可被正性或负性地与特定抗原分离。在正性选择情况下,在将柱子从磁场移除之后,将吸附至磁性柱的表达目标抗原的细胞洗出至单独的容器。在负性选择情况下,所用抗体为针对已知存在于非目标细胞上的表面抗原。在将细胞/磁性纳米颗粒溶液施加于柱子上之后,表达这些抗原的细胞结合至柱子并收集通过的馏分,因为其含有目标细胞。由于这些细胞未被连接至纳米颗粒的抗体标记,所以它们为“未触及”的。可使用直接磁性标记或间接磁性标记进行该过程。对于直接标记,特异性抗体直接连接至磁性颗粒。当直接磁性标记不可能或不期望时,间接标记是一种方便的替代方案。一级抗体、特异性单克隆或多克隆抗体、针对任何细胞表面标记物的一级抗体的组合可用于该标记策略。该一级抗体可为未结合、生物素化、或荧光团结合的。然后,用抗免疫球蛋白微珠、抗生物素微珠、或抗荧光团微珠实现该磁性标记。本发明方法允许直接磁性标记和间接磁性标记(参见实施例3)。如本文所用,术语“基本上纯的神经元细胞组合物”是指靶细胞部分中含有至少80%,更优选至少90%,最优选至少95%的CD51或CD51/ACSA(星形胶质细胞表面抗原)阴性细胞的细胞组合物。如果通过使用对CD51抗原特异性的抗原结合片段进行本发明方法,则CD51阴性细胞处于靶细胞部分中。如果通过使用对CD51抗原特异性的抗原结合片段和对星形胶质细胞特异表面标记物特异性的抗原结合片段-例如ACSA-2或GLAST(ACSA-1)-进行本发明方法,则CD51/ACSA阴性细胞处于靶细胞部分中。通常,神经元细胞结合在体内不同细胞类型的网络中。为了使得易于对这些组织进行富集和分选技术,在使用此类方法之前需将组织离解。在本发明中,使用例如神经组织离解试剂盒(T)(NTDK(T))或神经组织离解试剂盒(P)(NTDK(P))(MiltenyiBiotec),用基于胰蛋白酶或木瓜蛋白酶的过程酶性离解脑组织。用手或用允许自动组织离解的器械如gentleMACSTM离解器(MiltenyiBiotec)对该组织进一步机械离解。也可使用允许产生来自神经组织的活的单细胞悬浮液并为本领域技术人员所熟知的其它方法。可通过本文所公开方法获得的神经元细胞可用于随后的步骤,例如本领域技术人员已知的研究、诊断、药理或临床应用。从脑中各种其它细胞类型纯化神经元对于分子、生化或电生理学体外分析而言是先决条件。可使用为这种应用优化的培养基对细胞进行培养,例如补充有SupplementB27PLUS(MiltenyiBiotec)的NeuroMedium。本发明中,使用补充有SupplementB27PLUS(MiltenyiBiotec)和L-谷氨酸(0.5mM,Invitrogen)的NeuroMedium(MiltenyiBiotec),将分离细胞接种于涂有聚-L-赖氨酸的盖玻片之上并在37℃下的潮湿气氛中(5%CO2,95%空气)保持一周。这种神经元细胞培养物可用于研究例如神经系统发育、突触发生、细胞信号转导、神经递质释放、或用于进行用于研究神经活性的电生理测量。富集的神经元细胞也可在细胞培养之前和/或之后作为药物组合物用于治疗,例如细胞疗法,或预防疾病。该药物组合物可用于治疗和/或预防哺乳动物-特别是人类-的疾病,可能包括向哺乳动物施用药学有效量的该药物组合物。所述疾病可为任何如下疾病,其可通过神经元细胞的存在和/或通过增加相应位置如脑或脊髓中或处的相应细胞的浓度来治疗和/或预防。被治疗和/或被预防性治疗的疾病可为任何脑疾病,例如中枢神经系统特定区域的神经元退化性疾病。该治疗可为将富集的神经元细胞移植到脑部相应位置。本公开内容的药物组合物可以适于待治疗(或预防)疾病的方式施用。施用的量和频率将通过如患者状况、患者疾病类型和严重性等因素确定,虽然适当剂量可通过临床试验确定。具体实施方式允许用于富集、分离和/或检测细胞的负性选择标记物的用途的方法为例如磁性细胞分离法、免疫抗体包被筛选法、和FACS分选。抗原结合片段可用颗粒如磁性颗粒、半抗原样生物素、或荧光团来标记。该抗原结合片段可例如通过将它们吸附于培养皿表面上或通过用颗粒例如磁性珠粒标记它们而固定。在本发明的一个实施方案中,该抗原结合片段为用磁性颗粒(CD51微珠)标记的CD51抗体。抗体和颗粒的连接可为共价或非共价的。如果连接为共价的,则CD51抗体直接连接至磁性颗粒。如果连接为非共价的,则颗粒为例如抗生物素微珠或链霉亲和素微珠且CD51抗体被生物素化。将样品如标记的神经元细胞装载到置于磁场中的柱上。磁性标记的非神经元细胞保留于柱内而流经物含有未触及的富集神经元。培养这些细胞获得仅具有低百分比的污染非神经元细胞(<10%)的神经元细胞部分(参见实施例5)。在本发明的另一个实施方案中,抗原结合片段为抗CD51抗体和对星形胶质细胞特异性细胞表面标记物特异性的抗体例如ACSA-2或GLAST(ACSA-1)。这些抗体共价连接至磁性颗粒。同时用抗CD51微珠和例如抗ACSA-2微珠标记样品如神经元细胞悬浮液,并装载到置于磁场中的柱上。磁性标记的非神经元细胞保留于柱内而流经物含有未触及的富集神经元。培养这些细胞获得仅显示低百分比的污染非神经元细胞(<5%)的神经元细胞部分。在该实施方案的变体中,抗CD51抗体和对星形胶质细胞特异性细胞表面标记物特异性的抗体连接至相同的磁性颗粒。在本发明的另一个实施方案中,抗原结合片段为抗CD51抗体和对星形胶质细胞特异性细胞表面标记物特异性的抗体例如ACSA-2或GLAST(ACSA-1)。这些抗体共价连接至磁性颗粒。首先用CD51微珠标记样品如神经元细胞悬浮液,并装载在置于磁场中的柱上。磁性标记的非神经元细胞保留于柱内而流经物含有未触及的富集神经元。然后,用星形胶质细胞特异性微珠标记流经物并填载到置于磁场中的第二柱上。磁性标记的星形胶质细胞保留于柱内而流经物还含有富集神经元。在该实施方案的变体中,改变标记包含神经元细胞的样品的顺序,以首先用例如抗ACSA-2微珠标记而后用CD51微珠标记。在本发明的另一个实施方案中,抗原结合片段为抗CD51抗体和对星形胶质细胞特异性细胞表面标记物特异性的抗体如ACSA-2或GLAST(ACSA-1)。这些抗体被生物素化。用CD51-生物素和例如抗ACSA-2-生物素同时或相继标记样品,例如神经元细胞悬浮液。然后,用抗生物素微珠或链霉亲和素微珠实现磁性标记并将细胞装载到置于磁场中的柱上。磁性标记的非神经元细胞保留于柱内而流经物含有未触及的富集神经元。培养这些细胞获得仅显示低百分比的污染非神经元细胞(<5%)的神经元细胞部分(参见实施例8)。在本发明的另一个实施方案中,使用免疫抗体包被筛选法,用CD51抗体贫化包含神经元细胞的样品中的CD51阳性细胞。将该CD51抗体固定于筛选板如皮氏培养皿或多孔皿的表面。将筛选缓冲液中的包含神经元细胞的样品培养于CD51筛选板上以结合CD51表达细胞。通过例如离心收集未结合细胞并将其悬浮于例如细胞培养基中用于随后的用途。为了提高神经元细胞的纯度,在贫化CD51阳性细胞之后,使用星形胶质细胞筛选板-即其上固定了对星形胶质细胞标记物特异性的抗体例如ACSA-2或GLAST(ACSA-1)的板-进一步贫化细胞中的星形胶质细胞。在本发明的另一个实施方案中,包含神经元细胞的样品用荧光标记的CD51抗体(并任选地进一步用对星形胶质细胞特异标记物特异性的荧光标记抗体)来标记并经历流式细胞仪法如荧光-激活细胞分选(FACS)。进行本文所公开方法所必需的细胞分离成分可作为试剂盒提供。每个试剂盒含有进行将期望细胞从包含神经元细胞的样品中分离所必需的成分。用于富集、分离和/或检测神经元细胞的试剂盒包含a)连接至固相的对CD51抗原特异性的抗原结合片段;和任选的b)连接至固相的对星形胶质细胞特异性细胞表面标记物特异性的抗原结合片段。为了用于磁性细胞分选,如本文所述,抗原结合片段连接至磁性颗粒。试剂盒的磁性颗粒如微珠可处于溶液或悬浮液中,或者它们在用于本发明方法之前可为冻干状态。然后,在与待根据本发明处理的包含神经元细胞的样品接触之前,在方便的缓冲液中重构该冻干颗粒。对星形胶质细胞特异性细胞表面标记物特异性的抗原结合片段可为抗ACSA-2或抗GLAST(ACSA-1)。优选该星形胶质细胞特异性细胞表面标记物为ACSA-2。实施例以下通过实施例更加具体和明确地描述本发明,然而,所述实施例不意欲限制本发明。实施例1:出生后小鼠脑组织中CD51表达根据厂商说明书,使用神经组织离解试剂盒(T)(NTDK(T))或神经组织离解试剂盒(P)(NTDK(P))(MiltenyiBiotec)以及gentleMACSTM离解器(MiltenyiBiotec),用基于胰蛋白酶或木瓜蛋白酶的方法离解衍生自P6CD1小鼠的小鼠脑组织。用结合至APC或PE的CD51抗体染色单细胞悬浮液,用于流式细胞仪分析。为了避免归因于Fc受体相互作用的假阳性染色,在抗体标记之前应用小鼠FcR阻断试剂(MiltenyiBiotec)。细胞碎片和死亡细胞(通过碘化丙啶鉴别)排除在分析之外。在分析器(MiltenyiBiotec)上获得数据。胰蛋白酶以及木瓜蛋白酶离解的脑组织中检测到的CD51阳性细胞百分比为21.8-25.4%。CD51阳性细胞百分比取决于抗体偶联物和用于离解的酶而有些许不同,但未检测到显著差异。该实验显示CD51抗原未显示木瓜蛋白酶和胰蛋白酶敏感性且CD51阳性细胞可与获自小鼠脑组织的细胞悬浮液中CD51阴性细胞完全区分开(参见图1)。实施例2:出生后小鼠脑组织中CD51阳性细胞的流式细胞仪特性如前所述,使用NTDK(T)或(P)离解衍生自P1、P2、或P3CD1小鼠的小鼠脑组织。所得的单细胞悬浮液用CD51和对不同神经亚群特异性的标记物共同染色,并经历流式细胞仪分析。为了染色蛋白酶敏感的表位CD31和AN2,在37℃和连续旋转下将细胞悬浮液在NeuroSupplementB27PLUS中培养2小时以再表达该表位。由于缺乏允许标记活神经元细胞群的标记物,使用GAD67-GFP转基因小鼠,通过其表达GFP(绿色荧光蛋白质)以检测GABAergic神经元。该分析显示GAD67-GFP阳性GABAergic神经元缺乏CD51表达。此外,通过PSA-NCAM表达鉴别的神经元祖细胞被确定为CD51阴性(参见图2A)。相比而言,通过CD51检测到了CD11b-阳性小胶质细胞、CD45阳性淋巴细胞、AN2-阳性少突胶质细胞前体、O4-阳性少突胶质细胞、以及CD31阳性内皮细胞(参见图2A和B)。在AN2和CD31染色的情况下,由于用于再表达AN2和CD31表位的处理,CD51阳性细胞的总百分比增加。大多数通过星形胶质细胞特异性抗体抗GLAST(ACSA-1)和抗ACSA-2鉴别的星形胶质细胞也是CD51阳性的。大约50%的A2B5阳性祖细胞显示CD51表达(参见图2B)。该分析中所用的全部抗体偶联物可商购于MiltenyiBiotecGmbH,贝吉施-格拉德巴赫,德国。实施例3:通过磁性细胞分离贫化CD51阳性细胞为了贫化CD51阳性非神经元细胞,就靶细胞的纯度和回收率,将直接标记策略与间接标记相比较。对于直接标记,CD51特异性抗体共价结合磁性颗粒。如本文所用的超顺磁性颗粒的产生公开于US5543289,其通过引用包括于此。识别CD51抗原的单克隆抗体共价结合磁性珠,得到25μg抗体每mL珠悬浮液,浓度为OD450=10。将不同浓度的珠结合抗体(0.75、1.5、3、6OD450/ml)加入含1x107个细胞的100μl神经元细胞悬浮液中。4℃下培养细胞15分钟,用1mlPBS+0.5%BSA缓冲液洗涤一次,然后悬浮于1ml相同缓冲液中并填载到置于MidiMACSTM离析器(MiltenyiBiotec)磁场中的LD柱上。用1ml相同缓冲液洗涤柱子两次。磁性标记的CD51阳性细胞保留于柱中,而流经物含有CD51阴性靶细胞。CD51阳性细胞保留于柱中并在色谱柱由磁体移出之后作为正性选择细胞部分洗脱。为了测定贫化效率,用CD51-APC染色初始以及阴性和阳性细胞部分并通过流式细胞仪分析。3OD450/ml的微珠浓度导致高纯度CD51阴性细胞。图3A显示一个代表性实验的初始、阴性、和阳性部分。阴性细胞部分中96.7±0.5%的细胞被确定为CD51阴性。初始部分中所含的88.4±2.2%的靶细胞被收集在阴性部分中。一个代表性实验显示于图3A中。此外,测试间接标记策略。因此,首先用生物素化CD51特异性抗体标记1x107个细胞10分钟并用1mlPBS+0.5%BSA缓冲液洗涤一次。然后,应用连接至抗生物素抗体的超顺磁微珠。4℃下培养细胞15分钟,然后洗涤一次。如前所述进行分离。测试不同浓度的CD51-生物素偶联物(1、2、4、6、8μg/ml)。用6μg/ml的CD51-生物素浓度获得最高纯度的CD51阴性细胞。一个代表性实验显示于图3B中。分析显示阴性细胞部分中98.6±0.17%的细胞为CD51阴性。靶细胞回收率为76.7±2.6%(参见图3B)。实施例4:非神经元细胞的有效贫化使用衍生自P2或P3CD1小鼠的小鼠全脑和如前所述的间接标记策略贫化CD51阳性细胞。用CD51和示例性的A2B5、O4、GLAST(ACSA-1)、ACSA-2、CD11b特异性抗体共同染色初始、阴性以及阳性细胞部分以测定初始、阴性以及阳性细胞部分中不同神经亚型的百分比。使用GAD67-GFP小鼠允许检测GABAergic神经元。图4A显示GAD67-GFP阳性GABAergic神经元富集于阴性靶细胞部分中,而非神经元细胞如AN2阳性少突胶质细胞前体、O4阳性少突胶质细胞、和CD11b阳性小胶质细胞被贫化并被发现于阳性部分中(参见图4A、B)。大多数GLAST(ACSA-1)和ACSA-2阳性星形胶质细胞也被贫化,但大约6%的这些细胞保留于阴性部分内(参见图4B)。该分析中所用的全部抗体偶联物可商购于MiltenyiBiotecGmbH,贝吉施-格拉德巴赫,德国。实施例5:阴性细胞部分的培养由1天大的小鼠获得皮质半球并使用NTDK(P)离解。使用6μg/ml浓度的生物素化一级CD51特异性抗体和抗生物素微珠标记CD51阳性细胞,然后如前所述贫化。培养阴性以及阳性细胞部分。因此,将细胞接种于涂有聚-L-赖氨酸的盖玻片之上并在37℃下使用例如补充有SupplementB27PLUS(MiltenyiBiotec)和L-谷氨酸(0.5mM,Invitrogen)的NeuroMedium(MiltenyiBiotec)将其在潮湿气氛(5%CO2、95%空气)中保持5天。然后在4℃下用PBS中的4%多聚甲醛(PFA)(pH7.4)固定培养物20分钟。对于免疫染色,4℃下应用针对GLAST(ACSA-1,小鼠IgG2a,MiltenyiBiotec)的一级抗体、GFAP(小鼠IgG1,Millipore)、髓鞘碱性蛋白(MBP)(小鼠IgG2a,Millipore)、和微管相关蛋白2(MAP2)(兔多克隆,Millipore)过夜或室温下应用3h。用PBS冲洗3次之后,用相应的二级抗体(Invitrogen)于4℃下培养样品3h或室温下培养1h。使用荧光安装介质(Dako)将盖玻片置于载玻片上并通过共焦荧光显微镜(LeicaTCSSP2)分析样品。MAP2免疫染色检测到阴性细胞部分中的许多神经元而阳性部分中仅少数的神经元。对于MAP2和星形胶质细胞特异性标记物GFAP以及GLAST(ACSA-1)的共同染色显示一些星形胶质细胞被发现于阴性部分中,但阳性部分中检测到多得多的星形胶质细胞。阴性部分中几乎没有检测到MBP阳性少突胶质细胞,其主要发现于阳性部分中。污染星形胶质细胞和少突胶质细胞的百分比为<10%。实施例6:除CD51之外使用星形胶质细胞特异性标记物提高纯度如前所述,使用NTDK(P)离解衍生自P3CD1小鼠的小鼠全脑组织。为了进一步提高神经元细胞部分的纯度以及同时贫化污染的星形胶质细胞,将星形胶质细胞特异性抗体抗ACSA-2以不同浓度与CD51联合使用。因此,将不同浓度的生物素结合的CD51抗体和抗ACSA-2抗体同时应用于100μl含1x107个细胞的神经元细胞悬浮液,然后于4℃下培养10分钟。然后如前所述进一步处理细胞并使用一个LD柱分离。为了测定贫化效率,用荧光染料结合的CD51抗体和抗ACSA-2抗体染色初始以及阴性和阳性细胞部分,然后通过流式细胞仪分析。当应用4μg/ml浓度的CD51-生物素偶联物和1μg/ml浓度的抗ACSA-2-生物素时获得靶细胞的最佳纯度和回收率。图5显示了一个代表性实验。初始部分中检测的CD51/ACSA-2阳性细胞在阴性靶细胞部分中几乎全部贫化(参见图5)。用该抗体组合物获得的CD51/ACSA-2阴性细胞的平均纯度为98.55±1.2%,而69.5±3.15%的靶细胞在阴性部分中回收。实施例7:来自不同脑部区域的神经元的分离移除P4CD1小鼠的脑,并使用NTDK(P)分别离解皮质半球、小脑、中脑、或嗅球。如前所述,用CD51抗体和抗ACSA-2-生物素结合抗体,分别以4μg/ml和1μg/ml浓度标记细胞。然后,应用抗生物素微珠15分钟。分离之后,用ACSA-2和CD51特异性荧光染料结合的抗体染色初始、阴性以及阳性细胞部分,并通过流式细胞仪分析以测定纯度。取决于脑部区域,初始细胞部分中的CD51和ACSA-2阳性细胞频率不同。在衍生自嗅球组织的神经元细胞的情况下,CD51/ACSA-2阳性细胞显示了仅8%的百分比。小脑中该百分比增加至大约15%,而在皮质半球的情况下为40%和在中脑中甚至全部细胞的60%为CD51/ACSA-2阳性非神经元细胞。然而,在嗅球、小脑和皮质半球的情况下,阴性部分中神经元细胞的纯度为约99%,和对于中脑组织为97%(参见图6)。实施例8:分离自不同年龄小鼠的小鼠脑组织的神经元细胞的培养自1、3或5天大的小鼠获得皮质半球并使用NTDK(P)离解。如前所述,首先用CD51抗体和抗ACSA-2生物素化抗体而后用抗生物素微珠间接标记细胞并分离。培养阴性以及阳性细胞部分。因此,将细胞接种于涂有聚-L-赖氨酸的盖玻片上并在37℃下使用例如补充有SupplementB27PLUS(MiltenyiBiotec)和L-谷氨酸(0.5mM,Invitrogen)的NeuroMedium(MiltenyiBiotec)将其在潮湿气氛(5%CO2,95%空气)保持中5天。然后在4℃下用PBS中的4%多聚甲醛(PFA)(pH7.4)固定培养物20分钟。对于免疫染色,4℃下应用针对GLAST(ACSA-1,小鼠IgG2a,MiltenyiBiotec)的一级抗体、GFAP(小鼠IgG1,Millipore)、髓鞘碱性蛋白(MBP)(小鼠IgG2a,Millipore)、微管-相关蛋白2(MAP2)(兔多克隆,Millipore)、和NeuN(小鼠IgG1,Millipore)过夜或室温下应用3h。用PBS冲洗3次之后,用相应的二级抗体(Invitrogen)于4℃下培养样品3h或室温下培养1h。使用荧光安装介质(Dako)将盖玻片置于载玻片上并通过共焦荧光显微镜(LeicaTCSSP2)分析样品。阴性以及阳性细胞部分的免疫染色显示通过MAP2和NeuN免疫染色鉴别的主要神经元存在于神经元细胞部分中。靶细胞部分中仅检测到极少数目的污染GLAST或GFAP阳性星形胶质细胞和MBP阳性少突胶质细胞(<5%)。分离自P1、P3、和P7小鼠脑组织的神经元被成功培养。实施例9:人诱导多能干(iPS)细胞来源的神经元细胞中CD51表达使用保持于促进自发分化条件下的人诱导多能干(iPS)细胞的免疫细胞化学染色实验显示通过MAP2和NeuN免疫染色鉴别的神经元缺乏CD51免疫反应。相反,发现非神经元细胞如星形胶质细胞和少突胶质细胞表达CD51。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1