烟碱脱甲基酶活性降低的烟草植物的制作方法
与相关申请的交叉参考本申请要求2006年12月15日提交的美国专利申请系列号11/611,782的利益,该申请全文列入本文作为参考。发明背景1.
技术领域:
本发明一般性地涉及与烟碱脱甲基酶(nicotinedemethylase)活性降低的烟草植物相关的组合物和方法。2.背景信息已知烟草植物对烟碱进行N-脱甲基化以形成次级生物碱,即去甲烟碱,已知去甲烟碱是调制过的烟叶中由微生物介导形成N-亚硝基去甲烟碱(下文称之为“NNN”)所用的前体。N-脱甲基化反应由烟碱脱甲基酶(NDM)催化。使烟草中由底物烟碱至产物去甲烟碱的转变降低的最新方法利用筛选来清除用于商业种子生产的原种生长地中的转变者植物。然而,由筛选得到的种子直接产生的种子仍含有转变者。发明简述本文提供了与烟碱脱甲基酶基因中具有突变或表达含有烟碱脱甲基酶基因序列的双链RNA的烟草植物、杂种、品种和品系的生产相关的组合物和方法。本文提供了烟草杂种、品种和品系。烟草杂种、品种或品系可包含烟碱脱甲基酶基因中具有突变的植物。烟碱脱甲基酶基因中具有突变的植物可具有非-转变者表型,与包含含野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,该植物的后代可具有至少降低2倍(例如10倍至1000倍或2倍至100倍)的回复突变率。烟草杂种、品种或品系可以是白肋型、深色型、烘烤型或东方型烟草。烟草杂种、品种或品系可以是普通烟草(Nicotianatabacum)杂种、品种或品系。品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。本文还提供了包含在烟碱脱甲基酶基因座上具有突变等位基因的植物的烟草杂种、品种和品系。在某些实施方案中,烟碱脱甲基酶基因座上的突变等位基因编码选自下述的氨基酸序列:SEQIDNO:2,其中氨基酸329位的色氨酸被终止密码子取代;SEQIDNO:2,其中氨基酸107位的脯氨酸被选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的氨基酸取代;SEQIDNO:2,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;SEQIDNO:2,其中氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代;SEQIDNO:2,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;SEQIDNO:2,其中氨基酸序列含有三个选自I163M,L309E,G353C,Q416L,S423P和S452P的取代;SEQIDNO:2,其中氨基酸P107缺失;SEQIDNO:2,其中至少三个选自I163,L309,G353,Q416,S423和S452的氨基酸缺失;SEQIDNO:2,其中在选自P107,I163,L309,G353,Q416,S423和S452的氨基酸的邻近处插入一个或两个氨基酸;SEQIDNO:2,其中第1至328位中任意位置处的氨基酸被终止密码子取代;SEQIDNO:2,其中第330至457位中任意位置处的氨基酸被终止密码子取代。在一个具体实施方案中,突变等位基因编码的氨基酸序列含有SEQIDNO:2所示序列,其中氨基酸107位的脯氨酸被亮氨酸取代。在其它实施方案中,突变等位基因含有选自下述的核酸序列:SEQIDNO:1,其中核酸+2021位的鸟嘌呤被腺嘌呤取代;SEQIDNO:1,其中核酸+2291位的鸟嘌呤被腺嘌呤取代;SEQIDNO:1,其中内含子中插入剪接供体;SEQIDNO:1,其中内含子中插入剪接受体。在一个具体实施方案中,杂种、品种或品系是普通烟草(Nicotianatabacum)杂种、品种或品系。在另一个实施方案中,品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。在某些其它实施方案中,本发明涉及产生烟草植物的方法。在具体实施方案中,产生烟草植物的方法包括:在Nicotiana属物种的细胞中诱导突变,由所述细胞获得一种或多种植物,鉴定出至少一种烟碱脱甲基酶基因中具有至少一个突变的所述植物。在其它实施方案中,该方法还包括:使烟碱脱甲基酶基因中具有所述的至少一个突变的植物与第二种Nicotiana属植物杂交;选择具有烟碱脱甲基酶基因突变的杂种后代。在某些实施方案中,突变包括:编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸329位的色氨酸被终止密码子取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸107位的脯氨酸被选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的氨基酸取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸序列含有三个选自I163M,L309E,G353C,Q416L,S423P和S452P的取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸P107缺失;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中至少三个选自I163,L309,G353,Q416,S423和S452的氨基酸缺失;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中在选自P107,I163,L309,G353,Q416,S423和S452的氨基酸的邻近处插入一个或两个氨基酸;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中第1至328位中任意位置处的氨基酸被终止密码子取代;编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中第330至457位中任意位置处的氨基酸被终止密码子取代;含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中核酸+2021位的鸟嘌呤被腺嘌呤取代;含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中核酸+2291位的鸟嘌呤被腺嘌呤取代;含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中内含子中插入剪接供体;含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中内含子中插入剪接受体。在具体实施方案中,对Nicotiana属种植物种子的细胞进行诱变。在一些实施方案中,第二种烟草植物表现出表型性状,例如疾病抗性、高产量、高等级指标、调制特性、调制质量、机器可采收性、固定能力、烟叶品质、高度、植物成熟度(例如早熟、早熟至中熟、中熟、中熟至晚熟、或晚熟)、叶柄大小(例如小、中或大叶柄)、或每株植物长出的叶的数目(例如叶的数目少(如5-10片叶)、中等(如11-15片叶)或多(如16-21片叶))。在其它实施方案中,方法还包括用能用于生产杂种或雄性不育杂种的花粉供体对雄性不育花粉受体进行自花传粉或传粉。雄性不育花粉受体植物或花粉供体植物的烟碱脱甲基酶基因座具有突变等位基因。在一些实施方案中,这两种植物的烟碱脱甲基酶基因座的等位基因都是突变等位基因。本文还提供了经调制的烟草材料(curingtobaccomaterial)。在某些实施方案中,经调制的烟草从包含具有烟碱脱甲基酶基因突变之植物的杂种、品种或品系制得。在其它实施方案中,烟碱脱甲基酶基因中存在突变的烟草植物具有非-转变者表型。在其它实施方案中,与包含含野生型烟碱脱甲基酶基因的植物的相应杂种、品种或品系相比,该植物的后代具有降低的回复突变率。在其它实施方案中,经调制的烟草从含有被RNAi构建体转化之植物的杂种、品种或品系制得,所述构建体含有烟碱脱甲基酶基因或其片段。在其它实施方案中,经调制的烟草从含有被RNAi构建体转化之植物的杂种、品种或品系制得,所述构建体含有选自SEQIDNO:5、SEQIDNO:6、SEQIDNO:7和SEQIDNO:8的核酸序列。在某些实施方案中,通过选自热风管处理法(fluecuring)、晾制法(aircuring)、明火烘烤处理法(firecuring)和晒制法(suncuring)的处理方法来制备经调制的烟草材料。本文还提供了烟草制品。在一个具体实施方案中,烟草制品含有经调制的烟草材料,所述材料得自包含在烟碱脱甲基酶基因座具有突变等位基因之植物的杂种、品种或品系。在其它实施方案中,经调制的烟草制备自含有被RNAi构建体转化之植物的杂种、品种或品系,所述构建体含有烟碱脱甲基酶基因或其片段。在其它实施方案中,经调制的烟草制备自含有被RNAi构建体转化之植物的杂种、品种或品系,所述构建体含有选自SEQIDNO:5、SEQIDNO:6、SEQIDNO:7和SEQIDNO:8的核酸序列。在某些实施方案中,烟草制品是卷烟制品(cigaretteproduct)、雪茄烟制品(cigarproduct)、烟丝制品(pipetobaccoproduct)、无烟烟草制品(smokelesstobaccoproduct)、薄层(film)、薄片(tab)、凝胶(gel)、成型部分(shpaedpart)、烟杆(rod)或泡沫(foam)。本文提供了M1烟草植物及其后代。M1烟草植物的烟碱脱甲基酶基因座上的突变等位基因可以是杂合的,并且能产生后代,其中所述植物的第一代自花传粉后代中的至少一部分表现出非-转变者表型。所述M1烟草植物的后代可回复突变成转变者表型,其回复突变率在统计学上显著低于在所述烟碱脱甲基酶基因座上含有野生型等位基因的相应烟草植物的后代的回复突变率。M1烟草植物可表现出非-转变者表型,并且能产生后代,所述后代可回复突变成转变者表型,其回复突变率在统计学上显著低于在所述烟碱脱甲基酶基因座上含有野生型等位基因的相应烟草植物的后代的回复突变率。在一个具体实施方案中,植物或后代实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。本文还提供了烟草杂种、品种或品系,其中杂种、品种或品系的植物被RNAi构建体转化,所述构建体含有烟碱脱甲基酶基因或其片段,其中与缺乏RNAi构建体的对照烟草杂种、品种或品系的植物相比,所述植物表现出降低的烟碱脱甲基酶基因表达。烟碱脱甲基酶基因或其片段的长度可以是25至500或100至300个核苷酸。烟草杂种、品种或品系可以是白肋型、深色型、烘烤型或东方型烟草。烟草杂种、品种或品系可以是普通烟草(Nicotianatabacum)杂种、品种或品系。品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。杂种、品种或品系可以是普通烟草(Nicotianatabacum)杂种、品种或品系。本文还提供了烟草杂种、品种或品系,其中所述杂种、品种或品系的植物被RNAi构建体转化,所述构建体含有选自SEQIDNO:5,SEQIDNO:6,SEQIDNO:7和SEQIDNO:8的核酸序列,其中与缺乏RNAi构建体的对照烟草杂种、品种或品系的植物相比,所述植物表现出降低的烟碱脱甲基酶基因表达。品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。本文提供了产生烟草植物的方法。所述方法包括:在Nicotiana属植物的细胞中导入RNAi构建体,所述构建体含有烟碱脱甲基酶基因或其片段,由所述细胞获得一种或多种植物,鉴定出至少一种植物,与缺乏RNAi构建体的相应烟草植物相比,该植物表现出降低的烟碱脱甲基酶基因表达。该方法还包括:使含有RNAi构建体的植物与第二种Nicotiana属植物杂交,选择与缺乏RNAi构建体的相应烟草植物相比,表现出降低的烟碱脱甲基酶基因表达的杂种后代。在某些其它实施方案中,本发明涉及产生烟草植物的方法。在具体实施方案中,产生烟草植物的方法包括使得被含有烟碱脱甲基酶基因或其片段的RNAi构建体转化的植物与第二种Nicotiana属植物杂交,并选择具有RNAi构建体的杂种后代。在一些实施方案中,第二种烟草植物表现出表型性状,例如疾病抗性、高产量、高等级指标、调制特性、调制质量、机器可采收性、固定能力、烟叶品质、高度、植物成熟度(例如早熟、早熟至中熟、中熟、中熟至晚熟、或晚熟)、叶柄大小(例如小、中或大叶柄)、或每株植物长出的叶的数目(例如叶的数目少(如5-10片叶)、中等(如11-15片叶)或多(如16-21片叶))。在其它实施方案中,方法还包括用能用于生产杂种或雄性不育杂种的花粉供体对雄性不育花粉受体进行自花传粉或传粉。雄性不育花粉受体植物或花粉供体植物被含有烟碱脱甲基酶基因或其片段的RNAi构建体转化。除非另有说明,本文所用的所有技术和科学术语的含义都与本发明所属
技术领域:
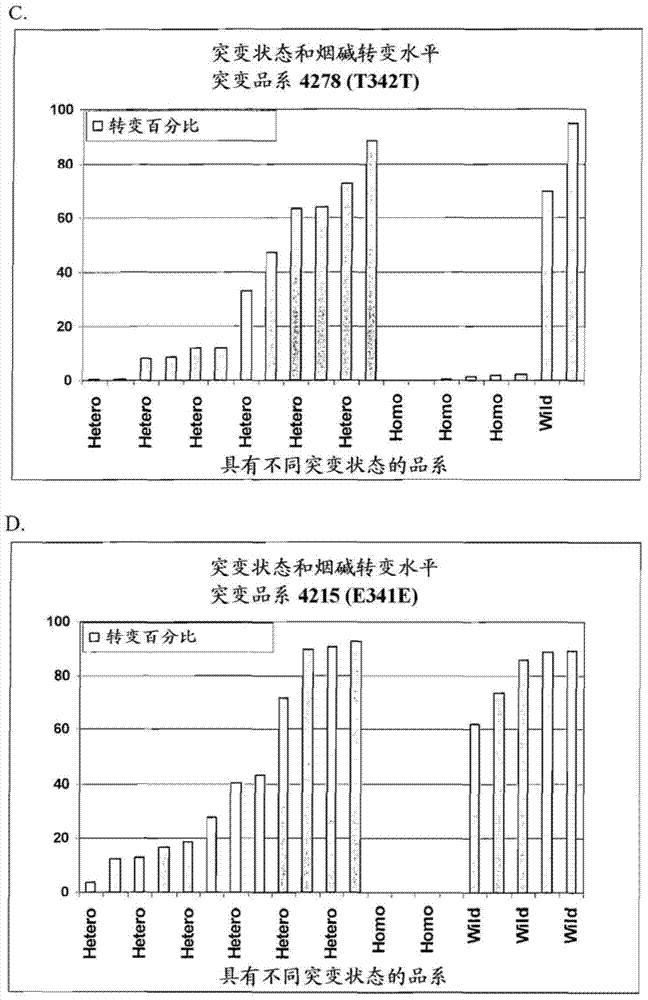
的技术人员通常所理解的含义相同。尽管与本文所述类似或等同的方法和材料可用于本发明的实践中,但是,下文描述了适当的方法和材料。本文提及的所有出版物、专利申请、专利和其它参考文献皆全文列入本文作为参考。当出现抵触时,以本说明书,包括定义为准。此外,本文所述的材料、方法和实施例仅是为了阐明而不是限制本发明。下文中的附图和详细描述部分描述了本发明的一个或多个技术方案的细节。从描述部分和附图以及权利要求书中可明显看出本发明的其它特征、目的和优点。附图描述图1显示了相对于突变状态而言,TN90烟草品系经乙烯处理的烟叶中由气相层析测定的烟碱至去甲烟碱的转变百分比。A:品系4246,B:品系1849,C:品系4278,D:品系4215,E:品系3320和F:品系1394。“杂合(hetero)”表示植物中突变的烟碱脱甲基酶等位基因是杂合的。“纯合(homo)”表示植物中突变的烟碱脱甲基酶等位基因是纯合的。“野生型(wild)”表示植物中野生型烟碱脱甲基酶是纯合的。图2显示了烟碱脱甲基酶核酸序列(SEQIDNO:1)和氨基酸序列(SEQIDNO:2)。左侧是对应于核苷酸序列的编号,右侧是对应于氨基酸序列的编号。使用WebSignalScan程序和序列比对工具鉴定下述内容:底物识别位点(框内),N-末端疏水性跨膜结构域(下划线),富含脯氨酸的区域(斜体下划线),含苏氨酸的氧-结合袋(点状下划线),K-螺旋和PERF共有序列(破折号下划线)和含半胱氨酸的血红素结合区域(黑体双下划线)。图3图解显示了烟碱脱甲基酶RNAi构建体。CsVMV-木薯脉花叶病毒启动子;NDMas-反义烟碱脱甲基酶序列;NDMs-有义烟碱脱甲基酶序列;Ter-Nos终止子;Act2-拟南芥肌动蛋白2启动子;NPTII-新霉素磷酸转移酶II基因。发明详述本发明涉及与烟碱脱甲基酶活性降低的烟草植物相关的组合物和方法。例如,本发明提供了烟碱脱甲基酶基因中含有一个或多个突变的烟草植物。本发明还提供了含有双链RNA的烟草植物,所述RNA含有烟碱脱甲基酶基因的核酸序列。其基因组中含有突变的烟碱脱甲基酶序列的烟草植物或含有双链RNA,其中RNA含有烟碱脱甲基酶基因的核酸序列的烟草植物一般具有降低的去甲烟碱含量。所述植物可用于烟草育种程序、制备经调制的烟草以及制备多种烟草制品和/或烟草衍生制品。烟碱脱甲基酶基因中的突变一般通过在Nicotiana属种的细胞中诱导突变来产生本文所述的烟草植物。术语“诱变”指的是使用诱变剂在个体群中诱导基因突变。被诱变的群体可含有植物、植物部分或种子。对于被诱变的群体而言,针对每种植物组织类型需通过实验来确定诱变化合物或辐射的剂量,以使获得的突变率低于特征在于致死率或生殖不育性的阈值。基于预期的突变率来估计由诱变处理导致的M1代种子的数目或M1植物群体的大小。然后在经诱变的群体或该群体的后代中筛选出由突变导致的合乎需要的性状(例如非-转变者表型)。或者,在经诱变的群体或该群体的后代中筛选出感兴趣的基因,如烟碱脱甲基酶基因中发生的突变。例如,可评价M1植物后代M2代的烟碱脱甲基酶基因中是否存在突变。“群体”是共享同一个基因库的任何个体组合。本文所用的“M0”指的是暴露于诱变剂的植物细胞(和由其培养出的植物),而“M1”指的是由自花传粉的M0植物产生的种子以及由该种子培养出的植物。“M2”是自花传粉的M1植物的后代(种子和植物),“M3”是自花传粉的M2植物的后代,“M4”是自花传粉的M3植物的后代,“M5”是自花传粉的M4植物的后代,“M6”、“M7”等各是自花传粉的上一代植物的后代。本文所用术语“selfed”指的是自花传粉。适当的诱变剂包括例如:化学诱变剂和电离辐射。适于诱导突变的化学诱变剂包括亚硝酸、叠氮钠、丫啶橙、溴化乙锭和甲基磺酸乙酯。适于诱导突变的电离辐射包括X-射线、γ射线、快速中子辐射和UV辐射。其它方法包括使用转座子(Fedoroffetal.,1984;美国专利号4,732,856和美国专利号5,013,658)以及T-DNA插入方法学(Hoekemaetal.,1983;美国专利号5,149,645)。可在烟草基因中诱导的突变类型包括例如点突变、缺失、插入、重复和倒位。在一些实施方案中,通过在导致体细胞克隆变体产生的组织培养中培养植物细胞来诱导突变。或者,利用被开发用于生产杂种植物的使用原生质体融合的标准原生质体培养方法学来生产具有变体基因表达(例如变体烟碱脱甲基酶基因表达)的植物。相应地,由具有变体基因表达的第一和第二种烟草植物产生原生质体。由成功的原生质体融合培养出愈伤组织,然后产生植物。根据本文所述的方法鉴定所得的后代杂种植物并选择变体基因表达,将所述植物用于本文所述的育种方法。本文所用术语“烟碱脱甲基酶基因”指的是编码烟碱脱甲基酶多肽的基因组核酸序列。烟碱脱甲基酶基因包括烟碱脱甲基酶基因座上的编码序列,还包括非编码序列,如调节区、内含子和其它非翻译序列。野生型烟碱脱甲基酶基因可含有SEQIDNO:1所示的核酸序列。本文所用术语“烟碱脱甲基酶多肽”指的是具有烟碱脱甲基酶活性的细胞色素P450CYP82E4多肽。“烟碱脱甲基酶活性”是对烟碱进行N’-脱甲基化以产生去甲烟碱的能力。野生型烟碱脱甲基酶多肽可含有SEQIDNO:2所示的氨基酸序列。如本文(如图2和实施例5)所提供,烟碱脱甲基酶多肽可含有与其它细胞色素P450多肽中的保守结构域具有同源性的区域。例如,经TFSEARCH和WebSignalScan程序鉴定,具有SEQIDNO:2所示序列的多肽含有6个底物识别位点(SRS),一个N-末端疏水性跨膜结构域,一个富含脯氨酸的区域,一个含苏氨酸的氧-结合袋,一个K-螺旋共有序列,一个PERF共有序列和一个含半胱氨酸的血红素结合区域。参见图2。据认为K-螺旋和PERF共有序列可使细胞色素P450多肽的核心结构稳定化。血红素结合区域含有半胱氨酸,该氨基酸在依赖于电子供体的细胞色素P450多肽中绝对是保守的。据认为富含脯氨酸的区域在多肽的跨膜区域和球状部分之间形成铰链。参见例如Werck-ReichhartandFeyereisen(2000)GenomeBiology1:3003。优选烟碱脱甲基酶基因中的突变导致含有突变的植物中的烟碱脱甲基酶活性降低,或甚至完全消失。烟碱脱甲基酶基因中的适当突变类型包括但不限于在野生型烟碱脱甲基酶基因序列中插入核苷酸、缺失核苷酸或进行转换或颠换。编码序列中的突变可导致相应基因产物中一个或多个氨基酸的插入、一个或多个氨基酸的缺失和/或非-保守性氨基酸的取代。在一些情况下,烟碱脱甲基酶基因序列中含有一个以上的突变或一种以上的突变类型。例如,编码序列中插入或缺失氨基酸可以破坏所得基因产物的底物结合袋的构象。氨基酸插入或缺失也可破坏对基因产物活性而言至关重要的催化位点(例如血红素结合位点)。本领域已知:与插入或缺失较小数目的氨基酸相比,插入或缺失较大数目邻接的氨基酸更可能使得基因产物无功能。所述突变的例子是编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因中的突变,所述突变导致氨基酸329位的色氨酸被终止密码子取代。非-保守性氨基酸取代可用不同类氨基酸取代一类氨基酸。非-保守性取代可使基因产物的电荷或疏水性发生实质性变化。非-保守性氨基酸取代也可使残基侧链的体积发生实质性变化,例如用丙氨酸取代异亮氨酸。非-保守性取代的例子包括用碱性氨基酸取代非-极性氨基酸,或用极性氨基酸取代酸性氨基酸。所述突变的例子是:编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因中的突变,所述突变导致氨基酸107位的脯氨酸被亮氨酸取代。在一些实施方案中,烟碱脱甲基酶基因中的突变未导致氨基酸改变(例如沉默突变)。沉默突变是不会影响编码多肽的氨基酸序列的核苷酸序列中的突变。能有效降低烟碱脱甲基酶活性的沉默突变包括SEQIDNO:1所示烟碱脱甲基酶基因中的突变,其中核酸+2021位的鸟嘌呤被腺嘌呤取代,或核酸+2291位的鸟嘌呤被腺嘌呤取代。其它不会导致氨基酸变化的突变可以位于5’非编码区(如启动子或5’非翻译区)、内含子或3’非编码区。所述突变尽管不影响所编码烟碱脱甲基酶的氨基酸序列,但可改变转录水平(例如增加或降低转录)、降低翻译水平、改变DNA或mRNA的二级结构、改变转录或翻译机的结合位点或降低tRNA结合效率。降低或消除烟碱脱甲基酶活性的适当突变包括在烟碱脱甲基酶基因的内含子中插入剪接供体、在内含子中插入剪接受体或缺失内含子的剪接位点所致的突变。在某些实施方案中,通过鉴定烟碱脱甲基酶基因中具有突变的植物并测定烟碱脱甲基酶活性来确定能有效降低烟碱脱甲基酶活性的烟碱脱甲基酶基因突变。在其它实施方案中,基于本文所述突变的效果,例如表1和表3所示的TN90品系4246,1849,4278和4215中所含的那些突变的效果来预测适于降低烟碱脱甲基酶活性的烟碱脱甲基酶基因突变。例如,编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因中的突变可包括用终止密码子取代氨基酸1-328中任一个的突变。在另一个实施方案中,基于相关序列,如SEQIDNO:3和SEQIDNO:4的功能来鉴定能有效降低烟碱脱甲基酶活性的烟碱脱甲基酶基因突变。例如,可以突变烟碱脱甲基酶基因,以使其编码在SEQIDNO:2中具有突变组合的烟碱脱甲基酶多肽,所述突变组合如I163M,K309E,G353C和S452P的组合,或Q416L和S423P的组合。在某些其它实施方案中,基于烟碱脱甲基酶多肽结构的分子模型或序列分析来鉴定能有效降低烟碱脱甲基酶活性的烟碱脱甲基酶基因突变。所述分子模型或序列分析可用于鉴定发生突变时哪些氨基酸会改变多肽的结构或功能。例如,分子模型可用于鉴定底物结合袋中的哪些氨基酸可被缺失或被非保守性的氨基酸取代以降低烟碱至去甲烟碱的转变水平。在另一个例子中,序列分析可确定哪些氨基酸可被终止密码子取代以破坏保守的结构域。例如,编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因中的突变可包括用终止密码子取代氨基酸330-457中的任一个,从而破坏烟碱脱甲基酶的血红素-结合位点的突变。具有突变的烟碱脱甲基酶等位基因的烟草植物由经诱变个体的细胞获得一株或多株M1烟草植物,至少一株植物被鉴定为含有烟碱脱甲基酶基因突变。M1烟草植物烟碱脱甲基酶基因座处突变的等位基因可以是杂合的,由于野生型等位基因的存在,该植物表现出转变者表型,即能将烟碱转变为去甲烟碱。在这种情况下,所述植物第一代自花传粉后代中的至少一部分表现出非-转变者表型。或者,M1烟草植物的烟碱脱甲基酶基因座处可具有突变的等位基因,并表现出非-转变者表型。所述植物可以是杂合的,尽管存在野生型等位基因,但由于显性失活阻抑现象的存在,该植物可表现出非-转变者表型,或者所述植物也可以是纯合的,因为烟碱脱甲基酶基因座处的两个等位基因都有独立诱导的突变。然而,两种类型M1植物的后代可回复突变成转变者表型,但其回复突变率在统计学上显著低于在烟碱脱甲基酶基因座处为野生型的相应烟草植物后代的回复突变率,这一点将在下文中讨论。携有突变的烟碱脱甲基酶等位基因的M1烟草植物可源自Nicotiana属的种,例如普通烟草(Nicotianatabacum),Nicotianaotophora,Nicotianathrysiflora,绒毛烟草(Nicotianatomentosa),茸毛烟草(Nicotianatomentosiformis),Nicotianaafricana,Nicotianaamplexicaulis,Nicotianaarentsii,Nicotianabenthamiana,印度烟草(Nicotianabigelovii),Nicotianacorymbosa,Nicotianadebneyi,Nicotianaexcelsior,Nicotianaexigua,粘毛烟草(Nicotianaglutinosa),Nicotianagoodspeedii,野生烟草(Nicotianagossei),Nicotianahesperis,Nicotianaingulba,Nicotianaknightiana,Nicotianamaritima,Nicotianamegalosiphon,Nicotianamiersii,Nicotiananesophila,Nicotiananoctiflora,Nicotiananudicaulis,Nicotianaotophora,Nicotianapalmeri,Nicotianapaniculata,Nicotianapetunioides,Nicotianaplumbaginifolia,Nicotianarepanda,Nicotianarosulata,Nicotianarotundifolia,黄花烟草(Nicotianarustica),Nicotianasetchelli,Nicotianastocktonii,Nicotianaeastii,Nicotianasuaveolens或沙漠烟草(Nicotianatrigonophylla)。特别有用的普通烟草(Nicotianatabacum)品种包括白肋型、深色型、烘烤型和东方型烟草,如烟草品种BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。携有突变的烟碱脱甲基酶等位基因的烟草植物可用于植物育种程序以产生新的和有用的品系、品种和杂种。因此,在一些实施方案中,将含有至少一个烟碱脱甲基酶基因突变的M1、M2、M3或再下一代的烟草植物与第二种Nicotiana植物杂交,鉴定出存在烟碱脱甲基酶基因突变的杂交后代。应理解第二种Nicotiana植物可以是本文所述的种和品种之一。也应理解第二种Nicotiana植物可含有与其欲杂交的植物相同的烟碱脱甲基酶突变,也可含有不同的烟碱脱甲基酶突变,或者其烟碱脱甲基酶基因座处可以是野生型的。通过已知方法进行育种。DNA指纹分析、SNP或类似的技术可用于标记-辅助的选择(MAS)育种程序,以按本文所述将烟碱脱甲基酶基因的突变等位基因转移或培育至其它烟草中。例如,育种者可使含有突变等位基因的基因型与农学上合乎需要的基因型进行杂交,以产生分离的群体。使用本文所列的一种技术,使用由烟碱脱甲基酶序列或其片段开发出的标记筛选出F2或回交代植物。将被鉴定为含有突变等位基因的植物回交或自花传粉以产生待筛选的第二个群体。根据预期的遗传性状模式或所用的MAS技术,或许有必要在每个回交周期之前对选定的植物进行自花传粉,这样有助于鉴定合乎需要的个体植物。可以重复进行回交或其它育种程序,直至发现回归亲本合乎需要的表型。表现出与普通烟草(Nicotianatabacum)的育种相容性的Nicotiana属种包括:Nicotianaamplexicaulis,PI271989;NicotianabenthamianaPI555478;NicotianabigeloviiPI555485;Nicotianadebneyi;NicotianaexcelsiorPI224063;NicotianaglutinosaPI555507;NicotianagoodspeediiPI241012;NicotianagosseiPI230953;NicotianahesperisPI271991;NicotianaknightianaPI555527;NicotianamaritimaPI555535;NicotianamegalosiphonPI555536;NicotiananudicaulisPI555540;NicotianapaniculataPI555545;NicotianaplumbaginifoliaPI555548;NicotianarepandaPI555552;Nicotianarustica;NicotianasuaveolensPI230960;野烟草(Nicotianasylvestris)PI555569;NicotianatomentosaPI266379;Nicotianatomentosiformis;andNicotianatrigonophyllaPI555572。也可参见AmericanPhytopathologySociety出版的CompendiumofTobaccoDiseases或JapanTobaccoInc出版的TheGenusNicotianaIllustrated。成功的杂交产生能育的F1植物,必要时,该植物能与亲本之一回交。在一些实施方案中,筛选F2代植物群体中的变体烟碱脱甲基酶基因表达,例如,根据标准方法,如通过使用PCR法,鉴定出因缺乏烟碱脱甲基酶基因而不能表达烟碱脱甲基酶的植物,所述PCR法所用引物可基于本文所述的烟碱脱甲基酶核苷酸序列信息。然后使选定植物与亲本之一杂交,使第一代回交(BC1)植物自花传粉以产生BC1F2群体,再次筛选其变体烟碱脱甲基酶基因表达(如烟碱脱甲基酶基因的无效形式)。将回交、自花传粉和筛选的过程重复例如至少4次,直至最终的筛选产生能育的、适当类似于回归亲本的植物。必要时将该植物自花传粉,随后再次筛选后代以进一步证实植物表现出变体烟碱脱甲基酶基因表达(例如显示出烟碱脱甲基酶无效状态的植物),或表现出NDM核酸序列或其片段的变体表达。任选对选定植物进行细胞遗传学分析以进一步证实染色体组和染色体配对关系。使用标准方法产生选定植物的原原种,所述方法包括例如田间试验、证实烟碱脱甲基酶无效状态、对经调制的烟叶进行化学分析以确定生物碱的水平和/或对经调制的烟叶进行化学分析以确定去甲烟碱与烟碱+去甲烟碱的比率。在将由第一种突变的烟草亲本(如TN90)和第二种野生型烟草亲本(如N.rustica)之间杂交所得的原始F1杂种与突变的烟草亲本杂交或回交的情形下,回交的后代可自花传粉以产生BC1F2代,BC1F2代可用于筛选突变的烟碱脱甲基酶等位基因。使用本文所述的突变烟草植物进行植物育种程序的结果是产生新的、有用的品系、杂种和品种。本文所用术语“品种”指的是都具有能将其与相同种(species)的其它植物区分开的恒定特征的植物群体。品种尽管不总是,但是经常能商业购买。在具有一个或多个与众不同的性状的同时,品种的特征还在于品种内部的个体之间存在很小的整体差异。通过几代自花传粉和选择,或使用组织或细胞培养技术由单个亲本进行营养繁殖,即可产生“纯品系”品种。品种实质上可源自另一品系或品种。如国际植物新品种保护条约(1961年12月2日制订,1972年11月10日、1978年10月23日和1991年3月19日修订)所定义,如果满足下述条件,可以说品种“基本上源自”原始品种:a)其主要源自原始品种,或源自主要源自原始品种的品种,同时保留了因原始品种的基因型或基因型组合所致的重要特征的表达;b)其明显不同于原始品种;和c)除了因衍生行为导致的差异外,其在因原始品种的基因型或基因型组合所致的重要特征的表达方面与原始品种一致。通过例如从原始品种植物中选择天然或诱导的突变体、体细胞克隆变体、变体个体,回交或转化,即可获得实质上源自原始品种的品种。与品种有所不同的“品系”最经常地表示非商业化使用,例如用于植物研究的一组植物。品系的个体之间在一个或多个感兴趣的性状上一般不会显示出太大的整体差异,但个体之间在其它性状上可能会有一些差异。通过防止第一个品种的雌性亲本植物(即种子亲本)自花传粉,允许第二个品种的雄性亲本植物的花粉与雌性亲本植物受精,并在雌性植物上形成F1杂种种子,即可产生杂种烟草品种。通过在花发育的早期对花进行去雄即可防止雌性植物的自花传粉。或者,使用雄性不育形式防止雌性亲本植物上形成花粉。例如,通过胞质雄性不育(CMS)、核雄性不育、遗传雄性不育、分子雄性不育(其中转基因抑制了小孢子发生和/或花粉形成)或自交-不亲和性来产生雄性不育性。含有CMS的雌性亲本植物特别有用。在雌性亲本植物是CMS的实施方案中,雄性亲本植物一般含有育性恢复基因以确保F1杂种是可育的。在雌性亲本是CMS的其它实施方案中,可使用不含育性恢复基因的雄性亲本。由这种亲本产生的F1杂种是雄性不育的。雄性不育杂种的种子可与雄性可育的种子间种以在所得雄性不育植物上提供下种用的花粉。本文所述的品种和品系可用于形成单交烟草F1杂种。在这种实施方案中,可将亲本品种的植物培养成基本上为纯系的邻接群体,以便于雄性亲本植物天然异花传粉至雌性亲本植物。通过常规方法选择性收集雌性亲本植物上形成的F1种子。也可以大批量培养两个亲本植物品种,并收集雌性亲本上形成的F1杂种种子和因自花传粉而在雄性亲本上形成的种子的混合物。或者,可进行三源杂交,其中将单交F1杂种用作雌性亲本,并与不同的雄性亲本杂交。或者,可产生双杂交种,其中两个不同单交的F1后代自身进行杂交。当形成双杂交种时,自交-不亲和性对于防止雌性亲本的自花传粉特别有用。本文所用的具有转变者表型的烟草植物是从高至膝盖或更后阶段的烟草植物上收集中间位置的烟叶,经乙烯处理后测得烟碱脱甲基化百分比至少为5%(如4.9%,4.5%,4.2%,4%,3.8%,3.5%,3%,2%,1%,0.8%,0.6%,0.5%,0.05%,0.02%,0.01%或不可测)的烟草植物。术语“具有转变者表型的植物”和“转变者植物”在本文中可互换使用。类似地,具有非-转变者表型的烟草植物是从高至膝盖或更后阶段的烟草植物上收集中间位置的烟叶,经乙烯处理后测得烟碱脱甲基化百分比低于5%(如4.9%,4.5%,4.2%,4%,3.8%,3.5%,3%,2%,1%,0.8%,0.6%,0.5%,0.05%,0.02%,0.01%或不可测)的烟草植物。术语“具有非-转变者表型的植物”和“非-转变者植物”在本文中可互换使用。使用本领域已知的方法(如气相层析)可测定经乙烯处理的烟叶中的烟碱和去甲烟碱。通过用在样品中测得的去甲烟碱的水平除以烟碱和去甲烟碱水平之和再乘以100,即可计算出样品中的烟碱脱甲基化百分比。通过选择或筛选经诱变的植物材料或其后代,即可鉴定出含有烟碱脱甲基酶基因突变的植物。本领域技术人员已知所述筛选和选择方法学。筛选和选择方法学的例子包括但不限于Southern分析,或用于检测多核苷酸的PCR扩增;Northern印迹、S1Rnase保护、引物-延伸或用于检测RNA转录物的RT-PCR扩增;用于检测多肽和多核苷酸的酶或核酶活性的酶解测定法;以及蛋白质凝胶电泳、Western印迹、免疫沉淀和用于检测多肽的酶联免疫测定法。也可使用其它技术,如原位杂交、酶染色和免疫染色来检测多肽和/或多核苷酸的存在或表达。实施上述所有技术的方法都是已知的。可从植物群体中筛选和/或选择出具有因烟碱脱甲基酶基因突变而赋予的合乎需要的性状或表型,如非-转变者表型的群体成员。可在一代或多代中进行选择和/或筛选,这可用于鉴定出具有所需性状的植物。在一些实施方案中,可在M1代中鉴定出具有非-转变者表型的植物。也可在一个以上的地理位置进行选择和/或筛选。另外,可在植物表现出表型的特定发育阶段进行选择和/或筛选。可使用具有非-转变者表型的植物群体来选择和/或筛选具有降低的回复突变率(即转变者表型植物在非-转变者植物的下一代中的百分比)的植物。通过在自花传粉之后收集非-转变者植物产生的种子,种植300至500颗种子,并测定所得的具有转变者表型的植物的数目,即可测定回复突变率。将回复突变率表示为具有转变者表型的后代植物的百分比。对烟碱脱甲基酶基因中具有突变且表现出降低的回复突变率的非-转变者植物进行育种以产生一个或多个烟草杂种、品种或品系,其回复突变率在统计学上显著低于具有相同或类似的遗传背景,但携有野生型烟碱脱甲基酶基因的对照烟草杂种、品种或品系的回复突变率。一般说来,当用适当的参数或非-参数统计学,如Chi-square试验、Student'st-试验、Mann-Whitney试验或F-试验测得p≤0.05时,即可认为相对于对照杂种、品种或品系,回复突变率的降低在统计学上是显著的。在一些实施方案中,当p<0.01,p<0.005或p<0.001时,回复突变率的降低在统计学上是显著的。回复突变率降低的程度一般取决于烟草类型。例如,相对于具有相同或类似的遗传背景,但携有野生型烟碱脱甲基酶基因的白肋型烟草品种而言,烟碱脱甲基酶基因中具有突变的非-转变者白肋型烟草的回复突变率一般降低10X或更高(如10X至1000X,10X至100X,50X至250X,50X至100X,150X至300X,100X至1000X,500X至1000X,800X至5000X,或1500X至10000X)。在另一个实施例中,相对于具有相同或类似的遗传背景,但携有野生型烟碱脱甲基酶基因的深色型烟草品种而言,烟碱脱甲基酶基因中具有突变的非-转变者深色型烟草的回复突变率一般降低2X或更高(如2X至100X,2X至5X,2X至10X,5X至30X,10X至50X,5X至100X,10X至100X,50X至300X,250X至500X,300X至3000X,或3000X至5000X)。在另一个实施例中,相对于具有相同或类似的遗传背景,但携有野生型烟碱脱甲基酶基因的烘烤型烟草品种而言,烟碱脱甲基酶基因中具有突变的非-转变者烘烤型烟草的回复突变率一般降低2X或更高(如2X至10X,5X至30X,10X至50X,10X至100X,50X至150X,100X至500X,200X至800X,400X至1000X,500X至3000X,或1000X至5000X)。在一些情况下,含有烟碱脱甲基酶基因中具有突变的植物的烟草杂种、品种或品系的回复突变率可以很低以至于检测不到。筛选降低的回复突变率的方法可取决于经诱变植物材料的来源。例如,如果经诱变的植物材料是具有转变者表型的植物的种子,适当的筛选方法包括鉴定具有烟碱脱甲基酶基因突变的后代和/或鉴定具有非-转变者表型的后代。一旦鉴定出这种后代,即从中筛选出其后代能表现出降低的回复突变率的植物。在另一个实施例中,如果经诱变的植物材料是具有非-转变者表型的植物的种子,适当的筛选方法包括鉴定具有烟碱脱甲基酶基因突变的后代和/或确定后代是否具有降低的回复突变率。在本文所述方法的一些实施方案中,使用标准的田间方法在田间评价由育种和筛选变体烟碱脱甲基酶基因所得的品系。包括原始的未经诱变的亲本的对照基因型被包括在内,以随机的完全分块设计或其它适当的田间设计来安排各项目。使用标准的烟草农学操作,例如收获烟草、称重、在调制处理之前和过程中取样以进行化学和其它常规检测。对数据进行统计学分析以进一步证实选定品系与亲本品系的相似性。烟碱脱甲基酶RNA干扰适于RNA干扰(RNAi)的转化载体包括那些可产生能形成双螺旋的RNA的载体(如烟碱脱甲基酶RNAi构建体),两个核酸序列中的一个位于有义方向,另一个位于反义方向,它们之间可操作地连接,并处于启动子的控制之下,所述启动子如CaMV35S、分离自木薯棕色条纹病病毒(CBSV)的启动子或分离自木薯脉花叶病毒(CsVMV)的启动子。使用内源性启动子,如烟碱脱甲基酶启动子或其能驱动转录的片段也是合适的。另外,该核酸可与转录终止序列,如胭脂碱合成酶(nos)基因的终止子可操作相连。该构建体中包含的烟草烟碱脱甲基酶核酸序列的长度需至少为22个核苷酸,如至少为22,23,24,25,26,27,30,35,40,50,80,100,200,300,400,500,700,1000,2000或更多个核苷酸,但可包含包括长至全长烟草烟碱脱甲基酶基因的序列。该构建体中包含的烟草烟碱脱甲基酶核酸序列的长度可以为22个核苷酸至2552个核苷酸,如22至100个核苷酸,25至250个核苷酸,25至500个核苷酸,50至100个核苷酸,50至500个核苷酸,100至300个核苷酸,100至500个核苷酸,300至600个核苷酸,500至1000个核苷酸,700至1500个核苷酸,或1000至2000个核苷酸。一般说来,可使用较高的同源性来补偿较短序列的使用。编码双链RNA的核酸构建体所用的适当核酸包括SEQIDNO:5,SEQIDNO:6,SEQIDNO:7和SEQIDNO:8及其互补物,其中所述双链RNA与烟碱脱甲基酶基因类似或相同。能形成双螺旋的RNA可含有环部分。双链RNA的环部分可以是3个核苷酸至5,000个核苷酸,如3个核苷酸至25个核苷酸,15个核苷酸至1,000个核苷酸,20个核苷酸至500个核苷酸,或25个核苷酸至200个核苷酸。RNA的环部分可包括内含子或其片段。适当的环部分包括SEQIDNO:9、SEQIDNO:10和SEQIDNO:11。实用性本文提供的突变和转基因烟草植物对农业特别有用。所述植物可用于本文所述的育种程序,以产生含有具有非-转变者表型的植物的烟草品系、品种或杂种,其中与烟碱脱甲基酶基因为野生型或缺乏烟碱脱甲基酶RNAi构建体的相应烟草品系、品种或杂种相比,所述品系、品种或杂种具有降低的回复突变率。在一些情况下,本文提供的突变或转基因烟草植物可与具有另一个所需性状的植物杂交,以产生既具有降低的回复突变率又具有另一个所需性状的烟草品种。其它所需性状的例子包括耐旱性、疾病抗性、烟碱含量、糖含量、烟叶大小、烟叶宽度、烟叶长度、烟叶颜色、烟叶变红、节间距、开花时间、倒伏抗性、叶柄厚度、烟叶产量、疾病抗性;高产量;高等级指标;调制特性;调制质量;机器可采收性;固定能力;烟叶品质;高度;成熟度;叶柄大小;和每株植物长出的叶的数目。可根据本领域的标准方法对烟草品系、品种或杂种进行育种。在其它情况下,人们可根据已公开的烟碱脱甲基酶突变对具有所述突变的植物表型的影响,寻找并鉴定出在其基因组中的烟碱脱甲基酶基因座上携有天然突变等位基因的烟草植物。所述植物可用于育种程序,以产生含有具有烟碱脱甲基酶基因突变的植物的烟草品系、品种或杂种,其中与具有野生型烟碱脱甲基酶基因的相应烟草品系、品种或杂种相比,所述品系、品种或杂种具有降低的回复突变率。在某些实施方案中,含有具有烟碱脱甲基酶基因突变的植物或含有本文提供的烟碱脱甲基酶RNAi构建体的烟草品系、品种或杂种可用于产生烟草材料以用于制备烟草制品。适当的烟草材料包括完整的烟叶、烟草精制品、烟草粉末、按尺寸制造的烟草薄片、经切割或辊压的烟梗、体积膨胀的烟草和切碎的烟草。可使用本领域已知的调制方法,如晾制法、明火烘烤处理法、热风管处理法(如大批量调制)和晒制法来调制得自已公开的突变烟草植物的烟草材料。在一些实施方案中,烟草材料是陈化和/或经发酵的。参见例如美国专利公开号20050178398。在其它实施方案中,含有具有烟碱脱甲基酶基因突变的植物或含有本文提供的烟碱脱甲基酶RNAi构建体的烟草品系、品种或杂种可用于制备烟草制品,与由得自含有具有野生型烟碱脱甲基酶基因的植物的相应烟草品系、品种或杂种的烟草制得的相应制品相比,所述烟草制品具有降低的去甲烟碱含量。使用本文所述的烟草植物材料可生产亚硝胺含量降低的烟草制品。烟草制品中去甲烟碱的量一般降低至低于约5mg/g。例如,所述制品中的去甲烟碱含量或NNN含量可以为:4.5mg/g,4.0mg/g,3.5mg/g,3.0mg/g,2.5mg/g,2.0mg/g,1.5mg/g,1.0mg/g,750μg/g,500μg/g,250μg/g,100μg/g,75μg/g,50μg/g,25μg/g,10μg/g,7.0μg/g,5.0μg/g,4.0μg/g,2.0μg/g,1.0μg/g,0.5μg/g,0.4μg/g,0.2μg/g,0.1μg/g,0.05μg/g或0.01μg/g。相对于其中所含总生物碱含量而言,次级生物碱的百分比低于90%,如低于70%,50%,30%,10%,5%,4%,3%,2%,1.5%,1%,0.75%,0.5%,0.25%或0.1%。与去甲烟碱或NNN有关的术语“降低量”指的是:按照相同的方法加工,烟草植物或植物组分或烟草制品中去甲烟碱或NNN或这两者的量低于相同烟草品种的野生型烟草植物或植物组分或烟草制品中的相应量,其中后者未为了降低去甲烟碱或NNN而进行转基因,或不具有烟碱脱甲基酶基因突变。在一个实施例中,将按照相同方法加工过的相同品种的野生型烟草植物用作对照,以测定通过本文所述的方法是否已使去甲烟碱或NNN或这两者的量降低。在另一个实施例中,使用标准方法评价亚硝胺含量降低的植物,所述方法包括例如监测基因或基因产物,如烟碱脱甲基酶、转基因或基因中特定突变的存在或缺乏。在另一个实施例中,将由育种程序所得植物的亚硝胺含量与具有降低量亚硝胺的植物育种所用的亲本品系之一的亚硝胺含量进行比较。根据烟草领域众所周知的方法测定去甲烟碱和NNN或这两者的水平。在某些实施方案中,将得自本文所提供的烟草品系、品种或杂种的烟草材料用于制备烟草制品,包括但不限于卷烟制品(如卷烟和比迪卷烟)、雪茄烟制品(如雪茄包裹烟草和小雪茄)、烟斗烟草制品、无烟卷烟制品、无烟烟草制品(如湿鼻烟、干鼻烟和嚼烟)、薄层、嚼烟、薄片、成型部分、凝胶、可消耗单位、不溶性型片、中空模型等。参见例如美国专利公开号2006/0191548。下述实施例将进一步描述本发明,所述实施例不会限制权利要求书所描述的本发明的范围。实施例实施例1-产生突变的Nicotiana植物将1克烟草TN90(Tennessee90)转变者种子(约10,000颗种子)置于0.1%吐温中洗涤15分钟,然后浸入30mlddH2O中2小时。将150μl(0.5%)EMS(Sigma目录号M-0880)与种子/ddH2O溶液混合,于室温(RT,约20℃)在罩下保温8-12小时(30rpm下旋转)。然后从种子中取出液体,使液体与1MNaOH混合过夜以进行净化和处理。用100mlddH2O将种子洗涤两次达2-4小时。然后将经洗涤的种子悬浮于0.1%琼脂:水溶液。将琼脂溶液中经EMS处理过的种子均匀地铺在浅苗床中用水浸泡过的Carolina’sChoiceTobaccoMixTM(CarolinaSoilCompany,Kinston,NC)上,每个苗床铺约2000颗种子。然后用SaranTM包裹物覆盖苗床,将苗床置于培养室中。一旦幼苗从土壤中长出,将SaranTM包裹物刺破,使得湿度逐渐降低。两周后完全除去SaranTM包裹物。将苗床移至温室,用NPK肥料为其施肥。将幼苗插入浮盘培养直至达到可移植的尺寸。将植物移植到田间。在培养过程中,使植物自花传粉以形成M1种子。在成熟阶段,从周围7000株植物的每一株中采集5个蒴果,对每株植物种子的籽苗给出各自的命名,这形成了M1群体。实施例2-鉴定突变培养实施例1中每株M0植物的M1多系种子,收集4至5株M1植物的叶,从混合组织样品中提取DNA。从每个M1品系中取两个混合样品。根据厂商提供的操作手册,使用Dneasy植物微型试剂盒(QIAGEN,目录号69104)提取DNA。设计经IRDyeTM700标记的正向引物和经IRDyeTM800标记的反向引物以扩增烟碱脱甲基酶基因(SEQIDNO:1)。选择两对覆盖了两个独立外显子的序列特异性引物,通过PCR扩增烟碱脱甲基酶(ND)基因。引物F6(5’-GGAATTATGCCCATCCTACAG)和R1(5’-CCAGCATTGCAGGGTTCGGGAAGA)覆盖了ND基因的-82至+1139位核苷酸,并产生1,220个核苷酸长的片段。引物F3(5’-CAGGTAAGGTCTAAAACGTGTGTTTGCTT)和R2(5’-AATAAAGCTCAGGTGCCAGGCGAGGCGCTAT)覆盖了ND基因的+1720至+2549位,并产生830个核苷酸长的片段。通过混合(1:4)经IRDyeTM700标记的引物与未经标记的引物来制备浓度为5μM的正向引物。通过混合(3:2)经IRDyeTM800标记的引物与未经标记的引物来制备浓度为5μM的反向引物。以正向引物:反向引物为2:1的比例来制备贮存引物(总引物浓度为5μM)。使用50–100ng得自混合植物组织DNA样品的基因组DNA和PlatinumTaqDNA聚合酶(Invitrogen,目录号10966-034),对靶区域进行PCR扩增(10μl反应中用2μl引物)。PCR条件如下:94℃2分钟1个循环;94℃1分钟,67℃1分钟,72℃1.5分钟,共40个循环;72℃10分钟1个循环,然后维持于4℃。扩增之后,使样品热变性和重新退火(95℃10分钟,每秒降2℃从95℃降至85℃,每秒降0.1℃从85℃降至25℃,1个循环),从而在突变的扩增子与其野生型配对物之间形成异源双链体。根据试剂盒中推荐的方法,使用SurveyorTM核酶(目录号706025)消化异源双链体。核酶保温条件是42℃20分钟,通过添加终止溶液(试剂盒)来终止反应。通过95℃加热2分钟,用测序加样染料(98%去离子甲酰胺,10mMEDTA(pH8.0),0.025%溴酚蓝)使异源双链体变性。使变性样品在冰上冷却,并上样于变性聚丙烯酰胺凝胶电泳系统。用6.5%KBPlus凝胶进行电泳,在DNA分析仪(Biosciences)上,在装配有0.25mm成层胶的18cm板中跑电泳,电泳条件为:1500-2000V,30mA,50W和45℃3.5小时。在混合样品中具有突变的聚丙烯酰胺凝胶泳道中,在IRDyeTM700红外线染料图像上的野生型条带下方可以看见一条带。在IRDyeTM800红外线染料图像上的相同泳道中可看见配对物条带。该条带是经IRDyeTM800红外线染料标记的从互补DNA链上裂解下来的产物。两个配对物条带的长度和等于扩增子的大小。对图像进行分析之后,鉴定出突变的混合样品(具有迟出条带)。对从其混合样品中检测到突变的各个植物进行第二轮筛选。从阳性品系中提取各个植物DNA,与野生型DNA样品混合以进行第二轮筛选。这有助于分离相同M1库中的野生型和突变植物(包括纯合和杂合突变体)。具有裂解条带的样品含有突变的ND基因序列,而缺乏裂解条带的样品含有野生型ND基因序列。仅使用突变的植物DNA为模板进行第三轮筛选以区分杂合和纯合植物。没有裂解条带的样品是纯合的。使用CEQ8000测序仪(Beckman,Fullerton,California)分析序列痕量信息以进一步证实突变。使用提取的DNA为模板进行PCR扩增以产生ND基因片段用于测序。在1%琼脂糖凝胶上分离PCR产物,纯化并进行测序。测序步骤如下:95℃加热2分钟使DNA变性,随后置于冰上。在冰上使用0.5至10μl变性DNA模板,2μl1.6pmole正向引物,8μlDTCSQuickStartMasterMix(用水将总体积调节为20μl)进行测序反应。热循环程序由30轮下述循环组成:96℃20秒,50℃20秒,60℃4分钟,然后维持于4℃。通过加入5μl终止缓冲液(等体积的3MNaOAc和100mMEDTA以及1μl20mg/ml糖原)以终止序列。用60μl冷的95%乙醇沉淀样品,6000g离心6分钟。弃去乙醇,用200μl冷的70%乙醇将沉淀物洗涤两次。干燥沉淀物,然后加入40μlSLS溶液,重新悬浮沉淀物并用矿物油层覆盖。然后将样品置于测序仪(CEQ8000自动测序仪)中测序。将序列与野生型序列进行比对。另外,对几个选定品系的基因组烟碱脱甲基酶DNA进行测序,以进一步证实每个品系中仅存在烟碱脱甲基酶基因单突变。筛选出700个独立的M1库之后,鉴定出19个突变的品系。表1中列出了每个品系中的突变。表1EMS突变烟草(TN90)中的烟碱脱甲基酶基因突变1nt=SEQIDNO:1中的核苷酸数目,aa=SEQIDNO:2中的氨基酸残基数目。这些突变的品系包括1个具有截短蛋白质的品系(TN90-4246),11个具有单个氨基酸变化的品系(TN90-1849,TN90-1394,TN90-1761,TN90-4281,TN90-1516,TN90-1514,TN90-3320,TN90-3341,TN90-3387,TN90-1804和TN90-1431)和7个具有沉默突变的品系(TN90-1777,TN90-1803,TN90-4264,TN90-1921,TN90-3147,TN90-4278和TN90-4215)。将这些品系移植到田间以进一步对其进行鉴定。将表1所列相同品系的多余M1种子播种至土壤,在温室中培养以筛选出更多的纯合植物并分析生物碱含量。实施例3-测定烟碱脱甲基化植物材料和诱导处理测试田间生长的实施例2中选定的M1突变品系将烟碱转变为去甲烟碱的能力。用0.3%乙烯溶液(PrepbrandEthephon(Rhone-Poulenc))喷洒采自每个处于高至膝盖或更后阶段的M1植物中间位置的烟叶,从而诱导去甲烟碱的形成。将每片喷洒过的烟叶悬挂在装配有加湿器并覆盖有塑料制品的处理架中。在整个处理阶段,用乙烯溶液周期性地喷洒取样的烟叶。乙烯处理约3天之后,收集烟叶并在50℃的炉中干燥,以对生物碱进行气相层析(GC)分析。气相层析生物碱分析按下文所述进行GC生物碱分析:将样品(0.1g)与0.5ml2NNaOH和5ml提取溶液一起以150rpm的转速振荡,所述提取溶液含有喹啉(作为内部标准)以及甲基叔丁基醚。在装配有FID检测器的HP6890GC(HewlettPackard,Wilmington,DE,USA)上分析样品。检测器和注射器的使用温度为250℃。在每分钟10℃的110-185℃温度梯度下使用GC柱(30m-0.32nm-1m),所述柱由与5%苯酚和95%甲基硅交联的融合硅组成。在100℃下,使用氦气为载气,以2μl的注射量、1.7cm3/分钟的流速和40:1的分传比对柱进行操作。用烟碱的量除以烟碱和去甲烟碱的总量再乘以100,即可计算出烟碱脱甲基化百分比。表2显示了8个突变品系中具有非-转变者表型的植物的百分比以及烟碱脱甲基化的平均百分比,所述百分比与所述品系中各个植物的基因突变状况有关,包括纯合突变、杂合突变和纯合野生型。M1代中4个突变品系的烟碱脱甲基化百分比低于5%,将其归类为表现出非-转变者表型,它们是突变品系4246,1849,4215和4278。M1代中的其它4个突变品系的烟碱脱甲基化百分比为5%或更高,将其归类为具有转变者表型,它们是突变品系1394,3320,4264和1924。表2烟碱脱甲基酶突变品系中的烟碱脱甲基化水平图1A-1D显示出突变品系4246,1849,4215和4278的杂合突变体、纯合突变体和纯合野生型M1植物中转变者和非-转变者表型的频率。图1E和1F显示出M1植物中烟碱脱甲基化无差异的突变品系的代表性结果。实施例4-烟碱脱甲基酶突变品系中的RNA表达分析使用半-定量RT-PCR分析两个品系的RNA以测定其mRNA表达。按实施例3所述用乙烯处理各个品系中约20个单独的M1植物,处理3天后提取总RNA。根据厂商的方法使用RNeasyPlantMini(Qiagen,Inc.,Valencia,California)分离总RNA。在液氮下使用经DEPC处理过的研体和研杵将组织样品研磨成细粉末。将约100mg磨碎的组织转移至无菌的1.5mlEppendorf将管置于液氮中直至收集到全部样品。然后,在每个单独的管中加入试剂盒中提供的450μlBufferRLT(添加了β-巯基乙醇)。将样品剧烈涡旋并在56℃保温3分钟。然后将裂解物上样于位于2-ml收集管中的QIAshredderTM自旋柱,以最大速度离心2分钟。收集流出液,在澄清的裂解液中加入0.5倍体积的乙醇。将样品充分混合,转移至位于2-ml收集管中的微型自旋柱。以10,000rpm将样品离心1分钟。接着,将700μl缓冲液RW1移液至柱,以10,000rpm离心1分钟。将缓冲液RPE移液至新收集管内的柱,以10,000rpm离心1分钟。将缓冲液RPE再次加入自旋柱,以最大转速离心2分钟以干燥膜。为了消除任何乙醇残留,将膜置于独立的收集管中,再以最大转速离心1分钟。将柱转移至新的1.5ml收集管中,使40μl无RNase的水直接移液至膜。以10,000rpm将最终的洗脱管离心1分钟。通过变性甲醛凝胶和分光光度计分析总RNA的质和量。根据厂商说明(Invitrogen,Carlsbad,California),使用SuperScriptTM逆转录酶生产第一链cDNA。将约100ng总RNA用于第一链cDNA生产。用各为100pmole的正向和反向引物进行RT-PCR。反应条件为:94℃2分钟,然后94℃1分钟、67℃1分钟、72℃3分钟共40个PCR循环,接着72℃单次延伸10分钟。通过1%琼脂糖凝胶电泳来分析50微升经扩增的样品。用溴化乙锭染色琼脂糖凝胶,基于条带的强度将存在的NDRNA的量分类为少量或大量。切下选定的样品,并从琼脂糖凝胶中纯化出该样品。按上文所述通过CEQ8000对纯化的DNA进行测序。实施例5-烟碱脱甲基酶序列分析使用TFSEARCH程序(cbrc.jp/htbin/nph-tfsearch)和WebSignalScan程序(dna.affrc.go.jp/sigscan)对SEQIDNO:2所示氨基酸序列进行分析,以鉴定出调节区元件(如TATA和CAAT盒)、器官-特异性元件和WRKY元件。如图2所示,分析表明:SEQIDNO:2在氨基酸108-129,212-220,249-256,312-326,380-390和491-497处含有6个底物识别位点(SRS),在氨基酸9-20处含有N-末端疏水性跨膜结构域,在氨基酸34-38处含有富含脯氨酸的区域,在氨基酸346-351处含有含苏氨酸的氧-结合袋,在氨基酸353-356处含有K-螺旋共有序列,在氨基酸430-433处含有PERF共有序列,在氨基酸450-459处含有含半胱氨酸的血红素-结合区域。实施例6-烟碱脱甲基酶突变品系的烟碱转变稳定性使用筛选出的低转变者(LC)经认证的商业品种(TN90-LC),以其高转变者对应品种(TN90-C)为对照,对选定的M2突变品系4246-8和1859-8B进行大规模田间试验。筛选出的LC认证品种可商购自F.W.RickardSeeds(Winchester,Kentucky)。筛选出的LC认证种子采集自由筛选出的LC原种培养出的植物。筛选出的LC原种采集自预先从中除去了烟碱转变水平高于3%的植物,并除去了其在除去烟碱转变水平高于3%的植物之前产生的任何花或蒴果的烟草植物群体。通过M1纯合突变植物的自花传粉产生了两个M2突变品系4246-8和859-8B。在3个田间试验中培养这些品系,总的株数为每个品系约200株植物。检测田间生长的植物将烟碱转变为去甲烟碱的能力。如实施例3所述,用乙烯处理每个M2植物中间位置的烟叶。如实施例3所述,用乙烯处理约3天后,收集烟叶,并在50℃的炉中干燥,以对生物碱进行气相层析(GC)分析。表3显示了相对于商业LC品系和转变者对照而言,M2突变品系中的烟碱转变稳定性。突变品系4246-8的烟碱转变百分比平均为1.9%,其中没有植物被归类为高转变者。突变品系1849-8B的烟碱转变百分比平均为2.1%,其中总共214株植物中有3株植物被归类为高转变者。LC和转变者品系的烟碱转变平均百分比分别为6.6%和80.6%,其中分别有24%和100%的植物被归类为高转变者。M3代具有类似的低转变频率,这表明突变品系中的低-转变者表型具有稳定性。表3烟碱脱甲基酶突变M2品系、筛选出的低转变者和转变者对照中的烟碱脱甲基化水平实施例7-检测烟碱脱甲基酶突变品系中烟草特异性亚硝胺的形成按实施例6所述,使用筛选出的低转变者(LC)经认证的商业品种(TN90-LC),以其高转变者对应品种(TN90-C)为对照,对选定的M2突变品系4246-8和1859-8B进行大规模田间试验。将实施例6中经田间培养的植物培养至成熟,收集这些植物,使用标准的烟草生产实践对其进行晾制。通过气相-层析-TAE分析来分析烟草化学。表4显示了相对于LC和转变者对照而言突变品系中的烟草特异性亚硝胺(TSNA)含量。突变品系中直接衍生自去甲烟碱的N-亚硝基去甲烟碱(NNN)含量以及总TSNA含量低于TN90-LC和TN90-转变者品系中的相应含量。表4晾制的白肋烟草突变品系中N-亚硝基去甲烟碱(NNN)和总烟草特异性亚硝胺(TSNA)水平品系NNN(ppm)总TSNA(ppm)4246-80.70.91849-8B0.80.9TN90空白载体1.61.9TN90-LC1.61.6TN90-C(高转变者)5.55.6实施例8-烟碱脱甲基酶RNA干扰使用烟碱脱甲基酶核酸序列(SEQIDNO:1)的片段构建Ti烟碱脱甲基酶RNA干扰(RNAi)构建体,以使每个烟碱脱甲基酶RNAi构建体含有木薯脉花叶病毒启动子(CsVMV),如图3所示,所述启动子与相对于该启动子而言位于反义方向上的烟碱脱甲基酶核酸片段(SEQIDNO:5,SEQIDNO:6,SEQIDNO:7或SEQIDNO:8)可操作相连,接着是环序列,各个片段的互补序列和Nos终止子。每个烟碱脱甲基酶RNAi构建体含有与拟南芥肌动蛋白2启动子和Nos终止子可操作相连的新霉素磷酸转移酶II基因,参见图3。表5中显示了烟碱脱甲基酶RNAi构建体中存在的序列。表5用于构建烟碱脱甲基酶RNAi构建体的核酸序列使用标准的农杆菌转化将每个烟碱脱甲基酶RNAi构建体导入NarrowLeafMadole深色型烟草和TN90白肋烟草。简单地说,将4周龄无菌生长植物的叶组织切成碎片,在含有根瘤农杆菌(菌株LB4404)的液体培养基中与所需构建体一起保温。在不含抗生素的基础培养基上使组织生长2天以增强组织感染。第3天,将组织铺于含有可用于选择转化体的卡那霉素(300mg/L)和可杀死残余根瘤农杆菌的Cetofexin(500mg/L)的培养基上。每周更换一次培养基直至长出愈伤组织。将得自愈伤组织的小苗转移至生根培养基进行生根,随后,将生根的小植株移植至含有商购土壤混合物的4英寸坛中。在温室内将植物培养至成熟并进行自花传粉。本文所用的“R0”指的是用外源核酸转化的植物细胞(和由其长出的植物),而“R1”指的是由自花传粉的R0植物产生的种子以及由该种子培养出的植物。“R2”是自花传粉的R1植物的后代(种子和植物),“R3”是自花传粉的R2植物的后代,“R4”是自花传粉的R3植物的后代。“R5”是自花传粉的R4植物的后代。“R6”,“R7”等各是上一代自花传粉植物的后代。筛选和再生转基因品系使原始转化体自交产生的R1种子萌发,并在含有300mg/L卡那霉素的培养基中培养。萌发后2-3周,当敏感的小苗萎黄并且不能长出真叶时,测定卡那霉素抗性和敏感小苗的数目。使用这些数据来鉴定分离模式。在温室内将卡那霉素抗性植物培养至成熟并进行自花传粉。从每个植物中收集种子,播种于含有卡那霉素的培养基以确定哪个R1植物的转基因是纯合的。将每个转基因RNAi品系的种子种植于田间,测定其烟碱至去甲烟碱的转变,针对每个烟草品种与三个对照进行比较:1.含有空白载体(即缺乏烟碱脱甲基酶核酸片段、环序列和烟碱脱甲基酶片段互补序列的载体)的烟草植物;2.可商购的LC品系植物(即针对NarrowLeafMadole转基因植物的NarrowLeafMadoleLC认证种子(F.W.RickardSeeds,Winchester,Kentucky)和针对TN90转基因植物的TN90-LC认证种子);和3.高转变者品系的植物(即针对NarrowLeafMadole转基因植物的181CK和针对TN90转基因植物的TN90-C)。如果深色型烟草植物的转变率为3%或更高,则将其鉴定为转变者。如果白肋型烟草植物的转变率为5%或更高,则将其鉴定为转变者。结果示于表6和7。表6转基因NarrowLeafMadole深色型烟草中烟碱至去甲烟碱的转变表7转基因TN90白肋型烟草中烟碱至去甲烟碱的转变使用定量RT-PCR测定相对于TN90-LC中的烟碱脱甲基酶RNA表达而言的烟碱脱甲基酶RNA表达。结果示于表8。表8相对的NDMmRNA表达烟草品系相对于TN90-LC的NDMmRNA表达NarrowLeafMadoleIN50.1NarrowLeafMadole2IN0.1NarrowLeafMadole2IN-1不可测TN902AT0.1TN90G2不可测TN90-LC1.0TN90-C(高转变者)3.1181CK(高转变者)6.6实施例9-在烟碱脱甲基酶RNAi品系中检测烟草特异性亚硝胺形成使用各个被空白载体转化的品种、各个筛选出的低转变者(LC)认证商业品种(即NarrowLeafMadoleLC和TN90-LC)以及各个高转变者相应品种(即181和TN90-C)作为对照,用选定的NDMRNAi品系NLM-IN5-44,NLM-IN5-52,NLM-2IN-22,NLM-2IN-38,NLM-2AT-33,NLM-2AT-32,NLM-3AT-11,TN90-IN5-14,TN90-IN5-22,TN90-2IN-12,TN90-2AT-4,TN90-2AT-5和TN90-G2-7进行大规模田间试验。按实施例7所述产生LC种子。使用由R1纯合转基因植物自花传粉而产生的6个RNAiTN90品系和8个RNAiNarrowLeafMadole品系来测定烟草特异性亚硝胺(TSNA)水平。在3次田间试验中将每个品系约200株植物培养至成熟。收集这些植物,使用标准技术,按表9-11所示对其进行加工处理。通过气相-层析-TAE分析来分析烟草化学。表9-11显示出与空白载体、LC和转变者对照相比较的RNAi品系的N-亚硝基去甲烟碱水平和总烟草特异性亚硝胺(TSNA)水平。该数据表明:NDMRNAi品系中的N-亚硝基去甲烟碱(NNN)水平和总TSNA水平低于对照品系中的相应水平。表9明火烘烤的深色型烟草RNAi品系中的NNN和总TSNA水平品系载体NNN(ppm)总TSNA(ppm)NLM-IN5-44pGen-RNAi1-IN0.1961.003NLM-IN5-52pGEN-RNAi1-IN0.191.069NLM-2IN-22pGen-RNAi3-IN0.3371.22NLM-2IN-38pGEN-RNAi3-IN0.3381.414NLM-2AT-33pGen-RNAi2-AT0.2881.113NLM-2AT-32pGEN-RNAi2-AT0.2541.321NLM-3AT-11pGEN-RNAi4-AT0.3231.428NLM-G2-2pGEN-RNAi1-gus0.3181.456NLM-载体空白载体0.7911.606NLMadoleLC--0.9522.041181CK--18.69620.488表10晾制的深色型烟草RNAi品系中的NNN和总TSNA水平品系载体NNN(ppm)总TSNA(ppm)NLM-IN5-44pGen-RNAi1-IN0.0930.254NLM-IN5-52pGEN-RNAi1-IN0.1860.567NLM-2IN-22pGen-RNAi3-IN0.1950.595NLM-2IN-38pGEN-RNAi3-IN0.1660.394NLM-2AT-33pGen-RNAi2-AT0.2050.762NLM-2AT-32pGEN-RNAi2-AT0.1120.439NLM-3AT-11pGEN-RNAi4-AT0.1420.373NLM-G2-2pGEN-RNAi1-gus0.1650.681NLM-载体空白载体3.6735.597NLMadoleLC--0.6171.167181CK--8.75610.909表11晾制的白肋型烟草RNAi品系中的NNN和总TSNA水平品系载体NNN(ppm)总TSNA(ppm)TN90-IN5-14pGen-RNAi1-IN0.2390.365TN90-IN5-22pGEN-RNAi1-IN0.5731.689TN90-2IN-12pGen-RNAi3-IN0.7080.785TN90-2AT-4pGEN-RNAi2-AT0.3350.472TN90-2AT-5pGen-RNAi2-AT0.4350.763TN90-G2-7pGEN-RNAi1-gus0.8921.091TN90-载体空白载体1.6351.869TN90LC--1.5521.606TN90C--5.5235.572实施例10-烟碱脱甲基酶突变和RNAi品系的表型特征按实施例7和9所述,在大规模田间试验中将烟碱脱甲基酶突变和RNAi品系培养至成熟。测定植物高度、烟叶长度、烟叶宽度和产量。结果示于表12-14。表12深色型烟草RNAi品系的表型特征表13白肋烟草RNAi品系的表型特征表14白肋烟草突变品系的表型特征其它实施方案应理解尽管结合其详细描述部分已描述了本发明,但前述的内容只是为了阐明而不是限制本发明的范围,本发明的范围由所附权利要求书的范围来限定。其它方面、优点和改动都包含在权利要求书的范围之内。本申请涉及以下项:1.烟草杂种、品种或品系,包括具有烟碱脱甲基酶基因突变的植物,所述植物表现出非-转变者表型,其中与含有具有野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,所述植物的后代的回复突变率至少降低2倍。2.项1的烟草杂种、品种或品系,其中所述杂种、品种或品系含有白肋型烟草植物。3.项2的烟草杂种、品种或品系,其中与含有具有野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,所述后代的回复突变率降低10倍至1000倍。4.项1的烟草杂种、品种或品系,其中所述杂种、品种或品系含有深色型烟草植物。5.项4的烟草杂种、品种或品系,其中与含有具有野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,所述后代的回复突变率降低2倍至100倍。6.项1的烟草杂种、品种或品系,其中所述杂种、品种或品系含有烘烤型烟草植物。7.项6的烟草杂种、品种或品系,其中与含有具有野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,所述后代每一代回复突变成转变者表型的频率降低2倍至100倍。8.项1的烟草杂种、品种或品系,其中所述杂种、品种或品系含有东方型烟草植物。9.项8的烟草杂种、品种或品系,其中与含有具有野生型烟碱脱甲基酶基因的植物的相应烟草杂种、品种或品系的回复突变率相比,所述后代每一代回复突变成转变者表型的频率降低2倍至100倍。10.项1的杂种、品种或品系,其中所述杂种、品种或品系是品种。11.烟草杂种、品种和品系,包括在烟碱脱甲基酶基因座上具有突变等位基因的植物,所述突变等位基因编码选自下述的氨基酸序列:a)SEQIDNO:2,其中氨基酸329位的色氨酸被终止密码子取代;b)SEQIDNO:2,其中氨基酸107位的脯氨酸被选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的氨基酸取代;c)SEQIDNO:2,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;d)SEQIDNO:2,其中氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代;e)SEQIDNO:2,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;f)SEQIDNO:2,其中氨基酸序列含有三个选自I163M,L309E,G353C,Q416L,S423P和S452P的取代;g)SEQIDNO:2,其中氨基酸P107缺失;h)SEQIDNO:2,其中至少三个选自I163,L309,G353,Q416,S423和S452的氨基酸缺失;i)SEQIDNO:2,其中在选自P107,I163,L309,G353,Q416,S423和S452的氨基酸的邻近处插入一个或两个氨基酸;j)SEQIDNO:2,其中第1至328位中任意位置处的氨基酸被终止密码子取代;k)SEQIDNO:2,其中第330至457位中任意位置处的氨基酸被终止密码子取代。12.项11的杂种、品种或品系,其是普通烟草(Nicotianatabacum)杂种、品种或品系。13.项11的杂种、品种或品系,其是品种。14.项11的杂种、品种或品系,其中所述突变等位基因编码含有SEQIDNO:2所示序列的氨基酸序列,其中氨基酸第107位的脯氨酸被亮氨酸取代。15.烟草杂种、品种和品系,包括在编码烟碱脱甲基酶的基因中具有突变等位基因的植物,所述突变等位基因含有选自下述的核酸序列:a)SEQIDNO:1,其中核酸+2021位的鸟嘌呤被腺嘌呤取代;b)SEQIDNO:1,其中核酸+2291位的鸟嘌呤被腺嘌呤取代;c)SEQIDNO:1,其中内含子中插入剪接供体;d)SEQIDNO:1,其中内含子中插入剪接受体。16.项15的杂种、品种或品系,其中所述杂种、品种或品系是品种。17.项10,13或16中任一项的品种,其中所述品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。18.制备烟草植物的方法,其包括下述步骤:a)在Nicotiana属物种的细胞中诱导突变;b)由所述细胞获得一种或多种植物;c)鉴定出至少一种烟碱脱甲基酶基因中具有至少一个突变的所述植物,所述突变选自:i)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸329位的色氨酸被终止密码子取代;ii)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸107位的脯氨酸被选自丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的氨基酸取代;iii)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;iv)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代;v)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸163位的异亮氨酸被甲硫氨酸取代,氨基酸309位的赖氨酸被谷氨酸取代,氨基酸353位的甘氨酸被半胱氨酸取代,氨基酸416位的谷氨酰胺被亮氨酸取代,氨基酸423位的丝氨酸被脯氨酸取代,氨基酸452位的丝氨酸被脯氨酸取代;vi)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸序列含有三个选自I163M,L309E,G353C,Q416L,S423P和S452P的取代;vii)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中氨基酸P107缺失;viii)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中至少三个选自I163,L309,G353,Q416,S423和S452的氨基酸缺失;ix)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中在选自P107,I163,L309,G353,Q416,S423和S452的氨基酸的邻近处插入一个或两个氨基酸;x)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中第1至328位中任意位置处的氨基酸被终止密码子取代;xi)编码SEQIDNO:2所示氨基酸序列的烟碱脱甲基酶基因,其中第330至457位中任意位置处的氨基酸被终止密码子取代;xii)含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中核酸+2021位的鸟嘌呤被腺嘌呤取代;xiii)含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中核酸+2291位的鸟嘌呤被腺嘌呤取代;xiv)含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中内含子中插入剪接供体;xv)含有SEQIDNO:1所示序列的烟碱脱甲基酶基因,其中内含子中插入剪接受体。19.项18的方法,还包括下述步骤:使所述烟碱脱甲基酶基因中具有所述的至少一个突变的所述植物与第二种Nicotiana属植物杂交;和选择在所述烟碱脱甲基酶基因中具有所述的至少一个突变的所述杂交的后代。20.项18的方法,其中所述细胞位于种子中。21.产生烟草植物的方法,其包括下述步骤:a)提供具有变体烟碱脱甲基酶基因表达的第一种烟草植物和含有所需表型性状的第二种烟草植物;b)使所述第一种烟草植物与所述第二种烟草植物杂交以产生一个或多个F1后代植物;c)收集由所述F1后代产生的种子以用于所述变体烟碱脱甲基酶基因表达;和d)萌发所述种子以产生具有降低的烟碱脱甲基酶基因表达的烟草植物。22.项21的方法,其中所述第一种烟草植物含有具有突变的内源性烟碱脱甲基酶基因。23.项22的方法,其中所述第一种烟草植物含有的突变是:缺失、取代、点突变、易位、倒位、重复或插入。24.项21的方法,其中所述第一种烟草植物含有具有无效突变的烟碱脱甲基酶基因。25.项21的方法,其中所述第一种烟草植物是普通烟草。26.项21的方法,其中所述第一种烟草植物是东方型烟草植物、深色型烟草植物、烘烤型烟草植物、晾制型烟草、Virginia烟草植物或白肋型烟草植物。27.项21的方法,其中所述第二种烟草植物是普通烟草。28.项21的方法,其中所述第二种烟草植物是东方型烟草植物、深色型烟草植物、烘烤型烟草植物、晾制型烟草、Virginia烟草植物或白肋型烟草植物。29.项21的方法,其中所述的所需表型性状选自疾病抗性、高产量、高等级指标、调制特性、调制质量、机器可采收性、固定能力、烟叶品质、高度、成熟度、叶柄大小和每株植物上烟叶的数目。30.项27的方法,其中所述第二种烟草植物是雄性不育品种或雄性不育杂种。31.项30的方法,还包括下述步骤:使步骤(d)中萌发种子产生的所述烟草植物与所述雄性不育品种或雄性不育杂种植物回交。32.经调制的烟草,由项1,11或15之一的杂种、品种或品系制得。33.项32的经调制的烟草,其中通过选自热风管处理法、晾制法、明火烘烤处理法和晒制法的处理方法制备所述烟草。34.烟草制品,含有项32的经调制的烟草。35.项34的烟草制品,其中所述烟草制品选自卷烟制品、雪茄烟制品、烟丝制品、无烟烟草制品、薄层、薄片、凝胶、成型部分、烟杆或泡沫。36.M1烟草植物,其烟碱脱甲基酶基因座上的突变等位基因为杂合基因,其中所述植物的第一代自花传粉后代中的至少一部分表现出非-转变者表型,其中所述M1烟草植物的后代回复突变成转变者表型,其回复突变率在统计学上显著低于在所述烟碱脱甲基酶基因座上含有野生型等位基因的相应烟草植物的后代的回复突变率。37.项36的烟草植物的后代,所述后代在所述烟碱脱甲基酶基因座上具有所述突变等位基因并具有所述非-转变者表型。38.M1烟草植物,其基因组的烟碱脱甲基酶基因座上携有突变等位基因,所述植物表现出非-转变者表型,其后代回复突变成转变者表型,其回复突变率在统计学上显著低于在所述烟碱脱甲基酶基因座上含有野生型等位基因的相应烟草植物的后代的回复突变率。39.项38的烟草植物的后代,所述后代在所述烟碱脱甲基酶基因座上具有所述突变等位基因并具有所述非-转变者表型。40.项36或38的植物,其中所述M1植物是选自下述的品种的植物:BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309,VA359以及实质上衍生自上述任何品种的品种。41.烟草杂种、品种或品系,其中所述杂种、品种或品系的植物被RNAi构建体转化,所述构建体含有烟碱脱甲基酶基因或其片段,与缺乏所述RNAi构建体的对照烟草杂种、品种或品系的植物相比,所述植物表现出降低的烟碱脱甲基酶基因表达。42.项41的烟草杂种、品种或品系,其中所述烟碱脱甲基酶基因或其片段的长度为25至500个核苷酸。43.项41的烟草杂种、品种或品系,其中所述烟碱脱甲基酶基因或其片段的长度为100至300个核苷酸。44.项41的烟草杂种、品种或品系,其含有白肋型烟草植物。45.项41的烟草杂种、品种或品系,其含有深色型烟草植物。46.项41的烟草杂种、品种或品系,其含有烘烤型烟草植物。47.项41的烟草杂种、品种或品系,其含有东方型烟草植物。48.项41的杂种、品种或品系,其是品种。49.项41的杂种、品种或品系,其是普通烟草(Nicotianatabacum)的杂种、品种或品系。50.烟草杂种、品种或品系,所述杂种、品种或品系的植物被RNAi构建体转化,所述构建体含有选自SEQIDNO:5,SEQIDNO:6,SEQIDNO:7和SEQIDNO:8的核酸序列,与缺乏所述RNAi构建体的对照烟草杂种、品种或品系的植物相比,所述植物表现出降低的烟碱脱甲基酶基因表达。51.项50的杂种、品种或品系,其中所述杂种、品种或品系是品种。52.项48或51的品种,其中所述品种实质上源自BU64,CC101,CC200,CC27,CC301,CC400,CC500,CC600,CC700,CC800,CC900,Coker176,Coker319,Coker371Gold,Coker48,CU263,DF911,Galpao烟草,GL26H,GL350,GL600,GL737,GL939,GL973,HB04P,K149,K326,K346,K358,K394,K399,K730,KDH959,KT200,KT204LC,KY10,KY14,KY160,KY17,KY171,KY907,KY907LC,KTY14xL8LC,LittleCrittenden,McNair373,McNair944,msKY14xL8,NarrowLeafMadole,NC100,NC102,NC2000,NC291,NC297,NC299,NC3,NC4,NC5,NC6,NC7,NC606,NC71,NC72,NC810,NCBH129,NC2002,NealSmithMadole,OXFORD207,‘Perique’烟草,PVH03,PVH09,PVH19,PVH50,PVH51,R610,R630,R7-11,R7-12,RG17,RG81,RGH51,RGH4,RGH51,RS1410,Speight168,Speight172,Speight179,Speight210,Speight220,Speight225,Speight227,Speight234,SpeightG-28,SpeightG-70,SpeightH-6,SpeightH20,SpeightNF3,TI1406,TI1269,TN86,TN86LC,TN90,TN97,TN97LC,TND94,TND950,TR(TomRosson)Madole,VA309或VA359。53.产生烟草植物的方法,所述方法包括下述步骤:a)在Nicotiana属植物的细胞中导入RNAi构建体,所述构建体含有烟碱脱甲基酶基因或其片段;b)由所述细胞获得一种或多种植物;c)鉴定出至少一种所述植物,与缺乏所述RNAi构建体的相应烟草植物相比,该植物表现出降低的烟碱脱甲基酶基因表达。54.项53的方法,还包括下述步骤:d)使含有所述RNAi构建体的所述植物与第二种Nicotiana属植物杂交;和e)选择与缺乏所述RNAi构建体的相应烟草植物相比,表现出降低的烟碱脱甲基酶基因表达的所述杂交的后代。55.项21的方法,其中所述第一种烟草植物含有RNAi构建体,所述构建体含有烟碱脱甲基酶基因或其片段。56.经调制的烟草,由项41或50的杂种、品种或品系制得。57.项56的经调制的烟草,其中通过选自热风管处理法、晾制法、明火烘烤处理法和晒制法的处理方法制备所述烟草。58.烟草制品,含有项56的经调制的烟草。59.项58的烟草制品,其中所述烟草制品选自卷烟制品、雪茄烟制品、烟丝制品、无烟烟草制品、薄层、薄片、凝胶、成型部分、烟杆或泡沫。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1