一种提高丙丁梭菌ABE发酵丁醇/丙酮比和丁醇产量的方法与流程
本发明涉及一种提高ABE发酵丁醇/丙酮比和丁醇产量的方法,尤其是一种丙丁梭菌和酿酒酵母混合培养提高丁醇/丙酮比和丁醇产量的ABE发酵方法,属于生物技术领域。
背景技术:
丁醇是一种重要的平台化合物,在化工、塑料、医药、有机合成和印染等行业具有广泛用途。同时,生物丁醇也是一种极具潜力、清洁可再生的新型液态燃料,可作为化石燃料的替代品。发展生物燃料已成为世界各国应对能源危机、减少温室气体排放、改善气候环境的重要措施。丁醇发酵一般分为两个阶段:第一阶段为产酸阶段,丁酸和乙酸大量生成,pH迅速下降;第二阶段为产溶剂阶段,生成的丁酸和乙酸被逐步消耗,丁醇和丙酮开始大量积累,pH逐渐回升。两个阶段之间的过渡称为相转型。利用产溶剂梭菌(Clostridia)和生物质原料发酵生产丁醇受到人们越来越多的关注。在使用产溶剂梭菌发酵生产溶剂的过程中,有三个最为关键的发酵指标,即丁醇产量、丁醇/丙酮比和总溶剂生产效率。由于ABE(Acetone-butanol-ethanol)发酵存在严重的丁醇产物抑制,使用传统丙丁梭菌的间歇式ABE发酵,最终丁醇浓度普遍停留在12–13g/L左右。ABE发酵原位分离耦合技术是该领域的研究热点之一,然而,由于分离耦合技术的成本高、不易操作等缺点,目前工业ABE发酵生产模式仍以传统间歇式为主。为了提高丁醇产量,研究者们通过菌株诱变、分子改造途径展开了一系列工作。上世纪90年代,国外研究者利用亚硝基胍诱变拜氏梭菌,得到丁醇高产菌株C.beijerinckiiBA101,丁醇和总溶剂产量由原始菌株的9g/L和13g/L提高到19g/L和29g/L。通过强化丙酮合成途径上的关键酶—辅酶A转移酶和乙酰乙酸脱羧酶的表达量,丙酮和丁醇产量分别由原始菌株的4.5和9.5g/L提高到8.7和13g/L,总溶剂产量提高57%。ABE发酵中,丁醇占总溶剂比例一般在60%,而另一主要溶剂产物丙酮占30%(即丁醇/丙酮比为2:1)。作为发酵产品,无论从市场价格、还是工业应用前景,丁醇都更胜丙酮一筹。因此,在总溶剂生产强度不变或略有提高的前提下,尽可能地提高丁醇/丙酮比和丁醇产量无疑是提升ABE发酵经济性的有效手段之一。强化胞内还原力NADH的合成强度是提高丁醇/丙酮比的一个潜在、有效方法。在电子往复穿梭传递系统中,由于NADH的合成需要与H2争夺电子和质子,抑制H2生成可以提高NADH合成强度。通过向发酵液中通入少量CO,可以抑制H2合成关键酶—氢化酶的活性、强化NADH合成,丁醇产量可以由4.6g/L提高到7.8g/L,丁醇丙酮比从2.8:1提高到3.6:1(KimBH,BellowsP,DattaR,etal.ControlofcarbonandelectronflowinClostridiumacetobutylicumfermentations:utilizationofcarbonmonoxidetoinhibithydrogenproductionandtoenhancebutanolyields.ApplEnvironMicrobiol,1984,48(4):764-770)。此外,除了直接抑制H2生成,研究者还试图在发酵过程中营造还原性环境,以增强胞内NADH的合成。研究者使用甘油和葡萄糖的混合原料、以及辅助添加1mmol/L的电子载体中性红,发现这一措施能提高胞内NADH的合成强度,使得NADH依赖型关键酶的活性提高;而有机酸合成途径上的部分酶活性则大幅降低,最终丁醇产量提高而丙酮产量降低(GirbalL,VasconcelosI,SaintamansS,etal.HowneutralredmodifiedcarbonandelectronflowinClostridiumacetobutylicumgrowninchemostatcultureatneutralpH.FEMSMicrobiolRev,1995,16(2-3):151-162)。然而,以上提高丁醇/丙酮比或丁醇产量的方法均存在明显的缺陷:或是增加了后续分离纯化(去除色素物质等)的难度,或是以牺牲总溶剂产量为代价。申请人前期研究发现通过适时添加酵母浸粉可提高木薯丁醇传统发酵的丁醇/丙酮比,此方法可以降低木薯原料丁醇发酵产溶剂期内催化有机酸再吸收和丁酸合成的关键酶编码基因ctfAB和buk的转录水平,导致流向丁酸合成/吸收再利用闭环回路的碳流减少,削弱了丙酮合成能力,增强了与丁酸合成竞争碳源的丁醇合成途径的代谢强度。其工艺成功应用于木薯传统发酵、油醇萃取发酵和生物柴油萃取发酵。然而,由于玉米原料丁醇发酵时有机酸合成和再吸收的能力强、有机酸生成/再吸收利用闭环回路的代谢强度高、生成积累的有机酸能够被迅速吸收利用并返回到代谢主途径,强化了丙酮合成路径,最终造成丙酮大量生成。因此,添加酵母浸粉无法提高玉米原料丁醇发酵的丁醇/丙酮比和丁醇产量。目前,混菌发酵技术广泛应用于食品工业、生物能源开发、生物降解和环境保护等领域,并显示出巨大的优势。在ABE丁醇发酵生产方面,研究报道主要是将产丁醇菌与产丁酸菌、产丁醇菌与枯草芽孢杆菌以及不同的丁醇生产菌混合培养以提高丁醇发酵性能。然而,现有混菌培养模式虽然在一定程度上提高了ABE发酵性能,但是丁醇产量并未达到丙丁梭菌的抑制浓度(约13g/L),丁醇/丙酮比也未有明显提高。酿酒酵母是兼性厌氧菌,在丙丁梭菌严格厌氧发酵的恶劣环境下依旧可以生存,并有可能诱发产生一些有利于丁醇合成的物质。本发明利用酿酒酵母和ABE生产菌丙丁梭菌混合培养成功解决了玉米原料传统丁醇发酵中丁醇/丙酮比低、丁醇产量低的问题,与此同时,总溶剂生产效率也有提高。整个发酵操作简单、实用,经济效益明显。
技术实现要素:
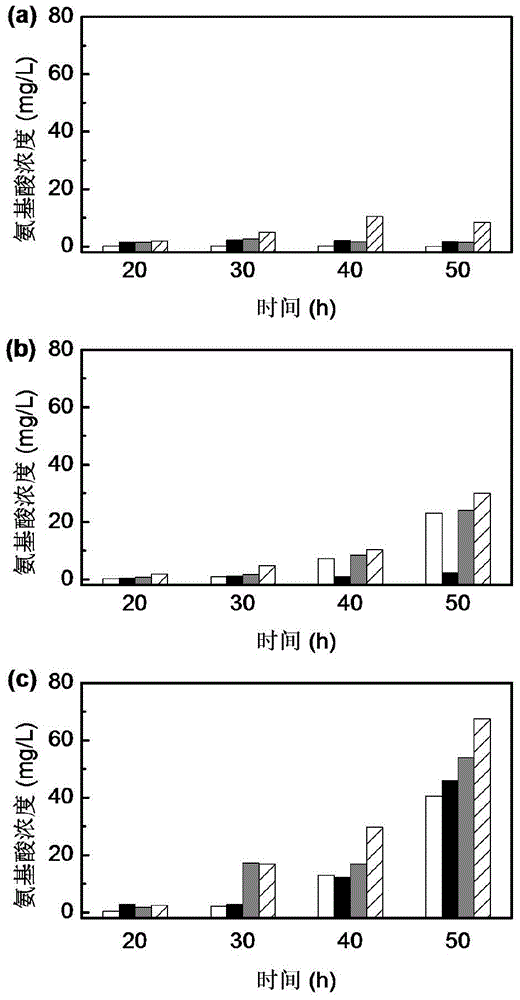
本发明的目标是提供一种丙丁梭菌和酿酒酵母混合培养提高丁醇/丙酮比和丁醇产量的ABE发酵方法。为实现上述目标,本发明采用的技术方案为:在玉米原料、传统丁醇发酵产溶剂期开始后,添加一定量的酿酒酵母,或者同时添加酵母和丁酸溶液,形成丙丁梭菌和酿酒酵母的混合发酵体系,酿酒酵母在严格厌氧环境中仍然可以生存,利用上述混合发酵体系形成更加适合丁醇合成的环境并弱化丁酸闭环回路的代谢强度,提高了丁醇/丙酮比和丁醇产量。所述酿酒酵母可选择市售的安琪超级酿酒酵母,购自安琪酵母股份有限公司。所述丙丁梭菌可选择丙丁梭菌(Clostridiumacetobutylicum)ATCC824。如果仅添加酿酒酵母,酿酒酵母的添加时间为丙丁梭菌(ClostridiumacetobutylicumATCC824)产溶剂期开始(24h左右),表征为产酸期积累的乙酸和丁酸被逐步消耗,pH逐渐上升。接种后的环境为丙丁梭菌和酿酒酵母的混合发酵体系,酿酒酵母在此环境中仍可生存,双菌在这一环境下相互作用,直至发酵结束。先将丙丁梭菌发酵液的pH上调至4.8-5.2,接种8-10%(v/v)的酵母培养液。在本发明的一种实施方式中,将丙丁梭菌发酵液的pH上调至5.0,接种10%的酵母培养液。如果同时添加酿酒酵母和丁酸,将丁酸pH调为5.8-6.2,酵母培养液接种量为8-10%,丁酸的添加量为3.5-4.5g/L。在本发明的一种实施方式中,进入溶剂生产期后,共混添加丁酸和酿酒酵母培养液时,接种10%的酵母培养液,丁酸的添加量为4.0g/L,并将丁酸的pH用3mol/L的氢氧化钠溶液调为6.0。在本发明的一种实施方式中,添加的酿酒酵母培养液的OD600为8.5~9.5,pH为4.4~4.8。在本发明的一种实施方式中,获得酿酒酵母培养液所采用的培养基配方为:葡萄糖20g/L,酵母抽提物8.5g/L,硫酸铵1.3g/L,七水硫酸镁0.1g/L,二水氯化钙0.06g/L,灭菌条件为121℃、20min。将保藏于4℃冰箱中的酿酒酵母斜面转接于装有100mL酵母培养基的500mL三角瓶中,于30℃条件下200r/min、培养24h。在本发明的一种实施方式中,采用的发酵培养基为15%(w/v)玉米粉的双酶水解液。制备方法为:第一步于95℃环境下加入高温淀粉酶,添加量为8U/g-淀粉,液化45min;第二步将第一步水解得到的酶解液冷却至62℃,于62℃条件下添加糖化酶,添加量为120U/g-淀粉,糖化60min;两步水解结束所得到的玉米酶解液即为丁醇发酵培养基。在本发明的一种实施方式中,在7L罐上进行玉米原料丁醇发酵,在产溶剂期开始后接种10%(v/v)活性酿酒酵母,与传统发酵(即对照,无酵母和丁酸添加)相比,丁醇/丙酮比由1.98升至2.22,提高12%,最终丁醇浓度由11.63g/L升至11.91g/L,提高2.4%,发酵时间由65h缩短至53h,缩短12h。在本发明的一种实施方式中,在7L罐上进行玉米原料丁醇发酵,在产溶剂期开始时添加10%(v/v)酿酒酵母和4g/L丁酸的浓缩液(pH=6.0),丁醇/丙酮比、最终丁醇浓度分别提高43%和35%,达到2.83和15.74g/L的最高水平,且发酵时间缩短17h(65→48h),残余丁酸浓度为0.39g/L、大部分外加丁酸得到利用。与此同时,总溶剂生产效率由0.29g/L/h提高至0.52g/L/h,提高了79%,发酵性能大幅提高。本发明的工艺原理:酿酒酵母的正常培养温度为29–31℃、兼性厌氧,丙丁梭菌的培养温度为37℃、偏性(严格)厌氧。当酿酒酵母生存恶劣环境(高乙醇、高丁醇、高糖高盐等)下,酵母自身会产生一系列抵抗因子热休克蛋白、氨基酸、甘油等以维持自身的生存,且甘油是还原性较强的碳物质,积累的甘油有可能会对提高丁醇/丙酮比产生正面影响,但是,测定发酵液中的甘油浓度发现,混菌培养条件下的甘油浓度与传统发酵并没有差异。利用HPLC对不同批次发酵液中的氨基酸浓度进行测量发现:与对照(无酵母和丁酸添加)相比,本发明添加酵母+丁酸发酵批次、发酵过程中的赖氨酸和蛋氨酸浓度不断、明显地增加积累,提高幅度至少达到25倍以上。与此同时,芳香族氨基酸也分别提高了40倍和7倍。综上所述,在添加酵母后,芳香族氨基酸(苯丙氨酸和酪氨酸)、天冬氨酸族氨基酸(赖氨酸和蛋氨酸)的大量、不断的积累提高了丙丁梭菌对高丁醇浓度的耐受能力;与此同时,添加少量丁酸后,丁酸闭环回路代谢强度被弱化。两者共同作用最终导致丁醇产量和丁醇/丙酮比的大幅提高。本工艺的优点:本发明针对玉米原料、传统ABE发酵中丁醇/丙酮比低(约2.0)、丁醇产物抑制严重等问题,利用酿酒酵母和丙丁梭菌形成的复杂混菌体系,获得了较高的丁醇/丙酮比、丁醇浓度、总溶剂浓度和生产效率。这一发明在实施上简单易行、操作成本低,无需额外添加昂贵的氨基酸。酿酒酵母在厌氧环境中产生的乙醇亦是ABE发酵的第三位产物,对ABE发酵综合性能没有负面影响。更加重要的是,工业/生活污水处理中的厌氧消化液中大都含有一定量的丁酸(约10g/L)和乙酸,直接排放会污染环境,去除上述有机酸是废水处理的重要一环。将来,如果可以合理地使用含有丁酸的厌氧消化液对丙丁梭菌-酿酒酵母混菌培养体系进行配料,既可以去除环境废水中的丁酸和乙酸、有效利用废水,又可以提高ABE发酵的综合性能。附图说明图1为玉米丁醇传统发酵和添加10%酿酒酵母+4g/L丁酸的罐发酵过程曲线。其中图1a和图1b为玉米丁醇传统发酵批次;图1c和图1d为添加酿酒酵母和丁酸发酵批次。图2为发酵罐不同发酵模式下氨基酸积累情况的比较。a:对照;b:混菌发酵;c:混菌发酵+丁酸。图中符号从左向右依次为蛋氨酸;赖氨酸;苯丙氨酸;酪氨酸。具体实施方式实施例1玉米丁醇传统发酵菌株活化:将保藏于4℃冰箱的丙丁梭菌(ClostridiumacetobutylicumATCC824)接种于5%(w/v)的玉米醪种子培养基中,用真空泵除空气后于37℃水浴锅中静态培养27h作为发酵种菌。其中,玉米醪种子培养基的制备过程如下:称取25g玉米粉溶于2L水中,在沸水中高温糊化处理直至玉米醪溶液体积为500mL,此即为5%(w/v)的玉米种子培养基,灭菌条件为121℃、50min。发酵培养基为15%(w/v)玉米粉的双酶水解液,制备过程为:第一步于95℃环境下加入高温淀粉酶,添加量为8U/g-淀粉,液化45min;第二步将第一步水解得到的酶解液冷却至62℃,于62℃条件下添加糖化酶,添加量为120U/g-淀粉,糖化60min;两步水解结束所得到的玉米酶解液即为丁醇发酵培养基。所用玉米粉中的淀粉含量约为60%(w/v)。发酵培养模式分为两种类型:(1)厌氧瓶发酵;(2)发酵罐发酵。其中厌氧瓶发酵条件如下:厌氧瓶体积为100mL,初始发酵培养基50mL,在121℃下高压蒸汽灭菌30min;然后置于超净工作台进行接种操作,接种量为10%(v/v),用真空泵抽去厌氧瓶中的残余氧气,置于37℃条件下进行发酵,每隔6h放出厌氧瓶中的气体,直至发酵结束。罐发酵条件如下:发酵罐体积为7L,初始装液量3.5L,在121℃下高压蒸汽灭菌30min;为保证发酵罐中的厌氧环境,在接种前向发酵培养基内通入N2,持续30min;以发酵罐自带的温控系统控制发酵温度于37℃进行接种,接种量为10%(v/v),继续通入N2使发酵罐内压力在0.04–0.045MPa,发酵开始、自产气发生后,停止通气,开始发酵;每1h测量产气量,在发酵过程中适时取样,直至发酵结束。发酵罐在线参数的测定:ORP、pH通过ORP、pH电极在线测定;产气量的测定:利用排水法和NaOH吸收CO2法测定发酵过程中气体(H2和CO2)的生成量;产物的测定:丙酮、丁醇、乙醇、乙酸和丁酸通过气相色谱GC测定。由表1可知,在厌氧瓶中,玉米原料、传统ABE发酵(对照)65h结束,丁醇产量、丁醇/丙酮比和总溶剂生产效率分别为12.52g/L、1.98和0.32g/L/h。在罐发酵中,相应的指标分别为11.63g/L、1.98和0.29g/L/h。在100mL厌氧瓶和7L发酵罐中,丁醇/丙酮比均为2.0左右,和传统ABE发酵的文献和实验数据相吻合。实施例2单一添加酿酒酵母实施例2中菌株活化和发酵条件均和实施例1相同,当发酵进行至24h时,用3mol/L的氢氧化钠溶液上调丁醇发酵液pH至5.0,再向发酵液中一次性添加10%(v/v)的酿酒酵母培养液,直至发酵结束。酿酒酵母的培养基配方为:葡萄糖20g/L,酵母抽提物8.5g/L,硫酸铵1.3g/L,七水硫酸镁0.1g/L,二水氯化钙0.06g/L,灭菌条件为121℃、20min;ABE发酵开始时,将保藏于4℃冰箱中的酿酒酵母斜面转接于装有100mL酵母培养基的500mL三角瓶中,于30℃、200r/min下培养24h,接入ABE发酵液时,酵母培养液OD600为8.5~9.5、pH为4.4~4.8。厌氧瓶和发酵罐操作条件与实施例1相同。参数的测定:相关参数的测定同实施例1。由表1可知,在单一添加10%(v/v)酿酒酵母条件下,两种培养模式(厌氧瓶和发酵罐)丁醇/丙酮比分别提高7%和12%。由于酿酒酵母也能在严格厌氧环境下生成乙醇,总溶剂生产效率分别提高19%和66%。因此,单独添加酿酒酵母对提高ABE发酵中的丁醇/丙酮比和总溶剂生产效率有促进作用。实施例3单一添加丁酸实施例3中菌株活化和发酵条件均和实施例1相同,当发酵进行至24h时,开始脉冲式添加丁酸溶液(pH3.8)。每隔3h进行一次有机酸的添加,每次添加以pH下降0.1为止。并记录下添加前后的天平读数,用以计算有机酸的添加量。添加过程伴随轻微搅拌(搅拌桨转速为100r/min),使加入的有机酸溶液和发酵液迅速混匀,保证发酵液各部分pH均一,添加过程结束后关闭搅拌,丁酸添加总量为4g/L。发酵罐操作条件与实施例1相同。参数的测定:相关参数的测定同实施例1。在丙丁梭菌产溶剂期,脉冲式添加丁酸会适度弱化丙丁梭菌中丁酸闭环途径的代谢强度,从而使得丁醇产量和丁醇/丙酮比的提高。如表1所示,对于罐发酵而言,脉冲式添加3g/L丁酸后,发酵结束时丁醇产量和丁醇/丙酮比达到13.50g/L和2.36。实施例4共混添加酿酒酵母和丁酸实施例4中菌株活化和发酵条件均和实施例1相同,当发酵进行至24h时,向厌氧瓶/发酵罐中添加10%(v/v)酿酒酵母和4g/L丁酸/乙酸(pH=6.0),直至发酵结束。其中酿酒酵母的培养方法和接种条件同实施例2。厌氧瓶和发酵罐操作条件与实施例1相同。其中,添加酿酒酵母和乙酸批次的结果(丁醇/丙酮比)较添加酿酒酵母和丁酸批次的为低,因此其发酵仅在厌氧瓶中进行,添加酿酒酵母和丁酸批次在厌氧瓶和发酵罐中分别实施。参数的测定:相关参数的测定同实施例1。单纯添加酿酒酵母和添加丁酸对于玉米原料、ABE发酵的丁醇/丙酮比均有提高。图1c和图1d是共混添加10%酿酒酵母培养液和4g/L-Broth丁酸的发酵曲线。发酵时间从对照的65h缩短到了48h,丁醇产量提高了35%(11.63g/L→15.74g/L)。ABE发酵的另外两个指标(丁醇/丙酮比和总溶剂生产效率)也大大提高,与对照相比,增加幅度分别为43%和79%,丁醇发酵综合性能大幅度提升。表1不同培养模式下的ABE发酵性能比较虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1