一种发生恶性转化的细胞模型的制作方法
本发明涉及细胞生物学领域,更具体地,本发明涉及一种发生恶性转化的细胞模型。
背景技术:
随着科学技术的发展,新化学物质日益增多,传统的毒理学评价方法面临着新的挑战。传统的食品毒理学主要立足于动物实验,其局限性主要表现在:1)动物实验与人体的相关性不够确定;2)基于高剂量摄入的动物实验结论与实际(低剂量长期暴露)偏差很大;3)观察终点是临床特征或病理学改变,无法检测体内早期变化;4)难以从多受体/信息传递通路和多代谢网络角度解释毒性机制;5)动物实验耗时长、投入大,不利于高通量检测大量化学物的毒性。
近几十年来,随着实验动物使用的3R原则的倡导与实施以及生物医学研究模式的转变,整体动物实验面临严峻挑战,替代动物实验的体外模型研究(主要是基于体外培养的人源细胞模型)已成为毒理学发展的重要方向,基于人源细胞的、以毒性通路为核心的转化毒理学研究方兴未艾。在此背景下,美国国立研究院发布“21世纪的毒性试验:观念和策略”,提出21世纪毒理学测试新技术的概念,指出毒理学试验和风险评价策略重点应放在“毒性作用通路”的基础上,这也需要研究模型从实验动物向人源细胞的转换。
因此发展更新更先进的基于人源细胞系毒性评价系统,既是整个毒理学研究领域的发展方向,也是中国安全性评价工作的现实需求。
技术实现要素:
本发明的目的在于提供一种发生恶性转化的细胞模型。
在本发明的第一方面,提供一种发生恶性转化的细胞,所述细胞在中国典型培养物保藏中心的保藏号为CCTCC NO:C2014243。
在一个优选例中,所述的细胞是由正常细胞诱导获得的。
在另一优选例中,所述的正常细胞是人正常肝细胞。
在另一优选例中,所述的诱导是利用苯并(a)芘进行的细胞诱导。
在本发明的另一方面,提供一种使正常肝细胞发生恶性转化的方法,所述方法包括:在正常肝细胞的培养基中加入100±10nM苯并(a)芘,以苯并(a)芘持续刺激30±5天,分离存活细胞。
在一个优选例中,所述的方法是非诊断或治疗方法。
在另一优选例中,所述的方法是体外方法。
在另一优选例中,所述的存活细胞是形态显著不同于亲代正常肝细胞,且呈现更强生长能力的细胞。
在另一优选例中,所述的正常肝细胞是肝细胞系HL-7702。
在本发明的另一方面,提供所述的细胞的用途,用于作为细胞模型:
研究苯并(a)芘的致病作用、生物学效应与分子机制;或
筛选抑制细胞发生恶性转化的药物。
在一个优选例中,所述的抑制细胞发生恶性转化包括:抑制细胞生长,抑制细胞的克隆形成能力,抑制细胞迁移。
在另一优选例中,所述的用途是非诊断或治疗用途。
在另一优选例中,所述的细胞模型是体外的细胞培养物模型。
在本发明的另一方面,提供一种用于研究苯并(a)芘的致病作用、生物学效应与分子机制或筛选抑制细胞发生恶性转化的试剂盒,所述的试剂盒中包括容器,以及装于容器中的所述的细胞。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
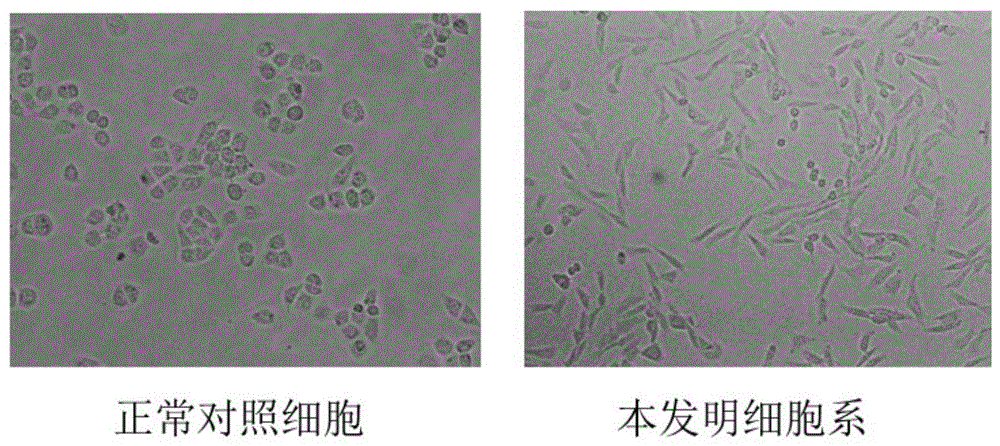
图1、本发明筛选获得的细胞与人源肝正常细胞系HL-7702的细胞形态对比图。
图2、本发明筛选获得的细胞与人源肝正常细胞系HL-7702的细胞生长曲线。
图3、本发明筛选获得的细胞与人源肝正常细胞系HL-7702的锚定依赖的克隆形成能力的比较。
图4、本发明筛选获得的细胞与人源肝正常细胞系HL-7702的锚定非依赖的克隆形成成能力的比较。
图5、本发明筛选获得的细胞与人源肝正常细胞系HL-7702的细胞迁移能力的比较。
具体实施方式
本发明人经过深入的研究,首次基于人源正常肝细胞,开发出一种新的、发生苯并(a)芘诱导的恶性转化的细胞系(CCTCC NO:C2014243)。该细胞系是经低浓度苯并(a)芘(Benzo(a)pyrene;3,4-Benzypyrene)长期刺激后筛选获得的,其发生了稳定的恶性转化。
苯并芘是一种多环芳香族碳氢化合物,是常见的食品和环境污染物,谷类食物、蔬菜、脂肪和油类是摄入“苯并芘”的主要膳食来源;油炸烟熏烧烤的食物含量较高。苯并芘一般来源于有机染料的不完全燃烧,常在烟草烟雾及汽车尾气中被检测到,被国际癌症研究机构(IARC)列为I类致癌物。
虽然已经将苯并芘列为致癌物质,但目前现有技术中,基于苯并芘的研究基本上以动物模型为主,这是由于较难以获得由苯并芘导致的、但能稳定存活、且发生稳定的恶性转化的细胞模型。
本发明人在进行了长期而大量的筛选工作后,意外地分离到一个苯并(a)芘诱导后仍然稳定存活,且发生稳定的恶性转化的细胞系。与源细胞相比,该细胞系具有异常快速的生长能力,说明苯并(a)芘的持续刺激改变了其分裂增殖能力;该细胞系的锚定依赖的克隆形成能力显著增加,说明苯并(a)芘的持续刺激促进了细胞的异常快速生长;该细胞系的锚定非依赖的克隆形成能力显著增加,说明苯并(a)芘的持续刺激还促进了锚定非依赖的细胞生长,这是肿瘤细胞的一个重要特征;该细胞系的迁移能力显著增加,说明苯并(a)芘的持续刺激促进了细胞的迁移,而细胞迁移能力不仅参与了肿瘤发生也参与了肿瘤转移等过程。
因此,与正常肝细胞相比,本发明筛选获得的细胞系发生了一定程度恶性转化,本发明细胞系表现出与源细胞不同的细胞特征和表型,这些差异可以反映出苯并芘(含苯并(a)芘)对细胞不同方面的作用以及这些作用对肿瘤发生发展进程的影响。本发明筛选获得的细胞系具有典型的肿瘤细胞的特征。
本发明的细胞系可用于研究苯并芘对肿瘤发生发展的影响,包括早期效应、分子信号通路、作用机制等。与现有模型相比,本发明细胞系用作细胞模型,具有以下优势:
1)人源化,更能反映人体实际情况;
2)长期暴露,更能反映现实暴露环境;
3)细胞模型,更加易于研究信号通路和早期分子效应;
4)培养方便,适合大规模培养,可以满足高通量检测的需要。
利用本发明的细胞系(细胞模型),可以在细胞分子水平研究苯并芘(含苯并(a)芘)的不良生物学效应,这更加易于阐明苯并芘在产生机体毒性之前的早期毒理学效应,也更加易于阐明苯并芘的毒性分子作用机制,从而便于发展更加有针对性的保护措施以及开发新的生物标志物。
此外,利用人源细胞系,可以排除传统动物实验带来的物种差异,更加能够反映人体真实情况。
因此,本发明细胞系作为一种新的细胞模型,对于研究苯并芘对人体的健康效应尤其是早期健康效应和相关分子作用机制,具有重要的应用价值。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料和方法
1、细胞复苏、培养与冻存
复苏细胞时,于液氮中取出冻存的细胞,迅速置37℃水浴,不断晃动冻存管使细胞快速融解,然后将细胞转入培养皿中加入正常培养基进行培养过夜,细胞贴壁后换液继续培养,待细胞生长至90%密度时传代。细胞冻存时,选生长状态好、生长旺盛的细胞用PBS洗细胞两次后,用胰酶消化至细胞变圆,用含10%胎牛血清的正常培养基终止反应,细胞800rpm离心5分钟后弃上清,加入冻存液。
细胞培养基:RPMI-1640培养基,含10%胎牛血清、1%青霉素和链霉素。
培养条件:95%空气、5%二氧化碳、37℃。
冻存液成分:10%DMSO,90%小牛血清。将细胞分装于冻存管中,放于程序降温盒中保存于-80℃超低温冰箱中,24小时后转移至液氮中。
2、细胞生长曲线测定
将培养状态良好的细胞用胰酶消化并计数,按照每孔200μL细胞悬液中含有4000个细胞的标准将细胞均匀种于96孔版,96孔板四条边的微孔不种细胞,以培养液封。并置于培养箱中37℃、5%CO2培养,6小时后加入10uL CCK-8试剂,于细胞培养条件下孵育3-4小时,于450nM处测定吸光度值,并连续4天在同一时间加入CCK-8试剂,同一时间测定450nM处吸光度值,并将第一天的吸光度值作为100%来标准化,将之后几天的根据不同细胞第一天的吸光度值进行百分比标准化,并绘制生长曲线。
3、克隆形成实验
将培养状态良好的细胞用胰酶消化并计数,并吹打使细胞充分分散成单细胞,并按照每孔2mL细胞悬液中含有250、500个细胞的标准将细胞均匀种于6孔板,并置于培养箱中37℃、5%CO2培养,每3天更换一次培养基,培养10天后,将培养基弃去,用0.5%结晶紫与6%戊二醛按1:1体积混合,每个孔加入2mL,染色45分钟,之后浸没于水中洗净,晾干后拍照。
4、软琼脂实验
将2%agar及1.4%agar在37℃中融化,按250uL 2%agar+750uL细胞培养基在6孔板内铺上base agar,待冷却后,将培养状态良好的细胞用胰酶消化并计数,并吹打使细胞充分分散成单细胞,并按照每750uL悬液中含有2500个细胞的标准将细胞与250uL 1.4%agar混匀,均匀地铺在base agar之上,置于培养箱中37℃、5%CO2培养,每3天补0.5mL培养基,培养10-14天后,用0.5%结晶紫与6%戊二醛按1:1体积混合,每个孔加入2mL,染色45分钟,用ddH2O漂洗3-5次,拍照。
5、细胞迁移实验
在24孔板中加入500uL培养基,并将Transwell小室放入,在37℃培养箱中孵育30分钟,将培养状态良好的细胞用胰酶消化并计数,并用无血清培养基按照每200uL悬液70000个细胞的标准加入Transwell小室中,置于培养箱中37℃、5%CO2培养,18小时后用伊红或0.5%结晶紫染色10分钟,并用ddH2O漂洗,用棉签擦去上层细胞,晾干后拍照。
实施例1、筛选本发明的细胞
取人源肝正常细胞系HL-7702(ATCC),在培养基中加入不同浓度苯并(a)芘(0.01nM,1nM,100nM)进行长期培养,每隔2-3天在显微镜下观察细胞生长状态,包括细胞形态、存活率、生长速率等。筛选中发现,100nM苯并(a)芘持续刺激在短期内导致细胞存活率降低。其中有一株细胞,其发生了显著形态变化,但细胞存活能力并未下降,并且还呈现更强的生长能力,这种表型变化在撤除苯并(a)芘后依然持续存在,说明该细胞已发生不可逆改变,转化为具有稳定性状的新细胞类型,即为本发明筛选获得的细胞系。本发明人将之命名为“人正常肝细胞苯并芘转化细胞系HL-7702BaPT”,该细胞系的保藏号为CCTCC NO:C2014243。
取该筛选获得的细胞进行冻存保种,并按照前面材料和方法“1”中所述正常条件进行复苏、培养和冻存。
实施例2、筛选获得的细胞的形态变化
将前述筛选获得的细胞系与未经苯并(a)芘处理的肝正常细胞比较,发现本发明细胞系的形态发生了明显变化。如图1所示,其形态由偏圆形变成了常形、梭形细胞。这种形态变化表示该细胞已经表现出与源细胞不同的细胞特征,且这是由苯并(a)芘持续刺激导致的。
以上结果提示,本发明细胞系可作为研究苯并(a)芘如何影响细胞骨架和形态学的新细胞模型。
实施例3、筛选获得的细胞的生长情况
将前述筛选获得的细胞系与未经苯并(a)芘处理的肝正常细胞进行生长情况的比较。结果如图2,发现本发明细胞系的生长速率明显增加,表明与源细胞相比,筛选获得的细胞系具有异常快速的生长能力,说明苯并(a)芘的持续刺激改变了细胞的分裂增殖能力。
以上结果表明,本发明筛选获得的细胞系可作为研究苯并(a)芘如何影响细胞分裂和增殖的新细胞模型。
实施例4、锚定依赖的克隆形成能力
将前述筛选获得的细胞系与未经苯并(a)芘处理的肝正常细胞进行克隆形成能力的比较。结果如图3,发现本发明细胞系的锚定依赖的克隆形成能力显著增加,这与生长曲线结果相一致,进一步说明苯并(a)芘的持续刺激促进了细胞的异常快速生长。
以上结果表明,本发明细胞系可作为研究苯并(a)芘如何影响细胞生长的新细胞模型。
实施例5、锚定非依赖的克隆形成能力
将前述筛选获得的细胞系与未经苯并(a)芘处理的肝正常细胞比较,进行软琼脂实验。结果如图4,发现源细胞在非贴壁状态下生长缓慢,而本发明细胞系则能正常快速生长,说明本发明细胞系的锚定非依赖的克隆形成能力显著增加,苯并(a)芘的持续刺激不仅促进了锚定依赖的细胞生长能力,还促进了锚定非依赖的细胞生长,而后者也是肿瘤细胞的一个重要特征。
以上结果表明,本发明细胞系可作为研究苯并(a)芘如何影响细胞生长和成瘤性的新细胞模型。
实施例6、细胞迁移能力
将前述筛选获得的细胞系与未经苯并(a)芘处理的肝正常细胞比较,进行Transwell实验。结果如图5,发现本发明细胞系的迁移能力显著增加,说明苯并(a)芘的持续刺激促进了细胞的迁移,而细胞迁移能力不仅参与了肿瘤发生也参与了肿瘤转移等过程。
以上结果表明,本发明细胞系可作为研究苯并(a)芘如何影响细胞迁移以及肿瘤转移过程的新细胞模型。
生物材料保藏
本发明的人正常肝细胞苯并芘转化细胞系HL-7702BaPT。保藏在中国典型培养物保藏中心(CCTCC,中国武汉,武汉大学),保藏号为CCTCC NO:C2014243;保藏日2014年12月17日。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!