保藏淋巴细胞体外培养增效剂的方法与流程
本发明涉及细胞生物学领域,具体地,涉及保藏淋巴细胞体外培养增效剂的方法。
背景技术:
淋巴细胞在体外的增殖和分化受多种因素的调节,最常见的调节剂主要是可溶性细胞因子、各种天然细胞和基因重组工程细胞。在细胞的体外培养中,由于饲养细胞(Feeder Cells)或抗原呈递细胞(APC)等固相化细胞因子对淋巴细胞的调节功能比游离的细胞因子更强,所以,目前常用饲养细胞或APC来促进淋巴细胞的增殖及活化。
在实际应用中,为了不影响淋巴细胞在体外的增殖和活化,需要对饲养细胞和APC进行失活处理。目前常规的方法有伽玛射线照射、UV照射、电休克、丝裂霉素化学处理法。但以上方法依存在无法大量制备、设备昂贵、操作不安全、灭活程度不好掌握、有残存活细胞或彻底损坏细胞等缺陷。
而且,以上方法制备的饲养细胞或APC都是细胞,为保证其生物学活性,必需存放在含有二甲亚枫(DMSO)或甘油的保存液中,含饲养细胞或APC的保存液在-80℃冰箱只能短期保存,长期保存只能是液氮。这种剂型及保存条件,对于条件较好的实验室来说不成问题,但普通临床试验室或细胞临床治疗,则不能够满足。这种保存方法存在运输的困难,高成本的弊端,而且,从细胞活性来说,从保存时的超低温到使用时的解冻都会造成蛋白质及细胞骨架的损伤,严重影响产品的活性。
因此,既有效又安全地保藏淋巴细胞体外增效剂是当今生物学的难题。
技术实现要素:
本发明旨在至少在一定程度上解决以上技术问题之一。为此,本发明的一个目的在于提出一种保藏淋巴细胞体外培养增效剂的方法与制备。
本发明将饲养细胞或抗原呈递细胞通过洗涤处理,制备成细胞空壳。发现以这种细胞空壳作为淋巴细胞体外培养增效剂,保持了原有饲养细胞或APC的活性。同时,发现这种细胞体外培养增效剂的成分为蛋白质,蛋白质存放在含有甘油的保存液中,在零下20摄氏度至零上4摄氏度条件下可以长期保持活性;或通过加入人血清白蛋白后利用冷冻干燥工艺制备成冻干粉,冻干粉放置4摄氏度即可长期保存。同时,本发明的冻干粉剂型和液体剂型淋巴细胞体外增效剂都可以4℃运输,既方便又价廉,因此,为规模化应用提供了保障。
在本发明的一个方面,本发明提供了一种保藏淋巴细胞体外培养增效剂的方法。根据本发明的实施例,该方法包括:将淋巴细胞体外培养增效剂悬浮于保存液中,以便获得淋巴细胞体外培养增效剂悬浮液;将所述淋巴细胞体外培养增效剂悬浮液于预定温度下进行冷冻保存,其中,所述预定温度为零下20摄氏度至零上4摄氏度。发明人惊奇地发现,利用本发明的该方法,能够有效保藏淋巴细胞体外培养增效剂,且该方法保存条件要求低,淋巴细胞体外培养增效剂活性保持高、活性保持时间长,可以4℃运输,既方便又价廉。
根据本发明实施例的保藏淋巴细胞体外培养增效剂的方法,还可以具有以下附加技术特征:
根据本发明的实施例,所述淋巴细胞体外培养增效剂为用饲养细胞或APC制备的细胞空壳。
根据本发明的实施例,所述保存液为含5-15体积%甘油的RPMI 1640培养液。
根据本发明的实施例,进一步包括:在将所述淋巴细胞体外培养增效剂悬浮液于预定温度下进行冷冻保存之前,预先将所述淋巴细胞体外培养增效剂悬浮液进行冷冻干燥处理,其中,所述保存液为含有1-10体积%的人血清白蛋白的RPMI 1640培养液。
根据本发明的实施例,所述细胞空壳是通过以下步骤制备的:将细胞进行洗涤处理,以便获得经过洗涤的细胞;将所述经过洗涤的细胞进行裂解处理,以便获得细胞空壳,其中,所述细胞的表面具有能够促进淋巴细胞增殖分化的细胞因子。发明人发现,利用本发明的该方法能够快速有效地制备获得所述细胞空壳,且该方法操作简单、容易控制,易于实现大规模生产。
需要说明的是,所述细胞的表面具有能够促进淋巴细胞增殖的细胞因子,可以是所述细胞本身能够在其表面表达所述细胞因子,也可以是通过基因工程方法(例如瞬时转染或稳定表达)将所述细胞因子表达在所述细胞表面,还可以是在细胞表面吸附或交联所述细胞因子。另外,所述细胞可以为原代细胞(例如外周血单核细胞),也可以为传代细胞(例如K562细胞)。
根据本发明的实施例,所述洗涤处理进一步包括:将所述细胞悬浮于等渗溶液中,以便获得细胞悬液;将所述细胞悬液进行离心处理,以便获得所述经过洗涤的细胞。
根据本发明的实施例,在将所述细胞悬浮于等渗溶液中之前,将所述等渗溶液预冷至4摄氏度。
根据本发明的实施例,所述等渗溶液为pH为7.4的等渗磷酸盐缓冲液(PBS)。
根据本发明的实施例,所述裂解处理进一步包括:按照预定体积比例将所述经过洗涤的细胞悬浮于低渗溶液中,将所得到的细胞悬液静置2小时,以便获得细胞裂解物;将所述细胞裂解物进行离心处理,以便获得所述细胞空壳。
根据本发明的实施例,所述预定体积比例为1:40。由此,有利于提高细胞裂解的效率。
根据本发明的实施例,在将所述经过洗涤的细胞悬浮于低渗溶液中之前,预先将所述低渗溶液预冷至4摄氏度。
根据本发明的实施例,所述低渗溶液为低渗Tris盐酸缓冲液。由此,有利于提高细胞裂解的效率。
根据本发明的实施例,能够促进淋巴细胞增殖的细胞因子为选自IL-4、IL-7、IL-15、IL-21、CD19、CD64、CD86和4-1BBL的至少一种。
在本发明的另一方面,本发明提供了一种保藏淋巴细胞体外培养增效剂的方法。根据本发明的实施例,该方法包括:将淋巴细胞体外培养增效剂悬浮于保存液中,以便获得淋巴细胞体外培养增效剂悬浮液;将所述淋巴细胞体外培养增效剂悬浮液进行冷冻干燥,以便获得冻干粉剂型的淋巴细胞体外培养增效剂;将所述冻干粉剂型淋巴细胞体外培养增效剂于零下20摄氏度至零上4摄氏度保存,其中,所述保存液为含有1体积%-10体积%人血清白蛋白的RPMI 1640培养液。
在本发明的一个实施例中,通过以下步骤制备细胞空壳::一)细胞空壳制备试剂:1)等渗PBS:0.15mol/L氯化钠,pH7.4;2)低渗Tris盐酸缓冲液:10mmol/L,pH7.4。二)操作步骤:1)细胞的收集及洗涤:将细胞悬浮于约3倍量预泠的pH7.4等渗PBS,4摄氏度600g(1500转)离心10分钟,除去上清,重复洗涤1-3次。2)裂解和细胞膜的洗涤:向洗净的细胞,约按体积比1:40的比例加入预冷的10mmol/L低渗Tris盐酸缓冲液,边加边缓慢搅拌,置4摄氏度冰箱中约2小时,使之完全裂解;然后于4摄氏度12000g(9000转)离心10分钟,使细胞膜沉淀。重复洗涤、离心3-5次,最后获得细胞空壳。3)用冷藏保存液约按2×107个/ml细胞空壳的浓度稀释和分装,-20摄氏度至4摄氏度冰箱冷藏;或用冷冻保护液约按2×107/ml细胞空壳的浓度稀释和分装,冰冻干燥后,4摄氏度冰箱冷藏保存备用。
为了验证本发明淋巴细胞体外培养增效剂的剂型及其保存方法的产品稳定性,本发明同时也以从外周单核细胞(PBMC)中扩增活化其中的NK细胞的方法作为实施例。本领域技术人员可以理解,使用相应细胞空壳(饲养细胞或APC)按类似的方法就可以扩增活化CTL及Treg。具体方法步骤:1)自体血浆制备:抽取抗凝外周血50ml,700G,20min室温离心;吸取血浆,置于水浴锅中56℃,30min;然后4℃静置15min;最后4℃,900G,离心30min,取自体血浆4℃保存备用。2)取血浆后的细胞层加入D-PBS混匀,用淋巴细胞分离液800G,20min分离PBMC;3)选T175培养瓶1个,向分离出的PBMC加入40ml淋巴细胞完全培养液(含有约200IU/ml IL-2、自体血浆1-10%、庆大霉素80U/ml的RPMI 1640)制成细胞悬液(约5×106个淋巴细胞),加入到T175培养瓶;同时加入2×107个细胞空壳,置于饱和湿度、37℃、5.0%CO2培养箱中培养;4)在所述培养的大约第四天,补加约40ml淋巴细胞完全培养液;5)在所述培养的第七天左右,将所述T175培养瓶中的细胞转移到培养袋中,补加所述淋巴细胞完全培养液至约400ml,并添加约8×107个前面所述的细胞空壳;6)在所述培养的第十天左右,将培养物传代至两个培养袋中,其中,每个培养袋中含有约640ml所述淋巴细胞完全培养液;以及7)在所述培养的第十二天左右,收集培养产物,以便获得NK细胞。或者若需更大量的NK细胞,就补加培养液到1280毫升/袋;8)在所述培养的第十二天左右,转到两个培养袋,加淋巴细胞完全培养液至各约850毫升/袋;9)在所述培养的第十六天左右,从两个培养袋每袋取约500毫升共约1000毫升细胞悬液,收集细胞,回输给病人。同时补加新鲜淋巴细胞完全培养液约150毫升/袋;10)在所述培养的第十八天左右,剩下约1000毫升细胞悬液,收集细胞,回输给病人。本领域技术人员可以理解,可以根据需要的NK细胞的数量,将NK细胞进行不同时间长短的培养。
为了验证本发明饲养细胞或APC的剂型及其保存方法的产品应用效果,本发明实施例中同时也提供了细胞毒性检验方法,具体方法步骤:1)测定前一天复苏一管效应细胞,比如NK细胞,在RPMI 1640完全培养液(含10%胎牛血清,80U/ml庆大霉素的RPMI 1640培养液)中培养;2)每次测定时使用一种细胞系作为靶细胞。需要6×105个效应细胞细胞和3×105个靶细胞;3)用RPMI 1640完全培养液稀释Calcein-AM,配制CAM液;4)把1×106个靶细胞悬浮于1mL CAM液。37℃培养1小时,适时晃动。然后用RPMI 1640完全培养液洗涤2次,每次1200rpm离心5min。计数,调整浓度为1×105个/mL;5)把效应细胞稀释为1×106个/mL,在U形底96孔细胞培养板上设3孔,每孔加靶细胞200μL,对应效靶比例(E:T)10:1;6)向最大释放孔加100uL 2%Triton X-100,其余孔加100μL完全培养液。7)把效应细胞做5次倍比稀释,最后一个稀释度的效靶比例(E:T)为0.3125:1;8)每孔加100μL靶细胞,100g离心1min,引导细胞接触。37℃ 5%CO2浮箱培养4小时;9)用100μL加样器轻轻吸打细胞,以悬浮释放的calcein;100g离心5min,以沉淀细胞。轻轻吸取上清液100μL,转移至一个新培养板,防止产生泡沫。如果有泡沫形成,就用针刺破;10)用荧光读板仪(激发光485nm,发射光530nm)读板;11)计算特异性细胞毒性百分比:[(试验组-自然释放组)/(最大释放组-自然释放组)]×100。
发明人为了更好地说明不同保存制剂的效果对比,实施中本发明的实施例中以K15-41BBL饲养细胞为例同时对所述的制备方法进行了介绍;K15-41BBL是将人IL-15及4-1BBL表达在K562细胞表面而制备的细胞系。我们对其经伽玛照射处理制备成饲养细胞,同时对其按我们的发明制备成细胞空壳,分别配制成不同的剂型;再分别在4℃、-20℃、及-80℃冰箱冷藏不同的时间然后通过检测其扩增活化PBMC中NK细胞的扩增活化效果。
附图说明
图1显示了根据本发明的实施例1、2,不同保存条件下不同剂型的淋巴细胞体外培养增效剂对PBMC中NK细胞的扩增活化效果图;
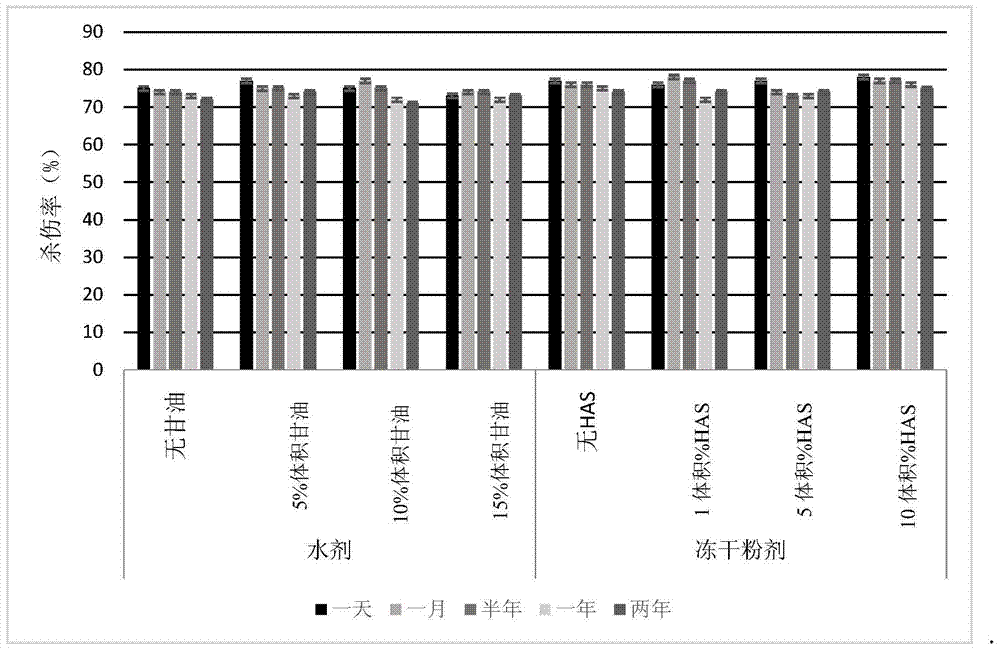
图2显示了根据本发明的实施例3所得的NK细胞对K562癌细胞的杀伤作用对比图。
具体实施方式
本发明提供了保藏淋巴细胞体外培养增效剂的方法,包括制备方法及其应用。本发明中的淋巴细胞体外培养增效剂为带有活性因子的细胞空壳;其保藏方法包括水剂和干粉剂2种剂型,具体以含5-15体积%甘油的RPMI 1640水剂,和含1-10%人血清白蛋白的RPMI 1640的冻干粉剂为例来说明。下面详细描述本发明的实施例,这些实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。比如,下面的实施例中用甘油配制冷藏保存液,但本领域技术人员能够理解的是,也可以采用其他具有促进冷藏保存效果并适合细胞培养的材料制备水剂型淋巴细胞体外培养增效剂。在本发明中,5-15体积%甘油为最适浓度,但本领域技术人员可以理解的是,也可以使用在这个范围之外的浓度。再如,下面的实施例中用人血清白蛋白作为冻干保护剂,但本领域技术人员可以理解的是,其它任何具有冻干保护效果并适合细胞培养的材料也可被用于制备粉剂型淋巴细胞体外培养增效剂。在本发明中,1-10%的人血清白蛋白浓度为最佳浓度,但本领域技术人员可以理解的是在这个范围之外的浓度也可以使用;此外,下面的实施例中在配制冷藏保存液和冷冻保护液时都添加了RPMI 1640,但本领域技术人员可以理解的是,可以不添加其它任何材料,或者也可以添加其它任何适当的材料。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
水剂型NK细胞体外培养增效剂的制备及其测试条件
按照以下步骤,采用K15-41BBL制备细胞空壳,其中,K15-41BBL是将人IL-15及4-1BBL表达在K562细胞表面而制备的细胞系。具体如下:
将K15-41BBL细胞悬浮于3倍量预冷至4摄氏度、的pH为7.4的等渗PBS中,于4摄氏度、1500转/分钟下离心10分钟,除去上清,重复洗涤1-3次,得到经过洗涤的K15-41BBL细胞;然后将经过洗涤的K15-41BBL细胞按体积比为1:40的比例加入预冷至4摄氏度、浓度为10mmol/L的低渗Tris盐酸缓冲液中,边加边缓慢搅拌,接着,将得到的混合液于4摄氏度的冰箱中静置2小时,使细胞完全裂解;随后,于4摄氏度、9000转/分钟下离心10分钟,使细胞空壳沉淀,进一步重复洗涤、离心3-5次,即得K15-41BBL细胞空壳,即K15-41BBL-空壳。
然后,按1×107/毫升的浓度,把K14-41BBL细胞空壳沉淀悬浮于不含甘油、含有5体积%、10体积%、及15体积%甘油的RPMI 1640冻存保存液中,即为淋巴细胞体外培养增效剂;分别在4摄氏度、零下20摄氏度、及零下80摄氏度保存一天、一个月、半年、一年、两年等不同的时间,然后测试其扩增活化PBMC中NK细胞的功能,同时测试所得NK细胞对K562癌细胞的杀伤活性。
实施例2
冻干粉剂型NK细胞体外培养增效剂的制备及其测试条件
按照实施例1中的方法制备K15-41BBL-空壳。按1×107/毫升的浓度,把K15-41BBL细胞空壳沉淀悬浮于不含人血清白蛋白、含有1体积%、5体积%、及10体积%人血清白蛋白(Human serum Albumin,HAS)的RPMI 1640冻干保护液中,然后冷冻干燥,即为冻干粉剂型淋巴细胞体外培养增效剂;分别在4摄氏度、零下20摄氏度、及零下80摄氏度保存一天、一个月、半年、一年、两年等不同的时间,然后测试其扩增活化PBMC中NK细胞的功能,同时测试所得NK细胞对K562癌细胞的杀伤活性。
实施例3
不同条件下保存的不同剂型的淋巴细胞体外培养增效剂对PBMC中NK细胞扩增活化及其结果
用实施例1和2中制备获得的不同保存时间、不同剂型的K15-41BBL-空壳刺激PBMC中的NK细胞扩增,每个实验重复3次,具体步骤如下:
1)自体血浆制备:抽取抗凝外周血50ml,700G,20min室温离心;吸取血浆,置于水浴锅中56℃,30min;然后4℃静置15min;最后4℃,900G,离心30min,取自体血浆4℃保存备用。
2)取血浆后的细胞层加入D-PBS混匀,用淋巴细胞分离液800G,20min分离PBMC);
3)选T175培养瓶1个,向分离出的PBMC加入40ml淋巴细胞完全培养液(含有约200IU/ml IL-2、自体血浆1-10体积%、庆大霉素80U/ml)制成细胞悬液(约5×106个淋巴细胞),加入到T175培养瓶;同时加入2×107个不同保存时间、不同剂型的细胞空壳,置于饱和湿度、37℃、5.0%CO2培养箱中培养;
4)在所述培养的大约第四天,补加约40ml淋巴细胞完全培养液;
5)在所述培养的第七天左右,将所述T175培养瓶中的细胞转移到培养袋中,补加所述淋巴细胞完全培养液至约400ml,并添加约8×107个不同保存时间、不同剂型的细胞空壳;
6)在所述培养的第十天左右,将培养物传代至两个培养袋中,其中,每个培养袋中含有约640ml所述淋巴细胞完全培养液;以及
7)在所述培养的第十二天左右,收集培养产物,测试不同保存时间、不同剂型的细胞空壳对PBMC中NK细胞的扩增活化效果。实验结果见图1。
由图1的结果可见,除了未加甘油的水剂和未加HAS的冻干粉剂,加了5体积%、10体积%、和15体积%甘油作为冷冻保存剂的水剂,及加了1体积%、5体积%、10体积%BSA作为冻干保护剂的冻干粉剂,在4摄氏度、-20摄氏度、及-80摄氏度保存条件下,都很好地保持了K15-41BBL空壳刺激PBMC扩增活化NK细胞的功能。未加甘油的水剂和未加HAS的冻干粉剂随着保存时间的延长,其功能逐渐减退。
实施例4
实施例3中所得NK细胞对K562癌细胞的细胞毒实验及其结果
以K562癌细胞为靶细胞,以实施例3中分别以在不同条件下保存的淋巴细胞体外培养增效剂刺激、从PBMC中扩增活化的NK细胞为效应细胞,进行细胞毒性实验,每个实验重复3次,具体步骤如下:
用RPMI1640完全培养液(含10%胎牛血清、80U/ml庆大霉素的RPMI 1640)稀释荧光染料Calcein-AM,配制成CAM液,将把1×106个靶细胞悬浮于1mL上述CAM液中,置于饱和湿度、37摄氏度、5体积%二氧化碳条件下培养1小时,培养过程中适时晃动,然后用RPMI1640完全培养液洗涤2次,每次1200rpm离心5min。计数,调整浓度靶细胞浓度为1×105个/mL。将效应细胞稀释至细胞浓度为1×106个/mL。
在U形底96孔细胞培养板上设3孔,每孔加靶细胞200uL,对应效靶比例(E:T)10:1,向其中的1孔加100uL 2%Triton X-100以完全裂解靶细胞作为最大释放阳性对照,向其余2孔加100uL RPMI 1640完全培养液,作为自然释放阴性对照。
将效应细胞做5次倍比稀释,最后一个稀释度的效靶比例(E:T)为0.3125:1。
根据所测不同浓度效应细胞总样品数目,在96孔板上设定所需的待测样品孔数,每孔加100μL靶细胞,100g离心1min,引导细胞接触,然后置于饱和湿度、37摄氏度、5体积%CO2浮箱中培养4小时,接着,用100μL加样器轻轻吸打细胞,以悬浮释放的calcein荧光染料,然后100g离心5min,以沉淀细胞,轻轻吸取上清液100μL,转移至一个新培养板,用荧光读板仪(激发光485nm,发射光530nm)读板。按照公式杀伤率=[(试验组-自然释放组)/(最大释放组-自然释放组)]×100,计算PBMC中的NK细胞经不同保存时间、不同剂型的细胞空壳刺激扩增后对K562细胞的杀伤率。实验结果见图2。
由图2的结果可见,PBMC中的NK细胞经不同保存时间、不同剂型的K15-41BBL-空壳刺激扩增后,对K562细胞均具有很强的细胞毒性,而且相互之间没有明显的差别。
虽然单从细胞毒性试验结果看是没有明显差别,但由于从不同组所得NK细胞总数不同,因此,加了冷藏保存剂的水剂及加了冻干保护剂的冻干粉剂都明显优于未加的对照组。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!