通过顺序杂交编条形码的分子多重标记的制作方法
本申请要求2013年4月30日提交的美国临时申请序列号61/817,651和2014年3月28日提交的美国临时申请序列号61/971,974的优先权,通过引用各自以其整体并入本文。
关于联邦政府赞助的研究或开发的声明
依据由美国国家卫生研究院授予的拨款号R01HD075605,美国政府对此发明具有一定的权利。
技术领域
本申请涉及但不限于通过顺序杂交编条形码的分子多重标记。
发明背景
细胞的转录谱分析(profiling)是许多目的必需的。能够在单细胞中分辨多种mRNA的显微成像可以提供关于转录物丰度和定位的有价值的信息,对理解细胞鉴定的分子基础和开发疾病治疗是重要的。因此,对通过例如显微成像对细胞中转录物的谱分析新的和改进的方法存在需要。
发明概述
本发明提供与对细胞中的,尤其是单细胞中的转录物或DNA基因座谱分析的现有技术相关的挑战或缺点的某些洞见。此外,本发明提供用于有效地实现此类谱分析包括单细胞的此类谱分析的新技术。提供的技术是广泛有用的,包括例如用于分离的细胞、组织中的细胞、器官中的细胞和/或生物体中的细胞的谱分析。
例如,本发明提供以下洞见:现有技术诸如单细胞RNA-seq或qPCR,需要将单细胞分离并且将其放入多孔格式中,这会是成本高昂的、劳动密集的并且倾向产生伪结果(prone to artifacts)的多重步骤的方法。此外,本发明认识到,首先利用酶促反应将mRNA转换成DNA模板的现有原位测序技术可以是非常低效的(例如在mRNA向DNA转化过程中),因此,通常,只有一小部分的RNA被转化和检测。本发明提供了这样的具体洞见:关于这种低效率(对于RT估计在1%和对于PLA在10%)的一种主要缺点是它可以在基因表达测量中引入显著的噪音和(ad)偏倚。本发明还认识到,利用单分子荧光原位杂交(smFISH)的现有光谱mRNA编条形码技术需要不同的荧光基团用于规模放大,并且可能在可生成的条形码的数量上被限制。smFISH还需要在杂交期间将探针分裂成编条形码的亚组。因为smFISH通常使用两种或更多种颜色用于靶,其在图像中产生高密度的对象,这可增加数据分析的复杂性。
除其他方面,本发明提供了用于对例如转录物和/或DNA基因座谱分析的新技术,该新技术克服了与本发明之前的方法有关的问题的一种或更多种或所有。在一些实施方案中,本发明提供用于通过允许不同靶的多路复用的顺序条形码方案在细胞中检测多个靶(例如转录物或DNA基因座)的方法。
在一些实施方案中,本发明提供了方法,所述方法包括以下步骤:
(a)进行第一接触步骤,所述第一接触步骤包括使包含多种(a plurality of)核酸的细胞与第一多种可检测地标记的寡核苷酸接触,所述第一多种可检测地标记的寡核苷酸的每一种靶向核酸并且被可检测部分标记,因此组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一核酸并且被第一可检测部分标记;和
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二核酸并且被第二可检测部分标记;
(b)在第一接触步骤之后对细胞成像,以便检测所述第一多种的寡核苷酸与其靶的相互作用;
(c)进行第二接触步骤,所述第二接触步骤包括使所述细胞与第二多种可检测地标记的寡核苷酸接触,所述第二多种包括靶向被所述第一多种靶向的重叠核酸的寡核苷酸,因此所述第二多种至少包含:
(i)第三寡核苷酸,所述第三寡核苷酸任选地在序列上与所述第一寡核苷酸相同,所述第三寡核苷酸靶向所述第一核酸;和
(ii)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与第二寡核苷酸相同,所述第四寡核苷酸靶向所述第二核酸,
其中所述第二多种与所述第一多种的不同在于,存在于所述第二多种中的寡核苷酸的至少一种被与所述第一多种中靶向相同核酸的对应的寡核苷酸不同的可检测部分标记,因此在所述第二多种中:
(iii)所述第三寡核苷酸被所述第一可检测部分、所述第二可检测部分或第三可检测部分标记;并且
(iv)第四寡核苷酸被所述第一可检测部分、所述第二可检测部分、所述第三可检测部分或第四可检测部分标记,
其中所述第三寡核苷酸被与所述第一寡核苷酸所用的不同的可检测部分标记,或所述第四寡核苷酸被与所述第二寡核苷酸所用的不同的可检测部分标记,或两者;
(d)在所述第二接触步骤之后对细胞成像,以便检测所述第二多种的寡核苷酸与它们的靶的相互作用;以及
(e)任选地所述重复接触和成像步骤,每次用新的多种可检测地标记的寡核苷酸,所述新的多种可检测地标记的寡核苷酸包含靶向被所述第一多种和第二多种靶向的重叠核酸的寡核苷酸,其中由于标记靶向相同核酸的寡核苷酸的可检测部分中的至少一种差异,所利用的每个多种(each utilized plurality)与所利用的每个其他的多种(each other utilized plurality)不同。
在一些实施方案中,本发明(例如,如在图1中呈现的),提供了方法,所述方法包括以下步骤:
(a)进行第一接触步骤,所述第一接触步骤包括使包含多种转录物和DNA基因座的细胞与第一多种可检测地标记的寡核苷酸接触,所述第一多种可检测地标记的寡核苷酸的每一种靶向转录物或DNA基因座并且被可检测部分标记,因此组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一转录物或DNA基因座并且被第一可检测部分标记;和
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二转录物或DNA基因座并且被第二可检测部分标记;
(b)在第一接触步骤之后对细胞成像,以便检测所述第一多种的寡核苷酸与它们的靶的识别;
(c)进行第二接触步骤,所述第二接触步骤包括使所述细胞与第二多种可检测地标记的寡核苷酸接触,所述第二多种包括靶向被第一多种靶向的重叠转录物和/或DNA基因座的寡核苷酸,因此所述第二多种至少包含:
(i)第三寡核苷酸,所述第三寡核苷酸任选地在序列上与第一寡核苷酸相同,所述第三寡核苷酸靶向所述第一转录物或DNA基因座;和
(ii)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与第二寡核苷酸相同,所述第四寡核苷酸靶向所述第二转录物或DNA基因座,其中所述第二多种与第一多种的不同在于,存在于第二多种中的寡核苷酸的至少一种被与所述第一多种中靶向相同的转录物或DNA基因座的对应的寡核苷酸不同的可检测部分标记,因此在所述第二多种中:
(iii)所述第三寡核苷酸被所述第一可检测部分、所述第二可检测部分或第三可检测部分标记;并且
(iv)所述第四寡核苷酸被所述第一可检测部分、所述第二可检测部分、所述第三可检测部分或第四可检测部分标记,
其中所述第三寡核苷酸被与所述第一寡核苷酸所用的不同的可检测部分标记,或第四寡核苷酸被与第二寡核苷酸所用的不同的可检测部分标记,或两者;
(d)在所述第二接触步骤之后对细胞成像,以便检测检测所述第二多种的寡核苷酸与它们的靶的识别;以及
(e)任选地重复所述接触和成像步骤,每一次用新的多种可检测地标记的寡核苷酸,所述新的多种可检测地标记的寡核苷酸包含靶向被所述第一多种和第二多种靶向的重叠转录物或DNA基因座的寡核苷酸,其中由于标记靶向相同转录物或DNA基因座的寡核苷酸的可检测部分中的至少一种差异,所利用的每个多种与所利用的每个其他的多种不同。
在一些实施方案中,被可检测地标记的寡核苷酸靶向的核酸是转录物和/或DNA基因座,或包含转录物和/或DNA基因座。在一些实施方案中,被可检测地标记的寡核苷酸靶向的核酸是转录物,或包括转录物。在一些实施方案中,被可检测地标记的寡核苷酸靶向的核酸是转录物。在一些实施方案中,被可检测地标记的寡核苷酸靶向的核酸是DNA基因座,或包括DNA基因座。在一些实施方案中,被可检测地标记的寡核苷酸靶向的核酸是DNA基因座。在一些实施方案中,在接触步骤中使用的多种可检测地标记的寡核苷酸的每个多种(each plurality)靶向相同的转录物和/或DNA基因座。
在一些实施方案中,在接触步骤中使用的多种可检测地标记的寡核苷酸称为一组可检测地标记的寡核苷酸。在一些实施方案中,一组可检测地标记的寡核苷酸的靶称为一组靶。在一些实施方案中,组中的靶是或包括转录物。在一些实施方案中,组中的靶是转录物。在一些实施方案中,组中的每一种靶是或包括转录物。在一些实施方案中,组中的每一种靶是转录物。在一些实施方案中,组中的靶是或包括DNA基因座。在一些实施方案中,组中的靶是DNA基因座。在一些实施方案中,组中的每一种靶是或包括DNA基因座。在一些实施方案中,组中的每一种靶是DNA基因座。
在一些实施方案中,提供的方法任选地包括在成像步骤之后去除多种可检测地标记的寡核苷酸的步骤。在一些实施方案中,提供的方法包括在每个成像步骤之后去除多种可检测地标记的寡核苷酸的步骤。在一些实施方案中,去除的步骤包括使多种可检测地标记的寡核苷酸与消化可检测地标记的寡核苷酸的酶接触。在一些实施方案中,去除步骤包括使多种可检测地标记的寡核苷酸与DNA酶接触。在一些实施方案中,去除步骤包括使多种可检测地标记的寡核苷酸与RNA酶接触。在一些实施方案中,去除步骤包括光漂白。
在一些实施方案中,每一组包括靶向相同的转录物和/或DNA基因座的两种或更多种可检测地标记的寡核苷酸。在一些实施方案中,靶向相同的转录物和/或DNA基因座的组中的两种或更多种可检测地标记的寡核苷酸产生相同的可检测的信号。在一些实施方案中,靶向相同的转录物和/或DNA基因座的组中的所有可检测地标记的寡核苷酸产生相同的可检测的信号。在一些实施方案中,其中可检测地标记的寡核苷酸被荧光团标记,可检测的信号是某种颜色。在一些实施方案中,靶向相同的转录物和/或DNA基因座的组中的所有可检测地标记的寡核苷酸被提供相同的可检测的颜色的荧光团标记。
在一些实施方案中,靶向相同的转录物和/或DNA基因座的组中的两种或更多种可检测地标记的寡核苷酸具有相同的可检测的标记。在一些实施方案中,靶向相同的转录物和/或DNA基因座的组中的所有可检测地标记的寡核苷酸具有相同的可检测的标记。在一些实施方案中,靶向相同的转录物和/或DNA基因座的所有可检测地标记的寡核苷酸具有相同的荧光团。
在一些实施方案中,本发明提供可用于进行所提供的方法的组合物。
在一些实施方案中,本发明提供组合物,所述组合物包含多种可检测地标记的寡核苷酸,所述可检测地标记的寡核苷酸的每一种靶向核酸并且被可检测的部分标记,因此所述组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一核酸并且被第一可检测部分标记;和
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二核酸并且被第二可检测部分标记。
在一些实施方案中,本发明提供了试剂盒,该试剂盒包含多种可检测地标记的寡核苷酸,所述可检测地标记的寡核苷酸的每一种靶向核酸并且被可检测部分标记,因此所述试剂盒至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一核酸并且被第一可检测部分标记;
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二核酸并且被第二可检测部分标记。
(iii)第三寡核苷酸,所述第三寡核苷酸任选地在序列上与所述第一寡核苷酸相同,所述第三寡核苷酸靶向所述第一核酸并且被所述第一可检测部分、所述第二可检测部分或第三可检测部分标记;和
(iv)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与所述第二寡核苷酸相同,所述第四寡核苷酸靶向核酸并且被所述第一可检测部分、所述第二可检测部分、所述第三可检测部分或第四可检测部分标记,
其中所述第三寡核苷酸被与所述第一寡核苷酸不同的可检测部分标记,或所述第四寡核苷酸被与所述第二寡核苷酸不同的可检测部分标记,或两者。
在一些实施方案中,可检测部分是荧光团或包括荧光团。
在一些实施方案中,多种可检测地标记的寡核苷酸靶向两种或更多种核酸(“靶”)。在一些实施方案中,靶是或包括转录物。在一些实施方案中,靶是转录物。在一些实施方案中,靶是RNA。在一些实施方案中,靶是mRNA。在一些实施方案中,靶是tRNA。在一些实施方案中,靶是rRNA。在一些实施方案中,靶是非编码RNA。在一些实施方案中,靶是或包括DNA基因座。在一些实施方案中,转录物是DNA基因座。在一些实施方案中,靶是转录物的基因座。在一些实施方案中,DNA序列的不同的转录物,诸如基因的剪接变体,构成不同的靶,其中所述变体的一种或更多种可以独立地被靶向和检测或定量。在一些实施方案中,本发明提供检测个体剪接变体的方法、试剂盒。在一些实施方案中,本发明提供用于检测单核苷酸多态性(SNP)的方法、试剂盒。
在一些实施方案中,提供的方法定量靶,例如,转录物或DNA基因座。
在一些实施方案中,靶向相同的靶的寡核苷酸具有相同的序列组,即,当其在不同的步骤被应用时,寡核苷酸之间的差异在部分间,而不是序列间。
定义
动物:如本文使用的,术语“动物”是指动物界的任何成员。在一些实施方案中,“动物”指在任何发育阶段的人类。在一些实施方案中,“动物”指在任何发育阶段的非人类动物。在某些实施方案中,非人类动物是哺乳动物(例如,啮齿动物、小鼠、大鼠、兔、猴、狗、猫、绵羊、牛、灵长类和/或猪)。在一些实施方案中,动物包括,但不局限于:哺乳动物、鸟类、爬行类、两栖类、鱼类和/或蠕虫。在一些实施方案中,动物可以是转基因动物、遗传工程化的动物和/或无性系。
大约:如本文使用的,关于数字的术语“大约”或“约”通常被采用以包括落入数字的任一方向(多于或少于)的5%、10%、15%或20%的范围内的数字,除非另有说明或另外从上下文明显(除非这样的数字将小于可能值的0%或超过100%)。在一些实施方案中,关于剂量的术语“约”的使用意指±5mg/kg/天。
同源性:“同源性”或“同一性”或“相似性”指的是两个核酸分子之间的序列相似性。同源性和同一性可以通过比较为了比较目的而可对齐的每个序列中的位置而被各自确定当。在相比较的序列中相当的位置被相同碱基占据,则分子在那个位置上是相同的;当相当的位点被相同的或相似的核酸残基(例如,在空间和/或电子上的性质相似)占据,则分子可以被称为在那个位置上同源(相似)。表示为同源性/相似性或同一性的百分比是指比较的序列共享的位置上相同的或相似的核酸的数目的函数。“无关的”或“非同源”的序列与本文描述的序列共享少于40%的同一性、少于35%的同一性、少于30%的同一性或少于25%的同一性。在两个序列的比较中,残基(氨基酸或核酸)的不存在或额外的残基的存在也减少同一性和同源性/相似性。
在一些实施方案中,术语“同源性”描述基于数学的序列相似性的比较,其被用于鉴定具有相似功能或基序的基因。本文描述的核酸序列可以被用作“查询序列”来针对公共数据库进行搜索,例如,来鉴定其他家族成员、相关的序列或同源物。在一些实施方案中,这种搜索可以使用Altschul,等人(1990)J.Mol.Biol.215:403-10的NBLAST和XBLAST程序(版本2.0)来进行。在一些实施方案中,可以用NBLAST程序,得分=100,字长=12进行BLAST核苷酸搜索,来获得与本发明的核酸分子同源的核苷酸序列。在一些实施方案中,为了获得用于比较目的的缺口的比对,可以利用描述于Altschul等人,(1997)Nucleic Acids Res.25(17):3389-3402中的Gapped BLASAT。当利用BLAST和Gapped BLAST程序时,可以使用各程序(例如,XBLAST和BLAST)的默认参数(参见www.ncbi.nlm.nih.gov)。
同一性:如本文使用的,“同一性”意指当序列被比对至最大序列匹配时,即,考虑到缺口和插入,在两个或更多个序列中对应位置上的相同的核苷酸残基的百分比。可以通过已知的方法容易地计算同一性,包括但不局限于在以下描述的那些(Computational Molecular Biology,Lesk,A.M.,编著,Oxford University Press,New York,1988;Biocomputing:Informatics and Genome Projects,Smith,D.W.,编著,Academic Press,New York,1993;Computer Analysis of Sequence Data,Part I,Griffin,A.M.,和Griffin,H.G.,编著,Humana Press,New Jersey,1994;Sequence Analysis in Molecular Biology,von Heinje,G.,Academic Press,1987;和Sequence Analysis Primer,Gribskov,M.和Devereux,J.,编著,M Stockton Press,New York,1991;和Carillo,H.和Lipman,D.,SIAM J.Applied Math.,48:1073(1988)。确定同一性的方法被设计来给出被测试的序列之间的最大匹配。此外,确定同一性的方法被编入公众可得的计算机程序。确定两个序列之间的同一性的计算机程序方法包括,但不局限于,GCG程序包(Devereux,J.等人,Nucleic Acids Research 12(1):387(1984))、BLASTP、BLASTN和FASTA(Altschul,S.F.等人,J.Molec.Biol.215:403-410(1990)和Altschul等人.Nuc.Acids Res.25:3389-3402(1997))。BLAST X程序是从NCBI和其他来源公众可得的(BLAST Manual,Altschul,S.等人,NCBI NLM NIH Bethesda,Md.20894;Altschul,S.等人,J.Mol.Biol.215:403-410(1990))。还可以使用公知的Smith Waterman算法来确定同一性。
体外:如本文使用的,术语“体外”是指发生在人工环境中的事件,例如,在试管或反应容器中,在细胞培养物中,等等,而不是在生物体内(例如,动物、植物和/或微生物)。
体内:如本文使用的,术语“体内”是指发生在生物体内(例如,动物、植物和/或微生物)的事件。
寡核苷酸:术语“寡核苷酸”是指核苷酸单体的聚合物或寡聚物,含有核酸碱基、被修饰的核酸碱基、糖类、被修饰的糖类、磷酸键或被修饰的键的任何组合。
本发明的寡核苷酸可以是各种长度的。在具体的实施方案中,寡核苷酸长度可以在从约2个核苷酸至约200个核苷酸的范围内。在多种相关的实施方案中,单链的、双链的和三链的寡核苷酸长度可以在从约4个核苷酸至约10个核苷酸、从约10个核苷酸至约50个核苷酸、从约20个核苷酸至约50个核苷酸、从约15个核苷酸至约30个核苷酸、从约20个核苷酸至约30个核苷酸的范围内。在一些实施方案中,寡核苷酸长度在从约9个核苷酸至约39个核苷酸的范围内。在一些实施方案中,寡核苷酸长度是至少4个核苷酸。在一些实施方案中,寡核苷酸长度是至少5个核苷酸。在一些实施方案中,寡核苷酸长度是至少6个核苷酸。在一些实施方案中,寡核苷酸长度是至少7个核苷酸。在一些实施方案中,寡核苷酸长度是至少8个核苷酸。在一些实施方案中,寡核苷酸长度是至少9个核苷酸。在一些实施方案中,寡核苷酸长度是至少10个核苷酸。在一些实施方案中,寡核苷酸长度是至少11个核苷酸。在一些实施方案中,寡核苷酸长度是至少12个核苷酸。在一些实施方案中,寡核苷酸长度是至少15个核苷酸。在一些实施方案中,寡核苷酸长度是至少20个核苷酸。在一些实施方案中,寡核苷酸长度是至少25个核苷酸。在一些实施方案中,寡核苷酸长度是至少30个核苷酸。在一些实施方案中,寡核苷酸是长度为至少18个核苷酸的互补链的双链体。在一些实施方案中,寡核苷酸是长度为至少21个核苷酸的互补链的双链体。
预先确定的:预先确定的意味着是故意选择,例如,与随机地发生或实现相对。可能包含如下的某些个体寡核苷酸的组合物不是“预先确定的”组合物:它们是通过不能被控制来有意地产生特定寡核苷酸的过程偶然产生的个体寡核苷酸。在一些实施方案中,预先确定的组合物是可以被有意地重现的组合物(例如,通过重复受控的过程)。
样品:如本文使用的,术语“样品”是指从如本文描述的感兴趣的来源获得或衍生的生物样品。在一些实施方案中,感兴趣的来源包括生物体,诸如动物或人类。在一些实施方案中,生物样品包括生物组织或生物流体。在一些实施方案中,生物样品是或包括骨髓;血液;血细胞;腹水;组织或细针穿刺活检样品;包含细胞的体液;游离核酸;痰;唾液;尿液;脑脊液、腹腔积液;胸腔积液;粪便;淋巴;妇科液;皮肤拭样;阴道拭样;口腔拭样;鼻拭样;洗涤或灌洗液诸如导管灌洗液或支气管肺泡灌洗液;抽吸物;刮涂物(scraping);骨髓样本;组织活检样本;手术样本;粪便、其他体液、分泌物和/或排泄物;和/或其所来自的细胞等。在一些实施方案中,生物样品是或包括从个体获得的细胞。在一些实施方案中,样品是通过任何适当手段从感兴趣的来源直接获取的“原始样品”。例如,在一些实施方案中,通过选自由活检(例如,细针抽吸或组织活检)、手术、体液(例如,血液、淋巴、粪便等)的收集等组成的组的方法获取原始生物样品。在一些实施方案中,如从上下文中将明确的,术语“样品”是指通过处理(例如,通过去除原始样品的一种或更多种组分和/或通过添加一种或更多种试剂至)原始样品获得的制备物。例如,使用半透膜过滤。这样的“处理的样品”可包括,例如从样品提取的或通过使原始样品经历诸如mRNA的扩增或反转录、某些成分的分离和/或纯化等的技术获得的核酸或蛋白质。
受试者:如本文使用的,术语“受试者”或“测试受试者”是指为了例如实验、诊断、预防和/或治疗目的,依照本发明所提供的化合物或组合物被施用至的任何生物体。典型的受试者包括动物(例如,哺乳动物诸如小鼠、大鼠、兔、非人类灵长类动物、和人类;昆虫;蠕虫等)和植物。在一些实施方案中,受试者可能患有疾病(disease)、紊乱(disorder)和/或状况(condition)或对疾病、紊乱和/或状况易感。
基本上:如本文使用的,术语“基本上”是指表现感兴趣的特征或性质的总的或接近总的范围或程度的定性条件。生物领域中普通技术人员将理解的是,生物和化学现象很少(若存在)进行完全和/或进行至完备或达到或避免绝对的结果。因此术语“基本上”在本文被用以捕获许多生物和/或化学现象中固有的完整性的潜在缺乏。
患有:“患有”疾病、紊乱和/或状况的个体已被诊断为具有和/或展示疾病、紊乱和/或状况的一种或更多种症状。
易感:对疾病、紊乱和/或状况“易感”的个体,是与一般公众的成员相比具有发展疾病、紊乱、和/或状况的较高风险的个体。在一些实施方案中,对疾病、紊乱和/或状况易感的个体可以未被诊断患有疾病、紊乱和/或状况。在一些实施方案中,对疾病、紊乱和/或状况易感的个体可显示疾病、紊乱和/或状况的症状。在一些实施方案中,对疾病、紊乱和/或状况易感的个体可以未表现出疾病、紊乱和/或状况的症状。在一些实施方案中,对疾病、紊乱和/或状况易感的个体将会发展疾病、紊乱和/或状况。在一些实施方案中,对疾病、紊乱和/或状况易感的个体将不会发展疾病、紊乱和/或状况。
治疗:如本文使用的,术语“治疗(treat)”、“治疗(treatment)”或“治疗(treating)”是指任何用于将疾病、紊乱和/或状况的一种或更多种症状或特征部分地或完全地减轻、改善、缓解、抑制、预防、延迟发作、减少严重程度和/或减少发生的方法。治疗可以对未表现出疾病、紊乱和或状况迹象的受试者施用。在一些实施方案中,为了例如减少发展与疾病、紊乱、和/或状况相关的病理学的风险的目的,治疗可以对仅表现出疾病、紊乱和或状况的早期迹象的受试者施用。
野生型:如本文使用的,术语“野生型”具有其领域内理解的含义,指的是具有如同在自然界中发现的处于“正常”(与突变、患病、改变等相对)状态或环境中的结构和/或活性的实体。本领域普通技术人员将领会的是,野生型的基因和多肽通常以多种不同的形式(例如,等位基因)存在。
附图简述
图1.由本公开内容提供的方法被展示在图1中。
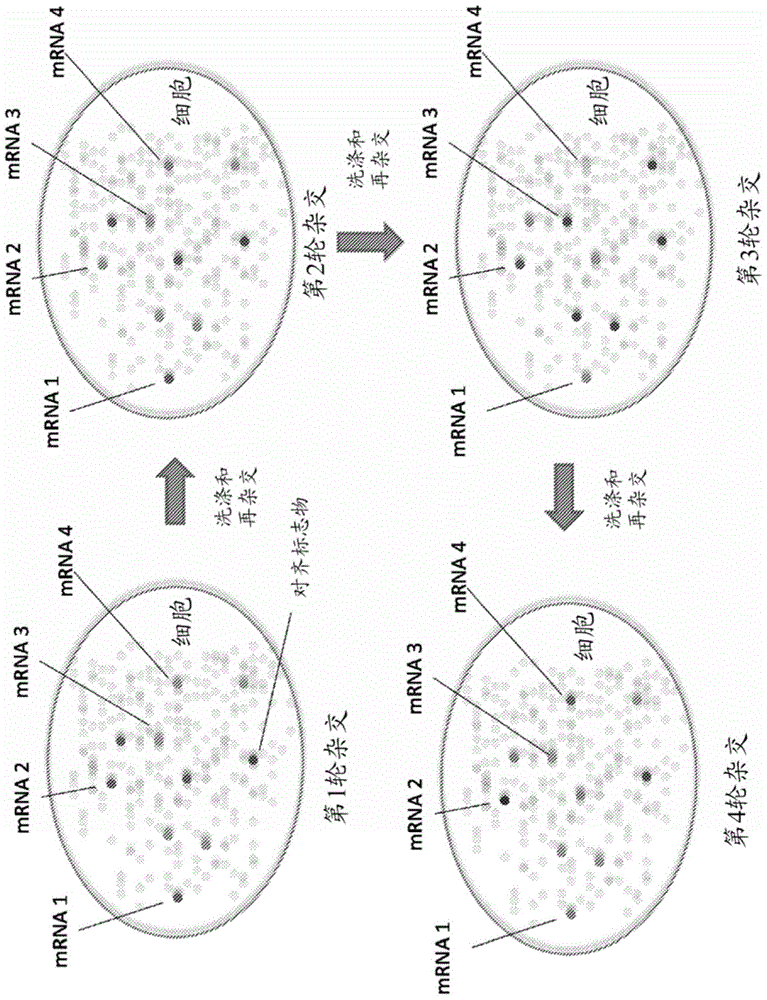
图2.所提供的方法的示例性顺序编条形码。(a)顺序编条形码的示意图。在每一轮杂交中,多种探针(例如,24种)被杂交在每一种转录物上,成像并且随后通过DNA酶I处理来剥离。可以在不同轮的杂交中使用相同的探针序列,但是探针被偶联至不同的荧光团上。(b)来自多酵母细胞上三轮杂交的复合四色FISH数据。十二个基因被2轮杂交编码,第三轮杂交利用与杂交1相同的探针进行。加框的区域在每个图像的右下角被放大。显示匹配的点并且提取条形码。非共定位的点,并非意图被理论限制,可能是由于细胞中探针的非特异性结合以及错误杂交。每个条形码的数目被定量来提供单细胞中对应的转录物的丰度。(c)示例性条形码。mRNA 1:黄-蓝-黄;mRNA 2:绿-紫-绿;mRNA 3:紫-蓝-紫;和mRNA 4:蓝-紫-蓝。
图3.顺序杂交和编条形码的示意图。(a)顺序杂交和编条形码的示意图。(b)细胞的FISH图像的示意图。在每一轮的杂交中,检测的是相同的点,但是与转录物相缔合的染料变化了。mRNA的身份被编码在杂交的染料的时间层序(temporal sequence)中。
图4.DNA酶I有效去除结合到mRNA的smFISH探针。DNA酶I有效去除结合到mRNA的smFISH探针。在抗漂白缓冲液中4小时的DNA酶I处理之前和之后,将点成像。处理之后的强度比率的平均值、中位数和STD是11.5%、8.3%和11%。在DNA酶I处理之后和之前绘制每一个点的点强度的比率。n=1084个点。
图5.DNA酶I处理之后光漂白去除残余强度。DNA酶I处理之后光漂白去除残余强度。4小时的DNA酶I处理之后通过10秒钟的激发来漂白点。漂白之后的强度比率的平均值、中位数和STD是0.03%、0.01%和0.049%。在DNA酶I处理之后和之前绘制每一个点的点强度的比率。n=1286个点。
图6.经过多轮再杂交,mRNA是稳定的。经过多轮再杂交,mRNA是稳定的。经过6次杂交绘制smRISH点的强度分布。两次杂交被重复3次以产生6次总的杂交。通过与下一个相同的杂交中的点的共定位来鉴定点。对于每一个箱形图,计数的点的数目是在191和1337之间。
图7.每个细胞中,从前两轮的杂交中鉴定的条形码在随后一轮的杂交中重新出现的比例。每个细胞中,从前两轮的杂交中鉴定的条形码在随后一轮的杂交中重新出现的比例。经过所有三次杂交通过共定位鉴定条形码。77.9±5.6%的条形码重新出现。n=37个细胞。
图8.在杂交1和杂交3中FISH点之间的逐点置换。在杂交1和杂交3中FISH点之间的逐点置换。在杂交1和杂交3中的Cy5图像中的FISH点被提取,用2D高斯(2D Gaussians)拟合。逐点的置换被示于3D直方图中。标准差是105.8nm,表明,mRNA可以在两轮杂交之间定位至100nm。n=1199个点。
图9.在相同的探针组的重复杂交之间鉴定的条形码(杂交1和杂交3)。在相同的探针组的重复杂交之间鉴定的条形码(杂交1和杂交3)。通过杂交之间的共定位鉴定条形码。每一列与一个个体细胞对应。每一行与在杂交1和杂交3之间鉴定的特定的条形码对应。加粗的行名称对应于重复的颜色条形码,其应该在杂交1和杂交3之间共定位。未加粗的行名称对应于假阳性条形码。例如,对(Alexa 532,Alexa 532)检测到了大量的条形码,表明在Alexa 532通道中点的共定位,n=37个细胞。Al532=Alexa 532。Al594=Alexa 594。Al647=Alexa 647。
图10.来自条形码提取的单细胞mRNA水平。来自条形码提取的单细胞mRNA水平。通过杂交1和杂交2之间的共定位鉴定条形码。每一列与个体细胞对应。n=37个细胞。Al532=Alexa 532。Al594=Alexa 594。Al647=Alexa 647。从顶部到底部:YLR194c、CMK2、GYP7、PMC1、NPT1、SOK2、UIP3、RCN2、DOA1、HSP30、PUN1和YPS1。
图11.在小鼠胚胎干细胞(mESC)中Nanog Alexa 647探针的DNA酶I剥离。在小鼠胚胎干细胞(mESC)中Nanog Alexa 647探针的DNA酶I剥离。在mESC中靶向Nanog的四十八个探针被杂交。通过以3单位/μL浓度的DNA酶I孵育30分钟将探针剥离。
图12.在小鼠胚胎干细胞(mESC)中Nanog mRNA的再杂交。在小鼠胚胎干细胞(mESC)中Nanog mRNA的再杂交。通过以3单位/μL浓度的DNA酶I孵育30分钟将探针剥离。Nanog Alexa 647探针被再杂交持续12小时并且将其成像。图像是产生自每1.5μm拍照一次的11个图像的z向堆叠的2D最大投射。
图13.在皮层中的β-肌动蛋白(红色)的HCR检测和在100μm冠状切片中用逆行示踪物(荧光金,绿)的可视化。完整的冠状切片在10X和60X(放大的插图)两种情况下成像。在60X的图像中,个体红点对应于单个β-肌动蛋白mRNA分子。β-肌动蛋白的表达可以通过计数荧光焦点来定量,同时检测被逆行示踪物(绿色)标记的神经元的末梢亚群。
图14.用HCR标记的可检测标记的寡核苷酸与用荧光团直接标记的smFISH探针在检测20μm脑切片中的RNA的单分子方面一样特异。HCR探针(左)和smFISH探针(右)同时靶向β-肌动蛋白并且共定位。注意HCR的改善的S/N。
图15.用HCR标记的可检测标记的寡核苷酸在20μm脑切片中良好地再杂交。HCR点在hyb1和hyb2中共定位,在两个杂交之间DNA酶处理。这显示HCR能与seqFISH方案完全整合。
图16.CLARITY与尼氏:Thy-1-eYFP小鼠大脑的1mm厚的冠状切片(前囟AP,2.3-1.3mm)被清晰化并用NeuroTrace荧光尼氏染剂(1:100稀释,48小时,RT)染色。左,运动皮层的3d冠状渲染。右,第五层运动皮层的100μm-厚的截面。箭头指示锥体神经元的顶端树突(红-尼氏荧光,绿-eYFP)。
图17.一种示例性的光片显微镜的示意图。
图18.SPIM检测在100μm CLARITY脑切片中的单个mRNA。切片被跨越100μm扫描。图像随后被配准和固定(stitch)至三维重建。图像中的衍射极限点与被HCR检测的单个β-肌动蛋白mRNA对应。比例尺是15μm。
图19.Allen Reference Atlas的连续冠状水平上的皮层躯体感觉运动(cortical somatic sensorimoto)子网络的连接图。其显示,躯体感觉运动区的四个主要组成部分(SSp、SSs、MOp和MOs)的每个,被分为4个功能域。这些功能相关的域与所有其他的广泛互联并且形成四个主要皮层躯体感觉运动子网络:口面咽(orofaciopharyngeal)(orf,蓝色)、上肢(ul,绿色)、下肢和躯干(ll/tr,红色)和须(bfd.cm&w,黄色)。数字说明切片相对前囟的位置(mm)。所提供的方法可以表征在不同的子网络内这些不同的域的每一个中的投射神经元的连通性和分子身份。
图20.用于自动地检测和绘制逆行标记的神经元和基因条形码信息的示例性信息学工作流程。A.用CTb标记(粉红色)和尼氏染色(蓝色)的原始图像。加框的区域显示CTb标记的神经元的特写镜头。B.多通道原始图像被转换成灰度图用于分割。C.通过分割管道运行个体示踪剂通道图像,所述分割管道离散地分离组织背景与标记的细胞。白点是标记的胞体(somata)的重构。D.重新集成的多画面tiff与用于配准的ARA中冠状切片相关。E.使用所提供的开发的配准软件,多重画面tiff被扭曲以将组织的轮廓和细胞结构描述两者与其对应的ARA水平对齐。F.通过分割过程提取的细胞被空间上标准化并且可以与在ARA内的层-特异性的或亚-核-特异性的ROI(sub-nucleus-specific)相关联。G.分割的和配准的标记重建,以及其伴随的seqFISH数据,在iConnectome FISH查看器上公众可得。分析选项卡提供了关于注射部位、示踪剂类型、由ROI标记的细胞的数量的信息,这可以进一步解释层特异性的细胞计数和细胞的基因表达。
图21.利用核酸外切酶III(Exo III)的杂交链式反应(HCR)再杂交。(a)桥接链和HCR聚合物的exoIII消化的图示。ExoIII以3’到5’方向消化桥接链和HCR聚合物为dNMP,留下中间探针链结合至靶(例如,mRNA)的。可以随后将新的桥接链杂交至具有不同的起始序列的靶结合探针,所述起始序列起始不同发夹组与不同的荧光染料的聚合。(b)阐释(a)中显示的示意图在T3T小鼠成纤维细胞系中使用抗β-肌动蛋白(Actb)转录物的探针的应用的原始数据。
图22.使用Lambda核酸外切酶(λ-exo)的杂交链式反应(HCR)再杂交。(a)桥接链的λ-exo消化的图示。λ-exo以5’至3’的方向选择性消化5’磷酸化的桥接链,从结合至靶(例如,mRNA)的中间探针释放HCR聚合物。释放的聚合物被洗涤缓冲液洗掉。可以随后将新的桥接链杂交至具有不同的起始序列的靶结合探针,所述起始序列起始不同发夹组与不同的荧光染料的聚合。(b)阐释(a)中显示的示意图在T3T小鼠成纤维细胞系中使用抗β-肌动蛋白(Actb)转录物的探针的应用的原始数据。
图23.使用尿嘧啶-特异性的切除试剂(USER)的杂交链式反应(HCR)再杂交。(a)桥接链的USER消化的图示。USER选择性消化在桥接链中的脱氧尿苷核苷酸,导致桥接链变得片段化。片段随后从中间探针链上解离,从结合至靶(例如,mRNA)的探针释放HCR聚合物。释放的聚合物被洗涤缓冲液洗掉。可以随后将新的桥接链杂交至具有不同的起始序列的靶结合探针,所述起始序列起始不同发夹组与不同的荧光染料的聚合。(b)阐释(a)中显示的示意图在T3T小鼠成纤维细胞系中使用抗β-肌动蛋白(Actb)转录物的探针的应用的原始数据。
图24.使用互补的寡核苷酸(cTOE)的可检测标记的寡核苷酸的示例性去除。
图25.示例性寡核苷酸制备。原始寡核苷酸(如在本图中示范的,探针)文库包含若干个探针亚文库。每个亚文库具有特定组的引物,其可以被用于利用PCR扩增亚文库。当期望的亚文库被扩增,将产物与切口酶一起孵育。酶在探针链上的识别位点切割磷酸二酯键。将所得产物变性,并且使其在变性凝胶上运行,允许所需的探针序列被释放。可以随后从凝胶切掉探针条带并且将其提取。所提取的产物可用于杂交。
图26.示例性寡核苷酸制备。产物是凝胶上的第三个条带。该文库具有与其相关的许多不同的引物,一个引物组用于每个亚组的探针。示例性引物是随机的20个核苷酸序列,具有45-55%的GC含量和大约55℃的Tm。切口核酸内切酶位点是GTCTCNN;对应的缺口核酸内切酶是Nt.BsmAI。产物探针是与具有45-55%的GC含量的感兴趣的mRNA互补的20聚体DNA序列。
某些实施方案的详细描述
除了其他以外,本发明提供了用于细胞中的核酸(例如,转录物和/或DNA基因座)谱分析的新的方法、组合物和/或试剂盒。
在一些实施方案中,本发明提供了用于细胞中的核酸(例如,转录物和/或DNA基因座)谱分析的方法。在一些实施方案中,所提供的方法对单一细胞中的多个靶进行谱分析。所提供的方法可以,除了其他以外,通过顺序编条形码用有限数目的可检测标记对大量靶(转录物、DNA基因座或其组合)谱分析。
图1示出了根据本发明的方法。如所示出的,本发明提供了这样的方法:其中用标记的探针的多轮杂交(接触步骤)对细胞中存在的核酸(例如,mRNA)谱分析。特别地,如图1中所示出的,提供了与细胞中的核酸靶杂交的探针的组,其中在单个组内标记探针(即,与不同靶杂交的可检测地标记的寡核苷酸)并且,此外,在不同的组中至少一个探针被不同地标记。
在一些实施方案中,本发明(例如,如在图1中所展示的),提供了包括以下步骤的方法:
(a)进行第一接触步骤,所述第一接触步骤包括使包含多种转录物和DNA基因座的细胞与第一多种可检测地标记的寡核苷酸接触,所述第一多种可检测地标记的寡核苷酸的每种靶向转录物或DNA基因座并且被可检测部分标记,因此组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一转录物或DNA基因座并且被第一可检测部分标记;和
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二转录物或DNA基因座并且被第二可检测部分标记;
(b)在第一接触步骤之后对细胞成像,检测所述第一多种的寡核苷酸与其靶的杂交;
(c)进行第二接触步骤,所述第二接触步骤包括使所述细胞与第二多种可检测地标记的寡核苷酸接触,所述第二多种包含靶向被所述第一多种靶向的重叠转录物和/或DNA基因座的寡核苷酸,因此所述第二多种至少包含:
(i)第三寡核苷酸,所述第三寡核苷酸任任选地在序列上与所述第一寡核苷酸相同,所述第三寡核苷酸任靶向所述第一转录物或DNA基因座;和
(ii)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与所述第二寡核苷酸相同,所述第四寡核苷酸靶向所述第二转录物或DNA基因座,其中所述第二多种与第一多种的不同在于存在于所述第二多种中的寡核苷酸的至少一种被与所述第一多种中靶向相同转录物或DNA基因座的对应寡核苷酸不同的可检测部分标记,因此在所述第二多种中:
(iii)所述第三寡核苷酸被所述第一可检测部分、所述第二可检测部分或第三可检测部分标记;并且
(iv)所述第四寡核苷酸被所述第一可检测部分、所述第二可检测部分、所述第三可检测部分或第四可检测部分标记,
其中所述第三寡核苷酸被与第一寡核苷酸所用的不同的可检测部分标记,或第四寡核苷酸被与第二寡核苷酸所用的不同的可检测部分标记,或两者;
(d)在所述第二接触步骤之后对细胞成像,以便检测所述第二多种的寡核苷酸与其靶的杂交;以及
(e)任选地重复所述接触和成像步骤,每次用新的多种可检测地标记的寡核苷酸,所述新的多种可检测地标记的寡核苷酸包含靶向被所述第一多种和第二多种靶向的重叠转录物或DNA基因座的寡核苷酸,其中由于标记靶向相同转录物或DNA基因座的核苷酸的可检测部分上的至少一种差异,所利用的每个多种与所利用的每个其他的多种不同。
如本文使用的,可检测地标记的寡核苷酸被可检测部分标记。在一些实施方案中,可检测地标记的寡核苷酸包含一个可检测部分。在一些实施方案中,可检测地标记的寡核苷酸包含两个或更多个可检测部分。在一些实施方案中,可检测地标记的寡核苷酸具有一个可检测部分。在一些实施方案中,可检测地标记的寡核苷酸具有两个或更多个可检测部分。
在一些实施方案中,可检测部分是荧光团或包含荧光团。标记有荧光团、的示例性可检测地标记的寡核苷酸包括但不局限于用于荧光原位杂交(FISH)的探针。如本领域普通技术人员所广泛已知并实践的,FISH被用于,除了其他以外,检测和定位特定DNA序列或RNA靶的存在或不存在。用于设计和制备经标记的可检测地标记的寡核苷酸的方法在本领域是广泛地已知的,包括但不局限于在美国专利申请公布US20120142014中所描述的那些方法。但是,由于诸如荧光团可得性的限制,FISH仅能够被用于对给定的实验中的有限数目的靶谱分析。通过对多种不同的靶顺序编条形码,本发明所提供的方法能够对大量靶、多达FN个,谱分析,其中F是可检测部分(在FISH的情况中,荧光团)的类型的数目,并且N是接触步骤(在FISH的情况中,杂交)的数目。例如,当F是4且N是8时,几乎整个转录组(48=65,536)可被谱分析。在一些实施方案中,F至少是2。在一些实施方案中,F是3。在一些实施方案中,F是4。在一些实施方案中,F是5。在一些实施方案中,F是6。在一些实施方案中,F是7。在一些实施方案中,F是8。在一些实施方案中,F是9。在一些实施方案中,F是10。在一些实施方案中,F是11。在一些实施方案中,F是12。在一些实施方案中,F是13。在一些实施方案中,F是14。在一些实施方案中,F是15。在一些实施方案中,F大于15。在一些实施方案中,N是2。在一些实施方案中,N大于2。在一些实施方案中,N是3。在一些实施方案中,N大于3。在一些实施方案中,N是4。在一些实施方案中,N大于4。在一些实施方案中,N是5。在一些实施方案中,N大于5。在一些实施方案中,N是6。在一些实施方案中,N大于6。在一些实施方案中,N是7。在一些实施方案中,N大于7。在一些实施方案中,N是8。在一些实施方案中,N大于8。在一些实施方案中,N是9。在一些实施方案中,N大于9。在一些实施方案中,N是10。在一些实施方案中,N大于10。在一些实施方案中,多种可检测地标记的寡核苷酸靶向至少100个靶。
在接触步骤中,可以在可检测地标记的寡核苷酸与其靶结合之前、同时或之后对其标记。在一些实施方案中,可检测地标记的寡核苷酸,诸如标记荧光团的寡核苷酸,在其与其靶结合之前被标记。在一些实施方案中,可检测地标记的寡核苷酸,在其与其靶结合的同时被标记。在一些实施方案中,可检测地标记的寡核苷酸,在其与其靶结合之后被标记。在一些实施方案中,可检测地标记的寡核苷酸在杂交之后通过用杂交链式反应(HCR)正交扩增而被标记(Choi,HM.,Nat Biotechnol.201011月;28(ll):1208-12)。在一些实施方案中,可检测地标记的寡核苷酸包含部分,例如核酸序列,能够在成像步骤中提供信号的该一个或更多个部分可以直接或间接地与寡核苷酸连接。
在一些实施方案中,可以将相同类型的标签附连到针对不同靶的不同探针。在一些实施方案中,在接触步骤中使用的多种可检测地标记的寡核苷酸中,针对相同靶的探针具有相同的标签(一组可检测地标记的寡核苷酸)。在数轮接触和成像后,每个靶具有其自身独特的标签组合(顺序编条形码),因此可以获得靶的信息,例如,数量信息和/或空间信息。例如,当荧光团被用于标记可检测地标记的寡核苷酸时,N个步骤后,靶会具有顺序条形码F1F2……FN,其中Fn是在第n次成像中用于靶的荧光团的颜色。由于它们的条形码的不同(例如,红红蓝红与红红红蓝比较),可将一个靶与另一个区分开。
在一些实施方案中,本发明的标签是或包含一种或更多种荧光染料,包括但不局限于荧光素、罗丹明、Alexa Fluor类、Dylight Fluor类、ATTO类染料或其任何类似物或衍生物。
在一些实施方案中,本发明的标签包括但不局限于荧光素和荧光素的化学衍生物;曙红;羧基荧光素;异硫氰酸荧光素(FITC);荧光素酰胺(Fluorescein amidite)(FAM);赤藓红;玫瑰红;从细菌铜绿假单胞菌(Pseudomonas aeruginosa)分泌的荧光素;亚甲基蓝;激光染料、罗丹明类染料(例如,罗丹明、罗丹明6G、罗丹明B、罗丹明123、金胺O、磺酰罗丹明101、磺酰罗丹明B和德克萨斯红)。
在一些实施方案中,本发明的标签包括但不局限于ATTO类染料;吖啶类染料(例如,吖啶橙、吖啶黄);Alexa Fluor;7-氨基放线菌素D;8-苯胺基萘-l-磺酸盐;金胺-罗丹明染料;苯并蒽酮;5,12-双(苯乙炔基)并四苯;9,10-双(苯乙炔基)蒽;Blacklight paint;脑虹(Brainbow);钙黄绿素;羧基荧光素;羧基二乙酸荧光素琥珀酰亚胺酯;羧基荧光素琥珀酰亚胺酯;l-氯-9,10-双(苯乙炔基)蒽;2-氯-9,10-双(苯乙炔基)蒽;2-氯-9,10-二苯基蒽;香豆素;花菁类染料(例如,花菁诸如Cy3和Cy5、DiOC6、SYBR Green I);DAPI、Dark quencher、Dylight Fluor、Fluo-4、FluoProbes;荧光酮类染料(例如,钙黄绿素、羧基荧光素、羧基二乙酸荧光素琥珀酰亚胺酯、羧基荧光素琥珀酰亚胺酯、曙红、曙红B、曙红Y、赤藓红、荧光素、异硫氰酸荧光素、荧光素酰胺、印度黄、汞溴红);Fluoro-Jade染料;Fura-2;Fura-2-乙酰氧基甲酯;绿色荧光蛋白、Hoechst染料、印度黄、Indo-1、荧光黄、萤光素、部花菁、光增白剂、噁嗪类染料(例如,甲酚紫、尼罗蓝、尼罗红);苝;菲啶类染料(溴化乙锭和碘化丙啶);焰红染料、藻胆素、藻红蛋白、藻红素、8-羟基-1,3,6-三磺酸芘(Pyranine)、罗丹明、罗丹明123、罗丹明6G、RiboGreen、RoGFP、红荧烯、SYBR Green I、(E)-二苯乙烯、(Z)-二苯乙烯、磺酰罗丹明101、磺酰罗丹明B、Synapto-pHluorin、四苯基丁二烯、四钠三(红菲绕啉二磺酸)钌(II)(Tetrasodium tris(bathophenanthroline disulfonate)ruthenium(II))、德克萨斯红、TSQ、伞形花内酯或黄色荧光蛋白。
在一些实施方案中,本发明的标签包括但不局限于荧光染料的Alexa Fluor家族(Molecular Probes,Oregon)。在荧光显微术和细胞生物学中,Alexa Fluor类染料被广泛地用作细胞和组织标记。Alexa Fluor系列的激发和发射光谱覆盖可见光谱并且延伸至红外光谱。大致地根据该家族的个体成员的最大激发(以nm)将其编号。某些Alexa Fluor类染料通过香豆素、罗丹明、呫吨(诸如荧光素)和花菁类染料的磺化合成。在一些实施方案中,磺化使Alexa Fluor类染料带负电荷并且具亲水性。在一些实施方案中,Alexa Fluor类染料比具有相当的激发和发射的普通染料(例如,荧光素、罗丹明)更稳定、更明亮并且对pH更不敏感,并且在某种程度上来讲是较新的花菁系列。示例性Alexa Fluor类染料包括但不局限于Alexa-350、Alexa-405、Alexa-430、Alexa-488、Alexa-500、Alexa-514、Alexa-532、Alexa-546、Alexa-555、Alexa-568、Alexa-594、Alexa-610、Alexa-633、Alexa-647、Alexa-660、Alexa-680、Alexa-700或Alexa-750。
在一些实施方案中,本发明的标记包括荧光类染料的DyLight Fluor家族的一种或更多种(Dyomics and Thermo Fisher Scientific)。示例性Alexa Fluor家族染料包括但不局限于DyLight-350、DyLight-405、DyLight-488、DyLight-549、DyLight-594、DyLight-633、DyLight-649、DyLight-680、DyLight-750或DyLight-800。
在一些实施方案中,可检测部分是或包含纳米材料。在一些实施方案中,可检测部分是或包含纳米颗粒。在一些实施方案中,可检测部分是或包含量子点。在一些实施方案中,可检测部分是量子点。在一些实施方案中,可检测部分包含量子点。在一些实施方案中,可检测部分是或包含金纳米颗粒。在一些实施方案中,可检测部分是金纳米颗粒。在一些实施方案中,可检测部分包含金纳米颗粒。
在一些实施方案中,本领域技术人员理解在特定的循环中特定探针的标记的选择可以基于多种因素来确定,所述多种因素包括,例如,大小、所产生的信号的类型、附连至或并入探针的方式、细胞组分的性质包括细胞组分在细胞内的位置、细胞的性质、被分析的相互作用的类型等等。
例如,在一些实施方案中,探针用Cy3或Cy5标记,Cy3或Cy5被合成为携带N-羟基琥珀酰亚胺酯(NHS-酯)反应性基团。由于NHS-酯容易地与脂肪胺基团反应,所以核苷酸可以用氨基烷基修饰。这可以通过在合成反应期间并入氨基烷基修饰的核苷酸进行。在一些实施方案中,每60个碱基使用一个标签以避免猝灭作用。
可检测地标记的寡核苷酸可以与靶杂交,所述靶例如转录物或DNA基因座。在一些实施方案中,靶是或包含转录物。在一些实施方案中,靶是转录物。在一些实施方案中,转录物是RNA。在一些实施方案中,转录物是mRNA。在一些实施方案中,转录物是tRNA。在一些实施方案中,转录物是rRNA。在一些实施方案中,转录物是snRNA。在一些实施方案中,RNA是非编码RNA。示例性非编码RNA类型在本领域是广泛已知的,包括但不局限于长非编码RNA(lncRNA)、微小RNA(miRNA)、短干扰RNA(siRNA)、piwi相互作用RNA(piRNA)、核仁小RNA(snoRNA)和其他短RNA。在一些实施方案中,RNA是IncRNA。在一些实施方案中,RNA是miRNA。在一些实施方案中,RNA是piRNA。在一些实施方案中,RNA是snoRNA。
在一些实施方案中,靶是或包含DNA基因座。在一些实施方案中,当靶是DNA基因座时,可检测地标记的寡核苷酸任选地包含一个或更多个RNA核苷酸或RNA区段。可检测地标记的寡核苷酸包含在成像之后可以被选择性地去除而不降解DNA靶的RNA序列,例如,通过RNA特异性酶消化去除。特异性降解RNA而不降解DNA的示例性酶包括但不局限于多种RNA酶,诸如RNA酶A和RNA酶H。
在一些实施方案中,可检测地标记的寡核苷酸与其靶例如转录物或DNA基因座直接地杂交。在一些实施方案中,可检测地标记的寡核苷酸通过与一个或更多个中间物结合或杂交来与其靶特异性相互作用(特异性识别其靶),所述一个或更多个中间物(例如寡核苷酸)与靶结合、杂交或以其他方式特异性地连接。在一些实施方案中,中间寡核苷酸以突出端与其靶杂交,因此具有互补序列的第二寡核苷酸(“桥接寡核苷酸”或“桥接探针”)可以与所述中间寡核苷酸结合。在一些实施方案中,中间物靶向核酸并且任选地被可检测部分标记,并且在与靶杂交之后包含突出端序列。在一些实施方案中,中间物包含与靶杂交的序列、突出端序列、和任选地可检测部分。在一些实施方案中,中间物包含与靶杂交的序列和突出端序列。在一些实施方案中,中间物不具有可检测部分。在一些实施方案中,第二寡核苷酸是可检测地标记的寡核苷酸。在一些实施方案中,第二可检测地标记的寡核苷酸被染料标记。在一些实施方案中,可检测地标记的寡核苷酸被HCR聚合物标记。在一些实施方案中,贯穿多次接触、去除和/或成像步骤,中间寡核苷酸保持与靶结合;在接触和成像步骤中通过可检测标签的组合来提供顺序条形码,所述可检测标签通过桥接探针与中间寡核苷酸连接。例如,当可检测地标记的寡核苷酸被用作桥接探针时,通过可检测地标记的寡核苷酸提供条形码,所述可检测地标记的寡核苷酸通过它们的突出端序列与中间寡核苷酸杂交。在成像步骤之后,桥接寡核苷酸被任选地如本文描述的去除。在一些实施方案中,对于一个靶采用1个中间寡核苷酸。在一些实施方案中,对于一个靶采用2个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用3个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用4个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用5个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用6个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用7个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用8个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用9个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用10个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用11个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用12个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用13个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用14个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用15个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用16个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用17个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用18个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用19个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用20个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用21个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用22个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用23个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用24个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用25个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用30个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用40个或更多个中间寡核苷酸。在一些实施方案中,对于一个靶采用50个或更多个中间寡核苷酸。
在一些实施方案中,每种中间寡核苷酸与靶的一个不同序列杂交。在一些实施方案中,靶的每种中间寡核苷酸包含相同的突出端序列。在一些实施方案中,针对靶的每种可检测地标记的寡核苷酸包含与靶的所有中间寡核苷酸共有的相同突出端序列互补的相同的序列。在一些实施方案中,中间寡核苷酸包含与靶互补的序列和与可检测地标记的寡核苷酸互补的序列。
在一些实施方案中,所提供的方法还包括以下步骤:
(f)进行接触步骤,所述接触步骤包括使包含多种核酸的细胞与多种中间寡核苷酸接触,所述多种中间寡核苷酸的每种:
(i)靶向核酸并任选地被可检测部分标记;并且
(ii)在与靶杂交后包含突出端序列;以及
(g)任选地对细胞成像,以便检测中间寡核苷酸与其靶之间的相互作用。
在一些实施方案中,步骤(f)和任选步骤(g)在步骤(a)之前进行。在一些实施方案中,步骤(f)是被进行的步骤(a)。在一些实施方案中,去除步骤保留中间寡核苷酸。
在一些实施方案中,所提供的技术被用于对由于剪接变异、RNA编辑、寡核苷酸修饰或其组合形成的不同转录物谱分析。在一些实施方案中,靶是RNA剪接变体。在一些实施方案中,所提供的技术对基因的一种或更多种剪接变体例如基因的一种或更多种剪接变体的位置和数量谱分析。在一些实施方案中,所提供的方法或组合物对不同的剪接变体谱分析。在一些实施方案中,包含一种或更多种变体的外显子通过顺序杂交和编条形码而被靶向并编条形码。在一些实施方案中,剪接变体包含由剪接得到的一个或更多个可区分的序列,并且此类序列被靶向。在一些实施方案中,通过靶向外显子和/或可区分的序列,所提供的技术能够对一种或更多种特定的剪接变体或mRNA的整个剪接库(splicing repertoire)谱分析。如本领域所广泛已知的,mRNA剪接对许多生物过程和疾病是重要的,例如,神经系统疾病,如自闭症或唐氏综合征。负责细胞间粘附和突触发生的分子被剪接并且已知在大脑中它们的缺损产生错误传送(miswiring)并导致疾病。
在一些实施方案中,可检测地标记的寡核苷酸靶向由序列编辑、化学修饰和/或其组合导致的序列修饰。在一些实施方案中,任选地在转化过程后,修饰的核酸靶与未修饰的靶相比与一种或更多种不同的互补序列杂交,并且利用选择性与修饰的核酸杂交的一种或更多种寡核苷酸而被谱分析。在一些实施方案中,靶是通过RNA编辑的RNA(Brennicke,A.,A.Marchfelder,等人.(1999)."RNA editing".FEMS Microbiol Rev 23(3):297-316)。在一些实施方案种,所提供的技术对通过RNA编辑形成的不同RNA变体谱分析。在一些实施方案种,所述提供的技术对修饰的寡核苷酸谱分析。在一些实施方案中,所提供的技术对甲基化的RNA谱分析(Song CX,Yi C,He C.Mapping recently identified nucleotide variants in the genome and transcriptome.Nat Biotechnol.2012 11月;30(l 1):1107-16)。在某些实施方案中,所提供的技术对甲基化的DNA谱分析。在一些实施方案中,靶是单核苷酸多态性(SNP)。
在一些实施方案中,通过对靶谱分析,所提供的技术,除了其他以外,提供在一些情况中在单一细胞、组织、器官或生物体中的靶的数量和/或位置的信息。在一些实施方案中,转录物的谱分析可被用来定性地和/或定量地界定细胞、组织、器官或生物体内基因表达的时空模式。
在一些实施方案中,一组中的每种可检测地标记的寡核苷酸具有不同的靶,例如,转录物或DNA基因座。在一些实施方案中,一组中的两种或更多种可检测地标记的寡核苷酸具有相同的靶。在一些实施方案中,两种或更多种可检测地标记的寡核苷酸靶向相同的转录物。在一些实施方案中,两种或更多种可检测地标记的寡核苷酸靶向相同的DNA基因座。在一些实施方案中,约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、50、60、70、80、90或100种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,两种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,5种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,10种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,15种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,20种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,25种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,30种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,35种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,40种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,45种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,50种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,60种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,70种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,80种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,90种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,100种或更多种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约1-10种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约5-15种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约10-20种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约15-25种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约20-30种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约25-35种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约30-40种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约35-45种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约40-50种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约45-55种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约50-70种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约60-80种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约70-90种可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,约80-100种可检测地标记的寡核苷酸靶向相同的靶。
在一些实施方案中,除了其他以外,对相同的靶使用多种可检测地标记的寡核苷酸增加信号强度。在一些实施方案中,靶向相同靶的组中的每种可检测地标记的寡核苷酸与靶的不同部分相互作用。
在一些实施方案中,在一组中针对靶的所有可检测地标记的寡核苷酸具有相同的可检测部分。在一些实施方案中,所有可检测地标记的寡核苷酸以相同的方式被标记。在一些实施方案中,针对靶的所有可检测地标记的寡核苷酸具有相同的荧光团。
在一些实施方案中,针对靶的可检测地标记的寡核苷酸定位在靶的被靶向区域内。被靶向区域可以具有多种长度。在一些实施方案中,被靶向区域的长度为约20bp。在一些实施方案中,被靶向区域的长度为约30bp。在一些实施方案中,被靶向区域的长度为约40bp。在一些实施方案中,被靶向区域的长度为约50bp。在一些实施方案中,被靶向区域的长度为约60bp。在一些实施方案中,被靶向区域的长度为约80bp。在一些实施方案中,被靶向区域的长度为约100bp。在一些实施方案中,被靶向区域的长度为约150bp。在一些实施方案中,被靶向区域的长度为约200bp。在一些实施方案中,被靶向区域的长度为约250bp。在一些实施方案中,被靶向区域的长度为约300bp。在一些实施方案中,被靶向区域的长度为约350bp。在一些实施方案中,被靶向区域的长度为约400bp。在一些实施方案中,被靶向区域的长度为约450bp。在一些实施方案中,被靶向区域的长度为约500bp。在一些实施方案中,被靶向区域的长度为约600bp。在一些实施方案中,被靶向区域的长度为约700bp。在一些实施方案中,被靶向区域的长度为约800bp。在一些实施方案中,被靶向区域的长度为约900bp。在一些实施方案中,被靶向区域的长度为约1,000bp。在一些实施方案中,针对靶的可检测地标记的寡核苷酸被定位为在靶上邻近彼此。
如本领域普通技术人员所理解的,不同的技术可以被用于成像步骤。示例性方法包括但不局限于落射荧光显微术、共聚焦显微术、不同类型的超分辨率显微术(PALM/STORM、SSIM/GSD/STED)和光片照明显微术(SPIM等)。
示例性超分辨率技术包括但不局限于I5M和4Pi-显微术、受激发射损耗显微术(STEDM)、基态损耗显微术(GSDM)、空间结构照明显微术(SSIM)、光激活定位显微术(PALM)、可逆饱和光线性荧光跃迁(RESOLFT)、全内反射荧光显微镜(TIRFM)、荧光-PALM(FPALM)、随机光学重建显微术(STORM)、一纳米精度的荧光成像(FIONA)及其组合。例如:Chi,2009"Super-resolution microscopy:breaking the limits,Nature Methods 6(1):15-18;Blow 2008,"New ways to see a smaller world,"Nature 456:825-828;Hell,等人,2007,"Far-Field Optical Nanoscopy,"Science 316:1153;R.Heintzmann和G.Ficz,2006,"Breaking the resolution limit in light microscopy,"Briefings in Functional Genomics and Proteomics 5(4):289-301;Garini等人,2005,"From micro to nano:recent advances in high-resolution microscopy,"Current Opinion in Biotechnology 16:3-12;和Bewersdorf等人,2006,"Comparison of I5M and 4Pi-microscopy,"222(2):105-117;和Wells,2004,"Man the Nanoscopes,"JCB 164(3):337-340。
在一些实施方案中,使用电子显微镜(EM)。
在一些实施方案中,成像步骤检测靶。在一些实施方案中,成像步骤定位靶。在一些实施方案中,成像步骤提供靶的三维空间信息。在一些实施方案中,成像步骤定量靶。通过使用多次接触和成像步骤,所提供的方法能够以出乎意料的高通量对大量的靶提供空间信息和/或数量信息。例如,当使用F种可检测的不同类型的标签时,在N次接触和成像步骤之后可以获得规模多达FN个靶的空间信息和/或数量信息。
在一些实施方案中,所提供的方法包括在接触和/或成像步骤之前或之后的另外的步骤。在一些实施方案中,所提供的方法在每个成像步骤之后包括去除多种可检测地标记的寡核苷酸的步骤。在一些实施方案中,去除步骤包括降解可检测地标记的寡核苷酸。在一些实施方案中,去除步骤不显著地降解靶,使得如果期望,能靶可用于下一轮接触和/或成像步骤。在一些实施方案中,去除步骤包括使多种可检测地标记的寡核苷酸与消化可检测地标记的寡核苷酸的酶接触。在一些实施方案中,去除步骤包括使可检测地标记的寡核苷酸与DNA酶或RNA酶接触。例如,在一些实施方案中,可检测地标记的寡核苷酸包含DNA序列并且DNA酶被用于其的降解;在一些其他的实施方案中,可检测地标记的寡核苷酸包含RNA序列并且RNA酶被用于其的降解。在一些实施方案中,去除步骤包括降解可检测部分。在一些实施方案中,去除步骤包括光漂白。
在一些实施方案中,一组可检测地标记的寡核苷酸的靶还是另一组的靶。在一些实施方案中,一组可检测地标记的寡核苷酸的靶与另一组的靶重叠。在一些实施方案中,重叠多于10%。在一些实施方案中,重叠多于20%。在一些实施方案中,重叠多于30%。在一些实施方案中,重叠多于40%。在一些实施方案中,重叠多于50%。在一些实施方案中,重叠多于60%。在一些实施方案中,重叠多于70%。在一些实施方案中,重叠多于80%。在一些实施方案中,重叠多于90%。在一些实施方案中,重叠多于91%。在一些实施方案中,重叠多于92%。在一些实施方案中,重叠多于93%。在一些实施方案中,重叠多于94%。在一些实施方案中,重叠多于90%。在一些实施方案中,重叠多于95%。在一些实施方案中,重叠多于96%。在一些实施方案中,重叠多于97%。在一些实施方案中,重叠多于98%。在一些实施方案中,重叠多于99%。在一些实施方案中,重叠多于99.5%。在一些实施方案中,重叠多于99.6%。在一些实施方案中,重叠多于99.7%。在一些实施方案中,重叠多于99.8%。在一些实施方案中,重叠多于99.9%。在一些实施方案中,重叠是100%。在一些实施方案中,一组可检测地标记的寡核苷酸的靶与另一组的靶相同。在一些实施方案中,每组可检测地标记的寡核苷酸靶向相同的靶。
在一些实施方案中,在第二接触步骤中靶向第一转录物或DNA基因座(第一靶)的第三可检测地标记的寡核苷酸任选地与靶向第一转录物或DNA基因座的第一可检测地标记的寡核苷酸具有相同的序列。在一些实施方案中,序列是相同的。在一些实施方案中,序列是不同的。相似地,在一些实施方案中,在第二接触步骤中靶向第二转录物或DNA基因座(第一靶)的第四可检测地标记的寡核苷酸任选地与靶向第一转录物或DNA基因座的第二可检测地标记的寡核苷酸具有相同的序列。在一些实施方案中,序列是相同的。在一些实施方案中,序列是不同的。
在一些实施方案中,第二多种与第一多种的不同在于存在于第二多种中的寡核苷酸的至少一种被与第一多种中的靶向相同的转录物或DNA基因座的对应寡核苷酸不同的可检测部分标记。在一些实施方案中,多种可检测地标记的寡核苷酸的每个多种与另一多种的不同在于存在于一个多种的至少一种寡核苷酸被与在另一多种中的靶向相同的转录物或DNA基因座的对应寡核苷酸不同的可检测部分标记。
在一些实施方案中,可检测地标记的寡核苷酸具有[S]-[L]结构,其中[S]是寡核苷酸序列,[L]是可检测部分或可检测部分的组合。在一些实施方案中,[L]包含多个单位的可检测标记的,例如荧光团,所述多个单位的每个独立地与寡核苷酸序列例如[S]的一个或更多个核苷部分缔合。在一些实施方案中,附连至相同的可检测地标记的寡核苷酸的每种可检测标记提供相同的可检测信号。在一些实施方案中,附连至相同寡核苷酸序列的所有可检测标记是相同的。
在一些实施方案中,在两组或更多组可检测地标记的寡核苷酸之中靶向相同的靶的寡核苷酸具有相同的序列组,即,在可检测地标记的寡核苷酸之间的差异,如果存在,在可检测部分内,而不是序列内。例如,在一组可检测地标记的寡核苷酸中,靶向第一靶的可检测地标记的寡核苷酸都具有相同的可检测部分,或检测部分的组合[L]1:
[S]1-[L]1、[S]2-[L]1、……、[S]n-[L]1,其中n是针对靶的可检测地标记的寡核苷酸的数目,例如,3-50的整数;
在另一组可检测地标记的寡核苷酸中,其中靶向相同的靶的寡核苷酸被不同地标记,靶向相同靶的寡核苷酸具有相同的寡核苷酸序列组([S]1、[S]2、……、[S]n),还有一个不同的[L]2:
[S]1-[L]2、[S]2-[L]2、……、[S]n-[L]2,其中[L]1被与[L]2不同地检测。
为了示例本发明的某些实施方案,以下提供了两步骤、两标记、4靶(FN=22=4)过程,其中靶向每组中的相同靶的所有可检测地标记的寡核苷酸独立地具有相同的可检测部分:
步骤1.使靶与第一多种(P1)可检测地标记的寡核苷酸接触:
靶T1:[S]P1-T1-1[L]1、[S]P1-T1-2[L]1、[S]P1-T1-3[L]1、……、[S]P1-T1-P1T1[L]1,其中P1T1是第一多种中靶向T1的可检测地标记的寡核苷酸的数目,并且[L]1是第一可检测标记;
靶T2:[S]P1-T2-1[L]1、[S]P1-T2-2[L]1、[S]P1-T2-3[L]1、……、[S]P1-T2-P1T2[L]1,其中P1T2是第一多种中靶向T2的可检测地标记的寡核苷酸的数目;
靶T3:[S]P1-T3-1[L]2、[S]P1-T3-2[L]2、[S]P1-T3-3[L]2、……、[S]P1-T3-PIT3[L]2,其中P1T3是第一多种中靶向T3的可检测地标记的寡核苷酸的数目,并且[L]2是与[L]1不同的可检测的标记;
靶T4:[S]P1-T4-1[L]2、[S]P1-T4-2[L]2、[S]P1-T4-3[L]2、……、[S]P1-T4-PIT4[L]2,其中P1T4是第一多种中靶向T4的可检测地标记的寡核苷酸的数目。
步骤2:成像;
步骤3:从靶去除P1;
步骤4:使靶与第二多种(P2)可检测地标记的寡核苷酸接触:
靶T1:[S]P2-T1-1[L]1、[S]P2-T1-2[L]1、[S]P2-T1-3[L]1、……、[S]P2-T1-P2T1[L]1,其中P2T1是第二多种中靶向T1的可检测地标记的寡核苷酸的数目;
靶T2:[S]P2-T2-1[L]2、[S]P2-T2-2[L]2、[S]P2-T2-3[L]2、……、[S]P2-T2-P2T2[L]2,其中P2T2是第二多种中靶向T2的可检测地标记的寡核苷酸的数目;
靶T3:[S]P2-T3-1[L]1、[S]P2-T3-2[L]1、[S]P2-T3-3[L]1、……、[S]P2-T3-P2T3[L]1,其中P2T3是第二多种中靶向T3的可检测地标记的寡核苷酸的数目;
靶T4:[S]P2-T4-1[L]2、[S]P2-T4-2[L]2、[S]P2-T4-3[L]2、……、[S]P2-T4-P2T4[L]2,其中P2T4是第二多种中靶向T4的可检测地标记的寡核苷酸的数目。
步骤5:成像。
在两次成像步骤之后,每种靶具有其自身独特的顺序条形码:
T1:[L]1[L]1;
T2:[L]1[L]2;
T3:[L]2[L]1;并且
T4:[L]2[L]2。
在一些实施方案中,另外的条形码,也可以使用Tl--、Τ2--、--Tl、--T2,其中--指示对于该步骤没有信号。
在以上示例性过程中,P1T1、P1T2、P1T3、P1T4、P2T1、P2T2、P2T3和P2T4的每个独立地是自然数(大于0的整数)。在一些实施方案中,P1T1=P2T1。在一些实施方案中,P1T2=P2T2。在一些实施方案中,P1T3=P2T3。在一些实施方案中,P1T4=P2T4。在一些实施方案中,一种可检测地标记的寡核苷酸被用于靶。在一些实施方案中,两种或更多种可检测地标记的寡核苷酸被用于靶。
在一些实施方案中,在每个多种中靶向相同靶的可检测地标记的寡核苷酸具有相同的序列组。例如,对于在以上实例中的靶T1,[S]P1-T1-1至[S]P1_T1_P1T1的每个独立地具有与[S]P2-T1-1至[S]P2-TI-P2TI之一相同的序列,并且[S]P2-T1-1至[S]P2-T1-P2T1的每个独立地具有与[S]P1-T1-1至[S]P1-TI-P1T1之一相同的序列。在一些实施方案中,在每个多种中靶向相同靶的可检测地标记的寡核苷酸具有不同的序列组。
在一些实施方案中,所提供的方法在成像步骤之后任选地包括去除多种可检测地标记的寡核苷酸的步骤。在一些实施方案中,所提供的方法在成像步骤之后包括去除步骤。在一些实施方案中,所提供的方法在除了最后的成像步骤之外的每个成像步骤之后包括去除步骤。在一些实施方案中,所提供的方法在每个成像步骤之后包括去除步骤。
在所提供的方法中的去除步骤可以达到多种目的中的一种或更多种。在一些实施方案中,去除步骤将多种可检测地标记的寡核苷酸从靶去除以使得靶可被用于与另一多种可检测地标记的寡核苷酸相互作用。在一些实施方案中,去除步骤去除多种可检测地标记的寡核苷酸以使得一个多种可检测地标记的寡核苷酸的可检测部分不干扰另一个多种可检测地标记的寡核苷酸与靶的结合的检测。在一些实施方案中,去除步骤去除至少80%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少85%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少90%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少91%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少92%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少93%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少94%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少95%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少96%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少97%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少98%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99.1%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99.2%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99.3%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99.4%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少99.5%的可检测地标记的寡核苷酸。在一些实施方案中,去除步骤去除至少80%的可检测信号。在一些实施方案中,去除步骤去除至少85%的可检测信号。在一些实施方案中,去除步骤去除至少90%的可检测信号。在一些实施方案中,去除步骤去除至少91%的可检测信号。在一些实施方案中,去除步骤去除至少92%的可检测信号。在一些实施方案中,去除步骤去除至少93%的可检测信号。在一些实施方案中,去除步骤去除至少94%的可检测信号。在一些实施方案中,去除步骤去除至少95%的可检测信号。在一些实施方案中,去除步骤去除至少96%的可检测信号。在一些实施方案中,去除步骤去除至少97%的可检测信号。在一些实施方案中,去除步骤去除至少98%的可检测信号。在一些实施方案中,去除步骤去除至少99%的可检测信号。在一些实施方案中,去除步骤去除至少99.5%的可检测信号。在一些实施方案中,去除步骤去除100%的可检测信号。在一些实施方案中,在去除步骤之后没有信号可被成像步骤检测出。
去除步骤任选地保留靶(例如,转录物或DNA基因座)用于进一步使用,例如,通过另外的接触和/或成像步骤进一步检测或定量。在一些实施方案中,去除步骤保留至少80%的靶。保留的靶的百分比可以例如通过比较在去除步骤之前和之后采集的数据而被测量出,任选地利用相同的接触和成像方案进行。在一些实施方案中,去除步骤保留至少85%的靶。在一些实施方案中,去除步骤保留至少90%的靶。在一些实施方案中,去除步骤保留至少91%的靶。在一些实施方案中,去除步骤保留至少92%的靶。在一些实施方案中,去除步骤保留至少93%的靶。在一些实施方案中,去除步骤保留至少94%的靶。在一些实施方案中,去除步骤保留至少95%的靶。在一些实施方案中,去除步骤保留至少96%的靶。在一些实施方案中,去除步骤保留至少97%的靶。在一些实施方案中,去除步骤保留至少98%的靶。在一些实施方案中,去除步骤保留至少99%的靶。
用于去除可检测地标记的寡核苷酸的方法在领域是被广泛已知的。在一些实施方案中,去除步骤包括降解可检测地标记的寡核苷酸。在一些实施方案中,通过酶消化去除可检测地标记的寡核苷酸。在一些实施方案中,去除步骤包括使多种可检测地标记的寡核苷酸与消化可检测地标记的寡核苷酸的酶接触。
合适的酶是本领域中被广泛使用的。例如,根据可检测地标记的寡核苷酸和/或靶的类型,可以使用DNA酶或RNA酶。在一些实施方案中,包含用于检测/定量RNA靶的DNA序列的可检测地标记的寡核苷酸通过DNA酶例如DNA酶I来消化。在一些实施方案中,包含用于检测/定量DNA靶的RNA序列的可检测地标记的寡核苷酸通过RNA酶来消化。在一些实施方案中,可检测地标记的RNA寡核苷酸被用来靶向DNA基因座。
在一些实施方案中,可检测地标记的寡核苷酸通过与一个或更多个中间物结合或杂交来与其靶相互作用,所述一个或更多个中间物诸如与靶结合、杂交或以其他方式连接的寡核苷酸。在一些实施方案中,可检测地标记的寡核苷酸通过与中间寡核苷酸杂交来与靶相互作用,所述中间寡核苷酸与靶杂交,其中中间寡核苷酸包含与靶互补的序列和与可检测地标记的寡核苷酸互补的序列(突出端)。在一些实施方案中,去除步骤将可检测地标记的寡核苷酸去除,任选地使中间寡核苷酸保持完整。在一些实施方案中,去除步骤将可检测地标记的寡核苷酸去除并且使中间寡核苷酸保持完整。在一些实施方案中,从化学或酶学角度,可检测地标记的寡核苷酸与中间物不同,以使得可检测地标记的寡核苷酸可被选择性地去除。
在一些实施方案中,中间DNA寡核苷酸被用来以突出端(例如,20nt)与DNA基因座杂交,以使得包含RNA序列的桥接寡核苷酸可与互补序列(例如,RNA桥接探针)结合。RNA桥接探针可以用染料或HCR聚合物(还可以是DNA)直接地标记。成像之后,可使用RNA酶来消化掉RNA桥接探针,同时使DNA探针保持完整地杂交在DNA基因座上。这样的方法提供多种优点。例如,随后的接触步骤仅包括RNA桥接探针以突出端与DNA寡核苷酸杂交,并且避免使双链DNA解链并与DNA寡核苷酸杂交,这是个困难的过程。另外,可以使靶向相同基因的所有DNA寡核苷酸(例如,20个至40个)的突出端相同,以使得每轮杂交每个基因仅需要一种类型的RNA桥接探针。为了针对不同的杂交(接触步骤)切换颜色,技术人员可以用不同的标记或不同的HCR聚合物改变RNA桥接探针。还可以使用这样的DNA桥接探针:可以例如用桥或HCR发夹上的诸如EcoRI的特异性酶限制位点来特异性地去除。将细胞与合适的核酸酶一起孵育可以消化掉所有的可检测部分而不影响DNA基因座和/或其上杂交的探针。
在一些实施方案中,可检测地标记的寡核苷酸包含5'-磷酸化并且可以被Lambda核酸外切酶降解,而中间寡核苷酸未被5'-磷酸化并且不能被Lambda核酸外切酶降解。
在一些实施方案中,可检测地标记的寡核苷酸包含尿嘧啶。在一些实施方案中,可检测地标记的寡核苷酸包含尿嘧啶,并且可以被USERTM酶(New England BioLabs,Ipswich,Massachusetts,MA,US)降解,而中间寡核苷酸不包含尿嘧啶并且不能被USERTM酶降解。
在一些实施方案中,与中间寡核苷酸的突出端杂交的寡核苷酸在与突出端杂交时具有凹陷的3'-末端。具有凹陷的3'-末端的可检测地标记的寡核苷酸当与中间寡核苷酸杂交时可以被核酸外切酶III选择性地消化。由于核酸外切酶III对不具有凹陷的3'-末端或其3'-端是RNA-DNA双链体的中间寡核苷酸的活性弱得多,所以它们可以保持完整。
在一些实施方案中,当涉及到酶时,在产生最佳结果的温度进行去除步骤。在一些实施方案中,在约37℃进行去除步骤。在一些实施方案中,在室温进行去除步骤。在一些实施方案中,用Lambda核酸外切酶的消化在约37℃进行。在一些实施方案中,用USERTM酶的消化在约37℃进行。在一些实施方案中,用USERTM酶的消化在室温进行。在一些实施方案中,用核酸外切酶III的消化在约37℃进行。在一些实施方案中,用核酸外切酶III的消化在室温进行。
在一些实施方案中,中间寡核苷酸和用于可检测地标记的寡核苷酸结合的突出端序列的使用提供了多种优点。在一些实施方案中,突出端序列和可检测地标记的寡核苷酸之间的杂交的历程比中间寡核苷酸与靶之间的杂交的历程快。在一些实施方案中,针对靶的所有中间寡核苷酸包含相同的突出端序列,并且针对靶的所有可检测地标记的寡核苷酸包含用于与相同的突出端序列结合的相同的互补序列。在一些实施方案中,一组可检测地标记的寡核苷酸和一组中间寡核苷酸之间的杂交比一组中间寡核苷酸和一组靶之间的杂交快多达约20-40倍。在一些实施方案中,可检测地标记的寡核苷酸和中间寡核苷酸之间的杂交可以在30分钟内完成,与之相比,在一些情况中,对于中间寡核苷酸和靶之间的杂交长达约12小时。
在一些实施方案中,在去除步骤中使用链置换来去除可检测地标记的寡核苷酸。在一些实施方案中,在去除步骤中利用加热来使可检测地标记的寡核苷酸解离。
在一些实施方案中,去除步骤包括光漂白。在一些实施方案中,光漂白破坏可检测地标记的寡核苷酸的染料,诸如荧光团。
在一些实施方案中,第一组和第二组可检测地标记的寡核苷酸靶向每个靶的不同序列,并且在第一成像步骤之后的去除步骤是任选的。例如,一种策略是用不同的DNA探针(可检测地标记的DNA寡核苷酸)来靶向相同的RNA,以使得第一多种探针可以靶向RNA上的一组序列,并且第二多种探针靶向相同RNA上的不同的序列组。在第一杂交(接触)时,使用第一多种探针。它们随后可以被成像并且任选地被DNA酶或破坏寡核苷酸或染料的其他方法光漂白或消化。第二组探针可以被杂交并且被成像,而不受第一组探针的干扰。
在一些实施方案中,所提供的方法任选地包括HCR、光片照明显微术、CLARITY或其组合。在一些实施方案中,所提供的方法允许对组织、器官或生物体中的靶直接谱分析。在一些实施方案中,器官是大脑。在一些实施方案中,所提供的方法允许对完整的大脑或组织中的转录物直接成像。在一些实施方案中,所提供的方法还包括HCR。在一些实施方案中,所提供的方法还包括光片照明显微术。在一些实施方案中,所提供的方法还包括CLARITY。
所提供的方法提供许多超越本发明之前的方法的优点。例如,在一些实施方案中,所提供的方法在合理的成本下提供了高通量。在一些实施方案中,所提供的方法提供了靶的直接探测,而不转化靶或扩增靶。在一些实施方案中,所提供的方法使得能够快速规模放大而不需要大量的可检测标记。在一些实施方案中,所提供的方法可以对相同的靶应用多种标签并且因此增加信号强度。在一些实施方案中,所提供的方法提供了所述优点的组合。
在一些实施方案中,本发明提供了包含多种可检测地标记的寡核苷酸组合物,所述组合物例如在所提供的方法中使用。示例性组合物包括但不局限于在本文的示例性方法实施方案中描述的那些组合物。
在一些实施方案中,本发明提供了包含多种可检测地标记的寡核苷酸的组合物,所述可检测地标记的寡核苷酸的每种靶向核酸并且被可检测部分标记,因此所述组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一核酸并且被第一可检测部分标记;以及
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二核酸并且被第二可检测部分标记。
在一些实施方案中,本发明提供了包含多种可检测地标记的寡核苷酸的组合物,所述可检测地标记的寡核苷酸的每种靶向转录物或DNA基因座并且被可检测部分标记,因此所述组合物至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一转录物或DNA基因座并且被第一可检测部分标记;以及
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二转录物或DNA基因座并且被第二可检测部分标记。
在一些实施方案中,本发明提供了包含多种可检测地标记的寡核苷酸的试剂盒,所述可检测地标记的寡核苷酸的每种靶向转录物或DNA基因座并且被可检测部分标记,因此所述试剂盒至少包含:
(i)第一寡核苷酸,所述第一寡核苷酸靶向第一转录物或DNA基因座并且被第一可检测部分标记;
(ii)第二寡核苷酸,所述第二寡核苷酸靶向第二转录物或DNA基因座并且被第二可检测部分标记。
(iii)第三寡核苷酸,所述第三寡核苷酸任选地在序列上与第一寡核苷酸相同,所述第三寡核苷酸靶向第一转录物或DNA基因座并且被第一可检测部分、第二可检测部分或第三可检测部分标记;以及
(iv)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与第二寡核苷酸相同,所述第四寡核苷酸靶向第二转录物或DNA基因座,并且被第一可检测部分、第二可检测部分、第三可检测部分或第四可检测部分标记,其中第三寡核苷酸被与第一寡核苷酸不同的可检测部分标记,或第四寡核苷酸用与第二寡核苷酸不同的可检测部分标记,或两者。
在一些实施方案中,组合物中的靶向相同的靶(转录物或DNA基因座)的可检测地标记的寡核苷酸被提供相同的可检测信号或在成像步骤中无法区分的可检测信号的部分标记。在一些实施方案中,组合物中的靶向相同的靶的可检测地标记的寡核苷酸被相同的可检测部分标记。
在一些实施方案中,可检测部分是或包含荧光团。在一些实施方案中,可检测部分是荧光团。示例性荧光团是领域内被广泛已知和使用的,例如但不局限于荧光素、罗丹明、Alexa Fluor类、Dylight Fluor类、ATTO类染料或其任何类似物或衍生物。
在一些实施方案中,第一可检测地标记的寡核苷酸和第二可检测地标记的寡核苷酸靶向不同的靶。在一些实施方案中,第一可检测地标记的寡核苷酸和第二可检测地标记的寡核苷酸靶向相同的靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向两种或更多种靶,例如,转录物和/或DNA基因座。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向两种或更多种转录物。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向两种或更多种DNA基因座。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少4种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少9种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少16种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少25种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少36种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少50种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少100种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少200种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少500种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少1,000种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少5,000种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少10,000种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少50,000种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少100,000种靶。在一些实施方案中,试剂盒中的可检测地标记的寡核苷酸靶向至少1,000,000种靶。
在一些实施方案中,第一寡核苷酸和第二寡核苷酸具有不同的寡核苷酸序列。在一些实施方案中,第一可检测部分和第二可检测部分是不同的。在一些实施方案中,第一可检测部分和第二可检测部分是相同的。
在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于5%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于10%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于20%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于30%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于40%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于50%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于60%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于65%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于68%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于70%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于80%的序列同一性。在一些实施方案中,第一寡核苷酸和第二寡核苷酸共有少于90%的序列同一性。
在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于5%的序列同一性。在一些实施方案中,每种寡核苷酸与其他任何寡核苷酸共有少于10%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于20%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于30%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于40%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于50%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于55%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于60%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于65%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于68%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于70%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于80%的序列同一性。在一些实施方案中,每种寡核苷酸与任何其他寡核苷酸共有少于90%的序列同一性。
在一些实施方案中,试剂盒包含靶向相同的靶的两种或更多种可检测地标记的寡核苷酸。在一些实施方案中,5、10、20、30、40、50种或更多种可检测地标记的寡核苷酸靶向相同的靶。
可检测地标记的寡核苷酸可以为多种合适的长度。在一些实施方案中,可检测地标记的寡核苷酸的长度为15个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为16个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为17个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为18个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为19个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为20个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为21个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为22个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为23个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为24个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为25个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为26个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为27个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为28个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为29个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为30个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少15个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少16个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少17个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少18个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少19个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少20个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少21个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少22个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少23个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少24个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少25个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少26个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少27个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少28个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少29个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少30个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少35个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少40个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为至少50个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约15-25个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约20-30个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约25-35个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约30-40个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约35-45个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约40-50个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约15-30个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约20-30个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约15-35个碱基对。在一些实施方案中,可检测地标记的寡核苷酸的长度为约20-35个碱基对。
在一些实施方案中,多种可检测地标记的寡核苷酸包含两种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含三种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含四种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含五种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含六种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含七种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含八种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含九种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含十种可检测部分。
在一些实施方案中,多种可检测地标记的寡核苷酸包含至少两种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少三种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少四种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少五种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少六种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少七种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少八种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少九种可检测部分。在一些实施方案中,多种可检测地标记的寡核苷酸包含至少十种可检测部分。
在一些实施方案中,组合物还包含:
(iii)第三寡核苷酸,所述第三寡核苷酸任选地在序列上与第一寡核苷酸相同,所述第三寡核苷酸靶向第一转录物或DNA基因座;以及
(iv)第四寡核苷酸,所述第四寡核苷酸任选地在序列上与第二寡核苷酸相同,所述第四寡核苷酸靶向第二转录物或DNA基因座,
其中第三寡核苷酸被与第一寡核苷酸不同的可检测部分标记,或第四寡核苷酸被与第二寡核苷酸不同的可检测部分标记,或两者。
在一些实施方案中,第三寡核苷酸在序列上与第一寡核苷酸相同。在一些实施方案中,第三寡核苷酸包含与第一寡核苷酸重叠的序列。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于50%的序列同一性。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于40%的序列同一性。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于30%的序列同一性。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于20%的序列同一性。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于10%的序列同一性。在一些实施方案中,第三寡核苷酸与第一寡核苷酸具有少于5%的序列同一性。
在一些实施方案中,第四寡核苷酸在序列上与第二寡核苷酸相同。在一些实施方案中,第四寡核苷酸包含与第二寡核苷酸重叠的序列。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于50%的序列同一性。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于40%的序列同一性。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于30%的序列同一性。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于20%的序列同一性。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于10%的序列同一性。在一些实施方案中,第四寡核苷酸与第二寡核苷酸具有少于5%的序列同一性。
在一些实施方案中,第三寡核苷酸被与第一寡核苷酸不同的可检测部分标记。在一些实施方案中,第四寡核苷酸被与第二寡核苷酸不同的可检测部分标记。
在一些实施方案中,多种、组合物、试剂盒或方法中的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的5%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的10%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的20%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的30%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的40%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的50%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的60%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的70%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的80%的可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的90%的可检测地标记的寡核苷酸的量是预先确定的。
在一些实施方案中,多种、组合物、试剂盒或方法中的至少5种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少10种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少20种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少30种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少40种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少50种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少60种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少70种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少80种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少90种可检测地标记的寡核苷酸的量是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法中的至少每种可检测地标记的寡核苷酸的量是预先确定的。
在一些实施方案中,对于一种靶提供两种或更多种可检测地标记的寡核苷酸。在一些实施方案中,针对一种靶的所有可检测地标记的寡核苷酸的总量是预先确定的。在一些实施方案中,针对一种靶的所有可检测地标记的寡核苷酸的总量是预先确定的,其中针对所述靶的每种可检测地标记的寡核苷酸的量是独立地且任选地预先确定的。在一些实施方案中,针对多种靶的每种的所有可检测地标记的寡核苷酸的总量是预先确定的。在一些实施方案中,多种靶具有至少两种靶。在一些实施方案中,多种靶具有至少五种靶。在一些实施方案中,多种靶具有至少10种靶。在一些实施方案中,多种靶具有至少50种靶。在一些实施方案中,多种靶具有至少100种靶。在一些实施方案中,多种靶具有至少500种靶。在一些实施方案中,多种靶具有至少1,000种靶。
在一些实施方案中,多种、组合物、试剂盒或方法的靶是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法的至少10种靶是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法的至少50种靶是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法的至少100种靶是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法的至少1,000种靶是预先确定的。在一些实施方案中,多种、组合物、试剂盒或方法的多达FN种靶是预先确定的,其中F是多种中的可检测部分的数目,且N是成像步骤的数目。
用于合成可检测地标记的寡核苷酸的方法是在领域中被广泛已知和实践的,例如,参见Lubeck,E.&Cai,L.Nat.Methods9,743-48(2012)。寡核苷酸也是从多个供应商商业上可得的。在一些实施方案中,本发明提供了用于制备可检测地标记的寡核苷酸的方法。在一些实施方案中,本发明提供了用于制备中间寡核苷酸的方法。在一些实施方案中,本发明提供了用于制备桥接寡核苷酸的方法。
在一些实施方案中,本发明提供了用于制备具有第一序列的靶核酸的方法,该方法包括以下步骤:
1)提供包含第一序列的第一核酸,其中第一序列在两末端的侧翼为切口核酸内切酶位点;
2)扩增第一核酸或第一核酸的一部分,以提供第二核酸,所述第二核酸包含第一序列和侧翼切口核酸内切酶位点;以及
3)使第二核酸与对应于侧翼切口核酸内切酶位点的一种或更多种切口核酸内切酶接触。
在一些实施方案中,具有第一序列的靶核酸是单链的。在一些实施方案中,扩增步骤包括聚合酶链式反应(PCR)。在一些实施方案中,所提供的方法还包括变性的步骤,其中双链的第二核酸变性并且双链变成单链的。在一些实施方案中,所提供的方法还包括分离具有第一序列的核酸。在一些实施方案中,在与切口核酸内切酶接触之前,第二核酸任选地被修饰。在一些实施方案中,所提供的方法还包括标记具有第一序列的核酸。
在一些实施方案中,两个侧翼核酸内切酶位点是相同的。在一些实施方案中,使用对应于相同的切口核酸内切酶位点的一种切口核酸内切酶。在一些实施方案中,两个侧翼核酸内切酶位点是不同的。在一些实施方案中,使用两种切口核酸内切酶,所述两种切口核酸内切酶的每种独立地对应于一个切口内切核酸位点。
在一些实施方案中,所提供的技术的寡核苷酸从寡核苷酸池(pool)产生。在一些实施方案中,此类池是商业上可得的。在一些实施方案中初始DNA寡核苷酸池由被组织成亚组的多达12,000种或更多种单链序列组成。每种序列被设计以使得期望的序列(例如,探针序列)的侧翼为切口核酸内切酶位点以及正向引物序列和反向引物序列。正向引物序列和反向引物序列对所期望的序列所属的亚组特异。引物对可被用于利用聚合酶链式反应(PCR)扩增亚组。PCR反应的产物被分离并通过切口核酸内切酶消化。与切口酶一起孵育的时间基于所使用的酶的量和回收的DNA的量而变化。在一些实施方案中,在约1小时内约10单位的酶消化约1μg的DNA。然后在缓冲液例如2x加载缓冲液(96%甲酰胺/20mM EDTA)和水中纯化和重构样品,以制备最终的加载缓冲液(48%甲酰胺/l0mM EDTA)并且变性,例如,通过加热至95℃以使DNA完全变性。纯化变性的DNA并且分离所期望的产物。在一些实施方案中,纯化和/或分离包括电泳。在图25中图示了示例性过程。
在一些实施方案中,本发明提供了用于制备具有第一序列的靶核酸的方法,所述方法包括以下步骤:
1)提供包含第一序列或其互补序列的第一核酸,其中第一序列或其互补序的侧翼为至少一个限制性位点;
2)扩增第一核酸或第一核酸的一部分,以提供第二核酸,所述第二核酸包含第一序列和至少一个侧翼限制性位点;以及
3)使第二核酸与对应于至少一个侧翼限制性位点的限制性酶接触,以提供包含凹陷末端的第三核酸;
4)使第三核酸与核酸酶接触,以选择性地消化包含互补序列(如果存在)的链,同时保留包含第一序列的链。
在一些实施方案中,第一序列或其互补序列在每个末端侧翼独立地为限制性位点。
在一些实施方案中,本发明提供了用于制备具有第一序列的靶核酸的方法,所述方法包括以下步骤:
1)提供包含第一序列或其互补序列的第一核酸,其中第一序列或其互补序列在两端侧翼均为限制性位点;
2)扩增第一核酸或第一核酸的一部分,以提供第二核酸,所述第二核酸包含第一序列和侧翼限制性位点;以及
3)使第二核酸与对应于侧翼限制性位点的限制性酶接触,以提供包含凹陷末端的第三核酸;
4)使第三核酸与核酸酶接触,以选择性地消化包含互补序列(如果存在)的链,同时保留包含第一序列的链。
在一些实施方案中,具有第一序列的靶核酸是单链的。在一些实施方案中,扩增步骤包括PCR。在一些实施方案中,所提供的方法还包括分离具有第一序列的核酸。在一些实施方案中,在与限制性酶接触之前,第二核酸任选地被修饰。在一些实施方案中,在与核酸酶接触之前,第三核酸任选地被修饰。在一些实施方案中,核酸酶是核酸外切酶III,其优先降解带有3’-凹陷末端的链,并且可以保留带有5’-凹陷末端的链。在一些实施方案中,限制性酶产生5’-凹陷末端。在一些实施方案中,限制性酶产生3’-凹陷末端。在一些实施方案中,在限制性消化之后,互补序列具有3'凹陷末端。在一些实施方案中,在限制性消化之后包含互补序列的链具有3’凹陷末端,并且在限制性消化之后包含第一序列的链具有5’凹陷末端。在一些实施方案中,所提供的方法还包括标记具有第一序列的核酸。
在一些实施方案中,单链的寡核苷酸,例如用于seqFISH的探针或中间寡核苷酸,可利用核酸酶消化诸如exoIII核酸酶消化来产生。可以使用扩增(例如,PCR)产物上的两个限制性位点而非两个切口位点位于探针和/或适体序列的侧翼。在一些实施方案中,一个限制性位点留下3’凹陷末端同时另一个留下5’凹陷末端。例如,EcoRI和BamHI留下5’凹陷末端,同时BmtI和PacI留下3’凹陷末端。此类限制性酶是领域中广泛已知和使用的。核酸外切酶III优先降解3’凹陷末端,并保留带有5’凹陷末端的链。这提供了利用PCR和限制性核酸酶从寡核苷酸池产生单链探针的另一种机制。
在一些实施方案中,所提供的靶核酸是DNA。在一些实施方案中,靶核酸具有与第一序列相同的序列。在一些实施方案中,靶核酸是中间寡核苷酸,包含与靶杂交的第一序列和与第二寡核苷酸杂交的第二序列,所述靶例如转录物或DNA基因座,所述第二寡核苷酸例如可检测地标记的寡核苷酸。在一些实施方案中,靶核酸是中间寡核苷酸,包含与靶杂交的第一序列和与由HCR标记的可检测地标记的寡核苷酸杂交的第二序列。在一些实施方案中,靶核酸是桥接探针。
在一些实施方案中,所提供的方法被用于诊断疾病,其中所述疾病与转录物或DNA基因座的异常数目有关。在一些实施方案中,所提供的方法被用来选择治疗的受试者。在一些实施方案中,所提供的方法被用来监控治疗方案。在一些实施方案中,所提供的方法中的细胞来自受试者。在一些实施方案中,所提供的方法中的细胞是哺乳动物细胞。在一些实施方案中,所提供的方法中的细胞是人类细胞。在一些实施方案中,所提供的方法中的细胞来自受试者。在一些实施方案中,所提供的方法中的细胞来自动物。在一些实施方案中,所提供的方法中的细胞来自人类受试者。在一些实施方案中,所提供的方法中的细胞从人类受试者分离。在一些实施方案中,所提供的的方法中的细胞来自病变组织或对疾病易感的组织。由于能够同时检测并且定量大量的靶,所提供的方法对诊断、治疗监控和患者分层提供了显著的优势。
在一些实施方案中,所提供的技术任选地包括对蛋白、神经活动和/或结构布置谱分析。在一些实施方案中,所提供的方法包括对同一样品中的蛋白质谱分析。在一些实施方案中,所提供的方法包括对同一样品中的神经活动谱分析。在一些实施方案中,所提供的方法包括对结构布置谱分析。
如同本文所示例的,所提供的技术适用于很多种样品。例如,HCR-seqFISH在脑切片中有效并且SPIM可以粗略地检测CLARITY脑切片中的单一mRNA。在一些实施方案中,所提供的技术可用于对神经退行性疾病的小鼠模型或人类大脑中的靶谱分析。在本发明之前没有其他的技术能够达到同样质量和数量的数据。
实施例
上述内容已经描述了本发明的某些非限制性实施方案。相应地,应理解本文描述的本发明的实施方案仅仅例证了本发明的原理的应用。本文详细描述的例证性实施方案并非意图限制权利要求的范围。
通过顺序杂交和编条形码对核酸原位谱分析
如在本文的非限制性实例中所描述的,通过所提供的方法,通过连续数论的接触、成像和去除步骤对细胞中的核酸例如mRNA谱分析(图2(a)和图3)。由于在细胞中转录物被固定,在多轮杂交期间对应的荧光斑点保持在原位,并且可以被对齐以读取荧光团序列。此顺序条形码被设计以独特地鉴定mRNA。
在每轮杂交期间,每种转录物被一组可检测地标记的寡核苷酸(在该情况中,FISH探针被单一类型的荧光团标记)靶向。对样品成像并且随后用DNA酶I对其处理以去除FISH探针。在随后的轮次中,使mRNA与具有相同的寡核苷酸序列组但现在被不同的染料标记的的FISH探针杂交。可用的条形码的数目规模为FN,其中F是荧光团的数目且N是杂交轮次数。例如,用4种染料,8轮杂交可以覆盖几乎整个转录组(48=65,536)。
作为例证,用4种染料和2轮杂交对单一酵母细胞中的12个基因编条形码(42=16,4个条形码被忽略;每次杂交进行三个循环)。细胞被固定在玻璃表面上。DNA探针被杂交、成像并且随后通过DNA酶I处理去除(88.5±11.0%(SE)的效率,图4)。剩余的信号被光漂白(图5)。甚至在6次杂交之后,观察到mRNA为原始强度的70.9±21.8%(SE)(图6)。观察到在前两次杂交中共定位的点的77.9±5.6%(SE)也与第三次杂交共定位(图7和图8)。通过计数细胞中对应的条形码的出现来定量mRNA丰度(图9和图10,n=37个细胞)。显示在哺乳动物细胞中mRNA可以被有效地剥离并再杂交(图11和图12)。如本文证实的,所提供的方法具有超越本发明之前的已知方法的许多优点。例如,所提供的方法快速地放大规模;即使用两种染料,编码能力在原则上是无限的(2N)。在每个接触步骤期间,可使用增加信号的亮度的针对探针的所有可用的可检测地标记的寡核苷酸(在此实施例中,FISH探针)。所提供的方法的读数也是稳健的并且使能够对天然样品充分Z-叠加(Z-stacks)。所提供的方法可以利用可检测地标记的寡核苷酸的高杂交效率的优势,所述可检测地标记的寡核苷酸诸如FISH探针(>95%的mRNA被检测出;Lubeck,E.&Cai,L.Nat.Methods9,743-48(2012))。申请人注意到还可以设计可检测地标记的寡核苷酸例如FISH探针,以分辨单一细胞中的大量剪接异构体、SNP以及染色体基因座(Levesque,M.J.&Raj,A.Nat Meth10,246-248(2013))。与超分辨率方法组合(Lubeck,E.&Cai,L.Nat.Methods9,743-48(2012)),所提供的方法使复合样品诸如大脑中的大量靶(例如转录组)能够被以单细胞分辨率直接地成像。
方法和程序
样品制备:使MDN1-GFP酵母细胞在补充有50mM CaCl2的YPD中生长,至OD为0.3。将细胞在1%甲醛5%醋酸中固定5分钟,在缓冲液B中冲洗3X并在30℃下去壁(spheroplasted)持续1小时。将细胞在70%EtOH中在-20℃下贮存长达两周。
通过以下准备盖玻片:用1M NaOH和100%EtOH的交替溶液超声3X,随后在丙酮中超声最终一轮。在丙酮中制备2%的(3-氨基丙基)三乙氧基硅烷(Sigma 440140)溶液并且将经清洁的盖玻片立即浸入该溶液中持续两分钟。冲洗胺改性的盖玻片并将其在室温下在超纯水中贮存。
在23℃下用0.5U/μL的DNA酶I溶液(Roche04716728001)预处理被固定的酵母细胞,持续30分钟。处理之后,通过在两片胺改性的盖玻片之间物理地按压酵母的稀释溶液使酵母细胞粘附至被包被的盖玻片。随后小心将盖玻片分开(pealed apart)并且将其立即浸入1%甲醛溶液中持续2.5分钟。固定之后将盖玻片干燥并且通过使包被粘附剂的流动细胞粘附至盖玻片来构建流动胞(GraceBio Labs SA84-0.5-SecureSeal)。将FluoSphere 365nm荧光珠添加至盖玻片来测量多次杂交的漂移(Life F8805)。将用封口膜覆盖的流动细胞在4℃下贮存。
可检测地标记的寡核苷酸的制备:根据Lubeck,E.&Cai,L.Nat.Methods9,743-48(2012)中的方法制备探针。对于每种靶,使用24种探针。将针对每组基因的所有24种探针与所使用的四种染料Alexa 532、594、Cy5和Cy7之一偶联。
杂交:使流动细胞在10%硫酸葡聚糖(Sigma D8906)、10%甲酰胺和2X SSC的杂交缓冲液中在2nM/探针的浓度下杂交过夜。杂交之后,将样品在添加至室温样品前预热至37℃持续10分钟的30%甲酰胺、0.1%Triton-X100缓冲液中洗涤。用2X SSC对样品洗涤数次以去除扩散的探针。
成像:将样品浸入抗漂白缓冲液(Swoboda,M.ACS Nano6,6364-69(2012)):20mM Tris-HCL、50mM NaCl、0.8%葡萄糖、饱和Trolox(Sigma:53188-07-1)、OD405nm为0.05的吡喃糖氧化酶(Sigma P4234)和1/1000稀释的过氧化氢酶(Sigma:9001-05-2)。
探针置换:成像之后,在DNA酶I缓冲液(Roche)中洗涤细胞并且允许细胞在0.5U/μL DNA酶I(Roche)中静置4小时。为抑制DNA酶,用30%甲酰胺、0.1%Trition-X 100、2X SSC对细胞洗涤两X。DNA酶处理之后在抗漂白缓冲液中对细胞再成像一次,以确定DNA酶I探针剥离比率。为了去除剩余的探针信号,在所有成像通道中将样品用10秒的激发漂白并且用标准激发时间再一次成像以记录残留信号。
再杂交:根据前面概述的条件使样品在显微镜上再杂交。在显微镜上杂交期间用封口膜覆盖样品以防止蒸发。
对同一样品进行至少六轮杂交。每轮杂交在显微镜下过夜发生,并在日间进行DNA酶处理和成像。在对应于此所应用的的迭代杂交方案中,利用两轮杂交对mRNA编条形码。随后重复条形码方案,以使得使用相同的探针进行hyb1和hyb3,而用另一组探针进行hyb2和hyb4。Hby1和hyb3之间的共定位给出了对于所检测的转录物的校准,而hyb1和hyb2产生编条形码的数据。
数据分析:用ImageJ、Python和Matlab进行数据分析。由于样本在实验期间漂移,利用从每个成像位置的DAPI通道确定的基于交叉关联的配准方法使原始图像对齐。然后将漂移校正传播到对应于相同位置的其他4个颜色通道。然后对图像去卷积来降低邻近的FISH点之间的重叠。个体通道中的点重叠很少被观察到,但是当图像被叠加时,在不同通道中的点会以其点扩散函数(PSF)重叠。基于迭代Lucy-Richardson算法(Lucy,L.B.TheAstronomical Journal.79,745(1974)和Richardson,W.H.J.Opt.Soc.Am.62,55-59(1972))来处理原始数据。显微镜的PSF通过对在显微镜的DAPI通道中测量的珠图像(~200nm直径)求平均值来评估。利用该测量的点扩散函数连同Lucy-Richardson算法,在计算该过程超过20次迭代之后,我们对在FISH图像中的荧光发射分布进行最大似然性评价。该去卷积方法的输出提供了分辨的FISH数据且增加了条形码分配的精确度。
利用局部最大值函数来鉴定对应于图像中的FISH信号的点。低于阈值的点被丢弃,不用于进一步分析。通过优化与相同的探针组杂交的hyb1和hyb3图像之间的共定位来确定阈值的值。将每个PSF的最大强度像素用作该mRNA分子的位置的代表。
从对应于hyb1和hyb2中的mRNA的点自动提取条形码。算法计算了在hyb1中鉴定的每个点和在hyb2中鉴定的所有点之间的成对距离。对于hyb1中的每个点,在hyb2中的最近的邻点被鉴定出。如果该距离是0像素或1像素并且hyb2中的点的最近的邻点也是hyb1中的原始点,则条形码对被确认。对称的最近邻点的要求减少了条形码的假分配。为减少cy7的假阳性,要求在hyb1中检测到的点cy7在hyb3中以cy7重复出现。
在该非限制性实施例中,由于DNA酶I的低成本和快速活性,申请人用DNA酶I去除探针。申请人注意到将探针从mRNA去除并使其完整的任何方法均可被用于所提供的编条形码方法,例如但不局限于,链置换(Duose,D.Y.Nucleic Acids Research,40,3289-3298(2012))和高温洗涤或甲酰胺洗涤。申请人注意到DNA酶I不要求从标准smFISH探针重新设计探针并且不因严苛的洗涤干扰样品。
在一些实施方案中,观察到来自dsDNA的DAPI信号在几秒钟内快速消失,而smFISH探针需要质的较长的时间段(数十分钟)来被降解。不意图受理论限制,相对于dsDNA裂解速率,DNA酶I的探针去除效率是低的。在短时间内去除过程仍然被观察到。
在某些实验中,在DNA酶I处理后,11.5%的荧光信号保持在mRNA上。通过漂白,剩余的信号几乎降低至零。申请人注意到在光漂白之前可达成更完全的信号和/或探针去除,以使得更多的mRNA可被用于之后轮次的杂交。申请人注意到光漂白对于编条形码并非是必需的,但在一些实施方案中,通过去除可能在进一步的编条形码轮次中给出假阳性的残留信号,光漂白确实简化了过程。与mRNA的结合的11.5%的残留探针中的一些可抑制进一步的杂交轮次。申请人注意到由于所展示的5次杂交的数据在杂交效率上显示出轻微下降,残留探针不显著抑制进一步的杂交轮。
对脑组织中的核酸谱分析
对完整脑切片中的细胞的转录谱分析对于理解细胞身份的分子基础是重要的。然而,本发明之前,在天然神经网络的解刨学背景下对单一细胞中的转录物丰度和定位定量地谱分析在技术上是困难的。皮层躯体感觉子网络被用作实例来说明示例性提供的技术的可行性和实用性,例如,利用FISH原位测序(seqFISH)和连接组学(connectomics)对不同功能区域内的不同的神经元群体中的多种基因谱分析,所述不同功能区域诸如在初级躯体感觉皮层区(SSp)、初级躯体运动皮层区(MOp)、次级躯体运动皮层区(MOs)和辅助躯体感觉皮层区(SSs)中的那些区域。
如本文广泛描述的,在一些实施方案中,本发明提供了经由通过FISH原位“测序”对单一细胞中的基因表达谱分析的技术,例如如由图1和图2所图示。为了检测个体mRNA,单分子荧光原位杂交(smFISH),和与mRNA序列互补的20mer寡核苷酸探针一起被使用(Fan,Y.Braut,SA,Lin,Q.,Singer,RH,Skoultchi,AI.Determination of transgenic loci by expression FISH.Genomics.2001年10月2日;71(1):66-9;Raj A,Peskin CS,Tranchina D,Vargas DY,Tyagi S.Stochastic mRNA synthesis in mammalian cells.PLoS Biol.2006年10月;4(10):e309)。通过将24种此类用荧光团标记的探针放置在mRNA上,细胞中的单一转录物变得可容易地原位检测。显示出通过smFISH,几乎所有的可被检测出的mRNA被观察到(Lubeck,E.L.Cai.Single cell systems biology by super-resolution imaging and combinatorial labeling.Nature Methods 9,743-48(2012))。所提供的方法是高度定量的且保留了组织样本内的空间信息,而不物理地分离单一细胞或使用匀浆。
在一些实施方案中,为了区分不同的mRNA种类,利用顺序的杂交轮用可检测地标记的寡核苷酸诸如FISH探针对mRNA编条形码。在一轮杂交期间,每种转录物被用单一类型的荧光团标记的一组多种探针例如24种FISH探针靶向。对样品成像并且通过酶促消化去除FISH探针。然后在随后的轮次中使mRNA与相同的FISH探针(但在一些情况下,现在被不同的染料标记)杂交。由于转录物被固定在细胞中,所以在多轮杂交期间,对应于单一mRNA的荧光点保持在原位,并且可以被对齐以读取颜色序列。因此每种mRNA种类被分配独特的条形码。给定的细胞中的每种转录物的数目可以通过计数对应的条形码的数目来确定。在图1、2或3中图示了示例性方法。
所提供的技术可以利用FISH的高杂交效率(>95%的mRNA被检测出)的优势。在一些实施方案中,对于鉴定转录物,碱基对分辨率是不需要的,尽管如果期望,碱基对分辨率是可达到的。所提供的方法的可用的条形码的数目规模为FN,其中F是不同的荧光团的数目且N是杂交轮次的数目。用5种不同的染料和3轮杂交,可对125种独特的核酸谱分析。通过6轮杂交(56=15,625)几乎整个转录组可以被覆盖,例如利用分辨细胞中的所有转录物的超分辨率显微术。在一些实施方案中,使用常规显微术来检测较少但仍然大量的靶,诸如100种基因多路复用(multiplex),所述常规显微术诸如常规的落射荧光显微术,其实施起来简单且稳健。
在多个杂交循环中,探针可被剥离并与相同的mRNA再杂交(图2)。许多商业上可得的荧光团效果稳健,诸如对于编条形码给出至少7种颜色的AlexaFluor 488、532、594、647、700、750和790。即便在6轮杂交结束时,探针可以以原始强度的70.9±21.8%与剥离的mRNA再杂交(图6)。作为例证,用4种染料和2轮杂交,被编条形码的12种基因被在单一酵母细胞中编条形码(42=16,图2,b)。
由于12种基因的多路复用图像只占据每个荧光通道的5%的光学空间,因此在细胞中存在足够的光学空间进行多种例如100种基因的多路复用。虽然图3中的所有4个荧光通道的复合图像看起来稠密,但是每个荧光通道中的点是分散地分布的。可以用2维度高斯曲线对每个点拟合来提取其图心位置并进一步降低与其他荧光通道中的点的重叠。显示在不同的杂交轮次之间相同点重新对齐至100nm(图8)。
在一些实施方案中,100种基因多路复用可以用3轮杂交快速地进行。在一些实施方案中,每个杂交循环包括约4小时的杂交、约1小时的成像和约1小时的DNA酶处理和洗涤,每次的时间长度可以任选且独立地变化。在一些实施方案中,3轮杂交花费约18小时。在一些实施方案中,限速步骤是成像时间,而不是杂交时间,因为一个脑切片可被成像同时在同一显微镜上的另一切片杂交。在一些实施方案中,单个显微镜可以8个切片同时地多路复用并且在18小时内在三个杂交循环结束时对所有8个切片获得100种基因数据。
在一些实施方案中,在显微镜上含有106个细胞的10mm×5mm×10μm的脑切片可以在35分钟内被成像并分析。在一些实施方案中,用20×气体目镜(airobjective)和13mm×13mm摄像头芯片,显微镜上的单个视野(FOV)为,0.5mm×0.5mm×2μm。在一些实施方案中,每个FOV以100毫秒曝光并读取。在一些实施方案中,以XYZ并在不同的颜色通道中扫描样品引起在快照之间200毫秒的时间延迟。在一些实施方案中,整个大脑切片可以在2000秒或35分钟内被成像。对于100种基因多重化所需的3轮杂交,总的成像时间是105分钟。在一些实施方案中,在一台显微镜上整个小鼠大脑可以在30天内被成像。当使用多路显微镜时,时间帧可被进一步缩短。在一些实施方案中,所提供的方法可以用500个切片对整个小鼠大脑成像,花费少于$25,000。
与本发明之前已知的其他方法相比,所提供的技术提供了多种优势。除了其他以外,所提供的技术是定量的、保留空间信息并便宜地扩大至整个组织、器官和/或生物体规模。
与本发明之前的单细胞RNA-seq比较。不像单细胞RNA-seq或qPCR,需要将单细胞分离并放入96孔的格式中,所提供的方法诸如seqFISH可以用自动显微术以少的额外花费在细胞的天然解剖学背景中扫描大量细胞。用微流体装置来达到相同水平的通量将会是经济上不可行的且劳动密集的。在一些实施方案中,所提供的技术的主要花费是探针合成的初始花费,所述初始花费被以下事实抵消:探针被合成后,它们可以被用于很多,例如1000到10,000次或甚至更多的反应。
所提供的方法诸如seqFISH基于单分子FISH并且可以以绝对定量测量低拷贝数的转录物。用这种方法获得的数据是高度地定量的且使能够进行高质量的统计分析。相比而言,目前的单细胞qPCR和RNA-seq实验因自反转录(RT)误差和PCR扩增误差的偏倚而在定量能力方面有。
与本发明之前的其他原位测序方法比较。smFISH方法的一个主要优点是被靶向的几乎所有mRNA可被观察到。经确定结合在mRNA上的每种FISH探针的效率是50%-60%(Lubeck,E.&Cai,L.Nat.Methods9,743-48(2012);Levesque,M.J.&Raj,A.Nat Meth10,246-248(2013))。靶向多种,例如每mRNA 24种至48种探针保证了至少10种探针在几乎每个mRNA上杂交,在非特异性背景下提供良好信号。用FISH探针直接地探测mRNA是高度地特异的并且确保了所有的转录物被检测到。
相反,在通过测序反应检测DNA模板之前,许多其他原位测序方法利用酶促反应将mRNA转化成DNA模板,而不是直接靶向mRNA。然而,mRNA至DNA的转化过程是高度地无效率的,并且只有小比例的RNA被转化并被检测出。低效率(对于反转录(RT)被评估为1%并且和对于锁式连接(padlock ligation)(PLA)被评估为10%)的一个示例性主要缺点是其可在基因表达测量中引入显著的噪音和偏倚。
假定典型的细胞大小为(10-20μm3),在该细胞中存在约25,000个衍射限制的点。在一些实施方案中,对于单细胞中的转录物检测这是可用的固定物(realestate)。在seqFISH中,所选择的一组基因,诸如转录因子(TF)和细胞粘附分子(CAM),可以高精确度被成像和定量。如果选择了具有每基因100个转录物的平均拷贝数的靶基因,则可以进行高度地定量的100-200个基因的谱分析实验。相反,对于很多其他原位测序方法,固定物的大部分被用来对核糖体RNA以及管家基因测序;感兴趣的基因诸如对神经细胞身份特异的那些基因是严重不足且难以检测的。
在一些实施方案中,所提供的方法使用杂交链式反应(HCR)(Choi,等人,Programmable in situ amplification for multiplexed imaging of mRNA expression Nature Biotechnol,28,1208-1212,(2010))来放大FISH信号,所述FISH信号允许用20X气体目镜得到大FOV成像,但同时保留了smFISH的高检测效率。
与本发明之前的对多路复用RNA编超分辨率编条形码的方法比较。在一些实施方案中,与本发明之前的通过smFISH对mRNA谱编条形码(Femino等人,Visualization of single RNA transcripts in situ.Science.1998年4月24日;280(5363):585-90;Kosman等人,Multiplex detection of RNA expression in Drosophila embryos.Science.2004年8月6日;305(5685):846;Levsky等人,Single-cell gene expression profiling.Science.2002年8月2日;297(5582):836-40;Lubeck等人,Single cell systems biology by super-resolution imaging and combinatorial labeling.Nature Methods 9,743-48(2012);和Levesque等人,Nat Meth 10,246-248(2013))相比,所提供的方法具有很多优点,其中针对特定mRNA的探针被分成被不同染料标记的亚组。除了其他以外,所提供的技术不需要很多不同的荧光团来放大规模;即便用两种染料,编码容量是巨大的,并且可以使用重复的条形码(例如,红色-红色-红色)。比较而言,本发明之前的对RNA谱编条形码在可产生的条形码的数目上受限制(~30)。在提供的方法中,在每轮杂交期间,所有可检测地标记的寡核苷酸诸如针对转录物的FISH探针可以被立即使用,而不是将探针划分成亚组。除了其他以外,由于每个mRNA上的信号较强,所提供的技术提供了条形码读取的改善的稳健性。与本发明之前的方法相比,由于每个mRNA可以具有较少的颜色,在一些实施方案中,在每轮杂交期间具有单种颜色,而不是在本发明之前谱条形编码方案中的至少三种颜色,所以图像中目标的密度较低。在超分辨率显微术是必要的之前,如果期望,则较低的图像密度可极大地简化数据分析并且允许更多的基因被多路复用。申请人注意到在所提供的实施方案中,某些谱编条形码的方法、探针、和/或超分辨率显微术可被使用并且可以是有用的实施方案。在一些实施方案中,为了用所提供的技术诸如seqFISH对转录组谱分析,超分辨率显微术被用于分辨细胞中的数百万的转录物。
除了转录物的谱分析,所提供的技术可以分辨对于相同的mRNA分子的多种可选剪接选择和RNA编辑。由于测序读段通常太短以致无法与相同转录物内的外显子关联,可选剪接异构体难以通过测序方法探测。所提供的方法诸如seqFISH允许大脑切片中的个体细胞内的全部剪接异构体直接可视化。类似地,检测单核苷酸多态性(SNP)的smFISH方法可以适用于seqFISH,以对神经元或其他细胞类型中的被编辑的转录物成像。
在一些实施方案中,所提供的技术提供了用于以下的高效和有成本效益的流水线(pipelines):通过顺序FISH(seqFISH)、和整体seqFISH(integrate seqFISH)和连接组学的基因原位谱分析,以对皮层中的躯体运动神经元谱分析,来鉴定对应于细胞身份的组合分子标志物。
大脑内基因表达映射的原位定量
光片照明显微术被应用于对CLARITY清晰化的大脑切片直接成像。在一些实施方案中,每台机器1个月内映射一个小鼠大脑。在一些实施方案中,用4-5台机器在一周内映射一个小鼠大脑。
放大:FISH信号的放大允许用20X低NA物镜实现对大脑切片大FOV成像。在一些实施方案中,所提供的方法使用被杂交链式反应(HCR)标记的可检测地标记的寡核苷酸(Choi等人,2010)来增加信背比(signal-to-background)和/或保留FISH方法的特异性和多路复用能力。通过这种方法,与mRNA靶互补的核酸探针触发了链式反应,在所述链式反应中亚稳态的荧光标记的核酸发夹自组装成栓荧光放大聚合物(tethered fluorescent amplification polymers)。利用携带光谱不同的荧光团的正交HCR放大器,可对所有通道同时进行原位放大。
在一些实施方案中,带有HCR(HCR探针)的可检测地标记的寡核苷酸包含与靶mRNA互补的20-nt区域,加上40-nt的HCR引发物。探针的杂交在10%甲酰胺的严格度下进行,随后在允许条件下进行扩增步骤。可以对如发夹浓度的条件进行优化以达到最佳结果;申请人指出,在某些情况中,较高浓度的发夹增加反应速率。每个HCR探针可以被扩增至衍射极限斑点。在一些实施方案中,在衍射极限点的规模内,FISH信号被放大约10-20倍。点亮度可以被进一步增强,同时通过例如在每个探针内并入多个HCR引发物和/或用多个荧光团标记每个HCR扩增发夹来保持衍射极限点规模。
在大脑切片中,从mRNA直接地观察到HCR放大的信号。当靶向相同的mRNA时,HCR探针以90%的比率与smFISH点共定位,但是要亮10-20倍(图14)。这允许HCR探针超越大脑的自发荧光被容易地检测到(图13)。高定位比率证明了HCR是与smFISH一样特异的并且大部分转录物被检测到。
HCR探针容易地被剥离并再杂交,并且可以与本文描述的seqFISH方案充分地整合。图15显示了在大脑切片中在两轮不同的杂交中HCR靶向的相同基因。两次杂交之间的良好的共定位显示了HCR-seqFISH稳健地对大脑中的mRNA编条形码。
HCR方案与smFISH杂交花费相同的时间范围并且不增加测定的循环时间。HCR中的初始杂交步骤在时间上与smFISH相似,而第二扩增步骤在30分钟与1小时内发生。使RNA探针与转录物杂交和任选地使用可选的发夹类型来放大信号的可选方法能够进一步减少循环时间。在一些实施方案中,HCR消除了对购买用胺标记的寡核苷酸探针的需求。除了其他以外,HCR能够潜在地降低约一半的试剂花费,例如,至每大脑$10,000。
自动化。硬件和软件两者的自动化可被应用于有效地扩大规模,例如,映射100种基因和/或减少人类劳力和/或错误。在一些实施方案中,技术的关键部分被整合以产生用于组织和/或器官成像,诸如大脑切片的成像的流水线和/或优化工作流程。除了其他以外,自动化射流(fluidics)、图像采集和/或整合分析可以独立地且任选地与快速杂交循环时间和成像时间组合。
硬件。在一些实施方案中,自动化系统需要最小的来自用户的干预并且在用户已设定实验后可自动地执行图像采集。在一些实施方案中,每个测序仪(sequencer)由进行成像的自动化落射荧光显微镜和进行连续杂交的自动化射流系统组成或包括进行成像的自动化落射荧光显微镜和进行连续杂交的自动化射流系统。在一些实施方案中,压缩空气被用来将试剂推进带有固定在底部盖玻片上的细胞和组织的l cm×l cm孔中。不意图被理论限制,申请人指出在一些实施方案中,由于杂交缓冲液的高粘度,压缩空气驱动系统消除了死体积并且还可被精确控制以递送限定体积的试剂。在一些实施方案中,单独的真空线被用于净化室。在一些实施方案中,所提供的方案的工作流程与在本发明的时期本领域所熟知的现有DNA测序仪相似。
在一些实施方案中,在每个杂交循环期间,机器自动地使样品与探针杂交、用缓冲液洗涤以去除过量的探针和/或扫描大脑切片用于成像。在一些实施方案中,其中在去除步骤中使用DNA酶,成像之后DNA酶流入以去除探针。在彻底的洗涤之后,随后可进行另一轮杂交。在杂交时间期间,显微镜移动至镜台上的不同位置以对已经杂交和洗涤的另一个大脑切片成像。以如此方式,大部分时间相机在采集图像,同时镜台上的其他样品在杂交。
软件。在一些实施方案中,使用软件,例如来自动化控制过程和分析数据。在一些实施方案中,将在Micromanager(由National Institute of Health支持的免费软件)中编写代码,来控制显微镜以及射流元件。在一些实施方案中,通过Micromanager来控制阀门、镜台、光源、相机和/或显微镜。
在一些实施方案中,压缩传感被用于密集的图像(Zhu等人,Faster STORM using compressed sensing.Nat.Methods.2012,9(7):721-3)并且去卷积方法被用于将密集的簇中的点区分开。在一些实施方案中,在图像分析上的改进提高了所提供方法例如seqFISH的多路复用能力(例如,超出100种基因多路复用的约4-5倍)。在一些实施方案中,以相似的方式从Illumina GAII测序仪改进至HiSeq仪器来提高效率,其中利用图像处理方法来分析测序芯片上的密集堆积的簇增加了通量。在一些实施方案中,数据采集和分析被整合在用户友好的包内。
在一些实施方案中,所提供的技术提供了用于数据分析的软件包。在一些实施方案中,所提供的技术提供了用于在Python和Matlab中分析数据的软件包。所提供技术的图像可以是多种尺寸的,并且如果期望能任选地被优化。在一些实施方案中,每个FOV为14位深的6兆像素,对应于每个图像1.5MB的数据。在一些实施方案中,每个运行产生约100GB的数据。在一些实施方案中,所提供的技术提供了用于数据处理和/或缓解数据阻塞(log jam)的方法。在一些实施方案中,数据阻塞通过以下缓解:从每个图像分割出点,用2维高斯分布对其拟合,并记录拟合点(fits)的中心位置。在一些实施方案中,所提供的技术通过丢弃原始图像并保存处理的数据来节省计算机空间。
用CLARITY清晰化的大脑切片的光片照明显微术。在一些实施方案中,所提供的技术提供了用于对组织、器官和/或有机体成像的方法。在一些实施方案中,所提供的技术提供了用于测量厚的组织或器官的方法。在一些实施方案中,厚的组织或器官具有约100μm或大于100μm的厚度。在一些实施方案中,所提供的技术保留了超出了单一细胞内的远程投射和形态。在一些实施方案中,光片照明显微术被用来测量厚的组织或器官。在一些实施方案中,组织、器官和/或生物体通过CLARITY被清晰化(Chung等人,Structural and molecular interrogation of intact biological systems,Nature,2013,doi:10.1038/nature12107)。
在一些实施方案中,为了对较好的保留远程投射和形态的较厚的大脑切片(>100μm)成像,光片照明显微术(也被称为选择性平面照明显微术(SPIM))被应用在CLARITY清晰化的大脑组织上。在一些实施方案中,CLARITY方法使大脑变的透明,用于神经元的组分及其分子身份的可视化和鉴定。在一些实施方案中,通过去除光散射脂质,CLARITY使大脑组织变成光学上透明且高分子-可渗透的,所述光散射脂质被多孔水凝胶置换以保留大脑组织的形态,以使得研究可以被进行而无需将大脑薄切,这使感兴趣的神经元及其远程突触连接能够可视化。不意图被理论限制,申请人注意到与本发明之前的以前在培养物或薄的切片中进行的FISH相比,所提供的技术可以使用较厚的组织并且允许个体神经元或3D神经网络转录组的更精确的重构。图16图示了一种成功的、经验证的基于Clarity的方案,来制备与FISH染色相容的光学上清晰的厚切片:(1)将2mL Eppendorf管中的100微米的冠状大脑切片在1.5mL的4%丙烯酰胺、2%甲醛、0.25%热引发剂、1×PBS中在4度下孵育过夜;(2)将氮气鼓穿水凝胶溶液,持续10秒;(3)将脱气样品在42度下孵育2小时,以使聚合;(4)将样品在PBS中洗涤3次并且在10%SDS、1×PBS中在37度下孵育4小时,以使清晰化;以及(5)将样品在PBS中洗涤3次并且即用于seqFISH。
在一些实施方案中,所提供的技术提供了用于使背景最小化或者避免虚化背景的方法。在一些实施方案中,所提供的技术利用使背景最小化或避免虚化背景的成像技术。在一些实施方案中,SPIM被用于具有较高虚化背景的较厚的切片。在一些实施方案中,虽然共聚焦显微镜能够拒绝这样背景,但是它扫描缓慢并且在对较下层成像时光漂白样品的较上层。在一些实施方案中,在SPIM中只有被成像的层被激发光照射。在一些实施方案中,在用于所提供的技术的SPIM设置中,彼此垂直放置的两个物镜被悬于样品之上约55°。在一些实施方案中,光片利用使光线的一个光轴线聚焦在约10μm高和约200μm的有效宽或FOV内的柱面透镜来产生。
在一些实施方案中,本发明为所提供的方法提供了显微镜设置。在一些实施方案中,本发明提供了光片显微镜,其中样品从侧部被照射。在一些实施方案中,光片与样品台平行。在一些实施方案中,光片与检测物镜垂直。在图17中图示了光片照射显微镜的示例性设置。通过改装两个反射镜和柱面透镜,产生光片的平面并且其从侧面照射样品,并且垂直于检测物镜(中)。底部反射镜与柱面透镜连接并且被直接安装在物镜的相同底座上。对于该配置,物镜与照射片同步地移动,允许沿着z-轴(右,上部)扫描样品。右(下部)图还显示了样品被置于杂交室内,并且由下面的空气物镜成像。
如在图18中所图示的,用CLARITY清晰化并与针对β-肌动蛋白的HCR探针杂交的100μm大脑切片获得SPIM图像。采用具有0.5μm间隔的200个光学切片来产生重构。用20×水浸物镜来观察清晰的HCR信号。β-肌动蛋白mRNA被高表达,对细胞体中的大量的点做出了解释。但是,在轴突中也观察到了清晰的衍射极限点。
在一些实施方案中,可改变针对CLARITY清晰化的大脑的和SPIM显微术的HCR-seqFISH方案。在4-5小时内100μm的切片被有效杂交,指示可检测地标记的寡核苷酸探针可以在100μm厚但清晰的切片中容易地扩散。另外,DNA酶也容易地扩散以从切片剥离HCR信号(图15)。在一些实施方案中,所提供的技术提供了可检测地标记的寡核苷酸,诸如FISH和HCR探针,它们比本领域普通技术人员常规用来扩散进入1mm厚的冠状切片的抗体小,并且提供了针对整个组织或器官对靶的谱分析,例如,对CLARITY清晰化的整个大脑进行seqFISH。
在一些实施方案中,所提供的技术提供了显微术的几何形状。在一些实施方案中,所提供的技术提供了SPIM的可选几何形状,以使得厚的大脑切片(>100μm)和潜在的整个CLARITY清晰化的大脑可以被安装在具有长工作距物镜的落射荧光显微镜上。在一些实施方案中,光片垂直于成像轴产生,并跨越200-300μm以10μm宽划分以一定倾角安装在显微镜上的样品。在一些实施方案中,所提供的几何形状允许指导开发的流室和自动化设计转移。在一些实施方案中,大脑切片中的基准标志物被用来记录连续的切片。在一些实施方案中,在划分之前,纳米级标尺被注射入大脑,允许不同分区间的良好记录。
速度。在一些实施方案中,成像速度限制了最终通量。在一些实施方案中,所提供的HCR扩增提供了超过足够成像的光子数目,并且可以使用不那么昂贵的相机来对样品成像。在一些实施方案中,来自收集物镜(collection objective)的光可以用成像平面二色和滤器分成多个例如6个不同的光束(例如,5个荧光和1个DAPI)。这极大地增加了原位“测序仪”的通量,使得在单台显微镜上在1周内可完成整个大脑。
靶基因选择。在一些实施方案中,本发明提供了用于选择和成像一组靶的技术,所述一组靶诸如一组转录物和/或DNA基因座(例如,如所示例的100个靶的组)。在一些实施方案中,从来自Allen brain atlas(ABA)的原位数据库选择靶基因。多重标准可以被用于选择感兴趣的基因,例如,皮层区中的可能代表细胞身份的那些基因。从重叠的标准计算选择最佳的基因的组是熟知的(2.Alon,N;Moshkovitz,Dana;Safra,Shmuel(2006),"Algorithmic construction of sets for k-restrictions",ACM Trans.Algorithms(ACM)2(2):153-177,ISSN 1549-6325;8.Cormen,TH.;Leiserson,Charles E.;Rivest,Ronald L.;Stein,Clifford(2001),Introduction to Algorithms,Cambridge,Mass.:MIT Press and McGraw-Hill,第1033-1038页,ISBN 0-262-03293-7;12.Feige,U(1998),"A threshold of In n for approximating set cover",Journal of the ACM(ACM)45(4):634-652,,ISSN 0004-5411)。在一些实施方案中,集合覆盖启发法(set-cover-heuristics,Pe’er,2002)被用于选择以下基因:1.已知限定细胞亚型的基因;2.在ABA中表现出“盐和胡椒(salt and pepper)”的表达模式的基因;3.属于诸如转录因子、离子通道、GPCR和神经妥乐平的基因家族的基因;和4.被从皮层样品的RNAseq实验剔除的基因。例如,SLC1A3标识胶质细胞而SLC6A1标识抑制性神经元,并且SLC17A7标识兴奋性神经元。在一些实施方案中,具有异质性表达模式的基因诸如PVALB、SST和CALB标识出抑制性神经元的亚组。以下显示了100种基因的示例性组:
seqFISH与蛋白质检测、细胞器标志物和活性测量集成。在一些实施方案中,所提供的技术例如seqFISH允许以单细胞分辨率对同一样品中的RNA以及蛋白质、神经活动和结构布置原位多路复用分析。在另外的一轮杂交中可使特定靶的抗体与样品杂交。在一些实施方案中,所提供的方法任选地包括免疫染色的步骤。在一些实施方案中,在多种抗体被用于顺序的杂交轮中检测许多蛋白质靶(Schubert W等人.Analyzing proteome topology and function by automated multidimensional fluorescence microscopy.Nat Biotechnol(2006)24(10):1270-1278)。申请人注意到在细胞中存在超出mRNA多达约100-1000倍或更多倍的较高的蛋白丰度。被靶向的蛋白可以标识诸如线粒体、ER、转运小泡、细胞骨架的细胞器以及突触连接。例如,可以使用MAP2抗体来标识出细胞边界,以帮助划分轴突和树突。
在通过所提供的方法(例如,seqFISH)对转录谱分析之前,可以在落射荧光和光片照明显微镜上对大脑切片的实况观察成像。在大脑切片中钙(Nakai J,Ohkura M,Imoto K(February 2001)."A high signal-to-noise Ca(2+)probe composed of a single green fluorescent protein".Nat.Biotechnol.19(2):137-41;Akerboom等人,"Optimization of a GCaMP calcium indicator for neural activity imaging."J Neurosci.2012年10月3日;32(40):13819-40;Stosiek等人,"In vivo two-photon calcium imaging of neuronal networks."Proceedings of the National Academy of Sciences 100(12):7319)和电压传感器(Cohen,等人,"Optical Measurement of Membrane Potential"in Reviews of Physiology."Biochemistry and Pharmacalogy,第83卷,第35-88页,1978(6月);Mutoh等人,Genetically Engineered Fluorescent Voltage Reporters ACS Chem Neurosci.2012年8月15日;3(8):585-592;Peterka等人,Imaging voltage in neurons.Neuron.2011年1月3日;69(l):9-21)可被成像。SPIM允许对大脑切片中的这些传感器有效且快速地成像。将大脑切片固定在显微镜上并且所提供的方案诸如seqFISH方案可以用自动化的射流来进行。在一些实施方案中,除了实况测量之外,检测活动依赖性即早基因(IEG)的mRNA作为在神经元中的整体神经活动的衡量。例如,在神经元中容易地检测到CamKII和cFos具有异质性表达水平;根据丰度可将它们分别并入基因的组中,例如,示例性100种基因多路复用,或在另外的循环中进行FISH。
集成连接组学和seqFISH以鉴定不同的躯体感觉运动神经网络内不同的神经元的分子身份。
利用所提供的技术系统地表征躯体感觉运动神经网络内不同的神经元群体的分子身份。在一些实施方案中,相同的功能子网络内的神经元群体可共用共同的标志物基因的组,但也具有在细胞水平上定义身份的其他基因的异质性表达。在一些实施方案中,不同子网络中的细胞在其表达方式上更为不同。其每个控制基础类型的感觉运动功能的示例性皮层-皮层躯体子网络为:(1)口面咽(orofaciopharyngeal),针对饮食;(2)上肢(upper limbs),针对伸出和抓取;(3)下肢(lower limbs),针对运动;和(4)须(whisker),针对有节奏的须运动。在一些实施方案中,所提供的技术提供了新颖且严密的方法,用于表征具有不同神经网络的皮层神经元的分子身份,并且为了解遗传回路提供了非常宝贵的信息,所述遗传回路为哺乳动物大脑的布线图的基础。
利用一系列神经通路,可以生成数字皮层连接图(atlas)来展示束路追踪研究的原始图像。可以用图表重构通路来生成皮层-皮层连接图,以助于大规模数据的分析。基于皮层内连接,可以建立四个不同的皮层-皮层躯体子网络,其每个控制基础类型的感觉运动功能。这些子网络的每个包含初级躯体感觉(SSp)皮层区、初级躯体运动(MOp)皮层区、次级躯体运动(MOs)皮层区和辅助躯体运动(SSs)皮层区中的4-5个不同的功能域(domain),根据这些皮层区与对应于特定躯体分区的其他躯体感觉运动区的连接强度这些皮层区被进一步细分。在一些实施方案中,口面咽子网络包括五个主要的节点:(1)SSp口和鼻域(SSp-m/n);(2)MOp口面域(Mop-orf);(3)MOs喙背外侧(rostrodorsolateral)域(MOs-rdl);(4)SSp桶状区前外侧(barrel field anterolateral)域(SSp-bfd.al);和(5)SSs喙和尾腹侧(caudoventral)域(SSs-r&cv)。在一些实施方案中,上肢子网络的四个主要节点包括(1)SSp上肢(SSp-ul);(2)Mop-ul;(3)喙背侧(rostrodorsal)MOs(MOs-rd);和(4)尾背侧(caudodorsal)SSs(SSs-CD)。在一些实施方案中,下肢/躯干子网络包括SSp下肢/躯干区域(SSp-ll/tr)、MOp-ll/tr和喙背侧中部(rostrodorsomedial)MOs(MOs-rdm)(图19)。在一些实施方案中,须子网络包括尾中部(caudomedial)SSp-bfd(SSp-bfd.cm),对应于须初级运动皮层(vM1)的MOp-w和尾背侧SSs(SSs-cd;图19)。示例性数据由Mouse Connectome Project(www.mouseconnectome.org)描述。
为了确定这些躯体感觉运动子网络的每个中的不同神经元群体的分子身份,使用多荧光逆行示踪剂来标记神经元,并且所提供的技术诸如seqFISH可被应用于以单细胞分辨率确定逆行地标记的群体的基因表达谱。为了标记神经元群体,将多种(例如,五种)逆行示踪剂注射入同一动物中的每个感觉运动子网络的主要节点之一的五个主要靶(示踪剂信息如下)。例如,在一个动物中,回路示踪剂被注射入口面咽子网络的主要的皮层节点中的两个(SSp-bfd.al和SSs-r&cv)和皮层下节点中的三个(尾壳腹外侧(caudoputamenventrolateral)域,CP-vl;丘脑腹后内侧核,VPM;和腹侧三叉神经脊束核,SPV)。这同时地背景(back)标记口面咽子网络的所有其他节点中的五种不同的神经元。在该实施例中,标记的神经元在SSSp-m/n域中且在Mop-oro域中。
另一方面,示踪剂可被注射入四种不同的SSp躯体分区(即SSp-m/n、SSp-ul、SSp-ll/tr和SSp-bfd.cm),其每种属于不同的躯体子网络。这同时地标记与不同的子网络相关的皮层区中的不同神经元群体。在这种情况中,例如,背景标记的神经元可在与每个子网络相关的MOp域中观察到,所述MOp域即Mop-orf、Mop-ul、Mop-ll/tr和Mop-w。被应用于四个躯体感觉运动子网络的每一个的所有主要节点和皮层下靶的注射策略标记了每个子网络的不同神经元群体。
注射示踪剂后(例如,注射示踪剂后一周),处死动物,并收获其大脑并以20μm或100μm的厚度冠状地切片,用于被背景标记的神经元的seqFISH分析。利用例如Allen Brain Atlas项目的在线数字基因表达数据库(www.Brian-Map.org)(Lein等人,2007Genome-wide atlas of gene expression in the adult mouse brain.Nature,11;445(7124):168-76)预选基因用于谱分析,所述基因诸如在躯体感觉运动皮层区(SSp、Mop、MOs、SSs)中富集表达的示例性的约100种基因。
注射策略和注射后处理。使用三百只4周龄的C57B1/6雄性小鼠。在一只动物中,如以上描述的将五种荧光逆行示踪剂注射入同一躯体感觉运动子网络内的不同节点,或不同躯体子网络的不同节点中(图19)。示踪剂是荧光金(FG,黄色)、与488或647(CTb-488[绿色]、CTb-647[粉红色])缀合的霍乱毒素b、Red retrobeads(RR,红色)、和与655(WGA-Qdot655,白色)缀合的麦胚凝集素。由于Qdot655具有与CTb647不同的激发波长,所以Qdot655可以被捕捉入不同的通道中并用独特的色度伪上色。经由立体定向手术注射(离子透入地或以压力注射)示踪剂。手术和灌注的细节被描述于例如Hintiryan等人,Comprehensive connectivity of the mouse main olfactory bulb:analysis and online digital atlas.Front Neuroanat.2012年8月7日;6:30.eCollection 2012。在一些实施方案中,在准确相同的坐标中用所使用的相同的示踪剂注射两只成对小鼠。动物中的一个被用来证实标记的细胞和注射位点的位置,而另一只经受所提供的例如seqFISH方法。在示踪剂运输后灌注动物,并且大脑被冠状地切成50μm厚度的片并且以四个系列收集。四个系列的切片中的一个用荧光尼氏染色液(NeuroTrace Blue[NTB])复染色、安装在载玻片上、并利用Olympus VS120虚拟显微术系统成像。在一些实施方案中,尼氏染色提供了用于使背景标记的细胞的精确解剖位置可视化的细胞结构背景。通过信息流水线对这些图像处理,以使得每个个体图像忠实地配准到它的Allen Reference Atlas(ARA)的相应水平。该尼氏染色连同所提供的信息工具一起使能够自动且精确的计数每个ROI(在该情况中,躯体感觉运动区的不同域)中的每种示踪剂标记的神经元群体的大约数目。分布方式被自动地标绘到对应的图水平以生成其连接图。
将成对的小鼠同时处死,并且将其大脑以20μm或100μm的厚度切片用于seqFISH分析。将这些切片首先在20×(或10×)物镜下成像以展现用不同的示踪剂背景标记的神经元。对于示例性的100种基因的组,包含躯体感觉运动区的贯穿所有的冠状水平的大脑切片被用于进行seqFISH。这种方法展现了每个示踪剂标记的神经元中的基因表达。所有图像首先被分析每种个体示踪剂标记的神经元的基因表达谱。每个切片被配准回其配对的大脑的最接近的匹配切片,以使得来自配对的大脑的近似相同冠状水平处的切片可以在连接体(connectome)视窗中被并排展示。如此,在不同神经元群体的最接近匹配的解剖学背景中,其分子谱被展示。在一些实施方案中,在每个逆行标记的神经元群体中,基因表达谱被关联。
结果。在一些实施方案中,在不同的躯体感觉运动区内不同的逆行地标记的神经元群体展示出不同的转录组谱;甚至用不同的示踪剂标记的相同域(例如,SSp-m)中的神经元群体展示出与具有不同连接谱的其邻近神经元不同的基因表达谱。在一些实施方案中,在相同子网络内的不同躯体感觉运动节点(例如,SSp-m、MOp-orf、SSp-bfd.al和SSs-r)内的不同神经元群体共用共同的网络特异的基因,而不同的神经网络内(例如,口面咽和下肢/躯干子网络)的神经元群体展示出非常不同的转录组谱。在一些实施方案中,对于不同皮层区和不同层中的那些神经元,鉴定区域(例如,SSp或MOp)或层(不同层)特异基因。
如示例的,所提供的技术提供了荧光束示踪与seqFISH技术的独特组合,来以亚神经元分辨率和忠实的解剖学背景表征不同的躯体感觉运动网络内基于连接的神经元群体(细胞类型)的分子身份。参见,例如,图3和图9,为示例性结果。在一些实施方案中,所提供的技术包括平行地测量其他参数(即抗体和细胞器染色,以及IEG表达水平),并且可被应用于整个新皮层或大脑。
用于在线分析并展示数据的高通量流水线和信息学工具。在一些实施方案中,所提供的技术提供了用于通过例如可公开访问的数据库,诸如www.MouseConnectome.org)在线分析并展示数据高通量流水线和信息学工具,。在一些实施方案中,所提供的技术提供了与Mouse Connectime Project的集成,Mouse Connectime Project的广泛研究范围和多荧光成像的使用使其在连接组学群体(community)之中成为有价值的工具并且非常适于小鼠大脑中的远程连接研究。例如,其提供了在线可视化工具,所述可视化工具允许用户将多荧光标记的途径在自身的细胞结构背景之上并且在对应的ARA图谱水平上可视化。在一些实施方案中,为了使seqFISH信息与其对应的逆行地标记的体细胞密质部分忠实地关联,被标记的细胞体被从组织背景并从同一切片的图像离散地分割出,但在不同的轮次中取得(例如,首先针对成像逆行示踪剂,然后针对seqFISH中不同的mRNA),并且通过它们相对于切片和/或组织中的解剖学地标上的固定的参考点的坐标来在空间上索引化。在一些实施方案中,为了将数据与在ARA中限定的立体定位坐标关联,本发明提供了极大地增加配准精确度(即,将每个扫描的显微图像扭曲至ARA的对应水平的形状)和图像分割的新颖的配准流水线,该图像分割自动且精确地枚举给定的ROI(例如,SSp-m,MOp-11)中的荧光标记的神经元的。在一些实施方案中,所提供的技术共同地允许大脑内的标记和来自多种示踪剂的seqFISH数据,并且跨越多个大脑,被整理成可视化和注释目的的单个解剖学框架(single anatomical framework)。
在一些实施方案中,在对应的Allen Reference Atlas(Dong,H.W.(2008).The Allen Reference Atlas:A Digital Color Brain Atlas of C57BL/6J Male Mouse,John Wiley&Sons)的图水平上配准图像。由配准过程产生的变形矩阵被应用到原始分辨率的图像上,来获得高分辨率的扭曲图像。在配准和配准精化后,荧光尼氏染色被转化成明场图像。接下来,每个图像的每个通道被调整亮度和对比度,以使工具中的标记可见度和质量最大化,所述工具例如iConnectome。在修正(即,偏斜度、角度)和JPEG2000文件格式转换后,可以将图像公布至iConnectome查看器(www.mouseconnectome.org)。
FISH可视化工具。在一些实施方案中,产生的所有连接数据通过MCP信息学流水线处理并且通过新的iConnectome FISH查看器(www.mouseconnectome.org)在线展示。不同于展示两个顺行地(PHAL和BDA)标记和两个逆行地(FG和CTb)标记的iConnectome查看器,iConnectome FISH可以展示多达五种带有逆行荧光染料的不同神经元群体。如上提到的,可将每组注射剂给予一对小鼠。一只可根据常规MCP流水线处理并且在iConnectome FISH查看器中被展示,以在多荧光标记的神经元群体自身尼氏染色的细胞结构背景内和它们对应的ARA水平内呈现多荧光标记的神经元群体。这些可以为跨越整个大脑的每个荧光标记的神经元群体提供精确的解剖学信息。在seqFISH之后,来自其配对伴侣的大脑切片被配准到其配对伴侣所配准至的最接近的ARA水平并且可以在不同的窗口中被并排显示。在神经元中表达的基因列表在侧部面板上被列出。点击基因之后,表达该基因的荧光标记的神经元可以变亮,来指示其表达的位置。这提供了在连接背景和解剖学背景的全局背景内显示神经元群体的分子身份的实用的方式。
在一些实施方案中,开发了对应的数据库,所述数据库允许用户对这些数据进行分析并且将神经连接与其分子身份关联。该信息学工具基于如下数据库建立:,所述数据库利用基因编条形码来存储与每个逆行标记的神经元群体相关的信息(例如细胞数目、解剖学位置)。该数据库可以帮助用户鉴定在相同神经网络或不同神经网络内的神经元的对应的基因条形码。
映射整个大脑。在一些实施方案中,所提供的技术在单个神经元水平上具有足够的灵敏度、选择性、自动化和/或时空分辨率,用于对整个大脑高通量分析逆行标记的神经元中的基因表达。
去除步骤的另外的示例性方法
在一些实施方案中,本发明提供了用于从靶去除可检测地标记的寡核苷酸的多种方法。在一些实施方案中,核酸外切酶III(ExoIII)被用来去除可检测地标记的寡核苷酸。图21图示了使用Exo III的HCR再杂交的示例性方法。在图21中,Exo III消化桥接链和HCR聚合物,保持中间寡核苷酸完整,用于与新的桥接链杂交。在图21(b)中展示了使用靶向T3T小鼠成纤维细胞中的β-肌动蛋白(Actb)转录物的可检测地标记的寡核苷酸的示例性数据。左边的图像显示了使用Alexa 488染料的Actb转录物的初始杂交和扩增。中间的图像显示了室温下在外切酶III中孵育1小时后Alexa 488通道中的信号完全丢失。右边的图像显示了仅添加新的桥接链以及用Alexa 647染料标记的相应发夹之后,Actb转录物的再扩增。调整图像的对比度以图示方法的某些特征。
在一些实施方案中,Lambda核酸外切酶(λ-exo)被用来去除可检测地标记的寡核苷酸。图22图示了使用λ-exo的HCR再杂交的示例性方法。在图22中,λ-exo消化5’磷酸化的桥接链并且从与靶(例如,mRNA)结合的中间寡核苷酸释放HCR聚合物,并且保持中间寡核苷酸的完整用于在洗涤去释放的聚合物之后与新的桥接链杂交。在图22(b)中展示了使用靶向T3T小鼠成纤维细胞中的β-肌动蛋白(Actb)转录物的可检测地标记的寡核苷酸的示例性数据。左边的图像显示了使用Alexa 488染料的Actb转录物的初始杂交和扩增。中间的图像显示了在37℃下在λ-exo中孵育1小时后Alexa 488通道中的信号丢失。右边图像显示了在用洗涤缓冲液洗涤并仅添加新的桥接链连同用Alexa 647染料标记的对应的发夹之后,Actb转录物的再扩增。调整图像的对比度以图示方法的某些特征。
在一些实施方案中,尿嘧啶特异性切除试剂(USER)被用来去除可检地测标记的寡核苷酸。图23图示了使用USER的HCR再杂交的示例性方法。在图23中,USER在桥接链中的脱氧尿苷核苷酸处消化并且从与靶(例如,mRNA)结合的中间寡核苷酸释放HCR聚合物,并且保持中间核苷酸的完整用于在洗涤去片段和释放的聚合物之后与新的桥接链杂交。在图23(b)中展示了使用靶向T3T小鼠成纤维细胞中的β-肌动蛋白(ACTb)的可检测地标记的寡核苷酸的示例性数据。左边的图像显示了使用Alexa 488染料的Actb转录物的初始杂交和扩增。中间的图像显示了在37℃下在USER中孵育1小时后Alexa 488通道中的信号丢失。右边图像显示了在用洗涤缓冲液洗涤并仅添加新的桥接链连同用Alexa 647染料标记的对应的发夹之后,Actb转录物的再扩增。调整图像的对比度以图示方法的某些特征。
在一些实施方案中,通过使用互补寡核苷酸(cTOE)置换来去除可检测地标记的寡核苷酸。在一些实施方案中,置换包括使用葡聚糖或其衍生物、盐和/或有机溶剂。在一些实施方案中,置换包括使用葡聚糖或其衍生物。在一些实施方案中,置换包括使用硫酸葡聚糖。在一些实施方案中,置换包括使用盐。在一些实施方案中,盐是MgCl2。在一些实施方案中,置换包括使用有机溶剂。在一些实施方案中,有机溶剂是甲酰胺。可以单独地或以组合优化多种因素,例如但不限于cTOE浓度、孵育时间、缓冲液的组成以及有机溶剂的类型和/或浓度。图24显示了使用cTOE置换smFISH探针的示例性数据。显示了待置换的smFISH探针(Alexa 647)和共定位的smFISH探针(Alexa 532)之间的荧光强度的平均比率。进行多种处理,其中比较了cTOE的浓度、杂交缓冲液组成和置换时间。所有的置换探针条件导致比对照显著更多的置换,在所述对照中细胞被置于10%DS中并且不添加cTOE。不意图被理论限制,申请人注意到,除了其他以外,增加cTOE的浓度、增加cTOE探针杂交的时间量、将缓冲液调整为10mM MgCl2或10%甲酰胺全都导致置换增加。cTOE以2.5μΜ在10%硫酸葡聚糖(DS)中持续2小时导致Alexa 647smFISH信号的最小残留但比基线信号较小的增加,所述基线信号通过杂交Alexa 594(A594)而不是Alexa 647且不添加cTOE来确定。
寡核苷酸制备的另加的实施例
通过PCR扩增一组序列(图25)。将产物分离,例如,在-20℃下用5体积沉淀缓冲液(30:1EtOH:1M NaAc)沉淀至少10分钟。将沉淀混合物离心10分钟。丢弃上清液并且在切口酶缓冲液中用合适单位的酶重构寡核苷酸团块,所述合适单位的酶基于在1小时中约10单位的酶消化约1μg DNA。孵育时间结束后,将样品再次沉淀并在2X加载缓冲液(96%甲酰胺/20mM EDTA)和水中重构以制备最终的加载缓冲液(48%甲酰胺/10mM EDTA)。将样品加热到95℃以使DNA完全变性。然后将变性的DNA加载进变性聚丙烯酰胺凝胶(8M尿素10-12%丙烯酰胺)中。使凝胶在250V下运行1小时,或按期望优化。电泳后使用1x sybr gold对凝胶染色15分钟且然后可视化。合适的条带被切出、破碎、并在DI水中孵育2小时。孵育后,对样品再次沉淀并且然后使用真空柱纯化。用30μL无RNA酶水洗脱柱以得到最终产物,如在图26中所示的。
在一些实施方案中,所提供的方法使用限制酶位点而不是切口核酸内切酶位点。与图25中的扩增步骤相似,通过PCR扩增5’-端侧翼为BamHI位点且3’-端侧翼为Aatll位点的一组序列。将PCR产物在-20℃下用5体积的沉淀缓冲液(30:1EtOH:1M NaOAc)沉淀至少10分钟并分离,随后用BamHI和Aatll消化。将产物再次纯化并经受exo III消化。去除消化的核酸提供产物寡核苷酸。
等同物
已经描述了本发明的一些例证性实施方案,对于本领域技术人员应该是明显的是上述仅仅是例证性的而非限制性的,仅以实例的方式呈现。大量的修改和其他例证性的实施方案在领域普通技术人员的理解范围内并且被构思为落在本发明的范围内。特别地,虽然本文展示的许多实例涉及方法行为或系统元素的特定组合,应理解这些行为和这些元素可以其他方式组合来完成相同的目标。仅结合一个实施方案讨论的行动、元素和特征不意图排斥其他实施方案中的类似角色。此外,对于在以下权利要求中引用的一个或更多个方法加功能限制,方法不意图被局限于在本文中公开的用于执行所述的功能的方法,而是意图在范围上覆盖现在已知或以后开发的用于执行所述的功能的任何方法。
在权利要求中使用序数术语如“第一”、“第二”、“第三”等,来修饰权利要求元件,其自身并不意味着任何优先性、优越性、或一种权利要求相对另一个的顺序或方法的行为被执行的时间顺序,而仅被用作标记以区分具有某个名字的一个权利要求元件和具有相同的名字(但使用了序数术语)的另一个元件,以区分权利要求元件。相似地,在权利要求中,使用的a)、b)等,或i)、ii)等其自身并不意味着权利要求中任何优先性、优越性或步骤的次序。相似地,在说明中使用的这些术语其自身并非具有任何所需的优先性、优越性或次序。
认为上述书面说明足以使本领域技术人员能够实践本发明。本发明不被所提供的实施例的范围限制,因为实施例意图作为本发明的一方面的单个例证并且其他功能上等同的实施方案在本发明的范围内。除了本文显示和描述的那些之外,根据前述说明本发明的多种改变对于本领域技术人员来说将变得明显,并且落入所附权利要求的范围内。本发明的优点和目的不必要被本发明的每个实施方案包括。
- 还没有人留言评论。精彩留言会获得点赞!