醇脱氢酶变体的制作方法
本申请要求2013年10月4日提交的标题为“ALCOHOLDEHYDROGENASEVARIANTS”、序列号为61/887251的美国临时专利申请的优先权,该申请的公开内容以引用方式并入本申请。同时,亦以引用的方式将2014年10月3日创建的标题为“GNO0003WO_Sequence_Listing_ST25.txt”、大小为206kb的ASCII文本文件的全部内容并入本申请。
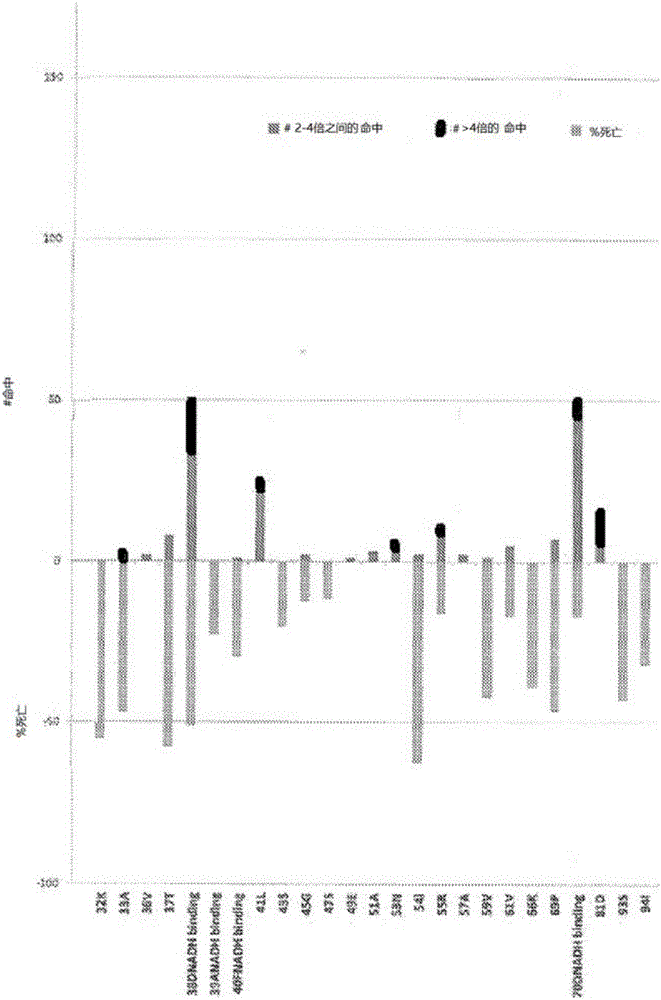
背景技术:
:醇脱氢酶(ADHs;EC1.1.1.1)促进醇类向醛类或酮类的转化,通常伴随着烟酰胺腺嘌呤二核苷酸的还原(NAD+至NADH)。ADHs在各种代谢产物的生物合成过程中协助产生具有醛基、酮基和醇基的重要化合物。甲醇脱氢酶(MDHs)是醇脱氢酶中的一类。MDHs,将甲醇(MeOH)转化为甲醛(Fald),可用在工程化到微生物中的酶途径里,允许使用MeOH作为唯一碳源或与其他原料(例如,葡萄糖、右旋糖、植物生物量或合成气)作为共同碳源,以产生有价值的产物。已经报道了代谢甲醇的微生物,且在某些情况下,经由甲醇脱氢酶进行所述代谢,并在更少的情况下,生产有价值的产物。增加MDH活性将提高对MeOH的使用,促进MeOH作为唯一碳源,降低了生产成本,减少更昂贵的辅助或共同碳源(例如葡萄糖)的用量,增加产物产量,并提供更快的MeOH利用速度。技术实现要素:一般地,本申请中所述的非天然NAD+-依赖性醇脱氢酶(ADHs)(即工程酶及其编码多核苷酸),与其原始或未修饰的对应物相比,能够将甲醇或乙醇向甲醛或乙醛的分别转化提高到至少两倍。在示例性方面中,描述了非天然NAD+-依赖性甲醇脱氢酶(MDHs),尤其是分类为EC1.1.1.244的酶。所述ADHs和MDHs,与其对应的天然或未修饰的醇脱氢酶相比,具有至少一个氨基酸置换。所述“未修饰的醇脱氢酶”是指,该ADH或MDH在加入本申请所述的任何修饰之前,可以先前已经经过工程改造(例如,不一定是天然发生的)。用作加入本申请中所述修饰以产生新工程酶的起始序列的所述醇脱氢酶,可选地,在此可以称为野生型,模板,起始序列,天然的,天然存在的,未修饰的,对应的天然醇脱氢酶,无氨基酸置换的对应天然醇脱氢酶,对应的醇脱氢酶,或无氨基酸置换的对应醇脱氢酶。本申请所述的实验研究,首次展示了沿氨基酸序列长度的若干氨基酸位置可以被置换,以提供底物转化提高的非天然脱氢酶。所述研究还表明,氨基酸序列中的置换的组合(例如,二,三,四,五,六,七,八,九,十,十一,或十二个等),还可以提供进一步提高的底物转化。因此,本申请提供了起始或模板或对应的醇脱氢酶的单一和组合变体,例如,尤其是底物转化提高的分类为EC1.1.1.244的酶。本公开的实施例提供了一种非天然NAD+-依赖性醇脱氢酶,其与对应醇脱氢酶相比,包含至少一个氨基酸置换,且在相对于未包含氨基酸置换的对应醇脱氢酶进行测量时,其能够将甲醇或乙醇向甲醛或乙醛的转化提高到至少两倍。本公开的实施例还提供一种非天然NAD+-依赖性醇脱氢酶,其包含至少一个氨基酸置换,且与表达NAD+-依赖性醇脱氢酶的第二序列相比,能够将甲醇或乙醇向甲醛或乙醛的转化分别提高到至少两倍,其中所述第一序列和第二序列之间的差异在于所述至少一个氨基酸置换。实施例还涉及到表达所述的能够将甲醇或乙醇向甲醛或乙醛的转化提高到至少两倍的非天然NAD+-依赖性醇脱氢酶的工程细胞。本公开的一些实施例,涉及表达包含至少一个氨基酸置换的非天然NAD+-依赖性醇脱氢酶(包括单一变体和组合变体)的工程细胞。所述细胞可用于提高目标产物或其中间体的生产。例如,该细胞可以提供用于增加目标产物或可以提供用于增加从甲醛和/或乙醛到目标产物的碳固定的还原当量(例如,NADH),或两者兼有。示例性产物包括:(a)1,4-丁二醇及其中间体,如4-羟基丁酸(4-hydroxybutanoicacid,4-羟基丁酸酯(4-hydroxybutanoate),4-羟基丁酸酯(4-hydroxybutyrate),4-HB),(b)丁二烯及其中间体,如1,4-丁二醇,1,3-丁二醇,巴豆醇,3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇,(c)1,3-丁二醇及其中间体,如2,4-戊二烯,巴豆醇或3-丁烯-1-醇,(d)己二酸酯,6-氨基己酸,己内酰胺,己撑二胺和乙酰丙酸及其中间体,例如4-氨基丁酰辅酶A,(e)甲基丙烯酸(2-甲基-2-丙烯酸)及其酯,统称为甲基丙烯酸酯,如甲基丙烯酸甲酯,甲基丙烯酸甲酯,3-羟基异丁酸酯和/或2-羟基异丁酸酯及其中间体,(f)1,2-丙二醇(丙二醇),正丙醇,1,3-丙二醇和甘油,及其中间体,和(g)琥珀酸及其中间体。可选地,工程细胞的实施例可以进一步包括一种或多种其它代谢途径的转基因,以进一步促进目标产物或其中间体的生产。在示例性实施例中,所述细胞还包括一个或多个甲醇代谢途径(MMP)的转基因,例如甲醛脱氢酶转基因,从而允许所编码的途径酶或辅助蛋白的表达。在示例性实施例中,所述细胞还包含含有用于生产目标产物的酶(及其编码多核苷酸)的产物途径,诸如本申请所述的用于从葡萄糖生产1,4-丁二醇的酶。其他实施例涉及包括工程细胞的组合物,如细胞培养物组合物,以及包括工程细胞所生产的一种或多种产物的组合物。例如,组合物可以包括细胞所生产的目标产物或其中间体,其中该组合物已经经过纯化以除去细胞或其他对细胞培养有用的组分。该组合物可以经过处理,以富集或纯化目标产物或其中间体。本公开的其它实施例,涉及从使用工程细胞的方法而得到的目标产物所制成的产品。示例性产品包括以目标产物制成的聚合物,例如从二醇目标产物与二酸相结合制成的聚合物,包括目标产物琥珀酸,例如,分别从1,4-丁二醇与对苯二甲酸或琥珀酸聚合而制成的聚对苯二甲酸丁二醇酯(PBT)和聚丁二酸丁二醇酯(PBS)。本公开的其它实施例,涉及编码具有一种或多种变体氨基酸的非天然醇脱氢酶的核酸,以及包含核酸的表达构建体,和含有该核酸或表达构建体的工程细胞。在其它实施例中,本公开还提供了用于生产与其未修饰(原始;模板)对应物相比能够将甲醇或乙醇向甲醛或乙醛的分别转化提高到至少2倍的非天然NAD+-依赖性醇脱氢酶的方法。在一些实施例中,该方法包括以下步骤:(a)在模板序列中识别提供转化提高的变体氨基酸,(b)在与该模板序列具有一致性的目标序列中,识别对应的氨基酸位置,以及(c)将目标序列的对应氨基酸位置上的氨基酸改变为变体氨基酸。本申请描述的用于加入修饰的起始模板,可以是天然存在的酶序列或已经过工程改造的酶序列。在其他实施例中,该方法包括以下步骤:(a)识别非天然的NAD+-依赖性醇脱氢酶中的非变体位置的氨基酸位置,(b)在原始模板中,提供非变体位置的氨基酸位置上的变异,和(c)从步骤(b)中识别提供了底物转化提高的变体。附图说明图1A-D是列举了甲醇脱氢酶(2315A)的氨基酸位置和所述位置的置换对酶活性的作用的曲线图。图2所示为在生物体如大肠杆菌中使用MDH以产生1,4-丁二醇(BDO)的途径。图3A-D所示为使用某些甲醇代谢酶的途径。图3D所示为使用酶经由甲醛同化途径将碳从甲醇固定到感兴趣的产物途径。如本申请中描述的,“产物途径”可以是1,4-丁二醇产物途径或其它产物途径。图4是各种铁依赖性醇脱氢酶与芽孢杆菌MeDH的氨基酸序列比对。具体实施方式本申请中所述的实施例并不意在将本公开内容尽数穷举,或限制为以下详细描述中所公开的精确形式。相反,对实施例进行了选择和描述,以便本领域技术人员可以理解和明白本说明书中的原理和实践。本申请提及的所有出版物和专利在此通过引用方式并入本申请。本申请所公开的出版物和专利仅用于公开。本申请中的内容均不可解释为承认发明人没有先于任一出版物和/或专利的资格,包括本申请引用的任何出版物和/或专利。一般地,本公开提供了一种非天然NAD+-依赖性醇脱氢酶(ADHs),与其未修饰对应物相比,其能够将甲醇或乙醇向甲醛或乙醛的转化提高到至少两倍。还描述了编码该非天然醇脱氢酶的核酸,以及包括该核酸的表达构建体,和包含所述核酸或表达构建体的工程细胞。还表述了表达非天然NAD+-依赖性醇脱氢酶的工程细胞,可选地包括一种或多种额外的代谢途径转基因、甲醇代谢途径基因和/或目标产物途径基因;包括所述细胞的细胞培养物组合物;用于提高所述目标产物或其中间体从细胞的生产的方法;包括所述目标产物或其中间体的组合物;和从所述目标产物或其中间体制得的产物。术语“非天然存在的”用于生物体(例如,微生物)时,是指该生物体具有至少一个通常不存在于所称物种的天然存在生物体中的基因改变。天然存在的生物体可以称为“野生型”,例如所称物种的野生型菌株。同样地,“非天然的”多肽或核酸,可以包括至少一个通常不会存在于天然存在的多肽或核酸中的基因改变。天然存在的生物体、核酸和多肽可以称为“野生型”或“原始的”,例如所称物种的野生型菌株。同样地,相对于任何氨基酸位置,存在于野生型生物体中的氨基酸可以称为“原始的”。使生物体变得非天然的基因改变,可以包括,例如,引入编码代谢多肽的可表达核酸的修饰,其它核酸添加,核酸删除和/或对生物体遗传物质的其它功能破坏。这样的修饰包括,例如,所称物种的异源、同源或异源和同源多肽的编码区及其功能片段。其他的修饰包括,例如,非编码调节区,其中所述修饰改变了基因或操纵子的表达。来自甲醇芽孢杆菌(Bacillusmethanolicus)MGA3的NAD(P)+-依赖性甲醇脱氢酶(Genbank检索号EIJ77596.1,GI号:387585261;本申请中命名为MDH2315,长度为382个氨基酸;SEQIDNO:1),被选定作为诱变模板,以识别改善活性的变体。选择该序列,是因为令人惊奇地发现它对甲醇很活跃,活性通常为其他受试醇脱氢酶的近两倍,并使用了NAD+,从而能够再生可用于目标途径的酶的NADH。MDH2315在文献中报道为来自甲醇芽孢杆菌MGA3的NAD(P)依赖性甲醇脱氢酶,且其序列记载于Brautaset等人的“Plasmid-DependentMethylotrophyinThermotolerantBacillusmethnolicus”,JournalofBacteriology,vol.186,pp1229-1238(2004)。它还在Brautaset的WO2013/110797中称为MDHMGA3,并在Krog等人的“MethylotrophicBacillusmethanolicusEncodesTwoChromosomalandOnePlasmidBornNAD+DependentMathanolDehydrogenaseParalogswithDifferentCatalyticandBiochemicalProperties”,PLOSONE,pp.1-11,(2013)中称为MDH“M”,其中报道了其他的野生型芽孢杆菌MDHs。在大肠杆菌中表达MDH2315A,并通过致错PCR(epPCR文库)产生变体文库。具体地,在大肠杆菌中表达MDH2315A,并在382个位置中的375个上进行饱和诱变,以产生20个常见氨基酸的全部单点置换的文库(NNK文库)。在初级筛选中,通过分析用于MeOH到Fald的转化的个体菌落细胞提取物,来筛选NNK文库。在该文库中筛选了活性高于野生型的2倍的变体(定义为阳性)。所述文库可以包含具有多个突变、缺失等的变体。但是,识别了具有单点置换的变体。在该初级筛选中,约150个位置产生了提取物活性稳定地高于野生型活性的2倍的菌落。其中,21个位置产生了提取物活性稳定地高于野生型活性的4倍的菌落。该NNK文库的初级筛选中,识别了约10个位置,其中90%或更多的菌落无活性,这暗示着在这些位置上存在的野生型以外的任何氨基酸都会导致酶失活(或快速降解)。识别出大约30个位置,其中小于5%的菌落无活性。还识别出许多位置,其中没有观察到阳性,但非活性的总数小于90%。还识别出许多位置,其中阳性和非活性的总数为小于95%。对于高于4倍活性的所有阳性和高于2倍活性的许多阳性进行次级体外三联测定和测序。根据测定,在40个位置上,共计90个置换,可造成所述高于2倍活性的增加,或在许多情况下,高于4倍,且多至10倍。在许多位置上,仅单一特定氨基酸产生了提高,在其它位置上,数个氨基酸置换产生了提高(例如,在213上仅为N213D,但在121上则是G121D和G121V,等等)。在epPCR文库的次级筛选中,揭示了约20个位置上的置换产生了高于野生型的3倍的活性。这些菌落的测序揭示,在每个位置上的特定置换,例如,N213D(命名法:N是213位置上的原始或未经修饰的氨基酸;D是置换物)。在这些20个位置上,共计有30个置换提供了高于野生型的3倍的活性,其中约15个变体提供了高于4倍的活性。对于部分已识别了MDH变体序列的菌落,在使使用甲醛的基因失活从而允许甲醛积累的菌株环境中,通过测量MeOH向甲醛的转化而进行了体内测定。总体而言,在体外筛选中呈阳性(高于野生型)的所有MDH变体,在体内的活性也高于野生型,虽然体外和体内的活性并不总是具有精确的相关性。在某些位置上,文库中该位置上的特定置换在总菌落种群中的频率为零或小于统计学预期。因此,某些位置上的一些置换可能是不存在或是存而没有检测到的。表1列出了相对于SEQIDNO:1的氨基酸突变,作为单一突变存在时提供了高于两倍的活性。虽然不被理论所限,但如在图1所示,命名为2315A的甲醇脱氢酶氨基酸位置和在其他此述的甲醇脱氢酶中的对应位置相关联的功能特性包括:与NADH辅助因子结合相关联的位置38D,39A,40F,70D,97G,98S,137T,138T,141T,142G,143S,145T,146T,147S,148L,149A,150V,161P,162V,163I;与激活位点相关联的位置95G,97G,98S;与底物相关联的位置145T,146T,147S,148L,149A,150V,161P,计162v,163I,253F,258L,266H,359D,360V,361C。如展示位点饱和诱变的图1所示,命名为2315A的甲醇脱氢酶中,有众多氨基酸位置可容忍置换(从高于2倍野生型酶活性(称为“命中”)的菌落百分比或具有野生型酶的0.2至小于2倍的活性的菌落百分比可以看出),而其他位置的容忍性则较低(从小于野生型酶20%活性的菌落百分比可以看出(称为“死亡”))。例如,168T和270G对变化非常容忍,其中,168T处的置换通常对活性几乎没有影响,而在270G处的置换主要会提高活性。可以使用本领域公知的方法来测试醇脱氢酶的酶活性,并且所述方法可用于测试醇脱氢酶(ADH)变体酶的活性。一般而言,包括醇脱氢酶(ADH)变体,醇(底物)和NAD(辅助因子)的反应组合物可以转化为脱氢产物。例如,乙醇的转化如下所示:反应可以在所需的温度(如25℃)和pH值(如pH7)下进行。ADH变体可以通过在pH8.8和25℃下每分钟将1.0μmol醇转化为脱氢产物的1单位酶的酶活性来定义。参见,例如,Kagi,J.H.R.andVallee,B.L.(1960)JournalofBiologicalChemistry235,3188-3192。这里特别感兴趣的是甲醇转化为甲醛以再生NADH。这种转化可以接着是转化为甲酸盐,或甲醛的碳固定到目标产物中,或两者皆有。甲酸盐可以转化为CO2,或其碳固定到目标产物中(例如通过转化回甲醛),或两者皆有。参见附图。开发了代表性体内测定,以测定生物体内的甲醇脱氢酶变体的活性,如美国申请序列号13/975678所报道。该测定基于对甲醛(Palp)的检测,从而测定酶的正向活性(甲醇氧化)。为此,使用LambaRed重组酶技术(DatsenkoandWanner,Proc.Natl.Acad.Sci.USA,697(12):6640-5(2000)),建立了包括BDOP并缺乏frmA,frmB,frmR的菌株。将表达甲醇脱氢酶的质粒转化到菌株中,然后在LB培养基+抗生素中37℃振荡培养至饱和。用空载体转化的菌株作为阴性对照。以O.D.调整培养物,然后用M9培养基+0.5%葡萄糖+抗生素以1:10稀释,并在37℃下振荡培养6-8小时直至对数期后期。添加甲醇至2%v/v,然后将培养物再在37℃振荡培养30分钟。培养物离心沉淀,取上清液,使用DETECTX甲醛检测试剂盒,根据厂商说明分析产生的甲醛(ArborAssays;AnnArbor,MI)。frmA,frmB,frmR缺失导致了天然甲醛利用途径的缺失,从而能够生成甲醛,以用于检测在生物体中的甲醇脱氢酶的活性。这些基因在这种情况下的删除,仅是为了通过防止被测分析物甲醛的损失,来协助对甲醇转化的测量。对10个单点变体进行了酶动力学分析,活性增加至2-10倍反映为Km或Vmax增加至2-10倍或两者兼有。没有测量辅助因子结合,或底物或产物的结合-解离速率。表7显示了来自各种野生型ADH蛋白质的酶学数据。表8和9所示为野生型和变体酶的数据,其中表8所示为使用甲醇或1,4-丁二醇的活性,且表9所示为野生型和变体甲醇脱氢酶的1,4-丁二醇依赖性稳态动力学参数。阳性(“阳性”是指如本申请所述的,与未修饰的模板序列相比,活性至少提高至两(2)倍的修饰序列)的诱变程序和原理设计和筛选的结果,揭示了本发明中所用的沿MDH蛋白2315A模板的若干氨基酸变体。表现出高于两倍活性的阳性如表1所示,并列举如下:S11T,D38N,H42Q,E48D,N53I,E56K,D60E,V61A,I63F,P65Q,D70N,P71I,P71T,P71V,T74S,D81G,K84R,E86K,N87K,I94V,S99P,S99T,A103V,I106L,G107S,L108V,L108W,V109Y,N112K,N112R,R115H,I116F,N117D,N117Q,N117Y,Q120H,Q120R,G121A,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122A,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,S124R,V125C,V125G,V125W,E126G,E126V,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T145M,T146N,S147R,L148A,L148F,L148G,L148I,L148T,L148V,L148W,A149L,A149M,A149T,A149V,V150A,V150I,T152M,A155V,K157N,V158E,V158H,V158K,V158W,P161A,P161G,P161Q,P161S,P161V,I163F,I163N,I163Q,I163T,D164G,D164N,E165G,K181R,A184T,L186M,T190A,T190S,I199V,Q217K,L226M,G256C,Q267H,G269S,G270M,G270S,G270Y,T296S,R298H,A300T,I302V,G312V,A316V,I323M,F333L,P336L,S337C,G343D,V344A,V344G,K345E,E350K,K354M,N355D,N355I,N355K,E358G,V360A,V360G,V360K,V360R,V360S,C361N,C361R,Q363K,和K379M。这些变化,其在SEQIDNO:1中的的位置,及其在其它模板序列上的对应位置,进一步描述在本申请的表格和其他地方。更感兴趣的是,如表1中所示的作为单点突变的、表现出高于两倍活性的阳性,并列出如下:D38N,D60E,P71I,P71V,N87K,S99T,A103V,G107S,L108V,L108W,V109Y,R115H,I116F,N117D,N117Q,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,V125C,V125G,V125W,E126G,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T146N,A149L,A149M,A149T,A149V,V150A,K157N,V158E,V158H,V158K,V158W,I163Q,D164N,Q267H,G270M,G270S,G270Y,K345E,N355D,V360G,V360K,V360R,V360S,C361R。这些变化,其在SEQIDNO:1中的的位置,及其在其它模板序列上的对应位置,进一步描述在本申请的表格和其他地方。本申请所述的原理设计的诱变程序和其它文库生成过程及阳性筛选的结果,揭示了沿MDH蛋白2315A模板的若干氨基酸变体组合。表2现出高于两倍活性的阳性如表2-4所示,并在如下的集合中作为变异列出:(a)D70N,L148G,P161G,V360A;(b)D70N,L148G,V360A,C361N;(c)D70N,L148V,V150I,P161A,V360G;(d)D70N,L148V,V360G;(e)D70N,P161A,V360A;(f)D70N,P161V,V360G,C361N;(g)D70N,V150I,P161A,V360A;(h)D70N,V150I,P161V,V360G,C361N;(i)E48D,L148V,P161A,V360A;(j)L148G,P161A,V360A,C361N;(k)L148G,P161A,V360G;(l)L148G,P161A,V360G,C361N;(m)L148G,P161G,V360A;(n)L148G,P161G,V360G,C361N;(o)L148G,V360A,C361N;(p)L148G,V360G,C361N;(q)L148I,P161G,V360G;(r)L148I,P161V,V360G;(s)L148T,V150I,V360A;(t)L148T,V360G;(u)L148V,P161A,V360A;(v)L148V,V150I,P161A,V360A;(w)L148V,V150I,P161A,V360A,C361N;(x)L148V,V150I,P161A,V360G;(y)L148V,V150I,P161A,V360G,C361N;(z)L148V,V150I,P161A,V360G,C361N;(aa)L148V,V150I,P161G,V360A;(ab)L148V,V150I,P161V,V360G,C361N;(ac)L148W,P161A,V360A,C361N;(ad)N112K,S147R,P161A,V360A;(ae)P161A,Q217K,V360A,C361N;(af)P161A,V360A,C361N;(ag)P161A,V360G;(ah)P161V,E358G,V360G;(ai)P161V,V360A,C361N;(aj)L148W,P161A,V360A,C361N;(ak)N112K,S147R,P161A,V360A;(al)P161A,Q217K,V360A,C361N;(am)P161A,V360A,C361N;(an)P161A,V360G;(ao)P161V,E358G,V360G;(ap)P161V,V360A,C361N;(aq)P161V,V360G;(ar)P65Q,L148G,V150I,P161A,V360G,C361N;(as)S147R,L148A,V150I,P161A,V360G;(at)S147R,L148F,V150I,P161G,V360G;(au)S147R,L148V,P161G,V360A;(av)P161V,V360G;(aw)P65Q,L148G,V150I,P161A,V360G,C361N;(ax)S147R,L148A,V150I,P161A,V360G;(ay)S147R,L148F,V150I,P161G,V360G;(az)S147R,L148V,P161G,V360A;(aaa)S147R,L148V,P161V,V360G;(aab)S147R,L148V,V150I,P161A,C361N;(aac)S147R,L148V,V150I,P161G,V360G;(aad)S147R,P161A,V360A;(aae)S147R,P161A,V360A,C361N;(aaf)S147R,P161A,V360G;(aag)S147R,P161V,V360G;(aah)S147R,P161V,V360G,C361N;(aai)S147R,V150I,P161V,V360A;(aaj)S147R,V150I,V360A,C361N;(aak)T145M,L148I,V360G;(aal)V150I,I302V,V360G,C361N;(aam)V150I,P161A,C361N;(aan)V150I,P161G,V360A,C361N;(aao)V150I,P161G,V360G;(aap)V150I,P161G,V360G,C361N;(aaq)V150I,P161V,C361N;(aar)V150I,P161V,K354R,V360A,C361N;(aas)V150I,P161V,V360A,C361N;(aat)V150I,P161V,V360G,C361N;(aau)V150I,V360A,C361N;(aav)V150I,V360G;(aaw)S11T,T74S,G269S,V344A;(aax)K84R,I163T;(aay)V122A,I163N;(aaz)G107S,F333L;(aaaa)V129M,T152M,G343D;(aaab)I63F,N355K;(aaac)G107S,F333L;(aaad)E86K,S99T,A149V;(aaae)N53I,V158E;(aaaf)N355I,K379M;(aaag)H42Q,G107S;(aaah)Q120H,I163N;(aaai)A149V,I323M;(aaaj)G107S,F333L;(aaak)D164G,K181R;(aaal)A155V,R298H,N355D;(aaam)N123D,E165G;(aaan)I163F,L186M;(aaao)G121A,T296S;(aaap)I94V,S99P,N123I;(aaaq)E126V,V129M,V344G;(aaar)Q120R,S143T;(aaas)G256C,A316V;(aaat)P161Q,G312V;(aaau)L226M,A300T,V360A;(aaav)S337C,E350K,N355D,Q363K;(aaaw)D81G,V158E;(aaax)I106L,N117Y,E126V;(aaay)G107S,G121D;(aaaz)V61A,V158E;(aaaaa)N53I,V158E;(aaaab)N117Y,T190S;(aaaac)S124R,I199V;(aaaad)K354M,C361R;(aaaae)A184T,C361R;(aaaag)E56K,Q267H;(aaaag)S124R,E126G;(aaaah)T190A,N355K;(aaaai)P71T,F333L;(aaaaj)G107S,F333L;和(aaaak)N123I,P336L,(aaaal)D38D/A149V,(aaaam)D38N/V163V,(aaaan)D73D/L108V,(aaaao)G121R/P161S,和(aaaap)N112R/P161S。还识别了SEQIDNO:1中通常不容忍置换的位置,包括P8,V132,E177,A207,T208,Q246,I264,P285,E308,Y339,A340,A353,T362,R367,P369,D373,和I377;其中,特别感兴趣的是SEQIDNO:1中的这些位置上的原始氨基酸,及其在如本申请所述的其他模板中对应的位置。还鉴定了SEQIDNO:1中通常非常容忍置换的位置,包括SEQIDNO:1中的E56,E78,E86,T2,N4,E237,E240,E327,E341,E347,P9,V18,R24,T44,L46,K52,D60,A62,F64,A67,P71,A72,D73,T74,V80,K84,Q85,I106,V109,R115,I116,N117,V122,K127,I135,T136,S154,A155,R156,P161,V162,I163,P169,T170,V171,V174,L178,M179,A184,G185,L186,A189,T190,A194,A198,Y202,V203,T211,F214,I216,Q217,K220,L221,N223,Y225,A229,Y244,A245,M248,A252,N254,H266,G270,Y272,I278,M284,H286,V287,N291,I293,A294,R298,H301,I302,L305,N309,A311,G312,T315,A317,R321,V324,I329,S332,S337,M342,K345,K354,N355,A356,Y357,T370,A375,和I378,及其在其它模板上的对应位置;其中,据观察,在这些位置上,通常所有的氨基酸,除了偶尔的1或2个之外,其对活性均为中性、有益、或活性降低小于80%。其中,D60,I378,L46,A62,A67,N117,K52,I135,Y202,I216,M248,N291,M342,T2,E240,T44,I116,V203,S332,及其在其它模板上的对应位置,容忍所有变化。还感兴趣的用于提高活性的置换的位置包括23T,81D,141T,174V,189A,332S,372Q和379K,及其在其他模板中的对应位置。本公开的实施例还涉及其他醇脱氢酶(ADH)变体酶的制备和使用,包括甲醇脱氢酶的变体酶,基于在MDH蛋白2315A模板中和相对于MDH蛋白2315A模板所识别的单氨基酸变体和组合氨基酸变体。在这些实施例中,可以基于提供提高的活性的所述MDH2315A变体的信息,生成与其原始未修饰的对应物相比,能够获得具有甲醇或乙醇向甲醛或乙醛的分别转化至少提高至两倍的非天然NAD+-依赖性醇脱氢酶(非2315A)。在一些实施例中,用于制备其他ADH变体的方法,包括(a)识别当存在于2315A模板序列中时提供提高的转化的变体氨基酸,(b)在与模板序列具有一致性的目标序列(即其他ADH或MDH序列)中,识别对应的氨基酸位置,以及(c)在所述目标序列的对应氨基酸位置上,将氨基酸改变为变体氨基酸。例如,在2315A的位置38上,当D被N置换时,相比于未修饰2315A序列,提供的活性高于原活性的2倍。在新的目标ADH或MDH模板序列中,鉴定了D38所对应的位置,例如,其适当地可以是D38或D39,并被N置换,以产生新的非天然存在的ADH或MDH。在某些情况下,首先识别出来自甲醇芽孢杆菌MGA3的NAD(P)依赖性物醇脱氢酶(2315A)(SEQIDNO:1)的“直系同源物(ortholog)”。直系同源物是指通过直系世代相关的一个或多个基因,其形成了不同生物体中基本相同或完全相同的功能。例如,若基因共有的序列相似性足以表明其同源,或者通过从共同的祖先进化而来,则该基因通过直系世代相关。若基因共有的是三维结构而非一定是序列相似性,且足以表明其从一级序列相似性无法识别的共同祖先发展而来,则该基因也可以视为直系同源。直系同源的基因,可以编码具有约45%至100%氨基酸序列一致性的序列相似性蛋白质,并且更优选地,约60%至100%的氨基酸序列一致性。与来自甲醇芽孢杆菌MGA3的NAD(P)依赖性甲醇脱氢酶(2315A)共有符合期望的一致性(例如,45%,50%,55%,或60%或更高)的基因,包括直系同源物和旁系同源物,可以通过本领域技术人员公知的方法来测定。例如,对于两个多肽的核酸或氨基酸序列的检查,将揭示对比序列之间的序列一致性和相似性。基于这样的相似性,本领域的技术人员可确定该相似性是否足够高到可以表明这些蛋白质通过从共同祖先进化得到而相关。序列比对和生成序列一致性的计算方法,包括全局比对和局部比对。全局比对使用全局优化来迫使比对范围跨越所有查询序列的整个长度。与此相反,局部比对则是识别往往整体大相径庭的长序列中的相似性区域。为了理解目标序列与甲醇芽孢杆菌MGA3(2315A)模板的一致性,可以使用全局比对。可选地,为了全局比对和生成识别得分,可以排除与模板序列共有很小或没有一致性的目标序列的氨基末端和/或羧基末端序列。本领域技术人员公知的算法,诸如Align,BLAST,ClustalW等,比较并确定原始序列相似性或一致性,且还确定序列中的空位的存在或显著性,并可对其分配权重或分数。这种算法也是本领域已知的,并且同样适用于确定核苷酸序列相似性或一致性。基于众所周知的用于计算统计相似性或在随机多肽中找到相似匹配的几率和所测定的匹配的显著性的方法,计算用于确定相关性的足够相似参数。根据需要,对两个或更多个序列的电脑比较,还可以由本领域技术人员进行视觉优化。可以期望,相关基因产物或蛋白质具有高相似性,例如,45%至100%的序列一致性。无相关性的蛋白质的一致性可以与在扫描了足够大的数据库的情况下偶然发生的预期结果基本相同(5%左右)。对使用SEQIDNO.1(2315A)作为参照的每个模板多肽,进行成对全局序列比对。使用Needleman-Wunsch算法(Needleman,S.&Wunsch,C.AgeneralmethodapplicabletothesearchforsimilaritiesintheaminoacidsequenceoftwoproteinsJ.Mol.Biol,1970,48,443-453),通过BALIGN工具(http://balign.sourceforge.net/),实现所述比对。在比对中,使用了默认参数,且使用了BLOSUM62作为评分矩阵。表10提供了目标多肽的细节和与SEQIDNO.1(2315A)的比对。这些序列代表了可以基于表现出转化增加的甲醇芽孢杆菌MGA3(2315A)变体中的变体氨基酸进行一个或多个氨基酸变异的目标序列。例如,一般而言,这一过程可以涉及模板2315A序列与目标序列(如表10中所列举的任一序列)的比对步骤。接下来,在模板2315A序列中识别提供甲醇或乙醇转化增加的氨基酸置换/变体(或一组置换)的位置。检查置换/变体位置处的氨基酸比对,以确定与模板2315A序列中氨基酸位置对应的目标序列中的氨基酸位置。用基于2315A变体的氨基酸变体置换的优选目标序列被突出显示。在某些情况下,原始氨基酸及其在模板2315A序列上的位置,将精确地与目标上的原始氨基酸和位置相关联。在其他情况下,原始氨基酸及其在模板2315A序列上的位置,将与原始氨基酸相关,但其在目标上的位置不会是对应的模板位置。然而,在目标上的对应氨基酸可以是与模板位置具有预定距离,例如在距离模板位置有10个,9个,8个,7个,6个,5个,4个,3个,2个,或1个氨基酸位置。在其他情况下,模板2315A序列上的原始氨基酸将不会精确地与目标上的原始氨基酸相关。然而可以理解,目标序列中的对应氨基酸是根据模板上的氨基酸的大致位置和目标氨基酸附近的氨基酸序列。例如,目标氨基酸附近的氨基酸可以看作是模板和目标序列之间的具有一定量的一致性或相似性的“序列基序”。在某些情况下,使用基本局部比对搜索工具(BasicLocalAlignmentSearchTool,BLAST)算法来理解模板序列和目标序列之间的氨基酸基序的序列一致性,是有用的。因此,在实践的优选模式中,BLAST被用于识别或理解模板和目标蛋白之间的较短氨基酸段(例如,序列基序)的一致性。BLAST通过定位两个序列之间的短匹配,使用近似Smith-Waterman算法的启发式方法,从而发现相似序列。所述(BLAST)算法可以识别与查询序列的相似度高于某个阈值的文库序列。使用BLAST算法来确定两个或更多个序列的关联性的示例性参数,例如,可以是如下所述。简要地说,氨基酸序列比对可使用BLASTP版本2.0.8(1999年1月5日)和下列参数来执行:Matrix:0BLOSUM62;gapopen:11;gapextension:1;x_dropoff:50;expect:10.0;wordsize:3;filter:on。核酸序列比对可使用BLASTN版本2.0.6(1998年9月16日)和下列参数执行:Match:1;mismatch:-2;gapopen:5;gapextension:2;x_dropoff:50;expect:10.0;wordsize:11;filter:off。本领域的技术人员将知道,可对上述参数进行改进,例如,以增加减少所述比较的严格性,并确定两个或更多个序列的相关性。鉴于并遵照本申请的教导,使用本领域已知的方法如序列比对和3D建模,可以容易地确定用于除SEQIDNO:1以外的模板多肽置换的“对应的位置和氨基酸”用于每个模板置换的对应位置。表11中对每个模板指明了提高多肽活性的置换对应位置,其中,具体构思了各原始氨基酸、其位置和置换,如同在此明确列出。例如,使用来自甲醇芽孢杆菌MGA3的EIJ83020.1,GI:387590701(SEQIDNO:7)的385氨基酸的模板多肽,其具有与SEQIDNO:1的61%全局一致性和79%相似性,式R1XR2可以直接并毫无意义地推出,显而易见,并构思得到(如同在此明确列出),从其容易设想R1XR2的位置:D41,E63,P74,N91,S102,G106,A110,L111,V112,K118,I119,H120,G124,V125,D126,V127,S128,K129,E130,P131,M132,V134,S146,T149,T152,I153,K160,V161,V166,D167,Q270,G273,K348,N358,A363,C364。这可从以下对每个用于置换的氨基酸的氨基酸位置(对应于SEQIDNO:1中的所述位置,并接受对应置换)中容易地推导出。上述方法适用于为本申请中每个模板多肽以及与其具有一致性的多肽获得一个式R1XR2结果。在另一个实施例中,来自387氨基酸模板多肽YP_002138168.1GI:197117741(SEQIDNO:17)中且与SEQIDNO:1具有52%全局一致性和71%相似性的用于R1XR2置换的氨基酸及位置,有:D43,S65,P76,G92,S104,A108,G112,M113,V114,H120,I121,R122,G126,V127,N128,K129,T130,T131,K132,P133,M134,P135,S148,T151,C154,I155,H162,V163,V168,D169,Q272,G275,K350,N360,A365,C366。以下内容从本申请的表格中容易地推导得出,表明了所述位置。表11提供了目标多肽的氨基酸序列,其中对用于与甲醇芽孢杆菌MGA3(2315A)变体中产生的变体氨基酸置换的目标氨基酸下划线标注。应了解,目标序列中的氨基酸替换(与来自2315A变体的对应位置的变体氨基酸)时,被置换的目标序列可以被看作是“模板序列”,在一些实施例中,可以用于进一步筛选用于置换的多肽序列。表11还展示了与SEQIDNO:1的序列一致性为60%或更好的模板,其中用下划线指示置换位置。非下划线位置则不需要置换,并且在实施例中保持不变(其在所有模板中相同)。所述位置可以通过至少在特定位置上的野生型替代物以及在用于置换为变体氨基酸位置的置换物的容忍位点中选择,从而容忍变化,定点诱变或序列改变(例如,位点特异性诱变或寡核苷酸定向诱变)可以用来对目标乙醇脱氢酶的DNA序列进行特异改变,以提供编码具有期望的氨基酸置换的醇脱氢酶的变体DNA序列。一般而言,使用具有提供编码变体氨基酸的密码子的序列的寡核苷酸。可选地,可以用作置换目标的优选醇脱氢酶的所述变体乙醇脱氢酶DNA序列的整个编码区的人工基因序列通常小于400个氨基酸长度。用诱变寡核苷酸来产生变体ADH序列的示例性技术,包括可利用置入噬菌粒中的ADH基因序列的Kunkel方法。大肠杆菌中的噬菌粒产生ADHssDNA,其是用于使用寡核苷酸进行诱变的模板,所述寡核苷酸在该模板上由引物延伸。根据ADHDNA中感兴趣位置两侧的限制酶位点,可以用盒式诱变来创建感兴趣的变体序列。对于盒式诱变,合成DNA片段,插入质粒,用限制性酶切割,并且随后连接到一对含有ADH变体突变的互补寡核苷酸中。所述质粒的限制性片段和寡核苷酸可以相互连接。可用于产生变体ADH序列的另一种技术是PCR定点诱变。使用诱变寡核苷酸引物来引入期望的突变,并提供携带突变序列的PCR片段。可以使用额外的寡核苷酸来扩展突变片段的末端,以提供适合用于限制性酶消化并插入基因中的限制性位点。用于定点诱变技术的市售试剂盒也是可以获得的。例如,QuikchangeTM试剂盒采用互补诱变引物,以使用高保真非链置换DNA聚合成酶(如pfu聚合成酶)对基因区域进行PCR扩增。该反应产生松弛的带切口的环状DNA。通过使用限制性酶(例如甲基化DNA特异性的DpnI)进行酶消化,去掉模板DNA。表达载体可被构造成包括一种或多种如本申请所示例的编码变体ADH并与宿主生物体中的功能性表达控制序列可操作地连接的核酸。适用于所提供的微生物宿主生物体中的表达载体包括,例如,质粒、噬菌体载体、病毒载体、附加体和人工染色体(包括可操作用于稳定整合到宿主染色体中的载体和选择序列或标记)。此外,表达载体可以包括一个或多个选择性标记基因和适当的表达控制序列。所包括的选择性标记基因还可以用于,例如,提供对抗生素或毒素的抗性,补充营养缺陷不足,或提供培养基中缺乏的关键营养物。表达控制序列可以包括本领域中公知的组成型和诱导型启动子,转录增强子,转录终止子等等。当要共表达两个或更多的外源编码核酸时,这两种核酸可以插入到,例如,单一表达载体或分开的表达载体中。对于单一载体表达,编码核酸可以可操作地连接到一个共同的表达控制序列,或连接于不同的表达控制序列,诸如一个诱导型启动子和一个组成型启动子。参与代谢或合成途径的外源核酸序列的转化,可以使用本领域中公知的方法来确认。所述方法包括,例如,核酸分析,如Northern印迹法或mRNA的聚合成酶链反应(PCR)扩增,或表达基因产物的免疫印迹,或其他合适的分析方法,来测试所引入核酸序列或其对应的基因产物的表达。本领域技术人员可以理解,该外源核酸的表达量足以产生期望的产物,且进一步理解的是,可以使用本领域中公知的方法和本申请所公开的方法优化该表达水平,以获得充分表达。术语“外源的”是指,所指的分子或所指的活性被引入到宿主微生物有机体中。该分子的引入可以是,例如,通过将编码核酸导入宿主遗传物质中,例如通过整合进宿主染色体中,或作为非染色体遗传物质,如质粒。因此,该术语在涉及编码核酸的表达时,将编码核酸的可表达形式引入微生物有机体中。当涉及生物合成活性时,该术语是指引入到宿主参照生物体中的活性。其来源可以是,例如,在导入宿主微生物有机体后表达所指的活性的同源或异源的编码核酸。因此,术语“内源性”指的是,存在于宿主中的所指的分子或活性。类似地,当用于提及编码核酸的表达时,该术语是指包含在微生物有机体中的编码核酸的表达。术语“异源的”是指来自除所指的物种以外来源的分子或活性,而“同源”是指来自宿主微生物有机体的分子或活性。对应地,编码核酸的外源表达可以利用异源或同源编码核酸中的任一种或两种。可以理解,当在微生物有机体中包括多个外源核酸时,所述多个外源核酸是指所指的编码核酸或生物合成活性,如上所论述。还应当理解,如本申请所公开的,多个外源核酸可以通过分开的核酸分子、多顺反子的核酸分子或其组合引入宿主微生物有机体中,而仍然看作是多个外源核酸。例如,如本申请所公开的微生物有机体可被工程化改造,以表达编码期望途径酶或蛋白质的两个或更多的外源核酸。在编码期望活性的两个外源核酸被引入宿主微生物有机体的情况下,可以理解,这两个外源核酸的引入可以作为单一核酸,例如通过单个质粒,通过分开的质粒,可以整合到宿主染色体中的单个或多个位点,而仍然被看作是两个外源核酸。类似地,可以理解,两个以上的外源核酸可以以任何期望组合引入到宿主生物体中,例如,通过单个质粒,通过分开的质粒,可以整合到宿主染色体中的单个或多个位点,而仍然被看作是两个或多个的外源核酸,例如三个外源性核酸。因此,所指的外源性核酸或生物合成活性的数量,是指编码核酸的数量或生物合成活性的数量,而不是引入到宿主生物体中的单独的核酸的数量。使用本领域公知的技术,包括但不限于,接合,电穿孔,化学转化,转导,转染,和超声波转化,可以将编码外源性变体ADH的核酸序列稳定或短暂地引入宿主细胞中。可选地,对于在大肠杆菌或其它原核细胞中的外源表达,真核核酸的基因或cDNA中的一些核酸序列可以编码靶向信号,例如N-末端线粒体或其他靶向信号,其可以根据需要,在转化进原核宿主细胞之前去除。例如,除去线粒体前导序列,使得在大肠杆菌中的表达增加(Hoffmeisteretal.,J.Biol.Chem.280:4329-4338(2005))。对于在酵母或其它真核细胞中的外源表达,基因可以在细胞溶质中表达而无需添加前导序列,或可以通过加入合适的靶向序列,诸如适于宿主细胞的线粒体靶向或分泌信号,从而靶向线粒体或其它细胞器,或靶向用于分泌。因此,可以理解,对核酸序列进行的删除或并入靶向序列的适当修饰,可以包含在外源核酸序列中,以赋予所需性质。此外,基因可以以在本领域中公知的技术进行密码子优化,以实现蛋白质的最佳表达。术语“微生物的”、“微生物有机体”或“微生物”,旨在表示作为古细菌、细菌或真核生物的领域中所包括的微观细胞存在的任何生物体。因此,该术语旨在包括具有微观尺寸的原核或真核细胞或生物体,并且包括细菌、古细菌和真细菌的所有物种以及真核微生物如酵母和真菌。该术语还包括可以培养用于生产生化产品的任何物种的细胞培养物。在用于提及微生物有机体时,“分离的”一词是指基本不含有所指微生物有机在自然界中存在时的至少一种组分的生物体。该术语包括,从其所存在的天然环境中的部分或所有组分中移出的微生物有机体。该术语还包括所述微生物有机体在非天然环境中存在时的部分或所有组分中移出的微生物有机体。在某些方面中,所述ADH变体基因引入受到基因破坏的细胞。术语“基因破坏”或其语法同义表达,是指使得所编码基因产物失活或减弱的基因改变。该基因改变可以是,例如,全基因的删除,转录或翻译所需的调控序列的删除,产生截短基因产物的基因部分的删除,或者使得编码基因产物失活或减弱的各种突变策略中的任一种。基因破坏的一种特别有用的方法是全基因删除,因为其降低或消除了基因回复的发生。基因破坏的表型效果可以是无效突变,这可以由许多类型的突变引起,包括令点突变失活、全基因删除和染色体片段或全染色体删除。特异性反义核酸化合物和酶抑制剂,如抗生素,也可以产生无效突变的表型,因此等效于基因破坏。代谢修饰是指从天然存在状态发生改变的生化反应。因此,微生物可以在编码代谢多肽或其功能片段的核酸上具有基因修饰。本申请公开了示例性的代谢修饰。本申请所提供的微生物可以含有稳定的基因改变,这指的是可培养超过五个世代而不丧失该改变的微生物。通常,稳定的基因改变包括持续超过10代的修饰,特别是持续超过约25代的稳定修饰,更具体地,持续超过50代的稳定基因修饰,包括无限期。本领域的技术人员将理解,对基因改变,包括本申请举例说明的代谢修饰的描述,均是对于合适的宿主生物体(诸如大肠杆菌)及其相应代谢反应,或对于所需遗传物质(如基因所需的代谢途径)的合适来源生物体。但是,鉴于各种生物体的完整基因组测序和基因组学领域中的高技术水平,本领域的技术人员将能够容易地将本申请所提供的教导和指导应用于基本上所有其他生物体。例如,本申请例举的大肠杆菌代谢改变,可以容易地通过结合来自所述物种以外的其他物种的相同或类似的编码核酸,来应用于其它物种。这种基因改变通常包括,例如,物种同源物的基因改变,并且具体地包括直系同源物,旁系同源物或非直系基因置换。各种微生物可以适合于结合所述变体ADH,可选地,连同一种或多种其他转基因。此类生物包括原核和真核生物,包括但不限于,细菌,包括古细菌和真细菌;和真核生物,包括酵母,植物,昆虫,动物和哺乳动物(包括人类)。示例性的物种如美国申请序列号13/975678(提交于2013年8月26日)中所述,其通过援引并入本申请,包括,例如,大肠杆菌(Escherichiacoli),酿酒酵母(Saccharomycescerevisiae),克氏酵母(Saccharomyceskluyveri),博伊丁氏假丝酵母(Candidaboidinii),克氏梭菌(Clostridiumkluyveri),丙酮丁醇梭菌(Clostridiumacetobutylicum),拜氏梭菌(Clostridiumbeijerinckii),Clostridiumsaccharoperbutylacetonicum,产气荚膜梭菌(Clostridiumperfringens),艰难梭菌(Clostridiumdifficile),肉毒梭菌(Clostridiumbotulinum),酪丁酸梭菌(Clostridiumtyrobutyricum),Clostridiumtetanomorphum,破伤风梭菌(Clostridiumtetani),丙酸梭菌(Clostridiumpropionicum),氨基丁酸梭菌(Clostridiumaminobutyricum),近端梭菌(Clostridiumsubterminale),斯氏梭菌(Clostridiumsticklandii),真氧产碱杆菌(Ralstoniaeutropha),牛分枝杆菌(Mycobacteriumbovis),结核分枝杆菌(Mycobacteriumtuberculosis),牙龈卟啉单胞菌(Porphyromonasgingivalis),拟南芥(Arabidopsisthaliana),嗜热菌(Thermusthermophilus),假单胞菌属(Pseudomonasspecies)(包括绿脓杆菌(Pseudomonasaeruginosa),恶臭假单胞菌(Pseudomonasputida),施氏假单胞菌(Pseudomonasstutzeri),荧光假单胞菌(Pseudomonasfluorescens)),智人(Homosapiens),家兔(Oryctolaguscuniculus),Rhodobacterspaeroides,嗜热厌氧杆菌(Thermoanaerobacterbrockii),勤奋金属球菌(Metallosphaerasedula),肠膜明串珠菌(Leuconostocmesenteroides),嗜热光全绿丝菌(Chloroflexusaurantiacus),Roseiflexuscastenholzii,赤杆菌属(Erythrobacter),西蒙得木(Simmondsiachinensis),不动杆菌物种(Acinetobacterspecies)包括醋酸钙不动杆菌(Acinetobactercalcoaceticus)和(Acinetobacterbaylyi),牙龈卟啉单胞菌(Porphyromonasgingivalis),硫化叶菌(Sulfolobustokodaii),硫矿硫化叶菌(Sulfolobussolfataricus),嗜酸热硫化叶菌(Sulfolobusacidocaldarius),枯草芽孢杆菌(Bacillussubtilis),蜡状芽孢杆菌(Bacilluscereus),巨大芽孢杆菌(Bacillusmegaterium),短芽孢杆菌(Bacillusbrevis),短小芽孢杆菌(Bacilluspumilus),褐家鼠(Rattusnorvegicus),克雷伯氏肺炎菌(Klebsiellapneumonia),产酸克雷伯菌(Klebsiellaoxytoca),眼虫(Euglenagracilis),齿垢密螺旋体(Treponemadenticola),热醋穆尔氏菌(Moorellathermoacetica),海栖热袍菌(Thermotogamaritima),嗜盐杆菌(Halobacteriumsalinarum),嗜热脂肪地芽孢杆菌(Geobacillusstearothermophilus),嗜热泉生古细菌(Aeropyrumpernix),野猪(Susscrofa),秀丽隐杆线虫(Caenorhabditiselegans),谷氨酸棒状杆菌(Corynebacteriumglutamicum),发酵氨基酸球菌(Acidaminococcusfermentans),乳酸乳球菌(Lactococcuslactis),植物乳杆菌(Lactobacillusplantarum),嗜热链球菌(Streptococcusthermophilus),产气肠杆菌(Enterobacteraerogenes),念珠菌(Candida),土曲霉(Aspergillusterreus),戊糖片球菌(Pedicoccuspentosaceus),运动发酵单胞菌(Zymomonasmobilus),巴氏醋酸杆菌(Acetobacterpasteurianus),乳酸克鲁维酵母(Kluyveromyceslactis),巴氏真杆菌(Eubacteriumbarkeri),多毛拟杆菌(Bacteroidescapillosus),Anaerotruncuscolihominis,嗜热盐碱厌氧菌(Natranaerobiusthermophilusm),空肠弯曲菌(Campylobacterjejuni),流感嗜血杆菌(Haemophilusinfluenzae),粘质沙雷氏菌(Serratiamarcescens),柠檬酸杆菌(Citrobacteramalonaticus),黄色粘球菌(Myxococcusxanthus),具核梭杆菌(Fusobacteriumnuleatum),产黄青霉(Penicilliumchrysogenum),海洋伽马变形菌(marinegammaproteobacterium),丁酸生产菌(butyrate-producingbacterium),Nocardiaiowensis,皮诺卡氏菌(Nocardiafarcinica),灰色链霉菌(Streptomycesgriseus),粟酒裂殖酵母(Schizosaccharomycespombe),热葡糖苷酶芽胞杆菌(Geobacillusthermoglucosidasius),鼠伤寒沙门氏菌(Salmonellatyphimurium),霍乱弧菌(Vibriocholera),幽门螺杆菌(Heliobacterpylori),烟草(Nicotianatabacum),水稻(Oryzasativa),地中海富盐菌(Haloferaxmediterranei),根癌土壤杆菌(Agrobacteriumtumefaciens),反硝化无色杆菌(Achromobacterdenitrificans),具核梭杆菌(Fusobacteriumnucleatum),Streptomycesclavuligenus,鲍曼不动杆菌(Acinetobacterbaumanii),小家鼠(Musmusculus),克氏酵母(Lachanceakluyveri),阴道毛滴虫(Trichomonasvaginalis),布氏锥虫(Trypanosomabrucei),施氏假单胞菌(Pseudomonasstutzeri),大豆慢生根瘤菌(Bradyrhizobiumjaponicum),慢生根瘤菌洛蒂(Mesorhizobiumloti),家牛(Bostaurus),心叶烟(Nicotianaglutinosa),创伤弧菌(Vibriovulnificus),反刍月形单胞菌(Selenomonasruminantium),副溶血性弧菌(Vibrioparahaemolyticus),闪烁古生球菌(Archaeoglobusfulgidus),死海盐盒菌(Haloarculamarismortui),耐超高温热棒菌(Pyrobaculumaerophilum),耻垢分枝杆菌(Mycobacteriumsmegmatis)MC2155,鸟分枝杆菌类结核亚种(Mycobacteriumaviumsubsp.paratuberculosis)K-10,海洋分支杆菌(Mycobacteriummarinum)M,微变冢村氏菌(Tsukamurellapaurometabola)DSM20162,双色藻(Cyanobium)PCC7001,盘基网柄菌(Dictyosteliumdiscoideum)AX4,以及其他本申请公开的物种或可用作对应基因的源生物体的物种。在某些实施例中,合适的生物体包括鲍曼不动杆菌Naval-82(AcinetobacterbaumanniiNaval-82),不动杆菌属ADP1(Acinetobactersp.ADP1),不动杆菌M-1(Acinetobactersp.strainM-1),琥珀酸放线杆菌130Z(Actinobacillussuccinogenes130Z),酒色闪杆菌(Allochromatiumvinosum)DSM180,嗜甲基拟无枝酸菌(Amycolatopsismethanolica),拟南芥(Arabidopsisthaliana),极小阿托波氏菌DSM20469(AtopobiumparvulumDSM20469),棕色固氮菌DJ(AzotobactervinelandiiDJ),嗜碱芽孢杆菌ATCC27647(BacillusalcalophilusATCC27647),产氮芽孢杆菌LMG9581(BacillusazotoformansLMG9581),凝结芽孢杆菌36D1(Bacilluscoagulans36D1),巨大芽孢杆菌(Bacillusmegaterium),甲醇芽孢杆菌MGA3(BacillusmethanolicusMGA3),甲醇芽孢杆菌PB1(BacillusmethanolicusPB1),甲醇芽孢杆菌PB-1(BacillusmethanolicusPB-1),亚硒酸盐还原芽胞杆菌(Bacillusselenitireducens)MLS10,史密斯芽孢杆菌(Bacillussmithii),枯草芽孢杆菌(Bacillussubtilis),洋葱伯克霍尔德菌(Burkholderiacenocepacia),洋葱伯克霍尔德杆菌(Burkholderiacepacia),多噬伯克霍尔德氏菌(Burkholderiamultivorans),吡咯伯克氏菌(Burkholderiapyrrocinia),稳定伯克霍尔德菌(Burkholderiastabilis),泰国伯克霍尔德菌(Burkholderiathailandensis)E264,伯克氏菌目细菌(Burkholderialesbacterium)Joshi_001,丁酸生产菌L2-50(Butyrate-producingbacteriumL2-50),空肠弯曲菌(Campylobacterjejuni),白色念珠菌(Candidaalbicans),博伊丁氏假丝酵母(Candidaboidinii),Candidamethylica,Carboxydothermushydrogenoformans,CarboxydothermushydrogenoformansZ-2901,柄杆菌属AP07(Caulobactersp.AP07),聚集绿曲挠丝状菌(Chloroflexusaggregans)DSM9485,嗜热光合绿曲挠丝状菌(Chloroflexusaurantiacus)J-10-FL,弗氏柠檬酸杆菌(Citrobacterfreundii),克氏柠檬酸杆菌ATCCBAA-895(CitrobacterkoseriATCCBAA-895),杨氏柠檬酸杆菌(Citrobacteryoungae),梭菌(Clostridium),丙酮丁醇梭菌(Clostridiumacetobutylicum),丙酮丁醇梭菌ATCC824(ClostridiumacetobutylicumATCC824),尿酸梭菌(Clostridiumacidurici),氨基丁酸梭菌(Clostridiumaminobutyricum),ClostridiumasparagiformeDSM15981,拜氏梭菌(Clostridiumbeijerinckii),拜氏梭菌NCIMB8052(ClostridiumbeijerinckiiNCIMB8052),ClostridiumbolteaeATCCBAA-613,ClostridiumcarboxidivoransP7,嗜纤维杆菌743B(Clostridiumcellulovorans743B),艰难梭菌(Clostridiumdifficile),ClostridiumhiranonisDSM13275,ClostridiumhylemonaeDSM15053,克氏梭菌(Clostridiumkluyveri),克氏梭菌DSM555(ClostridiumkluyveriDSM555),杨氏梭菌(Clostridiumljungdahli),杨氏梭菌DSM13528(ClostridiumljungdahliiDSM13528),甲基戊糖梭菌(Clostridiummethylpentosum)DSM5476,巴氏梭菌(Clostridiumpasteurianum),巴氏梭菌DSM525(ClostridiumpasteurianumDSM525),产气荚膜梭菌(Clostridiumperfringens),产气荚膜梭菌ATCC13124(ClostridiumperfringensATCC13124),产气荚膜梭菌菌株13(Clostridiumperfringensstr.13),ClostridiumphytofermentansISDg,糖丁酸梭菌(Clostridiumsaccharobutylicum),Clostridiumsaccharoperbutylacetonicum,ClostridiumsaccharoperbutylacetonicumN1-4,破伤风梭菌(Clostridiumtetani),谷氨酸棒杆菌ATCC14067(CorynebacteriumglutamicumATCC14067),谷氨酸棒杆菌R(CorynebacteriumglutamicumR),棒状杆菌种U-96(Corynebacteriumsp.U-96),变异棒杆菌(Corynebacteriumvariabile),钩虫贪铜菌N-1(CupriavidusnecatorN-1),双色藻(Cyanobium)PCC7001,DesulfatibacillumalkenivoransAK-01,Desulfitobacteriumhafniense,金属还原脱亚硫酸菌(Desulfitobacteriummetallireducens)DSM15288,还原脱亚硫酸菌(Desulfotomaculumreducens)MI-1,非洲脱硫弧菌(Desulfovibrioafricanus)str.WalvisBay,食果糖脱硫弧菌(Desulfovibriofructosovorans)JJ,普通脱硫弧菌(Desulfovibriovulgaris)str.Hildenborough,Desulfovibriovulgarisstr.'MiyazakiF',盘基网柄菌(Dictyosteliumdiscoideum)AX4,大肠杆菌,大肠杆菌K-12,大肠杆菌K-12MG1655,霍氏真杆菌DSM3353(EubacteriumhalliiDSM3353),Flavobacteriumfrigoris,具核梭杆菌多形亚种(Fusobacteriumnucleatumsubsp.polymorphum)ATCC10953,地芽孢菌种Y4.1MC1(Geobacillussp.Y4.1MC1),热反硝化地芽孢杆菌(Geobacillusthemodenitrificans)NG80-2,GeobacterbemidjiensisBem,金属还原泥土杆菌(Geobactersulfurreducens),金属还原泥土杆菌(GeobactersulfurreducensPCA),嗜热脂肪土芽孢DSM2334(GeobacillusstearothermophilusDSM2334),流感嗜血杆菌(Haemophilusinfluenzae),幽门螺旋杆菌(Helicobacterpylori),智人(Homosapiens),嗜热产氢杆菌(Hydrogenobacterthermophilus),嗜热产氢杆菌TK-6(HydrogenobacterthermophilusTK-6),反硝化生丝微菌(Hyphomicrobiumdenitrificans)ATCC51888,查氏生丝微菌(Hyphomicrobiumzavarzinii),克雷伯氏肺炎菌(Klebsiellapneumoniae),克雷伯氏肺炎菌肺炎亚种MGH78578(Klebsiellapneumoniaesubsp.pneumoniaeMGH78578),短乳杆菌ATCC367(LactobacillusbrevisATCC367),肠膜明串珠菌(Leuconostocmesenteroides),梭形芽孢杆菌(LysinibacillusFusiformis),球形赖氨酸芽孢杆菌(Lysinibacillussphaericus),百脉根中生根瘤菌MAFF303099(MesorhizobiumlotiMAFF303099),勤奋金属球菌(Metallosphaerasedula),乙酸甲烷八叠球菌(Methanosarcinaacetivorans),乙酸甲烷八叠球菌C2A(MethanosarcinaacetivoransC2A),巴氏甲烷八叠球菌(Methanosarcinabarkeri),马氏甲烷八叠球菌Tuc01(MethanosarcinamazeiTuc01),马里努斯甲基杆菌(Methylobactermarinus),扭脱甲基杆菌(Methylobacteriumextorquens),扭脱甲基杆菌AM1(MethylobacteriumextorquensAM1),荚膜甲基球菌(Methylococcuscapsulatus),Methylomonasaminofaciens,热醋穆尔氏菌(Moorellathermoacetica),分支杆菌(Mycobactersp.)菌株JC1DSM3803,鸟分枝杆菌类结核亚种(Mycobacteriumaviumsubsp.paratuberculosis)K-10,牛分枝杆菌(Mycobacteriumbovis)BCG,胃分枝杆菌(Mycobacteriumgastri),海洋分支杆菌(Mycobacteriummarinum)M,耻垢分枝杆菌(Mycobacteriumsmegmatis),耻垢分枝杆菌(Mycobacteriumsmegmatis)MC2155,结核杆菌(Mycobacteriumtuberculosis),NitrosopumilussalariaBD31,NitrososphaeragargensisGa9.2,皮诺卡氏菌(Nocardiafarcinica)IFM10152,Nocardiaiowensis(sp.NRRL5646),念珠菌属物种(Nostocsp.)PCC7120,Ogataeaangusta,OgataeaparapolymorphaDL-1(多形汉逊酵母(Hansenulapolymorpha)DL-1,PaenibacilluspeoriaeKCTC3763,脱氮副球菌(Paracoccusdenitrificans),产黄青霉(Penicilliumchrysogenum),深海嗜压发光杆菌(Photobacteriumprofundum)3TCK,PhytofermentansISDg,毕赤酵母(Pichiapastoris),PicrophilustorridusDSM9790,牙龈卟啉单胞菌(Porphyromonasgingivalis),牙龈卟啉单胞菌(Porphyromonasgingivalis)W83,绿脓杆菌PA01(PseudomonasaeruginosaPA01),脱氮假单胞杆菌(Pseudomonasdenitrificans),Pseudomonasknackmussii,恶臭假单胞菌(Pseudomonasputida),假单胞菌(Pseudomonassp),丁香假单胞菌丁香变体B728a(Pseudomonassyringaepv.syringaeB728a),冰岛火棒菌DSM4184(PyrobaculumislandicumDSM4184),Pyrococcusabyssi,焦酚火球菌(Pyrococcusfuriosus),掘越氏热球菌(Pyrococcushorikoshii)OT3,真氧产碱杆菌(Ralstoniaeutropha),真氧产碱杆菌(Ralstoniaeutropha)H16,荚膜红细菌(Rhodobactercapsulatus),球形红细菌(Rhodobactersphaeroides),球形红细菌ATCC17025,沼泽红假单胞菌(Rhodopseudomonaspalustris),沼泽红假单胞菌CGA009,沼泽红假单胞菌DX-1,深红红螺菌(Rhodospirillumrubrum),深红红螺菌ATCC11170,卵瘤胃球菌ATCC29174(RuminococcusobeumATCC29174),酿酒酵母,酿酒酵母S288C,沙门氏菌(Salmonellaenterica),肠道沙门氏菌肠道亚种鼠伤寒血清型LT2(Salmonellaentericasubsp.entericaserovarTyphimuriumstr.LT2),鼠伤寒沙门氏菌(Salmonellaentericatyphimurium),鼠伤寒沙门氏菌(Salmonellatyphimurium),粟酒裂殖酵母(Schizosaccharomycespombe),SebaldellatermitidisATCC33386,希瓦氏菌MR-1(ShewanellaoneidensisMR-1),苜蓿中华根瘤菌(Sinorhizobiummeliloti)1021,天蓝色链霉菌(Streptomycescoelicolor),灰色链霉菌灰色亚种NBRC13350(Streptomycesgriseussubsp.griseusNBRC13350),高温酸热硫化叶菌(Sulfolobusacidocalarius),硫矿硫化叶菌P-2(SulfolobussolfataricusP-2),集胞藻属PCC6803(Synechocystisstr.PCC6803),Syntrophobacterfumaroxidans,Thaueraaromatica,高温厌氧杆菌属(Thermoanaerobacter)X514,超嗜热原始菌(Thermococcuskodakaraensis),超嗜热古菌嗜热高温球菌(Thermococcuslitoralis),嗜酸热原体菌(Thermoplasmaacidophilum),嗜中性热变形菌(Thermoproteusneutrophilus),海栖热袍菌(Thermotogamaritima),桃红荚硫菌(Thiocapsaroseopersicina),TolumonasauensisDSM9187,阴道毛滴虫G3,布氏锥虫,微变冢村氏菌(Tsukamurellapaurometabola)DSM20162,霍乱弧菌(Vibriocholera),哈维氏弧菌ATCCBAA-1116(VibrioharveyiATCCBAA-1116),自养黄色杆菌PY2(XanthobacterautotrophicusPy2),中间耶尔森菌(Yersiniaintermedia),或玉米(Zeamays)。在一些方面中,将变体ADH基因引入具有提高的1,4-丁二醇(BDO)或羟基丁酸酯(4-HB)生物合成能力水平的工程化细胞,本领域的技术人员可以理解,通过将本申请提供的教导和指导应用于特定物种,代谢修饰的识别可以包括直系同源物的识别和加入或失活。在旁系同源物和/或非直系基因置换存在于所指的微生物中、编码催化相似或基本上相似的代谢反应的酶的程度范围上,本领域的技术人员也可以利用这些进化相关的基因。使用现在超过550种物种的完整基因组序列(其中超过一半可在公共数据文库如NCBI上找到),包括395种微生物基因组和各种酵母,真菌,植物和哺乳动物基因组,识别编码必要BDO或4-HB生物合成途径的基因,以及识别近缘物种或远缘物种中的编码其他已知的1,3-丁二醇(13BDO)、丁二烯、6-氨基己酸(6ACA)、六甲基二胺(hexamethyldiamine,HMDA)、己二酸或其衍生物、巴豆醇(croytlalcohol)、甲基乙烯基甲醇、3-丁烯-1-醇,琥珀酸或其衍生物、正丙醇、异丙醇、丙烯、甲基丙烯酸或其衍生物的生物合成途径、甲醇代谢和/或甲醛同化活性的一个或多个基因,包括例如同源物、直系同源物、旁系同源物和已知基因的非直系基因置换,以及生物体之间的基因改变的交换,这在本领域中都是常规和公知的。因此,本申请参照特定生物体(如大肠杆菌)所述的允许生物合成各种目标产物的代谢改变,包括1,3-丁二醇(13BDO),1,4-丁二醇(BDO),4-HB,丁二烯,6-氨基己酸(6ACA),六甲基二胺(hexamethyldiamine,HMDA),己二酸或其衍生物、巴豆醇(croytlalcohol)、甲基乙烯基甲醇、3-丁烯-1-醇,琥珀酸或其衍生物、正丙醇、异丙醇、丙烯、甲基丙烯酸或其衍生物,甲醇和/或甲醛的同化代谢,可容易地应用于其它微生物,类似地包括原核和真核生物。鉴于本申请提供的教导和指导,本领域技术人员可以知晓,以一种生物体举例说明的代谢改变可以同样适用于其它生物体。因此,包含非天然NAD+-依赖性醇脱氢酶的工程细胞,可以包括一种或多种基因改变,例如插入的转基因、删除、衰减、突变等,以期提高一种或多种中间体或其产物的水平,以及包括如US申请序列号13/975678(2013年8月26日提交)中所述的基因修饰,该申请通过参考形式并入本申请。示例性醇代谢途径基因,例如如美国申请序列号13/975678中所述,编码选自以下各项中的蛋白:a)甲酸脱氢酶(EM8),甲醛激活酶(EM10),甲醛脱氢酶(EM11),S-(羟甲基)谷胱甘肽合成酶(EM12),谷胱甘肽依赖性甲醛脱氢酶(EM13),S-甲酰谷胱甘肽水解酶(EM14),甲酸盐氢裂解酶(EM15)和氢化酶(EM16),任一种或多种可以与非天然NAD+-依赖性醇脱氢酶在工程细胞中共表达。其他的示例性醇代谢途径基因,例如如美国申请序列号13/975678中所述,其所编码的醇代谢途径基因编码有选自以下各项的蛋白:琥珀酰-CoA还原酶(醛形成型)(EB3),4-羟基丁酸酯(4-HB)脱氢酶(EB4),4-HB激酶(EB5),磷酸转-4-羟基丁酰酶(EB6),4-羟基丁酰-CoA还原酶(醛形成型)(EB7),1,4-丁二醇脱氢酶(EB8);琥珀酸还原酶(EB9),琥珀酰-CoA还原酶(醇形成型)(EB10),4-羟基丁酰-CoA转移酶(EB11),4-羟基丁酰-CoA合成酶(EB12),4-HB还原酶(EB13),和4-羟基丁酰-CoA还原酶(醇形成型)(EB15),琥珀酰-CoA转移酶(EB1),以及琥珀酰-CoA合成酶(EB2A),任一种或多种可以与非天然NAD+-依赖性醇脱氢酶在工程细胞中共表达。从本申请所述的表达工程化NAD+-依赖性甲醇或乙醇脱氢酶的宿主细胞所得到的目标产物,及该宿主细胞中适用于生产的产物途径,包括以下内容。特别感兴趣的是使用丙酮酸和乙酰-CoA作为其产物途径的入口点或前体的目标产物,部分是因为使用该新型酶的甲醇代谢途径允许将甲醇的碳固定到通向丙酮酸和乙酰-CoA的途径中。目标产物包括:(a)1,4-丁二醇及其中间体,如4-羟基丁酸(4-羟基丁酸酯,4-羟基丁酸酯,4-HB),(B)丁二烯及其中间体,如1,4-丁二醇,1,3-丁二醇,巴豆醇,3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇,(c)1,3-丁二醇及其中间体,如2,4-戊二烯,巴豆醇或3-丁烯-1-醇,(d)己二酸,6-氨基己酸,己内酰胺,己撑二胺和乙酰丙酸及其中间体,例如4-氨基丁酰CoA,(e)甲基丙烯酸(2-甲基-2-丙烯酸)及其酯,统称为甲基丙烯酸酯,如甲基丙烯酸甲酯,甲基丙烯酸甲酯,3-羟基异丁酸酯和/或2-羟基异丁酸酯及其中间体,(f)1,2-丙二醇(丙烯乙二醇),正丙醇,1,3-丙二醇和甘油,及其中间体,和(g)琥珀酸及其中间体。1,4-丁二醇及其中间体,如4-羟基丁酸(4-hydroxybutanoate,4-hydroxybutyrate,4-HB),是可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2008年9月25日公布的标题为“CompositionsandMethodsfortheBiosynthesisof1,4-ButanediolandItsPrecursors”的WO2008115840A2;2010年12月9日公布的标题为“ProcessofSeparatingComponentsofAFermentationBroth”的WO2010141780A1;2010年12月9日公布的标题为“MicroorganismsfortheProductionof1,4-ButanediolandRelatedMethods”的WO2010141920A2;2010年3月18日公布的标题为“MicroorganismsfortheProductionof1,4-Butanediol”的WO2010030711A2;2010年6月24日公布的标题为“MicroorganismsandMethodsforConversionofSyngasandOtherCarbonSourcestoUsefulProducts”的WO2010071697A1;2009年7月30日公布的标题为“MethodsandOrganismsforUtilizingSynthesisGasorOtherGaseousCarbonSourcesandMethanol”的WO2009094485A1;2009年2月19日公布的标题为“MethodsandOrganismsfortheGrowth-CoupledProductionof1,4-Butanediol”的WO2009023493A1;2008年9月25日公布的标题为“CompositionsandMethodsfortheBiosynthesisof1,4-ButanediolandItsPrecursors”的WO2008115840A2;和2013年8月27日提交的标题为“MicroorganismsanMethodsforEnhancingtheAvailabilityofReducingEquivalentsinthePresenceofMethanol,andforProducing1,4-ButanediolRelatedThereto”的国际申请号PCT/US13/56725的申请。丁二烯及其中间体,如1,4-丁二醇,1,3-丁二醇,巴豆醇,3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇,是可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。除了直接发酵生产丁二烯外,1,3-丁二醇,1,4-丁二醇,巴豆醇,3-丁烯-2-醇(甲基乙烯基甲醇)和3-丁烯-1-醇可以被分离,纯化(用于任何用途),然后在涉及金属基催化的第二步骤中脱水为丁二烯。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2011年11月10日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2011140171A2;2012年2月9日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofAromatics,2,4-Pentadienoateand1,3-Butadiene”的WO2012018624A2;2011年11月10日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2011140171A2;2013年3月21日公布的标题为“MicroorganismsandMethodsforProducingAlkenes”的WO2013040383A1;2012年12月27日公布的标题为“MicroorganismsforProducingButadieneandMethodsRelatedthereto”的WO2012177710A1;2012年8月9日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2012106516A1;2013年2月28日公布的标题为“MicroorganismsandMethodsforProducing2,4-Pentadienoate,Butadiene,Propylene,1,3-ButanediolandRelatedAlcohols”的WO2013028519A1;和2013年3月15日提交的序列号为61/799255的美国申请。1,3-丁二醇及其中间体,如2,4-戊二烯,巴豆醇或3-丁烯-1-醇,是可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2011年6月16日公布的标题为“MethodsandOrganismsforConvertingSynthesisGasorOtherGaseousCarbonSourcesandMethanolto1,3-Butanediol””的WO2011071682A1;2011年3月17日公布的标题为“MicroorganismsandMethodsfortheCo-ProductionofIsopropanolwithPrimaryAlcohols,DiolsandAcids”的WO2011031897A;2010年11月4日公布的标题为“OrganismsfortheProductionof1,3-Butanediol”的WO2010127319A2;2013年5月16日公布的标题为“EukaryoticOrganismsandMethodsforIncreasingtheAvailabilityofCytosolicAcetyl-CoA,andforProducing1,3-Butanediol”的WO2013071226A1;2013年2月28日公布的标题为“MicroorganismsandMethodsforProducing2,4-Pentadienoate,Butadiene,Propylene,1,3-ButanediolandRelatedAlcohols”的WO2013028519A1;2013年3月14日公布的标题为“EukaryoticOrganismsandMethodsforProducing1,3-Butanediol”的WO2013036764A1;2013年1月24日公布的标题为“MethodsforIncreasingProductYields”的WO2013012975A1;2012年12月27日公布的标题为“MicroorganismsforProducing1,3-ButanediolandMethodsRelatedThereto”的WO2012177619A2;和2013年3月15日提交的序列号为61/799255的美国申请。己二酸,6-氨基己酸,己内酰胺,己撑二胺和乙酰丙酸,以及其中间体,例如4-氨基丁酰辅酶A,是可用于例如制备尼龙聚合物,并可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2010年11月11日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofAdipate,Hexamethylenediamineand6-AminocaproicAcid”的WO2010129936A1;2013年1月24日公布的标题为“MethodsforIncreasingProductYields”的WO2013012975A1;2012年12月27日公布的标题为“MicroorganismsforProducing6-AminocaproicAcid”的WO2012177721A1;2012年7月26日公布的标题为“MethodsforIncreasingProductYields”的WO2012099621A1;2013年2月19日提交的序列号为61/766,620、标题为“MicroorganismsanMethodsforEnhancingtheAvailabilityofReducingEquivalentsinthePresenceofMethanol,andforProducingAdipate,6-Aminocaproate,HexamethylenediamineorCaprolactamRelatedThereto”的美国申请。甲基丙烯酸(2-甲基-2-丙烯酸;用于制备其统称为甲基丙烯酸酯的酯,如甲基丙烯酸甲酯,其最值得注意的是用在聚合物制造中),甲基丙烯酸酯如甲基丙烯酸甲酯,3-羟基异丁酸酯和/或2-羟基异丁酸酯及其中间体是可用于制备聚合物,并可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2012年10月4日公布的标题为“MicroorganismsforProducingMethacrylicAcidandMethacrylateEstersandMethodsRelatedThereto”的WO2012135789A2;2009年11月5日公布的标题为“MicroorganismsfortheProductionofMethacrylicAcid”的WO2009135074A2;2013年2月19日提交的序列号为61/766,620、标题为“MicroorganismsanMethodsforEnhancingtheAvailabilityofReducingEquivalentsinthePresenceofMethanol,andforProducingAdipate,6-Aminocaproate,HexamethylenediamineorCaprolactamRelatedThereto”的美国申请。1,2-丙二醇(丙烯乙二醇),正丙醇,1,3-丙二醇和甘油,及其中间体是可用于制备聚合物,并可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2009年11月9日公布的标题为“PrimaryAlcoholProducingOrganisms”的WO2009111672A1;2011年3月17日的标题为“MicroorganismsandMethodsfortheCo-ProductionofIsopropanolwithPrimaryAlcohols,DiolsandAcids”的WO2011031897A1;2012年12月27日公布的标题为“MicroorganismsforProducingN-Propanol1,3-Propanediol,1,2-PropanediolorGlycerolandMethodsRelatedThereto”的WO2012177599A2;2013年2月19日提交的序列号为61/766,635、标题为“MicroorganismsanMethodsforEnhancingtheAvailabilityofReducingEquivalentsinthePresenceofMethanol,andforProducing1,2-Propanediol,n-Propanol,1,3-Propanediol,orGlycerolRelatedThereto”的美国申请。琥珀酸及其中间体(可用于生产产物,包括聚合物,例如PBS,1,4-丁二醇,四氢呋喃,吡咯烷酮,溶剂,颜料,除冰器,塑料,燃料添加剂,织物,地毯,颜料和洗涤剂)是可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到::2008年7月2日公布的标题为“MethodsandOrganismsfortheGrowth-CoupledProductionofSuccinate”的EP1937821A2;2013年2月19日提交的序列号为61/766,635、标题为“MicroorganismsandMethodsforEnhancingtheAvailabilityofReducingEquivalentsinthePresenceofMethanol,andforProducingSuccinateRelatedThereto”的美国申请。从本申请所述的共表达工程化NAD+-依赖性甲醇或乙醇脱氢酶的宿主细胞所得到的目标产物,及该宿主细胞中适用于生产的产物途径,包括以下内容。丁二烯及其中间体,如1,4‐丁二醇,1,3‐丁二醇,巴豆醇,3‐丁烯‐2‐醇(甲基乙烯基甲醇)和3‐丁烯‐1‐醇,是可以通过下列文献及本申请中所描述的产物途径,与本申请所描述的新型醇脱氢酶共表达来获得的目标产物。除了直接发酵生产丁二烯外,1,3‐丁二醇,1,4‐丁二醇,巴豆醇,3‐丁烯‐2‐醇(甲基乙烯基甲醇)和3‐丁烯‐1‐醇可以被分离,纯化(用于任何用途),然后在涉及金属基催化的第二步骤中脱水为丁二烯。合适的产物途径和酶,筛选方法和分离方法,可以在本申请和以援引方式并入本申请中的以下文件中找到:2011年11月10日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2011140171A2;2012年2月9日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofAromatics,2,4‐Pentadienoateand1,3‐Butadiene”的WO2012018624A2;2011年11月10日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2011140171A2;2013年3月21日公布的标题为“MicroorganismsandMethodsforProducingAlkenes”的WO2013040383A1;2012年12月27日公布的标题为“MicroorganismsforProducingButadieneandMethodsRelatedthereto”的WO2012177710A1;2012年8月9日公布的标题为“MicroorganismsandMethodsfortheBiosynthesisofButadiene”的WO2012106516A1;2013年2月28日公布的标题为“MicroorganismsandMethodsforProducing2,4‐Pentadienoate,Butadiene,Propylene,1,3‐ButanediolandRelatedAlcohols”的WO2013028519A1;和2013年3月15日提交的序列号为61/799255的美国申请。在一些实施例中,本公开内容提供了一种包含MDH变体且被改造以提高还原当量可用性或利用经由甲醛同化途径(FAB)得到的甲醛的生物体,其可用于生产目标产物分子。本领域技术人员可以知晓,任何在其生产中利用还原当量的产物分子均可以在其他的生物合成途径中显示出增加的产量。BDO是用于生产高性能聚合物,溶剂和精细化学品的宝贵化学品。它是用于制备其他高价值化学品如四氢呋喃(THF)和γ-丁内酯(GBL)的基础。该价值链由三个主要部分组成,包括:(1)聚合物,(2)THF衍生物,和(3)GBL衍生物。在聚合物的情形中,BDO是用于生产聚对苯二甲酸丁二醇酯(PBT)的共聚单体。PBT是用于汽车,电器,供水系统以及小家电的中等性能的热塑性工程塑料。转化为THF,随后转化为聚四亚甲基醚二醇(PTMEG),提供了用于制造氨纶产物如纤维的中间体。PTMEG还与BDO结合用于生产特种聚酯醚(COPE)。COPEs是具有优异的机械性能和油/环境抵抗性的高模量弹性体,能够在高温和低温极限下操作。PTMEG和BDO也用于在标准的热塑性挤出、压延和成型设备中加工的热塑性聚氨酯,其具有出色的韧性和耐磨性特征。从BDO产生的GBL为制备吡咯烷酮以及服务于农用化学品市场提供了原料。吡咯烷酮作为高性能溶剂越来越多地用于提取工艺中,包括例如在电子工业和制药生产中。因此,本申请中提供的是根据本申请描述的方法得到的生物衍生BDO和包括生物衍生BDO或使用生物衍生BDO而获得的生物基产品。在许多工程化的途径中,基于碳水化合物原料实现最大产物产量,受到还原当量不足或还原当量损失为副产物而受到阻碍。甲醇是可用于通过利用一个或多个甲醇代谢酶而产生还原当量(如图3a所示)的相对廉价的有机原料。通过甲醇代谢产生的还原当量随后可用于驱动葡萄糖进入BDO生产途径,例如,如图2所示。如图2所示,所述生物体包含至少一种编码表达量足以生产BDO的BDOPE的外源核酸。在某些实施例中,所述BDOPE选自琥珀酰-CoA转移酶(EB1)或琥珀酰-CoA合成酶(EB2A)(或琥珀酰-CoA连接酶);琥珀酰-CoA还原酶(醛形成型)(EB3);4羟基丁酸酯(4-HB)脱氢酶(EB4);4HB激酶(EB5);磷酸转-4-羟基丁酰酶(EB6),4-羟基丁酰-CoA还原酶(醛形成型)(EB7),1,4-丁二醇脱氢酶(EB8);琥珀酸还原酶(EB9),琥珀酰-CoA还原酶(醇形成型)(EB10),4-羟基丁酰-CoA转移酶(EB11),4-羟基丁酰-CoA合成酶(EB12),4-HB还原酶(EB13),和4-羟基丁酰-CoA还原酶(醇形成型)(EB15)。用于将从琥珀酸盐和琥珀酰-CoA的各种产物(如BDO)的途径改造到微生物中的酶、基因和方法,是本领域公知的(参见,例如,U.S.Publ.No.2011/0201089)。一组BDOPEs代表一组,可以将琥珀酸盐转化为BDO的酶,如图2所示。如本申请所公开的从MDH途径获得的额外还原当量,在利用基于碳水化合物的原料时,改善所有这些产物的产量。例如,BDO可以从琥珀酰-CoA通过以前公开的途径产生(参见例如,Burketal.,WO2008/115840)。用于转化琥珀酰-CoA至BDO的示例性酶包括EB3(图2,步骤B),EB4(图2,步骤C),EB5(图2,步骤D),EB6(图2,步骤E),EB7(图2,步骤F),EB8(图2,步骤G),EB10(图1,步骤I),EB11(图2,步骤J),EB12(图2,步骤J),EB14(图2,步骤L),EB13(图2,步骤K),和EB15(图2,步骤M)。EB9(图2,步骤H)可以额外用于直接转化丁二酸到BDOP中间体,即琥珀酸半醛。经由图2中所示的途径并补充氧化TCA循环的反应(例如,柠檬酸合成酶,顺乌头酸,异柠檬酸脱氢酶,α-酮戊二酸脱氢酶)的BDO最大理论产率是1.09mol/mol。1C6H12O6→1.09C4H10O2+1.64CO2+0.55H2O当糖和甲醇这两种原料都可用时,甲醇可用于通过采用图1中所示的一种或多种酶来产生还原当量。从甲醇产生的还原当量可用来驱动葡萄糖至BDO生产途径,例如,如示于图2。从理论上讲,葡萄糖中的所有碳都将被保留,由此得到从葡萄糖到BDO的最大理论产率为每摩尔葡萄糖2molBDO,无论是在有氧或无氧条件下,如图2所示。10CH3OH+3C6H12O6=6C4H10O2+8H2O+4CO2在类似的方式中,使用图1和图2所示的反应,琥珀酸盐和4-HB的最大理论产率可以达到2mol/mol葡萄糖。C6H12O6+0.667CH3OH+1.333CO2→2C4H6O4+1.333H2OC6H12O6+2CH3OH→2C4H8O3+2H2O在其他实施例中,具有MDH蛋白的生物体,无论是单独使用或与BDOP组合,如本申请所提供,均可以进一步包括甲醛同化途径(FAP),该途径利用甲醛(例如,由甲醇氧化而获得)来形成某些中央代谢途径的中间体(可用于例如形成生物质)。在某些实施例中,所述生物体进一步包含FAP,其中,所述生物体包含至少一种编码表达量足以生产可用于生物质形成的糖酵解和/或代谢途径中间体的甲醛同化途径酶(FAPE)的外源核酸。在一个实施例中,FAPE的表达量足以产生糖酵解中间体。在另一个实施例中,FAPE的表达量足以产生可用于生物质形成的代谢途径中间体。在一些实施方式中,所述FAP包括己酮糖-6-磷酸(H6P)合成酶(EF1),6-磷酸-3-己酮糖异构酶(EF2),二羟基丙酮(DHA)合成酶(EF3)或DHA激酶(EF4)。在一个实施例中,FAP包括EF1和EF2。在一个实施例中,中间体是H6P,果糖-6-磷酸(F6P)或其组合。在其他实施例中,FAP包括EF3或EF4。在一个实施例中,中间体是DHA,DHA磷酸盐,或其组合。在某些实施例中,所述生物体包含两种外源核酸,各编码一个FAPE。本申请还提供了示例性的途径,其利用由甲醇氧化而产生的甲醛(例如,如图3A中的步骤j提供)在形成中可用于生物质形成的某些中央代谢途径中间体。可以利用甲醇氧化产生(例如,如图3a中提供)的甲醛的一个示例性FAP如图3b所示,其涉及通过EF1进行甲醛和D-核酮糖-5-磷酸缩合以形成H6P(图3b中,步骤A)。所述酶可以使用Mg2+或Mn2+来达到最大活性,尽管其它金属离子也是有用的,且甚至可以预期非金属离子依赖性的机制。H6P由EF2转化成F6P(图3b中,步骤B)。涉及从甲醇氧化产生的甲醛的解毒和同化的另一示例途径(例如,如图3a中提供)如图3c所示,并通过DHA进行。EF3是一种特殊的转酮酶,其首先将乙醇醛基团从木酮糖-5-磷酸转移到甲醛,由此形成DHA和G3P(糖酵解中间体)(图3c,步骤A)。从DHA合成酶得到的DHA随后由DHA激酶进一步磷酸化以形成DHA的磷酸盐(图3c中,步骤B)。DHAP可以同化入糖酵解及其他几个途径。如图3b和3c中所提供的途径,并未将甲醛转化为甲酸盐和排出的二氧化碳,而是展示了碳被同化并进入最终产物。因此,在一个实施例中,具有MDH蛋白,无论是单独使用或与BDOP组合,如本申请所提供,均可以进一步包括FAP,该途径利用甲醛(例如,由甲醇氧化而获得)来形成某些中央代谢途径的中间体(可用于例如形成生物质)。在一些实施例中,FAP包括3A或3B,其中3A是EF1且3B是EF2。在其他实施例中,FAP包括4A或4B,其中4A是EF3而4B是EF4。在某些实施例中,本申请提供的是具有MDH蛋白质的生物体,其中所述生物体包含至少一种编码表达量足以在甲醇的存在下提高还原当量可用性和/或表达量足以转化甲醇为甲醛的EM9的外源核酸。在一些实施例中,所述生物体包含至少一种编码表达量足以在甲醇的存在下提高还原当量可用性的EM9的外源核酸。在其他实施例中,所述生物体包含至少一种编码表达量足以转化甲醇为甲醛的EM9的外源核酸。在一些实施例中,微生物有机体进一步包括FAP。在某些实施例中,所述生物体进一步包含至少一种编码表达量足以生产糖酵解中间体的FAPE的外源核酸。在某些实施例中,所示FAPE选自EF1,EF2,EF3和EF4。适用于本申请所述的反应以将甲醇代谢为还原当量或碳的示例性酶包括如下相对于图3A,尤其是相对于步骤J,L,I,G,H,M,N和O的内容。图3,步骤G-甲酸氢裂解酶(EM15)EM15酶可以用来将甲酸转化为二氧化碳和氢。示例性EM15酶可在大肠杆菌中找到。大肠杆菌EM15由氢化酶3和甲酸脱氢酶-H组成(Maedaetal.,ApplMicrobiolBiotechnol77:879-890(2007))。它由fhlA的基因产物激活。(Maedaetal.,ApplMicrobiolBiotechnol77:879-890(2007))。在发酵液中加入微量元素、硒、镍和钼已显示可增强EM15活性(Soinietal.,Microb.CellFact.7:26(2008))。各种氢化酶3、EM8和转录激活因子基因如下所示。EM15酶也存在于超嗜热古菌嗜热高温球菌(Thermococcuslitoralis)中(Takacsetal.,BMC.Microbiol8:88(2008))。蛋白基因库IDGI号生物体mhyCABW05543157954626嗜热高温球菌mhyDABW05544157954627嗜热高温球菌mhyEABW05545157954628嗜热高温球菌myhFABW05546157954629嗜热高温球菌myhGABW05547157954630嗜热高温球菌myhHABW05548157954631嗜热高温球菌fdhAAAB949322746736嗜热高温球菌fdhBAAB94931157954625嗜热高温球菌还在鼠伤寒沙门氏菌(Salmonellatyphimurium),克雷伯氏肺炎杆菌(Klebsiellapneumoniae),深红红螺菌(Rhodospirillumrubrum),甲酸甲烷杆菌(Methanobacteriumformicicum)中发现了其他EM15系统(Vardar-Scharaetal.,MicrobialBiotechnology1:107-125(2008))。图3,步骤H-氢化酶(EM16)氢化酶可将氢气转化成质子并将电子转移到受体如铁氧还蛋白,NAD+或NADP+中。真氧产碱杆菌(Ralstoniaeutropha)H16使用氢作为能量来源,以氧作为末端电子受体。其膜结合摄取[NiFe]-氢化酶是“O2耐受”的EM16(Cracknell,etal.ProcNatAcadSci,106(49)20681-20686(2009)),其是周质导向的并经由b型细胞色素连接至呼吸链(SchinkandSchlegel,Biochim.Biophys.Acta,567,315-324(1979);Bernhardetal.,Eur.J.Biochem.248,179–186(1997))。真氧产碱杆菌还包含由Hox操纵子编码的O2-耐受可溶性EM16,其是细胞质性质的,并消耗氢来直接减少NAD+(SchneiderandSchlegel,Biochim.Biophys.Acta452,66–80(1976);Burgdorf,J.Bact.187(9)3122-3132(2005))。此外,可溶性EM16酶还存在于若干其他生物,包括硫还原地杆菌(Geobactersulfurreducens)(Coppi,Microbiology151,1239–1254(2005)),Synechocystisstr.PCC6803(Germer,J.Biol.Chem.,284(52),36462–36472(2009)),和桃红荚硫菌(Thiocapsaroseopersicina)(Rakhely,Appl.Environ.Microbiol.70(2)722–728(2004))。集胞藻属(Synechocystis)的酶能够从氢产生NADPH。来自集胞藻属菌株PCC6803的Hox操纵子和来自念珠藻属PCC7120的Hyp操纵子所编码的附加基因的过表达,相对于单独表达Hox基因,得到了提高的EM16活性(Germer,J.Biol.Chem.284(52),36462–36472(2009))。大肠杆菌及其它肠细菌的基因组编码了至多四个EM16酶(Sawers,G.,AntonieVanLeeuwenhoek66:57-88(1994);Sawersetal.,JBacteriol.164:1324-1331(1985);SawersandBoxer,Eur.JBiochem.156:265-275(1986);Sawersetal.,JBacteriol.168:398-404(1986))。鉴于酶活性的多重性,大肠杆菌或另一宿主生物体可以提供足够的EM16活性,以裂解传入的分子氢,并减少对应的受体。大肠杆菌的内源氢裂解酶包括氢化酶3,其为使用铁氧还蛋白作为受体的膜结合酶复合物;以及也使用铁氧还蛋白受体的氢化酶4。氢化酶3和4分别由hyc和hyf基因簇编码。M.thermoacetica和杨氏梭菌(Clostridiumljungdahli)中的EM16活性也取决于hyp基因,其对应的蛋白参与了EM16复合物的组装(Jacobietal.,Arch.Microbiol158:444-451(1992);Rangarajanetal.,JBacteriol.190:1447-1458(2008))。M.thermoacetica和杨氏梭菌(Clostridiumljungdahli)中的EM16适用于没有足够的内源性EM16活性的宿主。M.thermoacetica和杨氏梭菌可以用CO2作为唯一碳源来培养,表明还原当量取自H2,以允许经由Wood-Ljungdahl途径合成乙酰辅酶A(Drake,H.L.,JBacteriol.150:702-709(1982);DrakeandDaniel,ResMicrobiol155:869-883(2004);KellumandDrake,JBacteriol.160:466-469(1984))。M.thermoacetica具有与来自大肠杆菌的hyp,hyc和hyf若干基因的同源物。所述基因编码的这些蛋白质序列由以下基因库(GenBank)登记号标识。此外,编码EM16功能的几个基因簇存在于M.thermoacetica和杨氏梭菌中(参见例如US2012/0003652)。基因与大肠杆菌EM16基因同源的M.thermoacetica中的蛋白如下。编码来自杨氏梭菌的EM16酶的基因如下。在一些情况下,编码EM16的基因位置与CODH相邻。在深红红螺菌(Rhodospirillumrubrum)中,所编码的CODH/氢化酶蛋白形成膜结合酶复合体,已发现该复合体是通过将CO和H2O转化为CO2和H2从而以质子梯度形式产生能量的位点(Foxetal.,JBacteriol.178:6200-6208(1996))。C.hydrogenoformans的CODH-I及其相邻基因,基于其与深红红螺菌CODH/氢化酶基因簇的相似性,已推论其催化相同的功能作用(Wuetal.,PLoSGenet.1:e65(2005))。在C.hydrogenoformansCODH-I也在连接到电极时,表现出强烈的CO氧化和CO2还原活性(Parkinetal.,JAm.Chem.Soc.129:10328-10329(2007))。有些EM16和CODH酶将电子转移到铁氧还蛋白。铁氧还蛋白是含有一种或多种铁-硫簇的作为具有低还原电位的细胞内电子载体的小酸性蛋白。还原的铁氧还蛋白将电子贡献给铁依赖性酶,如铁氧还蛋白-NADP+氧化还原酶,丙酮酸:铁氧还蛋白氧化还原酶(PFOR)和2-酮戊二酸:铁氧还蛋白氧化还原酶(OFOR)。H.thermophilus基因fdx1编码了[4Fe-4S]型铁氧还蛋白,其是分别由OFOR和PFOR进行的2-酮戊二酸和丙酮酸的可逆羧化作用所需的(Yamamotoetal.,Extremophiles14:79-85(2010))。与硫矿硫化叶菌(Sulfolobussolfataricus)2-含氧酸:铁氧还蛋白还原酶相关联的铁氧还蛋白是单体二集群[3Fe-4S][4Fe-4S]型铁氧还蛋白(Parketal.2006)。虽然与该蛋白质相关的基因还没有被完全测序,其N-末端结构域与来自S.acidocaldarius的铁氧还蛋白zfx具有93%的同源性。大肠杆菌基因组编码了具有未知生理功能的可溶性铁氧还蛋白fdx。一些证据表明,这种蛋白质可以在铁硫簇组件中起作用(TakahashiandNakamura,1999)。其他铁氧还蛋白已识别于幽门螺杆菌(Helicobacterpylori)(Mukhopadhyayetal.2003)和空肠弯曲杆菌(Campylobacterjejuni)(vanVlietetal.2001)。来自巴氏梭菌(Clostridiumpasteurianum)的2Fe-2S铁氧还蛋白已被克隆并在大肠杆菌中表达(FujinagaandMeyer,BiochemicalandBiophysicalResearchCommunications,192(3):(1993))。据预测,产乙酸细菌如热醋穆尔氏菌(Moorellathermoacetica),ClostridiumcarboxidivoransP7,杨氏梭菌和深红红螺菌编码有若干铁氧还蛋白,下面列出。铁氧还蛋白氧化还原酶将电子从铁氧还蛋白或黄素氧化还原蛋白转移到NAD(P)H。催化电子从还原铁氧还蛋白可逆转移到NAD(P)+的两种酶是铁氧还蛋白:NAD+氧化还原酶(EC1.18.1.3)和铁氧还蛋白:NADP+氧化还原酶(FNR,EC1.18.1.2)。铁氧还蛋白:NADP+氧化还原酶(FNR,EC1.18.1.2)具有非共价结合的FAD辅助因子,其促进电子从NADPH可逆转移到低电位受体(如铁氧还蛋白或黄素氧化还原蛋白)(Blaschkowskietal.,Eur.J.Biochem.123:563-569(1982);Fujiietal.,1977)。幽门螺杆菌FNR,由HP1164(fqrB)编码,与丙酮酸:铁氧还蛋白氧化还原酶(PFOR)导致丙酮酸依赖性NADPH生产的活性相关(Stetal.2007)。一种类似的酶被发现于空肠弯曲杆菌中(StMauriceetal.,J.Bacteriol.189:4764-4773(2007))。铁氧还蛋白:NADP+氧化还原酶在大肠杆菌中的基因组中由fpr编码(Bianchietal.1993)。铁氧还蛋白:NAD+氧化还原酶利用还原的铁氧还蛋白来从NAD+产生NADH。在数种生物体中,包括大肠杆菌,这种酶是多功能双加氧酶复合物的成分。由hcaD,编码的大肠杆菌的铁氧还蛋白:NAD+氧化还原酶,是参与芳香酸利用的3-苯基丙酸酯加氧酶系统的一种成分(Diazetal.1998)。在嗜热氢杆菌的细胞提取物中检测到NADH:铁氧还蛋白还原酶的活性,尽管还没有明确该活性的基因(Yoonetal.2006)。其他的铁氧还蛋白:NAD(P)+氧化还原酶已标注在ClostridiumcarboxydivoransP7中。C.kluyveri的NADH依赖性的还原铁氧还蛋白:NADP氧化还原酶由nfnAB编码,用两当量的NADPH催化铁氧还蛋白和NAD+的共同还原(Wangetal,JBacteriol192:5115-5123(2010))。最后,能量保存的膜相关RNF型蛋白质(Seedorfetal,PNAS105:2128-2133(2008);andHerrmann,J.Bacteriol190:784-791(2008))提供了从还原的铁氧还蛋白生成NADH或NADPH的途径。图3,步骤I-甲酸脱氢酶(EM8)甲酸脱氢酶(FDH;EM8)催化电子从甲酸盐可逆转移到受体。具有FDH活性的酶利用各种电子载体,例如,NADH(EC1.2.1.2),NADPH(EC1.2.1.43),对苯二酚(EC1.1.5.6),细胞色素(EC1.2.2.3)和EM16s(EC1.1.99.33)。FDH酶已在热醋穆尔氏菌中得到表征(AndreesenandLjungdahl,JBacteriol116:867-873(1973);Lietal.,JBacteriol92:405-412(1966);Yamamotoetal.,JBiolChem.258:1826-1832(1983)。基因座Moth_2312负责编码EM8的α亚基,而β亚基是由Moth_2314编码(Pierceetal.,EnvironMicrobiol(2008))。另一组编码倾向于减少CO2的EM8活性的基因,由Syntrophobacterfumaroxidans中的Sfum_2703到Sfum_2706编码(deBoketal.,EurJBiochem.270:2476-2485(2003));Redaetal.,PNAS105:10654-10658(2008))。推定执行相同功能的一组类似的基因是由C.hydrogenoformans中的CHY_0731,CHY_0732,和CHY_0733编码(Wuetal.,PLoSGenet1:e65(2005))。也发现EM8s存在于许多其他生物中,包括C.carboxidivoransP7,甲醇芽孢杆菌(Bacillusmethanolicus),稳定伯克霍尔德菌(Burkholderiastabilis),热醋穆尔氏菌(Moorellathermoacetica)ATCC39073,博伊丁氏假丝酵母(Candidaboidinii),Candidamethylica,和酿酒酵母S288c。来自真氧产碱杆菌的可溶性EM8还原NAD+(fdsG,-B,-A,-C,-D)(OhandBowien,1998)。已经识别出若干EM8酶是相对于NAD对NADP具有更高特异性的辅助因子。这种酶已经被视为NADP依赖性甲酸脱氢酶,且已在已经从5种洋葱伯克霍尔德菌(Burkholderiacepacia)复合物中得到报道。其在多噬伯克霍尔德氏菌(Burkholderiamultivorans),稳定伯克霍尔德菌(Burkholderiastabilis),吡咯伯克氏菌(Burkholderiapyrrocinia),和洋葱伯克霍尔德菌(Burkholderiacenocepacia)的多个菌株中得到测试和验证(Hatrongjitetal.,EnzymeandMicrobialTech.,46:557-561(2010))。来自洋葱伯克霍尔德菌的酶已被表征,所述酶对甲酸盐,NADP,和NAD的表观Km分别报道为55.5mM,0.16mM和1.43mM。更多的候选基因可以通过存放在公共数据文库如NCBI,JGI和宏基因组数据文库中的蛋白序列同源性来识别。图3,步骤J-甲醇脱氢酶(EM9)NAD+依赖性EM9酶(EC1.1.1.244)催化甲醇和NAD+向甲醛和NADH的转化。参见如本文所述的本发明。图3,步骤L-甲醛脱氢酶(EM11)甲醛到甲酸盐的氧化通过EM11催化。NAD+依赖性EM11酶由恶臭假单胞菌(Pseudomonasputida)的fdhA所编码((Itoetal,JBacteriol176:2483-2491(1994))。其他EM11酶包括来自查氏生丝微菌(Hyphomicrobiumzavarzinii)和非NAD+和谷胱甘肽依赖性的EM11(Jeromeetal,ApplMicrobiolBiotechnol77:779-88(2007)),来自巴斯德毕赤酵母的谷胱甘肽依赖性EM11(Sungaetal,Gene330:39-47(2004))和来自Methylobactermarinus的NAD(P)+依赖性EM11(Speeretal,FEMSMicrobiolLett,121(3):349-55(1994))。蛋白基因库IDGI号生物体fdhAP46154.31169603恶臭假单胞菌faoACAC85637.119912992查氏生丝微菌Fld1CCA39112.1328352714巴斯德毕赤酵母fdhP47734.2221222447Methylobactermarinus除了上面列出的EM11酶外,用于将甲醛转化为甲酸盐的替代性酶和途径在本领域是公知的。例如,许多生物体采用谷胱甘肽依赖性甲醛氧化的途径,其中甲醛经由中间体S-羟甲谷胱甘肽和S-甲酰谷胱甘肽分三步转化为甲酸盐(Vorholtetal,JBacteriol182:6645-50(2000))。这一途径中的酶是EM12(EC4.4.1.22),EM13(EC1.1.1.284)和EM14(EC3.1.2.12)。图3,步骤M-自发性或S-(羟基甲基)谷胱甘肽合成酶(EM12)虽然甲醛到S-羟甲谷胱甘肽的转化可在谷胱甘肽的存在下自发发生,Goenrichetal已证明(Goenrich,etal.,JBiolChem277(5);3069-72(2002)),来自脱氮副球菌(Paracoccusdenitrificans)的酶可以加速这种自发缩合反应。催化甲醛和谷胱甘肽的转化的酶被纯化并命名为谷胱甘肽依赖性甲醛激活酶(GFa)。编码它的基因,命名为gfa,位于基因EM13的直接上游,其催化S-羟甲谷胱甘肽随后的氧化。与P.denitrificans具有序列一致性的假定蛋白也存在于球形红细菌,苜蓿中华根瘤菌(Sinorhizobiummeliloti)和百脉根中生根瘤菌(Mesorhizobiumloti)。图3,步骤N-谷胱甘肽依赖型甲醛脱氢酶(EM13)EM13(GS-FDH)属于III类乙醇脱氢酶家族。谷胱甘肽和甲醛非酶促性结合,以形成羟甲基谷胱甘肽,其为GS-FDH催化反应的真正底物。其产物,S-甲酰谷胱甘肽,进一步代谢成甲酸。图3,步骤O-S-甲酰谷胱甘肽水解酶(EM14)EM14是在细菌,植物和动物中发现的谷胱甘肽硫醇酯酶。其催化S-甲酰谷胱甘肽转化为甲酸盐和谷胱甘肽。P.denitrificans的fghA基因位于与gfa和flhA(参与该生物体中甲醛氧化为甲酸盐的两种基因)同一操纵子。在大肠杆菌中,FrmB编码在具有FrmR和FrmA(参与甲醛氧化的蛋白质)的操纵子中。大肠杆菌的YeiG是随意性丝氨酸水解酶;其最高比活性是针对底物S-甲酰谷胱甘肽的。进一步描述了将来自甲醇氧化产生的甲醛用于形成在目标产物或生物质的形成中使用的的中央代谢途径中间体的方法中的示例性酶,特别是相对于图3B和3C。本申请提供的是示例性的途径,其利用从甲醇氧化中产生的甲醛(参见,例如,图3,步骤J)来形成在目标产物或生物质的形成中使用的中央代谢途径中间体。用于提高还原当量的可用性,以及从甲醇产生的甲醛(步骤J)的可用性的MMPs,提供于图3中。图3展示了可以利用从甲醇氧化中产生的甲醛的一个示例性途径(例如,如图3中提供),其涉及通过EF1进行甲醛和D-核酮糖-5-磷酸缩合以形成H6P(图3b中,步骤A)。所述酶可以使用Mg2+或Mn2+来达到最大活性,尽管其它金属离子也是有用的,且甚至可以预期非金属离子依赖性的机制。H6P由EF2转化成F6P(图3b中,步骤B)。图3c展示了涉及从甲醇氧化产生的甲醛的解毒和同化的另一示例途径(例如,如图3中提供),且该途径通过DHA进行。EF3是一种特殊的转酮酶,其首先将乙醇醛基团从木酮糖-5-磷酸转移到甲醛,由此形成DHA和G3P(糖酵解中间体)(图3c,步骤A)。从DHA合成酶得到的DHA随后由DHA激酶进一步磷酸化以形成DHA的磷酸盐(图3c中,步骤B)。DHAP可以同化入糖酵解及其他几个途径。图3B,步骤A和B-己酮糖-6-磷酸合成酶(EF1)(步骤A)和6-磷酸-3-果糖异构酶(EF2)(步骤B)EF1和EF2酶均存在于数种生物体中,包括已将其从中纯化出来的甲烷营养菌(methanotroph)和甲基营养菌(methylotroph)(Katoetal.,2006,BioSciBiotechnolBiochem.70(1):10-21)。此外,这些酶在异养生物中也已得到报道,例如据报道,其在枯草芽孢杆菌(Bacillussubtilis)中参与甲醛解毒(Mitsuietal.,2003,AEM69(10):6128-32,Yasuedaetal.,1999.JBac181(23):7154-60)。来自甲基营养菌胃分枝杆菌(Mycobacteriumgastri)MB19的这两种酶已被融合且包含hps-phi构建体和大肠杆菌菌株显示出对甲醛的更有效利用(Oritaetal.,2007,ApplMicrobiolBiotechnol.76:439–445)。在一些生物中,这两种酶天然存在为双功能融合版本。H6P合成酶的示例性候选基因是:EF2基因的示例性候选基因是:蛋白基因库IDGI号生物体PhiAAR39393.140074228甲醇芽孢杆菌MGA3PhiEIJ81376.1387589056甲醇芽孢杆菌PB1PhiBAA83098.15706383MethylomonasaminofaciensRmpBBAA90545.16899860胃分枝杆菌其中,这两种功能融合成单个开放阅读框的候选酶包括以下内容。图3C,步骤A-二羟基丙酮合成酶(EF3)涉及从甲醇氧化产生的甲醛的解毒和同化的另一示例途径(例如,如图3a中提供)如图3c所示,并通过DHA进行。EF3是一种特殊的转酮酶,其首先将乙醇醛基团从木酮糖-5-磷酸转移到甲醛,由此形成DHA和G3P(糖酵解中间体)(图3c,步骤A)。从DHA合成酶得到的DHA随后由DHA激酶进一步磷酸化以形成DHA的磷酸盐(图3c中,步骤B)。DHAP可以同化入糖酵解及其他几个途径。博伊丁氏假丝酵母(Candidaboidinii)中的EF3酶使用焦磷酸硫胺和Mg2+作为辅助因子,且位于过氧化物酶体中。来自甲醇-生长羧菌(分枝杆菌(Mycobacter)菌株JC1DSM3803)的酶,也被发现具有DHA合成酶和激酶活性(Roetal.,1997,JBac179(19):6041-7)。来自该生物体的DHA合成酶也具有类似于来自博伊丁氏假丝酵母的酶的辅助因子要求。甲醛和木酮糖-5-磷酸的Km据报道分别为1.86mM和33.3microM。其他几种分枝杆菌,仅结核杆菌(Mycobacteriumtuberculosis)除外,可以使用甲醇作为碳和能量的唯一来源,并且据报道使用EF3(Partetal.,2003,JBac185(1):142-7)。图3C,步骤B-二羟基丙酮(DHA)激酶从DHA合成酶得到的DHA,由DHA激酶进一步磷酸化而形成DHA磷酸盐。DHAP可以同化入糖酵解及其他几个途径。EF4已从Ogataeaangusta纯化至均质(Bystrkh,1983,Biokhimiia,48(10):1611-6)。磷酸化DHA和在较小的程度上磷酸化甘油醛的酶,是139kDa的同型二聚体蛋白。ATP是所述酶的优选磷酸基团供体。当使用ITP,GTP,CTP和UTP时,其活性降低到30%左右。在若干生物体如克雷伯氏肺炎菌(Klebsiellapneumoniae)和弗氏柠檬酸杆菌(Citrobacterfruendii)中(Danieletal.,1995,JBac177(15):4392-40),DHA的形成是甘油氧化的结果,且DHA通过克雷伯氏肺炎菌的激酶DHA激酶转化成DHAP,对此已进行表征(Jonathanetal,1984,JBac160(1):55-60)。它对DHA极具特异性,其Km为4μM,并具有两个对ATP的Km值,一个为25至35μM,而另一个为200至300μM。DHA也可以通过甘油激酶磷酸化,但克雷伯氏肺炎菌的DHA激酶在数个方面上不同于甘油激酶。虽然这两种酶均可以磷酸化DHA,但是DHA激酶不能磷酸化甘油,也不会受到果糖-1,6-二磷酸的抑制。在酿酒酵母(Saccharomycescerevisiae)中,DHA激酶(I和II)参与从DHA的毒性作用中挽救细胞(Molinetal.,2003,JBiolChem.17;278(3):1415-23)。在大肠杆菌中,DHA激酶是由三个亚基DhaK,DhaL和DhaM组成,其功能类似于磷酸转移酶系统(PTS)之处在于,其利用磷酸烯醇丙酮酸盐作为磷酸供体(Gutknechtetal.,2001,EMBOJ.20(10):2480-6)。其不同之处在于不参与运输。磷酸化反应需要PTS系统的EI和HPr蛋白质的存在。DhaM亚基在多个位点上磷酸化。DhaK包含底物结合位点(Garcia-Allesetal.,2004,43(41):13037-45;Sieboldetal.,2003,PNAS.100(14):8188-92)。大肠杆菌酶的DHA的KM已被报道为6μM。该K亚基类似于弗氏柠檬酸杆菌和真核生物的ATP依赖性EF4的N末端这一半。该步骤的示例性DHA激酶基因的候选物是:可以使用公知的方法进行适当的纯化和/或测试,例如对于BDO的生产。对于受试的每一种工程化菌株,可以培养适当的重复式样,例如一式三份的培养物。例如,可以监控工程化生产宿主中的产物和副产物的形成。最终产物和中间体,以及其它有机化合物,可通过如HPLC(高效液相色谱),GC-MS(气相色谱-质谱)和LC-MS(液相色谱-质谱法)或其它使用在本领域中公知的其他常规程序的合适分析方法来进行分析。产物从发酵液中的释放,还可以用培养物上清液来测试。副产物和残余的葡萄糖可以通过HPLC来量化,例如,对于葡萄糖和醇使用折光率检测器,以及对于有机酸使用UV检测器(Linetal.,Biotechnol.Bioeng.90:775-779(2005)),或在本领域中公知的其他适合的试验和检测方法。来自外源DNA序列的各个酶或蛋白质活性,也可以使用本领域中公知的方法测定。BDO或其它目标分子可以使用多种本领域中公知的方法从培养物的其他成分中分离。所述分离的方法包括,例如,萃取程序,以及包括连续液-液萃取,渗透蒸发,蒸发,过滤,膜过滤(包括反渗透,纳米过滤,超滤,和微滤),膜渗滤,膜分离,反渗透,电渗析,蒸馏,萃取蒸馏,反应性蒸馏,共沸蒸馏,结晶和重结晶,离心,萃取过滤,离子交换层析,尺寸排阻层析,吸附层析,活性碳吸附,氢化,和超滤在内的方法。所有上述方法在本领域中是公知的。目标分子隔离工艺的实施例包括:对于13BDO,14BDO,丁二烯,甲基乙烯基甲醇,3-丁烯-1-醇,正丙醇,异丙醇,丙烯和巴豆醇使用蒸馏;对于6ACA(可选地,其可转化为己内酰胺,然后以蒸馏作为纯化的最终步骤),HMDA,己二酸或其衍生物,琥珀酸或其衍生物使用结晶;或对于甲基丙烯酸或其衍生物使用结晶,蒸馏,或萃取的任一种。目标分子例如13BDO,14BDO,丁二烯,甲基乙烯基甲醇,正丙醇,异丙醇,丙二醇,巴豆醇;3-丁烯-1-醇,6ACA,HMDA,己二酸或其衍生物,琥珀酸或其衍生物,或甲基丙烯酸或其衍生物,是在商业和工业应用中使用的化学品。在一些实施例中,BDO和/或4-HB用于各种商业和工业应用中。这种应用的非限制性实施例包括用于生产塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基脂肪酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等。此外,BDO和/或4-HB也在广泛范围的产品生产中用作原料,包括塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基脂肪酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等。因此,在一些实施例中,提供了生物基的塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基脂肪酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,其包含一种或多种由本申请所提供的生物体或使用本申请所公开的方法而产生的生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB中间体。如本申请所用的术语“生物衍生”,意思是来源于生物有机体或由生物有机体合成,并可以看作是可再生的资源,因为其可以由生物有机体产生。这样的生物有机体,特别是本申请所公开的微生物有机体,可利用原料或生物质,例如,从农业、植物、细菌或动物来源获得的糖或碳水化合物。可选地,生物有机体可以利用大气中的碳。如本申请中所使用的术语“生物基”是指全部或部分由本公开的生物衍生化合物组成的产物。生物基或生物衍生的产物与石油衍生的产物相反,其中后者产物衍生或合成自石油或石化原料。在一些实施例中,本公开提供了塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,其包含生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB的中间体,其中所述生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB的中间体包括用于生产塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等的全部或部分BDO和/或4-HB或BDO和/或4-HB的中间体。因此,在一些方面中,本公开提供了一种生物基塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,其包含至少2%,至少3%,至少5%,至少10%,至少15%,至少20%,至少25%,至少30%,至少35%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少95%,至少98%或100%的如本申请所公开的生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB的中间体。此外,在一些方面中,本公开提供了一种生物基塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,其中,用于其生产中的BDO和/或4-HB或BDO和/或4-HB的中间体,是生物衍生和石油衍生的BDO和/或4-HB或BDO和/或4-HB的中间体的组合。例如,生物基塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,可以使用50%生物衍生BDO和/或4-HB和50%石油衍生BDO和/或4-HB,或使用其他期望比例,如60%/40%,70%/30%,80%/20%,90%/10%,95%/5%,100%/0%,40%/60%,30%/70%,20%/80%,10%/90%的生物衍生/石油衍生前体,只要该产物的至少一部分包括由本申请公开的微生物有机体产生的生物衍生产物。可以理解,用于使用生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB的中间体生产塑料,弹性纤维,聚氨酯,聚酯(包括聚羟基烷酸酯如P4HB或其共聚物),PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等的方法,在本领域中是公知的。在一个实施例中,所述产物是塑料。在一个实施例中,该产物是弹性纤维。在一个实施例中,该产物是聚氨酯。在一个实施例中,该产物是聚酯。在一个实施例中,该产物是聚羟基脂肪酸酯。在一个实施例中,该产物是聚-4-HB。在一个实施例中,该产物是聚-4-HB的共聚合物。在一个实施例中,该产物是聚(四亚甲基醚)二醇。在一个实施例中,该产物是聚氨酯-聚脲共聚物。在一个实施例中,所述产物是氨纶。在一个实施例中,该产物是弹性纤维。在一个实施例中,该产物是LycraTM。在一个实施例中,该产物是尼龙。在一些实施例中,本申请提供了包含生物衍生BDO的培养基。在一些实施例中,所述生物衍生BDO是通过培养本申请所提供的具有MDH蛋白和BDOP的生物体产生的。在某些实施例中,生物衍生BDO的碳-12,碳-13和碳-14同位素比率反映了大气二氧化碳摄取源。在一个实施例中,所述培养基分离自具有MDH蛋白和BDOP的生物体。在其他实施例中,本申请提供了一种生物衍生BDO。在一些实施例中,所述生物衍生BDO是通过培养本申请所提供的具有MDH蛋白和BDOP的生物体产生的。在某些实施例中,上述生物衍生BDO的Fm值为至少80%,至少85%,至少90%,至少95%或至少98%。在某些实施例中,所述生物衍生BDO是培养基的组分。在某些实施例中,本申请提供了包含本申请所提供的生物衍生BDO的组合物,例如,通过培养本申请所提供的具有MDH蛋白和BDOP的生物体产生的生物衍生BDO。在一些实施例中,所述组合物进一步包括除所述生物衍生BDO以外的化合物。在某些实施例中,除所述生物衍生BDO以外的化合物,是微量的本申请所提供的具有MDH蛋白和BDOP的生物体的细胞部分。在一些实施例中,本申请提供包含本申请提供的生物衍生BDO的生物基产物。在某些实施例中,所述生物基产物是塑料,弹性纤维,聚氨酯,聚酯,聚羟基脂肪酸酯,聚-4-HB,聚-4-HB共聚物,聚(四亚甲基醚)二醇,聚氨酯-聚脲共聚物,氨纶,弹性纤维,LycraTM,或尼龙。在某些实施例中,所述生物基产物包含至少5%的生物衍生BDO。在某些实施例中,所述生物基产物是(i)聚合物,THF或THF衍生物,或GBL或GBL衍生物;(ii)塑料,弹性纤维,聚氨酯,聚酯,聚羟基脂肪酸酯,聚-4-HB,聚-4-HB的共聚物,聚(四亚甲基醚)二醇,聚氨酯-聚脲共聚物,氨纶,弹性纤维,LycraTM,或尼龙;(ⅲ)聚合物,树脂,纤维,珠,颗粒,丸,片,塑料,聚酯,热塑性聚酯,模塑制品,注模制品,注模部件,汽车部件,挤制型树脂,电气部件和外壳;且可选地,其中所述生物基产物是增强或填充型,及进一步地,其中所述生物基产物是玻璃增强或填充型或矿物增强或填充型;(iv)聚合物,其中该聚合物包括聚对苯二甲酸丁二醇酯(PBT);(ⅴ)聚合物,其中所述聚合物包含PBT,其所述生物基产物是树脂,纤维,珠,颗粒,丸,片,塑料,聚酯,热塑性聚酯,模塑制品,注模制品,注模部件,汽车部件,挤制型树脂,电气部件和外壳;且可选地,其中所述生物基产物是增强或填充型,及进一步地,其中所述生物基产物是玻璃增强或填充型或矿物增强或填充型;(ⅵ)THF或THF衍生物,其中所述THF衍生物是聚四亚甲基醚二醇(PTMEG),聚酯醚(COPE),或热塑性聚氨酯;(ⅷ)THF衍生物,其中所述THF衍生物包括纤维;或(ⅸ)GBL或GBL衍生物,其中所述GBL衍生物是吡咯烷酮;在某些实施例中,生物基产物包含生物衍生BDO为至少10%。在一些实施例中,生物基产物包含生物衍生的BDO为至少20%。在其他实施例中,生物基产物包含至少30%的生物衍生BDO。在一些实施例中,生物基产物包含生物衍生BDO为至少40%。在其他实施例中,生物基产物包含至少50%的生物衍生BDO。在一个实施例中,生物基产物包括所述生物衍生BDO的一部分作为重复单元。在另一个实施例中,本申请提供了通过模制本申请提供的生物基产物而获得的模制产品。在其他实施例中,本申请提供的是用于生产本申请提供的生物基产物的方法,包括令所述生物衍生BDO与自身或另一种化合物,在产生所述生物基产物的反应中发生化学反应。在某些实施例中,本申请提供包含生物衍生BDO或通过转化生物衍生BDO得到的聚合物。在其他实施例中,本申请提供了一种用于生产聚合物的方法,包括:通过化学或酶促转化,将所述生物衍生BDO转化为聚合物。在其它实施例中,本申请提供包含所述生物衍生BDO或其细胞裂解物或培养物上清液的组合物。在一些实施例中,碳质原料及其他细胞摄取源,如磷酸盐、氨、硫酸盐、氯化物及其它卤素,可以选择为改变存在于BDO和/或4-HB或任何BDO和/或4-HB途径中间体中的原子的同位素分布。如上列举的各种碳原料和其他摄取来源,将在本申请中统称为“摄取源”。摄取源可以为任何存在于产物BDO和/或4-HB或任何BDO和/或4-HB途径中间体中的原子,或为偏离BDO和/或4-HB途径的反应中产生的副产物,提供同位素富集。可以在任何目标原子中实现同位素富集,例如,碳,氢,氧,氮,硫,磷,氯或其它卤素。这同样适用于本申请所提供的MMPs和FAPs,及其中间体。在一些实施例中,可以选择摄取源以改变碳-12,碳-13,碳-14的比率。在一些实施例中,可以选择摄取源,以改变氧-16,氧-17和氧-18的比率。在一些实施例中,可以选择摄取源,以改变氢,氘和氚比率。在一些实施例中,可以选择摄取源,以改变氮-14和氮-15的比率。在一些实施例中,可以选择摄取源,以改变硫-32,硫-33,硫-34,以及硫-35的比率。在一些实施例中,可以选择摄取源,以改变磷-31,磷-32,磷-33的比率。在一些实施例中,可以选择摄取源,以改变氯-35,氯-36,和氯-37的比率。在一些实施例中,目标原子的同位素比率可以通过选择一个或多个摄取源来改变为所需的比例。摄取源可以从天然来源得到,如在自然界中发现,或从人造来源得到,且本领域技术人员可以选择天然来源,人造来源,或其组合,已得到所需的目标原子同位素比率。人造摄取源的一个例子包括,例如,至少部分衍生自化学合成反应的摄取来源。这种同位素富集的摄取来源,可商购获得,或在实验室中制备和/或可选地与天然来源的摄取源混合,以获得所需的同位素比率。在一些实施例中,可以通过选择自然界中存在的摄取源的期望来源,来得到摄取源的目标同位素比率。例如,如本申请所讨论的,天然来源可以是从生物有机体或来源(例如基于石油的产品或大气)衍生或合成得到的生物基。在一些所述实施例中,碳的来源,例如,可以来自化石燃料碳源(其碳-14可以相对贫乏),或环境或大气碳源,如二氧化碳,其可具有比其石油衍生对应物更多的碳-14。同位素富集容易通过使用本领域中已知的技术进行质谱分析法评估,如稳定同位素比率质谱法(SIRMS)和核磁共振位点特异性天然同位素分馏(SNIF-NMR)。所述质谱技术可以与分离技术例如液相色谱(LC)和/或高效液相色谱(HPLC)组合使用。不稳定的碳同位素碳-14或放射性碳,在地球大气层中每1012个碳原子中占1个,并且具有5700年的半衰期。上层大气中因涉及宇宙射线和普通氮(14N)的核反应而充满碳储量。化石燃料不含有碳-14,因其早已衰减。化石燃料的燃烧降低了大气中的碳-14比率,即所谓的“休斯效应”。确定化合物中的原子同位素比率的方法是本领域技术人员公知的。同位素富集很容易通过本领域已知技术来进行质谱分析评估,例如加速质谱分析(AMS),稳定同位素比率质谱分析(SIRMS)和核磁共振位点特异性天然同位素分馏(SNIF-NMR)。所述质谱技术可以与分离技术例如液相色谱(LC)和/或高效液相色谱(HPLC)组合使用。对于碳的情形,在美国,美国测试和材料国际协会(ASTM)开发了ASTMD6866作为使用放射性碳年代测定法确定固体、液体和气体样品中的生物基含量的标准化分析方法。该标准是基于使用放射性碳年代测定来测定产物的生物基含量。ASTMD6866首次发表于2004年,该标准的当前有效版本是ASTMD6866-11(2011年4月1日起有效)。放射性碳年代测定技术,包括本申请所述的部分,是本领域技术人员众所周知的。化合物的生物基含量由碳-14(14C)与碳-12(12C)的比率估算。具体而言,现代分数(FractionModern,Fm)从以下表达式计算所得:Fm=(S-B)/(M-B),其中B,S和M分别代表空白对照、样品和现代参照的14C/12C比率。现代分数是对样品与“现代(Modern)”的14C/12C比率偏差的量度。“现代”定义为国家标准局(NBS)草酸(即标准参照材料(SRM)4990b)的放射性碳浓度归一化为δ13CVPDB=-19‰(Olsson,TheuseofOxalicacidasaStandard.in,RadiocarbonVariationsandAbsoluteChronology,NobelSymposium,12thProc.,JohnWiley&Sons,NewYork(1970))的95%。质谱分析结果,例如,由ASM测量的结果,使用所述国际公认的定义法,以0.95乘以NBS草酸I(SRM4990b)的比活性归一化至δ13CVPDB=-19‰的比活性。这相当于绝对(AD1950)14C/12C比率为1.176±0.010x10-12(Karlenetal.,ArkivGeofysik,4:465-471(1968))。该标准计算考虑到了一种同位素相对于另一种同位素的摄取差别,例如,生物系统中优选摄取的顺序为C12>C13>C14,且所述修正反映的是经过对δ13的修正的Fm。草酸标准(SRM4990b或HOx1)以1955年的甜菜作物制成。虽然制作了1000磅,但该草酸标准无法再商购获得。草酸II标准(HOx2;N.I.S.T命名为SRM4990C)是从1977年法国甜菜糖蜜作物制成。在80年代初,一个12个实验室的团队测量了两个标准的比例。草酸II与1的活性比率为1.2933±0.001(加权平均)。HOxII的同位素比率是-17.8‰。ASTMD6866-11建议使用可用的草酸II标准SRM4990C(Hox2)作为现代标准(参见Mann,Radiocarbon,25(2):519-527(1983)中对原始vs.当前可用的草酸标样的讨论)。Fm=0%表示材料中完全缺乏碳-14原子,从而表明是化石(例如,石油基)碳源。Fm=100%(经过对1950年后从核弹试验注入大气层中的碳-14的修正后)表示完全是现代碳源。如本申请中所述,所述“现代”源包括生物基源。如ASTMD6866中所述,现代碳百分比(pMC)可以大于100%,因为50年代的核试验项目逐渐减弱的持续影响,其导致了大气中相当大的碳-14富集,如ASTMD6866-11所述。因为所有样品碳-14的活性均参照“核弹以前”的标准,且因为几乎所有新的生物基产物均在核弹后环境中产生的,所有的pMC值(修正同位素比率之后)必须乘以0.95(自2010年起),以更好地反映样品的真实生物基含量。高于103%的生物基含量,表明要么发生了分析错误,要么生物基碳的来源来自数年之前。ASTMD6866相对于材料的总有机含量来量化生物基,而不考虑无机碳及其它不含碳物质的存在。例如,一种50%淀粉基材料和50%水的产物,根据ASTMD6866,可认为其生物基含量=100%(含100%生物基的50%有机含量)。在另一实施例中,一种50%淀粉基材料、25%石油基和25%水的产物的生物基含量=66.7%(有机含量75%,但只有50%产物是生物基)。在另一实施例中,一种50%有机碳且基于石油的产物将被认为具有生物基含量=0%(50%的有机碳,但来自化石来源)。因此,根据用于确定化合物或材料的生物基含量的已知方法和已知标准,本领域技术人员可以容易地确定生物基含量和/或制备具有所期望的生物基含量的下游产物。碳-14年代测定技术用于量化材料的生物基含量,是本领域中公知的(Currieetal.,NuclearInstrumentsandMethodsinPhysicsResearchB,172:281-287(2000))。例如,碳-14年代测定已用于量化含对苯二酸酯的材料的生物基含量(Colonnaetal.,GreenChemistry,13:2543-2548(2011))。值得注意的是,来自可再生1,3-丙二醇和石油衍生的对苯二甲酸的聚对苯二甲酸丙二酯(PPT)聚合物,使得Fm值接近30%(即,由于聚合物碳的3/11来自可再生1,3-丙二醇且8/11来自化石来源的对苯二甲酸)(Currieetal.,同上,2000)。与此相反,来自可再生BDO和可再生对苯二甲酸的聚对苯二甲酸丁二醇酯聚合物,得到的生物基含量超过90%(Colonnaetal.,同上,2011)。因此,在一些实施例中,提供了BDO和/或4-HB或BDO和/或其4-HB途径中间体,其具有的碳-12、碳-13、碳-14比率反映着大气中的碳(也称环境碳)摄取来源。例如,在一些方面中,BDO和/或4-HB或BDO和/或4-HB中间体的Fm值可以是至少10%,至少15%,至少20%,至少25%,至少30%,至少35%,至少40%,至少45%,至少50%,至少55%,至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少95%,至少98%或多达100%。在一些所述实施例中,摄取源是CO2。在一些实施例中,提供了BDO和/或4-HB或BDO和/或其4-HB途径中间体,其具有的碳-12、碳-13、碳-14比率反映着基于石油的碳摄取源。在这个方面,BDO和/或4-HB或BDO和/或4-HB中间体的Fm值可以是小于95%,小于90%,小于85%,小于80%,小于75%,小于70%,小于65%,小于60%,小于55%,小于50%,小于45%,小于40%,小于35%,小于30%,小于25%,小于20%,小于15%,小于10%,小于5%,小于2%或小于1%。在一些实施例中,提供了BDO和/或4-HB或BDO和/或其4-HB途径中间体,其具有的碳-12、碳-13、碳-14比率来自大气碳摄取源和基于石油的碳摄取源的组合。使用所述摄取源的组合,是所述碳-12,碳-13,碳-14比率可能变化的一种方式,且各自的比率将反映出摄取来源的比例。此外,本公开部分涉及,如本申请所公开地生物生产BDO和/或4-HB或BDO和/或4-HB中间体,以及由此衍生的产物,其中所述BDO和/或4-HB或BDO和/或4-HB中间体的碳-12,碳-13,碳-14同位素比率与环境CO2具有大约相同的值。例如,在一些方面中,提供生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB中间体,其具有的碳12:碳13:碳14同位素比率与环境CO2的值大约相同,或是本申请所公开的任何其它比例。据了解,如本申请所公开的,产物可以具有的碳12:碳13:碳14同位素比率与环境CO2的值大约相同,或是本申请所公开的任何其它比例,其中该产物产生自本申请所公开的生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB中间体,其中所述生物衍生产物经过化学修饰以产生最终产物。化学修饰BDO和/或4-HB或其中间体的生物衍生产物,以产生所需产物的方法,是本领域技术人员公知的技术,如本申请所述。还提供了塑料,弹性纤维,聚氨酯,聚酯,包括聚羟基脂肪酸酯,如聚-4-羟基丁酸酯(P4HB)或其共聚物,聚(四亚甲基醚)二醇(PTMEG)(也称为PTMO,聚氧化四亚甲基)和聚氨酯-聚脲共聚物,称为氨纶、弹性纤维或者LycraTM(莱卡),尼龙等,具有的碳12:碳13:碳14同位素比率与环境CO2的值大约相同,其中塑料,弹性纤维,聚氨酯,聚酯,包括聚羟基脂肪酸酯如P4HB或其共聚物,PTMEG和聚氨酯-聚脲共聚物(称为氨纶),弹性纤维或者LycraTM,尼龙等,是直接产生或与如本申请所公开的生物衍生BDO和/或4-HB或生物衍生BDO和/或4-HB中间体共同产生。本领域技术人员能够理解,可以改造生物体,令其在碳源(例如单独的甲醇或甲醇与其他碳水化合物的组合)上生长时,分泌生物合成化合物。所述化合物包括,例如,BDO和任何BDOP中间代谢物。所需要的只是对一个或多个所需的酶或蛋白质的活性进行改造,以得到所需的化合物或其中间体的生物合成,包括,例如,包括部分或全部的BDO生物合成途径。因此,本申请提供的是一种生物体,其在碳水化合物或其他碳源上生长时生产和/或分泌BDO和/或在碳水化合物或其他碳源上生长时生产和/或分泌任何在BDOP中所示的中间代谢物。本申请所提供的生产BDO的微生物有机体可从中间体开始合成。这同样适用于甲醛同化作用中的中间体。在一个实施例中,所述碳源是甲醇或甲酸盐。在某些实施例中,使用甲醇作为碳源。在一个实施例中,碳源是甲醇或甲酸盐。在其他实施例中,使用甲酸作为碳源。在具体的实施例中,在本申请所述的生物体中,单独使用甲醇作为碳源,或与本申请所提供的产物途径相互组合。在一个实施例中,所述碳源包括甲醇和糖(例如,葡萄糖)或含糖的生物质。在另一个实施例中,所述碳源包括甲酸盐和糖(例如,葡萄糖)或含糖的生物质。在一个实施例中,所述碳源包括甲醇,甲酸盐和糖(例如,葡萄糖)或含糖的生物质。在具体的实施例中,在发酵原料中,提供甲醇或甲酸盐或两者与糖(例如,葡萄糖)或含糖生物质的混合物。在某些实施例中,所提供的糖用于菌株充分生长。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为200:1至1:200。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为100:1至1:100。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为100:1至5:1。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为50:1至5:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为100:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为90:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为80:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为70:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为60:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为50:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为40:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为30:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为20:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为10:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为5:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为2:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:100。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:90。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:80。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为对的1:70。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:60。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:50。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:40。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:30。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:20。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:10。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:5。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇:糖为1:2。在上面提供的比率的某些实施例中,所述糖是含糖的生物质。在某些实施例中,碳源包括甲酸盐和糖(例如,葡萄糖)。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为200:1至1:200。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为100:1至1:100。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为100:1至5:1。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为50:1至5:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为100:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为90:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为80:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为70:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为60:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为50:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为40:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为30:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为20:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为10:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为5:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为2:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:100。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:90。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:80。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为对的1:70。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:60。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:50。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:40。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:30。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:20。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:10。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:5。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲酸盐:糖为1:2。在上面提供的比率的某些实施例中,所述糖是含糖的生物质。在某些实施例中,所述碳源包括甲醇和甲酸盐的混合物和糖(例如,葡萄糖)。在某些实施例中,所提供的糖用于菌株充分生长。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为200:1至1:200。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为100:1至1:100。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为100:1至5:1。在一些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为50:1至5:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为100:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为90:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为80:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为70:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为60:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为50:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为40:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为30:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为20:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为10:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为5:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为2:1。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:1。在某些实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:100。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:90。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为以1:80。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:70。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:60。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:50。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:40。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:30。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:20。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:10。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:5。在一个实施例中,所提供的糖(例如葡萄糖)的摩尔浓度比为甲醇和甲酸盐:糖为1:2。在上面提供的比率的某些实施例中,所述糖是含糖生物质。1.一种工程细胞,(a)所述工程细胞表达与对应醇脱氢酶相比包含至少一个氨基酸置换的非天然的NAD+-依赖性醇脱氢酶,且与表达未包含氨基酸置换的所述对应醇脱氢酶的工程细胞相比,能够将甲醇或乙醇向甲醛或乙醛的转化分别提高到至少两倍;或者,(b)所述工程细胞表达包含至少一个氨基酸置换的非天然NAD+-依赖性醇脱氢酶的第一序列,且与表达非天然NAD+-依赖性醇脱氢酶的第二序列的工程细胞相比,能够将将甲醇或乙醇向甲醛或乙醛的转化分别提高到至少两倍,其中所述第一序列和第二序列之间的差异在于所述至少一个氨基酸置换。2.根据实施例1所述的工程细胞,其特征在于,进一步包含一个或多个代谢途径的转基因,所述转基因编码促进目标产物或其中间体的生产的代谢途径蛋白质。3.根据实施例1或2所述的工程细胞,其特征在于,所述非天然醇脱氢酶的表达,提供了用于增加目标产物的还原当量,和/或用于增加从所述甲醛到目标产物的碳固定的还原当量。4.根据前述实施例中任一实施例所述的工程细胞,其特征在于,还包括编码酶的转基因,所述酶将所述甲醛转化为甲酸盐,由此产生用于生产所述目标产物和/或用于进行将甲酸盐的碳固定到所述目标产物的还原当量。5.根据前述实施例任一项所述的工程细胞,其特征在于,所述目标产物选自二醇、1,4-丁二醇、1,3-丁二醇、丁二烯、琥珀酸盐、己二酸、HMDA,6-氨基己酸(6ACA)或其中间体化合物。6.根据前述实施例任一项所述的工程细胞,其特征在于,所述工程细胞进一步包含一种或多种醇代谢途径的基因,所述基因编码选自以下的蛋白:a)甲酸脱氢酶(EM8),甲醛激活酶(EM10),甲醛脱氢酶(EM11),S-(羟甲基)谷胱甘肽合成酶(EM12),谷胱甘肽依赖性甲醛脱氢酶(EM13),S-甲酸谷胱甘肽水解酶(EM14),甲酸盐氢裂解酶(EM15)和氢化酶(EM16)。7.根据前述实施例任一项所述的工程细胞,其特征在于,所述工程细胞进一步包含一种或多种醇代谢途径的基因,所述基因编码选自以下的蛋白:琥珀酰-CoA还原酶(醛形成型)(EB3),4-羟基丁酸酯(4-HB)脱氢酶(EB4),4-HB激酶(EB5),磷酸转-4-羟基丁酰酶(EB6),4-羟基丁酰-CoA还原酶(醛形成型)(EB7),1,4-丁二醇脱氢酶(EB8);琥珀酸还原酶(EB9),琥珀酰-CoA还原酶(醇形成型)(EB10),4-羟基丁酰-CoA转移酶(EB11),4-羟基丁酰-CoA合成酶(EB12),4-HB还原酶(EB13),和4-羟基丁酰-CoA还原酶(醇形成型)(EB15),琥珀酰-CoA转移酶(EB1),以及琥珀酰-CoA合成酶(EB2A)。8.包含前述实施例任一项所述的细胞或其细胞提取物的组合物。9.根据实施例8所述的组合物,其特征在于,所述组合物是细胞培养组合物,且可选地包含目标产物或其中间体。10.包含前述实施例任一项所述的细胞所生产的目标产物或其中间体的细胞培养组合物。11.包含前述实施例任一项所述的细胞所生产的目标产物或其中间体的组合物,可选地包括细胞碎片和/或剩余培养基。12.根据实施例11所述的组合物,其特征在于,包含的目标产物或其中间体在所述组合物中的纯度至少为50%,60%,70%,80%,90%,95%,96%,97%,98%,99%或99.9%。13.根据实施例11或12所述的组合物,其特征在于,其包含可检测痕量的编码所述非天然NAD+-依赖性醇脱氢酶的核酸,或可检测痕量的在不表达所述非天然NAD+-依赖性醇脱氢酶的、在所述对应原始细胞中未生产的代谢途径中间体或产物。14.根据实施例11所述的组合物,其特征在于,所述代谢途径中间体或产物是4-羟基丁酸酯(4-HB)和1,3-丙二醇(1,3-PDO)。15.根据实施例14所述的组合物,其特征在于,其包括含量在70-90%(体积/体积)范围内的1,4-丁二醇或1,3-丁二醇和含量在10-30%(体积/体积)范围内的水。16.用于提高甲醇或乙醇向甲醛或乙醛的分别转化的方法,包括步骤(a)在含有甲醇或乙醇的培养基中,培养表达相对于对应醇脱氢酶而包含至少一个氨基酸置换的NAD+-依赖性非天然醇脱氢酶的工程细胞,其中,在对所述细胞的所述培养中,与表达未包含氨基酸置换的所述对应醇脱氢酶的工程细胞相比,提供的甲醇或乙醇向甲醛或乙醛的分别转化提高到至少两倍。17.用于提高甲醇或乙醇分别向甲醛或乙醛的方法,包括步骤(a):提供pH在6-8的范围内的反应组合物,所述组合物包括相对于对应醇脱氢酶而包含至少一个氨基酸置换的NAD+-依赖性非天然醇脱氢酶和甲醇或乙醇,其中,在所述组合物中,与未包含氨基酸置换的所述对应醇脱氢酶相比,所述NAD+-依赖性非天然醇脱氢酶提供的甲醇或乙醇向甲醛或乙醛的分别转化提高到至少两倍。18.一种核酸,其编码相对于对应醇脱氢酶而包含至少一个氨基酸置换的NAD+-依赖性非天然醇脱氢酶,所述NAD+-依赖性非天然醇脱氢酶在细胞中表达时,与未包含氨基酸置换的所述对应醇脱氢酶相比,能够使甲醇或乙醇向甲醛或乙醛的分别转化提高到至少两倍。19.包括如实施例18所述核酸的表达构建体。20.相对于对应醇脱氢酶而包含至少一个氨基酸置换的NAD+-依赖性非天然醇脱氢酶,所述NAD+-依赖性非天然醇脱氢酶在细胞中表达时,与未包含氨基酸置换的所述对应醇脱氢酶相比,能够使甲醇或乙醇向甲醛或乙醛的分别转化提高到至少两倍。21.根据前述实施例任一项所述的主题,其特征在于,所述甲醇转化为甲醛。22.根据前述实施例任一项所述的主题,其特征在于,与表达未包含氨基酸置换的所述对应醇脱氢酶的工程细胞相比,所述非天然醇脱氢酶能够在体内使甲醇或乙醇向甲醛或乙醛的分别转化提高到至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或至少11倍。23.根据前述实施例任一项所述的主题,其特征在于,与表达未包含氨基酸置换的所述对应醇脱氢酶的工程细胞相比,所述非天然醇脱氢酶能够在体外使甲醇或乙醇向甲醛或乙醛的分别转化提高到至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍或至少11倍。24.根据前述实施例任一项所述的主题,其特征在于,与未包含氨基酸置换的所述对应醇脱氢酶相比,所述非天然醇脱氢酶能够分别使甲醇或乙醇向甲醛或乙醛的转化提高到2倍到12倍、2倍到11倍、2倍到10倍、2倍到9倍、2倍到8倍、2倍到7倍、2倍到6倍、2倍到5倍、或2倍到4倍。25.相对于对应醇脱氢酶而包含至少一个氨基酸置换的NAD+-依赖性非天然醇脱氢酶,其对于甲醇向甲醛转化的催化效率(kcat/Km)为8.6X10-4或以上。26.根据前述实施例任一项所述的主题,其特征在于,包括激活蛋白,所述激活蛋白为ActNudix水解酶。27.用于生产目标产物或其中间体的方法,包括:在包含甲醇或乙醇的培养基中,培养如实施例1-7中任一项所述的工程细胞,以生产所述目标产物(TP)或其中间体。28.根据实施例27所述的方法,其特征在于,还包括分离或纯化目标产物(TP)或其中间体(INT)的步骤。29.根据实施例28所述的方法,其特征在于,所述分离或纯化的步骤,包括以下各项中的一种或多种:连续液-液萃取,渗透蒸发,蒸发,过滤,膜过滤(包括反渗透,纳米过滤,超滤和微滤),膜渗滤,膜分离,反渗透,电渗析,蒸馏,萃取蒸馏,反应性蒸馏,共沸蒸馏,结晶和重结晶,离心,萃取过滤,离子交换层析,尺寸排阻层析,吸附层析,碳吸附,氢化和超滤。30.根据实施例29所述的方法,其特征在于,选自以下各组:(a)目标产物:1,4-丁二醇,纯化:蒸馏;(b)目标产物:1,3-丁二醇,纯化:蒸馏;(c)目标产物:丁二烯,纯化:蒸馏;(d)目标产物:6-氨基己酸,纯化:结晶,(a)目标产物:己内酰胺,纯化:蒸馏作为最后步骤;(e)目标产物:己撑二胺(HMDA),纯化:结晶;(f)目标产物:己二酸,纯化:结晶(己二酸晶体);(g)目标产物:巴豆醇,纯化:蒸馏(h)目标产物:甲基乙烯基甲醇,纯化:蒸馏;(i)目标产物:琥珀酸-结晶(琥珀酸晶体);(j)目标产物:正丙醇,纯化:蒸馏;(k)目标产物:异丙醇,纯化:蒸馏;(l)目标产物:丙烯,纯化:蒸馏;(m)目标产物:甲基丙烯酸,纯化:结晶,蒸馏或萃取,(n)目标产物:甲基丙烯酸甲酯(MMA)或另一种酯,纯化:蒸馏或结晶。31.根据实施例31所述的方法,其特征在于,所述分离或纯化的步骤进一步包括蒸馏。32.根据实施例28-31中任一项所述的方法,其特征在于,所述目标产物是二醇。33.根据实施例28-32中任一项所述的方法,其特征在于,所述目标产物是二醇是1,4-丁二醇或1,3-丁二醇。34.根据实施例28-32中任一项所述的方法,其特征在于,包括:将所述目标产物纯化至在组合物中的纯度为至少50%,60%,70%,80%,90%,95%,96%,97%,98%,99%或99.9%。35.用于制备聚合物的方法,包括:获得由如实施例1-7任一项所述的工程细胞或如实施例27-34中任一项所述的方法所生产的目标产物,并将所述目标产物进行聚合,可选地与一种或多种其他单体化合物进行聚合,以提供聚合产物。36.根据实施例35所述的方法,其特征在于,进一步包括分离或纯化所述聚合产物的步骤。37.根据实施例35或36所述的方法,其特征在于,包括:将所述聚合产物纯化至在组合物中的纯度为至少50%,60%,70%,80%,90%,95%,96%,97%,98%,99%或99.9%。38.根据实施例35-37中任一项所述的方法所制备的聚合物。39.根据实施例38所述的聚合物,其特征在于,所述聚合物是均聚物或共聚物。40.根据实施例39所述的聚合物,其特征在于,所述聚合物选自聚对苯二甲酸丁二醇酯(PBT)和聚丁二酸丁二醇酯(PBS)。41.包括含有如实施例38-40中任一项所述的聚合物的共混聚合物的组合物。42.包括如实施例38-41中任一项所述的聚合物或组合物的制品。43.根据实施例42所述的制品,其特征在于,所述制品为塑料制品。44.根据实施例17d或17e所述的制品,其特征在于,所述制品是从实施例41-43中任一项所述的聚合物或组合物经模制、挤制或成型而获得的。45.生物基产物,其包括由如实施例1-7中任一项所述的工程细胞所生产的目标产物或如实施例38-40中任一项所述的聚合物,其中,所述生物基产物是(i)聚合物,THF或THF衍生物,或GBL或GBL衍生物;(ii)塑料,弹性纤维,聚氨酯,聚酯,聚羟基脂肪酸酯,聚-4-HB,聚-4-HB的共聚物,聚(四亚甲基醚)二醇,聚氨酯-聚脲共聚物,氨纶,弹性纤维,LycraTM,或尼龙;(ⅲ)聚合物,树脂,纤维,珠,颗粒,丸,片,塑料,聚酯,热塑性聚酯,模塑制品,注模制品,注模部件,汽车部件,挤制型树脂,电气部件和外壳;且可选地,其中所述生物基产物是增强或填充型,及进一步地,其中所述生物基产物是玻璃增强或填充型或矿物增强或填充型;(iv)聚合物,其中该聚合物包括聚对苯二甲酸丁二醇酯(PBT);(ⅴ)聚合物,其中所述聚合物包含PBT,其所述生物基产物是树脂,纤维,珠,颗粒,丸,片,塑料,聚酯,热塑性聚酯,模塑制品,注模制品,注模部件,汽车部件,挤制型树脂,电气部件和外壳;且可选地,其中所述生物基产物是增强或填充型,及进一步地,其中所述生物基产物是玻璃增强或填充型或矿物增强或填充型;(ⅵ)THF或THF衍生物,其中所述THF衍生物是聚四亚甲基醚二醇(PTMEG),聚酯醚(COPE),或热塑性聚氨酯;(ⅷ)THF衍生物,其中所述THF衍生物包括纤维;或(ⅸ)GBL或GBL衍生物,其中所述GBL衍生物是吡咯烷酮;其中,所述生物基产物可选地包括至少5%,至少10%,至少20%,至少30%,至少40%或至少50%的生物衍生BDO;和/或其中所述生物基产物可选地包括所述生物衍生BDO的一部分作为重复单元。46.根据实施例10所述的生物基产物经过模制而获得的模制产物。47.用于生产如实施例45所述的生物基产物的方法,其包括:令所述生物衍生BDO与自身或另一种化合物,在产生所述生物基产物的反应中进行化学反应。48.包含如实施例45所述的生物衍生BDO的聚合物,或由如实施例45所述的生物衍生BDO转化而来的聚合物。49.用于生产聚合物的方法,包括:通过化学或酶促转化,将根据实施例45所述的生物衍生BDO转化为聚合物。50.包含实施例45所述的生物衍生BDO或其细胞裂解物或培养物上清液的组合物。51.用于生产可在生物质形成中使用的糖酵解中间体和/或代谢途径中间体的方法,包括:在条件和足够时间下培养如实施例1-7中任一项所述的工程细胞,以产生所述中间体,并且可选地,其中,消耗所述中间体,以用于提供还原当量或用于合成到BDO或目标产物中。52.根据实施例51所述的方法,其中所述生物体是在包括生物质,葡萄糖,木糖,阿拉伯糖,半乳糖,甘露糖,果糖,蔗糖,淀粉,甘油,甲醇,二氧化碳,甲酸盐,甲烷或其任意组合作为碳源的培养基中培养的。53.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶与选自以下各项的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高:选自1(MDHMGA3_17392),EIJ77596.1,AAA22593.1,EIJ77618.1,EIJ78790.1,EIJ80770.1,EIJ78397.1,EIJ83020.1,EFI69743.1,YP_004860127.1,YP_001699778.1,ZP_11313277.1,ZP_05587334.1,YP_004681552.1,AGF87161,YP_002138168.1,YP_359772.1,YP_001343716.1,ZP_16224338.1,AAC45651.1,YP_007491369.1,YP_002434746,YP_005052855,NP_561852.1,YP_001447544,YP_001113612.1,YP_011618,ZP_01220157.1,YP_003990729.1,ZP_07335453.1,NP_717107,YP_003310546.1,ZP_10241531.1,YP_001337153.1,YP_026233.1,YP_694908,YP_725376.1,YP_001663549,EKC54576,YP_001126968.1的NAD+-依赖性醇脱氢酶模板,或具有所述脱氢酶活性且具有氨基末端缺失、羧基末端缺失、或两者皆缺失的所述模板的片段,所述片段与所述模板的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高。54.根据前述实施例任一项所述的主题,其特征在于,所述模板选自EIJ77596.1,EIJ78397.1,EFI69743.1,YP_001699778.1,YP_002138168.1,YP_359772.1,YP_005052855,NP_561852.1,YP_001447544,ZP_01220157.1,YP_003990729.1,ZP_10241531.1和YP_026233.1。55.根据前述实施例任一项所述的主题,其特征在于,所述醇脱氢酶是甲醇脱氢酶。56.根据实施例55所述的主题,其特征在于,所述甲醇脱氢酶来自细菌。57.根据实施例56所述的主题,其特征在于,所述甲醇脱氢酶来自杆菌。58.根据实施例57所述的主题,其特征在于,所述甲醇脱氢酶来自甲醇芽孢杆菌(BacillusmethanolicusMGA3)MGA3或甲醇芽孢杆菌(BacillusmethanolicusMGA3)PB1。59.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶与如实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且其中,所述脱氢酶包括一个或多个基于式R1XR2的氨基酸置换,其中所述R1是在所述模板的位置X上的原始氨基酸,且所述R2是在所述模板上对应于X的位置上置换R1的变体氨基酸,其中,所述XR2选自以下组(a)中的各项:(a)11T,38N,42Q,48D,53I,56K,60E,61A,63F,65Q,70N,71I,71T,71V,74S,81G,84R,86K,87K,94V,99P,99T,103V,106L,107S,108V,108W,109Y,112K,112R,115H,116F,117D,117Q,117Y,120H,120R,121A,121D,121E,121L,121M,121R,121S,121T,121V,121W,121Y,122A,122P,123D,123I,123L,123R,123Y,124I,124L,124R,125C,125G,125W,126G,126V,127C,127R,128A,128R,128S,129A,129M,129P,129S,130F,130I,130Y,134T,143T,145M,146N,147R,148A,148F,148G,148I,148T,148V,148W,149L,149M,149T,149V,150A,150I,152M,155V,157N,158E,158H,158K,158W,161A,161G,161Q,161S,161V,163F,163N,163Q,163T,164G,164N,165G,181R,184T,186M,190A,190S,199V,217K,226M,256C,267H,269S,270M,270S,270Y,296S,298H,300T,302V,312V,316V,323M,333L,336L,337C,343D,344A,344G,345E,350K,354M,355D,355I,355K,358G,360A,360G,360K,360R,360S,361N,361R,363K,和379M,或选自以下组(b)中的各项:(b)38N,60E,71I,71V,87K,99T,103V,107S,108V,108W,109Y,115H,116F,117D,117Q,121D,121E,121L,121M,121R,121S,121T,121V,121W,121Y,122P,123D,123I,123L,123R,123Y,124I,124L,125C,125G,125V,125W,126G,127C,127R,128A,128R,128S,129A,129M,129P,129S,129V,130F,130I,130Y,134T,143T,146N,149L,149M,149T,149V,150A,157N,158E,158H,158K,158W,163Q,164N,267H,270M,270S,270Y,345E,355D,360G,360K,360R,360S,和361R。60.根据实施例59所述的主题,其特征在于,XR2选自:107S,121D,123D,123I,123L,123R,123Y,129A,129M,129P,129S,129V,130F,130I,130Y,143T,146N,149L,149M,149T,149V,158E,158H,158K,158W,267H,270M,270S,270Y,355D,360G,360K,360R,和360S。61.根据实施例60所述的主题,其特征在于,所述R1XR2选自以下组(a)中的各项:(a)S11T,D38N,H42Q,E48D,N53I,E56K,D60E,V61A,I63F,P65Q,D70N,P71I,P71T,P71V,T74S,D81G,K84R,E86K,N87K,I94V,S99P,S99T,A103V,I106L,G107S,L108V,L108W,V109Y,N112K,N112R,R115H,I116F,N117D,N117Q,N117Y,Q120H,Q120R,G121A,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122A,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,S124R,V125C,V125G,V125W,E126G,E126V,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T145M,T146N,S147R,L148A,L148F,L148G,L148I,L148T,L148V,L148W,A149L,A149M,A149T,A149V,V150A,V150I,T152M,A155V,K157N,V158E,V158H,V158K,V158W,P161A,P161G,P161Q,P161S,P161V,I163F,I163N,I163Q,I163T,D164G,D164N,E165G,K181R,A184T,L186M,T190A,T190S,I199V,Q217K,L226M,G256C,Q267H,G269S,G270M,G270S,G270Y,T296S,R298H,A300T,I302V,G312V,A316V,I323M,F333L,P336L,S337C,G343D,V344A,V344G,K345E,E350K,K354M,N355D,N355I,N355K,E358G,V360A,V360G,V360K,V360R,V360S,C361N,C361R,Q363K,和K379M;或选自以下组(b)中的各项:(b)D38N,D60E,P71I,P71V,N87K,S99T,A103V,G107S,L108V,L108W,V109Y,R115H,I116F,N117D,N117Q,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,V125C,V125G,V125W,E126G,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T146N,A149L,A149M,A149T,A149V,V150A,K157N,V158E,V158H,V158K,V158W,I163Q,D164N,Q267H,G270M,G270S,G270Y,K345E,N355D,V360G,V360K,V360R,V360S,和C361R。62.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶与根据实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且包括如组(a)或组(b)所示的氨基酸位置号的所有位置上未置换的原始氨基酸:(a)11,38,42,48,53,56,60,61,63,65,70,71,74,81,84,86,87,94,99,103,106,107,108,109,112,115,116,117,117,120,121,122,123,124,125,126,127,128,129,130,134,143,145,146,147,148,149,150,152,155,157,158,161,163,164,165,181,184,186,190,199,217,226,256,267,269,270,296,298,300,302,312,316,323,333,336,337,343,344,345,350,354,355,358,360,361,363和379;或(b)38,60,71,87,99,103,107,108,109,115,116,117,121,122,123,124,125,126,127,128,129,130,134,143,146,149,150,157,158,163,164,267,270,345,355,360,和361。63.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶与根据实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且包括在氨基酸位置号107,121,123,129,130,143,146,149,158,267,270,355,360的所有位置上未置换的原始氨基酸。64.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自以下(a)组或(b)组中的2、3、4、5、6、7、8、9、10、11或12个氨基酸置换:(a)S11T,D38N,H42Q,E48D,N53I,E56K,D60E,V61A,I63F,P65Q,D70N,P71I,P71T,P71V,T74S,D81G,K84R,E86K,N87K,I94V,S99P,S99T,A103V,I106L,G107S,L108V,L108W,V109Y,N112K,N112R,R115H,I116F,N117D,N117Q,N117Y,Q120H,Q120R,G121A,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122A,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,S124R,V125C,V125G,V125W,E126G,E126V,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T145M,T146N,S147R,L148A,L148F,L148G,L148I,L148T,L148V,L148W,A149L,A149M,A149T,A149V,V150A,V150I,T152M,A155V,K157N,V158E,V158H,V158K,V158W,P161A,P161G,P161Q,P161S,P161V,I163F,I163N,I163Q,I163T,D164G,D164N,E165G,K181R,A184T,L186M,T190A,T190S,I199V,Q217K,L226M,G256C,Q267H,G269S,G270M,G270S,G270Y,T296S,R298H,A300T,I302V,G312V,A316V,I323M,F333L,P336L,S337C,G343D,V344A,V344G,K345E,E350K,K354M,N355D,N355I,N355K,E358G,V360A,V360G,V360K,V360R,V360S,C361N,C361R,Q363K,和K379M;或(b)D38N,D60E,P71I,P71V,N87K,S99T,A103V,G107S,L108V,L108W,V109Y,R115H,I116F,N117D,N117Q,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,V125C,V125G,V125W,E126G,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T146N,A149L,A149M,A149T,A149V,V150A,K157N,V158E,V158H,V158K,V158W,I163Q,D164N,Q267H,G270M,G270S,G270Y,K345E,N355D,V360G,V360K,V360R,V360S和C361R。65.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自以下各项的一组氨基酸置换:(a)D70N,L148G,P161G,V360A;(b)D70N,L148G,V360A,C361N;(c)D70N,L148V,V150I,P161A,V360G;(d)D70N,L148V,V360G;(e)D70N,P161A,V360A;(f)D70N,P161V,V360G,C361N;(g)D70N,V150I,P161A,V360A;(h)D70N,V150I,P161V,V360G,C361N;(i)E48D,L148V,P161A,V360A;(j)L148G,P161A,V360A,C361N;(k)L148G,P161A,V360G;(l)L148G,P161A,V360G,C361N;(m)L148G,P161G,V360A;(n)L148G,P161G,V360G,C361N;(o)L148G,V360A,C361N;(p)L148G,V360G,C361N;(q)L148I,P161G,V360G;(r)L148I,P161V,V360G;(s)L148T,V150I,V360A;(t)L148T,V360G;(u)L148V,P161A,V360A;(v)L148V,V150I,P161A,V360A;(w)L148V,V150I,P161A,V360A,C361N;(x)L148V,V150I,P161A,V360G;(y)L148V,V150I,P161A,V360G,C361N;(z)L148V,V150I,P161A,V360G,C361N;(aa)L148V,V150I,P161G,V360A;(ab)L148V,V150I,P161V,V360G,C361N;(ac)L148W,P161A,V360A,C361N;(ad)N112K,S147R,P161A,V360A;(ae)P161A,Q217K,V360A,C361N;(af)P161A,V360A,C361N;(ag)P161A,V360G;(ah)P161V,E358G,V360G;(ai)P161V,V360A,C361N;(aj)L148W,P161A,V360A,C361N;(ak)N112K,S147R,P161A,V360A;(al)P161A,Q217K,V360A,C361N;(am)P161A,V360A,C361N;(an)P161A,V360G;(ao)P161V,E358G,V360G;(ap)P161V,V360A,C361N;(aq)P161V,V360G;(ar)P65Q,L148G,V150I,P161A,V360G,C361N;(as)S147R,L148A,V150I,P161A,V360G;(at)S147R,L148F,V150I,P161G,V360G;(au)S147R,L148V,P161G,V360A;(av)P161V,V360G;(aw)P65Q,L148G,V150I,P161A,V360G,C361N;(ax)S147R,L148A,V150I,P161A,V360G;(ay)S147R,L148F,V150I,P161G,V360G;(az)S147R,L148V,P161G,V360A;(aaa)S147R,L148V,P161V,V360G;(aab)S147R,L148V,V150I,P161A,C361N;(aac)S147R,L148V,V150I,P161G,V360G;(aad)S147R,P161A,V360A;(aae)S147R,P161A,V360A,C361N;(aaf)S147R,P161A,V360G;(aag)S147R,P161V,V360G;(aah)S147R,P161V,V360G,C361N;(aai)S147R,V150I,P161V,V360A;(aaj)S147R,V150I,V360A,C361N;(aak)T145M,L148I,V360G;(aal)V150I,I302V,V360G,C361N;(aam)V150I,P161A,C361N;(aan)V150I,P161G,V360A,C361N;(aao)V150I,P161G,V360G;(aap)V150I,P161G,V360G,C361N;(aaq)V150I,P161V,C361N;(aar)V150I,P161V,K354R,V360A,C361N;(aas)V150I,P161V,V360A,C361N;(aat)V150I,P161V,V360G,C361N;(aau)V150I,V360A,C361N;(aav)V150I,V360G;(aaw)S11T,T74S,G269S,V344A;(aax)K84R,I163T;(aay)V122A,I163N;(aaz)G107S,F333L;(aaaa)V129M,T152M,G343D;(aaab)I63F,N355K;(aaac)G107S,F333L;(aaad)E86K,S99T,A149V;(aaae)N53I,V158E;(aaaf)N355I,K379M;(aaag)H42Q,G107S;(aaah)Q120H,I163N;(aaai)A149V,I323M;(aaaj)G107S,F333L;(aaak)D164G,K181R;(aaal)A155V,R298H,N355D;(aaam)N123D,E165G;(aaan)I163F,L186M;(aaao)G121A,T296S;(aaap)I94V,S99P,N123I;(aaaq)E126V,V129M,V344G;(aaar)Q120R,S143T;(aaas)G256C,A316V;(aaat)P161Q,G312V;(aaau)L226M,A300T,V360A;(aaav)S337C,E350K,N355D,Q363K;(aaaw)D81G,V158E;(aaax)I106L,N117Y,E126V;(aaay)G107S,G121D;(aaaz)V61A,V158E;(aaaaa)N53I,V158E;(aaaab)N117Y,T190S;(aaaac)S124R,I199V;(aaaad)K354M,C361R;(aaaae)A184T,C361R;(aaaag)E56K,Q267H;(aaaag)S124R,E126G;(aaaah)T190A,N355K;(aaaai)P71T,F333L;(aaaaj)G107S,F333L;和(aaaak)N123I,P336L,(aaaal)D38D/A149V,(aaaam)D38N/V163V,(aaaan)D73D/L108V,(aaaao)G121R/P161S,和(aaaap)N112R/P161S。66.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自TNA和VTNAF(SEQIDNO:79)的序列基序。67.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自VEV和GVEVA(SEQIDNO:80)的序列基序。68.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自DIA,PDIAD(SEQIDNO:81),DVA,和PDVAD(SEQIDNO:82)的序列基序。69.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自EKC和QEKCD(SEQIDNO:83)的序列基序。70.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自STH和GSTHD(SEQIDNO:84)的序列基序。71.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自TVK和DTVKA(SEQIDNO:85)的序列基序。72.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自SLV,GVV,GWV,GLY,ISLVA(SEQIDNO:86),IGVVA(SEQIDNO:87),IGWVA(SEQIDNO:88),和IGLYA(SEQIDNO:89)的序列基序。73.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自HIN,RFN,RID,RIQ,GHIND(SEQIDNO:90),GRFND(SEQIDNO:91),GRIDD(SEQIDNO:92),和GRIQD(SEQIDNO:93)的序列基序。74.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自DVNSVEKPVV(SEQIDNO:94),EVNSVEKPVV(SEQIDNO:95),LVNSVEKPVV(SEQIDNO:96),MVNSVEKPVV(SEQIDNO:97),RVNSVEKPVV(SEQIDNO:98),SVNSVEKPVV(SEQIDNO:99),TVNSVEKPVV(SEQIDNO:100),VVNSVEKPVV(SEQIDNO:101),WVNSVEKPVV(SEQIDNO:102),YVNSVEKPVV(SEQIDNO:103),GPNSVEKPVV(SEQIDNO:104),GVDSVEKPVV(SEQIDNO:105),GVISVEKPVV(SEQIDNO:106),GVLSVEKPVV(SEQIDNO:107),GVRSVEKPVV(SEQIDNO:108),GVYSVEKPVV(SEQIDNO:109).GVNIVEKPVV(SEQIDNO:110),GVNLVEKPVV(SEQIDNO:111),GVNSCEKPVV(SEQIDNO:112),GVNSGEKPVV(SEQIDNO:113),GVNSWEKPVV(SEQIDNO:114),GVNSVGKPVV(SEQIDNO:115),GVNSVECPVV(SEQIDNO:116),GVNSVERPVV(SEQIDNO:117),GVNSVEKAVV(SEQIDNO:118).GVNSVEKRVV(SEQIDNO:119).GVNSVEKSVV(SEQIDNO:120).GVNSVEKPAV(SEQIDNO:121).GVNSVEKPMV(SEQIDNO:122).GVNSVEKPPV(SEQIDNO:123).GVNSVEKPSV(SEQIDNO:124).GVNSVEKPVF(SEQIDNO:125).GVNSVEKPVI(SEQIDNO:126),和GVNSVEKPVY(SEQIDNO:127)的序列基序。75.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自TETT(SEQIDNO:128),SETN(SEQIDNO:129),GTETTS(SEQIDNO:130),和GSETNS(SEQIDNO:131)的序列基序。76.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自LLVI(SEQIDNO:132),LMVI(SEQIDNO:133),LTVI(SEQIDNO:134),LVVI(SEQIDNO:135),和LAAI(SEQIDNO:136)的序列基序。77.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自NVKMPVID(SEQIDNO:137),KEKMPVID(SEQIDNO:138),KHKMPVID(SEQIDNO:139),KKKMPVID(SEQIDNO:140),KWKMPVID(SEQIDNO:141),KVKMPVQD(SEQIDNO:142),和KVKMPVIN(SEQIDNO:143)的序列基序。78.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自HVGG(SEQIDNO:144),QVGM(SEQIDNO:145),QVGS(SEQIDNO:146),和QVGY(SEQIDNO:147)的序列基序。79.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自VEE和GVEEE(SEQIDNO:148)的序列基序。80.根据前述实施例任一项所述的主题,其特征在于,所述非天然醇脱氢酶包括选自DAYEDVC(SEQIDNO:149),NAYEDGC(SEQIDNO:150),NAYEDKC(SEQIDNO:151),NAYEDRC(SEQIDNO:152),NAYEDSC(SEQIDNO:153),和NAYEDVR(SEQIDNO:154)的序列基序。81.一种核酸,其编码如实施例53-80中任一项所述的非天然醇脱氢酶。82.一种非天然醇脱氢酶,其与选自以下各项的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高:选自SEQIDNO:1(MDHMGA3_17392),EIJ77596.1,AAA22593.1,EIJ77618.1,EIJ78790.1,EIJ80770.1,EIJ78397.1,EIJ83020.1,EFI69743.1,YP_004860127.1,YP_001699778.1,ZP_11313277.1,ZP_05587334.1,YP_004681552.1,AGF87161,YP_002138168.1,YP_359772.1,YP_001343716.1,ZP_16224338.1,AAC45651.1,YP_007491369.1,YP_002434746,YP_005052855,NP_561852.1,YP_001447544,YP_001113612.1,YP_011618,ZP_01220157.1,YP_003990729.1,ZP_07335453.1,NP_717107,YP_003310546.1,ZP_10241531.1,YP_001337153.1,YP_026233.1,YP_694908,YP_725376.1,YP_001663549,EKC54576,YP_001126968.1的NAD+-依赖性醇脱氢酶模板,或具有所述脱氢酶活性且具有氨基末端缺失、羧基末端缺失或两者皆缺失的所述模板的片段,所述片段与所述模板的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高。83.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述模板选自EIJ77596.1,EIJ78397.1,EFI69743.1,YP_001699778.1,YP_002138168.1,YP_359772.1,YP_005052855,NP_561852.1,YP_001447544,ZP_01220157.1,YP_003990729.1,ZP_10241531.1,和YP_026233.1。84.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶与如实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且其中,所述脱氢酶包括一个或多个基于式R1XR2的氨基酸置换,其中所述R1是在所述模板的位置X上的原始氨基酸,且所述R2是在所述模板上对应于X的位置上置换R1的变体氨基酸,其中,所述XR2选自以下组(a)中的各项:(a)11T,38N,42Q,48D,53I,56K,60E,61A,63F,65Q,70N,71I,71T,71V,74S,81G,84R,86K,87K,94V,99P,99T,103V,106L,107S,108V,108W,109Y,112K,112R,115H,116F,117D,117Q,117Y,120H,120R,121A,121D,121E,121L,121M,121R,121S,121T,121V,121W,121Y,122A,122P,123D,123I,123L,123R,123Y,124I,124L,124R,125C,125G,125W,126G,126V,127C,127R,128A,128R,128S,129A,129M,129P,129S,130F,130I,130Y,134T,143T,145M,146N,147R,148A,148F,148G,148I,148T,148V,148W,149L,149M,149T,149V,150A,150I,152M,155V,157N,158E,158H,158K,158W,161A,161G,161Q,161S,161V,163F,163N,163Q,163T,164G,164N,165G,181R,184T,186M,190A,190S,199V,217K,226M,256C,267H,269S,270M,270S,270Y,296S,298H,300T,302V,312V,316V,323M,333L,336L,337C,343D,344A,344G,345E,350K,354M,355D,355I,355K,358G,360A,360G,360K,360R,360S,361N,361R,363K,和379M,或选自以下组(b)中的各项:(b)38N,60E,71I,71V,87K,99T,103V,107S,108V,108W,109Y,115H,116F,117D,117Q,121D,121E,121L,121M,121R,121S,121T,121V,121W,121Y,122P,123D,123I,123L,123R,123Y,124I,124L,125C,125G,125V,125W,126G,127C,127R,128A,128R,128S,129A,129M,129P,129S,129V,130F,130I,130Y,134T,143T,146N,149L,149M,149T,149V,150A,157N,158E,158H,158K,158W,163Q,164N,267H,270M,270S,270Y,345E,355D,360G,360K,360R,360S,和361R。85.根据实施例82所述的非天然醇脱氢酶,其特征在于,XR2选自:107S,121D,123D,123I,123L,123R,123Y,129A,129M,129P,129S,129V,130F,130I,130Y,143T,146N,149L,149M,149T,149V,158E,158H,158K,158W,267H,270M,270S,270Y,355D,360G,360K,360R,和360S。86.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述R1XR2选自以下组(a)中的各项:(a)S11T,D38N,H42Q,E48D,N53I,E56K,D60E,V61A,I63F,P65Q,D70N,P71I,P71T,P71V,T74S,D81G,K84R,E86K,N87K,I94V,S99P,S99T,A103V,I106L,G107S,L108V,L108W,V109Y,N112K,N112R,R115H,I116F,N117D,N117Q,N117Y,Q120H,Q120R,G121A,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122A,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,S124R,V125C,V125G,V125W,E126G,E126V,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T145M,T146N,S147R,L148A,L148F,L148G,L148I,L148T,L148V,L148W,A149L,A149M,A149T,A149V,V150A,V150I,T152M,A155V,K157N,V158E,V158H,V158K,V158W,P161A,P161G,P161Q,P161S,P161V,I163F,I163N,I163Q,I163T,D164G,D164N,E165G,K181R,A184T,L186M,T190A,T190S,I199V,Q217K,L226M,G256C,Q267H,G269S,G270M,G270S,G270Y,T296S,R298H,A300T,I302V,G312V,A316V,I323M,F333L,P336L,S337C,G343D,V344A,V344G,K345E,E350K,K354M,N355D,N355I,N355K,E358G,V360A,V360G,V360K,V360R,V360S,C361N,C361R,Q363K,和K379M;或选自以下组(b)中的各项:(b)D38N,D60E,P71I,P71V,N87K,S99T,A103V,G107S,L108V,L108W,V109Y,R115H,I116F,N117D,N117Q,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,V125C,V125G,V125W,E126G,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T146N,A149L,A149M,A149T,A149V,V150A,K157N,V158E,V158H,V158K,V158W,I163Q,D164N,Q267H,G270M,G270S,G270Y,K345E,N355D,V360G,V360K,V360R,V360S,和C361R。87.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶与根据实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且包括如组(a)或组(b)所示的氨基酸位置号的所有位置上未置换的原始氨基酸:(a)11,38,42,48,53,56,60,61,63,65,70,71,74,81,84,86,87,94,99,103,106,107,108,109,112,115,116,117,117,120,121,122,123,124,125,126,127,128,129,130,134,143,145,146,147,148,149,150,152,155,157,158,161,163,164,165,181,184,186,190,199,217,226,256,267,269,270,296,298,300,302,312,316,323,333,336,337,343,344,345,350,354,355,358,360,361,363和379;或(b)38,60,71,87,99,103,107,108,109,115,116,117,121,122,123,124,125,126,127,128,129,130,134,143,146,149,150,157,158,163,164,267,270,345,355,360,和361。88.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶与根据实施例53所述的模板中的任一个的序列一致性为45%或更高,55%或更高,65%或更高,75%或更高,85%或更高,90%或更高,92.5%或更高,95%或更高,96%或更高,97%或更高,98%或更高,或99%或更高,且包括在氨基酸位置号107,121,123,129,130,143,146,149,158,267,270,355,360的所有位置上未置换的原始氨基酸。89.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自以下(a)组或(b)组中的2、3、4、5、6、7、8、9、10、11或12个氨基酸置换:(a)S11T,D38N,H42Q,E48D,N53I,E56K,D60E,V61A,I63F,P65Q,D70N,P71I,P71T,P71V,T74S,D81G,K84R,E86K,N87K,I94V,S99P,S99T,A103V,I106L,G107S,L108V,L108W,V109Y,N112K,N112R,R115H,I116F,N117D,N117Q,N117Y,Q120H,Q120R,G121A,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122A,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,S124R,V125C,V125G,V125W,E126G,E126V,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T145M,T146N,S147R,L148A,L148F,L148G,L148I,L148T,L148V,L148W,A149L,A149M,A149T,A149V,V150A,V150I,T152M,A155V,K157N,V158E,V158H,V158K,V158W,P161A,P161G,P161Q,P161S,P161V,I163F,I163N,I163Q,I163T,D164G,D164N,E165G,K181R,A184T,L186M,T190A,T190S,I199V,Q217K,L226M,G256C,Q267H,G269S,G270M,G270S,G270Y,T296S,R298H,A300T,I302V,G312V,A316V,I323M,F333L,P336L,S337C,G343D,V344A,V344G,K345E,E350K,K354M,N355D,N355I,N355K,E358G,V360A,V360G,V360K,V360R,V360S,C361N,C361R,Q363K,和K379M;或(b)D38N,D60E,P71I,P71V,N87K,S99T,A103V,G107S,L108V,L108W,V109Y,R115H,I116F,N117D,N117Q,G121D,G121E,G121L,G121M,G121R,G121S,G121T,G121V,G121W,G121Y,V122P,N123D,N123I,N123L,N123R,N123Y,S124I,S124L,V125C,V125G,V125W,E126G,K127C,K127R,P128A,P128R,P128S,V129A,V129M,V129P,V129S,V130F,V130I,V130Y,A134T,S143T,T146N,A149L,A149M,A149T,A149V,V150A,K157N,V158E,V158H,V158K,V158W,I163Q,D164N,Q267H,G270M,G270S,G270Y,K345E,N355D,V360G,V360K,V360R,V360S和C361R。90.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自以下各项的一组氨基酸置换:(a)D70N,L148G,P161G,V360A;(b)D70N,L148G,V360A,C361N;(c)D70N,L148V,V150I,P161A,V360G;(d)D70N,L148V,V360G;(e)D70N,P161A,V360A;(f)D70N,P161V,V360G,C361N;(g)D70N,V150I,P161A,V360A;(h)D70N,V150I,P161V,V360G,C361N;(i)E48D,L148V,P161A,V360A;(j)L148G,P161A,V360A,C361N;(k)L148G,P161A,V360G;(l)L148G,P161A,V360G,C361N;(m)L148G,P161G,V360A;(n)L148G,P161G,V360G,C361N;(o)L148G,V360A,C361N;(p)L148G,V360G,C361N;(q)L148I,P161G,V360G;(r)L148I,P161V,V360G;(s)L148T,V150I,V360A;(t)L148T,V360G;(u)L148V,P161A,V360A;(v)L148V,V150I,P161A,V360A;(w)L148V,V150I,P161A,V360A,C361N;(x)L148V,V150I,P161A,V360G;(y)L148V,V150I,P161A,V360G,C361N;(z)L148V,V150I,P161A,V360G,C361N;(aa)L148V,V150I,P161G,V360A;(ab)L148V,V150I,P161V,V360G,C361N;(ac)L148W,P161A,V360A,C361N;(ad)N112K,S147R,P161A,V360A;(ae)P161A,Q217K,V360A,C361N;(af)P161A,V360A,C361N;(ag)P161A,V360G;(ah)P161V,E358G,V360G;(ai)P161V,V360A,C361N;(aj)L148W,P161A,V360A,C361N;(ak)N112K,S147R,P161A,V360A;(al)P161A,Q217K,V360A,C361N;(am)P161A,V360A,C361N;(an)P161A,V360G;(ao)P161V,E358G,V360G;(ap)P161V,V360A,C361N;(aq)P161V,V360G;(ar)P65Q,L148G,V150I,P161A,V360G,C361N;(as)S147R,L148A,V150I,P161A,V360G;(at)S147R,L148F,V150I,P161G,V360G;(au)S147R,L148V,P161G,V360A;(av)P161V,V360G;(aw)P65Q,L148G,V150I,P161A,V360G,C361N;(ax)S147R,L148A,V150I,P161A,V360G;(ay)S147R,L148F,V150I,P161G,V360G;(az)S147R,L148V,P161G,V360A;(aaa)S147R,L148V,P161V,V360G;(aab)S147R,L148V,V150I,P161A,C361N;(aac)S147R,L148V,V150I,P161G,V360G;(aad)S147R,P161A,V360A;(aae)S147R,P161A,V360A,C361N;(aaf)S147R,P161A,V360G;(aag)S147R,P161V,V360G;(aah)S147R,P161V,V360G,C361N;(aai)S147R,V150I,P161V,V360A;(aaj)S147R,V150I,V360A,C361N;(aak)T145M,L148I,V360G;(aal)V150I,I302V,V360G,C361N;(aam)V150I,P161A,C361N;(aan)V150I,P161G,V360A,C361N;(aao)V150I,P161G,V360G;(aap)V150I,P161G,V360G,C361N;(aaq)V150I,P161V,C361N;(aar)V150I,P161V,K354R,V360A,C361N;(aas)V150I,P161V,V360A,C361N;(aat)V150I,P161V,V360G,C361N;(aau)V150I,V360A,C361N;(aav)V150I,V360G;(aaw)S11T,T74S,G269S,V344A;(aax)K84R,I163T;(aay)V122A,I163N;(aaz)G107S,F333L;(aaaa)V129M,T152M,G343D;(aaab)I63F,N355K;(aaac)G107S,F333L;(aaad)E86K,S99T,A149V;(aaae)N53I,V158E;(aaaf)N355I,K379M;(aaag)H42Q,G107S;(aaah)Q120H,I163N;(aaai)A149V,I323M;(aaaj)G107S,F333L;(aaak)D164G,K181R;(aaal)A155V,R298H,N355D;(aaam)N123D,E165G;(aaan)I163F,L186M;(aaao)G121A,T296S;(aaap)I94V,S99P,N123I;(aaaq)E126V,V129M,V344G;(aaar)Q120R,S143T;(aaas)G256C,A316V;(aaat)P161Q,G312V;(aaau)L226M,A300T,V360A;(aaav)S337C,E350K,N355D,Q363K;(aaaw)D81G,V158E;(aaax)I106L,N117Y,E126V;(aaay)G107S,G121D;(aaaz)V61A,V158E;(aaaaa)N53I,V158E;(aaaab)N117Y,T190S;(aaaac)S124R,I199V;(aaaad)K354M,C361R;(aaaae)A184T,C361R;(aaaag)E56K,Q267H;(aaaag)S124R,E126G;(aaaah)T190A,N355K;(aaaai)P71T,F333L;(aaaaj)G107S,F333L;和(aaaak)N123I,P336L,(aaaal)D38D/A149V,(aaaam)D38N/V163V,(aaaan)D73D/L108V,(aaaao)G121R/P161S,和(aaaap)N112R/P161S。91.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自TNA和VTNAF(SEQIDNO:79)的序列基序。92.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自VEV和GVEVA(SEQIDNO:80)的序列基序。93.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自DIA,PDIAD(SEQIDNO:81),DVA,和PDVAD(SEQIDNO:82)的序列基序。94.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自EKC和QEKCD(SEQIDNO:83)的序列基序。95.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自STH和GSTHD(SEQIDNO:84)的序列基序。96.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自TVK和DTVKA(SEQIDNO:85)的序列基序97.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自SLV,GVV,GWV,GLY,ISLVA(SEQIDNO:86),IGVVA(SEQIDNO:87),IGWVA(SEQIDNO:88),和IGLYA(SEQIDNO:89)的序列基序。98.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自HIN,RFN,RID,RIQ,GHIND(SEQIDNO:90),GRFND(SEQIDNO:91),GRIDD(SEQIDNO:92),和GRIQD(SEQIDNO:93)的序列基序。99.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自DVNSVEKPVV(SEQIDNO:94),EVNSVEKPVV(SEQIDNO:95),LVNSVEKPVV(SEQIDNO:96),MVNSVEKPVV(SEQIDNO:97),RVNSVEKPVV(SEQIDNO:98),SVNSVEKPVV(SEQIDNO:99),TVNSVEKPVV(SEQIDNO:100),VVNSVEKPVV(SEQIDNO:101),WVNSVEKPVV(SEQIDNO:102),YVNSVEKPVV(SEQIDNO:103),GPNSVEKPVV(SEQIDNO:104),GVDSVEKPVV(SEQIDNO:105),GVISVEKPVV(SEQIDNO:106),GVLSVEKPVV(SEQIDNO:107),GVRSVEKPVV(SEQIDNO:108),GVYSVEKPVV(SEQIDNO:109).GVNIVEKPVV(SEQIDNO:110),GVNLVEKPVV(SEQIDNO:111),GVNSCEKPVV(SEQIDNO:112),GVNSGEKPVV(SEQIDNO:113),GVNSWEKPVV(SEQIDNO:114),GVNSVGKPVV(SEQIDNO:115),GVNSVECPVV(SEQIDNO:116),GVNSVERPVV(SEQIDNO:117),GVNSVEKAVV(SEQIDNO:118).GVNSVEKRVV(SEQIDNO:119).GVNSVEKSVV(SEQIDNO:120).GVNSVEKPAV(SEQIDNO:121).GVNSVEKPMV(SEQIDNO:122).GVNSVEKPPV(SEQIDNO:123).GVNSVEKPSV(SEQIDNO:124).GVNSVEKPVF(SEQIDNO:125).GVNSVEKPVI(SEQIDNO:126),和GVNSVEKPVY(SEQIDNO:127)的序列基序。100.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自TETT(SEQIDNO:128),SETN(SEQIDNO:129),GTETTS(SEQIDNO:130),和GSETNS(SEQIDNO:131)的序列基序。101.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自LLVI(SEQIDNO:132),LMVI(SEQIDNO:133),LTVI(SEQIDNO:134),LVVI(SEQIDNO:135),和LAAI(SEQIDNO:136)的序列基序。102.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自NVKMPVID(SEQIDNO:137),KEKMPVID(SEQIDNO:138),KHKMPVID(SEQIDNO:139),KKKMPVID(SEQIDNO:140),KWKMPVID(SEQIDNO:141),KVKMPVQD(SEQIDNO:142),和KVKMPVIN(SEQIDNO:143)的序列基序。103.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自HVGG(SEQIDNO:144),QVGM(SEQIDNO:145),QVGS(SEQIDNO:146),和QVGY(SEQIDNO:147)的序列基序。104.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自VEE和GVEEE(SEQIDNO:148)的序列基序。105.根据实施例82所述的非天然醇脱氢酶,其特征在于,所述非天然醇脱氢酶包括选自DAYEDVC(SEQIDNO:149),NAYEDGC(SEQIDNO:150),NAYEDKC(SEQIDNO:151),andNAYEDRC(SEQIDNO:152),和NAYEDSC(SEQIDNO:153),和NAYEDVR(SEQIDNO:154)的序列基序。106.一种核酸,其编码如实施例82-105中任一项所述的非天然醇脱氢酶。107.一种表达构建体,其包括如实施例106所述的核酸。108.一种工程细胞,其包括如实施例106所述的核酸或如实施例107所述的表达构建体。109.根据实施例108所述的工程细胞,其特征在于,所述工程细胞进一步包含一种或多种醇代谢途径的基因,所述基因编码选自以下的蛋白:a)甲酸脱氢酶(EM8),甲醛激活酶(EM10),甲醛脱氢酶(EM11),S-(羟甲基)谷胱甘肽合成酶(EM12),谷胱甘肽依赖性甲醛脱氢酶(EM13),S-甲酸谷胱甘肽水解酶(EM14),甲酸盐氢裂解酶(EM15)和氢化酶(EM16)。110.根据实施例108所述的工程细胞,其特征在于,所述工程细胞进一步包含一种或多种醇代谢途径的基因,所述基因编码选自以下的蛋白:琥珀酰-CoA还原酶(醛形成型)(EB3),4-羟基丁酸酯(4-HB)脱氢酶(EB4),4-HB激酶(EB5),磷酸转-4-羟基丁酰酶(EB6),4-羟基丁酰-CoA还原酶(醛形成型)(EB7),1,4-丁二醇脱氢酶(EB8);琥珀酸还原酶(EB9),琥珀酰-CoA还原酶(醇形成型)(EB10),4-羟基丁酰-CoA转移酶(EB11),4-羟基丁酰-CoA合成酶(EB12),4-HB还原酶(EB13),和4-羟基丁酰-CoA还原酶(醇形成型)(EB15),琥珀酰-CoA转移酶(EB1),以及琥珀酰-CoA合成酶(EB2A)。111.根据实施例108-110任一项所述的工程细胞,其特征在于,所述细胞为细菌。112.根据实施例112所述的转基因细菌,其特征在于,所述细菌为杆菌。113.用于提高甲醇或乙醇向所述醇的脱氢产物转化的方法,包括步骤(a)在含有甲醇或乙醇的培养基中,培养根据实施例108-112中任一项所述的工程细胞,其中,在对所述细胞的所述培养中,与表达未包含氨基酸置换的对应醇脱氢酶的工程细胞相比,提供的甲醇或乙醇向所述醇的脱氢产物的转化提高到至少两倍。114.用于提高甲醇或乙醇向所述醇的脱氢产物转化的方法,包括步骤(a):提供pH在6-98的范围内的反应组合物,所述组合物包括根据实施例82-105中任一项所述的非天然醇脱氢酶,其中,在所述组合物中,与未包含氨基酸置换的所述对应醇脱氢酶相比,对所述细胞的所述培养提供的甲醇或乙醇向所述醇的脱氢产物的转化提高到至少两倍。115.一种提供给二醇的方法,包括:在包括甲醇或乙醇的培养基中,培养根据实施例108-112任一项所述的工程细胞,以提供所述二醇。116.根据实施例115所述的方法,其特征在于,所述二醇是1,4-丁二醇。117.用于制备聚合物的方法,包括:获得由如实施例108-116任一项所述的工程细胞或方法所生产的单体产物,并聚合所述单体产物以提供聚合产物。118.根据实施例117所述的方法所制备的聚合物。119.用于筛查活性提高的非天然醇脱氢酶的方法,其中与所述非天然醇脱氢酶的未修饰对应物相比,所述非天然醇脱氢酶的活性可选地提高到至少2倍、可选地提高到至少4倍或更高,所述方法包括:(1)创建一个或多个非天然醇脱氢酶,所述非天然醇脱氢酶选自:SEQIDNO:1,和与除选自组(a)或组(b)的氨基酸位置以外的位置具有置换的SEQIDNO:1的序列一致性为45%或更高的非天然醇脱氢酶,或其对应位置,其中组(a)11,38,42,48,53,56,60,61,63,65,70,71,74,81,84,86,87,94,99,103,106,107,108,109,112,115,116,117,117,120,121,122,123,124,125,126,127,128,129,130,134,143,145,146,147,148,149,150,152,155,157,158,161,163,164,165,181,184,186,190,199,217,226,256,267,269,270,296,298,300,302,312,316,323,333,336,337,343,344,345,350,354,355,358,360,361,363和379;或组(b)38,60,71,87,99,103,107,108,109,115,116,117,121,122,123,124,125,126,127,128,129,130,134,143,146,149,150,157,158,163,164,267,270,345,355,360,和361;(2)测定所述创建的酶的的活性;和(3)选择与所述未修饰的对应物相比活性提高的所述创建的酶,所述活性提高到可选地至少2倍、可选地至少4倍或更高。实施例测定体外甲醇脱氢酶活性的测试使用高通量筛选测定法来评估裂解物中甲醇脱氢酶(MeDH)对甲醇及其它醇底物的氧化活性。使用市售化学试剂,从包含含有MeDH文库变体和激活蛋白的整合染色体拷贝的质粒的大肠杆菌制备裂解物。将裂解物的等分试样添加到384孔测定板。为了引发醇氧化反应,添加含有0.5M甲醇或其他醇,0.5mMNAD,5mMMgCl2,10M甲氧基-5-甲基吩嗪硫酸甲酯(1-甲氧基PMS和1mM3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴(MTT)的底物缓冲液混合物(pH7.6或pH8.5)。在560nm通过吸光度监测初始速率。对显示出比野生型对照更高活性的MeDH变体,进行了评估,以用于进一步表征。甲醛分析使用LambaRed重组酶技术,建立缺乏frmA,frmB,frmR(负责大肠杆菌中的甲醛利用的基因)的菌株。将表达甲醇脱氢酶的质粒转化到菌株中,然后在LB培养基+抗生素中,37℃下振荡培养生长至饱和。以O.D.调整培养物,然后用M9培养基+0.5%葡萄糖+抗生素以1:10稀释,并在37℃下振荡培养6-8小时直至对数期后期。添加甲醇至2%v/v,然后将培养物再在37℃振荡培养30分钟。培养物离心沉淀,取上清液,使用DETECTX甲醛检测试剂盒,根据厂商说明分析产生的甲醛(ArborAssays;AnnArbor,MI)。甲酸盐分析该测试的开发,是为了通过在含有MeOH途径中头两个步骤但缺乏转化甲酸盐到CO2的甲酸脱氢酶(hycE,fdnGHI,fdoGHI,fdhF)的宿主菌株中测量甲酸盐生成,来评估甲醇脱氢酶的体内活性。将表达甲醇脱氢酶的质粒转化到该菌株中。将菌株从菌落或甘油储存液接种到96深孔板的LB+抗生素中。该板用透气培养膜密封,并在37℃下800rpm振摇。过夜培养物在5250rpm下离心10分钟以沉淀细胞。将细胞再悬浮在板的1mlM9培养基中,用透气培养膜密封所述板,并在37℃下800rpm振摇。在一段时间中进行取样,并根据制造商提供的说明书,使用甲酸盐试剂盒测定甲酸盐的浓度。甲醇脱氢酶的纯化及表征其活性的分析在37℃下,在含有2mMMgSO4的LB中培养表达甲醇脱氢酶的细胞。收获后,以补充有15KU/mL溶菌酶(Novagen)中,25U/mLbezonase(Novagen),1XPierce蛋白酶抑制剂(ThermoScientific),0.5mM三(2-羧乙基)膦盐酸盐和2mMMgSO4的BugBuster蛋白提取试剂(Novagen)裂解细胞。裂解物通过离心澄清,并在经5mLStrepTrapHP柱(GEHealthcareLifeSciences)纯化。该柱以100mMMOPSpH7.5,0.2MNaCl2,2mMMgSO4,0.5mMTCEP(bufferA)制备和洗涤。纯化后的蛋白用含有0.3mg/mL脱硫生物素的缓冲液A洗脱。DNA2.0基因合成甲醇脱氢酶基因候选物使用DNA2.0密码子在经过密码子使用优化后进行合成(Welchetal.,PloSOne2009,4(9):e7002,DesignparameterstocontrolsyntheticgeneexpressioninEscherichiacoli)。甲醇转化为CO2的体内标记测定具有功能还原性TCA分支和丙酮酸甲酸裂解酶缺失的菌株在LB培养基中有氧培养过夜,然后接种在含有IPTG的M9高种子培养基中并有氧生长4小时。所述菌株在存在和不存在甲醛脱氢酶或甲酸脱氢酶的情况下具有甲醇脱氢酶/ACT对。此时,沉淀菌株,再悬浮在含有2%13CH3OH的新鲜M9培养基高种子培养基中,并在厌氧小瓶中密封。顶部空间置换为氮气,并在37℃下培养菌株40小时。培养之后,对顶部空间进行13-CO2分析。检测培养基中的残余甲醇以及BDO和副产物。表达MeDH突变体和MeDH/ACT对的所有构建体,其培养所得ODs略低于含有空载体对照的菌株。这可能是因为这些构建体的高表达。NAD依赖性甲醇脱氢酶/激活蛋白的描述,表达和使用来自甲醇芽孢杆菌(Bacillusmethanolicus)的NADH依赖性甲醇脱氢酶的序列分析,将所述酶归于醇脱氢酶家族III。其不包含任何色氨酸残基,由此得到低消光系数(18,500M-1,cm-1),并应在SDS凝胶上通过考马斯染色法进行检测。所述酶已表征为以每亚基含有1个Zn原子和1-2个Mg原子的43kDa亚基构建而成的多亚基复合物。电子显微镜和沉降研究确定其为十聚体,其中具有五次对称性的两个环彼此堆叠(Voncketal.,J.Biol.Chem.266,p.3949-3954,1991)。据描述,其包含紧密但不是共价结合的辅助因子,并且需要外源NAD+作为e-受体以测量体外活性。在激活蛋白(Act)的存在下,观察到体外活性的强烈增加(10-40倍),所述激活蛋白(Act)是一种同型二聚体(21kDa亚基),并每亚基含有1个Zn原子和1个Mg原子。Kloosterman等(J.Biol.Chem.277,p.34785-34792,2002)和Hektor等(J.Biol.Chem.277,p.46966-46973,2002)研究了所述激活的机制,Kloosterman等表明Act是Nudix水解酶,且Hektor等表明MeDH中的残基S97到G或T的突变,改变激活特性和对辅助因子的亲和性。而残基G15和D88的突变没有显著影响,暗示了残基G13对稳定性的作用以及残基G95,D100和K103对活性的作用。此两篇论文均提出了一种假说,认为Act裂解MeDH-结合的NAD+。MeDH保持AMP的结合,并进入流通量增加的激活循环。Act和MeDH之间的化学计量比在文献中没有得到良好定义。Kloosterman等(J.Biol.Chem.277,p.34785-34792,2002)测得的完全体外活化的二聚Act与十聚MeDH的比率为10:1。与此相反,Arfman等人(J.Biol.Chem.266,3955-3960,1991)测得的最大体外激活的对应比率为3:1,且体外显著活化的对应比率为1:6,但观察到对稀释的高敏感度。基于两种蛋白质在芽孢杆菌(Bacillus)中的表达,上述作者估计体内比率为大约1:17.5。使用了纯化激活蛋白(2317A)和甲醇脱氢酶(2315A)的体外实验表明,“act”与甲醇脱氢酶的比率为10:1。该体外试验的完成,使用了5M甲醇、2mMNAD和10μM甲醇脱氢酶2315A,pH7.4。在测定中使用的来自甲醇芽孢杆菌(Bacillusmethanolicus)MGA3的激活蛋白的序列(基因座标记:MGA3_09170,GI号:387591061,保藏号:EIJ83380)如下所示:MGKLFEEKTIKTEQIFSGRVVKLQVDDVELPNGQTSKREIVRHPGAVAVIAITNENKIVMVEQYRKPLEKSIVEIPAGKLEKGEDPRITALRELEEETGYECEQMEWLISFATSPGFADEIIHIYVAKGLSKKENAAGLDEDEFVDLIELTLDEALQYIKEQRIYDSKTVIAVQYLQLQEALKNK.2315稳定性试验和数据对甲醇脱氢酶2315A及其对应激活蛋白2317A的热稳定性进行了评估,并发现其熔化温度分别为62℃和75℃。使用蛋白热漂移分析(AppliedBiosystems)来测定熔化温度。该分析提供了纯化蛋白的相对热稳定性(熔化温度)。其依赖于在RT-PCR机中加热时与变性蛋白疏水区域结合的专有荧光染料。上述相对熔融温度从荧光信号峰的斜率计算得到。用于过表达的当前启动子和质粒用不同强度的若干组成型和诱导型启动子表达甲醇脱氢酶2315。下图显示了两个MeDH变体在三种启动子下的表达水平:p119,p104和p107。得到表达的两种变体为分别2315L和2315B。2315B是基于Hektor等人(同上)鉴定的突变S97G而构建的突变体。MDH蛋白的浓度甲醇脱氢酶是非常易溶的蛋白。展示了对于来自表达WT2315A的不同变体的大肠杆菌菌株的裂解物的可溶性蛋白质的SDS-PAGE分析。具体而言,左图显示了对裂解物的凝胶实验,而右图显示了对WT酶2315A的上清液的凝胶实验,用变体2315L和R(来自Hektor等人的变体,称为2315B)和空载体。使用BugBuster将细胞裂解,如前所述。使用来自BioRad的ImageLab3.0软件对蛋白质的量进行定量。WT蛋白估计为占总蛋白质~27%。质粒和启动子的背景资料载体骨架获取自Expressys的RolfLutz博士(http://www.expressys.de/)。所述载体和菌株是基于由RolfLutz博士和HermannBujard教授所开发的pZ表达体系(Lutz,R.&Bujard,H.IndependentandtightregulationoftranscriptionalunitsinEscherichiacoliviatheLacR/O,theTetR/OandAraC/I1-I2regulatoryelements.NucleicAcidsRes25,1203-1210(1997).)。本领域可用的启动子P119,p104,p107,p119根据需要提供了酶的不同表达水平。得到的载体为pZE13luc,pZA33luc,pZS*13luc和pZE22luc,并含有萤光素酶基因作为填充片段。为了将荧光素酶填充片段替换为两侧具有适当限制性酶位点的lacZ-α片段,首先通过用EcoRⅠ和XbaⅠ进行消化,将萤光素酶填充片段从每个载体中移除。使用以下引物从pUC19对lacZ-α片段进行PCR扩增:lacZalpha-RI5’GACGAATTCGCTAGCAAGAGGAGAAGTCGACATGTCCAATTCACTGGCCGTCGTTTTAC3’(SEQIDNO:155)lacZalpha3'BB5’-GACCCTAGGAAGCTTTCTAGAGTCGACCTATGCGGCATCAGAGCAGA-3’(SEQIDNO:156)由此,生成了在5'端具有EcoRI位点,NheI位点,核糖体结合位点,SalI位点和起始密码子的片段。该片段的3'端包含终止密码子,XbaⅠ,HindIII和AvrII位点。PCR产物用EcoRI和AvrⅡ消化,并连接到经过EcoRI和XbaI消化的基础载体(XbaI和AvrII具有配伍末端并产生非位点)。因为NheⅠ和XbaI限制性酶位点产生可以相互连接的配伍末端(但在连接后产生不由两酶中任一种消化的位点),克隆到载体中的基因可以以“Biobrick(生物砖)”((http://openwetware.org/wiki/Synthetic_Biology:BioBricks))技术结合在一起。简而言之,该方法能够使用相同的2个限制性位点将无限制数量的基因连接到载体中(只要所述位点不存在于基因内部),因为所述基因之间的位点在每次加入后被破坏。最初,从所述载体的表达低,,且其随后使用定点诱变试剂盒(NEB,Ipswich,MA,USA)进行修饰,在EcoRI和NheI位点之间插入间隔序列AATTAA。这消除了RNA中结合RBS和起始密码子的推定茎环结构。所有载体具有PZ标示,其后跟随着字母和数字,表明复制原点、抗生素抗性标记和启动子/调控单元。复制原点是第二个字母,并用E表示基于ColE1的原点,A表示基于P15A的原点,且S表示基于pSC101(以及S*表示pSC101的较低拷贝数版本)的原点。第一个数字代表的是抗生素抗性标记(1为氨苄青霉素,2为卡那霉素,3为氯霉素)。最后的数字定义了调节感兴趣基因的启动子(1为PLtetO-1,2为PLlacO-1和3为PA1lacO-1),并且每个所述启动子由其相应的诱导分子进行激活(pLtetO可用四环素诱导;pLlacO-1和pA1lacO-1可用IPTG诱导)。然后,设计并构建三个基础载体:pZS*13S,pZA33S和pZE13S,用作“诱导”质粒载体。除了上面提到的“诱导型”启动子之外,还从Registry(http://partsregistry.org/)处取样了一组“组成型”启动子。随后,通过如Li&Eledge(NatureMethods2007,4:251-256)所述的不依赖序列和连接反应的克隆(SequenceandLigationIndependentCloning,SLIC)法,将每个所述“组成型”启动子引入pZS*13S载体骨架,以取代pA1lacO-1诱导型启动子。对于所述取样的“组成型”启动子(p100,p104,p105,p107,p108,p111,p115&p119)进行了实验,以建立启动子强度顺序,并由蛋白质表达水平进行验证。对于此处所讨论的研究,我们使用了“诱导型”和“组成型”的质粒载体,并如上所述地经过生物砖和SLIC插入的修饰。为了进一步微调一些过度表达的蛋白质的蛋白质表达水平,使用RBS计算器(https://salis.psu.edu/software/),对启动子和基因的编码序列之间的核糖体结合位点(RBS)进行相应修饰。诱变技术-致错-PCREpPCR(Pritchardetal.,JTheor.Biol.234:497-509(2005))通过添加加入Mn2+离子、偏移dNTP浓度或其他条件变化,降低PCR反应中的DNA聚合成酶保真度,引入随机点突变。将诱变限制在感兴趣目标基因的五步骤克隆方法包括:1)感兴趣基因的易错PCR扩增;2)限制酶消化;3)所需DNA片段的凝胶纯化;4)连接到载体;5)基因变体转化到合适宿主中,并在文库中筛选改进的性能。这种方法可以在单个基因中同时产生多个突变,这可以用于筛选较大数量的具有所需活性的潜在变体。可以通过EpPCR产生大量突变体,由此使用高通量筛选测定法或选择方法,例如使用机器人技术,用于鉴定具有期望特性的突变体。诱变技术-位点饱和突变在位点饱和诱变中,所述起始材料是含有插入物的超螺旋dsDNA质粒和在基因突变所需部位简并的两种引物(Kretzetal.,MethodsEnzymol.388:3-11(2004))。携带感兴趣的突变的引物退火至DNA相反链上的相同序列。突变通常在引物的中间,且两侧各有约20个核苷酸的正确序列。所述引物中的序列为NNN或NNK(编码)及MNN(非编码)(N=所有4个,K=G、T,M=A、C)。扩展后,使用DpnI消化dam甲基化的DNA,以消除野生型模板。这种技术可探索给定基因座(即一个密码子)上的所有可能的氨基酸置换。该技术有助于在单一位点生成所有可能的置换物,而没有无意义密码子,并得到等于与大多数可能等位基因的近相等表示。这种技术不需要具有对目标酶的结构、机理或结构域的先前知识。若后续使用改组或基因重组,则该技术可以创建包含单位点突变的所有可能组合的重组体多样化文库。该技术组合已被证明用于超过50种不同酶的成功演化和指定酶的多种性质。组合突变MeDH结构模型和结构比较为了设计用于改进2315的催化速率的突变文库,对数种MeDHs的基因以及各种Fe依赖性ADH基因进行了比对。使用对Fe依赖性ADHs(与MeDHs之间具有40-47%序列一致性)的所述结构/功能关系,来鉴定MeDH序列内具有功能重要性的区域。所鉴定的区域比对如图4所示。使用MeDH序列在PDB结构数据文库中进行BLAST检索,发现了序列一致性在40%和47%之间的Fe依赖性醇脱氢酶的数种结构。相似度存在于蛋白质的整个长度中。鉴于其与已知结构的此种相似性,使用基于网络的iTasser结构预测工具(Royetal,NatureProtocols,5:725-738(2010).),使用MeDH序列来生成三维模型。具体使用了以下三种结构与来自芽孢杆菌(Bacillus)的MeDH进行比对和比较:3OX4:来自运动发酵单胞(Zymomonasmobilis)的ADH-2(序列一致性为47%)1RRM:来自大肠杆菌的乳醛还原酶(FucO,序列一致性为43%)3BFJ:来自肺炎克雷伯氏菌(Klebsiellapneumoniae)的1,3-PDO氧化还原酶(DhaT,序列一致性为47%)以结合辅助因子进行发酵单胞菌属(Zymomonas)酶的结晶,且对其结构进行了充分分析,包括用于金属、辅助因子和建议底物结合的某些氨基酸残基的标注(EtOHmodeledintostructure,Moonetal.,J.Mol.Biol.407,p413-424,2011)。类似于来自大肠杆菌的乳醛还原酶(Montellaetal.,J.Bact.187,p.4957-4966,2005),发酵单胞菌属ADH是同型二聚体。与此相反,在电子显微镜研究中,发现克雷伯氏菌属酶(Marcaletal.,J.Bact.191,p.1143-1151,2009)具有类似于MeDH外观的十聚体结构。序列比较表明,Fe依赖性ADHs的所有四个同位残基在MeDH结构中是保守的。Hektor等人(J.Biol.Chem.277,p.46966-46973,2002)提出,这四个残基中有两个在一个富含组氨酸的序列(残基258-290)中作为推定金属结合位点。由于Fe和Zn具有非常相似的结合特性,在ADHs中负责铁结合的相同氨基酸可以调节MeDH的锌原子。从比对可知,以下四个氨基酸有可能构成MeDH中的金属结合位点(编号转记为GenomaticageneID2315):D193,H197,H262,H276。被认为对发酵单胞菌属(Zymomonas)ADH的辅助因子结合具有重要作用的氨基酸大多在MeDH序列中是保守的。GenomaticageneID2315代表性的残基如下列出。如果对应的氨基酸不同,则发酵单胞菌属ADH残基在括号中注明:D38,D70(N),G97,S98,T137,T138,T146,L148(F),L178。为了广泛撒网,将与丙二醇的C1原子的距离为或以下的残基鉴定出来,并与已标注的发酵单胞菌属(Zymomonas)残基一同列举如下。残基数转记为GenomaticageneID2315,且原来的蛋白质中对应的氨基酸在括号中给出。来自发酵单胞菌属(Zymomonas)ADH-2:L148(F149),V150(I151),P161(A162),F253(F254),L258(L259),H266(H267),D359(D360),V360(A361),C361(C362);来自大肠杆菌FucO(的距离):T141(T144),G142(A145),S143(A146),L148(N151),A149(Y152),H266(H267)。将建议诱变位点映射到MeDH的结构模型中显示,选作目标位点的残基标示出了单体活性位点的入口。据发现,位点253,258,266,以及359是严格保守的,这暗示着它们更可能是功能必需的,因此将其从突变鉴定的残基列表中删除。对于剩下的五个残基,根据其在相关序列中的发生率来选择用于置换的氨基酸。仅在标注为具有限制模板大小作用和在活性位点定位烟酰胺环的作用的位点148上,提出了完整的一组氨基酸(NNK)。在其他的四个位点上,缩小置换物的范围,使得有可能包括额外的目标位点,同时保持合理的文库大小。根据位点在Fe依赖性ADHs中的可能功能和位置,增加了以下三个位点:D70,T145,S147。当在序列比中比较各位点的变化时,注意到残基之一是一种内部测试的醇脱氢酶的同源物。由于P160G突变增加了该醇脱氢酶的活性,将甘氨酸加入到各MeDH位置的置换列表中。下表总结了目标残基和置换(基于基因2315A的位置)的最后列表:表1相对于SEQIDNO:1的氨基酸突变,当表现为单突变时提供高于两倍的活性:表2相对于SEQIDNO:1的附加组合突变(从原理设计生成)表3相对于SEQIDNO:1的附加组合突变(从epPCR生成)表4相对于SEQIDNO:1的附加组合突变表5推定基序和相对于SEQIDNO:1的氨基酸位置的作用表6表7野生型酶学表8野生型和变体酶学测定甲醇使用活性。a在2mMNAD的存在和pH7.6,37℃下进行试验。表9野生型和变体酶学野生型和变体甲醇脱氢酶的1,4-丁二醇-依赖性稳态动力学指标a。a在2mMNAD的存在和pH7.6,37℃下进行试验。表10置换模板一致性百分比是基于与SEQIDNO:1的全局比对给出的。表11模板多肽展示示例置换、其位置及其在其他模板序列中的对应位置的模板多肽序列:当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1