使用MIRNA比率确定肺癌的制作方法
本申请要求2014年1月5日提交的美国临时申请号61/923,758和2014年1月12日提交的美国临时申请号61/926,323的优先权和权益,这两个申请均通过引用以其整体结合到本文中。
技术领域:
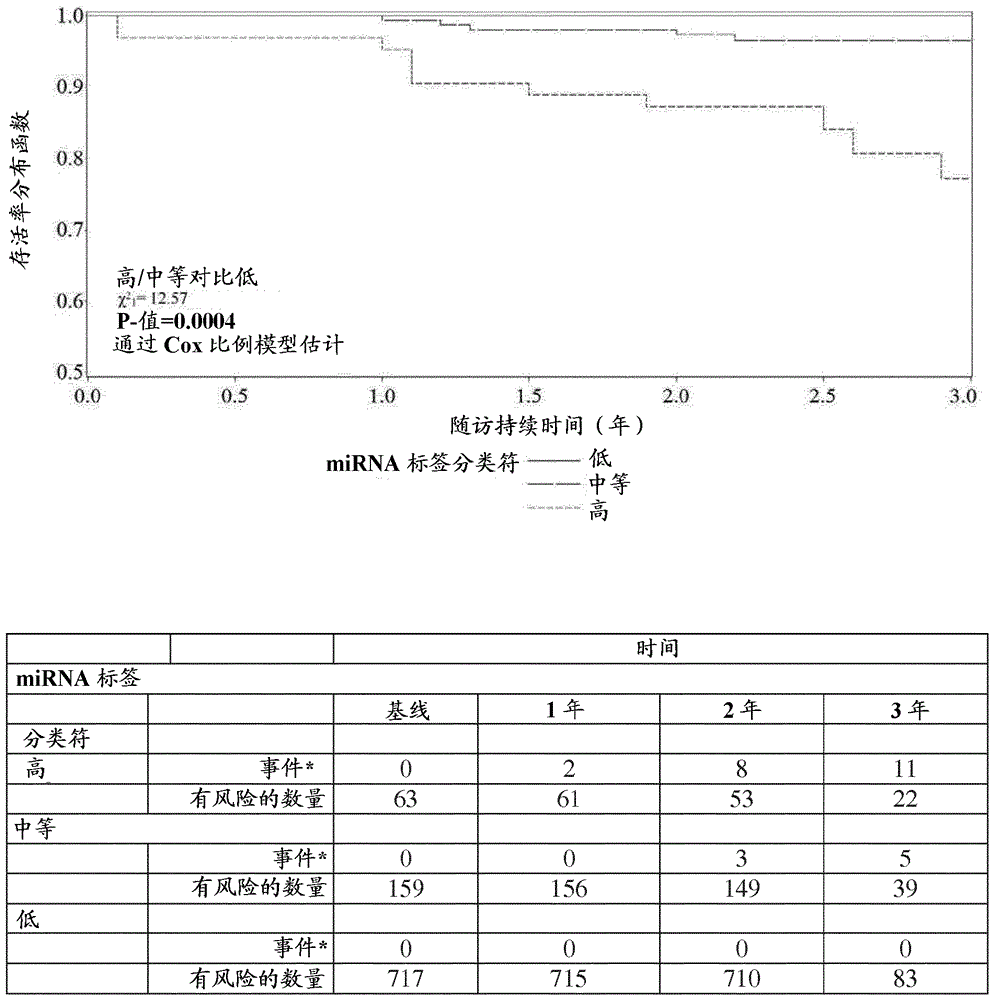
本申请总体上涉及诊断肺癌和确定肺癌的风险。更具体地,本申请涉及使用miRNA表达比率确定出现肺肿瘤或侵袭性肺肿瘤的风险,和确定肺肿瘤或侵袭性肺肿瘤的存在情况。发明背景肺癌是全世界癌症死亡的主要原因(Jemal等,CACancerJClin,61:69-9,2011)。目前大多数肺癌在晚期被检出,这时治疗具有有限功效和存活率低。在早期检出肺癌可显著减少死亡率。欧洲随机化肺癌筛选试验,利用观察对照组但有限大小,迄今为止未证实死亡率减少(Infante等,AmJRespirCritCareMed180:445-453,2009;Saghir等,Thorax67:296-301,2012;Pastorino等,EurJCancerPrev21:308-315,2012);然而,来自大的NCI-发起的国家肺筛选试验(NSLT)的结果表明,用低剂量计算机断层摄影术(LDCT)筛选具有≥30包-年的历史和自停止吸烟以来≤15年的高风险个体,与每年的胸部射线摄影术相比较,死亡率减少20%(Aberle等,NEnglJMed365:395-409,2011)。高的假阳性率、筛选高数量的高风险个体的成本(在美国估计为$350万)和与LDCT筛选有关的潜在危害仍然是临床条件下需要考虑的事项(Aberle等,2011;Goulart等,JNatlComprCancNetw10:267-275,2012)。因此,对改进肺癌的预测、预后和诊断的另外的方法存在需要。本发明满足所述需要。发明简述本发明部分地基于以下发现:测定方法可利用循环miRNA生物标记以对总体“发展或具有肺肿瘤的风险”测定提供三-水平分类符。因此,在一些实施方案中,提供确定受试者中肺肿瘤的存在情况的方法。所述方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值(cut-offvalue);(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直到(1)至少9个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后少于9个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b或320/660,或其反比;和(e)按以下将肺肿瘤的存在情况分类:(i)如果至少9个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于9个miRNA对表达比率被分配了正评分,则为阴性。根据另一个实施方案,确定受试者中侵袭性肺肿瘤的存在情况的方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p或320/660,或其反比;和(e)按以下将侵袭性肺肿瘤的存在情况分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。根据又一个实施方案,确定受试者中出现肺肿瘤的风险的方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少10个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后,少于10个miRNA对表达比率被分配了正评分,其中所述miRNA对包括133a/92a、15b/21、15b/30b、15b/30c、16/197或28-3p/451,或其反比;和(e)按以下将出现肺肿瘤的风险分类:(i)如果至少10个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于10个miRNA表达比率被分配了正评分,则为阴性。根据其它实施方案,确定出现侵袭性肺肿瘤的风险的方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660或28-3p/660,或其反比;和(e)按以下将出现侵袭性肺肿瘤的风险分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在其它实施方案中,预测受试者中发展或具有肺肿瘤的风险的方法包括:(a)确定上文所述的肺肿瘤的存在情况标签;(b)确定上文所述的侵袭性肺肿瘤的存在情况标签;(c)确定上文所述的出现肺肿瘤的风险标签;(d)确定上文所述的出现侵袭性肺肿瘤的风险标签;(e)如果步骤(a)-(d)的标签中无一被分类为阳性,则将受试者分类为发展或具有肺肿瘤的低风险;(f)如果至少步骤(a)的肺肿瘤的存在情况标签为阳性,或步骤(c)的出现肺肿瘤的风险标签为阳性;且步骤(b)的侵袭性肺肿瘤的存在情况标签和步骤(d)的出现侵袭性肺肿瘤的风险标签两者均为阴性,则将受试者分类为具有发展或具有肺肿瘤的中等风险;和(g)如果至少步骤(b)的侵袭性肺肿瘤的存在情况标签为阳性或步骤(d)的出现侵袭性肺肿瘤的风险标签为阳性,则将受试者分类为发展或具有肺肿瘤的高风险。另外提供对受试者确立治疗选项的方法。所述方法包括使用任何上述方法测试受试者和根据所述方法的结果确定治疗选项。方法可进一步包括将治疗给予需要所述治疗的受试者。尽管本公开内容已经结合其详细描述进行了描述,但前文的描述意欲说明而并非限制本公开内容的范围,其由随附的权利要求书的范围来定义。其它方面、优点和修改在随后的权利要求书的范围内。本文引用的专利和科学文献提供了本领域技术人员可用到的知识。本文引用的所有美国专利和公布或未公布的美国专利申请通过引用予以结合。本文引用的所有公开的外国专利和专利申请通过引用予以结合。本文引用的由检索号指示的Genbank和NCBI提交物通过引用予以结合。本文引用的所有其它公开的参考资料、文件、手稿和科学文献通过引用予以结合。附图简述图1是描述实施例1的样品组的特征的简图,实施例1:多中心意大利肺检测(MulticentricItalianLungDetection,MILD)研究2005-2012。图2是显示根据miRNA标签分类符(MSC)在所有受试者中自血样品收集的日期起的三年存活率的图和表。发明详述根据一个实施方案,本发明利用miRNA表达水平的多个比率以确定(a)出现肺肿瘤的风险,(b)出现侵袭性肺肿瘤的风险,(c)肺肿瘤的存在情况,(d)侵袭性肿瘤的存在情况,和当组合步骤(a)-(d)中检测的风险时,确定具有或发展肺肿瘤的总体风险。本发明可包括除去具有可检测水平的溶血的样品,例如通过包括使用miRNA溶血分类符;使用三-水平(低、中等或高)“疾病风险”分类符代替二-水平(低、高)分类符;或使用来自单一受试者的对照血浆样品代替库(pool)。可包括三个miRNA:miR-101、miR-145和miR-133a,其在之前的测定的验证步骤中因为在对照库中高的变异性被排除。根据本发明的示例性的方法,“microRNA标签分类符”(MSC)对单独MSC提供87%的筛选敏感性,和当与低剂量计算机断层摄影术(LDCT)筛选组合时为98%。因此,MSC可单独使用,或以协同方式与其它方法(例如LDCT)组合,以通过避免在大比例的受试者中更多轮的LDCT和不必要的侵袭性诊断随访,改进LDCT对肺癌筛选的有效性。本申请中详述的MSC单独的预后和诊断性能表明,不依赖于肿瘤阶段,在MSC内测量的miRNA不仅仅是肿瘤载荷的输出,而是与肿瘤侵袭性有关的发病机理的指示物。MSC的开发基于筛选100个不同的血浆miRNA的4,950个比率的无偏倚的计算机方法,以选择用于具有差的预后的肺癌检测和关联的miRNA比率的最佳集合(Boeri等,ProcNatlAcadSciUSA108:3713-3718,2011)。这些miRNA比率可反映肿瘤的不同细胞组分内的miRNA的miRNA调节的竞争机制和周围的微环境之间的调节。不受任何特定理论的束缚,基质细胞被发炎的肺微环境激活,释放特定miRNA至循环中,其可在功能上参与与肿瘤转化有关的靶基因的调节。MSC利用血浆-来源的miRNA标签的稳健的测定法。MSC具有对恶性疾病存在情况、未来恶性肿瘤的风险的诊断性能和区分肺癌与大部分良性LDCT-检出的肺小结的能力。本文详述了MSC可利用的特定标签。“肺肿瘤的存在情况”标签在一些实施方案中,提供确定受试者中肺肿瘤的存在情况的方法。所述方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少9个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后少于9个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b或320/660,或其反比;和(e)按以下将肺肿瘤的存在情况分类:(i)如果至少9个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于9个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,该测定法的miRNA对包括比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9、超过10、超过11、超过12个或每一个。在其它实施方案中,miRNA对可进一步包括比率106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660或28-3p/660,或其反比。在又其它的实施方案中,miRNA对包括比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b、320/660、106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660和28-3p/660或其反比的至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。技术人员将理解,利用这27个比率的一些而非全部将预期提供准确鉴定肿瘤存在情况的测定法。在一些实施方案中,本发明提供用于检测27个miRNA对的任一个的多个引物或探针在制备用于确定受试者中肺肿瘤的存在情况的诊断试剂中的用途,其中所述检测包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少9个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后少于9个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b或320/660,或其反比;和(e)按以下将肺肿瘤的存在情况分类:(i)如果至少9个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于9个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,所述多个引物或探针用于检测miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9、超过10、超过11、超过12个或每一个。在其它实施方案中,所述多个引物或探针进一步用于检测miRNA对表达比率106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660或28-3p/660或其反比。在又其它的实施方案中,所述多个引物或探针用于检测miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b、320/660、106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660和28-3p/660或其反比的至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。技术人员将理解,利用这27个比率的一些但非全部将预期提供准确鉴定肿瘤存在情况的测定法。在一些实施方案中,所述多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,所述多个引物或探针包括能够选择性结合样品中的miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b、320/660、106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660和28-3p/660的至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个的至少一个miRNA的至少一个引物或探针。在一些实施方案中,本发明提供用于确定受试者中肺肿瘤的存在情况的试剂盒。试剂盒包括在制备诊断试剂中用于检测27个miRNA对的任一个的多个引物或探针,和利用所述多个引物或探针确定受试者中肺肿瘤的存在情况的说明书。所述说明书包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少9个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后少于9个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b或320/660,或其反比;和(e)按以下将肺肿瘤的存在情况分类:(i)如果至少9个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于9个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,试剂盒中提供的多个引物或探针可用于检测miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9、超过10、超过11、超过12个或每一个。在其它实施方案中,试剂盒中提供的多个引物或探针进一步可用于检测miRNA对表达比率106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660或28-3p/660,或其反比。在又其它的实施方案中,试剂盒中提供的多个引物或探针可用于检测miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b、320/660、106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660和28-3p/660或其反比的至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。在一些实施方案中,试剂盒中提供的多个引物和探针的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,试剂盒中提供的多个引物或探针包括能够选择性结合样品中的miRNA对表达比率106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b、320/660、106a/660、106a/92a、126/660、140-5p/197、140-5p/28-3p、142-3p/145、142-3p/197、142-3p/28-3p、17/660、17/92a、197/660、197/92a、19b/660和28-3p/660的至少9、至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个的至少一个miRNA的至少一个引物或探针。“侵袭性肺肿瘤的存在情况”标签在其它实施方案中,提供确定受试者中侵袭性肺肿瘤的存在情况的方法。所述方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p或320/660,或其反比;和(e)按以下将侵袭性肺肿瘤的存在情况分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,该测定法的miRNA对包括比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,miRNA对可进一步包括比率106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p,或其反比。在又其它的实施方案中,miRNA对包括比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p、320/660、106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。技术人员将理解,利用这28个比率的一些但非全部将预期提供准确鉴定侵袭性肿瘤存在情况的测定法。在其它实施方案中,本发明提供用于检测28个miRNA对的任一个的多个引物或探针在制备用于确定受试者中侵袭性肺肿瘤的存在情况的诊断试剂中的用途,其中所述检测包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p或320/660,或其反比;和(e)按以下将侵袭性肺肿瘤的存在情况分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p、320/660、106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。技术人员将理解,利用这28个比率的一些而非全部将预期提供准确鉴定侵袭性肿瘤存在情况的测定法。在一些实施方案中,多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,多个引物或探针包括能够选择性结合样品中的miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p、320/660、106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个的至少一个miRNA的至少一个引物或探针。在其它实施方案中,本发明提供用于确定受试者中侵袭性肺肿瘤的存在情况的试剂盒。试剂盒包括在制备诊断试剂中用于检测28个miRNA对的任一个的多个引物或探针,和利用所述多个引物或探针确定受试者中侵袭性肺肿瘤的存在情况的说明书。所述说明书包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p或320/660,或其反比;和(e)按以下将侵袭性肺肿瘤的存在情况分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p和320/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p、320/660、106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。在一些实施方案中,试剂盒提供的多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,试剂盒中提供的多个引物或探针包括能够选择性结合样品中的miRNA对表达比率106a/16、106/660、16/17、16/320、17/660、197/30b、197/30c、320/451、320/486-5p、320/660、106a/451、106a/486-5p、126/451、126/486-5p、126/660、140-5p/197、16/197、17/451、17/486-5p、197/451、197/486-5p、197/660、197/92a、19b/451、19b/486-5p、19b/660、28-3p/451或28-3p/486-5p的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个的至少一个miRNA的至少一个引物或探针。连同上述两个诊断标签(“肺肿瘤的存在情况”和“侵袭性肺肿瘤的存在情况”)一起,提供两个预后标签–“出现肺肿瘤的风险”标签和“出现侵袭性肺肿瘤的风险”标签。这些预后标签可用于确定在获取样品后任何时间段内,例如3个月、6个月、12个月、18个月、24个月、36个月或这些时间段之外或中间的任何时间的风险。“出现肺肿瘤的风险”标签因此,在进一步的实施方案中,提供确定受试者中出现肺肿瘤的风险的方法。所述方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分;或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少10个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后少于10个miRNA对表达比率被分配了正评分,其中所述miRNA对包括133a/92a、15b/21、15b/30b、15b/30c、16/197或28-3p/451,或其反比;和(e)按以下将出现肺肿瘤的风险分类:(i)如果至少10个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于10个miRNA表达比率被分配了正评分,则为阴性。在一些实施方案中,该测定法的miRNA对包括比率133a/92a、15b/21、15b/30b、15b/30c、16/197和28-3p/451或其反比的超过2、超过3、超过4、超过5个或每一个。在其它实施方案中,miRNA对可进一步包括比率101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660,或其反比。在又其它的实施方案中,miRNA对包括比率133a/92a、15b/21、15b/30b、15b/30c、16/197、28-3p/451、101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660或其反比的至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。技术人员将理解,利用这27个比率的一些而非全部将预期提供准确鉴定出现肺肿瘤的风险的测定法。在一些实施方案中,本发明提供用于检测27个miRNA对的任一个的多个引物或探针在制备用于确定受试者中出现肺肿瘤的风险的诊断或预后试剂中的用途,其中所述检测包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少10个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后,少于10个miRNA对表达比率被分配了正评分,其中所述miRNA对包括133a/92a、15b/21、15b/30b、15b/30c、16/197或28-3p/451,或其反比;和(e)按以下将出现肺肿瘤的风险分类:(i)如果至少10个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于10个miRNA表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197和28-3p/451或其反比的超过2、超过3、超过4、超过5个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197、28-3p/451、101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660或其反比的至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。技术人员将理解,利用这27个比率的一些而非全部将预期提供准确鉴定出现肺肿瘤的风险的测定法。在一些实施方案中,多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,多个引物或探针包括能够选择性结合样品中的miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197、28-3p/451、101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660的至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个的至少一个miRNA的至少一个引物或探针。在其它实施方案中,本发明提供用于确定受试者中出现肺肿瘤的风险的试剂盒。试剂盒包括在制备诊断或预后试剂中用于检测27个miRNA对的任一个的多个引物或探针,和利用所述多个引物或探针确定受试者中出现肺肿瘤的风险的说明书。所述说明书包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少10个miRNA对表达比率被分配了正评分,或(2)在比较27个miRNA对的表达比率后,少于10个miRNA对表达比率被分配了正评分,其中所述miRNA对包括133a/92a、15b/21、15b/30b、15b/30c、16/197或28-3p/451,或其反比;和(e)按以下将出现肺肿瘤的风险分类:(i)如果至少10个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于10个miRNA表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197和28-3p/451或其反比的超过2、超过3、超过4、超过5个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197、28-3p/451、101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660或其反比的至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个。在一些实施方案中,试剂盒提供的多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,试剂盒中提供的多个引物或探针包括能够选择性结合样品中的miRNA对表达比率133a/92a、15b/21、15b/30b、15b/30c、16/197、28-3p/451、101/140-3p、106a/451、106a/660、106a/92a、126/660、133a/451、133a/660、140-3p/660、142-3p/15b、15b/451、15b/660、17/451、17/660、17/92a、197/19b、197/451、197/660、197/92a、19b/660、28-3p/660或320/660的至少10、至少11、至少12、至少13、至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26个或每一个的至少一个miRNA的至少一个引物或探针。“出现侵袭性肺肿瘤的风险”标签本文还提供确定受试者中出现侵袭性肺肿瘤的风险的方法。所述方法包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660或28-3p/660,或其反比;和(e)按以下将出现侵袭性肺肿瘤的风险分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,该测定法的miRNA对包括比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660和28-3p/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,miRNA对可进一步包括比率106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451或320/92a,或其反比。在又其它的实施方案中,miRNA对包括比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660、28-3p/660、106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451和320/92a或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。技术人员将理解,利用这28个比率的一些而非全部将预期提供准确鉴定出现侵袭性肿瘤的风险的测定法。在一些实施方案中,本发明提供用于检测28个miRNA对的任一个的多个引物或探针在制备用于确定受试者中出现侵袭性肺肿瘤的风险的诊断或预后试剂中的用途,其中所述检测包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660或28-3p/660,或其反比;和(e)按以下将出现侵袭性肺肿瘤的风险分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660和28-3p/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451或320/92a,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660、28-3p/660、106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451和320/92a或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。技术人员将理解,利用这28个比率的一些而非全部将预期提供准确鉴定出现侵袭性肺肿瘤的风险的测定法。在其它实施方案中,本发明提供用于确定受试者中出现侵袭性肺肿瘤的风险的试剂盒。试剂盒包括在制备诊断或预后试剂中用于检测28个miRNA对的任一个的多个引物或探针,和利用所述多个引物或探针确定受试者中出现侵袭性肺肿瘤的风险的说明书。所述说明书包括:(a)测定来自受试者的生物样品中的miRNA对的表达比率;(b)比较来自步骤(a)的表达比率与自多个对照样品的多个相应的miRNA对的平均比率测定的截止值;(c)如果步骤(a)的miRNA对的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的miRNA对的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;(d)对另外的miRNA对重复步骤(a)至(c),直至(1)至少14个miRNA对表达比率被分配了正评分,或(2)在比较28个miRNA对的表达比率后少于14个miRNA对表达比率被分配了正评分,其中所述miRNA对包括106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660或28-3p/660,或其反比;和(e)按以下将出现侵袭性肺肿瘤的风险分类:(i)如果至少14个miRNA对表达比率被分配了正评分,则为阳性;或(ii)如果少于14个miRNA对表达比率被分配了正评分,则为阴性。在一些实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660和28-3p/660或其反比的超过2、超过3、超过4、超过5、超过6、超过7、超过8、超过9个或每一个。在其它实施方案中,多个引物或探针可进一步用于检测miRNA对表达比率106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451或320/92a,或其反比。在又其它的实施方案中,多个引物或探针可用于检测miRNA对表达比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660、28-3p/660、106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451和320/92a或其反比的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个。在一些实施方案中,试剂盒提供的多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。在一些实施方案中,试剂盒中提供的多个引物或探针包括能够选择性结合样品中的miRNA对表达比率106a/142-3p、126/142-3p、126/21、126/92a、142-3p/17、142-3p/197、142-3p/28-3p、197/19b、197/660、28-3p/660、106a/451、126/451、145/197、17/451、197/21、197/30b、197/30c、197/451、197/92a、19b/451、21/221、21/28-3p、28-3p/30b、28-3p/30c、28-3p/451、28-3p/92a、320/451和320/92a的至少14、至少15、至少16、至少17、至少18、至少19、至少20、至少21、至少22、至少23、至少24、至少25、至少26、至少27个或每一个的至少一个miRNA的至少一个引物或探针。“发展或具有肺肿瘤的风险”分类符上述四种方法可在预测受试者发展或具有肺肿瘤的风险的方法中组合。该方法包括:(a)确定上述的肺肿瘤的存在情况标签;(b)确定上述的侵袭性肺肿瘤的存在情况标签;(c)确定上述的出现肺肿瘤的风险标签;(d)确定上述的出现侵袭性肺肿瘤的风险标签;(e)如果步骤(a)-(d)的标签中无一被分类为阳性,则将受试者分类为发展或具有肺肿瘤的低风险;(f)如果至少步骤(a)的肺肿瘤的存在情况标签为阳性或步骤(c)的出现肺肿瘤的风险标签为阳性;且步骤(b)的侵袭性肺肿瘤的存在情况标签和步骤(d)的出现侵袭性肺肿瘤的风险标签两者均为阴性,则将受试者分类为具有发展或具有肺肿瘤的中等风险;和(g)如果至少步骤(b)的侵袭性肺肿瘤的存在情况标签为阳性或步骤(d)的出现侵袭性肺肿瘤的风险标签为阳性,则将受试者分类为发展或具有肺肿瘤的高风险。上述四种用途可在预测受试者发展或具有肺肿瘤的风险的用途中组合。该用途包括:(a)在制备用于确定上述的肺肿瘤的存在情况标签的诊断试剂中使用用于检测27个miRNA对的任一个的多个引物或探针;(b)在制备用于确定上述的侵袭性肺肿瘤的存在情况标签的诊断试剂中使用用于检测28个miRNA对的任一个的多个引物或探针;(c)在制备用于确定上述的出现肺肿瘤的风险标签的诊断或预后试剂中使用用于检测27个miRNA对的任一个的多个引物或探针;(d)在制备用于确定上述的出现侵袭性肺肿瘤的风险标签的诊断或预后试剂中使用用于检测28个miRNA对的任一个的多个引物或探针;(e)如果步骤(a)-(d)的标签中无一被分类为阳性,则将受试者分类为发展或具有肺肿瘤的低风险;(f)如果至少步骤(a)的肺肿瘤的存在情况标签为阳性或步骤(c)的出现肺肿瘤的风险标签为阳性;且步骤(b)的侵袭性肺肿瘤的存在情况标签和步骤(d)的出现侵袭性肺肿瘤的风险标签两者均为阴性,则将受试者分类为具有发展或具有肺肿瘤的中等风险;和(g)如果至少步骤(b)的侵袭性肺肿瘤的存在情况标签为阳性或步骤(d)的出现侵袭性肺肿瘤的风险标签为阳性,则将受试者分类为发展或具有肺肿瘤的高风险。A.定义本文使用的术语“肺肿瘤”可以是良性或恶性肺肿瘤。肺肿瘤可与一种或多种肺病况有关,和可呈例如肺小结或肺块的形式。本文使用的术语"肺病况"是指关于肺的疾病、事件或健康状态的变化,包括例如肺癌和各种非癌病况。非癌肺病况的实例包括慢性阻塞性肺病(COPD)、良性肺肿瘤或细胞块(例如错构瘤、纤维瘤、神经纤维瘤)、肉芽肿、结节病和由细菌(例如结核病)或真菌(例如组织胞浆菌病)病原体引起的感染。在某些实施方案中,肺病况可与放射照相肺小结的出现有关。上述方法不狭窄地限于诊断和/或预测任何具体肺癌。本文使用的"肺癌"优选地指肺的癌症,但可包括人或其它哺乳动物的呼吸系统的任何疾病或其它病症。呼吸系统肿瘤病症包括例如小细胞癌或小细胞肺癌(SCLC)、非小细胞癌或非小细胞肺癌(NSCLC)、鳞状细胞癌(SCC)、腺癌、支气管肺泡癌(BAC)、混合型肺癌、恶性胸膜间皮瘤、未分化大细胞癌、巨细胞癌、同步瘤、大细胞神经内分泌癌、腺鳞状癌、未分化癌;和小细胞癌,包括燕麦细胞癌、混合型小细胞/大细胞癌(LC)、大细胞癌和组合型小细胞癌;以及腺样囊性癌、错构瘤、粘液表皮样瘤、典型类癌肺肿瘤、非典型类癌肺肿瘤、外周类癌肺肿瘤、中枢类癌肺肿瘤、胸膜间皮瘤、未分化肺癌和起源于肺外的癌症例如自身体的其它部分转移至肺的继发性癌症或现在已知或以后发现的任何其它肺癌。肺癌可以是任何阶段或等级。本文使用的术语“来自受试者的生物样品”是指来自任何受试者的样品,包括吸烟者、非吸烟者、从前吸烟者、癌症患者(例如用于诊断和/或监测治疗后的癌症复发)、从前的癌症患者等。在具体的实施方案中,生物样品来源于吸烟个体,其在采集样品时如果进行成像诊断方法则不存在肺肿瘤;特别是如果进行螺旋CT扫描则不存在尺寸大于5mm的小结的吸烟个体。本文使用的术语“生物样品”可以是提供受试者的miRNA概况的准确测量的任何组织。在一些实施方案中,生物样品是生物流体。这些实施方案不狭窄地限于任何特定的体液,因为miRNA存在于基本上所有的体液中(Weber等,ThemicroRNAspectrumin12bodyfluids,ClinChem56:1733-1741,2010;DeGuire等,ClinBiochem46:846-860,2013;亦参见Rodriguez-Dorantes等,MethMolBiol1165:81-87,2014)。有用的体液的实例是外周血、血清、血浆、腹水、尿、痰、唾液、支气管肺泡灌洗液、囊液、胸膜液、腹膜液、淋巴、脓、来自窦室的灌洗液、支气管肺抽吸物和骨髓抽吸物。技术人员可无需过度实验而确定任何特定体液是否可用于任何特定应用。在一些实施方案中,体液是血浆或血清。在一些实施方案中,生物样品是组织样品。本文使用的单数形式"一"、"一个"和"所述"意欲也包括复数形式,除非上下文明确另外指示。另外,“或”的使用意欲包括“和/或”,除非上下文明确另外指示。本文使用的“个体”、“受试者”、“患者”或“有需要的受试者”是具有发展肿瘤或侵袭性肿瘤的风险的个体,或可具有或可罹患或经诊断具有肿瘤或侵袭性肿瘤的个体。这些术语可互换使用。优选地,个体是哺乳动物。哺乳动物可以是例如任何哺乳动物,例如人、灵长类动物、鸟、小鼠、大鼠、家禽、狗、猫、奶牛、马、山羊、骆驼、绵羊或猪。优选地,哺乳动物是人。本文使用的多个引物或探针中的“引物”或“探针”是核酸分子。引物或探针可以是DNA、RNA或cDNA。引物或探针可以是天然存在的或合成的。引物或探针可以是至少5、至少10、至少15、至少20、至少25、至少50、至少75、至少100个核酸长。优选地,多个引物和探针中的至少一个引物或探针能够选择性结合样品中的miRNA对的至少一个miRNA。优选地,多个引物或探针包含能够选择性结合样品中所有miRNA对表达比率的至少一个miRNA的至少一个引物或探针。术语“选择性结合”意指引物或探针具有对结合样品中的miRNA对的至少一个miRNA的高亲和力,或与样品中的任何其它miRNA比较对结合miRNA对的至少一个miRNA的更高亲和力。术语“引物”意指核酸分子能够用作DNA合成的起点。即是说,DNA聚合酶可从引物的3’端开始复制。用任何上述方法,本文使用的术语“miRNA对的表达比率”是两个特定miRNA的表达水平的比率。应理解,本文所述的任何方法中指定的任何miRNA对的比率可作为指定的比率的反比计算。作为非限制性实例,当具体方法的miRNA对是“106a/140-5p、106a/142-3p、126/140-5p、126/142-3p、133a/142-3p、140-5p/17、142-3p/148a、142-3p/15b、142-3p/17、142-3p/21、142-3p/221、142-3p/30b和320/660,或其反比”时,这些miRNA对的任何1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个或13个的表达比率可作为反比计算,其中截止值相应进行调整。本文使用的术语“截止值”可以是负数或正数。对于一些比率,“超过截止值”的表达比率是在数量上小于截止值的值。对于其它比率,“超过截止值”的表达比率是在数量上大于截止值的值。参见例如表9,其中“>”表示在数量上大于截止值的数代表超过截止值的比率,和“<”表示在数量上小于截止值的数代表超过截止值的比率。在该“超过截止值”的定义下,(i)对于比率133a/92a的值-4.50超过表9中所列的-4.18的截止值,(ii)对于比率17/451的值3.50超过表9中所列的3.33的截止值,(iii)对于比率142-3p/17的值-1.80超过表9中所列的-1.95的截止值,和(iv)对于比率16/197的值4.50超过表9中所列的5.00的截止值。在本文所述的任何方法中,任何特定miRNA对的表达比率的截止值从多个对照样品的多个相应的miRNA对的平均比率测定。本文使用的术语“多个对照样品”可来自任何确定的群体,例如无任何癌症历史的健康受试者、无肺癌历史的健康受试者、具有肺癌的受试者、从未吸烟的受试者、曾经吸烟但不再吸烟的受试者等。在优选的实施方案中,多个对照样品来自健康受试者,和截止值是来自多个对照样品的多个相应的miRNA对的平均比率。在这些实施方案的一些中,本文使用的术语“平均值”可以是均值或中位数。在其它实施方案中,截止值是平均值+/-一个标准偏差或标准偏差的任何更小或更大比例,例如+/-½个标准偏差、+/-¾个标准偏差、+/-1.5个标准偏差、+/-2个标准偏差或标准偏差的任何更大、更小或在中间的比例。对于来自任何对照群体的任何多个对照样品,截止值可通过使用已知的方法无需过度实验而确定,例如通过使用实施例中描述的训练集(trainingset)。确立截止值以获得需要的敏感性(SE)、特异性(SP)、阳性预测值(PPV)和阴性预测值(NPV)。为评价这些诊断方法(肿瘤的存在情况;侵袭性肿瘤的存在情况)和预后方法(出现肿瘤的风险;出现侵袭性肿瘤的风险),分类化解析了在临床背景中的试验结果。方法的诊断或预后值可通过它的SE、SP、PPV和NPV定义。任何试验方法将产生真阳性(TP)、假阴性(FN)、假阳性(FP)和真阴性(TN)。试验的“敏感性”是有疾病存在或有响应的具有阳性试验的所有患者的百分比,或(TP/TP+FN)×100%。试验的“特异性”是无疾病或无响应的具有阴性试验的所有患者的百分比,或(TN/FP+TN)×100%。试验的“预测值”或“PV”是值(阳性或阴性)是真实值的次数的度量(%),即是真阳性的所有阳性试验的百分比是阳性预测值(PV+)或(TP/TP+FP)x100%。“阴性预测值”(PV)是不响应的具有阴性测试的患者的百分比或(TN/FN+TN)×100%。另一度量,试验的“准确度”或“有效性”,是与试验总数相比试验给出正确答案的次数的百分比,或(TP+TN/TP+TN+FP+FN)×100%。“误差率”自经预测有响应而无响应的那些患者和经预测无响应而有响应的那些患者计算,或(FP+FN/TP+TN+FP+FN)×100%。总体测试“特异性”是敏感性的准确度的度量,和试验的特异性不随群体中疾病的总体可能性变化而变化,而预测值却会改变。PV随医生对给定患者中疾病的存在或不存在或临床响应的存在或不存在的临床评价而变化。对于任何给定测试,TP、FN、FP和TN可由技术人员确定和调整而无需过度实验,通过例如调整截止值、调整用于做出预后或诊断判定的统计显著性(例如P值);调整试验程序的准确度等。B.方法miRNA的表达水平可通过本领域已知的任何方法测定。在一些实施方案中,通过使用反转录酶-聚合酶链反应(RT-PCR)制备各miRNA对中的各miRNA的cDNA拷贝来测定表达水平。在各个实施方案中,表达比率进一步使用实时PCR测定。在这些方法的特定的实施方案中,表达比率进一步使用TaqMan探针测定。然而,所述方法不限于这些实施方案,和可使用现在已知或以后发现的用于确定miRNA表达水平的任何合适的方法实施。在本发明方法的一些实施方案中,测量之前扩增miRNA。在其它实施方案中,在扩增过程期间测量这些核酸的水平。在又其它的方法中,在测量之前不扩增核酸。存在许多方法用于扩增miRNA核酸序列,例如成熟miRNA、前体miRNA和初级miRNA。合适的核酸聚合和扩增技术包括反转录(RT)、聚合酶链反应(PCR)、实时PCR(定量PCR(q-PCR))、基于核酸序列的扩增(NASBA)、连接酶链反应、多路可连接探针扩增、侵入物技术(ThirdWave)、滚环扩增、体外转录(IVT)、链置换扩增、转录介导的扩增(TMA)、RNA(Eberwine)扩增和本领域技术人员已知的其它方法。在某些实施方案中,使用超过一种扩增方法,例如反转录,接着实时定量PCR(qRT-PCR)。在PCR和q-PCR方法中,例如,对各靶序列使用一组引物。在某些实施方案中,引物的长度取决于许多因素,包括但不限于引物、靶核酸序列之间需要的杂交温度和待扩增的不同靶核酸序列的复杂性。在某些实施方案中,引物为约15至约35个核苷酸长。在其它实施方案中,引物等于或小于15、20、25、30或35个核苷酸长。在另外的实施方案中,引物为至少35个核苷酸长。在进一步的方面,正向引物可包含退火至miRNA的至少一个序列,和备选地可包含另外的5′非互补区。在另一方面,反向引物可经设计以退火至反转录的miRNA的互补物。反向引物可不依赖于miRNA序列,和多个miRNA生物标记可使用相同的反向引物扩增。或者,反向引物可以是对miRNA生物标记特异的。qRT-PCR反应可通过包括反转录酶和基于DNA的热稳定DNA聚合酶两者,进一步与反转录反应组合。当使用两种聚合酶时,可使用“热启动”方法使测定法性能最大化(美国专利号5,411,876和5,985,619)。例如,反转录酶反应和PCR反应的组分可使用一种或多种热激活方法或化学改变隔绝,以改进聚合效力(美国专利号5,550,044、5,413,924和6,403,341)。在某些实施方案中,标签、染料或标记的探针和/或引物用于检测扩增的或未扩增的miRNA。技术人员将认识到,根据检测方法的敏感性和靶标的丰度,什么检测方法是合适的。根据检测方法的敏感性和靶标的丰度,在检测之前可需要或可不需要扩增。本领域技术人员将认识到其中miRNA扩增是优选的检测方法。探针或引物可包括Watson-Crick碱基或修饰的碱基。修饰的碱基包括但不限于AEGIS碱基(来自EragenBiosciences),其已描述于例如美国专利号5,432,272、5,965,364和6,001,983。在某些方面,碱基通过天然的磷酸二酯键或不同的化学连键连接。不同的化学连键包括但不限于肽键或锁核酸(LNA)连键,其描述于例如美国专利号7,060,809。在进一步的方面,扩增反应中存在的寡核苷酸探针或引物适合于监测随时间产生的扩增产物的量。在某些方面,具有不同的单链对比双链性状的探针用于检测核酸。探针包括但不限于5′-外切核酸酶测定(例如TaqMan™)探针(参见美国专利号5,538,848)、茎-环分子信标(参见例如美国专利号6,103,476和5,925,517)、无茎或线性信标(参见例如WO9921881、美国专利号6,485,901和6,649,349)、肽核酸(PNA)分子信标(参见例如美国专利号6,355,421和6,593,091)、线性PNA信标(参见例如美国专利号6,329,144)、非-FRET探针(参见例如美国专利号6,150,097)、Sunrise™/AmplifluorB™探针(参见例如美国专利号6,548,250)、茎-环和双链体Scorpion™探针(参见例如美国专利号6,589,743)、凸环探针(参见例如美国专利号6,590,091)、假结探针(参见例如美国专利号6,548,250)、cyclicons(参见例如美国专利号6,383,752)、MGBEclipse™探针(EpochBiosciences)、发夹探针(参见例如美国专利号6,596,490)、PNA照亮探针、抗引物猝灭探针(Li等,Clin.Chem.53:624-633(2006))、自装配纳米颗粒探针和描述于例如美国专利号6,485,901的二茂铁修饰的探针。在某些实施方案中,扩增反应中的一个或多个引物包括标签。在又其它的实施方案中,不同的探针或引物包括彼此可区别的可检测标签。在一些实施方案中,核酸,例如探针或引物,可用两种或更多种可区别的标签标记。在一些实施方案中,miRNA的浓度使用微阵列或另一载体测量。“微阵列”是离散区的线性或二维或三维(和固相)阵列,各自具有在固体载体的表面上形成的确定区域,所述载体例如但不限于玻璃、塑料或合成膜。微阵列上的离散区的密度通过在单一固相载体的表面上的固定的待检测的多核苷酸的总数确定,例如至少约50/cm2、至少约100/cm2或至少约500/cm2、直至约1,000/cm2或更高。阵列可包含总共少于约500、约1000、约1500、约2000、约2500、约3000或更多固定的多核苷酸。本文使用的DNA微阵列是置于芯片或其它表面上的寡核苷酸或多核苷酸探针的阵列,其用于杂交至自样品扩增的或克隆的多核苷酸。因为阵列上各具体探针组的位置是已知的,样品多核苷酸的身份可根据它们与微阵列上的特定位置的结合来确定。作为使用微阵列的备选方案,在载体上具有任何大小的阵列可用于实施本公开内容,包括二维或三维排列的一个或多个位置的排列,以检测miRNA的表达。在一些方面,将标签连接至一个或多个探针,和标签具有一个或多个以下性质:(i)提供可检测信号;(ii)与第二标签相互作用以改变第二标签提供的可检测信号,例如FRET(荧光共振能量转移);(iii)稳定杂交,例如双链体形成;和(iv)提供结合复合物或亲和组的成员,例如亲和力、抗体-抗原、离子复合物、半抗原-配体(例如生物素-亲和素)。在又其它的方面,标签的使用可使用多种已知技术中的任一种,使用已知的标签、连键、连接基团、试剂、反应条件和分析和纯化方法实现。MiRNA可通过直接或间接的方法检测。在直接的检测方法中,一个或多个miRNA通过与核酸分子连接的可检测标签检测。在这样的方法中,miRNA可在与探针结合之前进行标记。因此,通过筛选与探针结合的标记的miRNA来检测结合。探针任选与反应体积中的珠连接。在某些实施方案中,核酸通过与标记的探针直接结合来检测,和探针随后被检测。在本发明的一个实施方案中,核酸,例如扩增的miRNA,使用与探针缀合以捕获需要的核酸的FIexMAPMicrospheres(Luminex)检测。一些方法可包括例如用荧光标签修饰的多核苷酸探针检测或分支DNA(bDNA)检测。在其它实施方案中,核酸通过间接检测方法检测。例如,生物素化探针可与链霉抗生物素-缀合的染料组合以检测结合的核酸。链霉抗生物素分子结合扩增的miRNA上的生物素标签,和结合的miRNA通过检测与链霉抗生物素分子连接的染料分子来检测。在一个实施方案中,链霉抗生物素-缀合的染料分子包括Phycolink®链霉抗生物素R-藻红蛋白(PROzyme)。其它缀合的染料分子是本领域技术人员已知的。标签包括但不限于:光发射、光散射和光吸收化合物,其产生或猝灭可检测荧光、化学发光或生物发光信号(参见例如Kricka,L.,NonisotopicDNAProbeTechniques,AcademicPress,SanDiego(1992)和GarmanA.,Non-RadioactiveLabeling,AcademicPress(1997))。用作标签的荧光报告分子染料包括但不限于荧光素(参见例如美国专利号5,188,934、6,008,379和6,020,481)、若丹明(参见例如美国专利号5,366,860、5,847,162、5,936,087、6,051,719和6,191,278)、苯并吩噁嗪(参见例如美国专利号6,140,500);能量转移荧光染料,包括供体和受体对(参见例如美国专利号5,863,727;5,800,996;和5,945,526),和花青(参见例如WO9745539)、丽丝胺、藻红蛋白、Cy2、Cy3、Cy3.5、Cy5、Cy5.5、Cy7、FluorX(Amersham)、Alexa350、Alexa430、AMCA、BODIPY630/650、BODIPY650/665、BODIPY-FL、BODIPY-R6G、BODIPY-TMR、BODIPY-TRX、CascadeBlue、Cy3、Cy5、6-FAM、异硫氰酸荧光素、HEX、6-JOE、OregonGreen488、OregonGreen500、OregonGreen514、PacificBlue、REG、RhodamineGreen、RhodamineRed、Renographin、ROX、SYPRO、TAMRA、四甲基若丹明和/或TexasRed,以及能够产生可检测信号的任何其它荧光部分。荧光素染料的实例包括但不限于6-羧基荧光素;2′,4′,1,4,-四氯荧光素;和2′,4′,5′,7′,1,4-六氯荧光素。在某些方面,荧光标签选自SYBR-Green、6-羧基荧光素(“FAM”)、TET、ROX、VICTM和JOE。例如,在某些实施方案中,标签是能够发射不同的光谱可解析的波长的光的不同荧光团(例如4-不同颜色荧光团);某些这样的标记的探针是本领域已知的,和描述于上文和美国专利号6,140,054。在一些实施方案中使用包括报告分子荧光团和猝灭分子荧光团的双重标记的荧光探针。应当理解,选择具有不同发射光谱的荧光团对,以便它们可容易被区分。在又一方面,标签是杂交稳定部分,其用于增强、稳定或影响双链体的杂交,例如嵌入剂和嵌入染料(包括但不限于溴化乙锭和SYBR-Green)、小沟结合剂和交联官能团(参见例如Blackburn等编辑“DNAandRNAStructure”,载于NucleicAcidsinChemistryandBiology(1996))。在其它方面,可使用依赖于杂交和/或连接以定量miRNA的方法,包括寡核苷酸连接(OLA)方法和允许杂交至靶核酸序列的可区别探针与未结合探针分开的方法。作为实例,公开于美国公开号2006/0078894的HARP-样探针可用于测量miRNA的数量。在所述方法的另外的实施方案中,探针连接反应可用于定量miRNA。在多路连接依赖的探针扩增(MLPA)技术中(Schouten等,NucleicAcidsResearch30:e57(2002)),在靶核酸上直接彼此邻近杂交的探针对仅在靶核酸存在的情况下彼此连接。在一些方面,MLPA探针具有侧连的PCR引物结合位点。MLPA探针可仅在它们已经连接的情况下扩增,因此允许检测和定量miRNA生物标记。C.溶血的检测红细胞和血小板的溶血释放miRNA,其可干扰上述方法(Kirschner等,PLoSOne6:e24145,2011;Pritchard等,CancerPrevRes(Phila)5:492-497,2012)。因此,在上述方法的一些实施方案中,测定生物样品中的溶血,和如果测出溶血,则样品不进行所述方法。可在受试者样品中通过本领域已知的任何方法测定溶血。在一些实施方案中,溶血经分光光度测量法测定,例如通过测量不同波长的吸光度(414nm,541nm,576nm)以鉴定样品中游离血红蛋白的存在情况和量(Kirschner等,2011)。在其它实施方案中,通过分析在发生溶血的样品中增量调节的溶血相关的miRNA的表达水平来测定溶血。在这些实施方案的一些中,使用miRNAmiR-451、miR-486-5p、miR-16、miR-92a或miR-140-3p中的任一个,与未发生溶血的样品相比,其在发生溶血的样品中显著增量调节。在这些实施方案的各个方面,溶血相关的miRNA是miR-451、miR-486-5p、miR-16和miR-92a。在进一步的实施方案中,测定在发生溶血的样品中未增量调节的多个校正miRNA的表达水平和用于将溶血相关的miRNA的表达水平归一化。这些校正miRNA可以与溶血相关的miRNA的比率使用以将测定的后者miRNA的表达水平归一化。在这些实施方案的一些中,校正miRNA包括miR-126、miR-15b、miR-221和miR-30b。“溶血”标签在一些实施方案中,溶血进一步通过以下测定:(a)确定样品中由miR-451、miR-486-5p、miR-16和miR-92a的每一个与miR-126、miR-15b、miR-221和miR-30b的每一个配对组成的16个miRNA对的每一个的表达比率(即miR-451/miR-126、miR-451/miR-15b、miR-451/miR-221、miR-451/miR-30b、miR-486-5p/miR-126、miR-486-5p/miR-15b、miR-486-5p/miR-221、miR-486-5p/miR-30b、miR-16/miR-126、miR-16/miR-15b、miR-16/miR-221、miR-16/miR-30b、miR-92a/miR-126、miR-92a/miR-15b、miR-92a/miR-221和miR-92a/miR-30b或其反比);(b)比较来自步骤(a)的16个表达比率的每一个与对来自多个对照样品的多个相应的miRNA对的平均比率的每一个表达比率测定的截止值;(c)对于16个miRNA对的每一个,如果步骤(a)的表达比率超过步骤(b)的截止值,则对所述比率分配正评分,或如果步骤(a)的表达比率未超过步骤(b)的截止值,则对所述比率分配非正评分;和(d)按以下将样品分类:(i)如果16个比率中的8个或更多个超过截止值,则具有溶血;或(ii)如果16个比率中少于8个超过截止值,则不具有溶血。关于上述的诊断和预后测定法,该溶血测定法的截止值依赖于对照群体,例如其中多个未发生溶血的血清样品用作对照样品的截止值将不同于其中多个发生溶血的血清样品用作对照样品的截止值。参见实施例。另外,截止值可调整,例如以实现所需的SE、SP、PPV和NPV值。在其中未发生溶血的血清样品用作对照样品的一些实施方案中,截止值将是多个对照样品的平均(均值或中位数)比率。任选地,该截止值具有+/-比例的标准偏差,以解释在用于测定截止值的样品之间的可变性的差异。在各个实施方案中,上述使用miRNA表达水平的任何溶血测定法还与另一溶血测定法组合,例如Kirschner等,2011中描述的分光光度测量测定法。D.诊断组合如实施例中所述,组合本文所述的MSC标签与低剂量计算机断层摄影术(LDCT)允许检测通过LDCT不可检出的其它癌症,提高筛选敏感性,从对单独MSC的87%和对单独LDCT的84%提高至LDCT与MSC组合时的98%。在与LDCT之外的癌症筛选测定法组合时,上述的诊断和预后方法将预期显示诊断敏感性的类似改进。LDCT筛选和相关的随访程序的健康护理成本是显著的。最近的考虑在美国广泛采用LDCT的预算影响模型表明,LDCT筛选将避免多达8100例过早肺癌死亡,筛选率75%,避免一例肺癌死亡需要$240,000的额外筛选成本(Goulart等,2012)。通过降低下游成本,用非侵入性的生物标记试验补充LDCT筛选,可增加LDCT筛选中登记的个体数(Peres,JNatlCancerInst105:1-2,2013)。因此,任何上述诊断或预后方法可与使用不包括miRNA表达分析的系统筛选受试者的肺癌相组合。所述系统可在miRNA表达分析之前、同时或之后使用。现在已知或以后发现的任何系统将预期从用MSC的另外分析中获益。这样的系统的非限制性实例包括血液检验、x-射线、计算机断层摄影术、正电子发射断层摄影术、胸腔穿刺术、支气管镜检查法、细针抽吸活检、胸腔镜检查法、胸廓切开术或纵隔镜检查术。在一些实施方案中,所述系统是低剂量计算机断层摄影术(LDCT)。E.监测任何上述方法可用于监测受试者中肺癌的存在情况和/或发展肺癌的风险。当对在不同的时间获自受试者的至少两种不同的生物样品进行任何上述方法时,监测受试者。在一些实施方案中,至少两种不同的生物样品的至少一种在受试者已对肺癌进行治疗后获自受试者。这样的监测评价肺癌的复发或复发风险。F.治疗上述方法可用于选择治疗选项。本文使用的术语“治疗”意指描述给予药剂以消除肺癌的征兆或症状或降低其严重性。备选地或另外,可在多个部位发生的病症,如果在多个部位的至少一个中施用疗法至病症,则得到治疗。根据一个实施方案,上述方法可用于选择治疗选项,如果确定阴性存在情况或风险或如果在用于预测发展或具有肿瘤的风险的组合方法中确定低风险,则受试者不对肺癌进行治疗。在另一实施方案中,如果确定阳性存在情况或风险或如果在组合方法中确定中等或高风险,则受试者对肺癌进行治疗。因此,还提供对受试者确立肺癌治疗选项的方法。该方法包括使用上述的诊断和/或预后方法测试受试者和根据所述方法的结果确定治疗选项。该方法可进一步包括给予治疗至有需要的受试者。G.MiRNA总共24个miRNA可组成肺肿瘤的存在情况(PD)标签、侵袭性肺肿瘤的存在情况(PAD)标签、出现肺肿瘤的风险(RD)标签和出现侵袭性肺肿瘤的风险(RAD)标签。表1记载了在各标签中可存在的这24个miRNA。表1miRNAhsa-miR-16hsa-miR-17hsa-miR-21hsa-miR-101hsa-miR-126hsa-miR-145hsa-miR-197hsa-miR-221hsa-miR-320hsa-miR-451hsa-miR-660hsa-miR-106ahsa-miR-133ahsa-miR-140-3phsa-miR-140-5phsa-miR-142-3phsa-miR-148ahsa-miR-15bhsa-miR-19bhsa-miR-28-3phsa-miR-30bhsa-miR-30chsa-miR-486-5phsa-miR-92a表2提供用于本发明的所有方面的miRNA的概述。表2以下实施例被提供用以更好地说明要求保护的发明和不应视为限制本发明的范围。在提及具体材料时,仅为举例说明的目的,和不意欲限制本发明。本领域技术人员可开发等同工具或试剂,而不需要运用创造性能力,并且未脱离本发明的范围。实施例以下实施例涉及在计算机断层摄影术肺癌筛选中基于血浆的microRNA标签分类符的临床功用,亦称为相关的MILD试验研究。提供来自验证研究的结果,所述验证研究在LDCT对比观察的随机多中心意大利肺检测(MILD)临床试验中在预期自吸烟受试者收集的样品中回顾评价的939名受试者中确定预指定miRNA标签分类符(MSC)算法的诊断性能(Pastorino等,2012)。我们证实,MSC具有显著的诊断和预后性能。实施例1:方法A.研究群体。多中心意大利肺检测(MILD)试验是一个随机的前瞻性临床试验,在2005年发起,和在米兰国立肿瘤研究所(IstitutoNazionaledeiTumori)募集4,099名目前或从前的吸烟者,至少50岁和在前五年内无癌症历史:2,376名(58%)随机化至LDCT组(1190名一年一次,1186名两年一次LDCT)和1,723名(42%)至观察组(Pastorino等,2012)。在试验的所有志愿者招募时(基线)和各每年一次或两年一次召回时,根据米兰国立肿瘤研究所国际审查和伦理委员会(InternalReviewandtheEthicsBoards),按所述(Boeri等,2011)收集全血。对于该研究,在试验募集的无肺癌个体中自2009年6月至2010年7月收集的1,000份连续的血浆样品用于确定MSC的特异性。首先测定血浆样品的溶血(见下文)以除去来自可能被血细胞miRNA污染的患者的样品(Kirschner等,2011;Pritchard等,2012)。在这1000份样品中,130份因为溶血而不可评价。在剩余的870名受试者中,594名(68%)属于LDCT组和276名(32%)属于观察组。为获得用于确定MSC的敏感性性能的小组,自到2012年9月诊断为肺癌的几乎全部患者获得血浆样品(N=85)。我们偏爱在代替匹配的病例和对照的大的未选择的受试者系列(其已经极大减少了对照数和研究能力)中,测量阴性预测值(NPV)。对于这85名患者中的69名,收集至少1份可评价样品。对于所有患者,我们考虑了最接近得出癌症诊断的LDCT检查的样品。具体地,对50名患者可获得诊断时的样品,和对19名患者可获得前-疾病样品(图1)。前-疾病样品自肺癌检测前8-35个月收集,具有18个月的中位数滞后时间。B.MicroRNA概况分析。自200μl血浆样品用mirVanaPARISKit(LifeTechnologies,Ambion)提取总RNA,并在50μl缓冲液中洗脱。对于miRNA表达,在3μl洗脱的RNA中,使用MultiplexPoolsProtocol在包含一式两份点样的24个miRNA的定制的微流卡(LifeTechnologies,AppliedBiosystems)上测定。对于各样品,个体miRNA的Ct使用ViiA7软件(LifeTechnologies,AppliedBiosystems)以阈值0.15和自动基线测定。为输入至MSC,预确定的miRNA比率的一式两份读数的平均值按之前所述(Boeri等,2011)计算。C.统计学分析。对个体受试者的临床结果盲的MSC风险评分提交至独立的研究中心,米兰的MarioNegri研究所(IstitutoMarioNegri),并按预指定的统计分析计划完成数据分析。MSC的敏感性(SE)、特异性(SP)、阳性预测值(PPV)和阴性预测值(NPV)用计算机处理,以评价MSC的识别性能,以对全部以及研究的LDCT和观察组两者,将经诊断具有肺癌的患者对比无疾病受试者进行分类。对于诊断性能,将分类在MSC-低风险组内的个体与在MSC-中等或MSC-高风险组内的那些比较。考虑到单阳性和双阳性试验,我们还用计算机处理了SE和SP以组合使用二元MSC和LDCT。为了解释MSC的时间依赖性作为疾病发展的预测物,使用Heagerty等,Biometrics56:337-344(2000)以及Zheng和Heagerty,Biometrics63:332-341(2007)描述的方法,对自血样品收集至肺癌诊断的不同时间间隔(6、12、18和24个月)评价了SE、SP、PPV和NPV。为确定MSC的预后性能,检查所有三个风险组,和在所有939名受试者中,根据MSC获得存活率曲线作为自血样品收集的日期的Kaplan-Meier估计值。我们使用Cox比例事故模型评价了MSC的存活不一致性,还考虑对年龄和性别进一步调整的模型,和用计算机处理了在高/中等和低MSC之间的χ21检验。D.评价影响血浆样品的溶血。存在溶血的血浆样品从随后的分析中除去,因为血细胞例如红细胞(RBC)或血小板的溶血释放污染miRNA(Kirschner等,2011;Pritchard等,2012)。对于该评价使用两次质量控制(QC)测量。首先,在RNA提取之前的预分析步骤中,通过测量在不同波长的吸光度(414nm,541nm,576nm)完成分光光度测量分析,以鉴定样品中游离血红蛋白的存在情况和量(Kirschner等,2011)。对所有样品,通过分析miRNA标签分类符内包含的溶血相关的miRNA的表达水平(MSC;mir-451,486-5p,16,92a),进行第二个QC步骤以获得甚至更大的溶血敏感性。溶血相关的miRNA的表达水平自所有样品的总体平均值超过2个标准偏差的血浆样品从随后分析中排除。具有可测定的经分光光度测量法测量的溶血的样品也在该第二QC步骤中被排除。在癌症对比对照样品中未观察到经分光光度测量法或通过溶血相关的miRNA分析测量的溶血的频率或量上的差异。除了溶血释放的污染miRNA的可能性之外,血浆中差异表达的miRNA可简单地反映不同的血细胞计数(Pritchard,2012)。为了分析该假设,将由中性粒细胞表达的和RBC表达的miRNA(Id.)组成的miRNA比率与通过自本研究的23名肺癌患者的全血计数(CBC)获得的中性粒细胞和RBC水平之间的比率比较。如表3所报告的,标签中存在的miRNA比率无一被发现具有与各自的CBC比率的显著相关性。表3.23名肺癌患者中血浆miRNA比率与血细胞计数的相关性。23个样品中的中性粒细胞对比RBCmiRNA比率和中性粒细胞对比RBC计数的Pearson相关系数显示在表中。报告了统计学显著相关性(双尾p-值<0.05)。包括溶血相关的miRNA的分析的第二QC步骤可另外或备选地利用溶血miRNA标签,其包括本文所述的MSC内含有的miRNA。i.使用miRNA标签检测溶血:血浆收集收集全血样品,加入EDTA,并处理之前在室温贮存不超过1-2小时。应避免在降低温度下贮存,因为其可导致非特异性释放miRNA。样品在4℃以大约1250xg离心10分钟,以分离血浆,小心将其转移,同时避开最接近淋巴细胞环的材料。将血浆再次在相同条件下离心和然后分成等份,不要沉淀材料,在-80℃贮存长达1年或更久。ii.在发生溶血的样品对比未发生溶血的样品中的MiRNA表达水平为了开发用于检测溶血的miRNA标签,将24份血浆样品溶血。溶血通过视觉检查评价。针对一组miRNA的表达,使用定制的微流卡分析发生溶血的样品的概况。将发生溶血的样品中的miRNA的表达与自98名无疾病个体的未发生溶血的(基于视觉评估)样品中的表达比较。四个miRNA(miR-16,miR-451,miR-486-5p和miR-92a)包括在miRNA标签的开发中。原始Ct值(表达水平的度量)显示在表4中。与未发生溶血的样品相比,在发生溶血的样品中,除了miR-140-3p之外,4个miRNA,miR-16,miR-451,miR-486-5p和miR-92a,也显著增量调节(p<0.00l)。表4.在发生溶血的样品对比未发生溶血的样品中miRNA的原始Ct值。iii.在溶血标签中产生miRNA比率为了使用miRNA比率区别发生溶血与未发生溶血的样品,分析包含连续稀释的体外溶血血浆样品的正常血浆样品的miRNA表达水平。计算各miRNA与表4中显示的增量调节的四个miRNA(miR-16、miR-451、miR-486-5p和miR-92a)的每一个的比率。MiR-126、miR-15b、miR-221和miR-30b被鉴定为与四个增量调节miRNA的比率具有最佳溶血相关性的miRNA(表5)。表5.代表体外溶血的血浆miRNA表达水平比率。各值表示为log2(比率)使用下式计算平均基线miRNA比率:来自98名无疾病个体的未发生溶血的血浆样品的平均比率+1.5s.d.(标准偏差)。这些基线比率设定为开发溶血miRNA标签中的16个miRNA比率的每一个的截止值。iv.使用溶血miRNA标签检测溶血溶血miRNA标签可用于检测血浆样品中的溶血。表6显示由8个miRNA(miR-126、15b、30b、221、451、16、486-5p和92a)构成的16个比率的列表。具体而言,4个miRNA,miR-451、miR-486-5p、miR-16和miR-92a,全都在发生溶血的样品中过量表达。该过量表达可用作血浆样品中溶血的指示物。此外,如果表6所示的16个比率中的8或更多个超过截止值,则血浆样品为溶血阳性。表6.溶血miRNA标签v.比较溶血miRNA标签与血红蛋白用于检测溶血的吸光度方法本领域已知血红蛋白具有414nm的吸光度波长。用于科学和临床实践两者以分析溶血的一个标准方法是血浆样品中的游离血红蛋白在波长414nm处的光谱测量(使用吸光度阈值0.2)。在该实验中,414nm处的吸光度针对375nm处的吸光度归一化,以克服在一些样品中(例如在脂血样品中)的高背景信号。对414nm处的吸光度与375nm处的吸光的比率,设定了截止值1.4。如表5的最后一行所示,A414nm/A375nm值大于1.40的样品对应于其中16个miRNA比率中的至少8个超过其各自的截止值的miRNA标签。这些设定用于评价miRNA标签在区分24个发生溶血的血浆样品与98个未发生溶血的(基于视觉检查)血浆样品中的能力。miRNA标签方法显示0.88的敏感性和0.93的特异性。关于敏感性,明显的是视觉评估发生溶血的24个样品的确发生了溶血。使用由选择的视觉上发生溶血的60个血浆样品(红色、橙色或深黄色)和根据视觉检查未发生溶血的43个血浆样品构成的独立系列,比较溶血miRNA标签和分光光度测量方法。关于敏感性(表7),通过两种方法,5个最溶血(红色)的样品全部被识别为溶血阳性。然而,在评价橙色和深黄色样品时,miRNA标签方法是更灵敏的(>90%对比分光光度测量方法的76%)。表7.比较分光光度测量和miRNA结果,以评价60个视觉上发生溶血的血浆样品中的溶血。()通过各方法检测为发生溶血的总体百分比另一方面,在根据视觉检查未发生溶血的43个血浆样品中(表8),结果显示使用下述两种方法时3(7%)个样品是溶血阳性的:在仅分光光度测量方法中,1(2%)个样品是阳性的;和在仅miRNA标签方法中,2(5%)个样品是阳性的。在两种方法之间40(93%)个样品具有溶血分类一致性。除了两种方法中均为阳性的3个案例以外,分光光度测量方法具有97.5%特异性和miRNA标签方法具有95%特异性。表8.比较分光光度测量和miRNA结果,以评价43个未发生溶血(根据视觉检查)的血浆样品中的溶血。()总体百分比;κ统计值=0.63E.MiRNA标签分类符(MSC)算法。本文详细描述了MSC算法。为开发该算法,在之前所述的INT/IEO肺癌筛选试验(Boeri等,2011)之前前瞻性收集或在从INT/IEO肺癌筛选试验诊断时的肺癌患者的样品的训练集中,自在血浆中(稳定)循环的100个不同的miRNA的4,950个比率开始,产生24个不同miRNA的不同基因表达比率。用于本研究的预指定的MSC算法的开发从之前的研究以两种方式精修。首先,将可检出溶血的样品自原始训练集中除去(Boeri等,2011)。在该出版物之后,研究者报告了溶血影响血浆和血清样品中miRNA的准确的表达测量。因此,为产生用于MSC的最佳的训练集,由于通过分光光度测量分析可检出血红蛋白和溶血相关的miRNA水平增加(如本文所述),原始训练集内的5个样品被排除。MiRNA比率然后用于最佳训练集以开发疾病风险(RD)、疾病存在情况(PD)、侵袭性疾病风险(RAD)和侵袭性疾病存在情况(PAD;表9)的miRNA标签。表9.精修的miRNA-比率标签和相应的截止值(log2)。RD:疾病风险;RAD:侵袭性疾病风险;PD:疾病存在情况;PAD:侵袭性疾病存在情况。对在-80℃贮存至少1年和至多5年的血浆样品建立比率截止值。自之前研究的不同于本研究的MSC算法开发的第二方式是,使用来自MILD试验的未包括在939名受试者验证组中的84名无疾病个体的训练集的血浆样品,产生预确定的比率截止值以获得≥80%特异性。使用来自单一受试者的血浆样品代替库(在Boeri等,2011中使用),允许我们考虑在训练集中最初鉴定的所有24个miRNA和产生准确的截止值。因此,本研究可包括mir-101、145和133a,其因为在用于该研究的对照库内的受试者之间高的变异性而被排除在之前的验证集中。为了对疾病建立三水平风险分类(MSC低、中等和高),训练集也用于确立超过被认为是阳性而需要的各自截止值的最少比率数:对于RD为10/27,对于PD为9/27,对于RAD为14/28,对于PAD为14/28。三水平MSC然后按以下定义:如果RDneg∩PDneg∩RADneg∩PADneg,则为低风险(L);如果RDposUPDpos∩RADneg∩PADneg,则为中等风险(I);或如果RADposUPADpos,则为高风险(H)。这些预指定的风险组然后用于测试在来自MILD筛选试验的939名受试者的独立集内的诊断和预后性能。F.受试者的特征。在MILD试验中募集的具有可评估的血浆样品的939名受试者的特征(2005-2012;LDCT:N=652;观察:N=287),包括69名肺癌患者和870名无肺癌受试者,根据年龄、性别和吸烟状态、持续时间和香烟数/天而指出(表10)。肺癌患者岁数大于无肺癌患者(p<0.0001)和男性比例更高(81.2%vs.63.3%;p=0.0029)。吸烟状态在有癌症或无癌症组之间无显著差异,但发展癌症的受试者已经吸烟更长的时间(p<0.0001)。表10:根据年龄、性别和吸烟,69名肺癌受试者和870名无肺癌受试者的分布。多中心意大利肺检测(MILD)研究,2005-2012。对于癌症患者,自随机至诊断的中位数时间是29个月(范围1-82)和自血浆采样至诊断的中位数时间是2个月(范围0-35)。在无肺癌受试者中,自随机至血浆采样的中位数时间是44个月(范围0-58)和自血浆采样至最后随访的中位数时间是27个月(范围3-41)。实施例2:MSC的诊断和预后性能对于在诊断之前或在诊断时自跨越LDCT和观察组的939名受试者获得的可评价的血浆样品,使用基于实时RT-PCR的测定法以癌症组的低、中等和高风险的预指定的MSC算法进行分析。对所有939名受试者,根据肺癌发生、肺癌死亡和肿瘤阶段(表11)检查MSC风险组。MSC中等和高正确地分类了69名肺癌患者中的60名,其中87%SE、81%SP、27%PPV和99%NPV。在随访期间死亡的19名肺癌患者中,18名是MSC试验阳性的,其中95%SE、81%SP、10%PPV和100%NPV。在随访期间未观察到由于并非肺癌的原因的死亡。在两个组内对肺癌检测比较的MSC诊断性能是类似的,其中对LDCT和观察组分别为88%SE、80%SP、31%PPV、99%NPV和82%SE、83%SP、16%PPV、99%NPV。表11.根据肺癌患病率、肺癌死亡和肺癌阶段和miRNA标签分类符(MSC),69名肺癌受试者和870名无肺癌受试者的分布,以及相应的敏感性(SE)、特异性(SP)、阳性预测值(PPV)和阴性预测值(NPV)。多中心意大利肺检测(MILD)研究,2005-2012。在所有三个MSC风险组中,观察到疾病引起死亡的比例的明显趋势,其中分别与低、中等和高相关的肺癌死亡的比例增加(p=0.0336)。MSC风险组与各个肿瘤阶段(I、II-III或IV;表11)不显著相关(p=0.40)。在MSC风险组和组织学亚型之间(χ2=1.60,p=0.4485)和在腺癌和鳞状细胞癌之间(χ2=0.55,p=0.759)未观察到显著差异。MSC的诊断性能的时间依赖性分析显示在采血和肺癌诊断之间6、12、18和24个月间隔的SE、SP、PPV和NPV的类似的值(表12)。表12.miRNA标签分类符(MSC)的时间依赖性分析,以及自采血至肺癌检测的6、12、18和24个月计算的敏感性(SE)、特异性(SP)、阳性预测值(PPV)和阴性预测值(NPV)。实施例3:LDCT和MSC的补充诊断性能限定分析至LDCT组中的总共652名受试者,LDCT鉴定了58名肺癌受试者中的46名,缺少未检出肺小结的251名受试者内的3名患者和因为79%的SE的间期癌症的9名患者(表13)。“无肺小结”的三例癌症包括一例非实体病灶、一例纵膈腺病和一例胸膜渗液。预指定的MSC二元风险组(考虑高和中等对比低)鉴定了46例LDCT-检出的癌症中的40例,9例间期癌症中的8例和全部3名“无肺小结”受试者。LDCT具有对非钙化小结>5mm的临床无效的亚组的81%的SP和相关的假阳性率19.4%(115/594)(表13)。当考虑双阳性(LDCT和MSC)受试者时,假阳性率降低至3.7%(22/594),其中SE降低(40/58,69%)。相反地,考虑具有至少一个阳性测试(LDCT或MSC)的受试者为阳性时,组合使用LDCT和MSC鉴定了58个病例中的57个,其中SE为98%和SP为65%。另一方面,MSC检出在观察组中存在的11(82%)例肺癌中的9例(表13)。实施例4:MSC风险组与存活率的关联自对具有三年随访的所有受试者(N=939)收集的血浆样品,完成分析以确定三个预确定的MSC风险组的预后性能,以预测总体存活率。对具有低MSC的受试者,两年存活率是100%,对中等MSC是98%和对高MSC是87%,而对低、中等和高,三年存活率分别是100%、97%和77%(图2)。在高/中等和低MSC之间存活率的差异是统计学显著的(χ2=49.53,P<0.0001)。在对年龄和性别调整后不一致性仍是显著的(χ2=12.57,P=0.0004)。实施例5:分析与99%的NPV相关的高敏感性的诊断特征表明,MSC是经临床上验证的筛选试验。此外,MSC作为肺癌发展的预测物的诊断性能通过时间依赖性分析得到证实。MSC鉴定了具有疾病导致死亡的高可能性的受试者。作为二元诊断,对于跨越两个组的939名受试者,MSC对疾病导致死亡具有95%的SE和100%的NPV。此外,MSC风险组与对于939名受试者的整个组的显著不同的3年存活率相关(对于低、中等和高MSC分别为100%、97%和77%)。这些发现证实了血浆miRNA鉴定了肿瘤的恶性和侵袭性两者。三个小的欧洲随机试验,包括MILD,迄今已报道了非显著的死亡率降低(Infante等,2009;Saghir等,2012;Pastorino等,2012)。国家肺筛选试验(NSLT),一个募集53,454个人以反差胸放射照片的3轮LDCT一年一次筛选的随机的临床筛选试验,证实了肺癌死亡率降低20%(Aberle等,2011)。在3轮筛选后,24.2%的受试者被分类为阳性,其中96.4%的这些受试者是假阳性,需要筛选320名受试者以防止1例肺癌死亡。在检查LDCT筛选的益处和害处的所有的随机临床试验的系统回顾中,平均小结检出率是20%,其中90%的小结是良性的(Bach等,JAMA307:2418-2429,2012)。在该研究中,MSC分类了在LDCT组的652名个体中74%(485)为低风险:478名为真阴性和7名为假阴性。MSC能够鉴定通过LDCT未能检出的9例间期癌症中的8例。因此,MSC和LDCT的整合(至少一例试验阳性)将提高筛选敏感性,从单独MSC的87%和单独LDCT的84%至98%(57/58),假阳性率为35%。相反地,考虑到双阳性受试者(MSC和LDCT阳性),MSC与LDCT的整合将降低LDCT筛选的假阳性率超过5-倍。特别是,与单独LDCT的19.7%(115/594)相比,双假阳性MSC和LDCT的频率仅为3.7%(22/594),不过降低SE至69%。因此,MSC可通过降低假阳性结果而补充LDCT筛选,和能够使诊断算法更大程度标准化,从而降低健康护理成本。此外,鉴于对于低MSC受试者缺少3年死亡率,可提议对具有低MSC的个体进一步重复MSC而非LDCT。预指定的基于血浆的测定法的本盲法研究代表了在LDCT筛选试验中测试生物标记的最大研究,和证实了与MSC组合时LDCT的优秀的诊断性能。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1