通过基于结构的探针切割鉴定核酸靶标的制作方法
本发明涉及核酸检测的领域。具体而言,本发明提供了进行靶核酸的高通量多路检测的方法。
背景技术:
许多用于检测靶核酸的方法是已知的。现有的用于核酸检测的同质测定法包括TaqMan®、Ampliflour®、染料结合、等位基因选择性的动态PCR和Scorpion®引物测定。由于待检测的每种靶核酸需要不同的染料,这些测定操作不容易多路化,并且因此在其改善潜力方面有限。为了克服此类局限性,几项近期研究已公开了含有可切割的“标签”部分的寡核苷酸探针的应用,所述“标签”部分可以被容易地分离和检测(例如参见Chenna等人,美国专利申请公开号2005/0053939;Van Den Boom,美国专利号8,133,701)。然而,来自这些研究的结果表明,在能够准确地使检测标签与靶核酸相关联上存在问题,并且仍需要进行靶核酸的高通量多路检测的准确方法。
发明概述
本发明提供了用于核酸序列检测的新型方法。在该方法中,在PCR期间通过DNA聚合酶的5'-核酸酶活性产生与扩增区内的靶核酸结合的、来自寡核苷酸探针的独特的鉴定性切割片段。这通过具有附接至探针的5'末端的非互补“翼(flap)”区来实现。通过鉴定独特的切割片段,可以确定靶核酸的身份。例如,这可以容易地通过质谱法来完成。由于具有独特的且可容易分辨的质量的可能切割片段的数目极大,由此使得核酸靶标的快速高通量多路检测成为可能。
因此,在一个方面,本发明提供了检测样品中存在或不存在靶核酸序列的方法,所述方法包括以下步骤:
(a)通过使包含靶核酸的样品与以下物质接触来制备反应混合物:(i)一对各自与亲和标记物附接的寡核苷酸引物,其中第一寡核苷酸引物包含与靶核酸序列的一条链中的区域互补的序列且引发第一延伸产物的合成,且其中第二寡核苷酸引物包含与所述第一延伸产物中的区域互补的序列且引发与所述第一延伸产物互补的核酸链的合成,和(ii)寡核苷酸探针,其包含至少两个不同部分,第一部分包含标准核苷酸,其具有或不具有核苷酸类似物,所述第一部分包含与靶核酸序列的区域至少部分互补的序列,其中所述第一部分在所述寡核苷酸引物对所结合的靶核酸序列内退火,且其中所述第一部分还包含亲和标记物,在3'末端处或附近的外切核酸酶抗性修饰以防止被3'至5'外切核酸酶切割,且在3'末端处被阻断以阻止通过核酸聚合酶延伸;且附接至所述第一部分的5'末端的第二部分包含核苷酸或非核苷酸或核苷酸和非核苷酸两者,且包含与靶核酸序列非互补的序列,其中所述第二部分还包含外切核酸酶抗性修饰;
(b)在一定条件下在包含核苷酸三磷酸和具有5'至3'核酸酶活性的核酸聚合酶的反应混合物中扩增所述靶核酸序列,所述条件允许所述寡核苷酸引物对和所述寡核苷酸探针与所述靶核酸序列退火以及从所述寡核苷酸引物对合成引物延伸产物,而所述核酸聚合酶的5'至3'核酸酶活性能够切割退火的寡核苷酸探针并从其释放含有所述寡核苷酸探针的第二部分的片段,所述片段具有或不具有来自所述寡核苷酸探针的第一部分的额外核苷酸;
(c)使所述反应混合物经受亲和基质,所述亲和基质识别并结合所述寡核苷酸引物对和所述寡核苷酸探针上的亲和标记物,由此除去过量寡核苷酸引物和未切割的寡核苷酸探针;
(d)用3'至5'外切核酸酶处理所述含有所述寡核苷酸探针的第二部分的片段,所述3'至5'外切核酸酶切割所述片段直到外切核酸酶抗性修饰,由此产生具有独特的质量可区分的大小的单个片段;和
(e)通过质谱法检测所述单个片段的存在或不存在,由此检测所述样品中存在或不存在所述靶核酸序列。
在一些实施方案中,在步骤(d)期间,通过添加碱性磷酸酶来除去未并入的核苷酸三磷酸。在一些实施方案中,步骤(e)之前是纯化所述反应混合物以除去质谱的污染物的步骤。
在另一个实施方案中,所述亲和标记物包含生物素,且亲和基质包含链霉抗生物素包被的颗粒。在另一个实施方案中,所述外切核酸酶抗性修饰选自硫代磷酸酯、2'-O-甲基-核糖核苷酸、丙二醇间隔物、HEG间隔物和反向核苷酸。
在另一个方面,本发明提供了包含寡核苷酸探针的组合物,其中所述寡核苷酸探针包含至少两个不同部分,其中第一部分包含标准核苷酸,其具有或不具有核苷酸类似物,所述第一部分包含与靶核酸序列的区域至少部分互补的序列,其中所述第一部分在所述寡核苷酸引物对所结合的靶核酸序列内退火,且其中所述第一部分还包含亲和标记物,在3'末端处或附近的外切核酸酶抗性修饰以防止被3'至5'外切核酸酶切割,且在3'末端处被阻断以阻止通过核酸聚合酶延伸;且附接至所述第一部分的5'末端的第二部分包含核苷酸或非核苷酸或核苷酸和非核苷酸两者,且包含与靶核酸序列非互补的序列,其中所述第二部分还包含外切核酸酶抗性修饰。
在另一个方面,所述组合物还包含一对各自与亲和标记物附接的寡核苷酸引物,其中第一寡核苷酸引物包含与靶核酸序列的一条链中的区域互补的序列且在扩增反应中引发第一延伸产物的合成,且其中第二寡核苷酸引物包含与所述第一延伸产物中的区域互补的序列且在所述扩增反应中引发与所述第一延伸产物互补的核酸链的合成。
在一个实施方案中,所述亲和标记物包含生物素,且亲和基质包含链霉抗生物素包被的颗粒。在另一个实施方案中,所述外切核酸酶抗性修饰选自硫代磷酸酯、2'-O-甲基-核糖核苷酸、丙二醇间隔物、HEG间隔物和反向核苷酸。
在另一个方面,本发明提供了包含寡核苷酸探针的组合物,其中所述寡核苷酸探针包含至少两个不同部分,第一部分包含标准核苷酸,其具有或不具有核苷酸类似物,所述第一部分包含与靶核酸序列的区域至少部分互补的序列,其中所述第一部分在所述寡核苷酸引物对所结合的靶核酸序列内退火,其中所述第一部分还包含在5'末端处的修饰,所述修饰使其对单链特异性5'-3'-外切核酸酶的切割具有抗性,且附接至所述第一部分的3'末端的第二部分包含核苷酸或非核苷酸或核苷酸和非核苷酸两者,且包含与靶核酸序列非互补的序列,其中所述第二部分还包含使其对单链特异性5'-3'外切核酸酶的切割具有抗性的修饰。
在一些实施方案中,所述寡核苷酸探针的第二部分中的外切核酸酶抗性修饰包含不可切割的核苷酸类似物,其选自硫代磷酸酯、2'-O-甲基-核糖核苷酸、丙二醇间隔物、HEG间隔物、反向核苷酸、或使得寡核苷酸片段在修饰附接点外对于核酸外切切割具有抗性的任何其它修饰。在其它实施方案中,所述寡核苷酸探针的第二部分包含非核苷酸,其可以是任何有机部分或重复单元(例如(CH2-CH2-O)n等)。
在另一个方面,本发明提供了在样品中进行不止一种靶核酸的高通量多路检测的方法,所述方法包括以下步骤:a)提供包含靶核酸的样品;b)从所述样品提取总核酸;c)提供不止一对寡核苷酸引物,其中各引物对与所述不止一种靶核酸之一互补并且可以引发从所述不止一种靶核酸之一合成延伸产物,且其中各寡核苷酸引物与亲和标记物附接;d)提供不止一种寡核苷酸探针,其中各探针包含至少两个不同部分,其特征在于:(i)第一部分包含标准核苷酸,其具有或不具有核苷酸类似物,所述第一部分包含与靶核酸序列的区域至少部分互补的序列,其中所述第一部分在所述寡核苷酸引物对所结合的靶核酸序列内退火,且其中所述第一部分还包含亲和标记物,在3'末端处或附近的外切核酸酶抗性修饰以防止被3'至5'外切核酸酶切割,且在3'末端处被阻断以阻止通过核酸聚合酶延伸;(ii)附接至所述第一部分的5'末端的第二部分包含核苷酸或非核苷酸或核苷酸和非核苷酸两者,且包含与靶核酸序列非互补的序列;其中所述第二部分还包含外切核酸酶抗性修饰,其中来自各寡核苷酸探针的第二部分与来自其它寡核苷酸探针的第二部分相比具有质量可区分的大小,
e)在包含不止一对寡核苷酸引物和不止一种寡核苷酸探针的反应混合物中,且在聚离子去污剂、盐和金属缓冲液、核苷酸三磷酸以及具有5'至3'核酸酶活性的核酸聚合酶的存在下,在允许各寡核苷酸引物对和各寡核苷酸探针对与其互补的靶核酸序列退火以及各寡核苷酸引物对合成引物延伸产物的条件下,扩增所述不止一种靶核酸,而所述核酸聚合酶的5'至3'核酸酶活性能够切割各退火的寡核苷酸探针并从其释放含有各所述寡核苷酸探针的第二部分的片段,其具有或不具有来自各所述寡核苷酸探针的第一部分的额外核苷酸;
f)使所述反应混合物经受亲和基质,所述亲和基质识别并结合所述不止一对寡核苷酸引物和所述不止一种寡核苷酸探针上的亲和标记物;
g)过滤反应混合物以除去过量的寡核苷酸引物和未切割的寡核苷酸探针,并收集包含来自所述寡核苷酸探针的第二部分的片段的上清液;h)向所述上清液中添加碱性磷酸酶以降解未并入的核苷酸三磷酸并加入3'至5'外切核酸酶,所述3'至5'外切核酸酶将来自寡核苷酸探针的第二部分的片段切割直至外切核酸酶-抗性修饰[包含丙二醇],由此产生来自各寡核苷酸探针的第二部分的单个片段,其中各单个片段对应于靶核酸且具有独特的质量可区分的大小;I)通过柱色谱法除去聚离子去污剂和盐以及金属缓冲液;j)使用质谱法以检测对应于所述样品中存在的所述一种或多种靶核酸的单个片段的存在。
在一个实施方案中,所述扩增步骤在多个反应混合物中进行。在另一个实施方案中,移除去污剂以及质谱法的步骤在自动化过程中进行。
附图简述
图1代表本发明的方法的说明性描述。
图2代表质谱图,其显示寡核苷酸T9JTTTGC经外切核酸酶I消化后的寡核苷酸片段,其中J是2’-O-甲基-尿苷(A)、HEG间隔物(B)或丙二醇间隔物(C)。
图3代表在PCR扩增反应中的EGFR T790M突变体5'-翼探针片段的LC-MS后,以及在不具有(A)或具有(B)通过外切核酸酶I的后续消化后的提取离子色谱图(EIC)。
图4代表进行靶核酸的高通量多路检测的本发明的方法的详细流程图。
图5代表实施例3中所述的多路测定的单离子监测色谱图。
发明详述
定义
如本文所使用的术语“样品”包括包含核酸的样本或培养物(例如,微生物培养物)。术语“样品”还意图包括生物样品和环境样品。样品可以包括合成起源的样本。生物样品包括全血、血清、血浆、脐带血、绒毛膜绒毛、羊水、脑脊液、脊髓液、洗出液(例如,支气管肺泡的、胃的、腹膜的、管的、耳的、关节镜的洗出液)、活组织检查样品、尿、粪便、痰、唾液、鼻粘液、前列腺液、精液、淋巴液、胆汁、泪液、汗液、乳汁、乳房流体、胚胎细胞和胎儿细胞。在一个优选的实施方案中,所述生物样品是血液,并且更优选地是血浆。如本文所使用的术语“血液”包括全血或任何血液级分,诸如如常规地定义的血清和血浆。血浆是指由用抗凝剂处理过的血液的离心产生的全血级分。血清是指血液样品已经凝固后剩下的流体的水样部分。环境样品包括环境材料诸如表面物质、土壤、水和工业样品,以及来自食物和乳制品加工仪器、仪器、设备、器皿、一次用弃的和非一次用弃的物品的样品。这些实例不应解释为限制可应用于本发明的样品类型。
如本文所使用的术语“靶标”或“靶核酸”意图指待检测或测量其存在、或者待研究其功能、相互作用或特性的任何分子。因此,靶标包括用于它的可检测探针(例如,寡核苷酸探针)或测定存在或可以由本领域技术人员生产的基本上任何的分子。例如,靶标可以是生物分子,诸如核酸分子、多肽、脂质或碳水化合物,其能够与可检测探针(例如抗体)结合或以其它方式发生接触,其中所述可检测探针还包含能够通过本发明的方法检测的核酸。如本文所使用的“可检测探针”是指能够与目标靶生物分子杂交或退火且允许如本文所述的靶生物分子的特异性检测的任何分子或试剂。在本发明的一个方面,所述靶标是核酸,且所述可检测探针是寡核苷酸。术语“核酸”和“核酸分子”可以贯穿本公开互换使用。所述术语是指寡核苷酸、寡物、多核苷酸、脱氧核糖核苷酸(DNA)、基因组DNA、线粒体DNA(mtDNA)、互补DNA(cDNA)、细菌DNA、病毒DNA、病毒RNA、RNA、信使RNA(mRNA)、转移RNA(tRNA)、核糖体RNA(rRNA)、siRNA、催化性RNA、克隆、质粒、M13、P1、粘粒、细菌人工染色体(BAC)、酵母人工染色体(YAC)、扩增的核酸、扩增子、PCR产物及其它类型的扩增的核酸、RNA/DNA杂交体和聚酰胺核酸(PNA),所有这些可以呈单链或双链形式,并且除非另有限制,否则将包括天然核苷酸的已知类似物,其可以以与天然存在的核苷酸类似的方式起作用,及其组合和/或混合物。因此,术语“核苷酸”是指天然存在的和修饰的/非天然存在的核苷酸,包括三、二和单磷酸核苷,以及在聚核酸或寡核苷酸内存在的单磷酸单体。核苷酸还可以是核糖核苷酸、2'-脱氧核苷酸、2',3'-脱氧核苷酸以及本领域众所周知的广泛多样的其它核苷酸模仿物。模仿物包括链终止核苷酸,诸如3'-O-甲基、卤代碱基或糖取代;替代性的糖结构,包括非糖、烷基环结构;替代性的碱基,包括肌苷;脱氮修饰的;接头修饰的χ和ψ;质量标记物修饰的;磷酸二酯修饰或替换,包括硫代磷酸酯、甲基膦酸酯、硼代磷酸酯、酰胺、酯、醚;和碱基或完全核苷酸间替换,包括切割键诸如光可切割的硝基苯基部分。
可以定量地或定性地测量靶标的存在或不存在。靶标可以以多种不同形式出现,包括例如简单或复杂混合物,或基本上纯化的形式。例如,靶标可以是含有其它组分的样品的组成部分,或可以是样品的唯一或主要组分。因此,靶标可以是全细胞或组织的组分、细胞或组织提取物、其分级分离的裂解物或基本上纯化的分子。另外,靶标可以具有已知的或未知的序列或结构。
术语“扩增反应”是指用于增加靶核酸序列的拷贝的任何体外方式。
“扩增”是指使溶液处于足以允许扩增的条件的步骤。扩增反应的组分可以包括、但不限于例如引物、多核苷酸模板、聚合酶、核苷酸、dNTP等。术语“扩增”通常是指靶核酸的“指数”增加。然而,如本文所使用的“扩增”还可以是指选定的靶核酸序列的数目的线性增加,但不同于一次性的、单引物延伸步骤。
“聚合酶链式反应”或“PCR”是指用于以等比数列扩增靶双链DNA的特定区段或子序列的方法。PCR是本领域技术人员众所周知的;参见,例如,美国专利号4,683,195和4,683,202;和PCR Protocols: A Guide to Methods and Applications, Innis等人编, 1990。
如本文所使用的“寡核苷酸”是指通过磷酸二酯键或其类似物连接的天然或修饰的核苷单体的线性寡聚体。寡核苷酸包括能够特异性地结合靶核酸的脱氧核糖核苷、核糖核苷、其端基异构形式、肽核酸(PNA)等。通常,单体通过磷酸二酯键或其类似物连接以形成寡核苷酸,所述寡核苷酸的大小范围从几个单体单元(例如3-4个)至几十个单体单元(例如40-60个)。每当寡核苷酸通过字母的序列诸如“ATGCCTG”是指时,应该理解,核苷酸从左到右是5'-3'顺序,并且除非另外指出,否则“A”是指脱氧腺苷,“C”是指脱氧胞苷,“G”是指脱氧鸟苷,“T”是指脱氧胸苷,并且“U”是指核糖核苷,尿苷。通常,寡核苷酸包含四种天然脱氧核苷酸;然而,它们还可以包含核糖核苷或非天然核苷酸类似物。当酶由于活性具有特定寡核苷酸或多核苷酸底物要求时,例如单链DNA、RNA/DNA双链体等,则关于寡核苷酸或多核苷酸底物的适当组成的选择完全是在普通技术人员的知识内。
如本文所使用的“寡核苷酸引物”或简称“引物”是指这样的多核苷酸序列:其与靶核酸模板上的序列杂交并且促进寡核苷酸探针的检测。在本发明的扩增实施方案中,寡核苷酸引物充当核酸合成的起始点。在非扩增实施方案中,寡核苷酸引物可以用于建立能够被切割试剂切割的结构。引物可以具有多种长度,并且通常是小于50个核苷酸的长度,例如12-25个核苷酸的长度。可以基于本领域技术人员已知的原则来设计用于PCR中的引物的长度和序列。
如本文所使用的术语“寡核苷酸探针”是指这样的多核苷酸序列:其能够与目标靶核酸杂交或退火并且允许所述靶核酸的特异性检测。
“亲和”标记物是可以特异性结合其分子结合配偶体的分子。所述结合可以通过共价或非共价(例如,离子、氢等)键。如本文所使用,亲和标记物诸如生物素可以选择性结合亲和基质,诸如链霉抗生物素蛋白包被的珠粒或颗粒。如本文所使用,“链霉抗生物素蛋白包被的颗粒”可以与“抗生物素蛋白包被的颗粒”互换使用。
如本文所使用的“亲和基质”是指附接至固体支持物或固体基质(例如磁性胶乳颗粒、玻璃珠粒)的表面的分子,其可以特异性结合其分子结合配偶体。所述结合可以通过共价键或非共价键。如本文所使用,亲和基质(诸如链霉抗生物素蛋白包被的颗粒)可以选择性结合亲和标记物,诸如生物素。
“错配核苷酸”或“错配”是指在所述一个或多个位置处与靶序列不互补的核苷酸。寡核苷酸探针可以具有至少一个错配,但还可以具有2、3、4、5、6或7个或更多个错配核苷酸。
如本文所使用的术语“多态性”是指等位基因变体。多态性可以包括单核苷酸多态性(SNP)以及简单序列长度多态性。多态性可以是由于与另一个等位基因相比在一个等位基因处的一个或多个核苷酸取代,或可以是由于本领域已知的插入或缺失、复制、反向及其它改变。
如本文所使用的术语“质量可区分的大小”可以与“切割产物大小”、“降解产物大小”或“探针片段大小”互换使用,并且是指如通过本文方法描述的由寡核苷酸探针的切割和释放产生的一种或多种降解产物的大小。具有质量可区分的大小(MDF)的片段可以包括、但不限于寡核苷酸探针片段、核苷酸寡核苷酸探针片段、非核苷酸寡核苷酸探针片段、含有修饰标签(例如疏水部分和亲和部分)以促进分离的寡核苷酸探针片段。产生具有独特的质量可区分的大小的片段会导致显著改善的灵敏度,且允许增强进行多路反应的能力。
如本文所使用的术语“修饰”是指在分子水平(例如,碱基部分、糖部分或磷酸酯主链)改变寡核苷酸探针。核苷修饰包括但不限于:引入切割阻断剂或裂解诱导物、引入小沟结合剂、同位素富集、同位素耗尽、引入氘和卤素修饰。核苷修饰还可以包括增加杂交的严格性或增加寡核苷酸探针的解链温度的部分。例如,核苷酸分子可以用连接2'和4'碳的额外桥进行修饰,从而产生对核酸酶切割具有抗性的锁核酸(LNA)核苷酸。
提及一种分子与另一种分子的结合的术语“特异性的”或“特异性”,诸如探针对靶多核苷酸的特异性,是指两种分子之间的识别、接触和稳定复合物的形成,以及该分子与其它分子的大幅减少的识别、接触或复合物形成。如本文所使用的术语“退火”是指两种分子之间形成稳定的复合物。
如果探针的至少一个区域与核酸序列的补体的至少一个区域共享实质序列同一性,则所述探针“能够与核酸序列退火”。“实质序列同一性”是至少约80%、优选地至少约85%、更优选地至少约90%、95%或99%、和最优选地100%的序列同一性。为了确定DNA序列和RNA序列的序列同一性的目的,U和T通常视为相同核苷酸。例如,包含序列ATCAGC的探针能够与包含序列GCUGAU的靶RNA序列杂交。
如本文所使用的术语“切割试剂”是指能够切割寡核苷酸探针以产生质量可区分的大小的片段的任何方式,包括但不限于酶。对于其中不发生扩增的方法,切割试剂可以仅用于切割、降解或以其它方式释放寡核苷酸探针的第二部分或其片段。切割试剂可以是酶。切割试剂可以是天然的、合成的、未修饰的或修饰的。
对于其中发生扩增的方法,切割试剂优选地是具有合成(或聚合)活性和核酸酶活性的酶。这样的酶通常为核酸扩增酶。核酸扩增酶的一个实例是核酸聚合酶,诸如水生栖热菌(Thermus aquaticus)(Taq)DNA聚合酶或大肠杆菌DNA聚合酶I。所述酶可以是天然存在的、未修饰的或修饰的。
术语“切割所述片段直至外切核酸酶抗性修饰”意指切割片段直至到达外切核酸酶抗性修饰自身或在定位接近于外切核酸酶抗性修饰的限定核苷酸处的切割活性。对于3'至5'外切核酸酶活性,接近于修饰的限定核苷酸可以位于距离所述修饰紧3'的第一个位置处。或者,该限定核苷酸可以位于距离所述修饰3'两个或三个或甚至更多个位置,只要通过3'至5'外切核酸酶的切割一致地在限定核苷酸的位置处终止。
术语“丙二醇”或“丙二醇间隔物”是指1,3-丙二醇,并且与丙烷-1,3-二醇、1,3-二羟基丙烷和亚丙基二醇同义。术语“HEG”或“HEG间隔物”是指六甘醇,其与3,6,9,12,15-五氧杂十七烷-1,17-二醇同义。术语反向核苷酸是指其中糖部分经由3'至3'磷酸二酯键而连接至邻近核苷酸的糖部分的核苷酸。
术语“质谱的污染物”是指能够干扰通过质谱仪检测具有质量可区分大小(MDF)的片段的任何物质。质谱的一些污染物的实例公开于Keller等人,Analytica Chimica Acta(2008)627:71-81中。
“核酸聚合酶”是指催化核苷酸向核酸内的掺入的酶。示例性的核酸聚合酶包括DNA聚合酶、RNA聚合酶、末端转移酶、逆转录酶、端粒酶等。
“热稳定的DNA聚合酶”是指这样的DNA聚合酶:当遭受高温选定的时间段时,其为稳定的(即抵抗分解或变性)且保持足够的催化活性。例如,当遭受高温使双链核酸变性所需的时间时,热稳定的DNA聚合酶保留实现后续引物延伸反应的足够活性。核酸变性所需的加热条件是本领域众所周知的,并且在美国专利号4,683,202和4,683,195中举例说明。如本文所使用的热稳定的聚合酶通常适用于温度循环反应诸如聚合酶链式反应(“PCR”)中。热稳定的核酸聚合酶的实例包括水生栖热菌Taq DNA聚合酶、栖热菌属(Thermus)种Z05聚合酶、黄栖热菌(Thermus flavus)聚合酶、海栖热袍菌(Thermotoga maritima)聚合酶诸如TMA-25和TMA-30聚合酶、Tth DNA聚合酶等。
“修饰的”聚合酶是指其中至少一个单体不同于参照序列的聚合酶,所述参照序列诸如所述聚合酶的天然或野生型形式或所述聚合酶的另一种修饰形式。示例性修饰包括单体插入、缺失和取代。修饰的聚合酶还包括嵌合聚合酶,其具有衍生自两个或更多个亲本的可鉴定的组分序列(例如,结构或功能结构域等)。在修饰的聚合酶的定义内还包括包含参照序列的化学修饰的那些。修饰的聚合酶的实例包括G46E E678G CS5 DNA聚合酶、G46E L329A E678G CS5 DNA聚合酶、G46E L329A D640G S671F CS5 DNA聚合酶、G46E L329A D640G S671F E678G CS5 DNA聚合酶、G46E E678G CS6 DNA聚合酶、Z05 DNA聚合酶、ΔZ05聚合酶、ΔZ05-Gold聚合酶、ΔZ05R聚合酶、E615G Taq DNA聚合酶、E678G TMA-25聚合酶、E678G TMA-30聚合酶等。
术语“5'至3'核酸酶活性”或“5'-3'核酸酶活性”是指通常与核酸链合成相关的核酸聚合酶的活性,由此核苷酸从核酸链的5'末端除去。例如,大肠杆菌DNA聚合酶I具有该活性,而克列诺片段没有。一些具有5'至3'核酸酶活性的酶是5'至3'外切核酸酶。术语“单链特异性5'-3'外切核酸酶”是指从5'末端起作用的外切核酸酶,其相对于双链核酸对单链核酸具有优先性。这样的单链特异性5'-3' 外切核酸酶的实例包括:来自枯草芽孢杆菌(B. subtilis)的外切核酸酶、来自脾的磷酸二酯酶、来自酵母的外切核酸酶II、来自酵母的外切核酸酶V和来自粗糙链孢霉(Neurospora crassa)的外切核酸酶。
术语“3'至5'外切核酸酶”或“3'至5'外切核酸酶活性”是指酶或酶的活性,由此核苷酸从核酸链的3'末端除去。3'至5'外切核酸酶的实例包括:来自大肠杆菌的外切核酸酶I、来自大肠杆菌的外切核酸酶IV、来自大肠杆菌的外切核酸酶V、来自噬菌体T4的T4外切核酸酶IV、来自噬菌体T4的T4 DNA聚合酶、来自酵母的外切核酸酶I、来自酵母的外切核酸酶III、来自大肠杆菌的DNA聚合酶I、Klenow片段、来自果蝇属(Drosophila)的DNA聚合酶α、来自果蝇属的DNA聚合酶γ和蛇毒磷酸二酯酶。
本发明的各个方面基于核酸聚合酶的特殊性质。核酸聚合酶可以具有几种活性,其中包括5'至3'核酸酶活性,由此核酸聚合酶可以从寡核苷酸切割单核苷酸或小寡核苷酸,所述寡核苷酸与其较大互补多核苷酸退火。为了使切割有效地发生,上游寡核苷酸还必须与相同的较大多核苷酸退火。
利用5'至3'核酸酶活性的靶核酸的检测可以通过如以下文献中所述的“TaqMan®”或“5′-核酸酶测定”来进行:美国专利号5,210,015、5,487,972和5,804,375;和Holland等人, 1988, Proc. Natl. Acad. Sci. USA 88: 7276-7280。在TaqMan®测定中,在扩增区内杂交的标记的检测探针在扩增反应期间存在。探针如此进行修饰,以阻止探针充当DNA合成的引物。所述扩增使用对双链核酸具有5'至3′核酸酶活性的DNA聚合酶进行。在扩增的每个合成步骤期间,与来自待延伸引物下游的靶核酸杂交的任何探针通过DNA聚合酶的5'至3′核酸酶活性降解。因此,新靶链的合成也导致探针的降解,并且降解产物的积累会提供靶序列合成的量度。
适合用于检测降解产物的任何方法均可用在5'核酸酶测定中。通常,检测探针用两种荧光染料进行标记,其中之一能够猝灭另一种染料的荧光。所述染料附接至探针,通常报道或检测染料附接至5'末端,且猝灭染料附接至内部位点,使得当探针处于非杂交状态时,猝灭发生,并且使得通过DNA聚合酶的5'至3'核酸酶活性实现的探针切割发生在两种染料之间。扩增导致染料之间的探针切割,伴随猝灭的消除和来自最初猝灭的染料的可观察的荧光的增加。通过测量反应荧光的增加,监测降解产物的积累。美国专利号5,491,063和5,571,673描述了用于检测与扩增伴随发生的探针降解的替代方法。
用于检测靶核酸的5'核酸酶测定可以采用具有5'至3′核酸酶活性的任何聚合酶。因此,在某些实施方案中,具有5'核酸酶活性的聚合酶是热稳定和热活性的核酸聚合酶。这样的热稳定的聚合酶包括、但不限于来自真细菌属栖热菌属、热袍菌属(Thermatoga)和栖热腔菌属(Thermosipho)的多个种的天然和重组形式的聚合酶以及其嵌合形式。例如,可以用于本发明的方法中的栖热菌属种聚合酶包括水生栖热菌(Taq)DNA聚合酶、嗜热栖热菌(Thermus thermophilus)(Tth)DNA聚合酶、栖热菌属种Z05(Z05)DNA聚合酶、栖热菌属种sps17(sps17)和栖热菌属种Z05(例如在美国专利号5,405,774、5,352,600、5,079,352、4,889,818、5,466,591、5,618,711、5,674,738和5,795,762中所述)。可以用于本发明的方法中的热袍菌属聚合酶包括例如海栖热袍菌DNA聚合酶和新阿波罗栖热袍菌(Thermatoga neapolitana)DNA聚合酶,而可以使用的栖热腔菌属聚合酶的一个实例是非洲栖热腔菌(Thermosipho africanus)DNA聚合酶。海栖热袍菌和非洲栖热腔菌DNA聚合酶的序列公开于具有公开号WO 92/06200的国际专利申请号PCT/US91/07035中。新阿波罗栖热袍菌的序列可以在国际专利公开号WO 97/09451中找到。
在5'核酸酶测定中,扩增检测通常与扩增同时发生(即,“实时”)。在某些实施方案中,扩增检测是定量的,并且扩增检测是实时的。在某些实施方案中,扩增检测是定性的(例如,靶核酸的存在或不存在的终点检测)。在某些实施方案中,扩增检测在扩增之后。在某些实施方案中,扩增检测是定性的,并且扩增检测在扩增之后。
在本发明中,来自寡核苷酸探针的降解产物的检测不涉及使用荧光报道染料和猝灭染料,而是涉及具有两个不同部分的探针的合成。第一部分是与靶核酸至少部分互补的互补部分,并且由标准核苷酸或核苷酸类似物组成,使得该部分能够与待检测的靶核酸结合。此外,探针的该第一部分的3'末端是修饰的或被封闭的,使得它不可被DNA聚合酶延伸。阻断3'末端以阻止聚合酶的延伸可以通过在3'端放置非匹配(即非互补)核苷酸或通过修饰或除去末端核苷酸的3'-羟基来实现。第一部分还含有如下所述的3'-5'外切核酸酶抗性修饰。第二部分是附接至第一部分的5'末端的非互补部分,并且形成不能与靶核酸结合的“5'翼”区(参见图1)。该5'翼部分可以包含核苷酸或非核苷酸或核苷酸和非核苷酸两者。可以存在于寡核苷酸探针的5'翼第二部分中的非核苷酸可以是任何有机部分或重复单元(例如(CH2-CH2-O)n等)。第二部分还含有使得其对3'至5'外切核酸酶的活性具有抗性的修饰(在图1中显示为“X”)。这种修饰可以是核苷酸类似物,其无法被3'至5'外切核酸酶切割,并且这样的核苷酸类似物的实例包括硫代磷酸酯、2'-O-甲基-核糖核苷酸、丙二醇间隔物、HEG间隔物、反向核苷酸或使得寡核苷酸片段在修饰附接点外对于核酸外切切割具有抗性的任何其它修饰。
本发明提供了寡核苷酸引物和探针。不预期用于产生这些探针和引物的方法以任何方式受到限制。本领域技术人员熟悉多种用于产生探针和引物的化学合成策略和试剂。还不预期本发明的寡核苷酸探针限于天然存在的核苷酸结构或天然存在的碱基(例如,腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶)。除核酸中通常发现的天然存在的杂环碱基之外,非天然核酸类似物也与本发明一起使用。
非天然类似物包括具有非天然存在的杂环碱基或其它修饰的碱基的那些。具体地,许多非天然存在的碱基进一步描述在,例如,Seela等人(1991), Helv. Chim. Acta 74: 1790, Grein等人(1994), Bioorg. Med. Chem. Lett. 4: 971-976,和Seela等人(1999), Helv. Chim. Acta 82: 1640。为了进一步举例说明,任选地包括在核苷酸中使用的充当解链温度(Tm)改性剂的某些碱基。例如,这些中的一些包括7-脱氮嘌呤(例如,7-脱氮鸟嘌呤、7-脱氮腺嘌呤等)、吡唑并[3,4-d]嘧啶、丙炔基-dN (例如,丙炔基-dU、丙炔基-dC等)等。参见,例如,美国专利号5,990,303。其它代表性的杂环碱基包括,例如,次黄嘌呤、肌苷、黄嘌呤;2-氨基嘌呤、2,6-二氨基嘌呤、2-氨基-6-氯嘌呤、次黄嘌呤、肌苷和黄嘌呤的8-氮杂衍生物;腺嘌呤、鸟嘌呤、2-氨基嘌呤、2,6-二氨基嘌呤、2-氨基-6-氯嘌呤、次黄嘌呤、肌苷和黄嘌呤的7-脱氮-8-氮杂衍生物;6-氮杂胞嘧啶;5-氟胞嘧啶;5-氯胞嘧啶;5-碘胞嘧啶;5-溴胞嘧啶;5-甲基胞嘧啶;5-丙炔基胞嘧啶;5-溴乙烯基尿嘧啶;5-氟尿嘧啶;5-氯尿嘧啶;5-碘尿嘧啶;5-溴尿嘧啶;5-三氟甲基尿嘧啶;5-甲氧基甲基尿嘧啶;5-乙炔基尿嘧啶;5-丙炔基尿嘧啶、4-乙酰基胞嘧啶、5-(羧基羟基甲基)尿嘧啶、5羧甲基氨基甲基-2-硫尿苷、5-羧甲基氨基甲基尿嘧啶、二氢尿嘧啶、β-D-半乳糖基Q核苷、肌苷、N6-异戊烯基腺嘌呤、1-甲基鸟嘌呤、1-甲基肌苷、2,2-二甲基鸟嘌呤、7-脱氮腺嘌呤、2-甲基腺嘌呤、2-甲基鸟嘌呤、3-甲基胞嘧啶、5-甲基胞嘧啶、N6-甲基腺嘌呤、7-甲基鸟嘌呤、7-脱氮鸟嘌呤、5-甲基氨基甲基尿嘧啶、5-甲氧基氨基甲基-2-硫尿嘧啶、β-D甘露糖基Q核苷、5'-甲氧基羧甲基尿嘧啶、5-甲氧基尿嘧啶、2-甲硫基-N6- 异戊烯基腺嘌呤、尿嘧啶-5-氧基乙酸(v)、怀丁氧苷(wybutoxosine)、假尿嘧啶、Q核苷、2硫代胞嘧啶、5-甲基-2-硫尿嘧啶、2-硫尿嘧啶、4-硫尿嘧啶、5-甲基尿嘧啶、尿嘧啶-5-氧基乙酸甲基酯、3-(3-氨基-3-N-2-羧基丙基)尿嘧啶、(acp3)w、2,6-二氨基嘌呤和5-丙炔基嘧啶等。为了进一步举例说明,修饰的寡核苷酸的其它实例包括具有一个或多个锁核酸(LNA™)单体的那些(包含LNA™单体的寡核苷酸,可得自例如Link Technologies,Ltd.,Lanarkshire,苏格兰;在来自Exiqon A/S, Vedbæk, Denmark的许可证下)。诸如这些的核苷酸类似物也描述在例如美国专利号6,639,059、美国专利号6,303,315和美国专利公开号2003/0092905中。
使用本领域已知的任何技术,可以制备寡核苷酸探针和引物。在某些实施方案中,例如,使用任何核酸合成方法化学合成寡核苷酸探针和引物,所述方法包括例如根据Beaucage和Caruthers (1981), Tetrahedron Letts. 22(20): 1859 1862描述的固相亚磷酰胺方法。为了进一步举例说明,还可以使用三酯法合成寡核苷酸(参见,例如,Capaldi等人(2000), “Highly efficient solid phase synthesis of oligonucleotide analogs containing phosphorodithioate linkages”, Nucleic Acids Res. 28(9):e40, 和Eldrup等人(1994), “Preparation of oligodeoxyribonucleoside phosphorodithioates by a triester method”, Nucleic Acids Res. 22(10): 1797-1804)。还可以利用本领域已知的其它合成技术,包括、例如,使用自动化的合成仪,如在Needham VanDevanter等人(1984), Nucleic Acids Res. 12: 6159-6168中所述。多种用于自动化寡核苷酸合成的设备是商购可得的。还任选地利用多核苷酸合成方案(例如,三-核苷酸合成等)。此外,引物核酸任选地包括各种修饰。在某些实施方案中,例如,引物包括限制位点接头,例如以促进后续扩增子克隆等。为了进一步举例说明,引物还任选地经过修饰以改善扩增反应的特异性,如例如美国专利号6,001,611中所述。引物和探针还可以用如本文描述的或如本领域以其它方式已知的各种其它修饰进行合成。
在本发明的反应混合物、方法和其它方面中利用的探针可以具有核苷酸或非核苷酸标签。这样的标签可以通过本领域已知的多种技术直接地或间接地附接至寡核苷酸。为了举例说明,取决于使用的标签的类型,标签可以附接至末端(寡核苷酸引物和/或探针的5’或3’末端)或非末端核苷酸,并且可以通过各种大小和组成的接头或间隔臂间接地附接。使用商购可得的亚磷酰胺试剂,经由适当保护的亚磷酰胺,可以产生在5'或3'末端处含有官能团(例如,硫醇或伯胺)的寡核苷酸,并且可以使用例如以下文献中所述的方案将标签附接至这样的寡核苷酸:Innis等人(编) PCR Protocols: A Guide to Methods and Applications, Elsevier Science & Technology Books (1990)(Innis)。
基本上任何核酸(标准的或非标准的,标记或未标记的)可以从多种商业来源中的任一种定制或标准定购,诸如The Midland Certified Reagent Company (Midland, TX)、Operon Technologies Inc. (Huntsville, AL)、Proligo LLC (Boulder, CO)及许多其它公司。
本发明还提供了包括实施本发明的方法所需的组分的试剂盒,所述组分可以包括以下中的一种或多种:请求保护的组合物(请求保护的寡核苷酸探针和引物)、酶(DNA聚合酶、外切核酸酶、碱性磷酸酶)、用于扩增的试剂(核苷酸三磷酸、盐和去污剂)和用于纯化的试剂(亲和树脂)。通常,为了易于使用而将所述试剂盒隔室化,并且含有提供用于实施所述方法的组分的容器。在一些实施方案中,所述试剂盒还包括一个或多个靶核酸序列,包括对照核酸序列(用于阳性和/或阴性对照)。
由于探针的退火的第一部分中的多重切割位点,在TaqMan PCR测定中使用本发明的寡核苷酸探针导致探针的多重片段的生成(图1)。尽管这些片段在通过质谱法的后续检测中获得关于给定靶核酸的“质量可区分标志”,但样品中的多种靶核酸的存在(例如,用超过十种靶核酸的多路测定)生成巨大数目的“质量可区分标志”片段,使得将出现源于不同靶核酸的具有非常相似的质量的片段。因此,准确鉴定特定靶核酸的存在或不存在将是困难的。这个问题通过提供使用3'至5'外切核酸酶的处理步骤得到解决,所述3'至5'外切核酸酶将切割片段直至到达外切核酸酶抗性修饰自身,或在定位接近于在5'翼部分上的外切核酸酶抗性修饰的3'侧的限定核苷酸处,并且不再进一步切割片段。因此,对于每种个别靶核酸生成单个“独特质粒”片段,并且通过质谱法进行检测。
具有质量可区分的大小(MDF)的片段通过特定物理属性或检测特征(包括、但不限于长度、质量、电荷或荷质比)来区分。在一个实施方案中,所述检测特征是质量。在另一个实施方案中,所述检测特征是电荷和质量。MDF的分离和检测可以通过电泳分离(例如,通过凝胶电泳、毛细管电泳、等电聚焦、通过微流体电泳)来完成。或者,分离和检测可以使用液相色谱(例如,高效液相色谱(HPLC)、反相HPLC、超高效液相色谱(UPLC)等)来完成。在另一个相关实施方案中,MDF可以通过与物理属性相关的行为来区分,包括、但不限于质量、在MALDI-TOF质谱法中的飞行时间。在一个相关实施方案中,来自一种或多种寡核苷酸探针的MDF被释放且从质谱基质选择性地解吸,使得非选择性引物和寡核苷酸探针(即不存在靶核酸)不解吸。对于这些实施方案,与寡核苷酸探针或反应混合物中存在的其它非MDF相比,MDF应从质谱基质更有效地解吸。优选的质谱基质包括2,5-二羟基苯甲酸、α-氰基-4-羟基肉桂酸、3-羟基吡啶甲酸(3-HPA)、柠檬酸二铵(DAC)和它们的组合。在另一个实施方案中,质谱基质可以设计用于蛋白质分析。用于蛋白质分析的示例性基质包括、但不限于DHB和CHCA。
该方法可以进一步包括使一种或多种寡核苷酸探针片段(即,MDF)与未切割的或部分地切割的寡核苷酸探针分离的另外步骤。可以使用捕获配体(诸如生物素或其它亲和配体)和与所述捕获配体具有特异性结合活性的捕获试剂(诸如抗生物素蛋白、抗生物素蛋白、抗体、受体、与MDF互补的捕获探针或其功能片段)来完成分离。MDF可以含有对捕获试剂具有特异性结合活性的捕获配体。捕获配体和捕获试剂还可以用于给MDF的剩余部分添加质量,使得它可以从质谱仪中检测的MDF的质量范围中排除。在一个实施方案中,捕获探针可以具有用于切割产物的通用扩增的通用引物。
分离步骤还可以用于从MDF中除去盐、酶或其它缓冲液组分。本领域众所周知的几种方法诸如色谱、凝胶电泳或沉淀可以用于提纯样品。例如,尺寸排阻色谱或亲和色谱可以用于从样品除去盐。分离方法的选择可以取决于样品的量。例如,当少量样品可获得或使用小型化仪器时,可以使用微量亲和色谱分离步骤。另外,是否需要分离步骤,以及分离方法的选择,可以取决于使用的检测方法。例如,通过从样品除去盐,可以改善基质辅助的激光解吸/电离和电喷射电离的效率。例如,盐可以吸收来自基质辅助的激光解吸/电离中的激光的能量并且导致更低的电离效率。
质谱法是检测本发明的具有质量可区分的大小(MDF)的片段的优选方法,并且因此鉴定和/或定量靶核酸。MDF可以在质谱仪中离子化,并且离子基于它们的质荷比在空间或时间中分离。质谱仪然后计算与每种离子相关的质量。因此,当提及质谱法时,术语质量可以用于简洁描述质荷比。
质谱法是用于分离和鉴定分子的灵敏且准确的技术。通常,质谱仪具有两个主要部件,即用于产生离子的离子源和用于测量离子的质荷比的质量选择性分析仪,其是且转换成这些离子的质量的测量。几种电离方法是本领域已知的并且在本文中描述。MDF可以在从寡核苷酸探针切割之前、期间或之后是带电的。结果,通过质谱法测量的MDF不总是需要电荷,因为电荷可以通过质谱法操作来获得。在质谱法分析中,MDF的任选组分诸如电荷和检测部分可以用于给MDF贡献质量。
如本文所述的不同质谱法方法例如四极质谱法、离子阱质谱法、飞行时间质谱法、气相色谱质谱法和串联质谱法可以利用离子源和质量分析仪的各种组合,其允许在设计定制的检测方案中的灵活性。另外,质谱仪可以程序化成将来自离子源的所有离子依次或同时传递进质谱仪。此外,质谱仪可以程序化成选择特定质量的离子用于传递进质谱仪,同时阻断其它离子。
精确地控制质谱仪中的离子移动的能力允许检测方案中的更多选项,当分析例如来自多路实验的大量MDF时,这可以是有利的。例如,在具有大量MDF的多路实验中,可以有利的是,从一组相似报道分子中选择个别报道分子且然后分别分析该报道分子。基于控制通过质谱仪检测的质量范围的另一个优点包括从分析中排除未切割的或部分地切割的带标签的探针的能力,这会降低来自测定的背景噪音。
质谱仪可以分辨具有小质量差异的离子,并且以高准确度测量离子的质量。因此,相似质量的MDF可以一起用于相同实验中,因为质谱仪可以区分甚至紧密相关的标签的质量。使用质谱法方法达到的高分辨程度和质量准确度允许使用带标签的探针的大集合,因为所得到的报道标签可以彼此区分。当设计多路实验时,使用带标签的探针的大集合的能力是一个优点。
使用质谱法用于检测MDF的质量的另一个优点是基于这类质量分析的高灵敏度。通过利用由离子源形成的大部分离子且将这些离子通过质量分析仪有效地传递给检测器,质谱仪实现高灵敏度。因为该高灵敏度水平,使用质谱法可以测量甚至有限量的样品。这可以是多路实验中的一个优点,在所述多路实验中每个MDF种类的量可以很小。
质谱法方法是本领域众所周知的(参见Burlingame等人. Anal. Chem. 70: 647R-716R (1998);Kinter和Sherman, Protein Sequencing and Identification Using Tandem Mass Spectrometry Wiley-Interscience, New York (2000))。与质谱法方法相关的基本过程是产生从样品衍生出的气相离子并测量其质量。
使用在质谱仪中产生的电磁场,可以精确地控制气相离子的移动。离子在这些电磁场中的移动与离子的m/z成比例,并且这构成测量样品的m/z并因此测量样品的质量的基础。离子在这些电磁场中的移动允许离子被包含和集中,这解释了质谱法的高灵敏度。在m/z测量过程期间,离子以高效率传递给颗粒检测器,所述颗粒检测器记录这些离子的到达。在每个m/z处的离子数量通过图上的峰来证实,在图中x轴是m/z,并且y轴是相对丰度。不同的质谱仪具有不同的分辨水平,也就是说,分辨在质量上紧密相关的离子之间的峰的能力。分辨率定义为R=m/δm,其中m是离子质量,并且δm是质谱图中两个峰之间的质量差异。例如,具有1000的分辨率的质谱仪可以将具有100.0的m/z的离子与具有100.1的m/z的离子区分开。
现有若干类型的质谱仪,并且可以以各种构型产生。一般而言,质谱仪具有以下主要部件:样品入口、离子源、质量分析仪、检测器、真空系统和仪器控制系统以及数据系统。样品入口、离子源和质量分析仪中的差异一般限定仪器的类型及其能力。例如,入口可以是毛细管柱液相色谱源,或可以是诸如在基质辅助的激光解吸中使用的直接探针或台(stage)。常见的离子源是例如电喷射,包括纳米喷雾和微米喷雾或基质辅助的激光解吸。示例性的质量分析仪包括四极质量过滤器、离子阱质量分析仪和飞行时间质量分析仪。
离子形成过程是质谱图分析的起点。几种电离法是可获得的,并且电离法的选择取决于待分析的样品。例如,对于多肽的分析,相对温和的电离操作诸如电喷射电离(ESI)可以是合乎需要的。对于ESI,使含有样品的溶液在高电位穿过细针,所述高电位产生强电场,从而产生被导向质谱仪的高度荷电的微滴的细喷雾。其它电离操作包括例如快原子轰击(FAB),其使用中性原子的高能束来撞击固相样品,从而造成解吸和电离。基质辅助的激光解吸电离(MALDI)是一种其中使用激光脉冲撞击样品的方法,所述样品已经在吸收紫外线的化合物基质中结晶。本领域已知的其它电离操作包括例如等离子体和辉光放电、等离子体解吸电离、共振电离、和次级电离。MDF可以在从带标签的探针切割之前、期间或之后变成离子化。
电喷射电离(ESI)具有可用于本文描述的发明的几种特性。例如,ESI可以用于难以电离或蒸发的生物分子诸如多肽。另外,ESI的效率可以是极高的,这会提供用于高灵敏度测量的基础。此外,ESI产生来自溶液的荷电分子,这对于分析溶液中的MDF是方便的。相反,电离程序诸如MALDI要求在电离前使样品结晶。
因为ESI可以直接从溶液产生荷电分子,所以它与来自液相色谱系统的样品相容。例如,质谱仪可以具有用于液相色谱系统(诸如HPLC)的入口,使得级分从色谱柱流进质谱仪内。液相色谱系统和质谱仪的这种线内排列有时被称为LC-MS。LC-MS系统可以用于例如在质谱法分析前使未切割的或部分地切割的MDF与切割的MDF分离。另外,色谱可以用于在质谱法分析前从MDF样品除去盐或其它缓冲液组分。例如,使用线内或离线反相HPLC柱使样品脱盐,可以用于增加电离过程的效率,且因此改善质谱法的检测灵敏度。
多种质量分析仪是可获得的,其可以与不同离子源配对。不同的质量分析仪具有不同的优点,如本领域技术人员已知的和如本文描述的。选择用于检测的质谱仪和方法取决于特定测定,例如,当产生少量离子用于检测时,可以使用更灵敏的质量分析仪。在下文描述了几类质量分析仪和质谱法方法。
离子迁移率质量(IM)光谱测定法是一种气相分离方法,其给质谱法(MS)添加新量纲。IM基于气相离子的碰撞横截面来分离它们,并且可以与飞行时间(TOF)质谱法偶联以产生用于鉴定和表征蛋白质和肽的有力工具。因此,当MDF是蛋白质或肽时,IM-MS对于本发明而言具有特殊效用。Verbeck等人在Journal of Biomolecular Techniques(第13卷, 第2期, 56-61)中更详细地讨论了IM-MS。
四极质谱法利用四极质量过滤器或分析仪。这类质量分析仪由排列为两套两个电连接杆的四个杆组成。当离子从质量过滤器开始移动到末端时,将rf和dc电压的组合施加于每对杆,这会产生引起离子的振荡运动的场。这些场的结果是在一对杆中产生高通质量过滤器,并且在另一对杆中产生低通过滤器。高通和低通过滤器之间的重叠留下限定的m/z,其可以穿过两个过滤器且穿越四极的长度。该m/z被选择且在四极质量过滤器中保持稳定,而所有其它m/z具有不稳定的轨迹并且不保留在质量过滤器中。质谱图如下产生:使施加的场逐渐变化,使得逐渐增加的m/z被选择穿过质量过滤器且到达检测器。另外,通过施加仅rf场,四极还可以设置为含有且传递所有m/z的离子。这允许四极充当质谱仪的特定区域中的透镜或聚焦系统,在所述特定区域中需要离子传递而无需质量过滤。这可用于如下文进一步描述的串联质谱法中。
四极质量分析仪、以及本文描述的其它质量分析仪可以程序化成分析限定的m/z或质量范围。质谱仪的这种特性对于本文描述的发明是有用的。因为切割的MDF的质量范围是在测定前已知的,所以质谱仪可以程序化成传递投射的正确质量范围的离子,同时排除更高或更低质量范围的离子。选择质量范围的能力可以减小测定中的背景噪音并且因此增加信噪比。另外,限定的质量范围可以用于排除任何未切割的寡核苷酸探针的分析,所述未切割的寡核苷酸探针具有比MDF的质量更高的质量。因此,质谱仪可以完成固有的分离步骤以及MDF的检测和鉴定。
离子阱质谱法利用离子阱质量分析仪。在这些质量分析仪中,施加场使得所有m/z的离子最初都被捕集在质量分析仪中且在其中振荡。离子从离子源穿过聚焦装置诸如八极透镜系统进入离子阱。在激发和穿过电极射出到检测器前,离子捕集发生在捕集区中。质量分析通过依次施加电压来完成,所述电压以将递增m/z的离子射出阱且进入检测器中的方式增加振荡的振幅。与四极质谱法相比,所有离子都保留在质量分析仪的场内,除了具有选定的m/z的那些之外。离子阱的一个优点是,它们具有极高灵敏度,只要小心地限制一次捕集的离子的数目。通过改变将离子注射到阱内的时间,可以完成离子数目的控制。离子阱的质量分辨率类似于四极质量过滤器的质量分辨率,但离子阱的确具有低m/z限制。
飞行时间质谱法利用飞行时间质量分析仪。对于这种m/z分析方法,离子首先通过在电场(由高电压产生)中加速获得固定量的动能。在加速后,离子进入无场或“漂移”区域,在该区域中它以与其m/z成反比的速度行进。因此,具有低m/z的离子比具有高m/z的离子更迅速地行进。测量离子经过无场区域的长度所需的时间,并用于计算离子的m/z。
这类质量分析中的一个考虑是,将待研究的离子集合同时引入分析仪内。例如,这类质量分析非常适合于电离技术如MALDI,其以短的充分确定的脉冲产生离子。另一个考虑是控制由离子产生的速度分布,所述离子在其动能的量方面具有变动。更长的飞行管、离子反射器或更高的加速电压的应用可以帮助使速度分布的效应最小化。飞行时间质量分析仪具有高灵敏度水平和比四极或离子阱质量分析仪更宽的m/z范围。另外,用这类质量分析仪可以快速地获得数据,因为质量分析仪的扫描不是必要的。
气相色谱质谱法会为实时检测靶标提供良好解决方案。系统的气相色谱(GC)部分将化学混合物分离成分析物(例如,MDF)的脉冲,并且质谱仪(MS)鉴定和定量分析物。
串联质谱法可以利用上文描述的质量分析仪的组合。串联质谱仪可以使用根据其m/z来分离离子的第一质量分析仪,以便分离目标离子用于进一步分析。分离的目标离子随后破碎成碎片离子(称为碰撞活化的解离或碰撞诱导的解离),并且碎片离子由第二质量分析仪进行分析。这些类型的串联质谱仪系统被称为在空间上串联的系统,因为两个质量分析仪通常由碰撞室在空间上分离。串联质谱仪系统还包括在时间上串联的系统,其中使用一种质量分析仪,然而,质量分析仪依次用于分离离子、诱导破碎和随后进行质量分析。
空间串联类别中的质谱仪具有不止一个质量分析仪。例如,串联四极质谱仪系统可以具有第一四极质量过滤器,随后为碰撞室,随后为第二四极质量过滤器,然后为检测器。另一种排列是使用四极质量过滤器用于第一质量分析仪,并使用飞行时间质量分析仪用于第二质量分析仪,碰撞室将两个质量分析仪隔开。其它串联系统是本领域已知的,包括反射-飞行时间、串联扇区和扇区-四极质谱法。
时间串联类别中的质谱仪具有在不同时间执行不同功能的一个质量分析仪。例如,离子阱质谱仪可以用于捕集所有m/z的离子。应用一系列rf扫描功能,其从阱射出所有m/z的离子,除了目标离子的m/z之外。在目标m/z已被分离后,施加rf脉冲以产生与阱中的气体分子的碰撞,从而诱导离子的破碎。然后通过质量分析仪测量碎片离子的m/z值。离子回旋加速器共振仪器,也被称作傅里叶变换质谱仪,是在时间上串联的系统的一个实例。
通过控制在实验的每个阶段中选择的离子,可以进行几类串联质谱法实验。不同类型的实验利用质量分析仪的不同操作模式,有时称为“扫描”。在被称为质谱图扫描的第一个实例中,第一质量分析仪和碰撞室将用于质量分析的所有离子传递到第二质量分析仪内。在被称为产物离子扫描的第二个实例中,目标离子在第一质量分析仪中进行质量选择,然后在碰撞室内破碎。所形成的离子随后通过扫描第二质量分析仪进行质量分析。在称为前体离子扫描的第三个实例中,扫描第一质量分析仪以依次将分析过质量的离子传递到碰撞室内用于破碎。第二质量分析仪对目标产物离子进行质量选择用于传递给检测器。因此,检测器信号是所有前体离子的结果,其可以破碎成共同的产物离子。其它实验形式包括中性丢失扫描,其中在质量扫描中表示出恒定质量差异。与多路实验一样,当在单个实验中测量报道标签的大集合时,这些不同的串联质谱法扫描操作的应用可以是有利的。
在典型应用中,基于循环阈(Ct)值确定在反应期间生成的MDF量,所述Ct值代表产生可检测量的核酸所需的循环的数目。Ct值的确定是本领域众所周知的。简言之,在PCR期间,随着形成的扩增子的量增加,信号强度增加至可测量的水平,并且在反应进入非对数期时在以后循环中达到平台。通过相对于反应的对数期中的循环数目绘制信号强度,可以推断出获得可测量信号时的具体循环,且用于计算在PCR开始之前的靶标数量。确定Ct的示例性方法描述在例如Heid等人. Genome Methods 6:986-94, 1996中,参考水解探针。
实施例
实施例1
外切核酸酶抗性修饰的评估
为了评估可以用于实践本发明的方法的不同外切核酸酶抗性修饰,合成了以下寡核苷酸:T9JTTTGC(SEQ ID NO: 1),其中T9代表5'翼部分,并且J代表修饰。在一个特定实验中使用的修饰包括硫代磷酸酯、2'-氨基-尿苷、2'-氟尿苷、2'-O-甲基尿苷、丙烷-二醇间隔物和HEG(全名)间隔物。将1μM各寡核苷酸悬浮于1 X外切核酸酶I缓冲液(New England Biolabs)和2单位的外切核酸酶I(New England Biolabs)中,并在37℃下温育三十分钟。反应通过在冰上冷却而终止,并且在Agilent Q-TOF 6530仪器中通过液相色谱-质谱法(LC-MS)分析外切核酸酶消化的产物。来自含有三种修饰(2'-O-甲基尿苷、HEG间隔物和丙二醇间隔物)之一的寡核苷酸的外切核酸酶I消化的产物显示于图2 A-C的质谱图上。这些结果显示:这些修饰有效阻断在修饰附接点外的寡核苷酸消化。
实施例2
使用5'翼探针检测EGFR T790M扩增
进行PCR测定,以检测人上皮生长因子受体(EGFR)基因的T790M突变(核苷酸变化2369 C->T)。以下引物用于扩增EGFR基因的区域,该区域包括T790M突变的位置:
正向引物: 5`CCTCCCTCCAGGAAGCCTACGTGA 3`(SEQ ID NO: 2)
反向引物: 5`CAGTCGAAGGGCATGAGCTGEA 3` (E= 叔丁基苄基-dC, SEQ ID NO: 3)。
为了检测,使用以下5'-翼探针,
5`-C6ECCTGCACGGTGGAGGTGAGGCAGP-3`(SEQ ID NO: 4),其中C6代表非互补的5'-翼部分,E代表1,3-丙二醇,且P代表磷酸酯。在96孔板上制备PCR反应混合物,具有以下终浓度:50 mM Tris-HCl (pH 8.0),80-100 mM氯化钾,200 µM各dATP、dCTP和dGTP,400 µM dUTP,200nM各引物,200 nM 5`-翼探针,靶DNA (1,000-100,000个拷贝的EGFR质粒) ,20 nM DNA聚合酶(具有5'核酸酶活性),0.1 mM EDTA,2.5 mM乙酸镁。使用Roche LightCycler® 480仪器(Roche Applied Science, Indianapolis, Ind.)进行扩增和分析。使用以下温度概况:95℃持续1分钟(或2个循环的95℃(10秒)至62℃(25秒),随后从92℃(10秒)至62℃(25-30秒)循环99次。在PCR反应结束时,将10单位的外切核酸酶I(New England Biolabs)添加至一些样品孔,并将溶液在37℃下温育30分钟,随后在冰上冷却。
使反应产物经过TopTip(Glygen Corp)阴离子交换柱,用于除去去污剂及其它污染物,然后上样至Agilent Q-TOF 6530仪器上,并通过LC-MS分析片段。图3显示了在通过外切核酸酶I消化前(A)和后(B),5'-翼探针的片段的提取离子色谱图(EIC)。在无外切核酸酶消化的反应中观察到两个不同的峰,其具有对应于具有序列C6ECC和C6ECCT的探针片段的预期质量。然而,在外切核酸酶I消化后,仅观察到质量对应于探针片段C6EC的单个独特峰,并且不再观察到对应于C6ECC和C6ECCT的峰。
实施例3
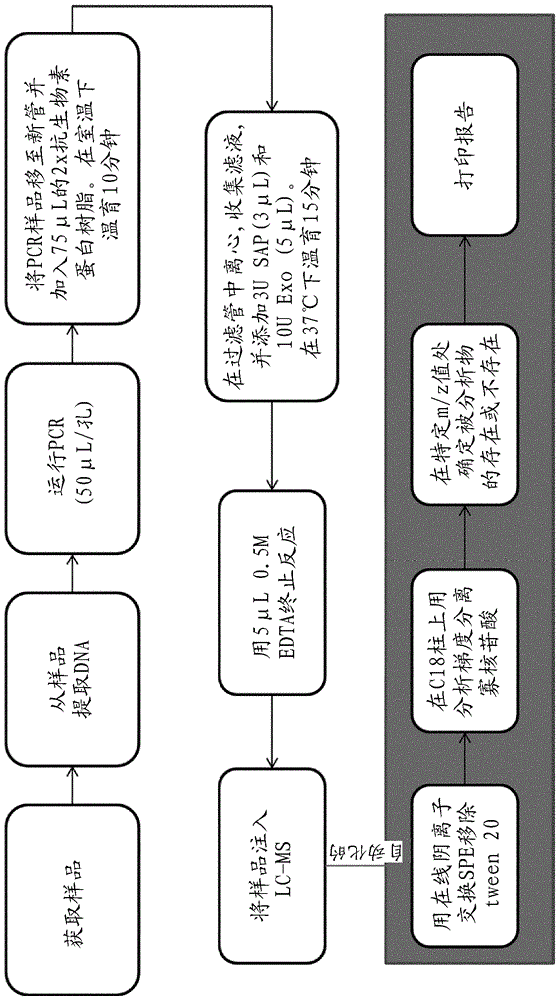
使用多种5'-翼探针的多路测定
关于如何使用本发明的方法来进行靶核酸的高通量多路检测的详细流程图显示于图2上。进行PCR测定以同时检测人表皮生长因子受体(EGFR)基因的外显子19缺失序列、T790M突变(核苷酸变化2369 C->T)、L858R突变和外显子28内部对照序列。在每种情况下,等位基因特异性引物用于扩增EGFR基因的包括指定突变的位置的区域。为了检测,使用以下5'-翼探针:
T790M: 5`-GGTGGAGETTTGCACGGTGGAGGTGAGGCAGEBT-3` (SEQ ID NO: 5)
外显子19 Del: 5`-GGGAGGGEGCCCAGAGCCATGGACCCCCACACAGEBT-3` (SEQ ID NO: 6)
L858R: 5`-TTCTTCTTECTTTACTGGTGAAAACACCGCAGCATGTEBT-3` (SEQ ID NO:7)
外显子28: 5`-ACCACCACCECTTAAAGGCCCGCTGGCTCTGTGCAGAAEBT-3` (SEQ ID NO:8)
对于各探针序列,E代表1,3-丙二醇,且B代表经由丙二醇接头(E)附接至寡核苷酸探针的生物素。
在96孔板上制备PCR反应混合物,具有以下终浓度:50 mM Tris-HCl (pH 8.0)、80-100 mM氯化钾、200 µM各dATP、dCTP和dGTP、400 µM dUTP、50 nM各引物、50 nM各5`-翼探针、靶DNA (对于各突变,10个拷贝的EGFR质粒) 、20 nM DNA聚合酶(具有5'核酸酶活性)、0.1 mM EDTA、2.5 mM乙酸镁。使用Roche LightCycler® 480仪器(Roche Diagnostics, Indianapolis, IN)进行扩增和分析。使用以下温度概况:95℃持续1分钟(或2个循环的95℃(10秒)至62℃(25秒),随后从92℃(10秒)至62℃(25-30秒)循环55次。在PCR反应结束时,将反应混合物与75uL预先转移至Eppendorf管中的1x外切核酸酶I缓冲液的固定化的抗生物素蛋白树脂(G Biosciences,Part 376A-A,批号112106)温育。添加样品(PCR孔,50 uL),并将反应混合物温育10分钟。然后将样品转移至旋转柱过滤器,并以500x g (2400 rpm)旋转。弃去树脂,并如下所述进一步处理流通物。
向指定样品中添加1uL 20单位/μL外切核酸酶I和3 uL 1u/uL虾碱性磷酸酶,并将反应混合物在37℃下温育15分钟。通过将溶液置于冰上来终止反应。
将反应产物通过TopTip (Glygen Corp)阴离子交换旋转柱用于除去去污剂和其它污染物,然后上样至自动进样器上,并通过LC-MS在Agilent TMQ 6460仪器上以SIM模式分析,在M/z 1518.7、1383.3、1345.8和1320.5处监测。图5显示在通过外切核酸酶I消化后各5'-翼的片段的单离子监测色谱图(SIM)。在反应消化中观察到四个不同的峰,其具有对应于具有以下所示序列的探针片段的预期质量:
外显子28_ ACCACCACC<丙烷1,3-二醇间隔物>C (M/z 1518.7,第二电荷状态)
L858R_ TTCTTCTT<丙烷1,3-二醇间隔物>C (M/z 1383.3,第二电荷状态)
外显子19 Del_GGGAGGG<丙烷1,3-二醇间隔物>G (M/z 1345.8,第二电荷状态)
T790M_GGTGGAG<丙烷1,3-二醇间隔物>T (M/z 1320.5,第二电荷状态)
仅当相应的靶标存在时才观察到这些峰。没有靶标对照没有显示峰(数据未显示)。
序列表
<110> Roche Diagnostics GmbH
F. Hoffmann-La Roche AG
Roche Molecular Systems, Inc.
<120> 通过基于结构的探针切割鉴定核酸靶标
<130> 32318 WO-HS
<160> 8
<170> PatentIn version 3.5
<210> 1
<211> 14
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针
<220>
<221> misc_feature
<222> (9)..(10)
<223> 外切核酸酶抗性修饰
<400> 1
tttttttttt ttgc 14
<210> 2
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 合成的引物
<400> 2
cctccctcca ggaagcctac gtga 24
<210> 3
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成的引物
<220>
<221> 修饰的碱基
<222> (21)..(21)
<223> 叔丁基苄基-dC
<400> 3
cagtcgaagg gcatgagctg ca 22
<210> 4
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针
<220>
<221> misc_feature
<222> (6)..(7)
<223> 1,3-丙二醇
<400> 4
cccccccctg cacggtggag gtgaggcag 29
<210> 5
<211> 31
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针T790M
<220>
<221> misc
<222> (7)..(8)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (30)..(31)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (30)..(31)
<223> 生物素
<400> 5
ggtggagttt gcacggtgga ggtgaggcag t 31
<210> 6
<211> 34
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针外显子19 Del
<220>
<221> misc
<222> (7)..(8)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (33)..(34)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (33)..(34)
<223> 生物素
<400> 6
gggaggggcc cagagccatg gacccccaca cagt 34
<210> 7
<211> 37
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针 L858R
<220>
<221> misc
<222> (8)..(9)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (36)..(37)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (36)..(37)
<223> 生物素
<400> 7
ttcttcttct ttactggtga aaacaccgca gcatgtt 37
<210> 8
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> 合成的探针外显子28
<220>
<221> misc
<222> (9)..(10)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (37)..(38)
<223> 1,3-丙二醇
<220>
<221> misc
<222> (37)..(38)
<223> 生物素
<400> 8
accaccaccc ttaaaggccc gctggctctg tgcagaat 38
- 还没有人留言评论。精彩留言会获得点赞!