一种低压低温提取高活性桑黄多糖的方法与流程
本发明属于生物技术领域,具体涉及一种药用真菌桑黄的活性成分多糖的提取方法。
背景技术:
桑黄又名鲍氏层孔菌(Phellinusigniarius),是锈革孔菌科(Hymenochaetaceae)、针层孔菌属(Phellinus)的真菌,具有抗肿瘤、抗氧化、抗菌、消炎、增强免疫等药理活性。桑黄是目前国际公认的生物抗癌领域中效果排在第一位的药用菌,是国际医药界与保健品行业抗癌产品的生产原料,市场潜力巨大。桑黄在自然界中很难形成桑黄子实体,并且人工栽培技术还不成熟,这些都是影响桑黄产量的重要因素。目前,桑黄的液体发酵技术已经成熟,可以生产出大量的菌丝体用于获得桑黄菌丝多糖。多糖作为桑黄真菌一种非常重要的活性物质,其具有非常好的药效作用。现代科学研究证实,桑黄多糖的药理活性主要有抗肿瘤、抗癌、抗突变、增强机体免疫力、抗氧化、抗衰老等。桑黄多糖作为活性物质,在桑黄多糖的提取过程中,保持多糖的活性就尤为重要。目前提取桑黄多糖的方法主要有热水浸提法、超声破碎法、酶解法、超声辅助复合酶法等,其中热水浸提法的提取温度一般为90~100℃,虽然可提高多糖得率,但得到的多糖活性明显降低;超声破碎法在合适的超声功率条件下,可以破碎细胞壁从而提高多糖得率,但由于在操作过程中剪切力过大,往往导致部分多糖分子结构破坏,进而使多糖活性明显降低;酶解法提取成本较高,不适合工业生产中大量提取多糖。
技术实现要素:
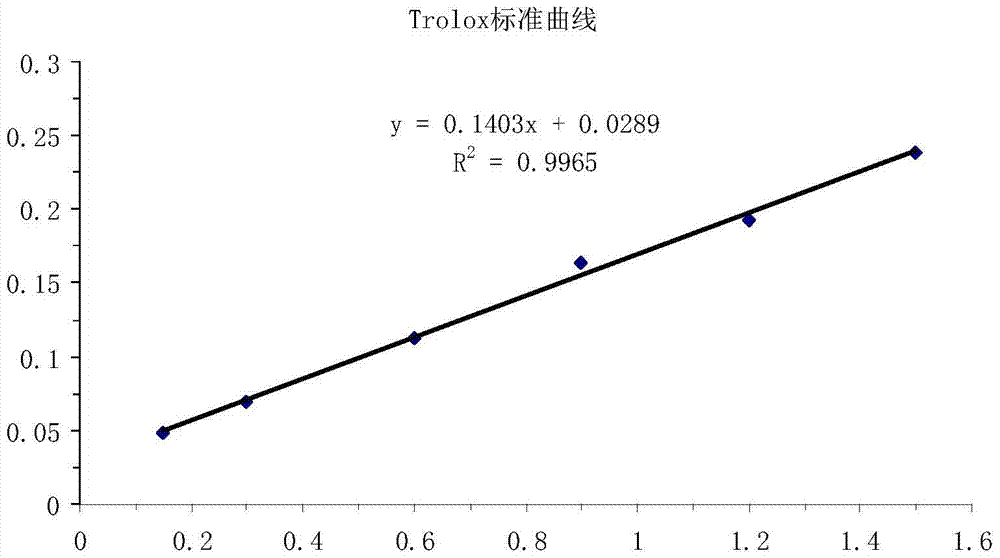
本发明所要解决的技术问题在于克服现有桑黄多糖提取方法存在的桑黄多糖活性低的问题,提供一种操作简单,能很好保持多糖活性的低温低压提取高活性桑黄多糖的方法。解决上述问题所采用的技术方案是:将桑黄菌丝体与水按料液比为1g:40~60mL混合均匀,在压力为-0.04~-0.07MPa、温度为50~60℃下提取1~3小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。本发明优选将桑黄菌丝体与水按料液比为1g:50mL混合均匀,在压力为-0.04~-0.07MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。本发明最佳选择将桑黄菌丝体与水按料液比为1g:50mL混合均匀,在压力为-0.06MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。本发明在低压条件下进行桑黄多糖提取,使得桑黄菌丝体细胞壁破裂溶出多糖,从而提高多糖产量,在此过程中,没有物理剪切力破坏多糖结构,又在较低的温度环境中保护了多糖活性结构,使得提取得到的桑黄多糖以最佳的活性结构溶于提取液中,从而获得了高活性的桑黄多糖。附图说明图1是葡萄糖标准曲线。图2是Trolox标准曲线。具体实施方式下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。下面实施例中的桑黄菌丝体按下述方法制备而成:1、菌株活化配制一级种子培养基(2%葡萄糖、25%土豆、1%MgSO4、1%KH2PO4、1.3%芦丁、0.2%CaCl2、0.2%硫酸亚铁、pH值为6.5),取保存的菌种斜面,挑取3~4块桑黄菌丝块接种于一级种子培养基中,250mL摇瓶装液量50mL、温度28℃、转速160rpm,培养10天,得到一级种子;配制二级种子培养基(2%葡萄糖、25%土豆、1%MgSO4、1%KH2PO4、0.2%CaCl2、0.2%硫酸亚铁、pH值为6.5),取一级种子接种于二级种子培养基中,250mL摇瓶装液量80mL、接种量10%、温度28℃、转速160rpm,培养6天,得到二级种子。2、桑黄菌丝发酵配制发酵培养基(5%葡萄糖、1.36%麦芽粉、0.24%天门冬氨酸、0.035%FeSO4、0.1%KH2PO4、0.1%MgSO4、0.4%吐温80、复合维生素0.5%,初始pH值为6.5),将二级种子接种于发酵培养基中,500mL摇瓶装液量150mL、接种量10%、温度28℃、转速160rpm,培养7天,9000rpm离心15分钟,收集菌丝体,用清水反复冲洗菌丝体直至除去发酵液,然后用四层纱布过滤菌丝体,置于50℃恒温烘箱中烘干,得到桑黄菌丝体,于-20℃冰箱保存。实施例1将10g桑黄菌丝体加入500mL去离子水中混合均匀,在压力为-0.04MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例2将10g桑黄菌丝体加入500mL去离子水中混合均匀,在压力为-0.05MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例3将10g桑黄菌丝体加入500mL去离子水中混合均匀,在压力为-0.06MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例4将10g桑黄菌丝体加入500mL去离子水中混合均匀,在压力为-0.07MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例5将10g桑黄菌丝体加入400mL去离子水中混合均匀,在压力为-0.06MPa、温度为60℃下提取1小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例6将10g桑黄菌丝体加入400mL去离子水中混合均匀,在压力为-0.05MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例7将10g桑黄菌丝体加入400mL去离子水中混合均匀,在压力为-0.04MPa、温度为60℃下提取3小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例8将10g桑黄菌丝体加入600mL去离子水中混合均匀,在压力为-0.06MPa、温度为60℃下提取1小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例9将10g桑黄菌丝体加入600mL去离子水中混合均匀,在压力为-0.05MPa、温度为60℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。实施例10将10g桑黄菌丝体加入600mL去离子水中混合均匀,在压力为-0.04MPa、温度为60℃下提取3小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到活性桑黄多糖。为了证明本发明的有益效果,发明人将本发明实施例1~10的提取方法分别与热水浸提法和超声协助提取法进行了实验室对比试验,具体试验情况如下:热水浸提法:将桑黄菌丝体与去离子水按料液比为1g:50mL混合均匀,分别在温度为60、70、80、90、100℃下提取2小时,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到桑黄多糖。超声协助提取法:将桑黄菌丝体与去离子水按料液比为1g:50mL混合均匀,在温度为60℃下超声提取2小时,超声功率分别为500W、600W、700W,离心分离,上清液用体积分数为80%的乙醇水溶液在4℃下醇沉12小时,得到桑黄多糖。根据下述方法检测不同提取方法对桑黄多糖得率和总抗氧化活性的影响,每种提取方法重复试验3次,试验结果见表1~3。桑黄多糖含量的测定:苯酚-硫酸法,以葡萄糖为标准品,测得470nm处标准曲线的线性回归方程为:y=0.0019x+0.0064,其中x为葡萄糖浓度,y为470nm处OD值,R2=0.9904,见图1。桑黄多糖得率计算:桑黄多糖得率=桑黄多糖含量/提取菌丝量×100%桑黄多糖总抗氧化能力测定:使用总抗氧化能力检测试剂盒(ABTS法),以Trolox为标准品,测得734nm处标准曲线的线性回归方程为:y=0.1403x+0.0289,其中x为Trolox的抗氧化能力,y为734nm处OD值,R2=0.9965,见图2。表1本发明提取方法的测定结果桑黄多糖得率(%)总抗氧化能力(mM)实施例15.41±0.036.16±0.02实施例25.55±0.056.43±0.03实施例35.58±0.036.48±0.01实施例45.52±0.046.21±0.02实施例55.27±0.016.18±0.02实施例65.35±0.036.33±0.04实施例75.42±0.036.28±0.03实施例85.31±0.026.26±0.02实施例95.46±0.046.44±0.02实施例105.53±0.036.37±0.01表2热水浸提法的测定结果提取温度(℃)桑黄多糖得率(%)总抗氧化能力(mM)603.98±0.044.03±0.05704.43±0.024.57±0.03805.12±0.054.62±0.04905.45±0.034.41±0.021005.57±0.044.34±0.03表3超声协助提取法的测定结果提取温度(℃)提取功率(W)桑黄多糖得率(%)总抗氧化能力(mM)605005.50±0.024.54±0.01606005.43±0.054.46±0.03607005.41±0.044.43±0.02对比表1和表2的试验结果可见,热水浸提法的提取温度为60℃时,桑黄多糖的得率仅为3.98%,虽然随着提取温度的升高桑黄多糖的得率逐渐升高,但桑黄多糖的活性普遍较低,总抗氧化性最大仅为4.62mM。而采用本发明提取方法,桑黄多糖的得率明显高于热水浸提法提取温度为60℃的多糖得率,且随着压力的升高桑黄多糖的得率逐渐升高,最大得率可达到5.58%,更重要的是得到的桑黄多糖的活性明显高于热水浸提法,总抗氧化性可达到6mM以上。由此可见,本发明提取方法与热水浸提法相比,既提高了桑黄多糖的得率,又提高了桑黄多糖的总抗氧化能力。对比表1和表3的试验结果可见,在提取温度均为60℃下,本发明提取方法与超声协助提取法的桑黄多糖得率基本相当,但超声协助提取法的桑黄多糖的活性较低,总抗氧化性仅为4.5mM左右,而采用本发明提取方法的桑黄多糖活性明显高于超声协助提取法,总抗氧化性均可达到6mM以上。由此可见,本发明提取方法与超声协助提取法相比,虽然桑黄多糖的得率相当,但得到的桑黄多糖的活性明显提高了。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1