一种诱导剂及其应用的制作方法
本发明涉及一种新的诱导剂及其应用,属于基因工程药物制备领域。
背景技术:
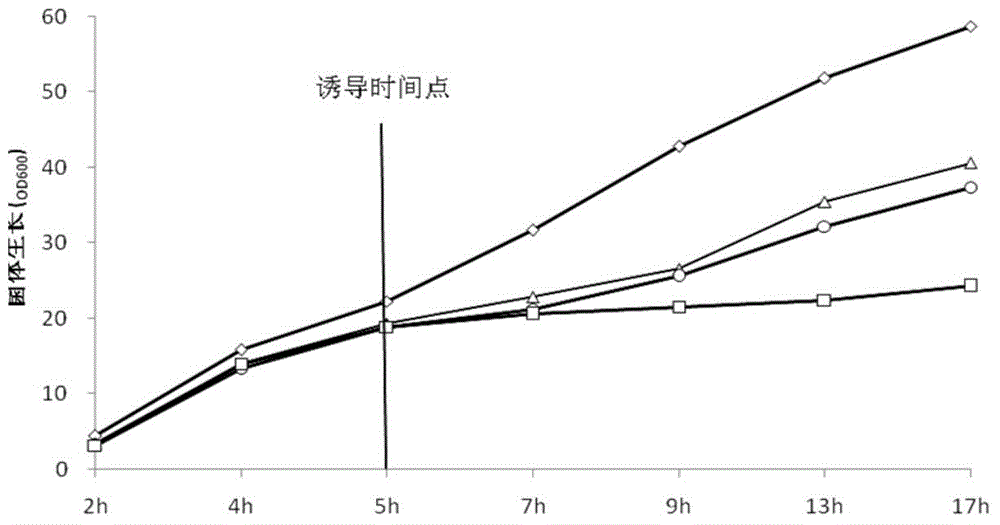
:目前,在大肠杆菌表达外源蛋白的研究,多以IPTG(异丙基-β-D巯基半乳糖苷)作为诱导剂诱导表达,但因为IPTG使异源蛋白的合成速度太快,以致于没有足够的时间进行折叠,当存在二硫键时,二硫键不能正确配对,过多蛋白间的非特异性结合,蛋白质无法达到足够的溶解度,多以包涵体的形式存在,导致可溶性蛋白含量很低(陈圆圆等,包涵体的形成原因及其处理方法.上海畜牧兽医通讯,2009,1:62)。而实验结果显示有些包涵体通过复性后失去了免疫活性,因此如何增加此类蛋白的可溶性表达量成了关键问题。另外,IPTG具有潜在的毒性(金奇.医学分子病毒学.北京:科学出版社,2001),对菌体生长具有一定的抑制作用,各国药典均不提倡使用,并且价格昂贵,因而不适宜在发酵罐中进行基因工程产品的规模化生产。传染性法氏囊病是由传染性法氏囊病病毒(InfectiousBursalDiseaseVirus,IBDV)导致的,以法氏囊肿大、肝脏损伤为主要特征的高度接触性传染病。随着我国养鸡业的集约化发展,传染性法氏囊病已成为危害养鸡业的一种主要传染病,目前,亟需免疫原性好、安全性高的新型亚单位疫苗问世。现有技术中,主要以IBDVVP2蛋白作为免疫原性蛋白研制亚单位疫苗,以大肠杆菌表达为主,但IBDVVP2是在细胞内产生的异源蛋白,因为真核糖蛋白无法糖基化使中间体溶解度下降,导致不溶解的包涵体形成(WilliamSelleck,SongTan.RecombinantProtienComplexExpressioninE.coli.CurrentProtocolsinProtein,Science,2008, 21(5):324-321),可溶性蛋白产量较低,实验结果显示IBDVVP2所形成的包涵体通过复性后没有免疫活性。技术实现要素:为克服现有技术的缺陷和不足之处,本发明的第一方面在于提供一种诱导在大肠杆菌表达系统中进行外源蛋白表达的诱导剂,其中,所述诱导剂包括蛋白乳清粉。作为本发明的一种实施方式,本发明的所述诱导剂包括蛋白乳清粉和蔗糖。作为本发明的一种实施方式,本发明的诱导剂中,所述蛋白乳清粉包括高蛋白乳清粉、中蛋白乳清粉、低蛋白乳清粉。其中,所述高蛋白乳清粉中,水分≤5%,蛋白质≥11%,灰分≤8%,乳糖≥68%,脂肪≤1.5%;所述中蛋白乳清粉中蛋白≥6%,乳糖≥75%,脂肪≤1.5%;所述低蛋白乳清粉中,蛋白≥2%,乳糖为82%-85%,脂肪≤1%。术语“蛋白乳清粉”又称为“乳清蛋白”(wheyprotein),是经巴氏杀菌法、脱盐、蒸发浓缩和喷雾干燥制成的,主要用于食品工业,特别是焙烤、糕饼制造和乳制品工业中,外观均为淡颜色,没有结块(如有轻微结块也可轻微碾开),没有非乳清的味道和气味;还可添加至动物饲料中,因乳清粉能提供大量的乳糖,在仔猪的消化道内发酵可产生大量的乳酸,帮助乳的消化,抑制致病细菌的生长,因而主要用于乳猪饲料的添加。奶牛及肉牛、狗和猫,家禽以及其他动物也从乳清蛋白产品的使用中不同程度的获得营养益处。术语“蛋白乳清粉”按蛋白含量高低可分为三种:高蛋白乳清粉水分≤5%,蛋白质≥11%,灰分≤8%,乳糖≥68%,脂肪≤1.5%;中蛋白乳清粉蛋白≥6%,乳糖≥75%,脂肪≤1.5%;低蛋白乳清粉蛋白≥2%,乳糖为82%-85%,脂肪≤1%。因其成本很低,且可以达到很好的诱导效果,所以可以大大节约生产成本。作为本发明的一种实施方式,本发明的所述诱导剂包括150-300g/L低蛋白乳清粉,5-20g/L七水硫酸镁,10-25g/L胰蛋白胨,15-40g/L酵母提取物。作为本发明的一种优选实施方式,本发明的所述诱导剂包括150g/L低蛋白乳清粉,15g/L七水硫酸镁,15g/L胰蛋白胨,30g/L酵母提取物。作为本发明的一种优选实施方式,本发明的所述诱导剂包括150-300g/L低蛋白乳清粉,50-200g/L蔗糖,5-20g/L七水硫酸镁,10-25g/L胰蛋白胨,15-40g/L酵母提取物。作为本发明的一种优选实施方式,本发明的所述诱导剂包括150g/L低蛋白乳清粉,150g/L蔗糖,15g/L七水硫酸镁,15g/L胰蛋白胨,30g/L酵母提取物。本发明的第二方面在于提供了一种使用所述诱导剂在大肠杆菌中诱导表达IBDV重组抗原蛋白的方法,所述方法包括:(1)将含IBDVVP2的重组质粒的宿主菌依次制备成一级种子和二级种子;(2)发酵和诱导:将所述步骤(1)中所述二级种子接种于含发酵培养基的发酵罐中,37℃培养,当DO值降至15%时缓慢增加通气量至400-800L/h;当pH上升、DO值上升时开始按DO值反馈慢速流加补料培养基,至DO值大于35%时自动流加补料培养基;当菌体浓度OD600为10-25时降温至诱导温度后开始添加含抗生素的所述诱导剂进行诱导,至DO值大于35%时慢速流加含抗生素的所述诱导剂,于诱导时间结束后收取发酵液,离心后收取含IBDV重组抗原蛋白的菌体。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)发酵和诱导步骤为:所述的二级种子接种于含发酵培养基的发酵罐中,37℃培养,初始搅拌为100-300rpm,初始通气量为100-300L/h,当DO值降至15%时缓慢增加通气量至400-800L/h;当pH上升、DO值上升时开始慢速流加补料培养基,至DO值大于35%时自动流加补料培养基;当菌体浓度OD600为10-25时降温至诱导温度后开始添加含抗生素的所述诱导剂进行诱导,至DO值大于35%时慢速流加含抗生素的所述诱导剂,于诱导时间结束后收取发酵液,离心后收取含IBDV重组抗原蛋白的菌体。作为本发明的一个实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(1)中所述含IBDVVP2的重组质粒的宿主菌制 备方法包括:I提取鸡传染性法氏囊病病毒的总RNA;II将IBDVVP2基因利用基因工程手段构建大肠杆菌重组质粒载体,并制备大肠杆菌重组质粒的宿主菌。作为本发明的一个优选实施方式,所述含IBDVVP2的重组质粒的宿主菌为DH5α(DH5α-VP2)、BL21(DE3-VP2)。优选地,所述宿主菌的制备方法之所述步骤II中所述大肠杆菌重组质粒可通过本领域的常规方法构建而成,即将IBDVVP2基因插入到大肠杆菌表达载体合适的限制性内切酶位点之间,使IBDVVP2基因可操作的与大肠杆菌表达调控序列相连接;更优选地,将IBDVVP2基因核苷酸序列插入到大肠杆菌表达载体pColdIII的多克隆位点之间,使所述核苷酸序列冷休克基因(CspA)启动子和lacZ启动子的下游并受其调控,得到重组大肠杆菌表达载体。优选地,所述宿主菌的制备方法之所述步骤II中所述大肠杆菌重组质粒可通过常规的方法转化宿主菌,所述宿主菌又称宿主细胞,所述宿主细胞的类型可为DH5α、BL21;更优选地,将大肠杆菌重组质粒采用CaCl2转化方法转化BL21(DE3)大肠杆菌株(EColi.BL21(DE3))。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述发酵培养基包括:10-15g/L胰蛋白胨,5-10g/L酵母提取物,5-10g/L甘油,1-2g/L磷酸氢二铵,5-8g/L磷酸二氢钾,0.6-1g/L柠檬酸,0.5-1g/L七水硫酸镁,5ml/L微量元素溶液,pH值为6.8-7.0,在使用前加入终浓度为50μg/mL的硫酸卡那霉素或100μg/mL的氨苄青霉素;其中,所述微量元素溶液包括:10g/L七水硫酸亚铁、2.25g/L七水硫酸锌、1g/L五水硫酸铜、0.5g/L五水硫酸锰、0.23g/L十水四硼酸钠、2g/L二水氯化钙、0.1g/L七钼酸铵,用5mol/L盐酸溶解上述物质,优选地,所述微量元素溶液需经116-121℃灭菌20-30min。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述发酵培养基包括:10g/L胰蛋白胨,5g/L酵母提取物,8g/L甘油,2g/L磷酸氢二铵,6.7g/L磷酸二氢钾,0.8g/L 柠檬酸,0.65g/L七水硫酸镁,5ml/L微量元素溶液,pH值为6.8-7.0,在使用前加入终浓度为50μg/mL的硫酸卡那霉素或100μg/mL的氨苄青霉素;其中,所述微量元素溶液包括:10g/L七水硫酸亚铁、2.25g/L七水硫酸锌、1g/L五水硫酸铜、0.5g/L五水硫酸锰、0.23g/L十水四硼酸钠、2g/L二水氯化钙、0.1g/L七钼酸铵,用5mol/L盐酸溶解上述物质,优选地,所述微量元素溶液需经116-121℃灭菌20-30min。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述补料培养基为蔗糖补料培养基,所述蔗糖补料培养基包括300g/L蔗糖、15g/L七水硫酸镁、15g/L胰蛋白胨、30g/L酵母提取物,在使用前加入终浓度为50μg/mL的硫酸卡那霉素或100μg/mL的氨苄青霉素。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述含抗生素的诱导剂的所述抗生素为浓度为50μg/mL的硫酸卡那霉素或100μg/mL的氨苄青霉素。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述诱导温度为25-35℃,所述诱导时间为6-16h。作为本发明的一种优选实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述诱导温度为28℃,所述诱导时间为8h。作为本发明的一种实施方式,本发明的诱导表达IBDV重组抗原蛋白的方法中,所述步骤(2)中所述含IBDV重组抗原蛋白的菌体经离心破碎后收集上清进行检测,所述检测的方式为琼扩实验。术语“IBDV重组抗原蛋白”是指含有IBDV免疫原性蛋白VP2的重组蛋白,术语“IBDV免疫原性蛋白VP2”是指含441AA的IBDV最主要的结构蛋白,也是主要宿主保护性抗原,其诱导的中和抗体能被动地保护宿主不受IBDV感染(祁小乐,王笑梅,高玉龙等.鸡传染性法氏囊病病毒VP2蛋白研究进展.中国预防兽医学报,2008,30(8):656-660)。术语“宿主菌”是指表达载体或DNA构建物的合适宿主,所述表达载体或DNA构建物的表达系统包含但不限于本发明的乳糖操纵子、tac 操纵子、trc操纵子等,其载体包括但不限于pET系列载体、pGEX系列载体。具体而言,宿主菌株优选为大肠杆菌,表达系统优选乳糖操纵子,tac操纵子、trc操纵子。术语“DO值”为当前状态下溶解氧占饱和状态的百分比,其中“DO”为DissolvedOxygen,又称溶解氧或溶氧,是指溶解于水中分子状态的氧。术语“抗生素”包括但不限于硫酸卡那霉素、氨苄青霉素、氯霉素、四环素、庆大霉素。本发明的第三方面在于提供所述诱导剂在制备IBDV重组VP2抗原蛋白方面的应用。本发明的优点在于:(1)用本发明的蛋白乳清粉、蛋白乳清粉-蔗糖作为诱导剂来诱导目的蛋白的表达,表达水平相当甚至高于ITPG、IPTG-甘油诱导时的效果,目的蛋白占菌体总蛋白的水平可高达10%-15%;得到的大肠杆菌BL21(DE3)菌体得率高,菌体浓度OD600可达到50-80,菌体湿重达到45-75g/L。(2)所述表达方法简单,发酵时间短,诱导剂蛋白乳清粉价廉易得,生产成本低,且无IPTG存在,后处理较为简单、安全。附图说明图1是摇瓶条件下不同诱导剂诱导8h时的目的蛋白琼扩效价AGP结果,其中上图为标准样品的琼扩图,下图为不同诱导剂(IPTG-甘油、低蛋白乳清粉、低蛋白乳清粉-蔗糖)情况下的琼扩结果;其中下图中PBS为阴性对照,22、23、24、25、26、27均表示琼扩效价AGP的数值。图2是10L发酵罐实验不同的诱导剂条件下菌体的生长情况,其中纵坐标为菌体生长OD600值,横坐标为生长时间,(◇)低蛋白乳清粉-蔗糖诱导剂;(△)IPTG-甘油诱导剂;(○)低蛋白乳清粉诱导剂;(□)IPTG诱导剂。图3是发酵过程中添加不同诱导剂条件下表达的目的蛋白的 WesternBlot结果,其中泳道M为Marker,泳道1为未诱导的空白对照,泳道2是添加IPTG诱导剂的实验结果,泳道3是添加IPTG-甘油诱导剂的实验结果,泳道4是添加低蛋白乳清粉诱导剂的实验结果,泳道5是添加低蛋白乳清粉-蔗糖诱导剂的实验结果。具体实施方式下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。实施例1含IBDVVP2的重组质粒的宿主菌的制备1.1菌株含IBDVVP2的重组质粒的宿主菌BL21(DE3)-IBDV-VP2表达体系的构建。1、实验材料质粒提取试剂盒购自天根生物;T4DNALigase购自BioLab;EcoR1、Sal1限制性内切酶、pColdIII_DH5α菌株购自TaKaRa;琼脂糖凝胶胶回收试剂盒购自天泽生物,其他试剂均为分析纯。2、实验步骤2.1VP2cDNA制备2.1.1总RNA的提取总RNA简要过程如下:将感染鸡传染性法氏囊病病毒超强毒LQ9株(该毒株公开于中国专利CN103849631A中)的SPF鸡法氏囊用研磨器研磨。取200μL病料补加TE(10mMTris,1mMEDTA,pH8.0)至500μL,加入5μL蛋白酶K和10%(W/V)十二烷基磺酸钠(SDS)50μL,56℃水浴3小时。加入等体积苯酚/氯仿(1:1,V/V)抽提3次,等体积氯仿抽提一次。移出上清至另一1.5mL离心管,加入1/10体积的 NaAc(3M,pH5.2)、等体积异丙醇,-20℃沉淀2小时。4℃、10000转/分离心15分钟,用75%乙醇洗一次。真空干燥,将RNA用无RNA酶去离子水0.5ml重新溶解。2.1.2VP2cDNA制备根据VP2基因5’和3’末端的保守区序列合成寡聚核苷酸引物,每个引物的5’端包含一个方便将基因克隆到载体上的限制酶切位点。这对引物被用来进行RT-PCR扩增生成cDNA。合成寡聚核苷酸引物序列如下:VP2-EcoR1-f:CCGGAATTCATGACAAACCTGCAAGATCAAACVP2-Sall-r:ACGCGTCGACTTACCTTAGGGCCCGGATTATGT2.2含酶切位点的VP2片段扩增对上述制备的VP2cDNA进行PCR扩增,并利用琼脂糖凝胶胶回收试剂盒回收,-20℃保存。2.3pColdⅢ质粒EcoR1、Sal1双酶切利用EcoR1、Sal1对pColdⅢ质粒进行双酶切,形成具有粘性末端的连接片段,反应体系如下:37℃水浴2h后,琼脂糖电泳回收1.7kb大小的目的片段。2.4目的基因片段的琼脂糖凝胶回收目的基因片段的琼脂糖凝胶回收按以下步骤进行:(1)从琼脂糖凝胶中切下含有目的条带的凝胶块,放入1.5ml离心管中,称重。(2)每100mg琼脂糖凝胶加入300μl溶胶溶液。(3)55℃温浴10min,至凝胶完全融化。(4)取700μl融化的凝胶溶液转移至纯化柱中,10000g室温离心1min。(5)将纯化柱放回收集管中,加入500μl洗涤缓冲液,10000g室 温离心1min。(6)弃去滤过液,纯化柱放回收集管,再次离心1min,以除去残留的WashingBuffer。(7)将纯化柱转移至1.5ml新的微量离心管中,在柱子中央加入30~50μl洗脱缓冲液,10000g室温离心1min。离心管中洗脱液即为回收的DNA。2.5酶连反应取约10μl经过酶切和纯化的pColdⅢ载体,加入30μl的待插入片段。加入1μlT4DNA连接酶,漩涡混匀,室温离心数秒。反应体系如下:20-25℃孵育连接2小时后可以取20μl直接转化大肠杆菌BL21(DE3),并涂布在含有100μg/mL氨苄青霉素LB固体培养基中培养过夜,长出的菌落即为阳性克隆,命名为pColdⅢ_VP2/E.ColiBL21(DE3)菌株。挑取单克隆在含有100μg/mL氨苄青霉素的LB培养基中培养过夜,提取质粒后,送Invitrogen公司测序分析,测序结果通过BLAST(http://blast.ncbi.nlm.nih.gov/)分析显示前期扩增的VP2基因序列(见SEQIDNo.1)与Genebank公布的IBDV超强毒株VP2基因序列同源性较高,能达到98%。实施例2培养基的制备2.1发酵培养基的制备发酵培养基包括:胰蛋白胨10g/L,酵母提取物5g/L,甘油8g/L,磷酸氢二铵2g/L,磷酸二氢钾6.7g/L,柠檬酸0.8g/L,七水硫酸镁0.65g/L,微量元素溶液5ml/L,用去离子水溶解,并用5mol/LNaOH调pH值至 6.8-7.0,116-121℃灭菌20-30分钟。在使用前加入终浓度为100μg/mL氨苄青霉素。其中,微量元素溶液包括:七水硫酸亚铁10g,七水硫酸锌2.25g,五水硫酸铜1g,五水硫酸锰0.5g,十水四硼酸钠0.23g,二水氯化钙2g,七钼酸铵0.1g,使用1000ml的5mol/L盐酸溶解上述物质。2.2补料培养基的制备甘油补料培养基:甘油500g,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL,在使用前加入终浓度为100μg/mL氨苄青霉素。蔗糖补料培养基:蔗糖300g,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL,在使用前加入终浓度为100μg/mL氨苄青霉素。2.3诱导剂的制备IPTG诱导剂:0.2mMIPTG,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL。IPTG-甘油诱导剂:0.2mMIPTG,甘油500g/L,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL。低蛋白乳清粉诱导剂:低蛋白乳清粉150g,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL。低蛋白乳清粉-蔗糖诱导剂:低蛋白乳清粉150g,蔗糖150g,七水硫酸镁15g,胰蛋白胨15g,酵母提取物30g,去离子水加至1000mL。实施例3诱导表达方式的建立IBDV重组VP2蛋白在大肠杆菌中的表达方法,包括:(1)将实施例1所制得的重组质粒的宿主菌pColdIII_VP2/E.ColiBL21(DE3)菌株依次制备一级种子和二级种子;(2)发酵和诱导:将步骤(1)所述二级种子接种于含发酵培养基的发酵罐中,37℃培养,初始搅拌为300rpm,初始通气量为300L/h,当DO值降低至15%时缓慢增加通气量至500L/h;当pH上升、DO值上 升时开始按DO值反馈慢速流加补料培养基,至DO值大于35%时自动流加补料培养基;当菌体浓度OD600至20左右时降温至28℃后开始添加含100μg/mL氨苄青霉素的所述诱导剂进行诱导,至DO值大于35%时慢速流加含100μg/mL氨苄青霉素的所述诱导剂,于诱导8h后收取发酵液,离心后收取含IBDV重组抗原蛋白的菌体。当诱导剂是IPTG诱导剂时,所添加的补料培养基为甘油补料培养基(缓慢流加),当诱导时加入IPTG诱导剂(一次性加入);当诱导剂是IPTG-甘油诱导剂,所添加的补料培养基为甘油补料培养基(缓慢流加),当诱导时加入IPTG-甘油诱导剂(其中所含的IPTG成分一次性加入,其余成分缓慢流加);当诱导剂为低蛋白乳清粉诱导剂时,所添加的补料培养基为蔗糖补料培养基(缓慢流加),当诱导时加入低蛋白乳清粉诱导剂(缓慢流加);当诱导剂为低蛋白乳清粉-蔗糖诱导剂时,所添加的补料培养基为蔗糖补料培养基(缓慢流加),当诱导时加入低蛋白乳清粉诱导剂(缓慢流加)。实施例4与现有表达方式的对比4.1摇瓶发酵试验一级种子的制备:将从-70℃冰箱中取出含有鸡传染性法氏囊IBDVVP2重组菌的甘油保藏管于冰水浴中解冻,混匀后以1%接种量接到含有5mL培养基的试管中,并加入终浓度为100μg/mL的氨苄青霉素溶液,于37℃的恒温摇床中震荡培养12h,转速为220rpm/min。在摇瓶发酵试验中,一级种子的接菌量为1%体积比,37℃,220rpm培养。当菌体OD600值生长至0.6左右时迅速降温至28℃,并加入诱导剂进行诱导,在诱导不同时间点取样离心破碎并用标准血清检测琼扩效价(即AGP,表明可溶性蛋白的琼扩效价),结果见表1,其中诱导8h时的琼扩实验见图1。表1摇瓶发酵试验不同诱导剂在不同诱导时间后VP2蛋白琼扩效价AGP由表1结果可知:在摇瓶发酵中,低蛋白乳清粉作为诱导剂时,诱导8h时效果(1:64)与IPTG-甘油的效果(1:64)相当,并且优于IPTG单独的诱导结果(1:32),表明可溶性蛋白的表达量相当于IPTG-甘油的,高于IPTG单独诱导时的结果;低蛋白乳清粉-蔗糖作为诱导剂时,诱导8h时效果(1:128)优于低蛋白乳清粉单独作为诱导剂、IPTG-甘油作为诱导剂使用时的效果(1:64),远远高于IPTG单独作为诱导剂时的效果(1:32),表明可溶性蛋白的表达量高于IPTG-甘油的、IPTG单独的结果,为扩大发酵提供了理论依据。4.2发酵罐实验一级种子的制备:将从-70℃冰箱中取出含有鸡传染性法氏囊IBDVVP2重组菌的甘油保藏管于冰水浴中解冻,混匀后以1%接种量接到含有5mL培养基的试管中,并加入终浓度100μg/mL氨苄青霉素溶液,于37℃的恒温摇床中震荡培养12h,转速为220rpm/min。二级种子的制备:把一级种子按5%(V/V)的接种量接入到含500mL三角瓶中,装液量为体积百分比20%,并加入终浓度100μg/mL氨苄青霉素溶液,于37℃的恒温摇床中震荡培养12h,转速为220rpm/min。发酵和诱导:将二级种子按10%(V/V)的接种量接种于含发酵培养基的10L发酵罐中,37℃培养,初始搅拌为300rpm,初始通气量为300L/h,当DO值降低至15%时缓慢增加通气量至500L/h;当pH上升、DO值上升时开始按DO值反馈慢速流加补料培养基,至DO值大于35%时自动流加补料培养基;当菌体浓度OD600至20左右时降温至28℃后开始添加含100μg/mL氨苄青霉素的所述诱导剂进行诱导,至DO值大 于35%时慢速流加含100μg/mL氨苄青霉素的所述诱导剂,于诱导8h后收取发酵液,离心后收取含IBDV重组抗原蛋白的菌体。诱导表达后的结果见表2和图2。表210L发酵罐中不同诱导剂条件以及不同诱导时间下目的蛋白的琼扩效价AGP对比结果表3不同诱导剂的市场价格及发酵过程中每升用量与成本诱导剂市场价(每千克)每升用量(g)每升成本价(元)IPTG10000-250000.050.5-1.2IPTG-甘油10000-250000.050.5-1.2低蛋白乳清粉6-10100.06-0.1低蛋白乳清粉-蔗糖6-10100.06-0.1注:从诱导开始到结束所消耗的IPTG诱导补料培养基、IPTG-甘油诱导补料培养基低蛋白乳清粉诱导补料培养基、低蛋白乳清粉-蔗糖诱导补料培养基的使用量均约为50ml/L。甘油和蔗糖的价格低廉,可忽略。由表2-3及图2可知:大批量生产时,当低蛋白乳清粉作为诱导剂时,得到的大肠杆菌BL21(DE3)菌体浓度(OD600为39)与IPTG-甘油的相当(OD600为40)且高于IPTG的(OD600为20),诱导8h时效果(1:64)与IPTG-甘油的效果(1:64)相当并优于IPTG单独的诱导结果(1:32),表明菌体得率高,可溶性蛋白的表达量相当于IPTG-甘油的,高于IPTG单独诱导时的结果;当低蛋白乳清粉-蔗糖作为诱导剂时,得到的大肠杆菌BL21(DE3)菌体浓度(OD600为60)高于其他诱导剂的效果,诱导8h时效果(1:128) 优于低蛋白乳清粉单独、IPTG-甘油作为诱导剂使用时的效果(1:64),是IPTG单独诱导时的4倍,表明菌体得率更高,可溶性蛋白的表达量高于IPTG-甘油的、IPTG单独诱导时的结果。同时,因为低蛋白乳清粉是来自工业生产奶酪制品的副产物,价格较为便宜(成本仅为IPTG的1/10左右),无毒无害,且诱导补料培养基中的蔗糖用量要少,进一步降低诱导补料培养基的生产成本。实施例5不同诱导剂所得的菌体湿重和目的蛋白琼扩效价对比将IPTG-甘油、低蛋白乳清粉、低蛋白乳清粉-蔗糖三种不同诱导剂分别按照实施例4.2实验进行制备并收取含IBDV重组抗原蛋白的菌体,通过离心测沉淀的方法测定菌体湿重,测定结果见表4。将收取含IBDV重组抗原蛋白的菌体经离心破碎后收集上清并进行检测,以中国兽医监察所的鸡传染性法氏囊标准阳性血清作为对照,用琼扩实验测定IBDVVP2蛋白的AGP效价(贺荣莲,鸡传染性法氏囊病快速诊断方法的研究。中国兽医杂志,1995,2(6):3-6),具体步骤详见傅先强主编的《养禽场禽病检验手册》(北京:中国农业大学出版社,1994.51-52)。表4相同条件下不同诱导剂的菌体湿重、琼扩效价AGP对比结果诱导补料培养基诱导条件菌体湿重IBDVVP2蛋白AGP效价IPTG-甘油28℃/8h40.3g/L1:64低蛋白乳清粉28℃/8h38.4g/L1:64低蛋白乳清粉-蔗糖28℃/8h60.7g/L1:128由表4可知:低蛋白乳清粉与IPTG-甘油诱导表达后的菌体湿重差距较小,IBDVVP2可溶性蛋白的AGP效果则一样。低蛋白乳清粉-蔗糖的诱导效果明显优于低蛋白乳清粉、IPTG-甘油的诱导效果,且IBDVVP2可溶性蛋白的AGP最高可达到1:128,同时菌体湿重明显增高,可达到60.7g/L,远远优于IPTG-甘油和低蛋白乳清粉的诱导表达效果。综上所述,本发明所用的蛋白乳清粉、蛋白乳清粉-蔗糖作为诱导剂诱导大肠杆菌表达,得到的大肠杆菌BL21(DE3)菌体得率高,菌体浓 度OD600可达到40-80,菌体湿重达到40-75g/L,获得的目的蛋白占菌体总蛋白的水平可高达10%-15%,优于ITPG的诱导水平;而且诱导后可溶性蛋白的表达量相当甚至高于IPTG或IPTG-甘油诱导后的表达效果;且蛋白乳清粉无毒无害,价廉易得,生产成本低,便于大规模生产。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1