蒿属植物奇蒿中单体去氢母菊内酯酮的提取方法及其应用与流程
本发明属于天然植物提取及应用技术领域,具体涉及蒿属植物奇蒿中单体奇蒿黄酮的提取及其在制备抑制无乳链球菌和金黄色葡萄球菌药物中的应用。
背景技术:
无乳链球菌(Streptococcus.agalactiae,SAG)又称为B族链球菌,是一种常见的革兰氏阳性球菌,常寄存于女性生殖道、直肠及呼吸道,为条件致病菌,在健康人群中带菌率高达15%~35%。在免疫力低下、抗菌药物广泛应用或院内感染时,SAG易引起泌尿生殖道感染(张卓然,倪语星.临床微生物和微生物检验[M].第3版.北京:人民卫生出版社,2003:86;赵明泽.无乳链球菌感染的临床特点及耐药性分析[J].浙江临床医学,2010,12(9):1019-1020.)、皮肤感染、心内膜炎、产后感染、新生儿败血症和新生儿脑膜炎等,是引起新生儿菌血症和脑膜炎的常见致病菌(吴健宁,林润华,林健,等.孕妇泌尿生殖道112例无乳链球菌感染的耐药性分析[J].医学研究杂志,2008,37(3):88-89.)。
在西方发达国家,SAG是新生儿感染最常见的致病菌,美国孕妇SAG定植率高达40%-50%,随着对SAG定植孕妇产时进行预防性抗生素治疗,美国新生儿SAG早发型败血症发病率发生明显降低(Newborn C O I D C O F A,CJ B,CL B,et al.Policy statement—Recommendations for the prevention of perinatal group B streptococcal(GBS)disease.[J].Pediatrics,2011,128(3):611-616.JR V.Prevention of Perinatal Group B Streptococcal Disease Revised Guidelines from CDC,2010[J].MMWR Recommendations&Reports,2010.)。我国对SAG感染的研究报道较少,国内有医院检验室曾检验出新生儿SAG感染的血培养呈阳性,由SAG感染引起的新生儿肺炎、上呼吸道感染数量较多(吴健宁,林润华,林健等.孕妇泌尿生殖道112例无乳链球菌感染的耐药性分析[J].医学研究杂志,2008,37(3):88-89)。随着临床医生和实验室工作员对SAG感染的重视,近年来我国新生儿SAG感染的病例报道呈逐渐上升趋势,引发新生儿早发型败血症位居首位的致病菌为SAG,占总感染细菌的26.15%,根据数据统计,2012年SAG感染病例明显增加 (戴怡蘅,曾立军,高平明.新生儿B族链球菌败血症16例临床分析[J].中国新生儿科杂志,2012,27(1):44-46.黄小艺,刘志伟.妇幼保健院新生儿早发型血流感染分析[J].中华医院感染学杂志,2012,22(11):2329-2332.)。因此,我国医务工作者应尽早对孕妇进行SAG定植检查,对高危发病人群进行预防干预,降低新生儿早发型SAG的发生。
SAG易感染围产期新生儿及产妇,对非孕妇成人也发生感染。相关报道表示SAG对免疫力低下的非孕妇成人引起感染的疾病主要有皮肤软组织感染、菌血症、肺炎、骨髓炎,还有其他少见病例如脑膜炎、链球菌中毒性休克综合征、感染性心内膜炎等(TH S,MM F,S P,et al.Increasing Burden of Invasive Group B Streptococcal Disease in Nonpregnant Adults,1990-2007[J].Clinical Infectious Diseases,2009,49(1):85-92.)。由无乳链球菌感染引起的心肌内膜炎死亡率高,该疾病单纯的采用抗生素治疗难以控制疾病的发展(SD P,AC M,DA M,et al.Infective endocarditis caused by Streptococcus agalactiae.[J].Int J Cardiol,1989,(2):179-183.)。SAG也是现在非孕妇成人化脓性关节炎的主要病原体,且由该菌引起的败血症关节炎死亡率最高(Nolla J M,G,Corbella X M P,et al.Group B streptococcus(Streptococcus agalactiae)pyogenic arthritis in nonpregnant adults.[J].Medicine,2003,82(2):119-128.)。我国无锡市人民医院SAG主要发生于老年人和患有基础疾病的患者,其引起的非孕妇成人感染主要有泌尿道感染、呼吸道感染、生殖道感染和皮肤软组织感染(王艳艳,任静,徐燕等.无乳链球菌在非孕妇成人患者中的临床分布特点与耐药性分析[J].中国医药科学,2013,(7):87-88.)。非孕妇成人感染SAG的病例在不断增加且病情严重,控制SAG的感染的发生迫在眉睫。
随着抗生素类药物的大量使用,SAG对多种抗生素药物产生了耐药性。相关数据报道,SAG对喹诺酮类、氨基苷类药物具有耐药性和大环内酯类具有高度耐药性(Spanish][I.[Streptococcus agalactiae highly resistant to fluoroquinolones].[J].EnfermedadesInfecciosas y MicrobiologíaClínica,2006,24(9):562-563.;M G,T L,G G,et al.High-Level Aminoglycoside Resistance In The Beta-Hemolytic Group G Streptococcus Isolate Bm2721[J].Antimicrob Agents Chemother.,1999,43(12)::3008–3010.),对四环素耐药率>90%,对红霉素、克林霉素及左氧氟沙星的耐 药率较高,并呈逐年上升趋势(高晶,刘晓艳.女性泌尿生殖道无乳链球菌的耐药性分析[J].检验医学,2015,(1).1673-8640.2015.01.004.);SAG对青霉素、氨苄西林、头孢曲松、头孢噻肟和万古霉素无耐药性,常选用青霉素作为治疗SAG感染的首选药物(伍婷婷,闵小春,王威.临床患者感染无乳链球菌分离株的耐药性分析[J].中华医院感染学杂志,2015,(1).2015-131516.)。青霉素药物严重的过敏反应局限了药物的使用,对青霉素过敏的患者可以采用红霉素或克林霉素进行预防和治疗,但其因具有较高的耐药性,因此对红霉素和克林霉素的使用受到了一定的限制。这对青霉素过敏者,治疗由SAG引起的感染提出了挑战。从植物中寻找高效、低毒的抗菌有效成分是现在抗生素药物发展重要方向,本研究基于奇蒿中药材的临床应用(荣远明,叶琦莉,何善明.用中药刘寄奴治疗急性细菌性痢疾34例[J].上海中医药杂志,1983,(1):21.邓存国.刘寄奴治疗早期乳痈效佳[J].中医杂志,2008,(9):820-821.),对奇蒿的抗菌有效成分(谭蔚峰,王靖,邢新.中药奇蒿提取物体外抗菌活性的实验研究[J].药学实践杂志,2010,28(2):101-104.)进行分离纯化,得到具有抗菌活性的去氢母菊内酯酮单体化合物。该化合物对无乳链球菌抗菌效果显著,为临床抗生素药物的研究开发和利用提供重要物质基础。本发明可指导中药材奇蒿药物资源的合理开发和应用。
中药奇蒿中含有丰富的化学成分,经天然产物化学研究报道(温晶,史海明,昝珂等.刘寄奴的化学成分研究[J].中草药,2010,41:870-873.)奇蒿中所含化合物类型主要为黄酮类,香豆素类及倍半萜内酯类等成分。其中,黄酮类化合物和香豆素类化合物均具有很好的抗菌药理活性(陈秋荣.黄酮类化合物药理作用的分析[J].中国实用医药,2012,07(21):254-255.郑玲,赵挺,孙立新.香豆素类化合物的药理活性和药代动力学研究进展[J].时珍国医国药,2013,24(3):714-717.),倍半萜类化合物也具有一定的抗菌活性。早期,我国药物研究者从黄花蒿中发现具有抗痢疾杆菌活性显著的倍半萜内酯类化合物青蒿素,为抗痢疾药物的研究取得了突破性进展。文献报道(文学.青蒿素抗菌作用研究[J].人参研究,2009,21(4):38-39)青蒿素对大肠杆菌和金黄色葡萄球菌也均有明显抗菌活性,其最低有效浓度分别为0.125mg/mL和0.25mg/mL;杨叶肖槿中倍半萜类化合物曼宋酮对芽孢杆菌具有一定的抑菌活性,其最低抑菌浓度为4.69ug/mL(Boonsri S,Karalai C,Ponglimanont C,et al.Cytotoxic and Antibacterial Sesquiterpenes from Thespesiapopulnea[J].J.Nat.Prod.,2008,71(7):1173-1177.)。目前,奇蒿中倍半萜类化合物抗菌活性仍未经报道,故本报道采用临床常见致病菌检测奇蒿中倍半萜内酯类化合物去氢母菊内酯酮的抗菌药理活性。
单体去氢母菊内酯酮是蒿属植物奇蒿中重要的倍半萜类化学成分,目前仅于艾科蒿属植物银叶艾蒿和阴地蒿中有此成分的报道;
前期,国外学者Seung-Ho Lee对中药阴地蒿进行分离纯化,得到倍半萜类化合物去氢母菊内酯酮(de-hydromatricarin),该倍半萜类化合物主要存在蒿属植物中,是蒿属植物鉴别的重要参考依据。
去氢母菊内酯酮为倍半萜类化合物,其药理活性研究报道较少。目前仅有学者Seung-Ho Lee研究了该化合物的抗癌活性,学者Seung-Ho Lee从蒿属植物中分离得到去氢母菊内酯酮,并对其进行了重组鼠FPTase(法尼基转移酶)抑制试验。试验结果显示去氢母菊内酯酮对重组鼠FPTase(法尼基转移酶)具有轻度的抑制作用,其IC50为300μM,具有一定的抗癌活性。
国外学者Seung-Ho Lee取阴地蒿干燥花1kg,采用甲醇2L提取2次,浓缩提取液得阴地蒿甲醇提取物,提取物经硅胶柱层析,甲醇-氯仿系统梯度洗脱得到各组流分,对各流分进行FPTase(法尼基转移酶)活性抑制试验得到活性流分,该活性组分由甲醇-氯仿系统为9:1-8:2洗脱得到,对该活性流分采用C18反相硅胶柱色谱,甲醇-水梯度洗脱得到70%甲醇洗脱的流分和80%甲醇洗脱的流分,对该2组流分进行Sephadex LH-20凝胶柱色谱分离,甲醇洗脱,然后对所得流分进行反相高效制备色谱分离,得到去氢母菊内酯酮单体化合物。(Lee S,Kang H,Song H,et al.Sesquiterpene Lactones,Inhibitors of Farnesyl Protein Transferase,Isolated from the Flower of Artemisia sylvatica[J].Tetrahedron,2000,56(27):4711–4715.)
以上去氢母菊内酯酮提取工艺中采用柱色谱法直接分离粗提物,分离化合物的极性区间大,分离具有盲目性,工作量大,得到目标化合物耗时长。且采用活性追踪法确定分离目标化合物,过程复杂繁琐,给提取工艺带来了不便。
技术实现要素:
本发明的目的在于提供一种蒿属植物奇蒿中单体去氢母菊内酯酮的提取方法及其在制备抑制无乳链球菌药物中的应用。
蒿属植物奇蒿中单体去氢母菊内酯酮的提取方法,按照下述步骤进行:
A、制备总粗提物
将中药奇蒿(南刘寄奴HerbaArtemisiaeAnomalae)粉碎,取奇蒿粉末30kg,加入提取溶剂70%乙醇水(乙醇和水的体积比为7:3)300L,加热70℃回流提取2h,提取2次,将提取液减压浓缩,得粗提取物5.3kg。
B、分离纯化
将5.3kg粗提取物加水10L溶解,使其混悬,得提取物混悬液,加入石油醚萃取三次(提取物混悬液与每次加入萃取的石油醚体积比为1:2),弃去三次石油醚萃取液,得到经石油醚萃取后的提取物混悬液;再向经石油醚萃取后的提取物混悬液中加入氯仿萃取三次(经石油醚萃取后的提取物混悬液与每次加入萃取的氯仿体积比为1:2),合并三次萃取液,减压回收溶剂得氯仿部位浸膏1.5kg。将氯仿部位浸膏上硅胶色谱柱(氯仿部位浸膏1.5kg,加入1.5kg硅胶干法拌样上柱,装柱硅胶7kg,以石油醚-二氯甲烷-甲醇-甲酸系统6:2:1:0.1的混合溶液溶解硅胶装柱),用石油醚-二氯甲烷-甲醇-甲酸系统以6:2:1:0.1约60L和4:2:1:0.1约20L进行梯度洗脱,流速为3滴/秒,接样体积1L,各流分采用薄层色谱点样法点样,在石油醚-二氯甲烷-甲醇-甲酸为4:2:1:0.1的展开剂系统中,Rf为0.5各流分合并,减压回收溶剂得到流分Fr1。
流分Fr1用反相高效液相制备,制备条件为色谱柱Kromasil C18(250mm×21.2mm i.d.;5μm);流动相比例为乙腈:0.2%甲酸水=28:72,流速20ml/min,柱温25℃,检测波长250nm,根据检测器谱图上显示的出峰位置,时间段在28.5min到29.5min内接收流分“Ⅰ”,得到单体去氢母菊内酯酮。
采用高效液相色谱法对所得流分进行纯度检测,测得流份“Ⅰ”为单一色谱峰,纯度高于99%,挥干溶剂后对流分“Ⅰ”进行MS、1HNMR和13CNMR分析,根据所得数据进行结构确认,流分“Ⅰ”为去氢母菊内酯酮。
去氢母菊内酯酮结构式如下式Ⅰ:
该化合物为白色粉末,ESI-MS m/z:345.1487[M+HCOO]—,结合1H-NMR和13C-NMR谱图数据确定分子式为C17H18O5。1H-NMR(CDCl3,600MHz)δ:6.19(1H,t,J=1.2HZ,H-3),3.49(1H,d,J=10.2HZ,H-5),3.70(1H,t,J=10.2HZ,H-6),3.25(1H,dt,J=3.6,10.2HZ,H-7),4.91(1H,dt,J=1.8,12.6HZ,H-8),2.71,2.46(IH,dd,J=2.4,13.8HZ,H-9),6.23,5.64(2H,d,J=3HZ,H-13),2.33(3H,s,H-14),2.44(3H,s,H-15),2.15(3H,s,H-17);13C-NMR(CDCl3,600MHz)δ:133.5(C-1),194.8(C-2),135.9(C-3),169.1(C-4),51.5(C-5),81.3(C-6),54.9(C-7),69.2(C-8),44.3(C-9),144.5(C-10),135.9(C-11),169.2(C-12),121.7(C-13),19.7(C-14),21.2(C-15),169.5(C-16),20.9(C-17);根据二维核磁谱图HMBC表示,C10与H15相关,C16与H17相关,C4与H14相关,由COSY谱图显示,H5与H6相关,H6与H7相关,H7与H8相关,NOESY谱图中H7与H5和H9远程相关,通过以上信息得到化合物Ⅰ结构,该结构数据与文献报道的去氢母菊内酯酮(dehydromatricarin)基本一致,故鉴定该化合物结构为(去氢母菊内酯酮)。(Lee S,Kang H,Song H,et al.Sesquiterpene Lactones,Inhibitors of Farnesyl Protein Transferase,Isolated from the Flower of Artemisia sylvatica[J].Tetrahedron,2000,56(27):4711–4715.)
本发明还进一步发现了通过上述方法制备的单体去氢母菊内酯酮,经抑菌试验结果显示其对无乳链球菌效果更佳,比现行抗无乳链球菌感染的首选药青霉素的效果更佳,对其他临床常见致病菌也具有一定抗菌活性。
上述制备方法所得的单体去氢母菊内酯酮在制备抑制无乳链球菌药物中的应用。
有益效果:
企业大规模制备化合物时,首先对中药材进行粉碎提取制备粗体物,然后采用不同溶剂萃取粗体物得到各极性部位,通过TLC薄层层析法确定目标化合物所在的极性部位,再对该极性部位进一步分离纯化。对柱层析法得到各流份采用TLC薄层层析法确定目标化合物,该确定目标化合物的方法较活性追踪法操作简单、快捷、易行。
上述制备所得的单体化合物去氢母菊内酯酮具有抗菌活性,对革兰氏阳性球菌活性明显,对革兰氏阴性杆菌活性较弱,经体外抗菌实验显示去氢母菊内酯酮对无乳链球菌(CICC10465)的抑菌浓度是0.1mg/mL,杀菌浓度是0.3mg/mL;对金黄色葡萄球菌(CMCC26003)的抑菌浓度是0.3mg/mL,杀菌浓度为1mg/mL,对金黄色葡萄球菌(ATCC6538)的抑菌浓度均为0.1mg/mL,杀菌浓度为1mg/mL;对革兰氏阴性杆菌大肠杆菌(CMCC44102)的抑菌浓度为1mg/mL,杀菌浓度为3mg/mL;对痢疾志贺菌(CMCC(B)51252)的抑菌浓度为0.1mg/mL,杀菌浓度为3mg/mL,其抑菌效果图见图9-13。
附图说明
图1去氢母菊内酯酮负离子模式扫描的MS图谱,去氢母菊内酯酮的加甲酸根负离子检测峰为[M+HCOO]—=345.1487m/z
图2实施例1正相柱分离流分Fr3中去氢母菊内酯酮的高效液相色谱图。
图3实施例1中流分Fr3经凝胶柱分离后得到流分A中去氢母菊内酯酮的高效液相色谱图。
图4实施例1中流分A中去氢母菊内酯酮在反相高效液相制备色谱中检测器的位置示意图。
图5实施例1中流分“Ⅰ”(去氢母菊内酯酮)纯度检测的高效液相色谱图。
图6实施例2中正相柱流分Fr3中去氢母菊内酯酮的高效液相色谱图。
图7实施例2中流分Fr3中去氢母菊内酯酮在反相高效液相制备色谱中检测器的位置示意图。
图8实施例2中流分“Ⅰ”(去氢母菊内酯酮)纯度检测的高效液相色谱图色谱图。
图9去氢母菊内酯酮对无乳链球菌的抗菌效果图
图10去氢母菊内酯酮对金黄色葡萄球菌(CMCC26003)的抗菌效果图
图11去氢母菊内酯酮对金黄色葡萄球菌(ATCC6538)的抗菌效果图
图12去氢母菊内酯酮对痢疾志贺菌的抗菌效果图
图13去氢母菊内酯酮对大肠杆菌的抗菌效果图
图14青霉素G对无乳链球菌的抗菌效果图
具体实施方式
下面结合实施例对本发明作进一步详细说明,但不以任何方式限制本发明。
实施例1
蒿属植物中单体奇蒿黄酮的提取方法,按照下述步骤进行:
A、制备总粗提物
将南刘寄奴HerbaArtemisiaeAnomalae干药材30kg粉碎,用300L的70%乙醇水(乙醇和水的体积比为7:3)加热至70℃回流提取2次,合并提取液,减压回收溶剂,得粗提物5.3kg。
B、分离纯化
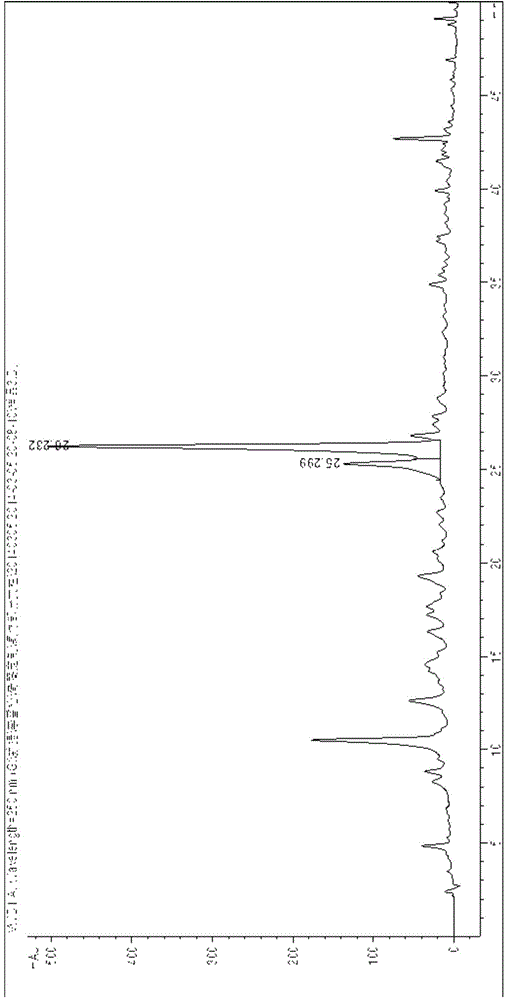
将5.3kg粗提取物加水10L溶解,使其混悬,得提取物混悬液,加入石油醚萃取三次(提取物混悬液与每次加入萃取的石油醚体积比为1:2),合并三次萃取液,减压回收溶剂得石油醚部位浸膏,弃去三次石油醚部位浸膏,得到经石油醚萃取后的提取物混悬液;再向经石油醚萃取后的提取物混悬液中加入氯仿萃取三次(经石油醚萃取后的提取物混悬液与每次加入萃取的氯仿体积为1:2),合并三次萃取液,减压回收溶剂得氯仿部位浸膏;将氯仿部位浸膏上硅胶柱色谱(氯仿部位浸膏1.5kg,加入1.5kg硅胶干法拌样上柱,装柱硅胶7kg,以石油醚-二氯甲烷-甲醇-甲酸系统8:2:1:0.1的溶液溶解硅胶装柱。),用石油醚-二氯甲烷-甲醇-甲酸系统以8:2:1:0.1、6:2:1:0.1、4:2:1:0.1、2:2:1:0.1、1:1:1:0.1进行梯度洗脱,每个梯度约60L,流速为3滴/秒,各流分接样体积1L,通过薄层层析法对各流分进行点样,合并相同极性的流分,按极性差别从小到大共得到7个部分洗脱液Fr1-Fr7,其中Fr3部分为6:2:1:0.1和4:2:1:0.1洗脱部分,该部分在极性为4:2:1:0.1的石油醚-二氯甲烷-甲醇-甲酸展开剂系统中Rf值为0.5。Fr3经HPLC检测,出峰时间t=26.232为目标化合物峰。Fr3的HPLC谱图见2。
流分Fr3用Sephadex G-20凝胶柱色谱分离,用氯仿-甲醇1:1溶液2L等度 洗脱,流速为6秒/滴,接样体积约接50mL,合并相同极性流份,得组分Fr3a-Fr3q,各流分经HPLC检测,出峰时间26.232min为目标化合物去氢母菊内酯酮的峰,合并含有目标峰的样品流分Fr3h-Fr3n得流分A。流分A的HPLC检测谱图见图3,保留时间为25.228min为目标化合物峰。
以上制备过程中HPLC法色谱条件为色谱柱Kromasil C18(250mm×4.6mm i.d.;5μm);流动相比例为乙腈(A):0.2%甲酸水(B);梯度洗脱,0~20min,35%~50%A,20min~30min,50%~60%A,30min~45min,60%~95%A,流速1ml/min,柱温30℃,检测波长250nm。
流分A用反相高效液相制备,制备条件为色谱柱Kromasil C18(250mm×21.2mm i.d.;5μm);流动相比例为乙腈:0.2%甲酸水=28:72,流速20ml/min,柱温25℃,检测波长250nm,根据检测器谱图上显示,时间段在28.5min到29.5min内接收流分“Ⅰ”,如下图4(出峰时间t=29min处为去氢母菊内酯酮的吸收峰)。
采用高效液相色谱法对所得流分进行纯度检测,测得流份“Ⅰ”为单一色谱峰,纯度高于99%,挥干溶剂后对流分“Ⅰ”进行MS、1HNMR和13CNMR分析,根据所得数据进行结构确认,流分“Ⅰ”为去氢母菊内酯酮。去氢母菊内酯酮的MS谱图见图1,流分“Ⅰ”的HPLC检测谱图见图5(出峰时间t=8.696min处为去氢母菊内酯酮的吸收峰)。
去氢母菊内酯酮的结构式Ⅰ如下:
该化合物为白色粉末,ESI-MS m/z:345.1487[M+HCOO]—,结合1H-NMR和13C-NMR谱图数据确定分子式为C17H18O5。1H-NMR(CDCl3,600MHz)δ:6.19(1H,t,J=1.2HZ,H-3),3.49(1H,d,J=10.2HZ,H-5),3.70(1H,t,J=10.2HZ,H-6), 3.25(1H,dt,J=3.6,10.2HZ,H-7),4.91(1H,dt,J=1.8,12.6HZ,H-8),2.71,2.46(IH,dd,J=2.4,13.8HZ,H-9),6.23,5.64(2H,d,J=3HZ,H-13),2.33(3H,s,H-14),2.44(3H,s,H-15),2.15(3H,s,H-17);13C-NMR(CDCl3,600MHz)δ:133.5(C-1),194.8(C-2),135.9(C-3),169.1(C-4),51.5(C-5),81.3(C-6),54.9(C-7),69.2(C-8),44.3(C-9),144.5(C-10),135.9(C-11),169.2(C-12),121.7(C-13),19.7(C-14),21.2(C-15),169.5(C-16),20.9(C-17);根据二维核磁谱图HMBC表示,C10与H15相关,C16与H17相关,C4与H14相关,由COSY谱图显示,H5与H6相关,H6与H7相关,H7与H8相关,NOESY谱图中H7与H5和H9远程相关,通过以上信息得到化合物Ⅰ结构,该结构数据与文献[13]报道的去氢母菊内酯酮(dehydromatricarin)基本一致,故鉴定该化合物结构为(去氢母菊内酯酮)。(Lee S,Kang H,Song H,et al.Sesquiterpene Lactones,Inhibitors of Farnesyl Protein Transferase,Isolated from the Flower of Artemisia sylvatica[J].Tetrahedron,2000,56(27):4711–4715.)
实施例2
A、制备总粗提物
取奇蒿(南刘寄奴HerbaArtemisiaeAnomalae)干药材30kg粉碎,用300L的70%乙醇水(乙醇和水的体积比为7:3)加热至70℃回流提取2次,合并提取液,减压回收溶剂,得粗提物5.3kg。
B、分离纯化
将5.3kg粗提取物加水10L溶解,使其混悬,得提取物混悬液,加入石油醚萃取三次(提取物混悬液与每次加入萃取的石油醚体积比为1:2),合并三次萃取液,减压回收溶剂得石油醚部位浸膏,弃去三次石油醚部位浸膏,得到经石油醚萃取后的提取物混悬液;再向经石油醚萃取后的提取物混悬液中加入氯仿萃取三次(经石油醚萃取后的提取物混悬液与每次加入萃取的氯仿体积为1:2),合并三次萃取液,减压回收溶剂得氯仿部位浸膏;将氯仿部位浸膏上硅胶柱色谱(氯仿部位浸膏1.5kg,加入1.5kg硅胶干法拌样上柱,装柱硅胶7kg,以石油醚-二氯甲烷-甲醇-甲酸系统8:2:1:0.1的溶液溶解硅胶装柱。),用石油醚-二氯甲烷-甲醇-甲酸系统以8:2:1:0.1、6:2:1:0.1、4:2:1:0.1、2:2:1:0.1、1:1:1:0.1进行梯度洗脱,每个梯度约60L,流速为3滴/秒,各流分接样体积1L,通过薄层层析法对各流分进行点样,合并相同极性的流分,按极性差别从小到大共得到7个部分洗脱液 Fr1-Fr7,其中Fr3部分为6:2:1:0.1和4:2:1:0.1洗脱部分,该部分在极性为4:2:1:0.1的石油醚-二氯甲烷-甲醇-甲酸展开剂系统中Rf值为0.5。Fr3经HPLC检测,色谱条件为色谱柱Kromasil C18(250mm×4.6mm i.d.;5μm),流动相比例为乙腈:0.2%甲酸水=43:57,流速1ml/min,柱温30℃,检测波长250nm,出峰时间t=24.333为目标化合物峰。Fr3的HPLC谱图见6。
流分Fr3用反相高效液相制备,制备条件为色谱柱Kromasil C18(250mm×21.2mm i.d.;5μm);流动相比例为乙腈:0.2%甲酸水=28:72,流速20ml/min,柱温25℃,检测波长250nm,根据检测器谱图上显示,时间段在28.5min到29.5min内接收流分“Ⅰ”,如下图7(出峰时间t=29min处去氢母菊内酯酮的吸收峰)。
采用高效液相色谱法对所得流分进行纯度检测,测得流份“Ⅰ”为单一色谱峰,纯度高于99%,挥干溶剂后对流分“Ⅰ”进行MS、1HNMR和13CNMR分析,根据所得数据进行结构确认,流分“Ⅰ”为去氢母菊内酯酮。流分“Ⅰ”为去氢母菊内酯酮纯度检测HPLC谱图见图8,去氢母菊内酯酮的MS谱图见图1。
去氢母菊内酯酮的结构式Ⅰ如下:
该化合物为白色粉末,ESI-MS m/z:345.1487[M+HCOO]—,结合1H-NMR和13C-NMR谱图数据确定分子式为C17H18O5。1H-NMR(CDCl3,600MHz)δ:6.19(1H,t,J=1.2HZ,H-3),3.49(1H,d,J=10.2HZ,H-5),3.70(1H,t,J=10.2HZ,H-6),3.25(1H,dt,J=3.6,10.2HZ,H-7),4.91(1H,dt,J=1.8,12.6HZ,H-8),2.71,2.46(IH,dd,J=2.4,13.8HZ,H-9),6.23,5.64(2H,d,J=3HZ,H-13),2.33(3H,s,H-14),2.44(3H,s,H-15),2.15(3H,s,H-17);13C-NMR(CDCl3,600MHz)δ:133.5(C-1),194.8 (C-2),135.9(C-3),169.1(C-4),51.5(C-5),81.3(C-6),54.9(C-7),69.2(C-8),44.3(C-9),144.5(C-10),135.9(C-11),169.2(C-12),121.7(C-13),19.7(C-14),21.2(C-15),169.5(C-16),20.9(C-17);根据二维核磁谱图HMBC表示,C10与H15相关,C16与H17相关,C4与H14相关,由COSY谱图显示,H5与H6相关,H6与H7相关,H7与H8相关,NOESY谱图中H7与H5和H9远程相关,通过以上信息得到化合物Ⅰ结构,该结构数据与文献[13]报道的去氢母菊内酯酮(dehydromatricarin)基本一致,故鉴定该化合物结构为(去氢母菊内酯酮)。(Lee S,Kang H,Song H,et al.Sesquiterpene Lactones,Inhibitors of Farnesyl Protein Transferase,Isolated from the Flower of Artemisia sylvatica[J].Tetrahedron,2000,56(27):4711–4715.)
实施例3
去氢母菊内酯酮的体外实验
一、主要试验材料
菌种:金黄色葡萄球菌(CMCC26003)、大肠杆菌(CMCC44102)购自北京北纳创联生物技术研究院;金黄色葡萄球菌(ATCC6538)、痢疾志贺菌[CMCC(B)51252]和无乳链球菌(CICC10465)购自南京便诊生物科技有限公司。
主要试剂:青霉素G钠盐无水购自上海生工生物工程有限公司;改良肉汤培养基和血琼脂培养基购自青岛海博生物技术有限公司;96孔板和培养皿购自广州洁特生物过滤制品有限公司。
主要仪器:LDZX-50KB立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-ID型单人净化工作台,苏州净化;ELX800酶标仪,基因有限公司;HZQ-X100恒温振荡培养箱,华美生化仪器;DHP-022电热恒温培养箱,上海申贤恒温设备厂。
二、去氢母菊内酯酮的抗菌实验
药物配制:待筛样品去氢母菊内酯酮以10mg/ml溶解于体积分数50%的乙醇溶剂中,阳性药(青霉素G钠盐)以100mg/ml溶解于蒸馏水中。
菌种活化和培养:
a.称取18g改良肉汤培养基于300ml蒸馏水中,于121℃灭菌20min。无菌条件下,分装至15ml的离心管中,每管10ml。
b.取1ml培养基至菌种冻干粉中,吹打混匀后转移到15ml离心管,于37℃,150rpm培养24h。
c.取100ul菌悬液涂布于血琼脂培养基表面,于37℃电热恒温培养箱培养24h。挑取单克隆于肉汤培养基中培养24h。
3.MBC和MIC测定:
a.取培养24h后的细菌种96孔板,每孔100ul;设置不加药孔,加药孔和阳性对照药孔。加药浓度从3mg/ml起,用培养基3倍梯度稀释,共6个梯度。阳性对照药孔从10mg/ml起,3倍梯度稀释,共6个梯度。
b.酶标板490nm测定OD值:加完药测定0h,2h,4h,8h和24h共6个时间点,计算MIC。
c.取酶标板中有抑菌效果的菌液,均匀涂抹于平板培养基上,生化培养箱中继续培养24小时,无菌落形成的最小浓度即为MBC.
三、试验结果及分析
该研究选用青霉素为阳性对照药,分别考察了去氢母菊内酯酮对大肠杆菌、金黄色葡萄球菌、痢疾志贺菌以及无乳链球菌的抗菌活性。结果显示去氢母菊内酯酮对无乳链球菌(CICC10465)的抑菌浓度是0.1mg/mL,杀菌浓度是0.3mg/mL;对金黄色葡萄球菌(CMCC26003)的抑菌浓度是0.3mg/mL,杀菌浓度为1mg/mL,对金黄色葡萄球菌(ATCC6538)的抑菌浓度均为0.1mg/mL,杀菌浓度为1mg/mL;对革兰氏阴性杆菌大肠杆菌(CMCC44102)的抑菌浓度为1mg/mL,杀菌浓度为3mg/mL;对痢疾志贺菌(CMCC(B)51252)的抑菌浓度为0.1mg/mL,杀菌浓度为3mg/mL。青霉素对无乳链球菌(CICC10465)的抑菌浓度是3mg/mL,杀菌浓度是3mg/mL。去氢母菊内酯酮对各临床致病菌活性效果图见图9-13,青霉素对无乳链球菌抗菌效果图见图14。
以上活性数据表示,去氢母菊内酯酮对检测各临床致病菌的抑菌活性强弱顺序为:无乳链球菌(CICC10465)=痢疾志贺菌(CMCC(B)51252)=金黄色葡萄球菌(ATCC6538)>金黄色葡萄球菌(CMCC26003)>大肠杆菌(CMCC44102);去氢母菊内酯酮对检测各临床致病菌的杀菌活性强弱顺序为:无乳链球菌(CICC10465)>金黄色葡萄球菌(ATCC6538)=金黄色葡萄球菌(CMCC26003)>痢疾志贺菌(CMCC(B)51252)=大肠杆菌(CMCC44102),综合以上活性数据顺 序,可以发现去氢母菊内酯酮对各检测致病菌的抗菌活性强弱顺序为:无乳链球菌(CICC10465)>金黄色葡萄球菌(ATCC6538)>痢疾志贺菌(CMCC(B)51252)>金黄色葡萄球菌(CMCC26003)>大肠杆菌(CMCC44102),表示去氢母菊内酯酮对无乳链球菌的抗菌作用效果最显著,以上抗菌效果图见图9-13。
根据实例3方案对单体去氢母菊内酯酮进行的体外抗菌实验,活性数据显示去氢母菊内酯酮对无乳链球菌(CICC10465)的抑菌浓度是0.1mg/mL,其阳性对照药青霉素对无乳链球菌(CICC10465)的抑菌浓度是3mg/mL,去氢母菊内酯酮对无乳链球菌(CICC10465)的抑菌活性是青霉素的30倍;去氢母菊内酯酮对无乳链球菌(CICC10465)的杀菌浓度是0.3mg/mL,青霉素对无乳链球菌(CICC10465)的杀菌浓度是3mg/mL,即去氢母菊内酯酮对无乳链球菌(CICC10465)的杀菌活性是青霉素的10倍。以上对比数据表明去氢母菊内酯酮抗无乳链球菌活性显著,能有效的抑制和杀死无乳链球菌,且抗菌活性明显高于阳性药青霉素,青霉素抗菌效果图见14。
我国对SAG感染的重视和防治研究较晚,且长期大量不规范使用抗生素药物,导致SAG对多种抗生素药物产生了耐药性。目前,SAG对青霉素的耐药性较小,从天然产物中寻找抗生素替代药物以免其对现行抗生素药物产生耐药性,对SAG耐药性的控制具有重要意义。本发明发现去氢母菊内酯酮对SAG的抗菌活性显著,且较现行首选抗SAG感染药物青霉素的抗菌活性强10倍以上,具有替代青霉素治疗SAG感染的潜力,对研究开发有效的抗SAG感染药物提供有效物质资源。去氢母菊内酯酮对金黄色葡萄球菌也表现出明显的抗菌活性,并对革兰氏阴性杆菌痢疾志贺菌和大肠杆菌具有一定的抗菌作用,因此,去氢母菊内酯酮可研究开发为广谱抗菌药物。本发明考察了去氢母菊内酯酮的体外抗菌活性,为进一步研究该化合物的体内药动学和生物利用度提供科学依据。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等同物界定。
- 还没有人留言评论。精彩留言会获得点赞!