一种应用于定量蛋白质组学研究的稳定同位素标记肽段合成及定量新方法与流程
本发明涉及一种应用于蛋白质的多反应监测的稳定同位素标记肽段合成及定量方法,该方法可应用于各种需要对蛋白质进行质谱定量检测的领域。
背景技术:
MRM技术是一种基于已知或假定的反应离子信息,有针对性地选择数据进行质谱信号采集,对符合规则的离子进行信号记录,去除不符合规则离子信号的干扰,通过对数据的统计分析从而获取质谱定量信息的质谱技术。随着基因组学和蛋白质组学的发展,MRM开始应用于蛋白质的定量。通过对已知蛋白的代表性的肽段进行母子离子的选择,在待分析物中加入已知量的同位素标记内标肽段并结合其标准曲线,从而实现对某个或某些目标蛋白的绝对定量。由此可见,在利用MRM质谱技术进行目标蛋白的绝对定量实验中,精确定量的稳定同位素标记的内标肽段是获得可靠的绝对定量结果的关键所在。
目前制备质谱用标准肽段的方法主要有化学合成法和QconCAT法。化学合成稳定同位素标记内标肽段的方法是利用氨基酸之间肽键的形成,按照给定肽段一级序列,依次将氨基酸添加上去。但是并不是所有的肽段都可以合成,在一定程度上依赖于肽段的氨基酸序列。重要的是,对化学方法合成肽段的定量多采用干粉称量的方法,带来的误差较大。而且由于肽段复溶往往存在问题,即不能判断给定的肽段干粉中有多少是完全溶解的,引入的误差更大,从而导致绝对定量数据的不准确。
QconCAT法是将多个编码肽段的DNA序列串联克隆到合适的表达载体上并进行重组表达和纯化。将重组表达菌株在含有稳定同位素标记氨基酸的培养基中进行培养就可获得带有同位素标记的QconCAT蛋白。然后对所得的QconCAT蛋白通过BSA标准品进行Bradford法蛋白的定量。测定时将已知量的QconCAT蛋白 按照合适的比例加入到待分析物中进行共酶解。通过标记肽段与待分析物中非标记肽段之间质谱响应的关系,结合标记肽段的定量曲线,从而实现对待分析物的绝对定量。QconCAT方法也存在表达成功率和可溶性问题。但更重要的是,QconCAT蛋白自身的定量会因其纯度而产生不确定的误差,多个肽段之间等摩尔比实现困难,进而影响对待分析物的绝对定量。
综上所述,目前制备蛋白质MRM定量的标准肽段的方法还不能满足对蛋白的绝对定量的要求,有必要开发更好的方法。
技术实现要素:
本发明的目的是提供一种快速制备定量更加准确的稳定同位素标记内标肽段的方法。
解决技术问题所采用的技术手段
本发明将目标肽段与strep-tag串联,通过体外无细胞表达系统进行合成并在完全酶解后,目标肽段和与之串联的strep-tag之间的摩尔比是1:1,所以对strep-tag的定量就是对目标肽段的定量。strep-tag因其独特的摩尔消光系数,故可用分光光度计测得strep-tag纯品的精确浓度。用已知浓度strep-tag的标准品绘制质谱峰定量标准曲线;在肽段得到合成及定量的过程中,此strep-tag是一个通用的标签,适用于任何需要合成的内标肽段,并且可用于肽段的亲和富集。
具体步骤分述如下:
1)串联肽段的设计及其DNA序列的准备
MRM的目标肽段一般满足以下基本要求A:分子量唯一;B:羧基端有Trypsin酶切位点(赖氨酸K或者精氨酸R)。我们将目标肽段与strep-tag串联,前端添加翻译起始氨基酸以及能促进酶切效率的序列MGAGR,后端添加三个氨基酸GGD,其既起到保护作用确保肽段合成的完整性又提高合成肽段的溶解性、其本身又能被完全酶解下来。因此设计的串联肽段结构如下:MGAGR-目标肽段序列-WSHPQFEK-GGD。
根据串联肽段的氨基酸序列利用辅助的DNA设计软件,选择大肠杆菌偏好性较高的密码子获得对应的DNA编码序列。并在两端加入T7启动子、终止子等一系列转录翻译所必需的原件,从而保证了此DNA能在无细胞合成体系中被 正确识别。典型的DNACassette见图1。然后,利用常规商业合成的DNA片段结合设计的5’和3’端通用引物进行PCR扩增,获得用于肽段合成的DNA。
2)串联肽段的体外合成
将DNA模板加入到无细胞蛋白表达体系中,加入适量的20种氨基酸混合物(包含稳定同位素标记的赖氨酸和精氨酸),进行串联肽段的体外合成。
3)串联肽段的富集
由无细胞反应体系得到的串联肽段中因为包含strep-tag,故可用对该strep-tag标签亲和的柱料对串联肽段进行富集,从而去除大部分合成系统里的背景蛋白。
4)富集后串联肽段的酶解
富集后的肽段经过还原烷基化、酶解后,真空冷冻抽干为干粉待用,此干粉即为用于绝对定量实验的稳定同位素标记肽段。
5)合成肽段的定量
用分光光度计结合摩尔消光系数测得strep-tag纯品的精确浓度,稀释后用于绘制strep-tag标准品量与质谱峰面积的标准曲线,结合此标准曲线则可对利用无细胞表达体系得到的strep-tag进行定量。由于strep-tag与目的肽段之间酶切后的比例关系,从而可得知合成的稳定同位素标记肽段的精确量。
本发明的优点及有益效果
1)本发明引入strep-tag,通过对strep-tag的定量而实现对目标肽段的定量,不依赖合成肽段的纯度,定量更为准确。
2)利用此发明进行稳定同位素标记肽段的合成,从肽段模板DNA的准备到肽段的合成富集以及定量,均是在体外完成,从DNA到肽段的产出一步实现,极大缩短了肽段合成的时间。
3)此发明的方法对于肽段的物化性质没有选择性,能够很好的适用于任何肽段的合成。因为此方法合成肽段是一个生物学的过程,且反应体系中的成分只识别核酸序列,而不对翻译得到的肽段序列进行任何的修饰。系统中的酶、辅因子以及缓冲环境决定了反应过程相较于大肠杆菌内源的表达(如QconCAT)更受控制。
4)利用此发明的方法,可以快速合成很多不同的标记肽段,尤其适合多靶标定量的蛋白质组学研究。
附图说明
图1:用于体外合成的DNA模板必备原件示意图,其中包含了T7启动子、核糖体结合位点、起始和终止密码子,以及融合肽段编码序列。
图2:PCR反应程序以及回收产物凝胶电泳(2%琼脂糖凝胶)。对于要合成的肽段,采用2次PCR反应的方式,首先将数据库计算出的两条序列经过短时间的反应,得到一段包含目的肽段的DNA,再将通用引物加入体系中进行第二次的退火延伸,得到包含所有必备元件的DNA模板。
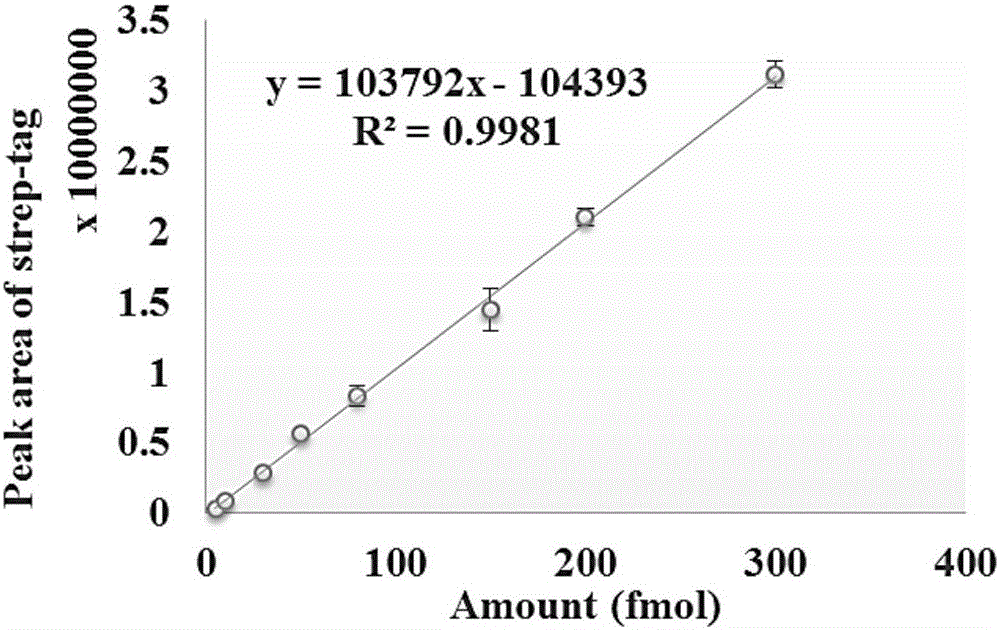
图3:Strep-tag标准品与MRM-MS质谱峰面积的标准曲线。
图4:利用无细胞肽段合成系统合成的稳定同位素标记strep-tag与A3-pep1肽段MRM-MS结果。内插图分别显示为两个肽段在特定时间点的母子离子对的检测强度。
图5:合成的标记肽段与样品中的未标记肽段的提取离子色谱图,两个不同标记形态的肽段在色谱上的保留时间呈现出一致性。
图6:合成的标记肽段与样品中未标记肽段的MRM-MS图。序列相同的两个肽段,由于同位素标记的使用,子离子在质谱中呈现出10Da差异(y3和y2离子)。
具体实施方式
下面结合图表和具体实施的方式对本发明做进一步阐述,以使本领域技术人员可以更清楚地得知本发明的技术方案,并非对本发明的限制。
实施例一串联肽段的合成
利用DNA序列的计算软件,得到编码A3-pep1(AILNYIASK)的DNA片段,temp-1:5’-ATACCAATGGGTGCGGGTCGTGCGATTCTGAACTATAT,temp-2:5’-CTGCGGATGGCTCCATTTGCTCGCAATATAGTTCAGAA。结合设计好的5’端
(5’-GAAATTAATACGACTCACTATAGGGTAACTTTAAGAAGGAGATATAC CAATGGGTGCGGGTCGT)和3’(5’-TATTCATTAATCGCCACCTTTTTCAAACTGCGGATGGCTCCA)端通用引物,对上述DNA片段进行聚合酶链式反应(PCR)扩增并纯化得到大量的模板。PCR的反应程序以及对纯化后的模板DNA进行琼脂糖凝胶电泳验证,结果如图2所示。
将400ng纯化后的模板DNA加入无细胞合成反应体系中,体系成分如表1所示,用DEPC处理后的灭菌水将反应体积补足到30μL,混匀后置于37℃孵育6小时,将反应管放置于冰上可终止合成反应。
表1:无细胞合成体系成分
*Solution A、Solution B、tRNA从New England Biolabs(Δ(aa,tRNA)Kit,E6840S)购买。
*Amino acid mixture按照表2配制,其中包含稳定同位素标记的赖氨酸(Lys 15N2,13C6)和精氨酸(Arg 15N4,13C6)。除稳定同位素标记的18种氨基酸,各取30μL储液,带同位素标记的赖氨酸和精氨酸各取120μL储液,混合后加入220μL经过DEPC处理过的H2O,得到共1mL工作液,工作液中未标记的氨基酸浓度为3mM,标记的赖氨酸和精氨酸浓度为12mM,混匀后存于﹣20℃。
表2:20种必需氨基酸混合液储液配置表
用对strep-tag标签亲和的磁珠(IBA-lifesciences,货号2-1612-002)对串联肽段进行富集,具体流程如下:
A.取20μL(1mg)的磁珠于洁净PCR小管中,将小管放置在磁力架上,静止10秒,小心用移液器吸去上清;
B.取下PCR小管,加入100μL的wash buffer(50mM碳酸氢铵,pH8.0),涡旋混匀使得磁珠悬浮,以平衡磁珠,再次将小管置于磁力架上,静置后吸去上清;
C.重复步骤B一次;
D.将30μL反应体系加入到装有磁珠的PCR管中,用wash buffer补足体积至100μL,涡旋混匀后置于震荡反应器,1200rpm,4℃孵育1小时,使得磁珠与strep-tag更好的结合;
E.将孵育后的PCR小管置于磁力架上,静置后小心吸去上清;
F.用100微升wash buffer洗涤磁珠,去除与磁珠非特异结合的杂质,重 复3次;
G.加入50μL洗脱液(50mM碳酸氢铵,10mM脱硫生物素,pH8.0),涡旋使得磁珠悬浮完全,将管子置于震荡反应器,1200rpm,4℃孵育15分钟,孵育完后置于磁力架,吸取上清保存;
H.重复G步骤2次,得到150μL洗脱产物,﹣20℃留存待用。
实施例二串联肽段的酶解
富集后的肽段经过还原烷基化后(10mM DTT 56℃反应45min,25mM IAM室温暗处反应30min),加入Trypsin 2μL(1μg/μL),37℃反应4h,其后补加Trypsin 2μL(1μg/μL),37℃反应8~12小时,以保证串联肽段的完全酶解。加入终浓度为0.1%的甲酸终止酶解反应。将酶解后的肽段混合物真空冷冻抽干为干粉待用,此干粉即无细胞合成体系反应得到的稳定同位素标记肽段A3-pep1与strep-tag的混合物。
实施例三标准曲线绘制以及合成肽段的定量
特定的物质在特定的溶液中以及特定的波长下有其独特的摩尔消光系数,结合strep-tag的这种特性,精确测定出strep-tag标准品的浓度。将其稀释后,按照5fmol、10fmol、30fmol、50fmol、80fmol、150fmol、20fmol、300fmol的量进行MRM-MS(多反应监测质谱)的测定,对得到的质谱数据进行strep-tag峰面积的计算,峰面积积分使用Skyline软件(http://proteome.gs.washington.edu/software/skyline/)。选用的transition为:2b3,2y6,2y5,3b2,3y5,3y3。利用所有母子离子对的峰面积之和作为纵轴,从而得到关于strep-tag标准品量与质谱峰面积的标准曲线(图3)。该图显示,strep-tag有着较好的质谱检测线性范围,相关系数R2大于0.99,能够用于定量实验。
向抽干后的肽段干粉中加入30μL的复溶液(98%H2O,2%乙腈,0.1%甲酸),涡旋混匀使得肽段干粉完全溶解,12000转离心5分钟。采用MRM-MS模式进行检测,检测系统为Eksigent NanoLC ultra液相搭配AB sciex Qtrap 5500质谱仪。上样量3μL,得到如图4的结果,图示中两个峰图分别为合成的稳定同位素标记的strep-tag与A3-pep1,利用Skyline软件 (http://proteome.gs.washington.edu/software/skyline/)对MRM-MS结果进行strep-tag峰面积积分,积分峰面积为8250000,结合前述绘制的标准曲线,从而可知此次合成中,A3-pep1的浓度为26.83fmol/μL,合成总量为804.9fmol。
实施例四复杂样本定量
为了确认利用无细胞合成体系得到的稳定同位素标记肽段是可以用于复杂样本的定量检测的,我们将合成的肽段按照一定比例掺入到酶解好的血清样本中,同样采用MRM-MS的方法进行检测(图5和图6)。图5显示利用无细胞体系合成的标记肽段与实际样本中的肽段有着相同的色谱学行为,即保留时间的一致性。图6显示标记肽段与实际样本中的肽段在质谱的响应中,母子离子对的信号响应排序是一致的,从高到低都是b3离子、y2离子、y3离子。
基于以上实验结果此可知,利用本发明的方法合成肽段用于基于质谱的蛋白定量检测是可行的。
- 还没有人留言评论。精彩留言会获得点赞!