己二酸的合成方法与流程
本申请要求于2014年12月10日提交的韩国专利申请号10-2014-0177803的优先权的权益,出于所有目的通过这种引用将该申请的全部内容结合于本文中。
技术领域
本公开内容涉及己二酸的新合成方法,所述己二酸具有多种用途,包括作为能够用于汽车发动机皮带注射单元(汽车发动机窗框注射单元,automobile engine sash injection unit)的尼龙用源材料。
背景技术:
由于人口和工业发展持续增长,所以石油现在是95%的化学制品的原材料,并且已经成为人类最重要的自然资源之一。
然而,油田是有限的,并且存在与开采油田有关的多种环境问题。因此,开发可替代的解决方案是很重要的,因此,存在探索石油资源的可替代材料的多种研究。在这点上,将天然产生、可再生、以及环境(生态)友好的生物质(源自植物资源,如谷物、甘蔗、木头(木材)-植物资源、棕榈(palm)、以及藻类)视为石油替代品的重要潜在资源。
汽车工业与石油资源紧密相关,并且作为用于汽车工业的未来资源的生物质相关的研究和开发的重要性不断增加。
尽管小工业规模和比生物质的石油化学材料更低的经济效率,Utretcht University的近来报告(根据欧洲生物塑料协会和EPNOE(欧洲多糖卓越网(European Polysaccharide Network of Excellence))的要求)预期从现在开始生物材料的使用将快速增长十(10)年,并且高达90%的石油化学材料能够用生物材料替代。目前在汽车工业中使用的内部/外部注射单元材料的实例包括聚丙烯、尼龙、聚碳酸酯以及丙烯腈丁二烯苯乙烯(ABS)。在以上材料中,聚丙烯是最常用的,并且尼龙是第二最常用的(每辆汽车约15kg)。因此,如果将用于尼龙的制造技术转化成基于生物质的制造技术,则预期的是将发生相当多的连锁反应。因此,针对生物质类尼龙材料的多种研究项目正在进行中。
在各种尼龙材料中,由于尼龙66以及尼龙6的优良性能,因此对于它们存在极大的需求,但尚未建立来自生物质资源的制造技术。一旦已经开发了对于尼龙66的制造技术,所预期的是在经济和环境方面具有巨大的作用。
由于尼龙66的优异的耐热性、耐磨性、以及耐化学性,因此将尼龙66用于能够经受住高温的汽车部件。在尼龙6之后,尼龙66是对于汽车最常用的尼龙。通过六亚甲基二胺和己二酸的脱水缩合反应制备尼龙66。使用源自原油的纯化过程中获得的苯的环己酮,经由化学合成方法生产用于尼龙66合成的单体己二酸。
然而,以上制造技术和方法具有多种问题,如石油价格不稳定、使用有毒化合物如苯、以及形成包括NOX的环境污染物。因此,对于使用生物质技术替代这种目前的制造技术,存在需要。因此,使用生物质的尼龙生产将降低石油依赖性并且减少环境污染物的形成。
在使用生物质的尼龙66生产中,认为从生物质合成用于尼龙66单体的己二酸是最重要的步骤。然而,该技术仍处于研究和开发(R&D)阶段,并且尚未商业化。
此外,尽管存在使用葡糖二酸作为用于己二酸合成的中间产物的多项专利,但尚未公开由葡萄糖或半乳糖合成己二酸的技术。
具体地,已经应用了制备源自绿藻类的D-葡糖二酸的方法。使用绿藻类获得的糖制备D-葡糖二酸,并且具体地,通过使用用D-葡糖二酸产生基因转染的重组微生物,将D-葡糖醛酸从绿藻类的原始形式转化成D-葡糖二酸。该方法包括以下步骤:(i)干燥和研磨绿藻类以形成绿藻类颗粒;(ii)用酸催化剂使绿藻类粉末水解以获得单糖;以及(iii)通过用具有D-葡糖二酸产生基因的重组微生物发酵,将单糖转化成D-葡糖二酸。在此,存在通过使用绿藻类资源制备具有巨大工业效用的化学制品的新发酵方法,但其尚未在工业规模上实施。该方法非常复杂,因为其使用通过利用下述生产葡糖二酸的代谢工程技术:(i)从绿藻类的原始形式制备单糖的糖化技术,以及(ii)用于葡糖二酸生产的重组微生物。
关于由生物质生产D-葡糖二酸的其他研究包括Moon,T.S.等人的(Moon,T.S.et al.(2009)Appl.Environ.Microbiol.75:589-595),其公开了使用D-葡萄糖作为原材料生产D-葡糖二酸的方法。
在以上方法中,通过使用PPS(磷酸烯醇丙酮酸合酶)、肌-肌醇-1-磷酸合酶、磷酸酶、肌-肌醇加氧酶、以及尿酸脱氢酶(urinatedehydrogenase),经由大肠杆菌中的复杂链酶促反应来制备D-葡糖二酸。这是非常复杂的合成,并且葡萄糖进料效率非常低(产率:17.4%或更低)。
进一步地,已经开发了由可再生的脂肪酸和遗传修饰微生物如酵母制备己二酸的生物学方法和己二酸。
已经研究了针对制备己二酸用于以高产率生产己二酸的遗传修饰,其中,遗传修饰酵母包括POX5多肽,其中,除去了POX4多肽或其启动子、 FAT1多肽或其启动子、以及ACS1多肽基因,并且已经研究了用于经由发酵从脂肪酸资源生产己二酸的方法。
然而,与化学合成方法相比,以上技术复杂得多,并且它们的成本非常高。
在以上情况下,本公开内容描述了新合成方法,该新合成方法能够简单并且经济地由生物质如植物或海洋资源提供己二酸。进一步地,本公开内容描述了一种方法,包括以下步骤:由源自植物或海洋资源的葡萄糖或半乳糖制备葡糖二酸或半乳糖二酸作为中间产物,然后将该中间产物还原以形成己二酸,用简单且生态友好的方法和低成本提供生物己二酸合成,从而完成本公开内容。
技术实现要素:
为了克服上述问题,本公开内容旨在提供利用葡糖二酸(glucaric acid)或半乳糖二酸(galactaric acid)作为原材料通过催化还原反应有效地合成生物己二酸(尼龙66的单体)的方法,所述葡糖二酸或半乳糖二酸源自来自生物质的葡萄糖或半乳糖。
本发明构思的一个方面提供了一种用于己二酸的新合成方法。
根据本公开内容的一个实施方式,用于己二酸的合成方法包括以下步骤:a)将作为原材料的葡糖二酸或半乳糖二酸、铼催化剂、以及酸催化剂添加至选自由庚醇和丁醇组成的组中的一种或多种反应溶剂中;以及b)利用贵金属催化剂使从步骤a)获得的中间产物进行加氢反应(氢化反应),然后,使从该反应获得的酯水解以获得己二酸。
附图说明
图1示出了根据本公开内容当使用半乳糖二酸作为原材料时的反应方案。
图2示出了实施例1中获得的半乳糖二酸二庚酯(diheptylgalactarate)的1H NMR数据。
图3示出了实施例1中获得的己二酸二庚酯的1H NMR数据。
图4示出了实施例1中获得的己二酸的1H NMR数据。
图5示出了实施例2中获得的半乳糖二酸二庚酯的1H NMR数据。
图6示出了实施例2中获得的己二酸二庚酯的1H NMR数据。
图7示出了实施例2中获得的己二酸的1H NMR数据。
图8示出了实施例3中获得的半乳糖二酸二庚酯的1H NMR数据。
图9示出了实施例4中获得的半乳糖二酸二庚酯的1H NMR数据。
图10示出了比较例1中获得的产物的1H NMR数据。
图11示出了比较例2中获得的产物的1H NMR数据。
图12示出了比较例3中获得的产物的1H NMR数据。
图13示出了比较例4中获得的产物的1H NMR数据。
图14示出了实施例1中获得的半乳糖二酸二庚酯的13C NMR数据。
图15示出了实施例1中获得的己二酸二庚酯的13C NMR数据。
图16示出了实施例1中获得的己二酸的13C NMR数据。
具体实施方式
参照以下实施例,更详细地进一步解释本公开内容。然而,不应以任何方式将这些实施例解释为限制本公开内容的范围。图1示出了根据本公开内容当使用半乳糖二酸作为原材料时的反应方案。图2示出了实施例1中获得的半乳糖二酸二庚酯的1H NMR数据。图3示出了实施例1中获得的己二酸二庚酯的1H NMR数据。图4示出了实施例1中获得的己二酸的1H NMR数据。图5示出了实施例2中获得的半乳糖二酸二庚酯的1H NMR数据。图6示出了实施例2中获得的己二酸二庚酯的1H NMR数据。图7示出了实施例2中获得的己二酸的1H NMR数据。图8示出了实施例3中获得的半乳糖二酸二庚酯的1H NMR数据。图9示出了实施例4中获得的半乳糖二酸二庚酯的1H NMR数据。图10示出了比较例1中获得的产物的1H NMR数据。图11示出了比较例2中获得的产物的1H NMR数据。图12示出了比较例3中获得的产物的1H NMR数据。图13示出了比较例4中获得的产物的1H NMR数据。图14示出了实施例1中获得的半乳糖二酸二庚酯的13C NMR数据。图15示出了实施例1中获得的己二酸二庚酯的13C NMR数据。图16示出了实施例1中获得的己二酸的13C NMR数据。
在下文中,将参照附图和实施例详细地描述己二酸的处理合成方法。
(1)通过脱氧脱水(Deoxydehydration)(DODH)反应制备中间产物
用于合成己二酸的公开方法的步骤(a)是通过脱氧脱水(DODH)反应制备己二酸的中间产物的步骤。更具体地,该方法包括使用葡糖二酸或半乳糖二酸作为原材料,以及将铼和酸催化剂添加到反应溶剂中以制备己二酸的中间产物。
在步骤(a)中使用的反应溶剂可以是醇,如丁醇、庚醇、或1-庚醇。使用丁醇或庚醇作为用于步骤(a)的反应溶剂具有以下方面的有利效果:(i)相对于其他溶剂成本较低(例如,3-戊醇:每升体积为300,000KRW(约275USD),丁二醇:10,000KRW(约9.1USD),以及庚醇:100,000KRW(约91USD)),(ii)易于再循环,以及准备供应,以及(iii)己二酸的生产产率较高。
进一步地,在步骤(a)中作为原材料使用的葡糖二酸或半乳糖二酸可以通过传统的制备方法获得,或也可以使用商业上可获得的葡糖二酸或半乳糖二酸,但不限于此。可以经过源自生物质(具体地,植物或海洋资源)的葡萄糖或半乳糖的氧化反应通过传统方法制备葡糖二酸或半乳糖二酸。
在本文中使用的葡糖二酸或半乳糖二酸的浓度可以是0.01M至0.2M。如果葡糖二酸或半乳糖二酸的量小于0.01M,则该方法的经济效率将降低,而如果浓度超过0.2M,则DODH反应将几乎不能进行,因此,将仅通过酯化反应获得半乳糖二酸,并且转化率将下降。
通过利用催化剂,具体为铼催化剂,经过DODH反应除去葡糖二酸或半乳糖二酸的两(2)个羟基基团,公开的方法的步骤(a)提供了双键。在本公开内容中使用的铼催化剂的实例是氧化铼(rhenium oxide)(氧化铼(VII),Re2O7)和氧化铼化合物(氧代铼化合物,oxorhenium compounds)(LxReOy(其中,L是胺、卤素、苯基甲硅烷基(phenylsilyl)、膦(phosphine)、C1-10烷氧基、C1-10烷基、或COOR(R是C1-10烷基),x+y是0至7的整数));选自由以下组成的组中的催化剂:甲基三氧化铼(VII)(methyltrioxorhenium(VII))氧化铼(VII)(Re2O7)、三氧代(三苯基甲硅烷基氧基)铼(VII)(三氧代(三苯基硅氧基)铼(VII), trioxo(triphenylsilyloxy)rhenium(VII))以及它们的混合物;或甲基三氧化铼(methyltrioxorhenium)。
在步骤(a)中使用的葡糖二酸或半乳糖二酸:铼催化剂的摩尔比可以是1:0.01至0.2(1:0.01至1:0.2)。
如果摩尔比小于1:0.01,则反应转化率将下降;而如果摩尔比超过1:0.2,则经济效率降低并且会发生副反应。
在步骤(a)中使用的酸催化剂促进葡糖二酸或半乳糖二酸中羟基基团的脱水反应。
酸催化剂的实例是有机酸和非有机酸(non-organic acid),包括Amberlyst 15、2,4-二硝基磺酸、硫酸、三氟甲磺酸、以及对甲苯磺酸。在步骤(a)中使用的葡糖二酸或半乳糖二酸:酸催化剂的摩尔比可以是1:0.05至2(1:0.05至1:2)。
如果摩尔比小于1:0.05,则反应效率将下降;而如果摩尔比超过1:2,则将发生副反应如环化。
进一步地,如以上描述的,将原材料(葡糖二酸或半乳糖二酸)、铼催化剂、以及酸催化剂添加至反应溶剂中,并且在适当的温度下一起反应适当的反应时间,然后,分离并且用常规方法纯化(例如,用硅胶柱(silica column)纯化)以获得葡糖二酸酯或半乳糖二酸酯作为己二酸的中间产物。在一个实施方式中,反应温度范围从100℃至200℃,并且反应时间是12小时至24小时。
己二酸的中间产物可以根据反应溶剂而变化。中间产物可以包括半乳糖二酸二庚酯(diheptyl galactarate)或半乳糖二酸二丁酯(dibutyl galactarate)作为半乳糖二酸酯。
在本公开内容的一个具体实施方式中,将20ml的1-庚醇、1mmol的半乳糖二酸、0.05mmol的甲基三氧化铼催化剂、以及0.05mmol的对甲苯磺酸倾注到50cc的反应器中。然后,将反应器中的温度升高至150℃,并且使反应进行12小时,将反应器温度维持在150℃下以获得半乳糖二酸二庚酯。
在以下反应方案1(通过半乳糖二酸的催化反应的DODH反应方案)和反应方案2(反应机理)中说明了本发明方法的步骤(a),但其不限于这些说明:
[反应方案1]
(其中,R可以根据溶剂的碳数而变化,并且R可以是丁基或庚基)
[反应方案2]
(2)由中间产物制备己二酸
本发明的用于合成己二酸的方法的步骤(b)是从步骤(a)中获得的中间产物制备己二酸作为最终产物的步骤,更具体地,利用贵金属催化剂在适当的反应溶剂中使葡糖二酸酯或半乳糖二酸酯(步骤(a)中获得的中间产物)进行加氢反应,然后使该反应的产物水解以获得己二酸。
在步骤(b)中使用的反应溶剂可以是有用的,只要溶解反应物并且具有高的氢溶解度。反应溶剂可以是选自由以下组成的组中的一种或多种溶剂:醇、氯仿、己烷、二氯甲烷、乙腈、以及乙酸乙酯,但不限于此。反应溶剂可以以使得中间产物溶液具有范围从0.1M至1M的浓度的量使用。
在步骤(b)中使用的加氢催化剂可以是贵金属催化剂,具体地,铝、二氧化硅(硅石)、或碳负载的铂或钯催化剂。加氢催化剂包括Pd/C或Pt/C。使用加氢催化剂以将从步骤(a)中获得的中间产物的双键转化成单键。反应物(中间产物):加氢催化剂的重量比可以是1:0.05至0.3(1:0.05 至1:0.3)。如果重量比小于1:0.05,则反应效率将下降;而如果重量比超过1:0.3,则经济效率将降低。
用于加氢反应的氢压力可以是大气压至30巴,并且反应温度范围可以从室温至70℃。如果反应温度超过70℃,则可能发生副反应。
然后,可以在酸性或碱性条件下使从加氢反应获得的反应物的酯基团水解以产生己二酸作为最终产物。可以使用适当的酸化剂如盐酸(盐酸可以是浓盐酸)以形成酸性条件,并且可以使用NaOH以形成碱性条件。
在以下反应方案3中描述了作为步骤(b)的一个示例性还原反应方案和反应机理(使用半乳糖二酸二庚酯作为中间产物),但不限于此。然而,当使用本公开内容的另一种中间产物时,可以采用相同的反应方案和反应机理,不同之处在于,键合至氧原子的两(2)个末端基团(端基)将根据中间产物而变化。
[反应方案3]
在本公开内容的一个具体实例中,以连续顺序进行步骤(a)和步骤(b),并且通过中间产物半乳糖二酸二庚酯或半乳糖二酸二丁酯(白色颗粒,熔点:58℃)产生己二酸的最终产物(白色颗粒,熔点:151℃)。
与使用石油化学材料的常规方法相比,本公开内容提供了由生物质如植物或海洋资源环境友好地合成己二酸。进一步地,相对于传统的合成方法,本公开内容提供了具有高产率和低成本的己二酸。
实施例
<实施例1>
如在表1中描述的,使用1-庚醇作为溶剂,将半乳糖二酸(原材料)以0.05M的浓度倾注到反应器中。以半乳糖二酸:甲基三氧化铼的1:0.05的摩尔比,添加甲基三氧化铼作为催化剂。然后,将对甲苯磺酸以半乳糖二酸:对甲苯磺酸的1:0.05摩尔比的浓度添加至反应器。
将反应进行12小时,使反应器维持150℃。
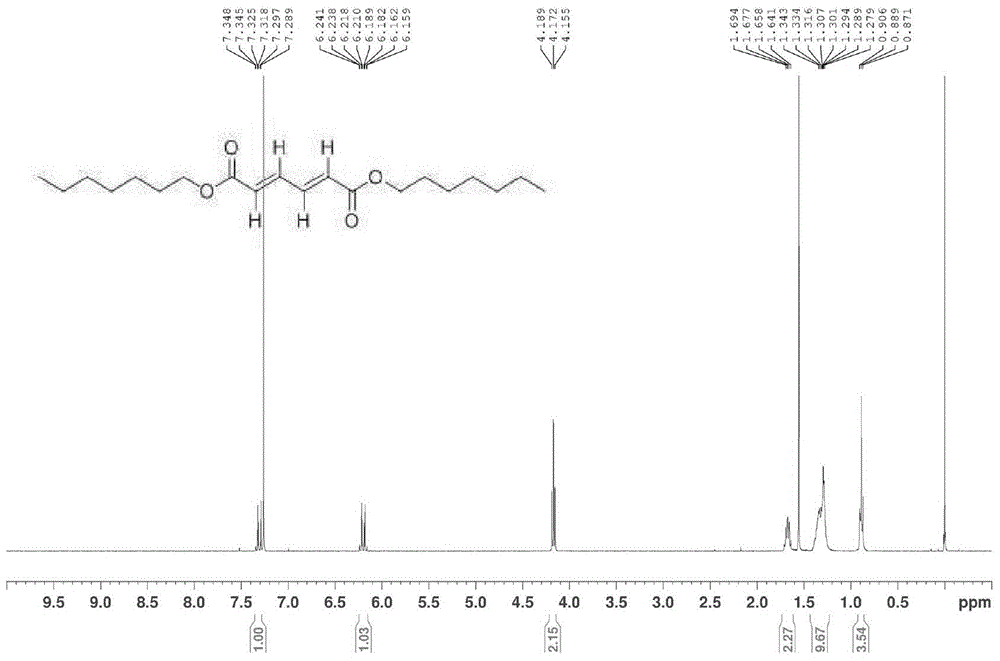
在反应终止之后,将反应产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的半乳糖二酸二庚酯(图2和图14)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标(内标物,internal standard),测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ7.32-7.29(m,2H),6.24-6.16(m,2H),4.17(t,J=6.8,4H),1.69-1.66(m,4H),1.39-1.29(m,16H),0.91-0.87(m,6H)
13C NMR(CDCl3)δ166.0,140.8,128.4,65.1,31.7,28.9,28.7,25.9,22.6,14.1
然后,将反应产物溶解在乙酸乙酯中,添加相对于反应产物和氢气包含10wt%量的Pd的Pd/C。使反应在30巴下进行24小时。在反应终止之后,将该反应的产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的己二酸二庚酯(图3和图15)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ4.17(t,J=6.8,4H),2.35-2.30(m,4H),1.69-1.58(m,8H),1.36-1.29(m,16H)0.91-0.87(m,6H)
13C NMR(CDCl3)δ173.4,64.5,34.0,31.7,28.9,28.6,25.9,24.5,22.6,14.0
在盐酸存在的情况下,将产物在高温下回流,然后,除去剩余的盐酸。通过进行NMR分析(Bruker AVIII400仪器)和FT-IR分析(Agiilent Technologies Cary 600)来确认己二酸合成(图4和图16)。通过将TMS(三甲基硅烷)溶解在DMSO中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(DMSO-d6)δ12.0(bs,2H),2.23-2.09(m,4H),1.52-1.48(m,4H)
13C NMR(DMSO-d6)δ174.2,33.2,23.9
FT-IR(配备有ATR附件)1689cm-1
<实施例2>
如在表1中描述的,使用1-庚醇作为溶剂,将半乳糖二酸(原材料)以0.05M的浓度倾注到反应器中。以半乳糖二酸:甲基三氧化铼的1:0.05的摩尔比,添加作为催化剂的甲基三氧化铼。然后,将对甲苯磺酸添加到反应器至半乳糖二酸:对甲苯磺酸为1:0.05摩尔比的浓度。
将反应进行12小时,使反应器维持150℃。
在反应终止之后,将反应产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的半乳糖二酸二庚酯(图5)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ7.32-7.29(m,2H),6.24-6.16(m,2H),4.17(t,J=6.8,4H),1.69-1.66(m,4H),1.39-1.29(m,16H),0.91-0.87(m,6H)
13C NMR(CDCl3)δ166.0,140.8,128.4,65.1,31.7,28.9,28.7,25.9,22.6,14.1
然后,将反应产物溶解在乙酸乙酯中,添加相对于反应产物和氢气包含10wt%量的Pd的Pd/C。使反应在30巴下进行24小时。在反应终止之后,将该反应的产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的己二酸二庚酯(图6)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ4.17(t,J=6.8,4H),2.35-2.30(m,4H),1.69-1.58(m,8H),1.36-1.29(m,16H)0.91-0.87(m,6H)
13C NMR(CDCl3)δ173.4,64.5,34.0,31.7,28.9,28.6,25.9,24.5,22.6,14.0
在NaCl存在的情况下在高温下用甲醇和水的混合溶液(以1:2的体积比)将产物回流12小时,然后,除去剩余的甲醇和水。通过用1N盐酸溶液形成酸性条件来形成结晶产物,并且通过过滤进行分离。通过进行NMR分析(Bruker AVIII400仪器)和FT-IR分析(Agiilent Technologies Cary 600)来确认产生的己二酸(图7)。通过将TMS(三甲基硅烷)溶解在DMSO中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(DMSO-d6)δ12.0(bs,2H),2.23-2.09(m,4H),1.52-1.48(m,4H)
13C NMR(DMSO-d6)δ174.2,33.2,23.9
FT-IR(配备有ATR附件)1689cm-1
<实施例3>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.1M的浓度倾注至反应器,并且以半乳糖二酸:甲基三氧化铼的1:0.05的摩尔比添加作为催化剂的甲基三氧化铼。然后,将对甲苯磺酸添加到反应器至半乳糖二酸:对甲苯磺酸为1:0.05摩尔比的浓度。
将反应进行12小时,使反应器维持150℃。
在反应终止之后,将反应产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的半乳糖二酸二庚酯(图8)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ7.32-7.29(m,2H),6.24-6.16(m,2H),4.17(t,J=6.8,4H),1.69-1.66(m,4H),1.39-1.29(m,16H),0.91-0.87(m,6H)
13C NMR(CDCl3)δ166.0,140.8,128.4,65.1,31.7,28.9,28.7,25.9,22.6
然后,将反应产物溶解在乙酸乙酯中,添加相对于反应产物和氢气包含10wt%量的Pd的Pd/C。使反应在30巴下进行24小时。在反应终止之后,将该反应的产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的己二酸二庚酯(图3和图15)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ4.17(t,J=6.8,4H),2.35-2.30(m,4H),1.69-1.58(m,8H),1.36-1.29(m,16H)0.91-0.87(m,6H)
13C NMR(CDCl3)δ173.4,64.5,34.0,31.7,28.9,28.6,25.9,24.5,22.6,14.0
在NaCl存在的情况下在高温下用甲醇和水的混合溶液(以1:2的体积比)将产物回流12小时,然后,除去剩余的甲醇和水。使用1N盐酸溶液在酸性条件下形成晶体,并且通过过滤分离。通过进行NMR分析(Bruker AVIII400仪器)和FT-IR分析(Agiilent Technologies Cary 600)来确认产生的己二酸。通过将TMS(三甲基硅烷)溶解在DMSO中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(DMSO-d6)δ12.0(bs,2H),2.23-2.09(m,4H),1.52-1.48(m,4H)
13C NMR(DMSO-d6)δ174.2,33.2,23.9
FT-IR(配备有ATR附件)1689cm-1
<实施例4>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.05M的浓度倾注至反应器,并且以半乳糖二酸:甲基三氧化铼的1:0.05摩尔比的浓度添加作为催化剂的甲基三氧化铼。然后,将对甲苯磺酸添加到反应器至半乳糖二酸:对甲苯磺酸为1:0.05摩尔比的浓度。
将反应进行12小时,使反应器维持120℃。
在反应终止之后,将反应产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的半乳糖二酸二庚酯(图9)。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ7.32-7.29(m,2H),6.24-6.16(m,2H),4.17(t,J=6.8,4H),1.69-1.66(m,4H),1.39-1.29(m,16H),0.91-0.87(m,6H)
13C NMR(CDCl3)δ166.0,140.8,128.4,65.1,31.7,28.9,28.7,25.9,22.6,14.1
然后,将反应产物溶解在乙酸乙酯中,添加相对于反应产物和氢气包含10wt%量的Pd的Pd/C。使反应在30巴下进行24小时。在反应终止之后,将该反应的产物与剩余的催化剂分离,并且通过NMR分析(Bruker AVIII400仪器)确认产生的己二酸二庚酯。通过将TMS(三甲基硅烷)溶解在CDCl3中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(CDCl3)δ4.17(t,J=6.8,4H),2.35-2.30(m,4H),1.69-1.58(m,8H),1.36-1.29(m,16H)0.91-0.87(m,6H)
13C NMR(CDCl3)δ173.4,64.5,34.0,31.7,28.9,28.6,25.9,24.5,22.6,14.0
在NaCl存在的情况下在高温下用甲醇和水的混合溶液(以1:2的体积比)将产物回流12小时,然后,除去剩余的甲醇和水。使用1N盐酸溶液在酸性条件下形成晶体,并且通过过滤分离。通过进行NMR分析(Bruker AVIII400仪器)和FT-IR分析(Agiilent Technologies Cary 600)来确认产生的己二酸。通过将TMS(三甲基硅烷)溶解在DMSO中作为内标,测定NMR谱(400MHz下的1H)。
1H NMR(DMSO-d6)δ12.0(bs,2H),2.23-2.09(m,4H),1.52-1.48(m,4H)
13C NMR(DMSO-d6)δ174.2,33.2,23.9
FT-IR(配备有ATR附件)1689cm-1
<比较例1>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.05M的浓度倾注到反应器中,并且以对甲苯磺酸与半乳糖二酸的1:1摩尔比的浓度添加对甲苯磺酸。
将反应进行12小时,使反应器维持150℃。
在反应终止之后,将产物与剩余的催化剂分离,并且通过NMR(Bruker AVIII400仪器)对产物进行分析。没有很好地合成半乳糖二酸二庚酯(图10)。
<比较例2>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.05M的浓度倾注到反应器中,并且以半乳糖二酸:甲基三氧化铼的1:0.05的摩尔比添加作为催化剂的甲基三氧化铼。然后,将Amberlyst 15添加到反应器至半乳糖二酸:Amberlyst 15为1:1摩尔比的浓度。
将反应进行12小时,使反应器维持80℃。
在反应终止之后,将产物与剩余的催化剂分离,并且通过NMR(Bruker AVIII400仪器)对产物进行分析。没有很好地合成半乳糖二酸二庚酯(图11)。
<比较例3>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.05M的浓度倾注到反应器中,并且以半乳糖二酸:甲基三氧化铼的1:0.05的摩尔比添加甲基三氧化铼作为催化剂。然后,将对甲苯磺酸以半乳糖二酸:对甲苯磺酸的1:0.05摩尔比的浓度添加至反应器。
将反应进行12小时,使反应器维持80℃。
在反应终止之后,将产物与剩余的催化剂分离,并且通过NMR(Bruker AVIII400仪器)对产物进行分析。没有很好地合成半乳糖二酸二庚酯(图12)。
<比较例4>
根据在表1中给出的组成,使用1-庚醇作为溶剂,将作为原材料的半乳糖二酸以0.5M的浓度倾注到反应器中,并且以半乳糖二酸:甲基三 氧化铼的1:0.05的摩尔比添加甲基三氧化铼作为催化剂。然后,将对甲苯磺酸以半乳糖二酸:对甲苯磺酸的1:0.05摩尔比的浓度添加至反应器。
将反应进行12小时,使反应器维持150℃。
在反应终止之后,将产物与剩余的催化剂分离,并且通过NMR(Bruker AVIII400仪器)对产物进行分析。没有很好地合成半乳糖二酸二庚酯(图13)。
表1
(A)半乳糖二酸(Sigma-Aldrich(USA)):1-庚醇的摩尔比
(B)半乳糖二酸(Sigma-Aldrich(USA)):甲基三氧化铼的摩尔比
(C)半乳糖二酸(Sigma-Aldrich(USA)):酸催化剂(Amberlyst 15或对甲苯磺酸)的摩尔比
(D)Pd/C催化剂中Pd的量,氢气的压力。
<实验例:NMR分析>
进行NMR分析以确定实施例1至4和比较例1至4中产物的组分。使用分别溶解在CDCl3或DMSO中的TMS(三甲基硅烷)作为内标(400MHz下的1H)和(100MHz下的13C),利用Bruker AVIII400仪器分析NMR谱。
从实施例1至4的产物获得以下NMR数据。
如在表1中示出的,与比较例1至4相比,在特定温度和催化剂条件下,通过将半乳糖二酸、对甲苯磺酸、以及铼催化剂添加至1-庚醇来合成实施例1至4中的半乳糖二酸二庚酯。
1H NMR(CDCl3)δ7.32-7.29(m,2H),6.24-6.16(m,2H),4.17(t,J=6.8,4H),1.69-1.66(m,4H),1.39-1.29(m,16H),0.91-0.87(m,6H)
13C NMR(CDCl3)δ166.0,140.8,128.4,65.1,31.7,28.9,28.7,25.9,22.6,14.1
然后,将产生的半乳糖二酸二庚酯添加至反应器,并且在乙酸乙酯中进行加氢反应和水解反应。在实施例1至4的特定条件下,添加氢气和Pt或Pd催化剂。使用NMR(Bruker AVIII400仪器)和FT-IR(Agilent Technologies Cary 600)确定和分析产物。图4和图7和图16中示出的NMR和FT-IR数据确认了合成的己二酸。
1H NMR(DMSO-d6)δ12.0(bs,2H),2.23-2.09(m,4H),1.52-1.48(m,4H)
13C NMR(DMSO-d6)δ174.2,33.2,23.9
FT-IR(配备有ATR附件)1689cm-1
[有益效果]
根据本公开内容的新合成方法可以由环境友好的生物质如植物或海洋资源制备己二酸。而且,与传统的合成方法相比,本公开内容通过甚至更简单的方法提供了具有高产率和低成本的己二酸。因此,由于技术采用生物己二酸作为可用于汽车工业的尼龙66用原材料,因此本公开内容对于工业能够具有巨大的连锁反应。
- 还没有人留言评论。精彩留言会获得点赞!