R构型4-(取代苯胺基)喹唑啉衍生物及其制备方法和用途与流程
本发明属于医药化工
技术领域:
,具体涉及N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺的R型立体异构体、其二甲苯磺酸盐以及所述二甲苯磺酸盐的多晶型,并具体公开了其制备方法和作为酪氨酸酶抑制剂的用途。
背景技术:
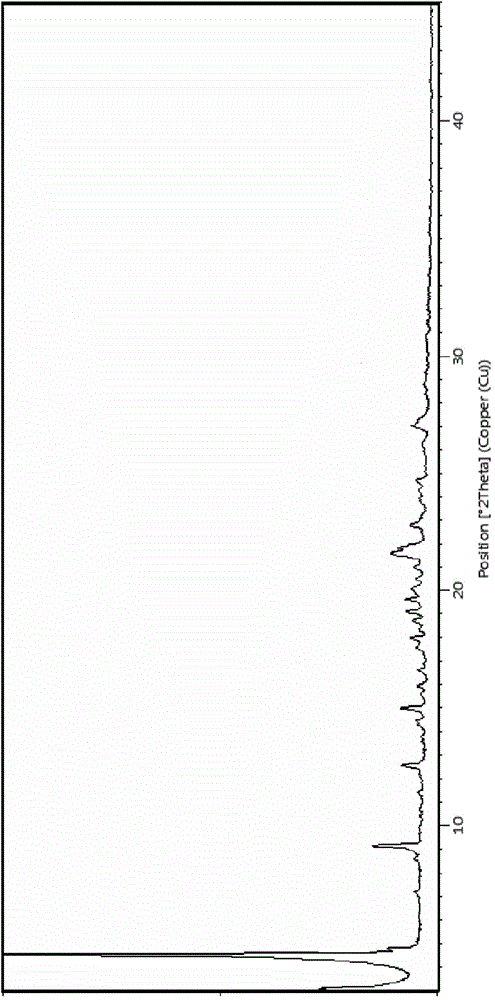
:肿瘤是目前严重威胁人类健康和生命的重要疾病之一。传统的肿瘤治疗是通过发现肿瘤并破坏来实现的,现在随着对细胞信号传导途径研究的不断深入,人们对肿瘤细胞内部的癌基因及抗癌基因的作用了解的越来越深入,针对肿瘤的特异性分子靶点设计新的抗肿瘤药物越来越受到关注,成为研究的热点领域,而靶向抗肿瘤药物作为一种新的治疗方法也已经应用于临床,并在短短几年内得到了显著的进展。近年来,人们致力于抑制细胞信号转导途径以开发新型靶点抗肿瘤药物。小分子酪氨酸激酶抑制剂作为新的靶向抗肿瘤药物,为肿瘤的治疗和预防打开了一扇新窗口,而且其副作用轻微,有良好的耐受性。专利文献CN102030742A具体公开了作为酪氨酸酶抑制剂的4-(取代苯胺基)喹唑啉衍生物,并具体公开了化合物N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺,该化合物对EGFR和Her2均具有较高的体外抑制活性;现有试验数据表明该化合物比同类已经上市产品Lapatinib具有更好的抑制肿瘤生长的作用和良好的安全性。专利文献CN103304544A公开了N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺消旋体二甲苯磺酸盐及多晶型。为更好、更有效地开发研究该化合物并能够潜在地应用于临床,本发明对该化合物的光学异构体及其二甲苯磺酸盐进行了研究,并基于该研究而完成本申请。技术实现要素:本发明人以开发具有良好理化性质或/和优异药物疗效、并适于制备成药用组合物形式的化合物为目的,对N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺的立体异构体进行了研究,获得了其R-型异构体、所述异构体的二甲苯磺酸盐、以及所述二甲苯磺酸盐的晶体形式。试验数据表明,该异构体及其二甲苯磺酸盐具有良好的生物活性和细胞增殖抑制作用,而且其二甲苯磺酸盐及多晶型还具有更好的稳定性和药代特性,如更高的暴露量和半衰期,更适于制备用于预防或治疗癌症的药物,本发明正是基于此而完成。本发明第一方面提供一种式I所示化合物(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺、或其药学上可接受的盐;式I本发明第二方面提供式II所示(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐,即式I所示化合物的二甲苯磺酸盐:式II本发明的发明人令人惊奇地发现,式II所示化合物可以以一种以上的多晶型物存在,并制备得到两种不同的晶体形式,分别命名为晶型A、晶型B。该晶型A和B在水中均显示出较好的溶解性,有利于体内吸收、分布,具有更好的稳定性,有利于包装和贮存。特别是显著地改善了药代性质如增加了体内暴露量,延长了半衰期等,更加适用于制备用于预防或治疗癌症的药物。为此,本发明提供了式II所示化合物的晶体形式。本发明第三方面提供式II所示化合物的晶型A,所述晶型A,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射(即X-RPD)图谱在4.6°±0.2°,4.8°±0.2°,9.2°±0.2°,12.6°±0.2°,15.0°±0.2°,19.1°±0.2°,19.6°±0.2°,21.5°±0.2°,21.6°±0.2°,21.8°±0.2°处有特征衍射峰。具体地,所述晶型A,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射图谱在4.6°±0.2°,4.8°±0.2°,9.2°±0.2°,12.6°±0.2°,14.5±0.2°,15.0°±0.2°,15.9°±0.2°,17.5°±0.2°,18.9°±0.2°,18.7°±0.2°,19.1°±0.2°,19.6°±0.2°,20.0°±0.2°,20.5°±0.2°,20.9°±0.2°,21.5°±0.2°,21.6°±0.2°,21.8°±0.2°,22.8°±0.2°,24.7°±0.2°,27.0°±0.2°,27.3°±0.2°处有特征峰。在本发明的一个实施方案中,所述晶型A具有如图1所示的X-RPD图谱。本发明所述晶型A经差示扫描量热(DSC)分析,其图谱在140~158℃、242~250℃范围内分别出现吸热峰;更具体地,其吸热峰的峰值分别出现在149.2±2℃、249.7±2℃;在本发明的一个实施例中,本发明所述晶型A具有如图2所示的DSC图谱。本发明第四方面提供式II所示化合物的晶型B,所述晶型B,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射图谱在4.6°±0.2°,8.5°±0.2°,9.1°±0.2°,11.9°±0.2°,13.5°±0.2°,15.2°±0.2°,16.1°±0.2°,17.1°±0.2°,18.2°±0.2°,18.8°±0.2°,19.1°±0.2°,19.4°±0.2°,19.6°±0.2°,21.2°±0.2°,21.6°±0.2°,22.3°±0.2°,22.8°±0.2°,22.9°±0.2°,26.3°±0.2°,27.1°±0.2°处有特征衍射峰。具体地,所述晶型B,使用Cu-Kα辐射,以2θ角度表示的X-射线粉末衍射图谱在4.6°±0.2°,7.5°±0.2°,8.5°±0.2°,9.1°±0.2°,11.9°±0.2°,12.9°±0.2°,13.5°±0.2°,14.6°±0.2°,15.2°±0.2°,15.5°±0.2°,15.7°±0.2°,16.1°±0.2°,16.4°±0.2°,17.1°±0.2°,17.5°±0.2°,18.2°±0.2°,18.4°±0.2°,18.8°±0.2°,19.1°±0.2°,19.4°±0.2°,19.6°±0.2°,20.0°±0.2°,20.8°±0.2°,21.2°±0.2°,21.6°±0.2°,22.3°±0.2°,22.8°±0.2°,22.9°±0.2°,23.4°±0.2°,25.0°±0.2°,25.8°±0.2°,26.3°±0.2°,27.1°±0.2°,27.6°±0.2°,29.2°±0.2°处有特征峰。在本发明的一个实施方案中,所述晶型B具有如图3所示的X-RPD图谱。本发明所述晶型B经差示扫描量热(DSC)分析,其图谱在121~148℃、235~250℃范围内分别出现吸热峰;更具体地,其吸热峰的峰值分别出现在131.8±2℃、247.1±2℃;在本发明的一个实施例中,本发明所述晶型B具有如图4所示的DSC图谱。本发明第五方面提供一种制备式I所示化合物及其二甲苯磺酸盐(式II所示化合物)的方法,该方法包括以下步骤:(1)将(R)-2-甲亚砜基乙胺(CAS:84104-28-9)与5-(4-(4-(3-氟苄氧基)-3-氯苯胺基)-6-喹唑啉基)呋喃-2-甲醛对甲苯磺酸盐在适宜碱作用下反应后,再经还原剂还原得到式I所示化合物;其中,所述适宜碱选自三乙胺、二异丙基乙基胺、氨水、碳酸钠、碳酸钾、碳酸氢钠、碳酸氢钾中的一种或多种;所述还原剂选自硼氢化钠、三乙酰基硼氢化钠、氰基硼氢化钠中的一种或多种。或者通过手性柱拆分消旋体N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺获得式I所示化合物。(2)式I所示化合物与对甲苯磺酸(即TsOH)反应,得到式II所示化合物;优选地,步骤(2)的具体步骤为:将(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺加入四氢呋喃中,搅拌溶解,加入对甲苯磺酸的乙醇溶液,析出固体,过滤,得式II所示的化合物。本发明第六方面提供一种制备式II所示化合物的晶型A的方法,该方法包括以下步骤:将式II所示的化合物加入到四氢呋喃和水的混合溶液中,加热搅拌溶解,降温析晶,过滤,60~100℃真空干燥,得式II所示化合物的晶型A;其中,四氢呋喃与水的体积比为3~15:1,优选5~10:1。本发明第七方面提供一种制备式II所示化合物的晶型B的方法,该方法包括以下步骤:将式II所示化合物加入到乙醇和水的混合溶液中,加热搅拌溶解,降温析晶,过滤,60~100℃真空干燥,得到式II所示化合物的晶型B;其中乙醇和水的体积比为3~15:1,优选5~10:1。本发明第八方面提供一种药物组合物,所述药物组合物包含本发明所述的式I所示化合物或其药学上可接受的盐,以及至少一种任选的药学上可接受的载体或赋形剂;在本发明的一个优选方案中,所述药学上可接受的盐为二甲苯磺酸盐;更优选地,所述二甲苯磺酸盐为晶型A、晶型B中的一种或其混晶。本发明第九方面提供本发明式I所示化合物或其药学上可接受的盐、式II所示化合物及其晶型A、晶型B在制备用于治疗和/或预防哺乳动物(包括人)与受体酪氨酸激酶相关的疾病或病症的药物中的用途。本发明第十方面提供本发明第八、九方面所述药物组合物在制备用于治疗和/或预防哺乳动物(包括人)与受体酪氨酸激酶相关的疾病或病症的药物中的用途。本发明第十一方面提供一种用于在有需要的哺乳动物中治疗和/或预防与受体酪氨酸激酶相关的疾病或病症的方法,该方法包括给有需要的哺乳动物施用治疗有效量的本发明式I所示化合物或其药学上可接受的盐、或者式II所示的化合物、或者有效剂量的本发明第八、或九方面所述的药物组合物。在本发明中,所述“与受体酪氨酸激酶相关的疾病或病症”优选“由受体酪氨酸激酶介导的肿瘤”、“由受体酪氨酸激酶驱动的肿瘤细胞的增殖和迁移”,更优选erbB受体酪氨酸激酶敏感癌症,如EGFR或Her2高表达及EGF驱动的肿瘤,具体包括实体肿瘤,如胆管、骨、膀胱、脑/中枢神经系统、乳房、结直肠、子宫内膜、胃、头和颈、肝、肺(尤其是非小细胞肺癌)、神经元、食道、卵巢、胰腺、前列腺、肾脏、皮肤、睾丸、甲状腺、子宫和外阴等的癌症,和非实体肿瘤,如白血病、多发性骨髓瘤或淋巴瘤等。根据本发明完全可以预期本发明化合物可用于上述疾病或病症的预防和/或治疗。需要注意的是,在本发明中,“式I所示化合物”与“化合物I”具有相同的含义,是指具有式I所示立体结构的化合物(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺;“式II所示化合物”与“化合物II”具有相同的含义,是指具有式II所示立体结构的化合物(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐;本发明所采用的原料或试剂都是本领域公知的,或者可以通过已经公开的现有技术制备得到,或者可以通过商业方式购买得到。例如,5-(4-(4-(3-氟苄氧基)-3-氯苯胺基)-6-喹唑啉基)呋喃-2-甲醛对甲苯磺酸盐可以从上海达瑞精细化学品有限公司或上海瀚香生物科技有限公司购买得到,(R)-2-甲亚砜基乙胺可以参照现有文献(Lim,Chin-Chinetal.Resolutionandenantiomericpuritiesof[2-(methylsulfinyl)ethyl]amine,Tetrahedron:Asymmetry,5(1994):1883-1886)制备得到。本发明所述的式I所示化合物或其二甲苯磺酸盐多晶型物在用于治疗和/或预防上述相关疾病时、或者在用于制备药物组合物时,可以作为唯一的药物活性成分单独使用,可以与其它活性成分组合或联合使用,只要它不产生其他不利作用,例如过敏反应。联合使用可以通过将各个治疗组分同时、顺序或隔开给药来实现。本发明所用的术语“组合物”意指包括包含指定量的各指定成分的产品,以及直接或间接从指定量的各指定成分的组合产生的任何产品。本领域技术人员可以通过改变本发明药物组合物中各活性成分的实际剂量水平,以便所得的活性化合物量能有效针对具体患者、组合物和给药方式得到所需的治疗反应。剂量水平需根据具体化合物的活性、给药途径、所治疗病况的严重程度以及待治疗患者的病况和既往病史来选定。但是,本领域的做法是,化合物的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。在本发明中,所述药物组合物可特别专门配制成以固体或液体形式供口服给药、供胃肠外注射或供直肠给药。术语“治疗和/或预防有效量”的本发明所述的式I所示化合物或其药学上可接受的盐指以适用于任何医学治疗和/或预防的合理效果/风险比治疗障碍的足够量的化合物。但应认识到,本发明式I所示化合物或其药学上可接受的盐和组合物的总日用量须由主诊医师在可靠的医学判断范围内作出决定。对于任何具体的患者,具体的治疗有效剂量水平须根据多种因素而定,所述因素包括所治疗的障碍和该障碍的严重程度;所采用的具体化合物的活性;所采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体化合物的给药时间、给药途径和排泄率;治疗持续时间;与所采用的具体化合物组合使用或同时使用的药物;及医疗领域公知的类似因素。例如,本领域的做法是,化合物的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。一般说来,本发明式I所示化合物或其药学上可接受的盐用于哺乳动物特别是人的剂量可以介于0.001~1000mg/kg体重/天,例如介于0.01~100mg/kg体重/天,例如介于0.01~10mg/kg体重/天。本发明生物活性试验数据表明,式I所示化合物或其药学上可接受的盐、式II所示化合物均对EGFR和Her2酪氨酸激酶都显示了较好的抑制活性,并对EGFR和Her2酪氨酸激酶高表达的细胞株有抑制作用,而且与消旋体N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺相比,该两化合物在溶解溶出、稳定性、体外激酶活性、部分特定肿瘤细胞株的抑制作用(如肿瘤抑制率)、细胞毒性、药代动力学(如药物吸收、暴露量)等方面具有不同程度的提高和改进;因此,本发明式I所示化合物和式II所示化合物可用于EGFR和Her2受体酪氨酸激酶单独或部分介导的疾病,主要通过抑制一种或多种EGFR家族酪氨酸激酶,并通过抑制激酶的活性产生抗增殖、抗迁移、促凋亡作用。具体地,式I所示化合物或其药学上可接受的盐可通过对EGFR和Her2酪氨酸激酶的抑制作用,用于预防和治疗一种或多种erbB受体酪氨酸激酶敏感的肿瘤,尤其是EGFR或Her2高表达及EGF驱动的肿瘤。包括实体肿瘤如胆管、骨、膀胱、脑/中枢神经系统、乳房、结直肠、子宫内膜、胃、头和颈、肝、肺(尤其是非小细胞肺癌)、神经元、食道、卵巢、胰腺、前列腺、肾脏、皮肤、睾丸、甲状腺、子宫和外阴的癌症,非实体肿瘤如白血病、多发性骨髓瘤或淋巴瘤。附图说明图1晶型A的X-RPD图谱;图2晶型A的DSC图谱;图3晶型B的X-RPD图谱;图4晶型B的DSC图谱。具体实施方式以下通过具体的实施方式,对本发明的上述内容做进一步的详细说明,但不应将此理解为对本发明保护范围的任何限制。凡基于本发明上述内容所实现的技术方案均属于本发明的范围。本发明对试验中所使用到的材料以及试验方法进行一般性和/或具体的描述。本发明下述描述中如果未特别说明,所进行的操作是本领域常规的室温条件下进行,所述室温具有本领域公知的技术含义,一般是指20~35℃,优选20~30℃,更优选20~25℃。本发明所用的检查仪器:(1)核磁共振谱仪器型号:VarianINOVA-600核磁共振仪测试条件:溶剂DMSO-d6(2)质谱分子量测定仪器型号:Agilent1100LC/MSD液质联用仪测试条件:ESI(3)比旋度仪器型号:鲁道夫(Rudolph)公司AutopolIV自动旋光仪测试条件:温度:20℃,D灯波长:589nm,甲醇溶液,浓度:1mg/ml(4)热重及差热仪器型号:METTLERTOLEDOTGA/DSC1同步热分析仪测试条件:温度范围30~270℃,升温速度10℃/min(5)晶型X-射线粉末衍射仪器型号:PANalyticalX射线粉末衍射仪(型号:X′PertPROMPD)测试条件:辐射源:CuKα射线,40kV,40mA;发散狭缝:1/8°;防散射狭缝:1/4°;扫描方式:连续扫描;扫描范围(2θ):3~45°;扫描步长(2θ):0.026°;扫描速度:8°/min;实施例1:(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺(化合物I)的制备:将5-(4-(4-(3-氟苄氧基)-3-氯苯胺基)-6-喹唑啉基)呋喃-2-甲醛对甲苯磺酸盐(16g)溶于二氯甲烷/甲醇(V二氯甲烷:V甲醇为3:1)的混合溶液中,加入12ml三乙胺搅拌反应10min,加入(R)-2-甲亚砜基乙胺(8.0g),室温搅拌反应,TLC检测原料反应完毕后,冰浴下分批加入硼氢化钠(4.0g),TLC检测反应完毕,加入500ml二氯甲烷,等体积饱和氯化铵溶液洗涤,饱和氯化钠溶液洗涤,无水硫酸钠干燥,减压蒸出溶剂,剩余物经柱层析得黄色固体13.3g,即为((R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐(化合物I),HPLC纯度97.03%。1H-NMR(600MHz,DMSO-d6,δppm):9.92(s,1H),8.74(s,1H),8.55(s,1H),8.16(d,1H,J=8.4Hz),8.01(s,1H),7.79(d,1H,J=8.8Hz),7.75(dd,1H,J=2.0Hz,J=8.4Hz),7.47(m,1H),7.28-7.35(m,3H),7.19(m,1H),7.05(d,1H,J=2.4Hz),6.48(d,1H,J=2.4Hz),5.27(s,2H),3.84(s,2H),2.94(m,3H),2.83(m,1H),2.56(s,3H).[a]D=33.883±0.847。Rt=17.613;ESI-MS(m/z):[M+H]+:565.1。实施例2:(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺(化合物I)的制备将N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺消旋体(R/S异构体比例49.55/50.45,制备方法如专利CN102030742所述)通过半制备手性柱拆分,拆分条件如下:仪器:高效液相色谱仪,紫外检测器;色谱柱:表面涂敷直链淀粉-三(3,5-二甲苯基氨基甲酸酯)硅胶为填充剂(20×250mm);柱温:30℃;流动相:0.2%二乙胺的无水乙醇-正己烷(32:28);检测波长:220nm;流速:1.0ml/min。其中(R)-N-(4-(3-氟苄氧基)3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺先洗脱出来。[a]D=35.016±0.385(HPLC纯度98.93%)。实施例3:(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐(化合物II)的制备将实施例1中所制备的化合物I(4g,7.08mmol)加入10ml四氢呋喃中,搅拌溶解,加入对甲苯磺酸(3.66g,21.02mmol)的乙醇溶液(10ml),迅速析出黄色固体,抽滤,晾干,得到6.04g无定形固体即为(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐(化合物II),收率94.1%。实施例4:(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐(化合物II)晶型A的制备将实施例3中所得化合物II(2g)加入40ml四氢呋喃和5ml水的混合溶液中,加热搅拌溶解后,降温析晶,抽滤,80℃真空烘干,得到1.49g黄色结晶性粉末,收率74.5%,HPLC纯度97.09%;经测定,其X-RPD图谱如图1所示,其DSC-TGA图谱如图2所示。晶型A:1H-NMR(400MHz,DMSO-d6,δppm):11.34(s,1H),9.29(s,2H),9.02(s,1H),8.93(s,1H),8.43(d,1H,J=8.8Hz),7.93(d,1H,J=8.8Hz),7.88(d,1H,J=1.6Hz),7.62(dd,1H,J=1.6Hz,J=8.4Hz),7.49(m,1H),7.48(d,4H,J=7.6Hz),7.34(m,3H),7.25(d,1H,J=2.8Hz),7.22(m,1H),7.10(d,4H,J=7.6Hz),6.89(d,1H,J=1.2Hz),5.32(s,2H),4.47(s,2H),3.48(m,2H),3.24(m,2H),3.06(m,2H),2.66(s,3H),2.28(s,6H).Rt=17.707;[a]D=25.671±0.519。实施例5:(R)-N-(4-(3-氟苄氧基)-3-氯苯基)-6-(5-((2-(甲基亚砜基)乙基氨基)甲基)-2-呋喃基)-喹唑啉-4-胺二甲苯磺酸盐(化合物II)晶型B的制备将实施例3中所得化合物II(2g)加入40ml乙醇和6ml水的混合溶液中,加热搅拌溶解后,降温析晶,抽滤,80℃真空烘干,得到1.62g黄色结晶性粉末,收率81%,HPLC纯度99.37%;经测定,其X-RPD图谱如图3所示,其DSC-TGA图谱如图4所示。晶型B:1H-NMR(400MHz,DMSO-d6,δppm):11.40(s,1H),9.30(s,2H),9.04(s,1H),8.94(s,1H),8.44(d,1H,J=8.8Hz),7.93(d,1H,J=8.4Hz),7.87(d,1H,J=2.0Hz),7.62(dd,1H,J=1.6Hz,J=8.4Hz),7.49(m,1H),7.48(d,4H,J=7.6Hz),7.34(m,3H),7.26(d,1H,J=3.2Hz),7.21(m,1H),7.10(d,4H,J=7.6Hz),6.89(d,1H,J=2.8Hz),5.32(s,2H),4.48(s,2H),3.49(m,2H),3.24(m,2H),3.06(m,2H),2.66(s,3H),2.28(s,6H).Rt=17.656;[a]D=27.112±0.551。通过制备不同晶体,我们发现一个有趣的现象:析出的晶型A的光学纯度与原料(化合物I)的光学纯度近似;析出的晶型B光学纯度更高,高于原料(化合物I)的光学纯度,更易于制备。溶解性试验本发明分别对化合物I、化合物II晶型A、化合物II晶型B的溶解度进行了研究,方法为:取样品化合物化合物I(2.5mg)、化合物II晶型A(250mg)、化合物II晶型B(250mg),置250ml的碘量瓶中,加水定容至250ml,于25℃±2℃下每间隔5分钟强力振摇30秒钟,观察30分钟内的溶解情况。试验结果见表1。表1、溶解度试验测试结果样品名称试验样品质量溶解情况溶解度化合物I2.5mg未全溶不溶化合物II晶型A250mg溶解微溶化合物II晶型B250mg溶解微溶结果表明:化合物I在水中不溶,化合物II的晶型A、B在水中微溶,说明晶型A、B具有更好的溶解性,比化合物I更有利于药物在体内的溶出。生物学试验为更好、更深入地研究本发明所述的式I所示化合物、式II所示化合物晶型A、式II所示化合物晶型B的生物学活性以及药代动力学特点,本发明人以下实验来测定本发明所述化合物在体外对EGFR/HER2高表达癌细胞(A431,SKOV-3,N87细胞和BT474细胞)的增殖抑制作用,以及药代动力学特点。A)细胞增殖抑制试验参考Rusnak等,CellProlif,2007,40,580-594中描述的方法进行试验。细胞增殖抑制试验采用EGFR或HER2过表达的肿瘤细胞株A431、SKOV-3、BT474和NCI-N87。在含10%胎牛血清、2mM谷氨酰胺和非必需氨基酸的Dulbecco改良Eagle培养基(DMEM)中,在37℃、5%CO2细胞培养箱中培养细胞,应用胰蛋白酶/乙二胺四乙酸(EDTA)从细胞培养瓶中收获细胞。细胞以4000/孔(0.1ml培养基)加入96孔细胞培养板贴壁过夜,加入0.1ml待测化合物的稀释液,DMSO的最终浓度为0.25%,将细胞培养板在37℃、5%的CO2条件下培养72h,在显微镜下观察细胞形态的变化,弃去培养液,然后每孔加入10%的三氯乙酸(TCA)固定细胞,4℃放置1h,培养板各孔用去离子水冲洗5遍,以去除TCA,甩干,空气干燥至无湿迹。每孔加质量分数为0.4%的SRB(磺酰罗丹明B)100μl,室温放置20min,弃去各孔内液体后用1%乙酸冲洗5遍,空气干燥后用10mMTris(三羟甲基氨基甲烷,pH为10.5)150μl萃取,检测550nm波长处的吸光度,以化合物浓度的对数值(lg[浓度])为横坐标,抑制率为纵坐标,然后采用GRAPHPADPRISM5软件做剂量-效应曲线拟合,计算得IC50值(nM)。结果见表2。表2细胞增殖抑制试验上述试验结果表明,本发明化合物I、化合物II晶型A、化合物II晶型B是有效的酪氨酸激酶抑制剂,能够实现对EGFR/HER2高表达癌细胞(A431,SKOV-3,NCI-N87和BT474细胞)的增殖抑制,且体外增殖抑制效果近似。B)药代动力学评价:健康SD大鼠9只,雄性,体重200-220g,随机分成3组(每组3只),分别单次灌胃给予式II所示化合物晶型A、式II所示化合物晶型B,给药剂量均为100mg/kg,,药物以10%吐温80加90%去离子水配制。试验前禁食12h,自由饮水。给药后2h统一进食。于给药后0,1.0,3.0,10和24h经大鼠眼球后静脉丛取血0.3ml,置肝素化试管中,以11000rpm速度离心5min,分离血浆,20℃保存。以液相色谱串联质谱法测定血浆中的化合物I及其代谢产物拉帕替尼(Lapatnib)的浓度,考察晶型A和B的药代动力学特征及体内代谢稳定性,结果见表3:表3药物代谢产物的药动学测试*.血浆中检测到的代谢产物Lapatinib以化合物I和活性代谢产物计算,晶型A明显具有更好的吸收和暴露量,同等剂量下,最大血药浓度或药时曲线下面积约为晶型B的1.3倍。预期晶型A比晶型B会有更好的体内抗肿瘤活性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1