一类基于茚并喹啉酮骨架的组蛋白去乙酰化酶抑制剂及其制备方法和应用与流程
本发明涉及医药技术领域,具体涉及一类基于茚并喹啉酮骨架的组蛋白去乙酰化酶抑制剂及其组合物、制备方法和应用。本发明还涉及该类化合物在制备预防或治疗因组蛋白去乙酰化酶表达异常导致的哺乳动物相关疾病的药物中的应用,特别是在癌症、神经变性疾病、病毒感染、炎症、白血病、疟疾和糖尿病等治疗领域中的应用。
背景技术:
据世界卫生组织报告,2012年全球癌症患者和死亡病例都在不断地增加。在肝癌、食道癌、胃癌和肺癌等恶性肿瘤中,中国新增病例和死亡人数均居世界首位。其中,肺癌是最普遍和最致命的的癌症,2012年约新增180万患者,并导致150万人死亡,中国约占此类病例的1/3以上。然而,现有的抗癌药物尚不能取得满意的治疗效果。因此,开发新型作用机制的抗肿瘤药物具有重要意义。
组蛋白的乙酰化对于基因转录具有重要的调控作用。组蛋白乙酰转移酶(HAT)和组蛋白去乙酰化酶(HDAC)是调节这个过程的关键酶。当组蛋白中特定赖氨酸残基的末端氨基被HATs乙酰化后,组氨酸和DNA之间的作用减弱,DNA呈舒展状态,使转录因子容易和DNA结合位点特异性结合,激活转录和复制过程,导致基因表达。当赖氨酸残基在HDACs作用下去乙酰化后,末端氨基被质子化,正电荷密度增加,组蛋白通过静电相互作用和带负电荷的DNA之间作用增强,使染色体紧缩从而造成基因沉默,最终导致转录过程被抑制,刺激肿瘤细胞增殖。
在正常生理条件下组蛋白的乙酰化和去乙酰化过程处于一种动态平衡的状态。当细胞发生转化时,HDACs异常表达,去乙酰化作用增强,改变了稳态平衡,DNA呈紧缩状态,阻止基因表达,降低肿瘤抑制基因的活性(如p21,p27),造成无限制的细胞增殖,从而导致肿瘤的产生。
HDAC家族在细胞生长,分化,代谢,凋亡等各个方面都有重要的功能。目前发现HDACs有18个亚型,主要分成I、II、III、IV四个家族。其中I家族 包括HDAC 1、2、3、8四种亚型,在许多肿瘤细胞株中都普遍表达,因而更受重视。IIa家族主要有HDAC 4、5、7、9四种亚型,IIb家族有两个催化区域,主要有HDAC 6、10两种亚型,IV家族只有HDAC 11一种亚型,其中I家族位于细胞核中,其他的II、IV家族在细胞核和细胞质中都存在。I、II、IV家族的HDAC都是Zn2+依赖酶,而III类家族属于NAD+依赖的蛋白酶。
研究发现在许多肿瘤细胞中都存在某些HDAC亚型高表达,主要表现为I家族(1、2、3、8)和IIb家族HDAC 6亚型的高表达。如在结肠癌中HDAC 1、2、3、8亚型高表达,胃癌中HDAC 1、2、3亚型高表达,乳腺癌中HDAC 4、6亚型高表达,这也证实了HDACs的活性与癌症的发生有关,因此HDACs成为一个非常有前景的抗肿瘤药靶而日益引起重视。
HDAC抑制剂通过抑制HDAC,增加组蛋白乙酰化程度,使得它们在细胞核内堆积,增加肿瘤抑制基因的活性,激活一些下游效应,包括肿瘤细胞的凋亡、分化和增殖的减少,从而达到抗肿瘤的目的。
HDAC抑制剂主要有异羟肟酸类、苯甲酰胺类、环肽类、短链脂肪酸类。目前已上市和临床研究阶段的HDAC抑制剂有三十多种,其中异羟肟酸类是研究最广泛的HDAC抑制剂。TSA(Trichostatin A)是最早研究的异羟肟酸类HDAC抑制剂,虽已退出临床研究,但TSA仍常作为对照药用于化合物活性评价。对TSA结构优化得到活性较好的伏立诺他(vorinostat,Zolina,SAHA),是广谱的HDAC抑制剂,对I家族的亚型都有效,2006年FDA批准上市,用于治疗转移性皮肤T细胞淋巴瘤(CTCL)。2014年FDA批准上市的贝利诺他(Belinostat,PXD-101)用于外周T细胞淋巴瘤(PTCL)的治疗,但存在心电图QT间期延长的副作用。环肽化合物Romidepsin(FK228,Istodax)选择作用于I家族的各种亚型,2009年FDA批准上市,用于皮肤及外周T细胞淋巴瘤。
HDAC抑制剂具有抗瘤谱广、抗耐药等优势,目前这类药物跟其他药物合用有着广阔的前景。Romidepsin已被FDA认证其罕用药地位,与索拉非尼合用,用于治疗原发性肝细胞癌,显著延长生存期。Entinostat与依西美坦联合,FDA已批准为突破性疗法,用于治疗雌激素受体阳性的转移性乳腺癌。
然而,许多HDAC抑制剂都存在较严重的心脏毒性,有研究发现上市的Romidepsin可以影响人hERG。贝利诺他(Belinostat,PXD-101)等也都存在导致心电图QT间期延长的副作用,因此,发展新型、有效的HDAC抑制剂仍然 是抗肿瘤药物研究领域具有挑战性的课题。
技术实现要素:
本发明目的是为了提供一类新型HDAC抑制剂及其药学上可接受的盐。本发明同时公开了该类化合物的制备方法、医疗用途和组合物。
在本发明的第一方面,提供了一类通式(I)或(II)所示的基于茚并喹啉酮骨架的化合物或其药学上可接受的盐、溶剂化物、前体药物或多晶型物:
式中,
R1的取代位置可位于1至4位,可以是单、双或多取代;R2的取代位置可位于7至10位,可以是单、双或多取代;所述的R1、R2取代基为下列基团中的任一类:a)氢;b)取代或未取代的C1-8的直链或支链烷氧基;c)取代或未取代的C1-8的直链或支链烷基;d)取代或未取代的C2-6的直链或支链的烯基;e)取代或未取代的C2-6的直链或支链的炔基;f)取代或未取代的C1-8的直链或支链烷酰胺基;g)取代或未取代的芳基或5-6元杂环芳基;h)取代或未取代的C1-8的直链或支链烷酰基;i)取代或未取代的C1-8的直链或支链烷酰氧基;j)硝基;k)氨基;l)羟基;m)卤素;n)亚甲二氧基;o)亚乙二氧基;p)氰基;
A为-(CH2)m-或-(CH2=CH2)n-,其中m=2-8,n=1-4;
所述的取代是指被下列一个或多个取代基所取代:C1-5烷基、C2-5烯基、C2-5炔基、C1-5烷氧基、卤素、硝基、氰基、羟基、氨基、羧基和氧代。
在另一优选例中,如上所述的化合物,R1的取代位置可位于2和3位中的任一个或两个;和/或R2的取代位置可位于8和9位中的任一个或两个。
在另一优选例中,如上所述的化合物,R1、R2取代基为下列基团中的任一类:a)氢;b)C1-8的直链或支链烷氧基;c)C1-8的直链或支链烷基;d)卤素。
在另一优选例中,如上所述的化合物,A为-(CH2)m-,其中m=2-6。
在另一优选例中,如上所述的化合物,R1为氢;R2位于9位,为甲基、卤素、甲氧基或氢中的任一种;A为-(CH2)6-。
在另一优选例中,所述化合物为下述化合物中的任一种:
N-羟基-7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺;
N-羟基-7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺;
N-羟基-6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酰胺;
N-羟基-5-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)戊酰胺;
N-羟基-4-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)丁酰胺;
N-羟基-7-(9-甲基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺;
N-(2-氨基苯基)-7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺;
N-(2-氨基苯基)-6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酰胺。
在本发明的第二方面,提供了一种组合物,它含有安全有效量的本发明第一方面所述的化合物或其药学上可接受的盐及药学上可接受的载体。在另一优选例中,所述的组合物为药物组合物。
在本发明的第三方面,提供了第一方面所述的化合物在制备预防或治疗因组蛋白去乙酰化酶表达异常导致的哺乳动物相关疾病药物中的应用。
在另一优选例中,所述的疾病为癌症、神经变性疾病、病毒感染、炎症、白血病、疟疾和糖尿病中的任一种。更优选地,所述的癌症为肺癌、结肠癌、乳腺癌或肝癌中的任一种。
在本发明的第四方面,提供了第一方面所述的式(I)化合物的制备方法,包括下列步骤:
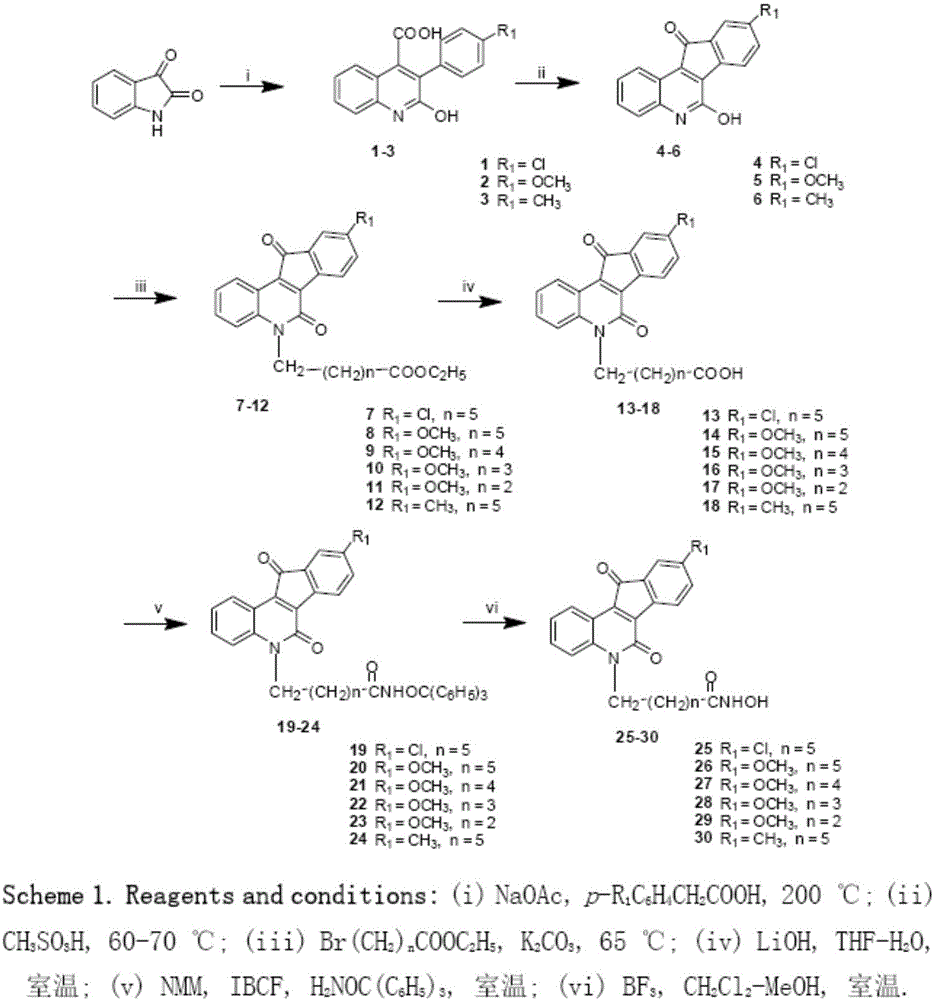
靛红在无水乙酸钠催化下与对位取代的苯乙酸反应生成3-取代苯基-2-羟基喹啉-4-羧酸,再在多聚磷酸作用下发生分子内脱水环合,生成9-位取代的6-羟基-11H-茚[1,2-c]喹啉-11-酮。该中间体和不同长度的ω-溴代脂肪羧酸乙酯生成5位-N上取代的酯,再在碱性条件下水解得到相应的酸。该酸在N-甲基吗啉存在下和氯甲酸异丁酯、三苯甲基羟胺反应生成三苯甲基保护的异羟肟酸中间体,最后在三氟化硼催化下水解为异羟肟酸的目标化合物。合成路线如图2所示。
在本发明的第四方面,还提供了第一方面所述的式(II)化合物的制备方法,包括下列步骤:
靛红在无水乙酸钠催化下与4-甲氧基苯乙酸反应生成3-(4-甲氧基苯基)-2-羟基喹啉-4-羧酸,在多聚磷酸作用下发生分子内环合,生成9-甲氧基-6-羟基-11H-茚并[1,2-c]喹啉-11-酮,所得化合物继续和不同长度的ω-溴代脂肪羧酸乙酯反应生成5-N上取代的酯,在LiOH作用下水解得到相应的酸。该酸在缩合剂作用下和邻苯二胺反应生成式(II)所示的目标化合物,合成路线如图3所示。
本发明涉及的药用组合物,含有安全有效量的上述目标化合物及药学上可接受的载体。可以是固体形式或是液体形式,所述的药物剂型可以是片剂、胶囊、粉末剂、颗粒剂、混悬剂、或注射剂。当本发明化合物用于上述用途时,可与一种或多种药学上可接受的载体或赋形剂混合,如溶剂、稀释剂等,而且可以用如下形式口服给药:片剂、丸剂、胶囊、可分散的粉末、颗粒或悬浮液(含有如约0.05-5%悬浮剂)、糖浆(含有如约10-50%糖)、和酏剂(含有约20-50%乙 醇),或以外用方式给药:软膏剂、凝胶、含药胶布等,或者以无菌可注射溶液或悬浮液形式(在等渗介质中含有约0.05-5%悬浮剂)进行非肠胃给药。例如,这些药物制剂可含有与载体混合的约0.01-99%,更佳地约为0.1%-90%(重量)的活性成分。
“安全有效量”指的是:化合物的量足以改善病情,而不至于产生严重的副作用。安全有效量根据治疗对象的年龄、病情、疗程等来确定。
“药学上可接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指代是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的疗效。药学上可接受的载体部分例子有糖(如葡萄糖、蔗糖、乳糖等),淀粉(如玉米淀粉、马铃薯淀粉等),纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等),明胶,滑石粉,固体润滑剂(如硬脂酸钠、硬脂酸镁),硫酸钙,植物油(如豆油、芝麻油、花生油、橄榄油等),多元醇(如丙二醇、甘油、甘露醇、山梨醇等),乳化剂(如吐温类)、润湿剂(如十二烷基磺酸钠),着色剂,调味剂,稳定剂,抗氧化剂,防腐剂,无热原水等。
本发明的化合物,经过抑酶活性测试,发现均有较强的抑制HDAC的活性。此外,还测试了部分化合物对四种人肿瘤细胞:A549(人肺癌细胞)、HCT116(人结肠癌细胞)、MDA-MB-231(人乳腺癌细胞)和BEL7404(人肝癌细胞)的体外细胞增殖抑制作用,结果显示本发明的目标化合物具有了良好的广谱抗肿瘤作用。此外,本发明的化合物可以单用,也可以和现有的药物合用,以取得更好的效果。
附图说明
图1含有茚并喹啉酮结构的HDAC抑制剂的结构通式(I)和(II);
图2式(I)化合物的合成路线图。
图3式(II)化合物的合成路线图。
具体实施方式
下面结合具体实施例,进一步阐明本发明。应理解仅用于说明发明而不用于限制本发明的范围。下列实施中注明具体条件的实施方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分 比和重量份数。
核磁共振仪(CDCl3或DMSO-d6为氘代试剂,含0.03%TMS)(型号:Bruker Avance 300产地:德国);质谱仪(型号:API-3000LC-MS产地:美国);红外光谱仪(KBr压片)(型号:Perkin-Elmer Spectrum 1600FTIR产地:美国);显微熔点仪(温度计未经校正)(型号:XT4A产地:北京市科仪电光仪器厂)。中压制备液相(型号:Compact Avance 300产地:利穗科技有限公司,中国),实验中所用试剂均为分析纯,购于国药集团化学试剂公司。柱层析所用硅胶为300-400目(产地:青岛海洋化工所)。薄层色谱板为GF254硅胶板(产地:烟台江友硅胶开发有限公司)。所有目标化合物的结构均经过1H NMR、ESI-MS、IR的确证。
实施例1
3-(4-氯苯基)-2-羟基喹啉-4-羧酸的制备(1)
在100mL三颈烧瓶中加入颠红(5.51g,0.0375mol)、无水乙酸钠(1.24g,0.0151mol)和对氯苯乙酸(11.18g,0.0656mol)混匀后,于200℃加热回流3h至TLC检测反应结束。向反应液中加入10%氢氧化钠(200mL)使其溶解,过滤,滤液用二氯甲烷洗涤(3×80mL),分出水层,水层用冰醋酸调pH 5-6,过滤,滤液再用浓盐酸调pH 1-2,过滤析出的固体,水洗,抽干,得白色的固体1(8.87g,79.1%)。
1H NMR(300MHz,DMSO-d6):δ12.22(s,1H),7.59(t,J=7.7Hz,1H),7.49(d,J=8.4Hz,3H),7.42-7.35(m,3H),7.26(t,J=8.0Hz,1H).
3-(4-甲氧基苯基)-2-羟基喹啉-4-羧酸(2)
靛红和4-甲氧基苯乙酸反应生成白色固体2,合成方法同上。1H NMR(300MHz,DMSO-d6):δ12.14(s,1H),7.58(t,J=7.7Hz,1H),7.49(d,J=8.0Hz,1H),7.40(d,J=8.3Hz,1H),7.36(d,J=8.6Hz,2H),7.27(t,J=7.6Hz,1H),7.00(d,J=8.6Hz,2H),3.82(s,3H).
3-(4-甲基苯基)-2-羟基喹啉-4-羧酸(3)合成方法同上。
实施例2
9-氯-6-羟基-11H-茚并[1,2-c]喹啉-11-酮的制备(4)
在100mL圆底烧瓶中加入多聚磷酸(21.95g,0.065mol)和3-(4-氯苯 基)-2-羟基喹啉-4-羧酸1(2.75g,0.0097mol),130℃加热回流至TLC监测反应结束。将反应液倒入冰水中,搅拌,静置后析出固体,过滤,水洗至中性,得红棕色固体4(2.22g,81.9%),直接用于下步反应。ESI-MS(m/z):280.40([M-H]-,100%)。
中间体5、6的合成方法同上。
实施例3
7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸乙酯(7)的制备
在100mL圆底烧瓶中加入9-氯-6-羟基-11H-茚并[1,2-c]喹啉-11-酮(4)(1.41g,0.005mol)、7-溴庚酸乙酯(1.36g,0.0055mol)和无水碳酸钾(1.66g,0.012mol)溶于DMF(24mL)中,60℃加热搅拌反应至TLC监测反应结束。将反应液过滤,滤饼用CH2Cl2洗至无色,滤液用水洗涤,无水Na2SO4干燥,过滤,浓缩至干得黑红色粗品。该粗品用中压制备液相分离,得橘红色固体7(0.47g)。
1H NMR(300MHz,CDCl3):δ8.71(dd,J=8.0,1.5Hz,1H),8.07(d,J=7.9Hz,1H),7.62(ddd,J=8.7,7.2,1.6Hz,1H),7.56(d,J=1.8Hz,1H),7.48(dd,J=7.9,2.0Hz,1H),7.40(d,J=8.6Hz,1H),7.34(t,J=7.6Hz,1H),4.38(t,J=7.5Hz,2H),4.14(q,J=7.1Hz,2H),2.33(t,J=7.4Hz,2H),1.88-1.75(m,2H),1.74-1.65(m,2H),1.59-1.51(m,2H),1.46(m,2H),1.27(t,J=7.1Hz,3H).IR(KBr)cm-1:2926,2851,1725,1649,1590,1557,1446,1282,1168,761,739.
其他中间体8-12的合成路线同上。
7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸乙酯(8)
红褐色固体。1H NMR(300MHz,CDCl3):δ8.69(d,J=7.8Hz,1H),8.00(d,J=8.2Hz,1H),7.56(t,J=7.4Hz,1H),7.31-7.39(m,2H),7.18(d,J=2.1Hz,1H),6.94(dd,J=8.2,2.2Hz,1H),4.37(t,J=7.5Hz,2H),4.14(q,J=7.1Hz,2H),3.88(s,3H),2.33(t,J=7.3Hz,2H),1.82-1.76(m,2H),1.72-1.66(m,2H),1.57-1.42(m,4H),1.27(t,J=7.1Hz,3H).IR(KBr)cm-1:2927,2858,1716,1650,1604,1579, 1482,1446,1277,1241,751.
6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酸乙酯(9)
红褐色固体。1H NMR(300MHz,CDCl3):δ8.69(d,J=6.8Hz,1H),7.99(d,J=8.1Hz,1H),7.55(t,J=7.3Hz,1H),7.38–7.33(m,1H),7.30(d,J=7.6Hz,1H),7.18(d,J=2.4Hz,1H),6.93(dd,J=8.1,2.4Hz,1H),4.38(t,J=6.5Hz,2H),4.13(q,J=7.1Hz,2H),3.87(s,3H),2.35(t,J=7.3Hz,2H),1.87-1.80(m,2H),1.78-1.70(m,2H),1.58-1.53(m,2H),1.26(t,J=7.1Hz,3H).
5-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)戊酸乙酯(10)
红褐色固体。1H NMR(300MHz,DMSO-d6):δ8.49(d,J=7.7Hz,1H),7.75(d,J=8.3Hz,1H),7.62(dd,J=7.5,4.5Hz,2H),7.50(t,J=7.2Hz,1H),7.16(d,J=2.4Hz,1H),7.08(dd,J=8.2,2.4Hz,1H),4.54(t,J=6.1Hz,2H),4.05(q,J=7.1Hz,2H),3.83(s,3H),2.43(t,J=7.1Hz,2H),1.92-1.85(m,2H),1.84-1.74(m,2H),1.16(t,J=7.1Hz,3H).IR(KBr)cm-1:2960,2917,2851,2833,1719,1649,1580,1477,1433,1222,1206,751.
4-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)丁酸乙酯(11)
红褐色固体。1H NMR(300MHz,CDCl3):δ8.68(d,J=7.7Hz,1H),7.98(d,J=8.1Hz,1H),7.67–7.53(m,2H),7.36–7.28(m,1H),7.17(d,J=2.4Hz,1H),6.93(dd,J=8.1,2.5Hz,1H),4.45(t,J=6.5Hz,2H),4.20(q,J=7.1Hz,2H),3.87(s,3H),2.55(t,J=6.8Hz,2H),2.24–1.99(m,2H),1.30(t,J=7.1Hz,3H).
7-(9-甲基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸乙酯(12)
红褐色固体。1H NMR(300MHz,DMSO-d6):δ8.53(d,J=7.9Hz,1H),7.85(d,J=7.4Hz,1H),7.66-7.63(m,2H),7.40–7.33(m,3H),4.33(t,J=7.5Hz,2H),4.04(q,J=7.1Hz,2H),2.35(s,3H),2.29(t,J=7.3Hz,2H),1.72-1.60(m,2H),1.57-1.50(m,2H),1.41–1.32(m,4H),1.17(t,J=7.1Hz,3H).
实施例4
7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸的制备(13)
在100mL圆底烧瓶中加入7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸乙酯(7)(0.219g,0.5mmol)、氢氧化锂一水合物(0.0882g,2.1mmol)溶于THF(20mL)和水(8mL)中,室温搅拌反应至TLC监测反应完全。将反应液用稀盐酸调pH至中性,旋去溶剂,有固体析出,过滤,水洗,抽干,得红褐色固体13(0.19g,93.8%)。1H NMR(300MHz,DMSO-d):δ11.99(s,1H),8.51(d,J=8.1Hz,1H),7.97(d,J=7.9Hz,1H),7.67(d,J=2.6Hz,2H),7.66-7.58(m,2H),7.41-7.34(m,1H),4.33(t,J=7.5Hz,2H),2.20(t,J=7.2Hz,2H),1.69-1.58(m,2H),1.55-1.47(m,2H),1.46-1.31(m,4H).ESI-MS(m/z):410.29([M+H]+,100%).IR(KBr)cm-1:3421,2920,2852,1722,1648,1590,1577,1558,1449,1420,1290,762,738.
其他中间体14-18的合成路线同上。
7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸(14)
1H NMR(300MHz,DMSO-d6):δ12.01(s,1H),8.47(d,J=7.9Hz,1H),7.84(d,J=8.1Hz,1H),7.61(d,J=3.6Hz,2H),7.33(dt,J=8.0,4.0Hz,1H),7.11(d,J=2.3Hz,1H),7.04(dd,J=8.1,2.4Hz,1H),4.29(t,J=7.5Hz,2H),3.81(s,3H),2.20(t,J=7.2Hz,2H),1.66-1.58(m,2H),1.55-1.47(m,2H),1.44-1.31(m,4H).IR(KBr)cm-1:2924,2852,1718,1647,1577,1432,1293,1221,753.
6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酸(15)
1H NMR(300MHz,DMSO-d6):δ12.04(s,0H),8.52(d,J=8.0Hz,1H),7.89(d,J=8.1Hz,1H),7.65(d,J=3.6Hz,2H),7.38(dd,J=7.9,4.0Hz,1H),7.17(d,J=2.2Hz,1H),7.09(dd,J=8.2,2.1Hz,1H),4.34(t,J=6.5Hz,2H),3.85(s,3H),2.24(t,J=7.1Hz,2H),1.71-1.63(m,2H),1.62-1.55(m,2H),1.49-1.42(m,2H).IR(KBr)cm-1:3199,2974,2932,2862,1718,1632,1588,1558,1490,1448,1386,1283,752.
5-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)戊酸(16)
1H NMR(300MHz,DMSO-d6):δ12.06(s,1H),8.48(d,J=8.0Hz,1H),7.85(d,J=8.1Hz,1H),7.62(d,J=2.2Hz,2H),7.38-7.30(m,1H),7.13(d,J=2.1Hz,1H),7.06(dd,J=8.1,2.3Hz,1H),4.33(t,J=6.0Hz,2H),3.82(s,3H),2.29(t,J=6.6Hz,2H),1.68-1.62(m,4H).IR(KBr)cm-1:2947,2855,1702,1652,1595,1579,1481,1448,1277,1238,752
4-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)丁酸(17)
1H NMR(300MHz,DMSO-d6):δ12.20(s,1H),8.45(d,J=8.0Hz,1H),7.82(d,J=8.1Hz,1H),7.71(d,J=8.7Hz,1H),7.60(t,J=7.8Hz,1H),7.32(t,J=7.5Hz,1H),7.10(s,1H),7.03(dd,J=8.1,1.8Hz,1H),4.32(t,J=6.5Hz,2H),3.81(s,3H),2.41(t,J=7.1Hz,2H),1.91-1.80(m,2H).IR(KBr)cm-1:3178,2980,2935,2837,1721,1634,1574,1558,1492,1449,1286,1247,752.
7-(9-甲基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸(18)
1H NMR(300MHz,DMSO-d6):δ11.99(s,1H),8.54(d,J=8.2Hz,1H),7.86(d,J=7.4Hz,1H),7.67-7.64(m,2H),7.41-7.34(m,3H),4.33(t,J=6.5Hz,2H),2.35(s,3H),2.22(t,J=7.2Hz,2H),1.72-1.59(m,2H),1.57-1.50(m,2H),1.48-1.33(m,4H).
实施例5
7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)庚酰胺(19)
在50mL圆底烧瓶中加入7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸(13)(0.267g,0.4mmol),加入THF(20mL),加入N-甲基吗啉(0.051mL,0.4mmol),冷却至-15℃搅拌5min。将氯甲酸异丁酯(0.051mL,0.4mmol)加入反应液中-15℃搅拌10min,再加入O-三苯甲基羟胺(0.11g,0.4mmol)和N-甲基吗啉(0.128mL,1.0mmol)-15℃搅拌10min。室温搅拌反应至TLC监测反应完全。反应液旋去THF,加入CH2Cl2(100mL)和H2O(100mL),分出CH2Cl2层,依次用H2O、5%NaHCO3、H2O各洗涤一次,再用饱和食盐水洗涤,分出有机层,无水Na2SO4干燥,过滤,滤液浓缩至干,粗品用CH2Cl2-MeOH重结晶,得红色固体13(0.07g,26.5%)。mp 182-183℃.1H NMR (300MHz,DMSO-d6):δ10.17(s,1H),8.49(d,J=7.6Hz,1H),7.94(d,J=7.9Hz,1H),7.68(d,J=7.5Hz,1H),7.63(d,J=2.1Hz,2H),7.60(d,J=2.0Hz,1H),7.57(d,J=1.8Hz,1H),7.35-7.27(m,15H),4.26(t,J=6.2Hz,2H),1.78(t,J=6.8Hz,2H),1.58-1.49(m,2H),1.29-1.15(m,4H),1.06-0.97(m,2H).ESI-MS(m/z):665.22([M-H]-,100%),1355.24([2M+Na]+,100%).
其他中间体20-24的合成路线同上。
7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)庚酰胺(20)
1H NMR(300MHz,DMSO-d6):δ10.16(s,1H),8.50(d,J=8.4Hz,1H),7.88(d,J=8.1Hz,1H),7.62(d,J=5.5Hz,2H),7.39-7.25(m,16H),7.15(d,J=2.4Hz,1H),7.07(dd,J=8.2,2.4Hz,1H),4.27(t,J=6.5Hz,2H),3.83(s,3H),1.78(t,J=7.6Hz,2H),1.58-1.49(m,2H),1.30-1.16(m,4H),1.06-0.97(m,2H).ESI-MS(m/z):661.12([M-H]-,100%).IR(KBr)cm-1:3146,2936,2861,1722,1650,1609,1578,1485,1446,1275,1224,756,702.
6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)己酰胺(21)
1H NMR(300MHz,DMSO-d6):δ10.18(s,1H),8.50(d,J=7.9Hz,1H),7.87(d,J=8.1Hz,1H),7.63-7.56(m,2H),7.37-7.29(m,16H),7.14(d,J=2.3Hz,1H),7.07(dd,J=8.1,2.4Hz,1H),4.23(t,J=6.1Hz,2H),3.84(s,3H),1.81(t,J=7.5Hz,2H),1.56-1.47(m,2H),1.36-1.28(m,2H),1.21-1.13(m,2H).ESI-MS(m/z):647.23([M-H]-,100%),1319.38([2M+Na]+,100%).
5-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)戊酰胺(22)
1H NMR(300MHz,DMSO-d6):δ10.25(s,1H),8.51(d,J=8.3Hz,1H),7.77(d,J=8.6Hz,1H),7.63(t,J=8.1Hz,2H),7.55–7.48(m,1H),7.33-7.21(m,16H),7.08(d,J=8.1Hz,1H),4.42(t,J=6.4Hz,2H), 3.84(s,3H),1.91(t,J=5.9Hz,2H),1.62-1.53(m,2H),1.52-1.41(m,2H).ESI-MS(m/z):633.12([M-H]-,100%).IR(KBr)cm-1:3420,2921,2851,1722,1656,1609,1579,1477,1448,1292,1224,750,702.
4-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)丁酰胺(23)
1H NMR(300MHz,DMSO-d6):δ10.37(s,1H),8.48(d,J=8.0Hz,1H),7.83(d,J=8.0Hz,1H),7.61(t,J=7.5Hz,1H),7.45(d,J=8.9Hz,1H),7.39-7.20(m,16H),7.14(d,J=1.6Hz,1H),7.06(d,J=8.3Hz,1H),4.00(t,J=6.1Hz,2H),3.82(s,3H),1.98(t,J=6.5Hz,2H),1.68-1.55(m,2H).ESI-MS(m/z):619.14([M-H]-,100%).
7-(9-甲基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)庚酰胺(24)
1H NMR(300MHz,DMSO-d6):δ10.19(s,1H),8.52(d,J=7.8Hz,1H),7.84(d,J=7.4Hz,1H),7.64-7.59(m,2H),7.41-7.37(m,3H),7.35-7.25(m,15H),4.27(t,J=6.5Hz,2H),2.33(s,3H),1.77(t,J=6.1Hz,2H),1.59–1.50(m,2H),1.25–1.18(m,4H),1.05–0.97(m,2H).ESI-MS(m/z):669.41([M+Na]+,18%),1315.43([2M+Na]+,100%).
实施例6
N-羟基-7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺(25)
取7-(9-氯-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)-N-(三苯甲氧基)庚酰胺(19)(0.053g,0.08mmol),溶于CH2Cl2-MeOH(1:1)(14mL)中,加入BF3-Et2O溶液(0.17mL),室温搅拌反应至TLC监测反应完全。加入H2O(80mL)和10%MeOH的CH2Cl2溶液(100mL)终止反应,分出水层,用饱和NaHCO3调节pH 8-9,水层用10%MeOH的CH2Cl2溶液萃取三次,合并有机层,用饱和食盐水洗涤,无水Na2SO4干燥,过滤,滤液浓缩至干,滤饼加CH2Cl2(20mL)粉碎,过滤,洗涤,抽干得红色固体25(0.12g,35.7%),mp 180-182℃.
1H NMR(300MHz,DMSO-d6):δ10.35(s,1H),8.66(s,1H),8.51(d,J=7.8Hz,1H),7.97(d,J=7.7Hz,1H),7.70-7.58(m,4H),7.42-7.35(m,1H),4.33(t,J=7.4Hz,2H),1.95(t,J=7.2Hz,2H),1.70 -1.59(m,2H),1.53-1.46(m,2H),1.46-1.40(m,2H),1.35-1.28(m,2H).ESI-MS(m/z):423.17([M-H]-,100%),871.07([2M+Na]+,100%).IR(KBr)cm-1:3238,2921,2852,1719,1651,1576,1446,1421,754,739.
其他目标化合物26-30的合成路线同上。
N-羟基-7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺(26)
红色固体,mp 188-190℃.1H NMR(300MHz,DMSO-d6):δ10.36(s,1H),8.68(s,1H),8.49(d,J=7.6Hz,1H),7.86(d,J=8.0Hz,1H),7.66-7.59(m,2H),7.36(d,J=6.5Hz,1H),7.15-7.11(m,1H),7.07(d,J=7.8Hz,1H),4.31(t,J=6.5Hz,2H),3.84(s,3H),1.97(t,J=7.1Hz,2H),1.69-1.61(m,2H),1.56-1.48(m,2H),1.48-1.40(m,2H),1.38-1.31(m,2H).ESI-MS(m/z):419.44([M-H]-,100%),863.27([2M+Na]+,100%).IR(KBr)cm-1:3251,2928,2854,1720,1648,1578,1479,1446,1280,1222,1041,754.
N-羟基-6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酰胺(27)
红色固体.1H NMR(300MHz,DMSO-d6):δ10.33(s,1H),8.66(s,1H),8.50(d,J=7.9Hz,1H),7.87(d,J=8.2Hz,1H),7.62(d,J=3.5Hz,2H),7.39-7.32(m,1H),7.15(d,J=2.0Hz,1H),7.07(d,J=8.1Hz,1H),4.31(t,J=6.1Hz,,2H),3.83(s,3H),1.96(t,J=7.1Hz,2H),1.63-1.57(m,4H),1.46-1.37(m,2H).ESI-MS(m/z):407.39([M+H]+,100%).
N-羟基-5-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)戊酰胺(28)
红褐色固体,mp 207-209℃.1H NMR(300MHz,DMSO-d6):δ10.35(s,1H),8.67(s,1H),8.50(d,J=7.8Hz,1H),7.87(d,J=8.2Hz,1H),7.63(d,J=4.3Hz,2H),7.35(t,J=7.8Hz,1H),7.15(d,J=2.2Hz,1H),7.07(dd,J=8.1,2.3Hz,1H),4.34(t,J=6.5Hz,2H),3.83(s,3H),2.02(t,J=6.1Hz,2H),1.68-1.61(m,4H).ESI-MS(m/z):391.16([M-H]-, 100%)),807.15([2M+Na]+,100%).IR(KBr)cm-1:3270,2931,2865,1720,1646,1578,1485,1445,1281,1248,1020,757.
N-羟基-4-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)丁酰胺(29)
红色固体.1H NMR(300MHz,DMSO-d6):δ10.45(s,1H),8.77(s,1H),8.50(d,J=7.7Hz,1H),7.86(d,J=7.6Hz,1H),7.68(d,J=7.9Hz,2H),7.42-7.32(m,1H),7.14(s,1H),7.07(dd,J=8.2,1.9Hz,1H),4.33(t,J=6.5Hz,1H),3.83(s,3H),2.07(t,J=7.1Hz,2H),1.95-1.79(m,2H).ESI-MS(m/z):379.33([M+H]+,98%),779.12([2M+Na]+,100%).
N-羟基-7-(9-甲基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺(30)
桔红色固体,mp 177-179℃.1H NMR(300MHz,DMSO-d6):δ10.38(s,1H),8.55(d,J=8.2Hz,1H),7.87(d,J=7.7Hz,1H),7.69–7.65(m,2H),7.45–7.35(m,4H),4.38–4.30(m,2H),2.36(s,3H),1.98(t,J=8.3Hz,2H),1.71–1.63(m,2H),1.57–1.50(m,2H),1.48–1.41(m,2H),1.38–1.31(m,2H).ESI-MS(m/z):405.45([M+H]+,48%),831.14([2M+Na]+,100%).
实施例7
N-(2-氨基苯基)-7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酰胺的制备(31)
在100mL圆底烧瓶中加入7-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)庚酸(14)(0.081g,0.2mmol)溶于DMF(12mL),加入DIPEA(0.104mL),HATU(0.084g,0.22mmol)和邻苯二胺(0.068g,0.6mmol),室温搅拌反应至TLC监测反应完全。向反应液中加入CH2Cl2和H2O各100mL,振摇后分出有机层,依次用H2O、5%NaHCO3、饱和食盐水洗涤,有机层用无水Na2SO4干燥,过滤,滤液旋干后得红褐色的固体31,mp 194-196℃.1H NMR(300MHz,DMSO-d6):δ9.08(s,1H),8.49(d,J=8.0Hz,1H),7.87(d,J= 8.1Hz,1H),7.62(d,J=3.4Hz,2H),7.35(dd,J=10.2,5.8Hz,1H),7.18-7.11(m,2H),7.06(dd,J=8.2,2.5Hz,1H),6.87(t,J=7.0Hz,1H),6.69(d,J=6.9Hz,1H),6.52(t,J=7.5Hz,1H),4.80(s,2H),4.33(t,J=6.5Hz,2H),3.82(s,3H),2.32(t,J=7.3Hz,2H),1.71-1.56(m,4H),1.50-1.35(m,4H).ESI-MS(m/z):496.44([M+H]+,100%).IR(KBr)cm-1:3418,3348,3282,2939,2853,1721,1650,1592,1578,1485,1459,751.
N-(2-氨基苯基)-6-(9-甲氧基-6,11-二氧-6,11-二氢-5H-茚并[1,2-c]喹啉-5-基)己酰胺(32)
合成方法同上,得红褐色的固体32,mp 191-192℃.1H NMR(300MHz,DMSO-d6):δ9.11(s,1H),8.47(d,J=8.2Hz,1H),7.85(d,J=8.1Hz,1H),7.61(d,J=4.6Hz,2H),7.33(t,J=5.6Hz,1H),7.16-7.09(m,2H),7.05(dd,J=8.2,2.4Hz,1H),6.88(t,J=7.5Hz,1H),6.70(d,J=7.9Hz,1H),6.51(t,J=7.4Hz,1H),4.95(s,2H),4.33(t,J=6.5Hz,,2H),3.82(s,3H),2.33(t,J=7.2Hz,2H),1.72-1.64(m,4H),1.51-1.45(m,2H).ESI-MS(m/z):482.44([M+H]+,100%).IR(KBr)cm-1:3407,3348,3267,2919,2851,1722,1648,1592,1578,1484,1459,750.
实施例8:体外抑酶活性研究
考察目标化合物对HDAC活性的抑制作用,以及不同碳链长度的异羟肟酸和邻苯二胺侧链对HDAC活性的影响。
1)实验材料
384孔板(购于Perkin Elmer,Cat.No.6007279);HDAC 1,2,3,4,5,6,7,8,9,10,11(购于BPS Bioscience,USA,Cat.No.50051,50004,50006,50008,50060,50011);SAHA(Sigma,Cat.No.SML0061);CUDC-907(TRC,Cat.No.C834510);TSA(Sigma,Cat.No.T8552-5MG);TMP269(XCESSBIO,Cat.No.M60119-2s)。
2)实验方法
将待测化合物转移到384孔板中用100%DMSO连续稀释化合物3-4倍,另在两个空的孔中加入100%DMSO 30μL,分别作为不加酶和化合物的对照和不 加化合物的对照。从源板中转移事先准备的化合物的DMSO稀溶液0.25μL到384孔的试验板中。在试验缓冲液中分别制备酶溶液和加入胰蛋白酶、乙酰化肽底物的底物溶液。将酶溶液0.25μL转移到试验板中或者对于低对照,转移15μL酶溶液到试验板中。室温孵化15min后,加10μL底物溶液到每孔中以诱发反应。室温培养60min,在355nm激发波长和460nm发射波长的最大吸光度。绘制拟合曲线,用公式(1)计算抑制率,用公式(2)计算出IC50。
抑制率%=(最大信号-本底)/(最大-最小)*100 (1)
Equation(1):Inh%=(Max-Signal)/(Max-Min)*100
Y%=Bottom+(Top-Bottom)/(1+10^((LogIC50-X)*Hill Slope)) (2)
Y是抑制率,X是化合物的浓度
3)实验结果
A.目标化合物对HDAC1的抑制活性结果见表1。
SAHA、TSA为异羟肟酸类化合物的阳性对照,MS275是邻苯二胺类化合物的阳性对照。
表1.目标化合物对HDAC1的抑酶活性
体外抑酶实验结果表明,化合物25、26对HDAC 1都表现出较强的抑制活性,其IC50分别为4.5nM和0.77nM。这两个化合物对HDAC 1的抑制作用都要强于阳性对照药SAHA,分别是SAHA的1.9和11.2倍。
B.选取抑酶活性较好的化合物26,考察其对HDAC亚型的作用。
化合物26对HDAC 1、2、3、6、8、10亚型的抑酶活性结果见表2,其中SAHA和TSA为阳性对照。化合物26对HDAC 4、5、7、9、11亚型的抑酶活性结果见表3,其中TMP-269和CUDC-907为阳性对照。
表2.化合物26对HDAC 1、2、3、6、8、10的抑酶活性
表3.化合物26对HDAC 4、5、7、9、11的抑酶活性
从表2的实验结果可看出,化合物26对HDAC 1、2、3、8、6、10都表现出较好的抑酶活性,其IC50均达到纳摩尔水平,其对HDAC 1、2、3、8、10的抑酶作用要显著优于阳性对照药SAHA,分别是SAHA的11倍、6倍、18倍、29倍、2倍和41倍。化合物26对HDAC 8、10的抑酶作用略优于阳性对照药TSA,分别是TSA的1.7倍和2.6倍,对HDAC 3和HDAC 1的抑酶作用则与TSA相当。
表3的实验结果表明,化合物26对HDAC 4、5、7、9、11亚型的抑制作用很弱,这意味着不会产生由HDAC IIa类(HDAC 4、5、7、9)和IV类(HDAC11)亚型所带来的副作用。说明化合物26对HDAC I家族(HDAC 1、2、3、8)和IIb家族(HDAC 6、HDAC 10)亚型有较高的选择性,抑酶作用较强。
实施例9:体外抗肿瘤活性研究
1.实验细胞株:
本实验测试的细胞株采用:A549(人肺癌细胞)、HCT116(人结肠癌细胞)、MDA-MB-231(人乳腺癌细胞)和BEL7404(人肝癌细胞),这些细胞株均由上海医药工业研究院药理实验室冻存和传代。
2.样品配置:
样品均制备成盐酸盐,用DMSO(Merck)溶解后,加入PBS(-)配成1000μg/ml的溶液或均匀的混悬液,然后用含DMSO的PBS(-)稀释。SAHA和DOX为阳性对照药。
3.试验方法
本次体外细胞抗肿瘤活性实验采用MTT法。96孔板每孔加入浓度为4-5×104个/mL的细胞悬液100μl,置37℃,5%CO2培养箱内。24h后,加入样品液,10μL/孔,设双复孔,37℃,5%CO2作用72h。每孔加入5mg/mL的MTT溶液20μL,作用4h后加入溶解液,100μL/孔,置培养箱内,溶解后用全波长多功能酶标仪测570nm OD值。实验结果见表4。
表4.目标化合物对肿瘤细胞的体外增殖抑制作用
实验结果显示,化合物25、26对乳腺癌细胞MDA-MB-231的细胞毒活性均好于阳性对照药SAHA,分别是SAHA的2.5倍和5.1倍。化合物26对乳腺癌细胞MDA-MB-231和人肝癌细胞BEL7404的细胞毒活性与阳性对照药DOX相当,尤其对BEL7404的作用比较强,IC50为0.53μM。
实验结果还表明,化合物26对HCT116、MDA-MB-231和BEL7404也具有较好的细胞毒活性,因此,化合物26具有广谱的抗肿瘤活性。
本发明化合物具有广谱抗肿瘤活性活性,特别是部分化合物对肝癌、肺癌、乳腺癌具有较强的抗肿瘤活性,具有很好的开发价值。本发明的茚并喹啉酮类化合物代表着一类全新结构的具有抗肿瘤活性的化合物,这为深入研究和开发新的抗肿瘤药物开辟了途径和方向。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!