本发明涉及临床分子诊断
技术领域:
,具体涉及一种PKD2基因的STR位点及其应用。
背景技术:
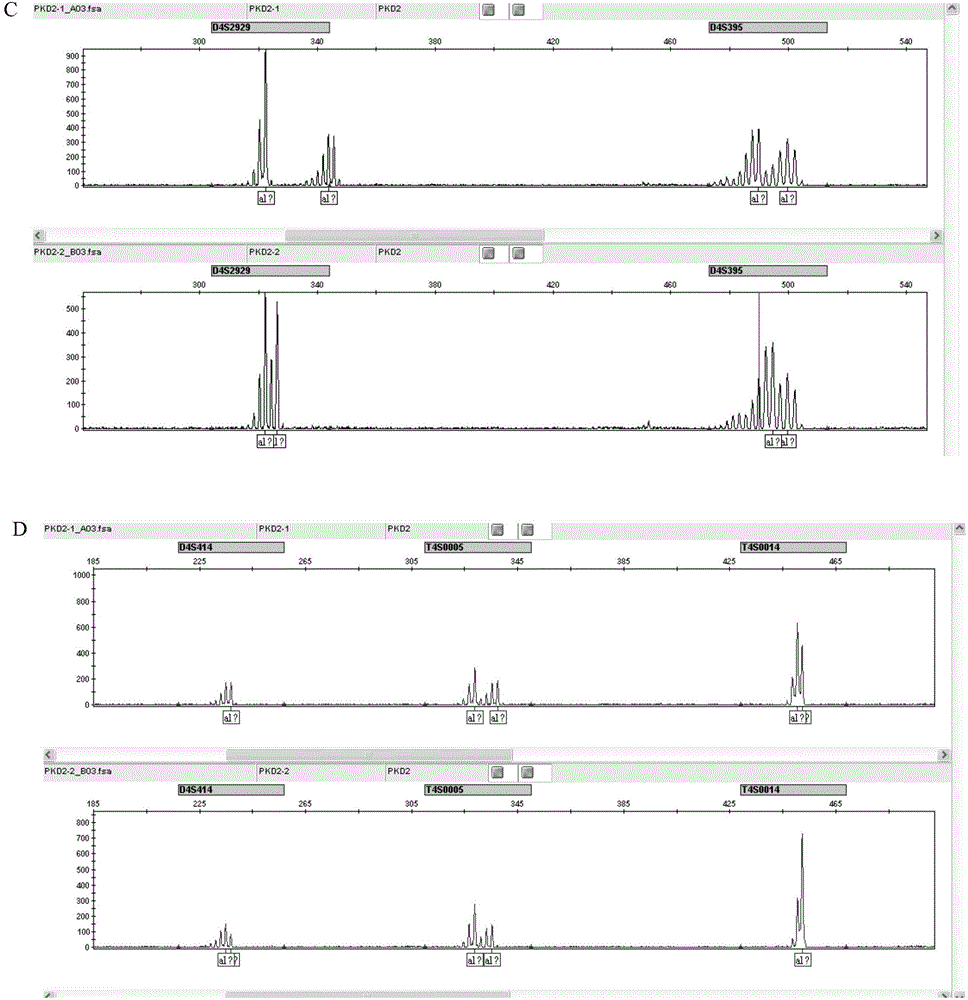
:常染色体显性遗传性多囊肾病(Autosomaldominantpolycystickidneydisease,ADPKD)是人类最常见的单基因遗传病之一,发病率约为0.1%。其主要临床特征是双侧肾脏形成多个液性囊泡,囊肿进行性生长,导致肾脏结构和功能的损害,至60岁时约50%患者发展为终末期肾功能衰竭,约占终末期肾功能衰竭病因的10%。多囊肾病患者除肾脏改变外,还可累及全身多个器官,如肝、胰、脾囊肿、颅内动脉瘤、高血压等。另有学者认为与胰腺癌发生有关。ADPKD属延迟显性遗传,患者一般在40岁左右才出现临床症状,此时多已将致病基因传给下一代。由于ADPKD目前尚无有效治疗方法,因此及时对ADPKD家系中有发病风险的成员进行症状前基因诊断,尤其是对高风险胎儿或胚胎进行产前诊断及植入前遗传学诊断,是控制其发生和发展的关键。ADPKD存在遗传异质性,目前已知引起该病的突变基因可能有3个,分别为PKD2,PKD2和PKD3。其中约15%的患者由PKD2突变所致。PKD2基因定位于第4号染色体长臂2区2带到2区3带(4q22-23),基因长度68kb,由15个外显子组成,转录起始点在外显子1内,转录的mRNA约5.4kb,其编码蛋白为含968个氨基酸的跨膜糖蛋白。PKD2基因突变的类型较多,不存在明显的突变热点,这给PKD2基因的突变检测带来了困难。目前PKD2的基因检测主要有以下几种方法:一、基因芯片检测基因芯片是将检测探针按照预先设定的排列矩阵固定在载体表面,与荧光标记的样品核酸分子杂交,通过检测探针上显示的荧光信号来检测样品中基因的结构或表达情况。基因芯片具有信息量大、灵敏度高、平行快速检测等特点。2006年吴忠标等针对中国人群中较为常见的PKD2基因突变位点,建立了分型用基因芯片,将该芯片用于PKD2基因变异的检测,取得了一定成果。但该技术的缺陷在于操作复杂繁琐,而且只能检测特定的几种突变,在临床应用上受到很大的限制。二、单链构象多态性分析(SSCP)SSCP是利用组成碱基不同导致DNA单链构象的差异,在进行非变性的聚丙烯酰胺凝胶电泳时,迁移速度出现改变的检测方法。SSCP技术由于成本低、简便、快捷,不受家系连 锁分析的限制,能够对单个患者进行突变的检测,且对单个位点的变异检出率较高。Deltas等用此技术检测PKD2突变,共检测出至少57种突变,其中30%为无义突变、51%为插入或缺失突变、14%为剪切突变、15%为错义突变。不过该技术存在5%~30%的漏检率,且只能检测突变的存在而不能确定突变的位置,这些缺陷严重限制了该技术在临床上的推广应用。三、变性高效液相层析(DHPLC)DHPLC是对扩增区域进行PCR扩增,PCR产物加热变性成单链状态,通过高压液相层析分析仪检测其中碱基含量,若发生改变则会出现峰值的移动,从而检测突变是否发生。Mizoguchi等首先采用此技术从PKD2部分编码区(第23~34外显子)和PKD2全编码区检测出8个突变位点。之后Rossetti等应用DHPLC技术分别对45个ADPKD患者进行了PKD2和PKD2全编码区突变检测。DHPLC技术虽然快速、简便,可判断有否突变,但不能确定SNP的位置和类型,需用标准样品或结合测序验证。只能检测杂合突变是DHPLC的主要不足之处,在点突变筛查的检测通量、灵敏度上也与其他检测技术存在差距。四、变性梯度凝胶电泳(DGGE)变性梯度凝胶电泳(Denaturinggradientgelelectrophoresis)是根据DNA在不同浓度的变性剂中解链行为的不同而导致电泳迁移率发生变化,从而将片段大小相同而碱基组成不同的DNA片段分开。具体而言,就是将特定的双链DNA片段在含有从低到高的线性变性剂梯度的聚丙烯酰胺凝胶中电泳,随着电泳的进行,DNA片段向高浓度变性剂方向迁移,当它到达其变性要求的最低浓度变性剂处,双链DNA形成部分解链状态,这就导致其迁移速率变慢,由于这种变性具有序列特异性,因此DGGE能区分存在低至单个碱基差异的DNA片段,被用于ADPKD的基因突变检测领域。该技术的缺陷在于检测通量较低,无法确定突变的具体类型,限制了其在临床检测中的应用。五、短串联重复序列(STR)STR在基因组中广泛存在,是以2~6个碱基为核心单位串联重复而成的一类序列,又称为微卫星DNA(microsatelliteDNA)。由于核心序列重复数目的变化,而在群体中呈现出遗传多态性,但在同一家系内具有高度的遗传保守性,以孟德尔方式遗传。因此利用微卫星DNA多态性连锁分析,可在同一家系中筛选出ADPKD患者。目前用于ADPKD连锁分析的STR基本为(CA)n重复,与PKD2连锁的微卫星DNA有D4S414,D4S423,D4S1542和D4S1563等。由于ADPKD基因的复杂性和突变位点的难确定性,连锁分析仍为目前ADPKD基因诊断的主要手段。但是目前所用的这些STR基因座中并非都是最优选择,有些STR基因座难于进行基因型判定。例如:二核苷酸重复PCR扩增时出现滑行,检测不稳定,容易发生错判;D4S423离PKD2基因较远,可能会由于基因重组而导致误诊;实际检测中可能 会出现一些STR基因座扩增失败的情况影响检测结果的判读,等等。为了解决这些问题,我们需要筛选出更多离PKD2基因距离近,遗传距离小,重组率低,杂合度高的有信息的STR位点作为遗传标记来进行常染色体显性遗传性多囊肾病的基因检测,以提高检测效率,为该疾病的临床诊断和胚胎植入前诊断提供依据。技术实现要素:本发明要解决目前PKD2基因的STR位点由于存在离PKD2基因距离较远、重组率高、杂合度低等缺点致使检测效率不高的技术问题,提供具有更高分辨率的PKD2基因的STR新位点,该STR新位点用于PKD2基因的连锁遗传分析,能有效提高分型识别效率和准确性。此外,还需要提供一种用于PKD2基因连锁遗传分析的检测试剂盒。为了解决上述技术问题,本发明通过如下技术方案实现:在本发明的一个方面,提供了一种PKD2基因的STR位点,该STR位点选自SEQIDNO.1~SEQIDNO.6所示的核酸序列。在本发明的另一方面,还提供了一种上述PKD2基因的STR位点的应用,用于常染色体显性遗传性多囊肾病的胚胎植入前诊断或产前诊断。在本发明的另一方面,还提供了一种诊断常染色体显性遗传性多囊肾病的检测试剂盒,包含分别针对SEQIDNO.1~SEQIDNO.6中任意两个以上STR位点的特异性引物对。优选的,包含分别针对SEQIDNO.1~SEQIDNO.6所示STR位点的特异性引物对。在本发明的一个优选实施例中,针对SEQIDNO.1所示STR位点的特异性引物对序列为SEQIDNO.28和SEQIDNO.29,针对SEQIDNO.2所示STR位点的特异性引物对序列为SEQIDNO.16和SEQIDNO.17,针对SEQIDNO.3所示STR位点的特异性引物对序列为SEQIDNO.12和SEQIDNO.13,针对SEQIDNO.4所示STR位点的特异性引物对序列为SEQIDNO.20和SEQIDNO.21,针对SEQIDNO.5所示STR位点的特异性引物对序列为SEQIDNO.18和SEQIDNO.19,针对SEQIDNO.6所示STR位点的特异性引物对序列为SEQIDNO.30和SEQIDNO.31。更优选的,还包含针对SEQIDNO.7~SEQIDNO.11中任意一个以上STR位点的特异性引物对。在本发明的另一方面,还提供了一种用于PKD2基因STR位点连锁遗传分析的复合扩增系统,包含:分别针对SEQIDNO.1~SEQIDNO.11中任意三个以上STR位点的特异性引物对。优选的,所述复合扩增系统包含:分别针对SEQIDNO.1~SEQIDNO.10所示STR位点的特异性引物对。本发明SEQIDNO.1~SEQIDNO.6所示的6个新STR位点,其所在区域不存在CNV(拷 贝数变异)情况,且该6个位点兼容性好,有利于与其它STR基因座位点组成高效的复合扩增系统。本发明的主要优点如下:1.新筛出的STR位点是利用现有最新的人类全基因组序列信息进行筛选获得,排除兼容性差、存在CNV或位于高度重复序列区等影响因素。2.筛选出的6个有关PKD2基因STR新位点,丰富了产前诊断或胚胎植入前诊断等相关应用领域STR基因座的选择范围。3.提供了分辨率更高的STR新位点,该STR新位点与已知的STR位点组成同一个体系检测相关遗传疾病,能更加高效、准确地得到分型数据。附图说明下面结合附图和具体实施方式对本发明作进一步详细的说明。图1是本发明实施例2多个STR位点的原始峰图。具体实施方式本发明筛选出PKD2基因中具有高分辨度的新STR基因座位点,该新STR位点结合一些现有STR基因座应用于常染色体显性遗传性多囊肾病(ADPKD)的分子研究和分子诊断领域,为该疾病的临床诊断和胚胎植入前诊断提供依据。实施例1筛选出6个PKD2基因的STR新位点1.STR的预测(1)使用生物公共数据库查阅整理STR信息,(数据库参照截止2011年11月之前NCBIhttp://www.ncbi.nlm.nih.gov/数据库),获得NCBI有报道STR信息;(2)生物信息学预测STR,得到重复单元2bp重复次数10次以上的基因座若干个;(3)比较这些STR位点在NCBI数据库中的三个基因组(refercese、HuRef、Celera)中的重复次数,获得重复数差异大的STR位点信息;(4)结合文献、生物数据库及生物信息学预测,根据实际STR的序列特征,筛选出6个生物信息学预测的STR,并将其分别命名为T4S0005(SEQIDNO.1),T4S0006(SEQIDNO.2),T4S0008(SEQIDNO.3),T4S0009(SEQIDNO.4),T4S0012(SEQIDNO.5),T4S0014(SEQIDNO.6)。2.STR的检测利用荧光标记扩增产物长度多态分析方法检测所有预测的STR位点,引物设计采用primer3软件,设计时尽量避开目前数据库中已知的SNP多态位点和高度重复序列区域等特殊序列。PCR产物稀释后取少量与内标标记混匀后直接上ABI3130xl进行毛细管电泳,数据 文件用GeneMapper4.0(Appliedbiosystems)来分析;获得所筛选到的新的STR基因座的多态信息量(PIC)等信息。实施例2STR新位点样本验证将新筛选出来的6个STR基因座(T4S0005,T4S0006,T4S0008,T4S0009,T4S0012,T4S0014)与4个常用基因座位点D4S395(SEQIDNO.7),D4S2929(SEQIDNO.8),D4S414(SEQIDNO.9),Amelogenin(AmeloX:SEQIDNO.10;AmeloY:SEQIDNO.11)组合,采用两步法多重荧光PCR技术检测2个个体样本。具体实验操作步骤如下:(1)DNA样本准备在医院中对2个选取的样本个体采集血液;通过DNA提取试剂盒抽提得到DNA样本并各取1μl1%agarose电泳对其样本进行质量检查以及浓度估计,然后根据估计的浓度将样本稀释到工作浓度5-10ng/μl。(2)PCR反应各取1ul样本,进行PCR反应。PCR反应体系总体积为10微升(1μl10×PCR缓冲液(Qiagen公司),0.2μl25mmol氯化镁、1μl检测多个STR基因座的混合引物(引物序列见下表1)、0.8μl2.5mmoldNTP、0.04μlHotStarplusTaq酶(Qiagen公司),5.96μlddH2O。PCR反应条件设置如下:95℃10分钟;7个循环的Touchdown程序(94℃20秒,65℃-1℃/循环40秒和72℃2min),28个循环扩增(94℃20秒,65℃30秒和72℃2min),在72℃延伸2分钟,在60℃延伸60分钟,4℃保存。(3)加荧光反应各取1ul样本,进行PCR反应。PCR反应体系总体积为10微升(1μl10×PCR缓冲液(Qiagen公司),0.2μl25mmol氯化镁、1μl检测多个STR基因座的混合引物、0.8μl2.5mmoldNTP、0.04μlHotStarplusTaq酶(Qiagen公司),5.96μlddH2O。PCR反应条件设置如下:95℃5分钟;30个循环(94℃20秒,56℃40秒和72℃2min),在72℃延伸2分钟,4℃保存。表1PKD2基因10个基因座引物序列STR基因座引物序列荧光标记T4S0008F:5’-ATGGCCAGCTCCAAGACAAAAA-3’(SEQIDNO.12)FAMR:5’-CTTTATGTGGATGAAGGTTGTCTGG-3’(SEQIDNO.13)AmeloF:5’-GCCCTGGGCTCTGTAAAGAATAGTG-3’(SEQIDNO.14)FAMR:5’-GTTTCTTGAGGCCAACCATCAGAGCTTA-3’(SEQIDNO.15)T4S0006F:5’-AGAGCCCCTAATCCATCCCAGT-3’(SEQIDNO.16)FAMR:5’-GGAGCAATTTTCCTCTGAACATCTTG-3’(SEQIDNO.17)T4S0012F:5-TTTTTGCATTTGGGCAGTAGCA-3’(SEQIDNO.18)VICR:5-CGATGAATTGGAGTGGTTTTGTTG-3’(SEQIDNO.19)T4S0009F:5-TCACCATTTTCCCCAGTTGTCA-3’(SEQIDNO.20)VICR:5-TTCCAGTCCAGCTTAGGCAACA-3’(SEQIDNO.21)D4S2929F:5-CAGAGTGGTCAATCCTGGCACT-3’(SEQIDNO.22)NEDR:5-TTCTCACCCATTCCTAGGCTGTC-3’(SEQIDNO.23)D4S395F:5-GCCAGGATGATAGCAATGGTCA-3’(SEQIDNO.24)NEDR:5-AACAGACGCACAGGCCAGGT-3’(SEQIDNO.25)D4S414F:5-CAGAGTTCTTACGCTGGTTCTTTCAG-3’(SEQIDNO.26)PETR:5-TTGCTATCATACCCCCCCTGTG-3’(SEQIDNO.27)T4S0005F:5-TTGCACAAGTGTTCACGCTGTC-3’(SEQIDNO.28)PETR:5-AGGATTTGGTGGCGTGAGAAAA-3’(SEQIDNO.29)T4S0014F:5-GGTTTCACCTTGTGCATGTGATG-3’(SEQIDNO.30)PETR:5-GTCCTGTTGAGCCTGCCAGATT-3’(SEQIDNO.31)PCR反应完成后,将PCR扩增产物稀释20倍,取出1ul加入8.9ulHIDI和0.1ulLIZ,混匀后95℃5min,毛细管电泳上样;因STR位点检测引物带有荧光,通过毛细管电泳检测不同颜色荧光及不同大小的扩增片断,用荧光检测系统分析结果得出STR分型信息(如表格2所示)。结果如图1和表2-4所示。表2是PKD2基因STR位点分布情况。表2PKD2基因STR位点分布情况图1是两个样本多个STR位点检测的原始峰图,分别为样本1(上图)和样本2(下图)。图1中,“A”为FAM峰图,“B”为VIC峰图,“C”为NED峰图,“D”为PET峰图。图1中各STR位点信息说明见下表3。表3PKD2基因各STR位点PCR扩增片段大小由图1得到的STR检测结果见下表4。表410个STR基因座的检测结果由图1和表4可知,新筛选得到的6个STR位点在结果上表现出了较高的区分度,应用到胚胎植入前诊断、STR分型、亲权鉴定、个体识别等生物医学检测中,能有效提高分型识别效率和准确性,并且这一体系具有很高的个体识别率,对PKD2基因的连锁遗传分析有很强的实用性。以上所述实施例仅表达了本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3