一种3-磷酸甘油酰基转移酶基因的筛选和鉴定方法与流程
本发明涉及到基因工程领域,具体涉及到一种真核生物细胞中3-磷酸甘油酰基转移酶(GPATs)基因和参与甘油酯合成途径中第一步酰化反应酶的基因的分离和鉴定;GPATs酶抑制剂的筛选;以及GPATs基因序列的优化与改造。
背景技术:
真核生物中,甘油脂的从头生物合成的初始反应和第二步酰化反应分别是由3-磷酸甘油酰基转移酶(GPATs)和溶血磷脂酸酰基转移酶(LPATs)催化。目前,仍然不清楚高等植物和哺乳动物中究竟含有多少个编码GPATs和LPATs的基因。
随着大规模测序技术的发展与应用,人们发现很多基因编码的蛋白含有保守酰基转移酶特征序列。然而,大多数膜结合GPATs与LPATs都含有这些特征序列,因而通过生物信息学分析难以区分这些基因到底编码哪一类酰基转移酶(Lewin et al.,1999;Zheng et al.,2003)。另外,真核生物中是否存在一类不含有酰基转移酶特征序列的GPATs,目前仍然不清晰。因此,为了有效的解析甘油脂合成途径中的第一步关键反应,有必要建立一个高效的GPATs筛选鉴定体系。
GPATs酶活性鉴定主要通过体外酶学分析和体内遗传功能互补实验(Zheng and Zou,2001;McIntyre et al.,1977;Lewin et al.,1999;Lindner et al.,2014)。体外酶学分析依赖于放射性同位素标记,且不适合于高通量筛选;而遗传功能互补实验被认为是一种体内有效的筛选方法。在原核生物中,已报道的大肠杆菌突变体plsB是一种GPATs功能缺陷型菌株,适合于原核生物GPATs基因的筛选。然而,原核生物II型脂肪酸合成途径的主要酰基供体是酰基载体蛋白(acyl-ACP),区别于真核生物的酰基供体酰基辅酶A(acyl-CoA),导致上述该体系不能应用于真核生物GPATs的筛选(Murata et al.,1997;Zheng and Zou,2001;Zhang and Rock,2008;Manas-Fernandez et al.,2010;Lindner et al.,2014)。
真核生物的甘油脂合成具有高度保守性,因此,可利用酵母GPATs功能缺陷型突变体,建立高效和特异的GPATs遗传互补筛选体系(Wilkison and Bell,1997;Athenstaedt and Daum,1999;Zheng and Zou,2001;Zheng et al.,2003)。酿酒酵母含有两个编码sn-1位的3-磷酸甘油酰基转移酶基因GAT1和 GAT2,催化甘油脂生物合成途径的第一步酰基化反应。研究表明,同时敲除这两个基因会使酵母双突变体致死(Zheng and Zou,2001;Zaremberg and McMaster,2002)。在W303菌株遗传背景下,已构建出两个条件型的双敲除突变体CMY228(gat1△gat2△+[pGAL1::GAT1 URA3])和VZY23(gat1△gat2△+[pGAL1::GAT2 URA3]),在含有半乳糖的培养基中能正常生长,而在含有葡萄糖的培养基中不能生长(Zaremberg and McMaster,2002;Bratschi et al.,2009)。
我们在BY4742菌株遗传背景下构建了两个条件型的双敲除突变体BY-NIU8(BY4742,gat1△gat2△+[pGAL1::GAT1 URA3])和BY-LEI5(BY4742,gat1△gat2△+[pGAL1::GAT2 URA3])。结果显示两个突变体在含有半乳糖和葡萄糖的培养基中均能生长(GAL1是半乳糖诱导和葡萄糖抑制型的启动子)。我们推测可能是由于酵母自身GAT1和GAT2互补基因在含有葡萄糖的培养基中低水平表达,从而维持了酵母双突变体的生长,这将导致候选GPATs筛选过程中可能出现假阳性结果,表明该条件型双突变体不适于GPATs筛选,需进一步优化改造。
人们普遍认为一个酶的催化活性在本体细胞中较高,而在异源的细胞中催化活性较低。我们试图用一个低催化活性的异源互补基因来替代酵母本身的GAT1和GAT2基因,所构建的条件型双突变体由于异源互补基因或其他编码sn-1酰基转移酶基因的高表达,在含有半乳糖的培养基中能恢复生长,但在含有葡萄糖的培养基中低表达情况下不足以恢复生长。之前研究结果表明,拟南芥AtGPATs基因家族中AtGPAT1和AtGPAT5具有Gat1和Gat2相似的基因功能,但在酵母细胞内异源表达的酶催化活性与酵母自身GPATs(Gat1p和Gat2p)活性相比低10倍(Zheng and Zou,2001;Zheng et al.,2003)。基于上述假设和研究结果,我们将利用AtGPAT1和AtGPAT5的特性,拟构建一个新型、特异且稳定的酵母遗传互补体系用于真核生物GPATs筛选,该酵母遗传互补筛选体系能快速有效的鉴定酰基转移酶基因,促进甘油磷脂从头生物合成途径的研究。
技术实现要素:
本发明构建条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5LEU2]),建立快速和高效的体内遗传互补筛选体系,应用于真核生物中含有或不含有酰基转移酶特征序列的GAPTs基因的筛选;同时,也可应用于医学上抗肥胖病的药物筛选。
本发明提供了一种3-磷酸甘油酰基转移酶(GPATs)基因的筛选和鉴定方法,包括如下步骤:
步骤一、构建中间型酵母双突变体:将带有异源GPATs基因的表达载体通过酵母遗传转化手段,引入到带有酵母自身GAT1或GAT2基因(编码GPATs)的表达载体的酵母双突变体,获得含有分别带有酵母GAT1(或GAT2)基因和一个异源GPAT基因的两个表达载体的中间型酵母双突变体;
步骤二、将步骤一所获得的中间型酵母双突变体经含有尿嘧啶(URA)液体培养基摇菌过夜,然后在含有5-氟乳清酸(5-FOA)和URA的固体培养基上进行筛选,得到新的含有一个异源GPAT基因的表达载体的条件型致死酵母双突变体;
步骤三、利用改造后的pYES2-yADH1-Kan新型质粒构建候选GPATs基因表达载体,导入到新的条件型致死酵母双突变体。
步骤四、采用含有葡萄糖的培养基作为筛选条件,能使新的条件型致死酵母双突变体在葡萄糖培养基中恢复生长的异源基因,即为编码具有GPAT酶活性的基因。
优选地,所述的GPATs基因的筛选和鉴定方法中的步骤一中的异源GPATs基因为拟南芥中的AtGPAT1与AtGPAT5。
优选地,所述的GPATs基因的筛选和鉴定方法中的步骤一中的异源GPATs基因编码的蛋白序列与拟南芥中的AtGPAT1与AtGPAT5蛋白序列同源性达到85%以上的基因。
优选地,所述的GPATs基因的筛选和鉴定方法中的与拟南芥中的AtGPAT1与AtGPAT5蛋白序列同源性达到85%以上的基因,包括拟南芥(Arabidopsis lyrata)、亚麻荠(Camelina sativa)、荠菜(Capsella rubella)、山萮菜(Eutrema salsugineum)、欧洲油菜(Brassica napus)、高山南芥(Arabis alpina),芜菁(Brassica rapa),醉蝶花(Tarenaya hassleriana)中分别与AtGPAT1和AtGPAT5蛋白序列同源性达到85%以上的基因序列。
优选地,所述的GPATs基因的筛选和鉴定方法中的中间型致死酵母双突变体构建过程包括:
一、用BamHI和XhoI双酶切YEplac181-GAT1-LEU2载体,去掉酵母GAT1基因,然后将拟南芥GPATs基因家族中具有GPAT活性的基因通过BamHI和XhoI 这两个酶切位点克隆至该载体;
二、将上述已构建好的表达载体分别转化酵母双突变体NIU8和LEI5,获得含有两种表达载体的中间型酵母双突变体。
优选地,所述的GPATs基因的筛选和鉴定方法中的拟南芥GPATs基因家族中具有GPAT活性的基因包括AtGPAT1,AtGPAT5,AtGPAT7。
优选地,所述的GPATs基因的筛选和鉴定方法中的酵母双突变体NIU8的遗传型为BY4742 gat1Δgat2Δ+[pGAL1::GAT1 URA3,LEI5的遗传型为BY4742gat1Δgat2Δ+[pGAL1::GAT2 URA3,所述的双突变体NIU8和LEI5是在BY4742菌株遗传背景下构建而成。
优选地,所述的GPATs基因的筛选和鉴定方法中的中间型酵母双突变体包括
BY4742 gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT1 LEU2、
BY4742 gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT5 LEU2、
BY4742 gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT7 LEU2、
BY4742 gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT1 LEU2、
BY4742 gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT5 LEU2、
BY4742 gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT7 LEU2、
优选地,所述GPATs基因的筛选和鉴定方法中的步骤三中的pYES2-yADH1-Kan新型质粒包括如下特征:(1)以酵母乙醇脱氢酶1为启动子(yADH1)诱导外源候选基因的表达,该启动子为葡萄糖诱导组成型表达启动子;(2)引入卡那霉素抗性基因作为该穿梭质粒在细菌中的筛选标记;(3)引入酶切位点HindIII、KpnI、SacI、BamHI、SpeI、EcoRI、NofI、XhoI、XbaI用于基因的克隆。
一种将所述的GPATs基因的筛选和鉴定方法用于筛选或鉴定三磷酸甘油酰基转移酶基因。
一种将所述的GPATs基因的筛选和鉴定方法用于筛选或鉴定三磷酸甘油酰基转移酶基因的抑制剂。
一种将所述的GPATs基因的筛选和鉴定方法用于优化或改造三磷酸甘油酰基转移酶基因的序列。
一种将所述的GPATs基因的筛选和鉴定方法用于筛选或鉴定参与甘油脂合成途径中第一步酰化反应酶的基因。
本发明的更具体的技术解决方案如下:
1.新型条件型致死酵母双突变体构建
1.1利用异源酰基转移酶(GPATs)基因在酵母中表达产生的酶催化活性较低的特性,替代酵母双突变体中自身编码GPATs的基因。构建拟南芥酰基转移酶基因表达载体YEplac181-AtGPAT1(pGAL1::AtGPAT1 LEU2)和YEplac181-AtGPAT5(pGAL1::AtGPAT5 LEU2)分别转化酵母双突变体BY-NIU8(BY4742 gat1△gat2△+pGAL::GAT1 URA3)和BY-LEI5(BY4742gat1△gat2△+pGAL::GAT2 URA3),获得含有两种表达载体的中间型酵母双突变体(如:BY4742 gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT1 LEU2)。
1.2中间型酵母双突变体经含有尿嘧啶(URA)的液体培养基过夜摇菌,部分来源于NIU8突变体细胞丢失pYES2-GAT1(pGAL1::GAT1 URA3)或来源于LEI5突变体细胞丢失pYES2-GAT2(pGAL1::GAT2 URA3)载体,后经在含有5-FOA和URA的固体培养基筛选,获得新的条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])。
BY4742:酵母基因型;GAT1和GAT2分别位于酵母K与B染色体;gat1△gat2△+pGAL1::GAT1 URA3代表含有pYES2-GAT1质粒的酵母双突变体;gat1△gat2△+[pGAL1::AtGPAT1 LEU2代表含有YEplac181-AtGPAT1质粒的新型酵母双突变体。
2.基于新型条件型致死酵母双突变体的互补体系的建立
2.1由于新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])的异源拟南芥基因(AtGPAT1和AtGPAT5)在半乳糖诱导下能高效表达(GAL1为半乳糖诱导启动子),导致新型条件型致死酵母双突变体在含有半乳糖的培养基中恢复生长;但在含有葡萄糖的培养基中(GAL1为葡萄糖抑制型启动子),因异源拟南芥基因表达活性较低,新型条件型致死酵母双突变体不足以恢复生长,表现为双突致死表型。
2.2基于以上筛选原理,利用改造后的pYES2-yADH1-Kan新型质粒(yADH1为葡萄糖诱导表达启动子)构建候选GPATs基因表达载体,转化新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2]),以含有葡萄糖的培养基作为筛选条件,能够快速、高效地鉴定候选GPATs基因的功能。
本发明同现有技术相比具有以下优点及效果:GPATs的体外酶学分析方法步骤繁琐,依赖于放射性标记,且筛选效率较低。新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])筛选体系能避开上述问题,并能解决之前构建的酵母双突变体筛选体系的假阳性问题;同时,该新型条件型致死酵母双突变体是一个特异性强且高效的体内遗传互补筛选体系,针对异源GPATs基因有稳定可靠的筛选鉴定效果。
具体表现在:
1.利用那些在酵母细胞中异源高表达情况下能够产生足够的GPAT活性恢复致死双突变体生长,但在低表达情况下不足以维持细胞的生长的基因构建条件型致死酵母双突变体,并用此条件型致死双突变体筛选鉴定GPATs基因。
2.利用拟南芥基因AtGPAT1和AtGPAT5构建条件型致死酵母双突变体,并用此条件型致死双突变体筛选鉴定GPATs基因。
3.利用与AtGPAT1和AtGPAT5同源性高于85%的异源基因构建条件型致死酵母双突变体,并用此条件型致死双突变体筛选鉴定GPATs基因。
4.利用其他非植物的异源物种中的GPATs基因,譬如哺乳动物中GPATs基因,构建条件型致死酵母双突变体,并用此条件型致死双突变体筛选鉴定GPATs基因。
5.新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])应用于GPATs筛选鉴定。
6.新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])应用于GPATs酶活性关键序列的鉴定。
7.新型条件型致死酵母双突变体ZAFU1(BY4742,gat1△gat2△+[pGAL1::AtGPAT1 LEU2])和ZAFU2(BY4742,gat1△gat2△+[pGAL1::AtGPAT5 LEU2])应用于GPATs抑制剂的筛选鉴定。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本发明新型酵母双突变体的构建示意图。
图2为本发明的载体PCR2.1-GAT1和PCR2.1-GAT1的酶切验证电泳图。
图3:表达载体pYES2-GAT1和pYES2-GAT2的酶切电泳图。
图4:表达载体pYES2-GAT1图谱附图说明。
图5:GAT1和GAT2基因敲除载体构建示意图。
图6:GAT1和GAT2基因敲除载体酶切电泳图
图7:表达载体YEplac181-GAT1酶切电泳图
图8:YEplac181-GAT1载体图谱
图9:lei5、lei7突变体的PCR验证引物位置图
图10:lei5、lei7突变体的PCR验证PCR电泳图
图11:niu7、niu8突变体的PCR验证引物位置图
图12:niu7、niu8突变体的PCR验证电泳图
图13:双突变体和单突变体在5-FOA培养基上的生长状态图
图14:pYES2-Kan-yADH1表达载体图谱
图15:新型条件型致死酵母双突变体遗传互补体系的筛选效率图
图16A:N端氨基酸残基缺失对AtGAPT1酶活性的影响线形图
图16B:N端氨基酸残基缺失对AtGAPT1酶活性的影响
上述附图的简要说明:
图1:BY4742:酵母基因型;GAT1和GAT2分别位于酵母K与B染色体;gat1△gat2△+pGAL1::GAT1 URA3代表含有pYES2-GAT1质粒的酵母双突变体;gat1△gat2△+[pGAL1::AtGPAT1 LEU2代表含有YEplac181-AtGPAT1质粒的新型酵母双突变体。
图2:以酵母基因组为模板扩增出GAT1和GAT2基因,通过T克隆连接到PCR2.1载体上。
1:PCR2.1-GAT1(BamHI和XhoI);
2:PCR2.1-GAT1(BamHI和XhoI);
M:DNA Marker
图3:从载体PCR2.1-GAT1和PCR2.1-GAT1用BamHI+XhoI切下GAT1和GAT2片段,分别连接到表达载体pYES2上。
1、2、3、4:pYES2-GAT1(BamHI+XhoI);
5、6、7、8:pYES2-GAT2(BamHI+XhoI);
M:DNA Marker
图4:表达载体pYES2-GAT1的基因图谱。
图5:以pRS423为模板,扩增得到HIS3片段,以PCR2.1-GAT1为模板,扩增得到5’-GAT1-PCR2.1-GAT1-3’片段,同时通过SmaI和PstI双酶切,连接,得到基因敲除载体PCR2.1-5’-GAT1-PCR2.1-GAT1-3’,并酶切电泳验证。同理得到基因敲除载体PCR2.1-5’-GAT2-PCR2.1-GAT2-3’。
图6:GAT1和GAT2基因敲除载体酶切电泳图
1:GAT1基因敲除载体(SmaI+PstI);
2:GAT2基因敲除载体(SamI+PstI);
M:DNA Marker
图7:以pYES2-GAT1为模板扩增得到pGAL1-GAT1-CYCTT片段,并与YEplac181载体经PstI和SmaI双酶切,连接,得到表达载体YEplac181-GAT1,然后用XhoI和BamHI双酶切验证;
M:DNA Marker;1:YEplac181-GAT1(XhoI+BamHI)
图8:YEplac181-GAT1载体图谱
图9:lei5、lei7突变体的PCR验证,提取突变体基因组,分别用三对引物进行验证,该图为验证引物位置图。
图10:改图为ei5、lei7突变体的PCR验证的PCR电泳图
1:以lei5基因组为模板
2:以lei7基因组为模板
1、2:以ZZF27+ZZF10为引物
1’、2’:以ZZF28+ZZF9为引物
1”、2”:以ZZF27+ZZF28为引物
M1:2.0bp DNA Marker
M2:10kb DNA Marker
图11:niu7、niu8突变体的PCR验证,提取突变体基因组,分别用三对引物进行验证,该图为其验证引物位置图。
图12:niu7、niu8突变体的PCR验证电泳图,
1:以niu7基因组为模板
2:以niu8基因组为模板
1、2:以ZZF29+ZZF9为引物
1’、2’:以ZZF30+ZZF10为引物
1”、2”:以ZZF29+ZZF30为引物
M1:2.0bp DNA Marker
M2:10kb DNA Marker
图13:双突变体和单突变体在5-FOA培养基上的生长状态图,取OD600=0.5菌液,并依次4倍稀释,5个浓度梯度,分别点到不同的SC培养基上,培养22或33小时。
图14:pYES2-Kan-yADH1表达载体图谱
图15:新型条件型致死酵母双突变体遗传互补体系的筛选效率
图16包括A与B:N端氨基酸残基缺失对AtGAPT1酶活性的影响。(A)带有AtGAPT1野生型基因和突变体基因(5’端1-237碱基删除)的酵母双突变体的生长曲线分析;(B)4种遗传型的细胞在不同细胞浓度下的生长差异分析,这4种遗传型分别为带有空白质粒的酵母双突变体、带有野生型AtGAPT1基因的酵母双突变体、带有5’端1-237碱基删除的AtGAPT1基因和带有5’端1-372碱基删除的AtGAPT1基因的酵母突变体。最初细胞浓度为OD600=0.5,按1:5稀释。
具体实施方式
下面结合实施例对本发明做进一步的详细说明,以下实施例是对本发明的解释而本发明并不局限于以下实施例。
实施例:
1.遗传互补体系的构建
1.1表达载体构建
1.1.1表达载体pYES2-GAT1和pYES2-GAT2的构建
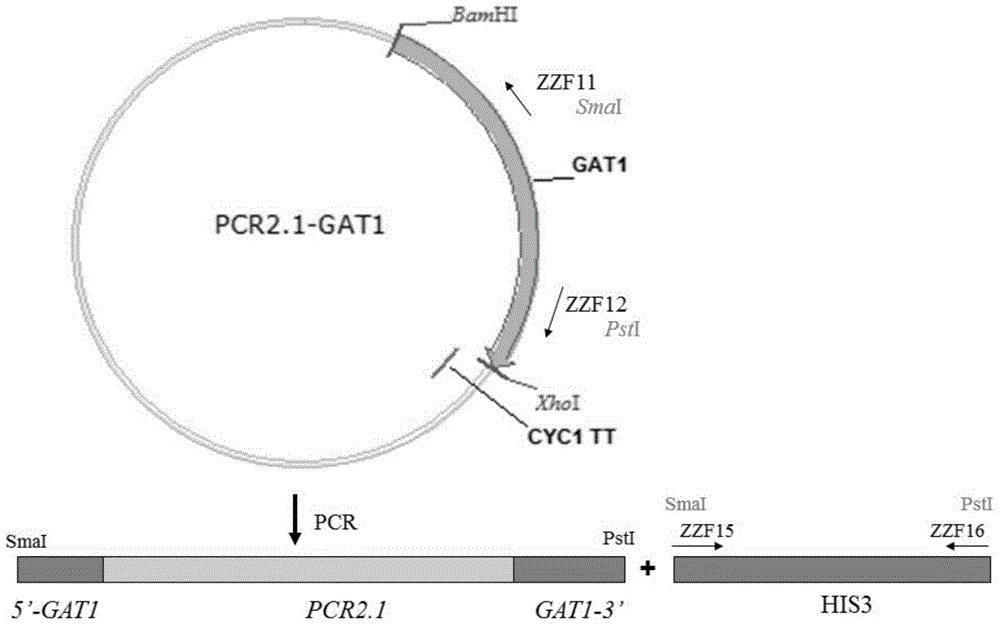
以酵母基因组为模板,GAT1 FP和GAT1 RP为引物,扩增GAT1片段,GAT2 FP和GAT2 RP为引物,扩增GAT2片段,通过TA克隆,分别连接到载体PCR2.1上,构成载体PCR2.1-GAT1和PCR2.1-GAT1,并通过BamHI和XhoI双酶切进行验证,电泳如图2,GAT1片段大小为2.2kb,GAT2片段大小约2.2kb,PCR2.1大小约3.9kb。
用BamHI和XhoI两个限制性内切酶双酶切PCR2.1-GAT1和pYES2载体,回收GAT1和pYES2两个片段,连接得到过表达载体pYES2-GAT1,并通过BamHI和XhoI双酶切验证,电泳如图3,GAT1大小约2.2kb,pYES2大小约5.9kb。
用BamHI和XhoI两个限制性内切酶双酶切PCR2.1-GAT2和pYES2载体,回收GAT2和pYES2两个片段,连接得到过表达载体pYES2-GAT2,并通过BamHI和 XhoI双酶切验证,电泳如图3,GAT2大小约2.2kb,pYES2大小约5.9kb。
1.1.2 GAT1和GAT2基因敲除载体的构建
以PCR2.1-GAT1为模板,ZZF11和ZZF12为引物,扩增5’-GAT1-PCR2.1-GAT1-3’片段;以pRS423为模板,ZZF15和ZZF16扩增HIS3片段,同时用SamI和PstI双酶切,然后连接到一起,构成新载体PCR2.1-5’-GAT1-HIS3-GAT1-3’,并通过SamI和PstI双酶切进行验证,电泳如图6,5’-GAT1-HIS3-GAT1-3’片段大小约2.0kb,PCR2.1大小约3.9kb。同理,以PCR2.1-GAT2为模板,ZZF13和ZZF14为引物,扩增5’-GAT2-PCR2.1-GAT2-3’片段,同时用SamI和PstI双酶切,然后连接到一起,构成新载体PCR2.1-5’-GAT2-HIS3-GAT2-3’,并通过SamI和PstI双酶切进行验证,电泳如图6,5’-GAT2-HIS3-GAT2-3’片段大小约2.0kb,PCR2.1大小约3.9kb。
以PCR2.1-5’-GAT1-HIS3-GAT1-3’为模板,ZZF17和ZZF18为引物,利用高保真酶扩增得到5’-GAT1-HIS3-GAT1-3片段,回收备用,用于敲除酵母基因组中的GAT1基因。
以PCR2.1-5’-GAT2-HIS3-GAT2-3’为模板,ZZF19和ZZF20为引物,利用高保真酶扩增得到5’-GAT2-HIS3-GAT2-3’片段,回收备用,用于敲除酵母基因组中的GAT2基因。
1.1.3表达载体YEPlac181-GAT1的构建
以pYES2-GAT1为模板,ZZF45和ZZF46为引物,用高保真酶扩增得到GAL1-GAT1-CYC1TT(启动子+GAT1片段+终止子)片段。用PstI和SmaI双酶切GAL1-GAT1-CYC1TT片段和YEplac181,连接得到过表达载体YEPlac181-GAT1,并通过BamHI+XhoI双酶切验证,电泳如图7。
1.2.条件型双突变体的构建
将载体pYES2-GAT2转入到gat2△突变体中,通过SC-URA+Gal(半乳糖)培养基进行筛选,得到新突变体gat2△+[pGAL1::GAT2 URA3]。利用同源重组原理,将GAT1U-HIS3-GAT1D片段导入到突变体gat1△gat2△+[pGAL1::GAT2 URA3]中,代替突变体中的GAT1基因,通过SC-URA(尿嘧啶)-His(组氨酸)+Gal培养基进行筛选,并利用引物ZZF27+ZZF10、ZZF28+ZZF9和ZZF27+ZZF28(图9)进行PCR验证,电泳如图10。得到两个阳性克隆gat1△gat2△+[pGAL1::GAT2 URA3],命名为LEI5-1、lEI5-2。
将载体pYES2-GAT1转入到gat1△突变体中,通过SC-URA+Gal培养基进行筛选,得到新突变体gat1△+[pGAL1::GAT1 URA3]。利用同源重组原理,将GAT2U-His-GAT2D片段导入到突变体gat1△gat2△+[pGAL1::GAT1 URA3]中,代替突变体中的GAT2基因,通过SC-URA-His+Gal培养基进行筛选,并利用引物ZZF29+ZZF9、ZZF30+ZZF10和ZZF29+ZZF30进行PCR验证,电泳如图12。得到两个阳性克隆gat1△gat2△+[pGAL1::GAT1 URA3],命名为niu8-1、niu8-2。
1.3双突变体的FOA验证
5-FOA作为一种负筛选药物,在酵母细胞能表达URA3时,URA3基因编码尿嘧啶合成途径中的重要酶:乳清酸核苷5-磷酸脱羧酶,它能把5-氟乳清酸(5-FOA)转变为细胞毒性物质,使细胞无法生长。反之,细胞可以生长。
先用含URA的SC培养基摇菌,部分gat1△+pYES2、gat2△+pYES2-URA3、gat1△+pYES1-GAT2中的pYES2质粒会丢失,分别形成gat1△、gat2△、gat1△突变体,能在含URA培养基上生长。而那些没有丢失pYES2质粒的酵母就会表达URA3,在含5-FOA的培养基上无法生长,在不含5-FOA的培养基上能生长。
先用含URA的SC培养基摇菌,使得部分LEI5、NIU8中的pYES2质粒丢失,而不能生长,而那些没有丢失pYES2质粒的酵母就表达URA3,在含5-FOA的培养基上无法生长,在不含5-FOA的培养基上能生长。
根据以上结果,我们可以得出:在上述5-FOA的筛选体系中,双突变体的存活依赖于GAT1或GAT2基因的表达。目的基因和YEplac181的组合表达载体转到LEI5中,先用含URA的SC培养基摇菌,pYES2质粒丢失,经过5-FOA筛选得到的突变体,其导入的目的基因是与GAT1或GAT2功能相似的基因。由此,我们建立了一个新的GPATs的筛选体系,下一步就进行目的基因的筛选。
2.新型条件型致死酵母双突变体构建
用BamHI和XhoI双酶切YEplac181-GAT1-LEU2载体(图8),去掉酵母GAT1基因,然后将拟南芥GPATs基因家族中具有GPAT活性的基因(AtGPAT1,AtGPAT4,AtGPAT5,AtGPAT6,AtGPAT7,AtGPAT8)通过BamHI和XhoI这两个酶切位点克隆至该载体。新构建的表达载体具有以下特征:i外源基因由半乳糖(GAL1)诱导启动子驱动;ii同时引入相应的CYC终止子。
将上述已构建好的表达载体分别转化酵母双突变体NIU8(BY4742 gat1Δ gat2Δ+[pGAL1::GAT1 URA3])和LEI5(BY4742 gat1Δgat2Δ+[pGAL1::GAT2URA3]),获得含有两种表达载体的中间型酵母双突变体(BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT1 LEU2、BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT4 LEU2、BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT5 LEU2、BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT6 LEU2、BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT7 LEU2、BY4742gat1△gat2△+pGAL::GAT1 URA3+pGAL1::AtGPAT8 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT1 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT4 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT5 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT6 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT7 LEU2、BY4742gat1△gat2△+pGAL::GAT2 URA3+pGAL1::AtGPAT8 LEU2)。
将中间型酵母双突变体在含有半乳糖和尿嘧啶且不含有组氨酸和亮氨酸的SC液体培养中过夜摇菌,约有1%的中间型酵母双突变体会丢失含有尿嘧啶筛选标记的表达载体pGAL::GAT1 URA3或pGAL::GAT2 URA3;然后分别涂布于含有尿嘧啶和5-氟乳清酸且不含有组氨酸和亮氨酸的半乳糖固体培养基平板以及含有尿嘧啶和5-氟乳清酸且不含有组氨酸和亮氨酸的葡萄糖固体培养基平板上。而未丢失尿嘧啶筛选标记表达载体的酵母细胞在含有5-氟乳清酸的培养基中由于尿嘧啶基因的表达使5-氟乳清酸转变为有毒性的物质,使酵母细胞无法生长。上述筛选结果显示,来源于转化YEPlac181-AtGPAT1、YEPlac181-AtGPAT5和YEPlac181-AtGPAT7载体的原始遗传型双突变体的部分酵母细胞在含有半乳糖的培养基中能正常生长,而在葡萄糖的培养中则完全不能生长;且来源于转化YEPlac181-AtGPAT7载体的原始遗传型双突变体生长速度明显慢于来源于转化YEPlac181-AtGPAT1和YEPlac181-AtGPAT5载体的原始遗传型双突变体;另外,来源于转化YEPlac181-AtGPAT4、YEPlac181-AtGPAT6和YEPlac181-AtGPAT8载体的原始遗传型双突变体在半乳糖和葡萄糖的培养基中均不能生长(表1)。
对来源于转化YEPlac181-AtGPAT1、YEPlac181-AtGPAT5和YEPlac181-AtGPAT7载体的原始遗传型双突变体随机挑选单克隆进行URA3、GAT1、AtGPAT1、AtGPAT5、和AtGPAT7基因的PCR检测。结果显示,来源于转化YEPlac181-AtGPAT1、YEPlac181-AtGPAT5和YEPlac181-AtGPAT7的酵母单克 隆分别含有拟南芥外源基因AtGPAT1、AtGPAT5和AtGPAT7;其中,来源于转化YEPlac181-AtGPAT1和YEPlac181-AtGPAT5载体的原始遗传型双突变体单克隆且不含有URA3和GAT1基因,而来源于转化YEPlac181-AtGPAT7载体的5个单克隆中仅有1个存在GAT1基因(表1),表明拟南芥AtGPAT1、AtGPAT5和AtGPAT7基因具有与酵母GAT1和GAT2相同的GPAT催化活性,使新形成的酵母双突变体(gat1Δgat2Δ+[pGAL1::AtGPAT1 LEU2]、gat1Δgat2Δ+[pGAL1::AtGPAT5LEU2]和gat1Δgat2Δ+[pGAL1::AtGPAT7 LEU2])在半乳糖诱导条件下能恢复生长,而在葡萄糖培养基中由于外源基因活性较低而不能恢复生长。
我们将上述新形成的条件型致死酵母双突变体gat1Δgat2Δ+[pGAL1::AtGPAT1LEU2、gat1Δgat2Δ+[pGAL1::AtGPAT5 LEU2和gat1Δgat2Δ+[pGAL1::AtGPAT7 LEU2分别命名为ZAFU1、ZAFU2和ZAFU3。
表1 NIU8遗传型酵母双突变体自身GAT1基因被拟南芥AtGPAT基因家族基因替换后的表型及PCR检测结果
*来源于转化YEPlac181-AtGPAT1和YEPlac181-AtGPAT5的原始遗传型双突变体酵母细胞在SC+URA-His-leu+gal+FOA固体培养基上涂板1x106个细胞,对照和其他候选基因涂板5x107个细胞。
**被检测含有目的基因的细胞占全部检测细胞的比例
3.新型条件型致死酵母双突变体的互补体系的建立
以新型条件型致死酵母双突变体ZAFU1(gat1Δgat2Δ+[pGAL1::AtGPAT1LEU2)为基础,利用葡萄糖特异诱导启动子表达载体,构建一个筛选异源GPATs基因的酵母体内遗传互补体系。我们已成功改造并获得了用于条件型致死酵母双突变体遗传互补筛选的表达载体pYES2-Kan-yADH1(图14),它具有以下特征:i以酵母乙醇脱氢酶1为启动子(yADH1)诱导外源候选基因的表达,该启动子为葡萄糖诱导组成型表达启动子;ii表达载体引入卡那霉素作为原核表达 筛选标记,不同于条件型致死酵母双突变体的互补载体的氨苄青霉素筛选标,易于分离候选互补基因;iii引入多克隆位点HindIII、KpnI、SacI、BamHI、SpeI、EcoRI、NofI、XhoI、XbaI,便于外源获选基因的克隆。
我们将4个已知的酵母基因(GAT1,GAT2,SCL1和PST1)和一个拟南芥基因(LPAT4)克隆至pYES2-Kan-yADH1表达载体,并转化至新型条件型致死酵母双突变体ZAFU1,利用含有葡萄糖的培养基作为筛选条件。结果表明,转化具有GAPT催化活性的酵母GAT1和GAT2基因能使条件型致死酵母双突变体ZAFU1在葡萄糖培养基中恢复生长,而其余无GAPT催化活性的基因则不能使条件型致死酵母双突变体ZAFU1恢复生长(表2)。另外,转化酵母GAT1和GAT2基因的条件型致死酵母双突变体ZAFU1不仅能在葡萄糖培养中恢复生长,而且突变体在半乳糖培养基中的生长速率也随之提高,表明突变体的生长速率与GAPT催化活性紧密相关,同时,也表明我们所构建的新型条件型致死酵母双突变体是一个非常可行、稳定和特异的真核生物GAPTs基因筛选体系。
表2 基于新型条件型致死酵母双突变体遗传互补筛选体系的GPAT基因筛选
我们利用酵母GAT1基因对上述新型条件型致死酵母双突变体ZAFU1遗传互补筛选体系的高效性进行进一步的检测。将空载体(对照)、pYES2-Kan-yADH1+GAT1表达载体以及二者按1:1000和1:5000的比例混合后的载体转化新型条件型致死酵母双突变体ZAFU1,再进行半乳糖和葡萄糖培养基筛选。结果表明,转化pYES2-Kan-yADH1+GAT1表达载体条件型致死酵母双突变体ZAFU1能很好的恢复生长,而对照则完全没有细胞生长(图15);同时,空载体(对照)和pYES2-Kan-yADH1+GAT1表达载体在浓度为1:1000的条件下也能 获得较好的阳性互补实验结果(图15),表明该新型条件型致死酵母双突变体ZAFU1遗传互补筛选体系具有较高的筛选效率。
4.控制AtGPAT1酶活性的关键氨基酸残基的发掘
我们将AtGPAT1基因5‘端不同长度碱基对缺失的突变体克隆至pYES2-Kan-yADH1载体,然后转化条件致死型突变体ZAFU1,结果发现,将AtGPAT1基因5‘端237个碱基对(对应多肽N端氨基酸残基1-79)删除,的AtGPAT1突变体与野生型AtGPAT1一样,都能使酵母突变体恢复生长,因而表明N端氨基酸残基1-79并不显著影响GPAT酶的活性(图16A,B)。但是当把AtGPAT1基因5‘端372个碱基对(对应多肽N端氨基酸残基1-124)删除,AtGPAT1基因的突变体不能恢复条件致死型酵母突变体的生长能力,因而表明多肽N端氨基酸残基80-124是GPAT酶活性所必需的。
此外,需要说明的是,本说明书中所描述的具体实施例,其提到的一些物质所取名称等可以不同,凡依本发明专利构思所述的特征及原理所做的等效或简单变化,均包括于本发明专利的保护范围内,本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,只要不偏离本发明的结构或者超越本权利要求书所定义的范围,均应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!