解聚海参糖胺聚糖组合物及其制备方法与应用与流程
本发明属于医药和保健品技术领域,本发明涉及重均分子量范围为2000Da-12000Da的解聚海参糖胺聚糖组合物及其制备方法,以及该解聚海参糖胺聚糖组合物在预防和治疗肿瘤疾病中的应用。
背景技术:
恶性肿瘤是一种常见病,严重威胁人类的生命。目前主要的治疗手段是手术、放疗、化疗和免疫治疗。治疗手段之一的化疗,在抑制、杀灭肿瘤细胞的同时存在两大障碍即其毒副作用和耐药性。毒副作用体现在不仅杀伤肿瘤细胞,而且杀伤正常组织细胞,对人体造成毒副反应、降低患者生理功能。因此,研究开发能与抗肿瘤药物联合运用,具有减毒、增敏、增效的新型药物,具有重要的积极意义。
海参糖胺聚糖(Holothurian Glycosaminoglycan,简称HG或HGAG),其结构式如下,是从海参中提取的一种含岩藻糖支链的硫酸糖胺聚糖,其结构与肝素(Heparin)近似却又有显著差异。HG组成单糖包括氨基半乳糖、葡萄糖醛酸、岩藻糖以及它们的硫酸酯基,其中葡萄糖醛酸和氨基半乳糖通过β(1-3)及β(1-4)糖苷键交互连接,形成与哺乳动物体内的硫酸软骨素E相似的二糖重复结构单元的主链,而岩藻糖及其硫酸酯基以侧链形式连接于主链(Vieira RP et al.,J.Biol.Chem.,1991,266:13530-13536)。此外,不同海参来源和制备方法所得的HG在结构上也存在着不同程度的差异(Ken-ichiro Y et al.,Tetrahedron Letters,1992,33:4959),主要表现在糖主链中氨基半乳糖的4-位和6-位硫酸酯化的差异,以及岩藻糖侧链上的硫酸酯化的差异。
内外研究均证实,HG具有良好的抗凝血、抗血栓作用。HG与肝素虽同属于糖胺聚糖一族,并且生物学活性也极其相似,但HG可作用于抗凝的多个环节,引起出血的危险性较小。
众所周知,肝素是目前所发现的天然产物中抗凝活性最强的,且早已被发现其在抗炎和抗肿瘤方面具有良好的生物活性,肝素单独或与其他药物联合使用,被证实在各种临床前肿瘤模型和临床恶性肿瘤治疗中均有效。一些低分子肝素,如达肝素(Dalteparin)已被大量应用于抗肿瘤的临床治疗,主要采取与抗肿瘤药物联合运用的方式,但由于其抗凝活性,FDA仍未正式批准达肝素在肿瘤治疗方面的应用。因为肝素类的抗凝作用,临床只能使用其抗凝剂量来治疗肿瘤,作用有限,所以如果在减少抗凝活性的同时保留抗肿瘤活性就能增加临床使用剂量,从而大大增强抗肿瘤效果,同时显著降低出血风险。
海参糖胺聚糖相对于肝素,抗凝活性显著降低。本发明人试验发现,解聚海参糖胺聚糖(dHG)的抗凝活性相比于未解聚的糖胺聚糖又有明显的降低,dHG可能具有避免(不论是未分级的大分子肝素还是低分子肝素)肝素诱导血小板聚集减少症(Hepaein-Induced Thrombocytopenia,HIT)的致命风险。因此,如果能将不良反应更小的dHG应用于临床肿瘤的治疗将为肿瘤患者带来福音。目前国内外尚未有dHG应用于抗肿瘤的报道。
技术实现要素:
发明目的:本发明的目的是为了克服现有技术的不足,提供一种疗效确切、安全性好的重均分子量为2000Da-12000Da的解聚海参糖胺聚糖组合物;本发明另一个目的是提供解聚海参糖胺聚糖组合物简单高效的制备方法,本发明对制备得到的解聚海参糖胺聚糖组合物进行了系统的体内外抗肿瘤试验研究,发现其具有很好的抗肿瘤活性,因此可以用于制备抗肿瘤药物或保健品。
为了实现以上目的,本发明采取的技术方案为:
一种解聚海参糖胺聚糖组合物,它为重均分子量介于2000Da-12000Da的解聚海参糖胺聚糖的一种或多种。
本发明提供的解聚海参糖胺聚糖组合物的制备方法,其包括以下步骤:
1)从海参中提取、纯化海参糖胺聚糖;
2)降解提取出的海参糖胺聚糖。
作为优选方案,以上所述的解聚海参糖胺聚糖组合物的制备方法,所述步骤1)中的海参选自但不限于以下棘皮动物门的沙海参、黑海参、玉足海参、糙海参、黑乳海参、格皮氏海参、白底辐肛参等中的一种或多种。其中玉足海参产于我国南海海域,分布广、资源量大、价格便宜、而且含糖量高,是最理想的原材料。作为其它方案,本发明所述的糖胺聚糖可以选自棘皮动物门中的一种或多种。
所述的解聚海参糖胺聚糖组合物的制备方法,其特征在于,步骤1)从海参中提取海参糖胺聚糖的步骤包括对其进行绞碎、酶解并沉淀分离获得海参糖胺聚糖粗品;所述酶解所用 的酶包括碱性蛋白酶、中性蛋白酶、胰酶、木瓜蛋白酶中的一种或多种;所述沉淀包括用有机溶剂甲醇、乙醇、异丙醇或丙酮进行沉淀,分离包括离子交换树脂分离和金属盐分级沉淀。
作为优选方案,以上所述的解聚海参糖胺聚糖组合物的制备方法,步骤1)纯化海参糖胺聚糖的步骤包括用离子交换树脂进行吸附和分级洗脱,双氧水脱色并除热源得到海参糖胺聚糖纯品;
所用的离子交换树脂为阳离子交换树脂或阴离子交换树脂;所述的洗脱是指用水和浓度为1~20%(m/m)的无机盐水溶液进行分级洗脱。
作为优选方案,以上所述的解聚海参糖胺聚糖组合物的制备方法,步骤2)降解提取出的海参糖胺聚糖的步骤包括:在酸性环境,温度控制在20-80℃之间,利用双氧水降解反应2-48小时,降解得到重均分子量介于2000Da-12000Da的解聚海参糖胺聚糖组合物;
所述的双氧水用量在0.1-30%(v/v)之间;所述酸性环境所用的酸为甲酸、乙酸、丙酸、盐酸或硫酸;所述酸的用量在0.1-20%(v/v)之间。
作为优选方案,以上所述的解聚海参糖胺聚糖组合物的制备方法,步骤2)降解提取出的海参糖胺聚糖包括用不同浓度的氯化钠分级沉淀除盐,然后冷冻干燥或减压干燥,得到分散度小于1.5的解聚海参糖胺聚糖组合物。
一种保健品组合物,包括解聚海参糖胺聚糖组合物和保健品行业可接受的载体。
一种药物组合物,包括本发明所述的解聚海参糖胺聚糖组合物和药学上可接受的载体。
本发明所述的解聚海参糖胺聚糖组合物在制备预防和治疗肿瘤疾病药物或保健品中的应用。
本发明所述的解聚海参糖胺聚糖组合物在制备预防和治疗肿瘤疾病药物或保健品中的应用,单独应用或与抗肿瘤药物联合应用。
本发明通过大量实验优化得到海参糖胺聚糖的提取纯化工艺,改进海参糖胺聚糖的降解方法,整个制备工艺设计合理,可操作性强,并对得到的解聚海参糖胺聚糖组合物进行结构表征,得到重均分子量介于2000Da与12000Da的解聚海参糖胺聚糖组合物。通过本发明所述方法制备的解聚海参糖胺聚糖组合物,其分子量分布、旋光度、硫酸酯基组成比例、核磁等质量控制指标可采用本领域已知方法检测。
本发明对所述的解聚海参糖胺聚糖组合物进行了体内外抗肿瘤研究。本发明所得到的解聚海参糖胺聚糖dHG在体外能显著抑制脐静脉内皮细胞(HUVEC)的管腔生成,在体内能抑制黑色素瘤和乳腺癌的肺部转移,并有明显的量效关系,具有很好的抗肿瘤效果。
附图说明
图1为解聚海参糖胺聚糖dHG的分子量分布。
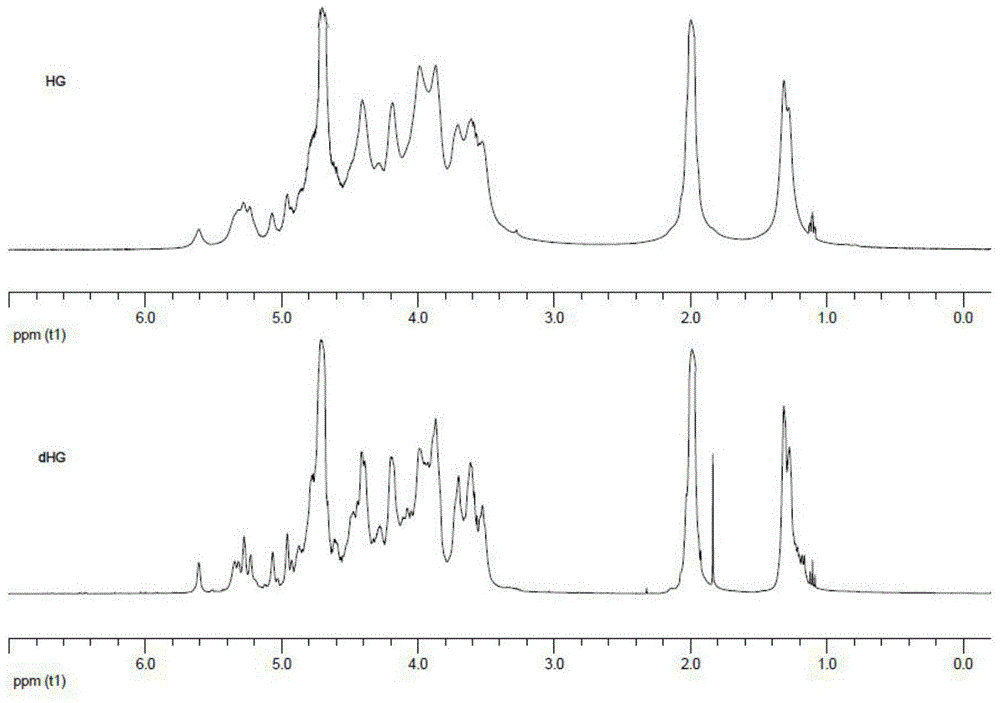
图2为海参糖胺聚糖HG和解聚海参糖胺聚糖dHG的1H-NMR。
图3为HUVEC管腔形成结果。
图4为乳腺癌模型中肺部转移瘤灶计数柱状图。
图5为乳腺癌模型中肺部转移瘤覆盖率柱状图。
具体实施方式
下面通过实施例对本发明作进一步的描述,但不以任何方式限制本发明。
实施例1:海参糖胺聚糖(HG)的提取及纯化
1.称取干燥玉足海参药材5Kg,水浸泡过夜。洗净,取体壁,沥干水分,绞碎,称重并补水至25Kg。置60℃水浴,用氢氧化钠调节pH为8.0,加入2%的碱性蛋白酶2709,酶解6小时后,再加入2%的胰酶继续酶解16小时,酶解过程中注意控制pH为弱碱性。酶解结束后离心,上清液加入等体积的乙醇醇沉,离心收集固体,再用30倍质量的水溶解,并加入1%NaCl固体使之全部溶解,然后加入1Kg(湿重)1074型离子交换树脂,调节pH至8.0,在室温下搅拌吸附4小时,吸附完成后,抽滤,将抽滤后的树脂先用清水洗涤,然后分别用7%(w/v)和10%(w/v)的NaCl溶液各洗脱3次,每次15分钟。收集合并10%NaCl的洗脱液,并加入0.8倍体积的乙醇醇沉,在4℃条件下静置过夜,然后抽滤收集沉淀并在45℃减压干燥得粗品海参糖胺聚糖24g。
2.所得的上述海参糖胺聚糖粗品用20倍质量的水溶解,用4M NaOH溶液调节pH为10,然后加入双氧水使其浓度为3%(v/v)进行脱色处理,在室温下搅拌反应2小时。反应后加入1%NaCl和等体积的乙醇醇沉,得固体再用10倍量的水溶解,再用1%NaCl和乙醇醇沉2次。所得的固体用乙醇洗涤2次后于45℃减压干燥,得纯品海参糖胺聚糖22.5g。
实施例2:解聚海参糖胺聚糖(dHG)的制备
1.dHG的制备
取实施例1所述制得的纯品海参糖胺聚糖20g,加入160mL水溶解,并加入19.0mL醋酸和60.0mL双氧水,在60℃下搅拌反应22小时后,冰浴中降温,然后加入4M NaOH溶液调节pH至9.5,再加入2倍体积的乙醇醇沉,静置,离心得沉淀,即为解聚海参糖胺聚糖粗品。
取该粗品再用200mL水溶解并加入3%NaCl固体,用1倍体积乙醇醇沉,所得沉淀复溶后再分别用2%、1%NaCl固体和1倍体积乙醇醇沉2次,最终得到的沉淀用乙醇洗涤2次,然后减压干燥得到18.0g解聚海参糖胺聚糖(dHG)。
2.dHG的理化性质
2.1分子量分布
所得解聚海参糖胺聚糖(dHG)以HPGPC分析,色谱柱为一根TSKgel G2000SW(7.8mm×30cm,5μm,产品编号:T08542)和一根TSKgel G3000SW(7.8mm×30cm,5μm,产品编号:T10407-02T)连接使用,测得重均分子量为10092Da,分散度为1.3。如图1所示(图中40.5min处为溶剂峰)。
2.2旋光度:根据中国药典(2010版)二部附录VIE方法测定。使用WZZ-1S型自动旋光仪,钠光源(λ589nm),样品管为1dm。测定结果为-56.5°,与纯品糖胺聚糖旋光度-60.5°相近。结果表明,本发明采用的降解工艺不会改变其空间构型。
2.3硫酸根羧酸根比例:电导滴定法测定,测得dHG的硫酸根羧酸根比例为3.84与纯品糖胺聚糖3.55一致。结果表明,本发明采用的降解工艺不会减少硫酸根含量。
2.4 1H-NMR
本发明制备得到的海参糖胺聚糖HG和解聚海参糖胺聚糖dHG的1H-NMR图谱如图2所示,该图谱表明降解前后海参糖胺聚糖的信号特征基本一致,只是分子量低的信号更为清晰,也表明海参糖胺聚糖降解前后的基本化学结构未发生显著变化。而δ1.33ppm为岩藻糖基上的甲基特征峰以及δ1.92ppm为氨基半乳糖上的乙酰基特征峰,表明海参糖胺聚糖的单糖组成包含氨基半乳糖和岩藻糖侧链的共同特征。而不同的海参糖胺聚糖的主要不同点在于主链中氨基半乳糖的4-位和6-位硫酸酯化的差异,以及岩藻糖侧链上的硫酸酯化的差异。根据图谱分析,在δ4.22ppm有明显的特征峰而δ4.8ppm左右无特征峰,说明了玉足海参糖胺聚糖的氨基半乳糖上仅存在6-位硫酸酯化而无4-位硫酸酯化,这与文献(樊绘曾等,药学学报,1983,18(3):203)报道的一致。而在侧链岩藻糖基上,存在约15%的2,4-二硫酸酯基(δ5.65ppm特征峰)、约30%的3,4-二硫酸酯基(δ5.26ppm和4.90ppm特征峰)和约20%的4-硫酸酯基(δ5.34ppm和5.35ppm特征峰)。除以上有报道的特征峰外,在低场处还存在如δ5.10ppm和δ5.00ppm两个特征峰,而且化学位移值又比上述报道的特征峰略低,说明该海参糖胺聚糖存在2-位或3-位的硫酸酯基单取代。
2.5抗凝活性检测
本发明测定了实施例2所得重均分子量为10092Da的解聚海参糖胺聚糖dHG和达肝素的抗-Xa活性。结果见表1:
表1 抗凝活性检测
结果提示解聚海参糖胺聚糖dHG的体外抗凝活性只有达肝素的百分之一,说明解聚海参糖胺聚糖dHG出血风险更小,安全性更高,为后续药物剂量的设定提供依据。
实施例3:解聚海参糖胺聚糖dHG急性毒性实验
1.实验材料
dHG10092(按本发明实施例2方法制备所得);ICR小鼠。
2.实验方法
ICR小鼠按照体重随机分为2组(每组10只,雌雄各半),分别尾静脉给予剂量为4000mg/kg及2000mg/kg的dHG10092。
3.实验结果
4000mg/kg剂量组部分动物在尾静脉给药后,立即出现抽搐、呼吸困难、腹式呼吸、翻正反射消失及尿失禁等现象,给药3分钟后上述症状缓解,但自发活动与对照组相比明显减少;
2000mg/kg剂量组动物在尾静脉给药后未出现明显异常症状。给药后各组动物体重均下降,其中4000mg/kg组给药1天后动物体重与溶剂对照组比较存在显著性差异(P<0.05);给药后第2天起动物体重恢复增长,各组动物体重与溶剂对照组相比均无显著性差异。观察期内各组均未见动物死亡,无其他明显异常。给药后第14天结束观察,CO2处死动物后进行解剖观察,各组动物主要脏器均无肉眼可见异常。实验结果表明本发明提供的dHG 10092安全性较好,在剂量达到4000mg/kg时依然安全。
实施例4:解聚海参糖胺聚糖dHG对HUVEC细胞管腔结构形成的影响研究
1.实验材料
受试化合物:实施例2制备得到的重均分子量为10092Da的解聚海参糖胺聚糖(dHG10092)、卡博替尼(Cabozantinib)。
细胞株:原代HUVEC细胞系购自澳赛尔斯(Allcells)公司。
试剂:内皮细胞基础培养基(澳赛尔斯,Cat#HUVEC-004B),内皮细胞完全培养基(澳赛尔斯,Cat#HUVEC-004),Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix(without phonol red)(GIBCO,cat#A1413202),0.25%Trypsin-EDTA(GIBCO,Cat#25200),胎牛血清(GIBCO,Cat#10099141),青霉链霉双抗溶液(GIBCO,Cat#15140-122),二甲亚砜(DMSO)(Sigma,Cat#D2650)。
2.实验方法
2.1受试化合物配制:卡博替尼溶于DMSO配成20mM储存液。在DMSO中梯度稀释成200倍终浓度的储存液。本发明制备得到的解聚海参糖胺聚糖dHG10092溶于0.9%NaCl配成20mM储存液。再用0.9%NaCl梯度稀释成50倍终浓度的储存液。加药时再用基础培养基(含2%FBS)稀释成2倍终浓度的化合物溶液。
2.2管腔形成实验方法:加50μL/孔Geltrex胶至96孔板,然后放入37℃培养箱孵育1小时,使胶凝固。取细胞覆盖率约80%的HUVEC细胞(细胞用完全培养基培养,实验前一天用含2%FBS的基础培养基饥饿过夜),用胰酶消化离心收集细胞,用基础培养基(含2%FBS)重悬并计数。用基础培养基(含2%FBS)将细胞悬液稀释至2×105个细胞/ml,然后将细胞悬液与2倍终浓度的化合物溶液1:1混合。将100μL含1×化合物的细胞悬液均匀铺至包被Geltrex胶的96孔板中(1×104个/孔),复孔检测。4小时后在显微镜下拍照,并统计形成的管腔数目。用CTG方法检测化合物毒性。GraphPad Prism软件制作量效图。
3.结果
实验结果表明,本发明制备得到的dHG10092在浓度50μM时即显现出对内皮细胞HUVEC管腔形成有较为显著的抑制作用,且有剂量依赖关系。管腔形成数据统计结果分别见图3。
实施例5:解聚海参糖胺聚糖dHG对B16F10黑色素瘤细胞自发性肺转移的影响
1.实验材料
1.1实验动物与细胞
清洁级C57BL/6小鼠(雌性,6-8周龄,16-20g),北京维通利华实验动物技术有限公司提供。
1.2实验药物
dHG10092(按本发明实施例2方法制备所得);达肝素。
1.3实验试剂
DMEM(美国GiBCO公司),磷酸盐缓冲液(PBS),小牛血清,胰蛋白酶(Trypsin),乙二胺四乙酸(EDTA),甲醛,生理盐水,碳酸氢钠。
1.4实验器材
莱卡倒置荧光显微镜,精密移液器,全自动高压灭菌锅,超净工作台,超低温冰箱,CO2培养箱,纯水仪,电子天平,台式电热鼓风干燥箱,冰箱,液氮罐,离心机,pH计,注射器。
2.实验方法
2.1制备细胞悬液
常规培养B16F10肿瘤细胞,实验前4-5天,按1:10,细胞传代于细胞培养瓶中,以免细胞生长过度出现不完全汇合。每个培养瓶大约含6-8×106细胞,取对数生长期的细胞,弃去培养液,用PBS洗净,加入1mL 0.25%胰酶-0.02%EDTA消化液,放入细胞培养箱当中,1-3min后,轻敲培养瓶使细胞脱落。加入10mL DMEM,用移液管吹打细胞,获得单细胞悬液,转入50mL聚丙烯离心管。离心细胞(1200rpm×10min),然后用PBS洗两遍。用台盼蓝计数细胞,调整细胞浓度为2.5×106个/mL。
2.2复制B16F10实验性肿瘤转移模型
取C57BL/6小鼠置于小鼠注射固定器,尾静脉注射0.2mL细胞悬液(含有2×105肿瘤细胞)。接种过肿瘤细胞的小鼠随机分为三组:模型对照组(生理盐水),给药组:本发明制备得到的dHG10092剂量组(20mg/kg),达肝素组(20mg/kg),皮下注射药物,20天后麻醉,处死小鼠,取肺脏。避免镊子触及脏器表面,防止损伤组织,用PBS洗净组织。10%PBS-福尔马林固定肺组织,称取肺重,拍照,评价药物对B16F10血行肺转移的影响。
3.实验结果
3.1体重
实验过程中,小鼠体重无明显减少
3.2肺重
给药组和生理盐水组的肺重有显著差异。达肝素组显著抑制肺重增长,本发明提供的dHG10092也抑制了肺重的增长。达肝素的抑制率达到83.6%,dHG10092的抑制率达到55.7%。
3.3肺部肿瘤结节数
与对照组(生理盐水组)相比,达肝素组和dHG10092组的肿瘤结节数明显减少。对照组(生理盐水组)、达肝素组和dHG10092组肺部肿瘤结节数分别为99、17、34。
以上实验结果表明,本发明制备得到的解聚海参糖胺聚糖dHG10092在20mg/kg剂量单独使用能显著抑制肿瘤转移,且对小鼠体重没有影响。
实施例6:解聚海参糖胺聚糖dHG对4T1小鼠乳腺癌细胞自发性肺转移的影响
1.实验材料
1.1实验动物与细胞
清洁级BALB/C小鼠(雌性,6-8周龄,16-20g),北京维通利华实验动物技术有限公司提供。
1.2实验药物:
dHG10092(按本发明实施例2方法制备所得);顺铂(cisplatin);达肝素。
1.3实验试剂:
DMEM(美国GiBCO公司),磷酸盐缓冲液(PBS),小牛血清,胰蛋白酶(Trypsin),乙二胺四乙酸(EDTA),甲醛,生理盐水,碳酸氢钠。
1.4实验器材
莱卡倒置荧光显微镜,精密移液器,全自动高压灭菌锅,超净工作台,超低温冰箱,CO2培养箱,纯水仪,电子天平,台式电热鼓风干燥箱,冰箱,液氮罐,离心机,pH计,注射器。
2.实验方法
2.1细胞培养
4T1细胞使用RPMI-1640培养液培养,其中添加的胎牛血清的浓度为10%,青霉素/链霉素双抗按1::100的比例稀释于培养液中,培养于含5%CO2饱和湿度为37℃恒温培养箱中。细胞每2至3天以1:3-1:5传代。
2.2切除原位瘤时小鼠肺转移灶的情况
BALB/C小鼠70只,随机分为7组,乳腺第四脂肪垫接种1×1054T1细胞。随后每组分别给予dHG 10092剂量为20mg/kg、40mg/kg、80mg/kg,达肝素4mg/kg。连续给药12天后,切除乳腺部位肿瘤,在第13天,每组增加顺铂4mg/kg,每四天一次。在第30天,麻醉,处死小鼠,取出肺脏和脾脏,洗净,称重,10%PBS-福尔马林固定肺组织,评价药物对肺转移的影响。
3.实验结果
3.1体重
所有经顺铂治疗后的小鼠(单独或者联合)体重均有下降,表明是顺铂导致了体重的下降。
3.2瘤重
不同组别之间原发瘤的肿瘤生长没有显著差异,但是顺铂与dHG10092联合用药组与单独的顺铂组相比,瘤重减少。
3.3肺重和脾重
经顺铂治疗后的组别(单用顺铂或者顺铂与本发明制备得到的dHG10092合用),与阴性对照组相比,肺重和脾重显著降低,表明治疗组均能抑制肿瘤转移和与肿瘤相关的骨髓细胞的扩散。
3.4肺部转移量化
与单独使用顺铂组相比,本发明提供的dHG 10092与顺铂联合用药可明显减少肺部肿瘤结节数,且呈剂量依赖关系,80mg/kg组明显少于顺铂单独组(P<0.05),如图4所示。
HE染色,量化肺部肿瘤区域,结果提示所有顺铂治疗组(单用顺铂或者顺铂与本发明制 备得到的dHG10092合用)可以显著降低肺部肿瘤区域范围(p<0.0001),并且本发明提供的dHG 10092显示出量效关系,80mg/kg剂量组疗效最好。如图5所示。
以上实验结果表明,本发明提供的解聚海参糖胺聚糖dHG 10092和顺铂联用能显著抑制肿瘤转移,且呈现剂量依赖关系,80mg/kg剂量组效果最显著,且未发现任何不良反应。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!