EIN2蛋白在抑制基因表达中的应用的制作方法
本发明涉及基因工程技术领域,尤其涉及EIN2蛋白在抑制基因表达中的应用。
背景技术:
在模式植物拟南芥中EIN2(Ethylene Insensitive 2)基因(AT5G03280)功能缺失导致完全乙烯不敏感。这是到目前为止人们发现的唯一的单基因缺失突变导致完全乙烯不敏感的突变体,说明EIN2蛋白是乙烯反应的正调控组分,也说明EIN2蛋白是乙烯信号通路的关键组分(Alonso et al.,1999;Ji and Guo,2013)。
拟南芥EIN2蛋白具有1294个氨基酸,其N端含有12个跨膜结构域(1~461),负责将蛋白定位于内质网膜。同时,其C端(462~1294)为亲水区。虽然进化分析表明EIN2的C端(EIN2CEND)比较保守,但生物信息学分析表明该区域不包含目前已知的任何典型的蛋白功能结构域(Ji and Guo,2013)。在功能缺失突变体ein2-5中过量表达EIN2CEND,可以组成型激活乙烯反应;而当过量表达EIN2的N端却并没有组成型乙烯反应。这暗示整个N端作为一个跨膜结构接受上游的信号,而EIN2CEND参与了乙烯的信号转导并将信号向下转导(Alonso et al.,1999)。
近期,有研究表明EIN2蛋白C端的激活乙烯信号转导的一种机制(Ju et al.,2012;Qiao et al.,2012;Wen et al.,2012)。当植物体内存在大量乙烯时,EIN2的C端因被某种蛋白酶剪切而脱离内质网并进入细胞核并激活乙烯反应(Ju et al.,2012;Qiao et al.,2012;Wen et al.,2012)。除此之外,人们还发现EIN2在细胞质中也有一定的分布(Qiao et al.,2012;Wen et al.,2012),这说明EIN2在细胞质中可能具有重要的功能,但该功能需要进一步的研究。
技术实现要素:
本发明目的是提供EIN2蛋白在抑制基因表达中的应用。EIN2蛋白在细胞质中与EBF1mRNA的3’UTR相互作用,并与EIN5等蛋白互作共同定位于P-body,进而抑制EBF1mRNA的翻译过程。
本发明解决技术问题采用如下技术方案:EIN2蛋白在抑制基因表达中的应用。
优选地,所述EIN2蛋白的氨基酸序列如SEQ ID No.1所示。
优选地,所述EIN2蛋白在细胞质中抑制EBF1mRNA到蛋白质的翻译过程中的应用。
优选地,所述EIN2蛋白在抑制带有EBF1 3’UTR的报告基因的表达中的应用。
优选地,所述EIN2蛋白在获得乙烯超敏感型转基因拟南芥中的应用。
一种检测EIN2蛋白在抑制基因表达中的功能的方法,包括制备重组基因M1C与M1F,其中M1F包括依次连接的MYC标签编码序列、EBF1编码序列、EBF1mRNA的3’UTR、重组基因所转录出的成熟mRNA的PolyA;M1C包括依次连接的MYC标签编码序列、EBF1编码序列、重组基因所转录出的成熟mRNA的PolyA;分别转入野生型拟南芥Col-0、ein2-5突变体以及EIN2过表达的EIN2ox植株中,进而检测转基因株系体内MYC-EBF1蛋白的水平。
优选地,所述方法包括制备重组基因35S::EIN2-mRFP,所述重组基因为将EIN2基因与红色荧光蛋白mRFP的编码序列融合,然后将重组基因转入乙烯完全不敏感突变体ein2-5中获得转基因株系35S::EIN2-mRFP/ein2-5,筛选获得对乙烯反应与野生型拟南芥Col-0一致的35S::EIN2-mRFP/ein2-5株系,对该株系施加外源乙烯,同时对融合蛋白EIN2-mRFP进行亚细胞定位。
本发明提供EIN2蛋白在抑制基因表达中的应用,EIN2蛋白在植物中,特别是高等植物中表达,首次发现乙烯促进EIN2蛋白在细胞质内形成斑点,并可以抑制任何一个带有EBF1 3’UTR基因的翻译过程;进而得到,只要把靶基因的编码序列和EBF1 3’UTR融合,然后通过一定条件表达EIN2就可以在转录后水平打开或者关闭该基因的表达。
附图说明
图1为EIN2蛋白亚细胞定位;
图2为EIN2通过3’UTRT抑制EBF1mRNA的翻译并激活乙烯反应;
图3为EIN2与EBF1mRNA 3’UTR、EIN5在体内发生相互作用;
图4为EIN2和EBF1 3’UTR抑制基因表达。
具体实施方式
下面结合实施例及附图对本发明的技术方案作进一步阐述。以下实施例中使用的试剂和材料均为市售商品。
实施例1EIN2蛋白亚细胞定位
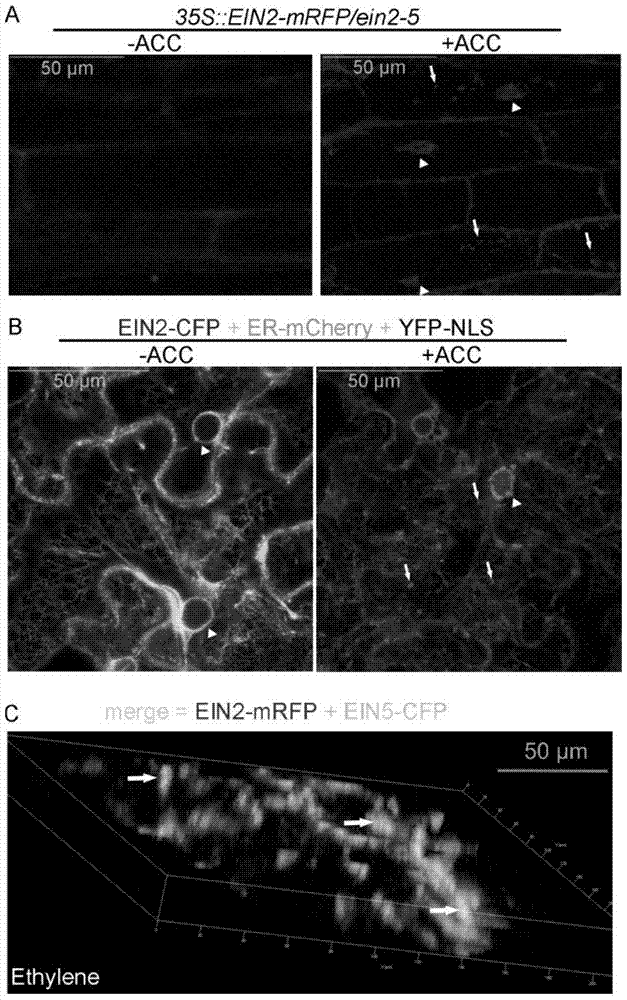
将红色荧光蛋白mRFP的编码序列与EIN2基因融合,并利用35S启动子构建重组基因35S::EIN2-mRFP。然后,利用农杆菌介导的办法将该重组子转入乙烯完全不敏感突变体ein2-5中,获得转基因株系35S::EIN2-mRFP/ein2-5。通过抗性筛选和表型分析,获得了对乙烯反应与野生型拟南芥Col-0一致的35S::EIN2-mRFP/ein2-5株系,这说明该株系中的融合蛋白EIN2-mRFP具有与植物内源蛋白EIN2相同的功能。利用该转基因材料并借助激光共聚焦荧光显微镜,分析在施加外源乙烯时融合蛋白EIN2-mRFP的亚细胞定位。如图1A所示,转基因株系35S::EIN2-mRFP/ein2-5在黑暗条件下生长在MS培养基(-ACC)以及含10μM ACC的MS培养基(+ACC)上,3天后取材观察红色荧光蛋白的定位。图1A中白色三角形代表细胞核,白色箭头代表细胞质中的点状结构。ACC是乙烯生物合成的前体,常做外源施加处理。图1A结果表明,当不存在外源乙烯即植物体内乙烯含量很低时,红色荧光信号较弱且在细胞内随机分布;而当施加外源乙烯即植物体内乙烯含量很高时,红色荧光信号增强且明显在细胞核内积累(见图中三角形所示),更明显的是在细胞质内出现明亮的点状结构(见图中箭头所示)。这说明乙烯信号促进EIN2蛋白稳定且诱导其在细胞核内积累,这与人们之前的报道相一致(Qiao et al.,2012;Wen et al.,2012)。同时,还表明乙烯促进EIN2蛋白在细胞质内形成斑点,这是以往研究中未见报道的。
为了进一步确认EIN2蛋白的亚定位,构建青色荧光蛋白标记的EIN2,即EIN2-CFP。通过农杆菌侵染介导的瞬时表达体系,在烟草叶片中共同表达了EIN2-CFP、内质网膜标记蛋白ER-mCherry、细胞核标记蛋白YFP-NLS,并观察荧光、分析乙烯对于EIN2-CFP在细胞质内分布的影响。如图1B所示,将分别含有35S::EIN2-CFP、35S::ER-mCherry、35S::YFP-NLS的农杆菌共同注射到烟草叶片中,恢复生长48小时。之后,再次注射100μM ACC并于2小时后观察荧光。其中,红色代表EIN2-CFP,绿色代表内质网膜,蓝色代表细胞核;黄色为红、绿色叠加,紫色为红色、蓝色叠加。结果表明,未施加外源乙烯处理时EIN2主要是定位在内质网膜上;而当施加外源乙烯处理2小时之后烟草叶片叶肉细胞的细胞质内便出现点状结构,这些点状结构在细胞内散状分布,由此说明乙烯诱导EIN2蛋白脱离内质网膜并在细胞质内形成点状结构。
上述施加外源乙烯处理时EIN2蛋白所形成的大小不一、散状分布的点状结构与一种称作processing body(P-body)的亚细胞结构非常像,其为真核细胞中mRNA翻译抑制和降解的场所,人们利用免疫荧光研究酵母中负责mRNA降解的Xrn1时发现,该蛋白定位在细胞质中且以点状结构存在(Decker and Parker,2012)。于是,本实施例中选取拟南芥中的同源蛋白AtXRN4/EIN5,并使其与EIN2在烟草中共表达,如图1C所示,将分别含有35S::EIN2-mRFP、35S::EIN5-CFP的农杆菌共同注射到烟草叶片中,恢复生长48小时。之后,于含100ppm乙烯的空气中放置2小时后观察荧光。红色代表EIN2,绿色代表EIN5,黄色代表二者叠加。结果显示,乙烯诱导EIN2与EIN5在细胞质中共定位,且形成明显的点状结构,这表明乙烯促进EIN2蛋白参与形成P-body。
实施例2EIN2通过3’UTRT抑制EBF1mRNA的翻译并激活乙烯反应
中国专利ZL201110110101.0中已经公开了EBF1mRNA 3’UTR作为一个顺式作用元件能抑制由mRNA到蛋白的翻译过程,该3’UTR在EBF1mRNA的翻译过程中起负调作用。从遗传关系上讲,EIN2是通过负向调节EBF1/2的功能而激活下游乙烯信号的(An et al.,2010;Guo and Ecker,2003)。本实施例检测作为参与形成翻译抑制结构P-body的EIN2蛋白是否具有调控翻译的功能。
由于缺乏特异针对内源EBF1蛋白的抗体,本实施例将MYC标签编码序列与EBF1蛋白编码序列(即Coding Sequence,简称CDS)重组在一起,这样就可以用商业化的MYC标签抗体来检测MYC-EBF1蛋白水平;构建一个“长版”的EBF1重组基因,即在MYC-EBF1序列后面融合了EBF1mRNA的3’UTR序列,且以翻译终止密码子TGA相隔,将此重组基因命名为M1F(MYC-EBF1Full-length);同时,构建一个“短版”的EBF1重组基因,该重组子没有3’UTR,命名为M1C(即MYC-EBF1CDS),如图2A所示,重组基因M1C与M1F结构示意图,其中左侧依次表示MYC标签编码序列、EBF1编码序列(coding sequence,简称CDS)、重组基因所转录出的成熟mRNA的多聚腺嘌呤尾巴(PolyA);右侧依次表示MYC标签编码序列、EBF1编码序列(coding sequence,简称CDS)、EBF1mRNA的3’非翻译序列(un-translated region,简称3’UTR)、重组基因所转录出的成熟mRNA的多聚腺嘌呤尾巴(PolyA)。箭头表示用于检测MYC-EBF1转录本时引物所在位置。重组基因M1C与M1F均为35S启动子驱动。
如图2B和2C所示,得到重组基因之后,将重组基因M1C与M1F分别转入野生型拟南芥Col-0,通过杂交获得在ein2-5突变体以及EIN2过表达转基因株系EIN2ox背景下的植株中。以野生型拟南芥Col-0为背景利用转基因技术,获得了多个可稳定遗传且为单拷贝插入的转基因株系M1C/Col-0和转基因株系M1F/Col-0;通过杂交获得了在突变体ein2-5和EIN2过表达转基因株系EIN2ox/ein2-5背景的株系:M1C/ein2-5、M1C/EIN2ox、M1F/ein2-5、M1F/EIN2ox。继而,检测上述株系体内MYC-EBF1蛋白的水平,不同的株系于黑暗条件下生长在含10μM ACC的MS培养基上3天,然后用MYC标签抗体检测植株体内MYC-EBF1融合蛋白的含量,并用RT-PCR分析MYC-EBF1转录本的丰度。如图2B所示,Loading代表western blot实验时总蛋白的上样量;TUB4则作为RT-PCR的内参基因,图中结果显示,MYC-EBF1融合蛋在M1C/Col-0、M1C/ein2-5、M1C/EIN2ox三个株系内MYC-EBF1蛋白含量基本一致;而在M1F/ein2-5中较在M1F/Col-0要多,在M1F/EIN2ox中较M1F/Col-0少。图2C所示为MYC-EBF1转录本的丰度,图中结果显示M1C和M1F在不同背景下具有相同的表达水平,这表明MYC-EBF1蛋白水平的差异来自翻译过程;同时,还表明EIN2抑制M1F而不是M1C的翻译。由于M1F与M1C的差别是在包含3’UTR,则EIN2可能通过某种方式作用在EBF1mRNA的3’UTR上调控其翻译过程。
如图2D和2E所示,野生型拟南芥Col-0、不同背景下M1C与M1F转基因株系于黑暗条件下生长在含10μM ACC的MS培养基上3天的黄化苗的“三重反应”表型和根与下胚轴的长度定量结果。已知拟南芥的乙烯反应强弱程度主要由两个关键的转录因子EIN3和EIL1决定,它们在蛋白水平上受到F-Box类蛋白EBF1和EBF2所介导的泛素化降解调控(An et al.,2010;Guo and Ecker,2003),则EBF1/2的蛋白水平会决定EIN3/EIL1的蛋白水平和乙烯反应强度。为此,我们观察了外源施加乙烯时转基因株系M1F/Col-0和M1C/Col-0的“三重反应”表型,图2D结果显示,与野生型Col-0相比,二者都表现出明显的乙烯不敏感表型;图2E结果显示,转基因株系M1F/Col-0与转基因株系M1C/Col-0相比,下胚轴和根较短,这与转基因株系M1F/Col-0中的MYC-EBF1蛋白水平较低相一致,说明3’UTR介导乙烯通过某种方式抑制EBF1mRNA的翻译过程,导致EBF1蛋白水平下调,从而解除了EBF1对EIN3/EIL1的抑制,使得EIN3/EIL1蛋白得以积累并激活下游乙烯反应基因的表达。进一步,M1F/Col-0较M1F/ein2-5矮,而其与M1F/EIN2ox相比较高,这与它们体内的MYC-EBF1蛋白水平变化相一致;而这种表型的差别在M1C/Col-0、M1C/ein2-5、M1C/EIN2ox三者之间并没有发生,这说明EIN2通过作用在EBF13’UTR上进而抑制EBF1mRNA的翻译并激活乙烯反应。
实施例3EIN2与EBF1mRNA 3’UTR、EIN5在体内发生相互作用
实施例2中表明EIN2通过某种方式直接或者间接作用在EBF1mRNA的3’UTR上进而抑制EBF1的翻译,本实施例检测EIN2与EBF1mRNA的3’UTR在植物体内是否具有相互作用。首先利用RNA Immunoprecipitation(RNA IP)技术检测在M1C/EIN2ox和M1F/EIN2ox株系内EIN2与mRNA是否发生相互作用,图3A显示,RNA-IP检测EIN2与EBF1mRNA之间的相互作用。在EIN2ox背景下,分别过表达重组基因M1C与M1F的转基因株系,在含10μM ACC的MS培养基上于黑暗条件下生长3天;之后,提取细胞总核酸蛋白复合物,并使用HA抗体做IP反应,然后经RNA提取、RT-PCR检测M1C与M1F。图3A中,EIN2ox表达出的为EIN2全长与HA标签融合的重组蛋白,TUB4为RT-PCR内参基因,RT-PCR结果表明EIN2可以捕获M1F mRNA而不能捕获M1C mRNA。这说明在植物体内EIN2通过直接或者间接与EBF1mRNA3’UTR相互作用进而抑制EBF1的翻译。图3B显示,CO-IP检测EIN2与EIN5之间的相互作用。分别将含有EIN2ox(即重组基因35S::EIN2-HA)、35S::EIN5-CFP(与图1C相同)的农杆菌共同注射到烟草叶片中,恢复生长48小时。之后,于含100ppm乙烯的空气中放置2小时,并提取细胞总核酸蛋白复合物,留部分提取物作为Input,其余提取物做IP反应。其中,IP反应和WB使用HA抗体和CFP抗体。
实施例1及图1C表明EIN2可以与EIN5共定位于P-body,因此进一步利用蛋白免疫共沉淀实验(即co immunoprecipitation,简称CO-IP)检测EIN2与EIN5在体内是否具有相互作用,本实施例中CO-IP实验按照PierceTM HA-Tag Magnetic IP/Co-IP Kit说明书的标准流程进行,试剂盒货号为88838。图3B结果表明,EIN2可以特异地捕获EIN5-CFP蛋白,这说明二者可以在体内发生相互作用并共同调控EBF1mRNA的翻译过程。
上述结果表明,EIN2在细胞质中与EBF1mRNA的3’UTR发生相互作用,并进一步与EIN5等相关组分发生相互作用而定位于P-body,从而抑制EBF1mRNA的翻译过程而激活下游乙烯反应。
实施例4EIN2和EBF1 3’UTR抑制基因表达
将GFP基因的编码序列与EBF1 3’UTR融合构建了重组基因GFP-3’UTR,并以单独的GFP基因做对照,如图4A所示,分别为报告基因GFP和GFP-3’UTR结构,后者(即右侧图)为GFP的编码序列与EBF1 3’UTR序列融合之后的重组基因,图4A中“S”表示终止密码子,两个报告基因的启动子均为35S启动子驱动。首先将报告基因GFP和GFP-3’UTR分别转入拟南芥并获得在ein2-5突变体背景下转基因株系,然后通过杂交获得了在EIN2ox背景下的株系。进一步,如图4B所示,显示表达报告基因GFP和GFP-3’UTR的转基因植株根部荧光观察结果(左)和GFP、EIN2蛋白水平检测(右上)以及转录本水平检测(右下)。其中,“EIN2ox-”表示GFP或者GFP-3’UTR分别通过转基因的方式获得在ein2-5背景下的株系GFP/ein2-5和GFP-3’UTR/ein2-5;“EIN2ox+”表示GFP/ein2-5和GFP-3’UTR/ein2-5分别于EIN2ox/ein2-5杂交而获得EIN2ox背景下的株系GFP EIN2ox/ein2-5和GFP-3’UTR EIN2ox/ein2-5。上述所得株系在在MS培养基上暗中生长3天,之后在含100μM ACC的MS液体培养基中瞬时处理4小时并观察荧光和提取总蛋白以及RNA。通过观察荧光发现无论是否有EIN2ox存在,表达GFP的株系中的荧光均较表达GFP-3’UTR的株系亮,且荧光强度不受EIN2ox影响;而表达GFP-3’UTR的株系中的荧光在没有EIN2ox时比有EIN2ox时要亮。可见,EIN2ox的表达可以抑制带有EBF1 3’UTR的报告基因的表达。如图4C所示,利用农杆菌介导的方法分别将GFP、GFP-3’UTR独立(“EIN2ox-”)或者与EIN2ox共同(“EIN2ox+”)在烟草叶片中表达,侵染48小时后观察荧光(左)并提取总蛋白分析蛋白水平(右上)以及提取RNA分析转录本水平(右下)。“EIN2ox”为HA标签融合的蛋白EIN2-HA,检测其蛋白水平用HA标签抗体;“Loading”代表总蛋白上样量;TUB4作为拟南芥内参基因;eIFa为烟草内参基因。图4B右上结果表明无论是否有EIN2蛋白存在表达GFP的株系中GFP蛋白的水平均未有明显变化;而EIN2蛋白大量表达时GFP-3’UTR株系中的GFP蛋白水平明显下降,这与荧光观察结果相一致。图4B右下结果表明,对比蛋白水平的变化与转录本水平的不变,可以看出EIN2蛋白可以在翻译水平抑制带有3’UTR的报告基因的表达,这暗示在拟南芥中EIN2可以抑制任何一个带有EBF1 3’UTR的基因的翻译过程。图4C结果显示,虽然EIN2在烟草中是异源表达,但EIN2仍然可以抑制GFP-3’UTR的翻译过程。
以上实施例的先后顺序仅为便于描述,不代表实施例的优劣。
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!