用于细胞固着培养的装置及固着培养方法与流程
本发明涉及微培养和微流控技术领域,具体来说,涉及一种用于细胞固着培养的微流控装置及固着培养方法。
背景技术:
微流控(Microfluidics)是一种在微米尺度空间对流体进行操控的科学技术(林炳承,微纳流控芯片实验室,科学出版社,2013)。液滴微流控(Droplet microfluidics)。微流控芯片可以将生物、化学等实验的基本功能微缩到平方厘米大小的芯片上,实现集成化、高通量、自动化、便携化的定量溶液实验。液滴微流控(Droplet microfluidics)是微流控在最近几年得到快速发展的重要分支(Teh SY,et al.Droplet microfluidics.Lab on a Chip 2008,8(2):198-220),通过在微通道或微结构中对不互溶流体界面的主动或被动分割,能够大批量生成大小均一的飞升至纳升体积的液滴。以液滴作为培养和反应的容器,通过控制融合、分割、反应和分选等操作,可实现高通量的单分子、单细胞定量反应和分析。基于液滴微流控,可进行大批量单细胞的培养、单细胞酶活性分析、单细胞裂解和基因组扩增、单细胞转录组扩增等,具有广阔的前景。
微液滴在微流控芯片通道内生成后,需要特定的步骤和装置转移到储存容器中,这使得单个液滴的定位、提取和分析等操作较为不便,对单个液滴中承载的单细胞或分子等的测量也比较困难。另外,液滴在芯片上与通道壁是不接触的,这使得现有的液滴微流控技术不适于贴壁细胞的培养和分析,包括很多动物细胞以及微生物被膜的生长,都需要贴壁的条件才能实现正常的生长和发育分化。最近研究者报道了一种在通道侧壁制作的带有微排液出口的微坑阵列培养装置,可将细胞悬液引入微坑并用油相封闭,进行贴壁培养(Shemesh,J.,et al., Stationary nanoliter droplet array with a substrate of choice for single adherent/nonadherent cell incubation and analysis.Proc.Natl.Acad.Sci.U.S.A.,2014.111(31):p.11293-8)。然而,该芯片中,细胞在微坑的所有表面固着生长,难以对微坑内的所有细胞进行同步观察,且对于贴壁细胞的回收较为困难。如何结合液滴微流控的优势,实现限定表面的贴壁细胞的生长,以及生长细胞的回收,仍然是目前的一个难题。
技术实现要素:
本发明提供了一种用于液滴固着培养的装置及固着培养方法,利用微液滴固着部件的亲水性区域固着微液滴,限制细胞的生长区域,实现贴壁和非贴壁生长细胞的培养,并利用液滴输送通道生成部件向固着的微液滴输送培养基,并实现细胞释放物质的回收。该技术对于贴壁生长的细胞可以进行长时间培养,对于非贴壁细胞,可以进行高通量的阵列分隔培养和回收。
本发明的另一个方面,提供一种用于细胞固着培养的装置,包括微流控芯片及微液滴固着部件;
所述微流控芯片设有溶液注入通道和液滴输送通道;所述溶液注入通道与所述液滴输送通道相连通;所述溶液注入通道一端开设有溶液注入口,另一端与所述液滴输送通道相连通;所述液滴输送通道一端开设油相载液输入口,另一端开设有液滴排出口;
所述微液滴固着部件设置在所述液滴输送通道底面或顶面。
以上所述的装置,所述溶液注入通道和所述液滴输送通道表面疏水,所述微液滴固着部件表面亲水。
以上所述的装置,所述液滴输送通道内包含单个或多个微液滴固着部件。
以上所述的装置,所述微流控芯片设有1个或多个溶液注入通道,所述1个或多个溶液注入通道都与所述液滴输送通道相连通。
以上所述的装置,所述液滴输送通道的宽度为20μm–10mm,高度为10μm–5mm,长度为500μm–5000mm;优选的,所述液滴输送通道的宽度为100μm-1mm,高度为50μm-500μm,长度为 5mm–50mm。
以上所述的装置,所述微液滴固着部件在所述液滴输送通道宽度方向上的尺寸小于或等于所述液滴输送通道的宽度,所述微液滴固着部件在所述液滴输送通道宽度方向上的尺寸优选在5μm–5mm之间,更优选在25μm–500μm之间。
以上所述的装置,微液滴固着部件分布区域的长度小于或等于液滴输送通道的长度,优选在5μm到50mm之间,更优选在25μm–5mm之间。
本发明的另一个方面,提供一种利用以上任一所述的装置固着培养细胞的方法,包括如下步骤:
a)从所述溶液注入口注入细胞悬液,从所述油相载液输入口注入油相载液,在所述液滴输送通道内形成流动的油水间隔液流;
b)油水间隔液流内的细胞悬液液滴在流经所述微液滴固着部件时,与所述微液滴固着部件表面发生融合,使部分包含细胞的微液滴吸附在所述微液滴固着部件上;
c)培养悬浮细胞时,停止溶液注入,用油相载液冲走通道内的液滴,静置培养;
培养贴壁生长的细胞时,从所述溶液注入口注入细胞培养液,从所述油相载液输入口注入油相载液,在液滴输送通道内形成流动的油水间隔液流,进行不间断营养供给培养;
d)固着液滴的培养及观察:培养吸附在所述微液滴固着部件上的细胞并观察、记录;
e)收集细胞:通过所述液滴排出口排出所述微液滴固着部件(2)上吸附的微液滴及其中的游动和脱落细胞并收集;或通入细胞洗脱液,将固着的细胞洗脱并收集。
以上所述的固着培养细胞的方法,步骤c)中还包括通过所述溶液输入口注入其他试剂溶液,所述其他试剂溶液包括细胞刺激和诱导试剂、细胞裂解液、细胞染色试剂、与固着细胞有相互作用的细胞、病毒以及质粒悬液。
在上述技术方案中,所述细胞包括细菌、藻类、真菌、多细胞微 生物、动物以及高等植物细胞。
本发明提供的用于细胞固着培养的装置包括微流控芯片及微液滴固着部件,细胞悬液通过微流控芯片能够产生稳定的包裹细胞的液滴,并通过注入连续的油相液体载流,将包裹细胞的液滴输送到微液滴固着部件,形成含细胞的附着液滴,液滴在后续培养时,还可以通过溶液注入通道注入营养物质溶液或测试溶液,通过液滴融合的形式给微液滴中的细胞供给营养或进行测试,实现细胞培养以及后续分析等操作。本发明的优势在于细胞在微液滴固着部件的一个表面生长,适于对贴壁细胞的培养,并且容易观察和量化,还可以通过脉冲式供给营养保持稳定流动,促进细胞生长;细胞生长的空间、时间等可以通过载流油相液体流动速度的变化进行精确调节;提高通量后可以应用于单细胞细菌、真菌、动物细胞等的大批量筛选、获取和分析。
本发明除了进行限定区域的细胞固着培养外,还可以通过采用多个溶液入口分别引入不同组分的液滴,对培养的细胞进行周期性的刺激,便于实验操作。
本发明还可以通过增加微液滴固着部件的数量来实现阵列化的单细胞液滴培养。
附图说明
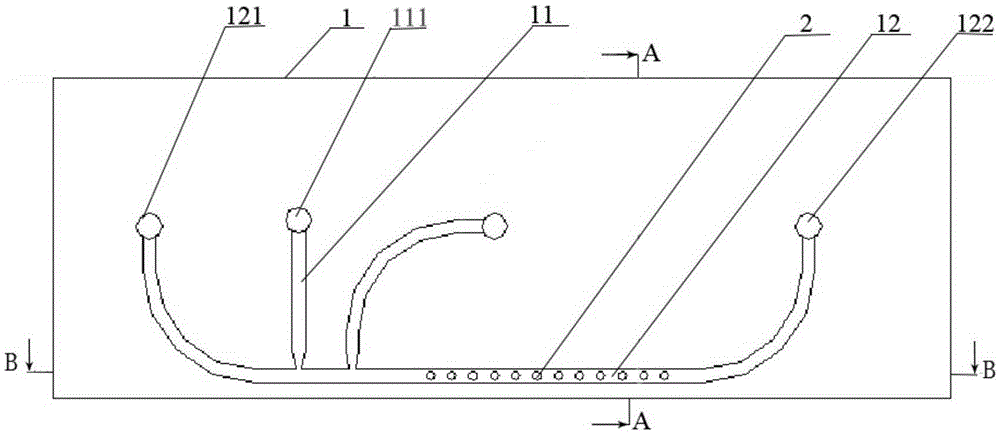
图1为本发明实施例1的用于细胞固着培养的装置的平面图;
图2为本发明实施例1的用于细胞固着培养的装置的立体结构示意图;
图3为本发明图1的用于细胞固着培养的装置A-A方向剖视图;
图4为本发明图1的用于细胞固着培养的装置B-B方向剖视图;
图5为利用本发明实施例1的用于细胞固着培养的装置的一种变形进行细胞悬液接种和微液滴固着培养流程示意图;
图6为利用本发明实施例1的用于细胞固着培养的装置的另一种变形进行细胞悬液接种和微液滴固着培养流程示意图;
图7为本发明实施例1的用于细胞固着培养的装置使用方法的流程图;
图8A为本发明实施例1所形成的色素溶液微液滴固着部件阵列显微照片(比例尺:200μm);
图8B为本发明实施例1所形成的单个固着微液滴的初始阶段(0h)明场显微照片(比例尺:100μm);
图8C为本发明实施例1所形成的单个固着微液滴的初始阶段(0h)绿色荧光显微照片(比例尺:100μm);
图9A为本发明实施例1所形成的单个固着微液滴的24h后的细菌生物被膜阶段明场显微照片(比例尺:100μm);
图9B为本发明实施例1所形成的单个固着微液滴的24h后的细菌生物被膜阶段绿色荧光显微照片(比例尺:100μm);
图10为本发明实施例2对已形成的单个固着微液滴PAO1生物被膜,在培养液滴中加入抗生素处理前后绿色荧光显微照片对比(比例尺:100μm);
图11为本发明实施例3中用大规模的微液滴固着部件阵列用于细胞固着培养的装置示意图;
图12本发明实施例4中用宽通道容纳并行的微液滴固着部件阵列用于细胞固着培养的装置示意图。
其中,1为微流控芯片;
11为溶液注入通道,12为液滴输送通道,11a为第一溶液注入通道,11b为第二溶液注入通道;
111为溶液注入口;
121为油相载液输入口,122为液滴排出口,123为液滴收集装置;
101为微流控芯片上层,102为微流控芯片下层;
2为微液滴固着部件;
3为微液滴。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
图1至图4所示,本实施例的用于细胞固着培养的装置包括微流控芯片1及微液滴固着部件2,微流控芯片1设有溶液注入通道11、液滴输送通道12,溶液注入通道11与液滴输送通道12相连通。微液滴固着部件2设置在液滴输送通道12底面。
微流控芯片1由上下两层结构组合而成,上层101开设有液体注入凹槽和液体输送凹槽,上层101与下层102之间固定连接时,上层101的液体注入凹槽和液体输送凹槽扣合在下层102的上表面,形成溶液注入通道11和液滴输送通道12,上层101与溶液注入通道相对应的部位开设有溶液注入口111,上层101与液滴输送通道12一端相对应的部位开设有油相载液输入口121,与液滴输送通道12另一端相对应的位置开设有液滴排出口122;
微流控芯片的上层101材料为PDMS(polydimethylsiloxane,聚二甲基硅氧烷),为透明材质;下层102材料为透明玻璃,便于全方位观察微液滴3的情况。
具体地,本实施例的微液滴生成及固着装置的溶液注入通道11分为第一溶液注入通道11a和第二溶液注入通道11b,第一溶液注入通道11a和第二溶液注入通道11b都与液滴输送通道12相连通。
微流控芯片1的下层102表面具有进行亲水处理形成的微液滴固着部件2,微液滴固着部件2在所述液滴输送通道宽度方向上的尺寸优选在5μm–5mm之间,更优选在25μm–500μm之间。
以上所述的装置中的微液滴固着部件2进行亲水处理的步骤包括:首先,将所述液滴输送通道12底面的多个微液滴固着部件2使用正性光刻胶选择性覆盖保护;第二,对所述微流控芯片1,和硅烷化试剂(二氯二甲基硅烷)一同放置于真空干燥器皿中,并抽真空,使硅烷化试剂挥发并与芯片表面反应,再通过65℃加热台烘干,使通道表面疏水,而微液滴固着部件2表面由于光刻胶保护保持亲水属性;最后,用无水乙醇清洗掉正性光刻胶,露出亲水的微液滴固着部件表面。需要说明的是,现有技术中可以采用多种方式进行材料表面的亲水处理,此处仅为举例说明但并非对亲水处理方法的限制。
第一溶液注入通道11a和第二溶液注入通道11b长度为4000μm,宽度为300~500μm,高度为100~300μm;液滴输送通道12的长度为10000μm,宽度为300~500μm,高度为100~300μm;液滴排出口122的直径与收集微液滴所用的装置直径相适应。需要说明的是,第一溶液注入通道11a、第二溶液注入通道11b和液滴输送通道12的长度可根据需要并适应微流控芯片的规格进行适当选择,此处仅为举例说明而并非限制。
利用本发明实施例的细胞固着培养装置固着培养细胞的简要步骤如图7所示,主要包括:
(1)从溶液注入口111注入细胞悬液,从油相载液输入口121注入油相载液,在液滴输送通道12内形成流动的油水间隔液流,具体步骤如下:
制备细胞悬液:选取绿色荧光蛋白标记的铜绿假单胞菌PAO1作为模式菌株。菌株保存在15%甘油中,实验时先将菌株接种在Luria-Bertani(LB)培养基平板上,30℃培养24h;然后取少量菌体接种于LB液体培养基中培养12h,调整至合适浓度备用,LB培养基购买于生工生物工程(上海)股份有限公司。铜绿假单胞菌PAO1容易形成生物被膜,绿色荧光蛋白标记的便于对菌的生长状况进行实时观察和定量。将铜绿假单胞菌PAO1在LB液体培养基中培养到OD=0.4左右,离心收集菌体,用新的LB液体培养基重悬菌体细胞作为待测样品。选取矿物油作为油相载液。
将细胞悬液、培养液、油相载液分别装载到250μL、1000μL、2000μL的注射器中,并将注射器固定到可编程控制的注射泵(Pump 11Elite,Harvard Apparatus,美国)上,用来控制流速。油相载液通过油相载液输入口121注入液滴输送通道12,细胞悬液通过第一溶液注入通道11a注入液滴输送通道12,油相载液按500-3000nL/min的速度持续注入,细胞悬液按150-500nL/min的速度注入,持续120min,在液滴输送通道12内形成流动的油水间隔液流。
(2)油水间隔液流内的细胞悬液液滴在流经所述微液滴固着部件2时,与所述微液滴固着部件2表面发生融合,使部分包含细胞的微液滴吸附在所述微液滴固着部件2上。
(3)当微液滴固着部件2上都吸附了微液滴3后,停止细胞悬液的注入,从第二溶液注入通道11b按300nL/min的速度,将油相载液和铜绿假单胞菌PAO1的培养液灌注到液滴输送通道12中,连续注入24小时,培养液形成的微液滴3会与附着在微液滴固着部件2上的含有菌体细胞的微液滴3进行液体交换,附着在微液滴固着部件2上的菌体可以不断获取新的养分。
(4)固着液滴的培养及观察:在倒置荧光显微镜下观察铜绿假单胞菌PAO1的生长情况,并拍照记录。图8C和图9B分别是0h和24h对同一个微液滴的在488nm激发和518nm发射的荧光照片,从图中可以看出,24h时具有绿色荧光的铜绿假单胞菌生物被膜充满了附着液滴。图8B和图9A分别是0h和24h对同一个微液滴的明场显微照片,从图中可以看出形成固着微体积液滴的情况及细菌细胞吸附后群体生长及形成生物被膜的情况。
(5)收集细胞:将液体收集装置123(外径0.8mm的特氟龙毛细管)一端连接泵管一端与液滴排出口122相连接,将附着的微液滴3及其中的铜绿假单胞菌抽出至特氟龙毛细管中。特氟龙毛细管作为微液滴3收集装置可以稳定的储存液滴,形成一维液滴阵列,避免液滴的蒸发,并方便对液滴中的细胞进行孵育和生长的观察。
为了进一步说明以上装置的操作,图8A展示了本实施例的用于细胞固着培养的装置的微液滴固着部件2附着了含色素液滴的显微 照片。液滴输送通道12通入红色素溶液或绿色素溶液,然后再通入油相载液,在液滴输送通道12的微液滴固着部件2阵列上会附着形成大小均一的色素液滴。
如图5所示,本实施例的用于细胞固着培养的装置中,第一溶液注入通道11a和第二溶液注入通道11b还可以分设在液滴输送通道12两侧,都与液滴输送通道12相连通。
如图6所示,本实施例的用于细胞固着培养的装置中,第一溶液注入通道11a和第二溶液注入通道11b分设在液滴输送通道12两侧相对设置,在液滴输送通道12中与第一溶液注入通道11a和第二溶液注入通道11b接入口相对的部位设置隔挡部件,可用于分隔第一溶液注入通道11a和第二溶液注入通道11b注入的液体。
实施例2
选取铜绿假单胞菌PAO1菌悬液,利用本发明实施例1的用于细胞固着培养的装置观察抗生素对生物被膜的消除作用。绿色荧光蛋白标记的铜绿假单胞菌PAO1在LB培养基中培养到OD=0.4左右,离心去除培养基,并用LB培养液重悬,作为待测样品。选取LB培养基,矿物油作为油相载液。
按照实施例1的实验条件对待测样品进行附着培养,对PAO1微液滴在实施例1中的用于细胞固着培养的装置中持续培养20小时,使固着微液滴中形成生物被膜,之后在注入的培养液中添加抗生素头孢吡肟(100μg/mL),生成的含有抗生素的流动液滴对形成的生物被膜处理1小时,采用明场和绿色荧光分别拍照。其结果如图10所示。可以看到,处理1小时后,液滴中的荧光强度有很大减弱,铜绿假单胞菌PAO1的生物被膜被大部分消除。
因此,可以说明本发明对于观察研究未知生物样品在生物被膜的消除方面具有应用价值。
实施例3
图11所示,本发明的装置的液滴输送通道12为蛇行通道,该装 置被应用于液滴阵列单细胞培养和分析的研究,可提高研究的通量。本实施例中,装置仅设有液滴输送通道12,液滴输送通道12长度为30-100cm,宽度为300-500μm,高度为150-300μm;需要说明的是,通道长度可根据需要并适应微流控芯片的规格进行适当选择。
本发明实施例的微液滴生成及固着培养装置应用的简要步骤包括:
从油相载液输入口121先通入隐球菌悬液充满通道,再通入油相载液,菌悬液浓度为1×106CFU/mL,最后在液滴排出口122处以一定压力抽取,隐球菌悬液液滴在抽取过程中通过液滴输送通道12的微液滴固着部件2时会附着在微液滴固着部件2上形成固着微液滴阵列。形成附着微液滴体积约为0.5nL时,液滴内的隐球菌的个数为1个或0个。
本实施例可用于在固着微液滴内进行隐球菌的生长特性研究,可以观察隐球菌的单细胞多态性。本实施例的优势在于,固着微液滴的微液滴固着部件的位置容易精确定位,进行选择性富集后可以进行单细胞基因测序的研究。
实施例4
图12所示,本发明的装置的液滴输送通道12为宽通道。本实施例中,装置仅设有液滴输送通道12,通道长度3-5cm,宽度0.5-1cm,高度500μm,油相载液输入口121直径1mm。固着微液滴的微液滴固着部件2的直径为300-500μm,间隔300-500μm,微液滴固着部件2共9排,每排39个液滴,共形成351个微液滴,液滴排出口122的直径为0.6mm。油相载液输入口121和液滴排出口122直径一般为0.8-1mm,可以保持一致。需要说明的是,液滴输送通道宽度、长度及微液滴固着部件的数量都可以根据需要并适应微流控芯片的规格进行适当选择。
本发明实施例的微液滴生成及固着装置应用的简要步骤包括:
从液滴输送通道12的油相载液输入口121先通入铜绿假单胞菌PAO1菌株及突变株菌株悬液充满通道,其浓度为1×105CFU/mL,再 通入油相载液,油相载液将多余的菌液推出液滴输送通道12,液滴输送通道12中的多排微液滴固着部件2会吸附微液滴,在通道中形成固着微液滴阵列,形成附着微液滴体积约为1.0nL时,部分液滴内的细菌的个数为1个。培养一段时间后,再通过液滴输送通道12连续通入培养液流动培养。
本实施例可用于在液滴内进行不同菌株的吸附特性研究,可以观察不同菌株的细胞黏附性。本实施例的优势在于,固着微液滴阵列的通量较高,位置容易确定。
最后应说明的是:显然,上述实施例仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!