保护与修复线粒体及促进干细胞增生的方法与流程
本发明涉及一种保护与修复线粒体(粒线体)及促进干细胞增生的方法,特别是一种利用余甘子(Emblica Officinalis)萃取物保护与修复线粒体及促进干细胞增生的方法。
背景技术:
线粒体(Mitochondria)是细胞内进行氧化磷酸化和合成三磷酸腺苷(ATP)的主要场所。由于三磷酸腺苷为细胞活动的能量来源,所以线粒体又有“细胞能量工厂”之称。除了为细胞提供能量外,线粒体还参与细胞分化、细胞信息传递和细胞凋亡等过程,并拥有调控细胞生长周期的能力。
然而,线粒体在进行氧化磷酸化反应时产生的部份副产物对于线粒体的内膜是有害的。长期累积下来,严重受损的线粒体内膜将触发线粒体崩解,进而触发细胞凋亡。因此,如何修补与保护线粒体以减缓线粒体崩解所触发的细胞凋亡的速度已成为一个重要的课题。
技术实现要素:
本发明的目的在于提供一种保护与修复线粒体及促进干细胞增生的方法,使其可以利用余甘子(Emblica Officinalis)萃取物保护与修复线粒体及促进干细胞增生,借此延缓线粒体崩解所触发细胞凋亡的速度。
为实现上述目的,本发明提供一种保护与修复线粒体的方法,包含提供一余甘子(Emblica Officinalis)萃取物予一细胞的步骤,用以提高该细胞内的多个线粒体进行氧化磷酸化反应与三磷酸线苷(ATP)合成的能力。
其中,该余甘子萃取物的浓度为每毫升20至50微克(μg/ml)。
其中,提供该余甘子萃取物予该细胞的步骤包含食用该余甘子萃取物。
其中,食用的该余甘子萃取物的有效剂量为216毫克(mg)至540毫克。
其中,该余甘子萃取物提高该线粒体的预存耗氧能力(Spare Respiratory Capacity)。
其中,该余甘子萃取物提高该线粒体进行该氧化磷酸化反应的基础耗氧量。
其中,该余甘子萃取物提高该线粒体进行该氧化磷酸化反应的基础耗氧量中使用于合成三磷酸线苷的媒合效率(Coupling Efficiency)。
其中,该余甘子萃取物降低该线粒体的氢离子泄漏(Proton Leakage)。
其中,该余甘子萃取物提高该线粒体的三磷酸腺苷产量。
本发明还提供一种促进干细胞增生的方法,包含提供一余甘子萃取物予一干细胞的步骤,用以增加该干细胞进行细胞分裂的次数。
其中,该余甘子萃取物的浓度为每毫升50至1200微克(μg/ml)。
其中,提供该余甘子萃取物予该干细胞的步骤包含食用该余甘子萃取物。
其中,食用的该余甘子萃取物的有效剂量为540毫克(mg)至12960毫克。
根据上述本发明所公开的保护与修复线粒体及促进干细胞增生的方法,提供余甘子萃取物予细胞可保护与修复线粒体的内膜以延缓线粒体发生崩解的时间,提供余甘子萃取物予干细胞可增加干细胞进行细胞分裂次数。如此一来,可减缓线粒体崩解触发细胞凋亡的速度以及提供更多的具有高分化潜能的干细胞,以便进行细胞分化后取代受损或死去的细胞。
以下结合附图和具体实施例对本发明进行详细描述,但不作为对本发明的限定。
附图说明
图1为实施例一至实施例二、比较例一至比较例五与控制组的合成三磷酸线苷的耗氧量示意图。
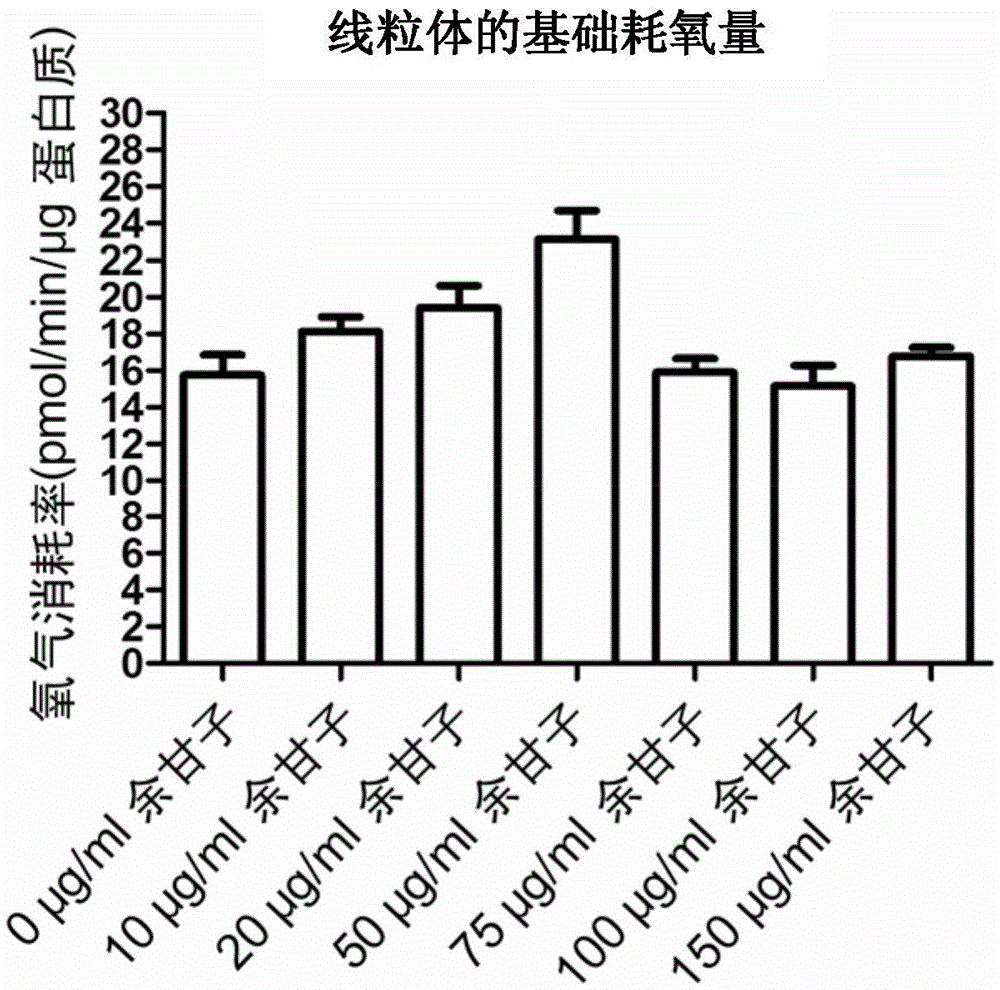
图2为实施例一至实施例二、比较例一至比较例五与控制组的线粒体的基础耗氧量示意图。
图3为实施例一至实施例二、比较例一至比较例五与控制组的克服自由基泄漏的耗氧量示意图。
图4为实施例一至实施例二、比较例一至比较例五与控制组的线粒体的最大耗氧能力示意图。
图5为实施例一至实施例二、比较例一至比较例五与控制组的线粒体的预 存耗氧能力示意图。
图6为实施例一至实施例二、比较例一至比较例五与控制组的线粒体的三磷酸线苷媒合效率示意图。
图7为实施例一至实施例二、比较例一至比较例五与控制组的非线粒体耗氧量示意图。
图8为实施例三至实施例十与比较例六至比较例七的干细胞发出的荧光强度比示意图。
具体实施方式
以下在实施方式中详细叙述本发明的详细特征以及优点,其内容足以使本领域技术人员了解本发明的技术内容并据以实施,且根据本说明书所公开的内容、权利要求及图式,本领域技术人员可轻易地理解本发明相关的目的及优点。以下的实施例进一步详细说明本发明的观点,但非以任何观点限制本发明的范畴。
余甘子(Phyllanthus Emblica或Emblica Officinale),又称余柚子、油柑、庵摩勒(Amalaka)、马六甲树(Pokok Melaka)、印度醋栗(Indian Gooseberry),属于大戟科余甘子属(Emblica)的落叶亚乔木,分布于自印度至马来西亚地区及中国南部,一般认为印度为原产地。
本发明使用的余甘子萃取物的取得方式例如以二氧化碳作为超临界流体萃取余甘子果实,或者是以甲醇、乙醇、丙酮、乙酸乙酯、重量百分浓度0.1至5%的氯化钠水溶液、氯化钾水溶液、氯化钙水溶液、氯化镁水溶液或重量百分浓度0.1至5%的氯化钠乙醇溶液、氯化钾乙醇溶液、氯化钙乙醇溶液、氯化镁乙醇溶液作为溶剂萃取余甘子果实而得到一初萃液。接着,将初萃液过滤纯化后得到本发明所使用的余甘子萃取物。
当提供浓度为每毫升20至50微克(μg/ml)的余甘子萃取物予细胞,进入细胞内的余甘子萃取物可保护与修复线粒体的内膜。如此一来,于线粒体内膜进行的氧化磷酸化反应以合成三磷酸线苷的效率得到提升。详细来说,经余甘子萃取物修复的线粒体进行氧化磷酸化反应合成的三磷酸线苷数量提高,线粒体的基础耗氧量提高,线粒体内膜的氢离子泄漏量下降,粒线体的最大耗氧能力提高,线粒体的预存耗氧能力提高,线粒体的三磷酸线苷媒合效率提高。
提供余甘子萃取物予细胞的方法例如为以食用的方式由口摄取余甘子萃取物。以食用的方式提供余甘子萃取物予细胞时,余甘子萃取物的有效剂量为216毫克(mg)至540毫克。此处的有效剂量根据细胞实验的有效剂量与人体公斤数的换算公式进行换算得到。换算公式如下:人体有效剂量=细胞实验的有效剂量×小鼠体重×折算系数×人体公斤数。折算系数由动物与人体的每公斤体重剂量折算系数表查表得到。当小鼠体重为20克以及人体公斤数为60公斤时,折算系数为9.01。
再者,随着线粒体的氧化磷酸化反应合成三磷酸线苷数量提升,可供细胞生长与分裂使用的能量也跟着提升,有利于细胞进行增生。因此,提供浓度为每毫升50至1200微克(μg/ml)的余甘子萃取物予干细胞后,干细胞的增生速度得到提升。其中,当提供浓度为每毫升50至800微克(μg/ml)的余甘子萃取物予干细胞后,干细胞的增生速度提升效果更为显着。
提供余甘子萃取物予干细胞的方法例如为以食用的方式由口摄取余甘子萃取物。以食用的方式提供余甘子萃取物予干细胞时,余甘子萃取物的有效剂量为540毫克(mg)至12960毫克。当余甘子萃取物的有效剂量为540毫克至8640毫克时,干细胞的增生速度提升效果更为显着。
为方便以食用的方式由口摄取余甘子萃取物,余甘子萃取物可制成例如液体状、固体状、颗粒状、粉体状、糊状或凝胶状的余甘子萃取物加工品。余甘子萃取物加工品中可搭配作为添加剂的赋形剂或呈味剂,以提升风味与方便食用。
赋形剂例如为小麦淀粉、米淀粉、玉米淀粉、马铃薯淀粉、糊精、环糊精等淀粉类;结晶纤维素类;乳糖、葡萄糖、砂糖、还原麦芽糖、饴糖、果寡糖、乳化寡糖等糖类;山梨糖醇、赤藻糖醇、木糖醇、乳糖醇、甘露醇等糖醇类。
呈味剂例如为龙眼萃取物、荔枝萃取物、柚子萃取物等各种果汁萃取物;苹果汁、橘子汁、柠檬汁等各种果汁;桃子香料、梅子香料、酸奶酪香料等各种香料;乙酰磺胺酸钾、蔗糖素、赤藻糖醇、寡糖类、甘露糖、木糖醇、异构化糖类等各种甜味剂;柠檬酸、苹果酸、酒石酸、葡萄糖酸等各种酸味剂;绿茶、乌龙茶、巴拿巴茶(Banaba tea)、杜仲茶、铁观音茶、薏苡茶、七叶胆茶、茭白茶、昆布茶等各种茶成分等。
此外,着色剂、防腐剂、增黏剂、结合剂、崩解剂、分散剂、稳定剂、胶 化剂、抗氧化剂、界面活性剂、防腐剂、pH值调整剂等符合政府单位规定的添加物亦可依照政府单位规定的剂量标准与加工生产的需求添加于余甘子萃取物加工品中。
以下借由本发明实施例一至二与比较例一至五说明本发明所公开的保护与修复线粒体的方法,并且进行实验测试以说明本发明所公开的保护与修复线粒体的方法的功效。
实验使用的细胞为第六代(P6)的脂肪间叶干细胞(ADSC)。实验样品准备方式为于孔盘的每一个孔中植入8000个脂肪间叶干细胞后培养24个小时。实验中,模拟线粒体受损状况的方式为将细胞暴露于浓度200mM的H2O2中30分钟,接着再以磷酸缓冲生理食盐水(Phosphate buffered saline,PBS)清洗细胞。
于实验过程中,首先将预定浓度的余甘子萃取物加入孔中并浸泡24小时。接着,将浓度为200mM的H2O2加入孔中,使细胞浸泡于浓度为200mM的H2O2中30分钟。接着,以磷酸缓冲生理食盐水(Phosphate buffered saline,PBS)清洗细胞。最后,以海马生物能量测定仪量测孔中细胞的氧气消耗量。
海马生物能量测定仪的测量原理与流程如下。首先,检测孔中细胞的基础耗氧量。接着,加入三磷酸线苷合成酶抑制剂以抑制粒线体产生三磷酸线苷,此时减少的耗氧量即为合成三磷酸线苷的耗氧量。接着,加入适当浓度的抗耦合剂,在不破坏线粒体内膜的电子传递链的情况下,让粒线体以极限状况空转以评估粒线体的最大耗氧能力。最后,加入电子传递链抑制剂已完全关闭粒线体的耗氧,借此确认量测的背景值,亦即是非线粒体耗氧量。线粒体的基础耗氧量等于细胞的基础耗氧量减去非线粒体耗氧量。线粒体的基础耗氧量减去合成三磷酸线苷消耗的氧气量等于克服自由基泄漏的耗氧量。线粒体的最大耗氧能力减去线粒体的基础耗氧量等于线粒体的预存耗氧能力。线粒体的三磷酸线苷媒合效率等于合成三磷酸线苷耗氧量除以线粒体的基础耗氧量。
实施例一至实施例二与比较例一至比较例五的余甘子萃取物浓度与实验量测结果如表一所示。表一中呈现的实验量测结果为已对细胞量进行标准化后的实验量测结果。
表一
请参照图1至图8与表一。图1为实施例一至实施例二、比较例一至比较例五的合成三磷酸线苷的耗氧量示意图。图2为实施例一至实施例二、比较例一至比较例五的线粒体的基础耗氧量示意图。图3为实施例一至实施例二、比较例一至比较例五的克服自由基泄漏的耗氧量示意图。图4为实施例一至实施例二、比较例一至比较例五的线粒体的最大耗氧能力示意图。图5为实施例一至实施例二、比较例一至比较例五的线粒体的预存耗氧能力示意图。图6为实施例一至实施例二、比较例一至比较例五的线粒体的三磷酸线苷媒合效率示意图。图7为实施例一至实施例二、比较例一至比较例五的非线粒体耗氧量示意图。
如图1所示,实施例一与实施例二的合成三磷酸线苷的耗氧量高于比较例一至比较例五。如图2所示,实施例一与实施例二的线粒体的基础耗氧量高于比较例一至比较例五。如图3所示,实施例一与实施例二的克服氢离子泄漏的耗氧量低于比较例一至比较例五。如图4所示,实施例一与实施例二的线粒体的最大耗氧能力高于比较例一至比较例五。如图5所示,实施例一与实施例二的线粒体的预存耗氧能力高于比较例一至比较例五。如图6所示,实施例一与实施例二的线粒体的三磷酸线苷媒合效率高于比较例一至比较例五。如图7所示,实施例一、实施例二与比较例一至比较例五的非线粒体耗氧量无明显变化,余甘子萃取物主要对线粒体的耗氧量产生影响,对细胞中其它胞器的耗氧量无明显影响。因此,由图1至图7可知实施例一与实施例二的线粒体增加的基础耗氧量主要用作合成三磷酸线苷,使得三磷酸线苷的合成量增加,亦即是线粒体的三磷酸线苷媒合效率提高。同时,实施例一与实施例二的线粒体内膜的氢离子泄漏量下降,使得线粒体重新将氢离子输送至膜间隙的所消耗氧气量减少,代表的是线粒体内膜破损的情况受到余甘子萃取物的修复而改善。
根据上述实验测试结果,以浓度为20μg/ml至50μg/ml的余甘子萃取物处理后的线粒体受到余甘子萃取物的保护而降低线粒体内膜受到氧化剂的破坏。同时,线粒体内膜也受到余甘子萃取物的修复,使得自膜间隙穿过破损的内膜泄漏至基质中的氢离子量下降,进而使得线粒体重新将氢离子输送至膜间隙所消耗氧气量减少。
以下借由本发明实施例三至实施例十与比较例六至比较例七说明本发明所公开的促进干细胞增生的方法,并且进行实验测试以说明本发明所公开的促进 干细胞增生的方法的功效。
实验使用的细胞为脂肪间叶干细胞。实验样品准备方式为于孔盘的每一个孔中植入2000个脂肪间叶干细胞后培养24个小时。
于实验过程中,首先将预定浓度的余甘子萃取物加入孔中并浸泡24小时。接着,孔中的培养基更换为含有10%Alamar Blue试剂的培养基并培养4小时。干细胞中线粒体内的酵素(NADH)将原本深蓝色无荧旋光性的Alamar Blue还原成粉红色高荧旋光性的产物。最后,判读孔中的荧光强度。
实施例三至实施例十与比较例六至比较例七的余甘子萃取物浓度如表二所示。
表二
请参照图8与表二。图8为实施例三至实施例十与比较例六至比较例七的干细胞发出的荧光强度比示意图。如图8所示,以比较例六的未给予余甘子萃取物的干细胞发出的荧光强度作为基准,实施例三浸泡浓度为50μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.20倍。实施例四浸泡浓度为100μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.22倍。实施例五浸泡浓度为200μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.27倍。实施例六浸泡浓度为400μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.28倍。实施例七浸泡浓度为600μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.28倍。实施例八浸泡浓 度为800μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.23倍。实施例九浸泡浓度为1000μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.12倍。实施例十浸泡浓度为1200μg/ml的余甘子萃取物的干细胞发出的荧光强度为比较例六的1.10倍。荧光强度越强代表被干细胞线粒体内的酵素还原成粉红色高荧旋光性产物的Alamar Blue的数量越多,代表线粒体的数量越多进而可推得干细胞的数量越多。因此,由图8的荧光强度比可知提供浓度50μg/ml至1200μg/ml的余甘子萃取物予干细胞可增加干细胞进行细胞分裂的次数以得到更多的干细胞,且当余甘子萃取物浓度为50μg/ml至800μg/ml时,可达到更佳的细胞增生效果。
根据上述本发明所公开的保护与修复线粒体的方法,提供余甘子萃取物予细胞以保护与修复线粒体的内膜以延缓线粒体发生崩解的时间。如此一来,可减缓线粒体崩解触发细胞凋亡的速度。
再者,根据上述本发明所公开的促进干细胞增生的方法,提供余甘子萃取物予干细胞以增加干细胞进行细胞分裂次数。如此一来,可提供更多的具有高分化潜能的干细胞,以便进行细胞分化后取代受损或死去的细胞。
当然,本发明还可有其它多种实施例,在不背离本发明精神及其实质的情况下,熟悉本领域的技术人员可根据本发明作出各种相应的改变和变形,但这些相应的改变和变形都应属于本发明权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!