Muts型重组毕赤酵母的发酵控制工艺的制作方法
本发明属于微生物发酵领域,具体涉及muts型重组毕赤酵母的发酵控制工艺。
背景技术:
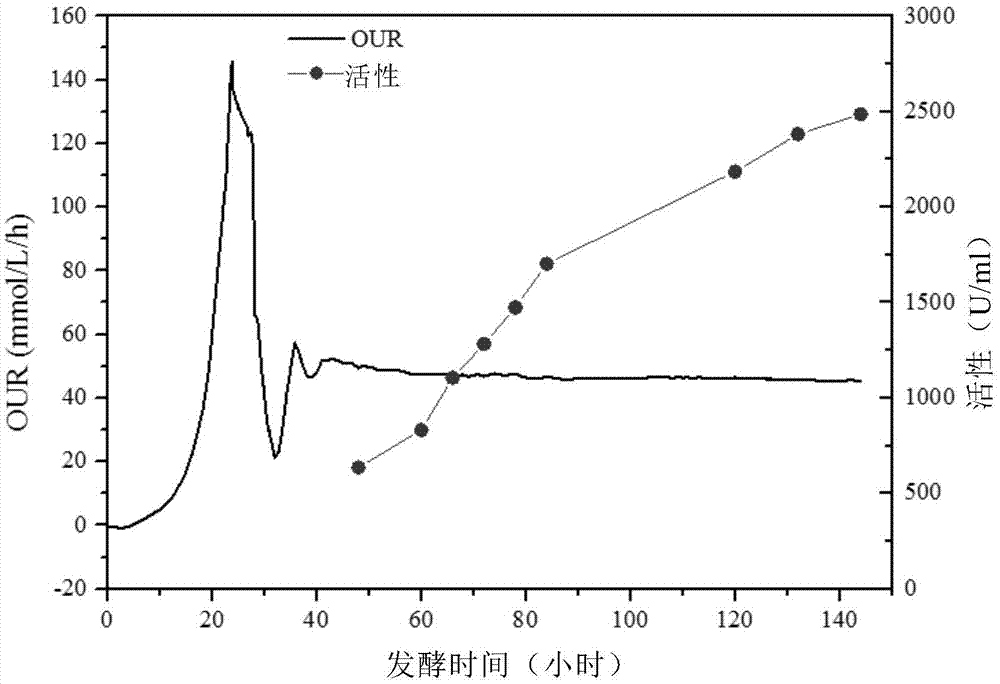
:甲醇型毕赤酵母是表达异源蛋白的最重要平台,目前已有超过600种重组蛋白可在毕赤酵母宿主菌内表达〔zhangal、luojx、zhangty、panyw、tanyh、fucy和tufz,2009,recentadvancesonthegappromoterderivedexpressionsystemofpichiapastoris,molbiolrep36:1611-1619〕。发酵过程甲醇速率流加的最优控制是保证异源蛋白的活性得到最大化表达的关键。甲醇型毕赤酵母根据重组过程中乙醇氧化酶基因(aox1和aox2)的破坏情况,分为三种类型〔looserv、bruhlmannb、bumbakf、stengerc、costam、camattaria.、fotiadisd、kovark.,2015,cultivationstrategiestoenhanceproductivityofpichiapastoris:areview,biotechnoladv(inpress)〕:(1)aox1和aox2都完好的为甲醇快速利用型(mut+),(2)只有aox1被破坏的为甲醇慢利用型(muts),(3)aox1和aox2均被破坏的为甲醇利用缺陷型(mut-)。使用最广泛的为前两种宿主菌,而目前针对的甲醇流加控制工艺大多数针对mut+型,如do-stat、qs-stat等来控制甲醇速率流加,而muts型毕赤酵母由于甲醇利用速率很慢,do-stat、qs-stat等控制策略均失效,因此甲醇流加的合理控制是muts毕赤酵母发酵的难点,只能(1)通过经验控制甲醇的流加(常规经验型控制工艺),如脉冲补入观察do的变化,如果补入后do下降,那么则机械地增加甲醇流加速率,或者(2)通过甲醇在线检测仪来反馈控制甲醇浓度处于恒定状态〔谢静莉、张励、叶勤、周庆玮、辛利、杜鹏、甘人宝,2003,muts型基因重组巴斯德毕赤酵母高密度发酵过程中甲醇流加的控制, 《无锡轻工大学学报》,22(1):12-15;周祥山、范卫民、张元兴,2002,不同甲醇流加策略对重组毕赤酵母高密度发酵生产水蛭素的影响,《生物工程学报》18(3):348-351〕,一般控制在3g/l内〔同〔looserv等〕,然而甲醇在线检测仪易受其它挥发性组分影响,非常容易漂移失灵〔高敏杰,基于智能工程和代谢调控的毕赤酵母发酵过程控制研究,博士学位论文,无锡:江南大学,2012〕,经常导致毕赤酵母的代谢活性受到高浓度甲醇抑制,极大影响异源蛋白的产量。针对上述问题,本发明提供了一种简单的甲醇在线控制策略,能使muts型毕赤酵母免受甲醇的毒害,保证异源蛋白产量持续增加,在甲醇在线检测仪失灵或缺失的情况下特别有效。该策略能比常规工艺控制下的异源蛋白产量提高2-5倍。技术实现要素:本发明提供判断muts型毕赤酵母发酵中甲醇过量或不足的方法,该方法包括在以0.8~1.8g/l/h的基础甲醇补料速率进行流加的发酵过程中,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度将甲醇加到发酵液中,并检测加入该甲醇后指定时间内发酵液的do和our相对于加入该甲醇前的do和our的变化,从而确定发酵液中的甲醇是过量还是不足。在一个或多个实施方案中,所述方法包括:(1)如果加入所述甲醇后在指定时间i内未出现高于2.5%的do下降程度,且our在加入甲醇后在指定时间ii内出现升高回落情形的,则停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降5%~50%;(2)如果加入所述甲醇后在指定时间iii内出现高于4.5%的do下降程度,且our升高至最高值后能够维持该最高值附近超过指定时间iv,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速5%~50%。在一个或多个实施方案中,所述发酵中,以1.0~1.5g/l/h的基础甲醇补料速率进行流加。在一个或多个实施方案中,每隔5~15小时以1.0~2.0g甲醇/l发酵液的 浓度加入甲醇。在一个或多个实施方案中,若出现(1)所述情形,停止甲醇流加2~4小时。在一个或多个实施方案中,(1)中所述升高指指定时间ii内our的最高增幅为至少1.5%,如至少2.0%,优选至少2.5%,所述回落指指定时间ii内our最高值与our最低值之间的差值为升高值的至少50%,如至少60%,至少70%,至少80%,至少85%,至少90%,或大于升高值。在一个或多个实施方案中,(2)中所述的最高值相对于加入甲醇前的our值具有至少3.0%的增幅,优选至少4.0%,如至少5.0%、至少6.0%、至少10.0%等的增幅。在一个或多个实施方案中,所述指定时间i为20分钟。在一个或多个实施方案中,所述指定时间i为15分钟。在一个或多个实施方案中,所述指定时间i为10分钟。在一个或多个实施方案中,所述指定时间ii为20分钟。在一个或多个实施方案中,所述指定时间ii为15分钟。在一个或多个实施方案中,所述指定时间ii为10分钟。在一个或多个实施方案中,所述指定时间iii为30分钟。在一个或多个实施方案中,所述指定时间iii为25分钟。在一个或多个实施方案中,所述指定时间iii为20分钟。在一个或多个实施方案中,所述指定时间iii为15分钟。在一个或多个实施方案中,所述指定时间iii为10分钟。在一个或多个实施方案中,所述指定时间iv为15分钟。在一个或多个实施方案中,所述指定时间iv为20分钟。在一个或多个实施方案中,所述指定时间iv为25分钟。在一个或多个实施方案中,所述指定时间iv为30分钟。在一个或多个实施方案中,第(1)种情况中,恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~40%,例如10%~30%。在一个或多个实施方案中,第(2)种情况中,在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~40%,例如10%~30%。在一个或多个实施方案中,(1)所述情况中,优选未出现do下降程度高于2.0%的情形。在一个或多个实施方案中,(2)所述情况中,优选出现高于5.0%的do下降程度,例如高于5.5%或高于6.0%的do下降程度。在一个或多个实施方案中,如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,在判定为甲醇过量,此时,停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%。在一个或多个实施方案中,如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则判定为甲醇不足,此种情况下,可立即在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。本发明还提供一种控制muts型毕赤酵母发酵中甲醇流加速率的方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后在指定时间i内未出现高于2.5%的do下降程度,且our在加入甲醇后在指定时间ii内出现升高回落情形的,则停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降5%~50%;(2)如果加入所述甲醇后在指定时间iii内出现高于4.5%的do下降程度,且our升高至最高值后能够维持在该最高值附近超过指定时间iv,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速5%~50%。在一个或多个实施方案中,所述发酵中,以1.0~1.5g/l/h的基础甲醇补料速率进行流加。在一个或多个实施方案中,每隔5~15小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇。在一个或多个实施方案中,若出现(1)所述情形,停止甲醇流加2~4小 时。在一个或多个实施方案中,(1)中所述升高指指定时间ii内our的最高增幅为至少1.5%,如至少2.0%,优选至少2.5%,所述回落指指定时间ii内our最高值与our最低值之间的差值为升高值的至少50%,如至少60%,至少70%,至少80%,至少85%,至少90%,或大于升高值。在一个或多个实施方案中,(2)中所述的最高值相对于加入甲醇前的our值具有至少3.0%的增幅,优选至少4.0%,如至少5.0%、至少6.0%、至少10.0%等的增幅。在一个或多个实施方案中,所述指定时间i为20分钟。在一个或多个实施方案中,所述指定时间i为15分钟。在一个或多个实施方案中,所述指定时间i为10分钟。在一个或多个实施方案中,所述指定时间ii为20分钟。在一个或多个实施方案中,所述指定时间ii为15分钟。在一个或多个实施方案中,所述指定时间ii为10分钟。在一个或多个实施方案中,所述指定时间iii为30分钟。在一个或多个实施方案中,所述指定时间iii为25分钟。在一个或多个实施方案中,所述指定时间iii为20分钟。在一个或多个实施方案中,所述指定时间iii为15分钟。在一个或多个实施方案中,所述指定时间iii为10分钟。在一个或多个实施方案中,所述指定时间iv为15分钟。在一个或多个实施方案中,所述指定时间iv为20分钟。在一个或多个实施方案中,所述指定时间iv为25分钟。在一个或多个实施方案中,所述指定时间iv为30分钟。在一个或多个实施方案中,第(1)种情况中,恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~40%,例如10%~30%。在一个或多个实施方案中,第(2)种情况中,在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~40%,例如10%~30%。在一个或多个实施方案中,(1)所述情况中,优选未出现do下降程度高于2.0%的情形。在一个或多个实施方案中,(2)所述情况中,优选出现高于5.0%的do下降程度,例如高于5.5%或高于6.0%的do下降程度。在一个或多个实施方案中,如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,在判定为甲醇过量,此时,停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%。在一个或多个实施方案中,如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后后能够维持在该最高值附近超过30分钟以上,则判定为甲醇不足,此种情况下,可立即在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。本发明还包括所述判断muts型毕赤酵母发酵中甲醇过量或不足的方法和/或所述控制muts型毕赤酵母发酵中甲醇流加速率的方法在muts型毕赤酵母发酵、发酵muts型毕赤酵母用于生产异源蛋白、提高异源蛋白的产量、以及以muts型毕赤酵母为宿主菌表达的异源蛋白的调控中的应用。附图说明图1显示单独采用do控制时的蛋白产量变化。图2显示单独采用our控制时的蛋白产量变化。图3显示采用甲醇浓度反馈控制时的蛋白产量变化。图4显示实施例4的流程工艺控制。图5显示实施例4的流程工艺控制。图6显示实施例4中do和our联动控制甲醇速率的工艺下的蛋白产量。具体实施方式在muts型毕赤酵母发酵过程中,通过甲醇脉冲补入后的do(溶氧)和our(摄氧率)响应的特征时间及程度来判断毕赤酵母是否处于甲醇过量状态,从而改变甲醇流加速率。采用本发明方法能比常规工艺控制下的异源蛋白产量提高2-5倍。具体而言,本发明提供判断muts型毕赤酵母发酵中甲醇过量或不足的方 法,该方法包括在以0.8~1.8g/l/h的基础甲醇补料速率进行流加的发酵过程中,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度将甲醇加到发酵液中,并检测加入该甲醇后指定时间(即特征时间)内发酵液的do和our相对于加入该甲醇前的do和our的变化程度,从而确定发酵液中的甲醇是过量还是不足。muts型毕赤酵母发酵通常包括三个阶段:甘油分批发酵阶段:初始od600约为0.1左右,初始甘油为5%;过程中调转数,通风,罐压使do%>20%;通常,此阶段持续约24小时;甘油限制性流加阶段:温度由初始30℃降为28℃,ph由原来5.5降为5,以恒定速率流加甘油使do控制在20%左右;当菌体湿重达到200g/l后,通过每隔0.5~1h脉冲补入0.5~1.5g/l的甲醇进行3~5次,让毕赤酵母进入甲醇适应期,适应期间our不断下降,然后开始反弹,最后our进入到一个平台期,表明毕赤酵母已能很好地适应并利用甲醇,可开始进行甲醇流加补料阶段;甘油限制性流加阶段结束时湿重在200~220g/l;此阶段通常持续2~7小时;甲醇流加阶段:通过以大约0.8~1.8g/l/h的基础甲醇补料速率进行流加。上述甘油分配发酵阶段和甘油限制性流加阶段可采用本领域常规的方法进行。通常,整个发酵周期均为144小时左右。在发酵之前,还可包括种子制备的步骤。可采用本领域常规的技术制备种子。例如,在一个具体实施方式中,从保藏在甘油管中的菌悬液中挑取一环在ypd平板上划线,在大约28℃的培养箱中培养至平板上长出单一、较大的菌落为止,挑取平板上单一较大的菌落接种到含ypd-甘油液体培养基的带挡板三角瓶中,在大约28℃培养16~20h,转种入种子罐后,再进行培养16~20h,使得od600在8~10,即得到种子液。发酵所有培养基也是本领域常规的培养基,且可根据不同的发酵菌株而不同。如前所述,本发明通过在甲醇流加阶段甲醇脉冲补入后的do(溶氧)和our(摄氧率)响应的特征时间及程度来判断毕赤酵母是否处于甲醇过量状态,从而改变甲醇流加速率。具体而言,如果加入所述甲醇后在指定时间i内未出现高于2.5%的do下 降程度,且our在加入甲醇后在指定时间ii内出现升高回落情形的,则判断为甲醇过量。所述指定时间i通常为20分钟。在一个或多个实施方案中,所述指定时间i为15分钟。在其它实施方案中,所述指定时间i优选为10分钟。所述指定时间ii通常为20分钟。在一个或多个实施方案中,所述指定时间ii为15分钟。在其它实施方案中,所述指定时间ii优选为10分钟。优选的是,在某些实施方案中,在指定时间i内未出现高于2.0%的do下降程度。本文中,所述升高指指定时间ii内our的最高增幅为至少1.5%,如至少2.0%,优选至少2.5%,所述回落指指定时间ii内our最高值与our最低值之间的差值为升高值的至少50%,如至少60%,至少70%,至少80%,至少85%,至少90%;或大于升高值,即指定时间ii内测得的our出现低于加入所述甲醇前测得的our的情形。判断为甲醇过量后,可停止甲醇流加。通常停止甲醇流加2~6h,例如2~4小时。应理解,停止流加的时间从指定时间i和指定时间ii中后到者起算。停止甲醇流加,do趋势会缓慢回升(通常,大约2h内回升3%左右),当出现do下降的拐点时,意味着甲醇的毒性解除,细胞开始正常利用甲醇,可恢复补料,这一时间通常在2~6h。甲醇停止流加的过程中,除停止发酵培养基流加外,其余按停止流加前的培养条件(温度、转速、通气等)发酵。停止流加时间到后,或当出现do下降的拐点时,恢复甲醇流加。通常,将甲醇流加速率由添加所述甲醇前的流加速率下降5%~50%,例如下降10%~40%,或下降10%~30%。在某些实施方案中,如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,在判定为甲醇过量。此时,停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%。另一种情形是,如果加入所述甲醇后在指定时间iii内出现高于4.5%的do下降程度,且our升高至最高值后能够维持在该最高值附近超过指定时间iv,则判定为甲醇不足。所述指定时间iii通常为30分钟,或者为25分钟、20分钟、15分钟或10分钟。所述指定时间iv通常为15分钟,或者为20分钟、25分钟或30分钟。通常,our的所述最高值相对于加入甲醇前的our值具有至少3.0%的增幅,优选至少4.0%,如至少5.0%、至少6.0%、至少10.0%等的增幅。our升至最高值之后维持该最高值或在该最高值附近小范围内波动,例如正负1%以内的波动,超过指定时间iv,均视为满足本文所述的情形。在某些实施方案中,do下降程度需高于5.0%。在其它实施方案中,do下降程度需高于5.5%,例如需高于6.0%。判定为甲醇不足后,在添加所述甲醇前的流加速率的基础上增加甲醇流加流速5%~50%,如10%~40%,优选10%~30%。在某些实施方案中,如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则判定为甲醇不足。此种情况下,可立即在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。优选的是,所述发酵中,最初以1.0~1.5g/l/h的基础甲醇补料速率进行流加。甲醇脉冲时,优选每隔5~15小时进行一次,每次以1.0~2.0g甲醇/l发酵液的浓度加入甲醇。本发明还包括所述判断muts型毕赤酵母发酵中甲醇过量或不足的方法和/或所述控制muts型毕赤酵母发酵中甲醇流加速率的方法在muts型毕赤酵母发酵、发酵muts型毕赤酵母用于生产异源蛋白、提高异源蛋白的产量、以及以muts型毕赤酵母为宿主菌表达的异源蛋白的调控中的应用。因此,在优选某些实施方案中,本发明提供一种muts型毕赤酵母发酵方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,则停止甲醇流加2~6h, 并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%;(2)如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。在其它优选的实施方案中,本发明提供一种发酵muts型毕赤酵母用于生产异源蛋白的方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,则停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%;(2)如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。在其它优选的实施方案中,本发明提供一种提高异源蛋白的产量的方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,则停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%;(2)如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。在其它优选的实施方案中,本发明提供一种通过do和our判定发酵液内甲醇是否过量的方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,则认为发酵液内甲醇过量;(2)如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则认为发酵液内甲醇不足。在其它优选的实施方案中,本发明还提供以muts型毕赤酵母为宿主菌表达的异源蛋白的调控方法,所述方法包括:以0.8~1.8g/l/h的基础甲醇补料速率进行流加,每隔3~18小时以1.0~2.0g甲醇/l发酵液的浓度加入甲醇,同时检测加入该甲醇前以及加入之后发酵液中的do和our,其中,(1)如果加入所述甲醇后10min内未出现高于2%的do下降程度,且our在加入甲醇后10分钟内出现升高回落情形的,则停止甲醇流加2~6h,并在恢复补料后将甲醇流加速率由添加所述甲醇前的流加速率下降10%~30%;(2)如果加入所述甲醇后10min内出现高于6%的do下降程度,且our升至最高值后能够维持在该最高值附近超过30分钟以上,则在添加所述甲醇前的流加速率的基础上增加甲醇流加流速10%~30%。适用于本发明的muts菌株的例子都包括本领域周知的各种muts菌株,例如km71、km71h等。异源蛋白包括本领域已知的可采用muts菌株发酵生产的各种异源蛋白,例如甘露聚糖酶等。可采用常规的方法检测do和our。例如,do值通过do电极在线检测获得;our值通过尾气分析仪检测尾气中的o2含量和co2含量,通过以下公式在线计算得出:耗氧量our,mmol/l/h式中:fin:进气流量,mmol/h;cin\co2in:分别为进气中惰性气体、及氧的浓度%;co2out\cco2out:分别为排气中氧及二氧化碳的浓度%;v:发酵液体,l;式中pin:进气的绝对压强,pa;tin:进气的温度,℃;h:进气的相对湿度,%。实施例以下将以具体实施例的方式阐述本发明。应理解,这些实施例仅仅是阐述性的,并非限制本发明。实施例中所用到的方法、试剂和条件,除非另有说明,否则这些方法、试剂和条件都是本领域常规的方法、试剂和条件。(1)菌株来源:构建的重组菌为表达了甘露聚糖酶的重组毕赤酵母,该重组的毕赤酵母构建方法按照常规的毕赤酵母表达手册操作完成,其中来源:宿主菌:毕赤酵母km71菌株(muts),购自invitrogen公司;表达的基因:来自枯草芽孢杆菌。发酵培养基:基础培养基(/l):硫酸钙0.9g,无水硫酸镁11.67g,硫酸铵9g,消泡剂0.3g,磷酸二氢钾33.3g,ptm4ml;补料培养基(/l):甲醇800g(含12mlptm),甘油500g(含12mlptm);ptm(/l):五水硫酸铜5.99g,碘化钠0.08g,一水硫酸锰3.0g,二水钼酸钠0.2g,六水氯化钴0.5g,五水氯化锌20.04g,七水硫酸亚铁65.05g,硼酸0.02g;(2)种子的制备:从保藏在甘油管中的菌悬液中挑取一环在ypd平板上划线,在28℃的培养箱中培养72h,待平板上长出单一、较大的菌落为止,挑取平板上单一较大的菌落接种到含30mlypd-甘油液体培养基的200ml带挡板三角瓶中,在28℃培养16-20h,转种入7.5l种子罐后,再进行培养16-20h,使得od600在8-10,即得到50l罐种子液。(3)发酵过程控制工艺上海国强50l发酵罐:加入25l发酵基础培养基,溶氧、ph电极校正无误后包扎完好,在121℃灭菌30分钟。冷却后,接入2l种子液,于30℃、300r/min,通气量18l/min发酵培养。发酵过程中经过三个阶段控制:甘油分批发酵过程:初始od600约为0.1左右,初始甘油为5%;过程中调转数,通风,罐压使do%>20%;甘油限制性流加过程:温度由初始30℃降为28℃,ph由原来5.5降为5,以恒定速率流加甘油使do控制在20%左右;该阶段结束时湿重在200~220g/l;和甲醇流加过程:甲醇流加过程分为两种情况,一种是采用本发明提出的新控制工艺,一种采用经验型控制工艺即常规控制工艺,发酵周期均为142小时。(4)甘露聚糖酶的活力检测检测原理:甘露聚糖酶能从底物洋槐豆粉中水解产生还原糖,还原糖的产生量与酶活性成正比,用dns显色法测定还原糖的含量,从而计算酶活力。酶活力单位(u)的定义:在50℃、ph6.0的酶活力测定条件下,1min催化10g/l的洋槐豆粉溶液生成1μg还原糖(以甘露糖表示)所需的酶量定义为一个酶活力单位(u)。试剂配置:配置500mmph7.0的磷酸钾缓冲液50ml;取10ml磷酸钾缓冲 液加入0.1g洋槐豆粉底物,75℃加热直至完全溶解;dns试剂的配置,称取3,5-二硝基水杨酸(dns)3.15g,加水500ml,搅拌5s,水浴至45℃,随后逐步加入100ml5m的氢氧化钠溶液,同时不断搅拌,直到溶液清澈透明,再逐步加入四水酒石酸钾钠91.0g、苯酚2.50g和无水亚硫酸钠2.50g,继续45℃水浴加热,同时补加水300ml,不断搅拌,直到加入的物质完全溶解,冷却至室温后,加水定容至1000ml,放入棕色瓶,避光保存。测定步骤:取320μl底物,加入稀释一定倍数的发酵液20μl,在50℃水浴锅内保温10min,然后用冰水急速冷却5min,离心3min后,取出320μl底物,加入680μl的dns试剂,漩涡震荡后,沸水浴煮10min,随后放置在冰水内冷却5min,在540nm测定吸光度,od540需要在0.3-0.8之间。空白组制备:取320μl底物,离心3min后,取出320μl底物,加入680μl的dns试剂和稀释一定倍数的发酵液20μl,沸水浴煮10min。酶活计算公式:酶活(u/ml)=(od540+0.064)/2.221/(0.02×10)×稀释倍数。实施例1实施例1采用单独do控制的策略。如图1所示,整个发酵过程分为三个阶段,0-24h为甘油批发酵阶段,do从最初的100%降到14.1%,24-28h为甘油补料阶段,do%维持在15-20%,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,适应期间do保持在70-80%左右,待do快速下降至61.5%,表明毕赤酵母已能很好地适应并利用甲醇,开始进行甲醇补料阶段,甲醇的补料控制通过do反馈进行控制,通过调整甲醇补料速率将do维持在55-65%之间,直到发酵结束。通过do反馈控制甲醇流速的发酵结果如图1所示,可以看出最终的产量仅为978u/ml。实施例2实施例2采用单独our控制的策略。如图2所示,整个发酵过程分为三个阶段,0-24h为甘油批发酵阶段,our从最初的0mmol/l/h升到131.71mmol/l/h,24-28h为甘油补料阶段,our维持在117-131mmol/l/h,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,适应期间our不断下降,最低下降到21.3mmol/l/h,然后开始反弹至50mmol/l/h,然后our进入到一个平台期,表明毕赤酵母已能很好地适应并利用甲醇,开始进行甲醇补料阶段,甲醇的补料控制通过our反馈进行控制,通过调整甲醇补料速率将our维持在45-50mmol/l/h之间,直到发酵结束。通过our单独反馈控制甲醇流速的最终发酵结果如图2所示,可以看出最终的产量为2485.37u/ml。实施例3实施例3采用甲醇浓度反馈控制的策略。如图3所示,整个发酵过程分为三个阶段,0-24h为甘油批发酵阶段,毕赤酵母利用甘油为碳源,24-28h为甘油补料阶段,毕赤酵母仍以甘油为碳源,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,待菌体经过适应期后,开始流加甲醇,通过测定甲醇浓度反馈控制发酵液中的甲醇浓度在3-5g/l,直到发酵结束。通过甲醇浓度反馈控制甲醇流速的最终发酵结果如图3所示,可以看出最终的产量为2238u/ml。实施例4实施例4采用do和our联动控制甲醇补料速率的工艺。整个过程分成三个阶段,0-24h为甘油批发酵阶段,do从最初的100%降到14.1%,24-28h为甘油补料阶段,do%维持在15-20%,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,适应期间do保持在70-80%左右,待do快速下降至61.5%,表明毕赤酵母已能很好地适应并利用甲醇,开始进行甲醇补料阶段。在甲醇补料阶段以1.5g/l/h 的基础甲醇补料速率进行流加,每隔数小时进行1g/l-2g/l的甲醇脉冲补料操作,根据do和our的响应判定甲醇的补料速率是否过量。具体而言,在46h时进行1.5g/l的甲醇脉冲补料,do从65.4%下降到64.2%(do下降1.2%),而our从43.2mmol/l/h上升到了44.7mmol/l/h,5min后又下降到了43.4mmol/l/h,判定甲醇补料过量,停止补加甲醇2h后恢复甲醇补料,但是甲醇补料速率从1.5g/l/h降低成1.2g/l/h(甲醇速率降低了20%);在59h时进行2.0g/l的甲醇脉冲补料,do下降了0.4%,our从41.5mmol/l上升到了43.1mmol/l/h,8min后又下降到了41.4mmol/l/h,判定甲醇过量,停止补加甲醇4.5h后恢复甲醇补料,但甲醇补料速率从1.2g/l/h变为1.05g/l/h;在72h进行1g/l的甲醇脉冲补料,do从67.3%下降到了61.2%(下降了6.1%),而our从38.3mmol/l/h上升到了42.7mmol/l/h,并且维持了1h,判定为甲醇补料速率过慢,将甲醇补料速率从1.05g/l/h增加到1.15g/l/h(甲醇速率增加10%);在80h时进行了1.5g/l/h的甲醇脉冲补料,do下降了9.9%,our从40.4mmol/l/h增加为46.9mmol/l/h,并且维持了1小时45分钟,判定为甲醇补料速率过慢,将甲醇补料速率从1.15g/l/h增加为1.3g/l/h;在94.4h时进行1g/l的甲醇脉冲补料,do从55.1%下降到了53.1%(do下降2%),而our从44.1mmol/l/h上升到了45.3mmol/l/h,10min后又下降到了43.9mmol/l/h,判断甲醇补料过量,停止补加3h后恢复补料速率,但是甲醇补料速率从1.3g/l/h降低成1.17g/l/h(甲醇速率下降了10%);在108h时脉冲补入1.2g/l的甲醇脉冲补料,do从62.1%下降到了61.4%(do下降0.7%),而our从42.1mmol/l/h上升到了43.3mmol/l/h,4min后又下降到了42.0mmol/l/h,判断甲醇补料过量,停止补加6h后恢复补料速率,甲醇补料速率从1.17g/l降低成1.00g/l/h;在114h进行1.2g/l的甲醇脉冲补料,do下降了6.3%,our从39.4mmol/l/h上升到了45.3mmol/l/h,并维持了42min,判定甲醇补料速率过慢,将甲醇速率由1.0g/l/h调整为1.3g/l/h;在117h时进行2g/l的甲醇脉冲补料,do从71.1%下降到了56.1%(do下降15%),而our从36mmol/l/h上升到了46mmol/l/h,并维持时间达到了 5h,判断甲醇补料速率过慢,将甲醇补料速率从1.3g/l/h增加到了1.69g/l/h(甲醇速率增加了30%);在130h进行1.0g/l/h的甲醇脉冲补料,do下降了1.5%,our从45.9mmol/l/h上升为48.2mmol/l/h,并在6min内回落到46.1mmol/l/h,判定为甲醇过量,停止甲醇补料2h,恢复补料后将速率从1.69g/l/h调整为1.28g/l/h。培养至144h发酵结束。上述控制工艺如图4和5以及下表1所示。表1初始甲醇流加1.5g/l/h46h脉冲补料1.5g/l流加速率由1.5变为1.259h脉冲补料2.0g/l流加速率由1.2变为1.0572h脉冲补料1.0g/l流加速率由1.05变为1.1580h脉冲补料1.5g/l流加速率由1.15变成1.394.4h脉冲补料1.0g/l流加速率由1.3变成1.17108h脉冲补料1.2g/l流加速率由1.17变成1.00114h脉冲补料1.00g/l流加速率由1.00变成1.3117h脉冲补料2.0g/l流加速率由1.3变为1.69130h脉冲补料1.0g/l流加速率由1.69变成1.28在该控制工艺下发酵结果见图6,最终产量为5000u/ml,分别是实施例1、实施例2、实施例3甘露聚糖酶产量的511%、201%和223%。实施例5实施例5同样采用do和our联动控制甲醇补料速率的工艺。整个过程同样分成三个阶段,0-24h为甘油批发酵阶段,do从最初的100%降到10.2%,24-28h为甘油补料阶段,do%维持在15-20%,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,适应期间do保持在70-80%左右,待do快速下降至63.4%,表明毕赤酵母已 能很好地适应并利用甲醇,开始进行甲醇补料阶段。在甲醇补料阶段以1.2g/l/h的基础甲醇补料速率进行流加,每隔数小时进行1g/l-2g/l的甲醇脉冲补料操作。在48h进行1.4g/l的脉冲补料,发现do下降了1.7%,our从34.1mmol/l/h升高到了37.3mmol/l/h,在5min内回落到了34.2mmol/l/h,判定甲醇过量,停止补料2h,恢复补料后将1.2g/l/h的甲醇速率调整为0.95g/l/h;66h进行1.0g/l的脉冲补料,do下降了7.4%,our从32.8mmol/l/h上升到了38.1mmmol/l/h,并维持时间达到了55min,判定甲醇补料速率过慢,将0.95g/l/h的甲醇速率增加为1.22g/l/h;在80h进行1.5g/l/h的甲醇脉冲补料,do下降了11.3%,our从37.1mmol/l/h增加到了42.3mmol/l/h,并维持了1h30min,判定为甲醇补料速率过慢,将甲醇速率1.22g/l/h增加成1.58g/l/h;在96h进行1.5g/l/h的甲醇脉冲补料,do下降了0.3%,our从40.7mmol/l/h上升到了43.9mmol/l/h,在9min内our回落到了41.0mmol/l/h,判定甲醇过量,停止甲醇补料5h,恢复补料后将甲醇速率从1.58g/l/h调整为1.2g/l/h;在107h进行1.0g/l的甲醇脉冲补料,do下降了1.1%,our从38.5mmol/l/h上升到了40.7mmol/l/h,4min后our回落到了38.5mmol/l/h,判定为甲醇过量,停止补料3h后,恢复补料将甲醇速率从1.2g/l/h调整为1.0g/l/h;在120h进行1.8g/l的甲醇脉冲补料,do下降了15.3%,our从36.8mmol/l/h上升为45mmol/l/h,并维持了1h33min,将甲醇速率从1.0g/l/h增加为1.3g/l/h。培养至144h发酵结束。上述控制工艺汇总于下表2中。表2在该控制工艺下,最终发酵结果为4883u/ml,分别是实施例1、实施例2、实施例3甘露聚糖酶产量的499%、197%和218%。实施例6实施例6同样采用do和our联动控制甲醇补料速率的工艺。整个过程同样分成三个阶段,0-24h为甘油批发酵阶段,do从最初的100%降到16.3%,24-28h为甘油补料阶段,do%维持在15-20%,菌体湿重达到200g/l后,通过每隔1h脉冲补入1g/l的甲醇进行4次,让毕赤酵母进入甲醇适应期,适应期间do保持在70-80%左右,待do快速下降至57.5%,表明毕赤酵母已能很好地适应并利用甲醇,开始进行甲醇补料阶段。在甲醇补料阶段以1.65g/l/h的基础甲醇补料速率进行流加,每隔数小时进行1g/l-2g/l的甲醇脉冲补料操作。在54h进行1.8g/l的甲醇脉冲补料操作,do下降了1.9%,our从47.4mmol/l/h上升到了50.3mmol/l/h,8min后our回落到了47.6mmol/l/h,判定为甲醇补料速率过快,停止甲醇补料4h,恢复补料后将1.65g/l/h降低为1.3g/l/h;在70h进行2.0g/l的甲醇脉冲补料操作,do下降了8.9%,our从43.1mmol/l/h上升到了48.3mmol/l/h,并维持了3.5h,判定为甲醇速率过慢,将甲醇补料速率从1.3g/l/h增加为1.45g/l/h;在84h进行1.4g/l的甲醇脉冲补料操作,do下降了7.3%,our从45.5mmol/l/h上升到了48.8mmol/l/h,并维持了1.5h,判定为甲醇补料速率过慢,将1.45g/l/h的甲醇速率调整为1.72g/l/h;在98h进行1.0g/l的甲醇脉冲补料操作,do下降了0.2%,our从 50.1mmol/l/h上升到了52.4mmol/l/h,6min后回落到了49.8mmol/l/h,判定为甲醇过量,停止甲醇补料2.5h,恢复补料后将甲醇补料速率从1.72g/l/h下降为1.40g/l/h;在107h进行1.2g/l/h的甲醇脉冲补料操作,do下降了1.4%,our从43.8mmol/l/h上升为45.2mmmol/l/h,4min内our回落到了44.0mmol/l/h,判定为甲醇过量,停止甲醇补料2h,恢复补料后将速率从1.40g/l/h调整为1.22g/l/h;在124h进行1.5g/l的甲醇脉冲补料操作,do下降了10.3%,our从38.2mmol/l/h上升到了45.0mmol/l/h,判定为甲醇补料速率过慢,将甲醇速率从1.22g/l/h调整为1.45g/l/h。培养至144h发酵结束。上述控制工艺汇总于下表2中。表3初始甲醇流加1.65g/l/h54h脉冲补料1.8g/l1.65g/l/h变为1.3g/l/h70h脉冲补料2.0g/l1.3g/l/h变为1.45g/l/h84h脉冲补料1.4g/l1.45g/l/h变为1.72g/l/h98h脉冲补料1.0g/l1.72g/l/h变为1.40g/l/h107h脉冲补料1.2g/l1.40g/l/h变为1.22g/l/h124h脉冲补料1.5g/l1.22g/l/h变为1.45g/l/h在该控制工艺下,最终发酵结果为5429u/ml,分别是实施例1、实施例2、实施例3甘露聚糖酶产量的555%、218%和242%。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1