本发明属于药学领域,本发明介绍了一类新颖化学结构的萜类化合物及其制备方法,本发明还揭示了所述化合物的抗炎用途。
背景技术:
非甾体抗炎药(non-steroidanti-inflammatorydrugs,nsaids)是急、慢性风湿性疾病的治疗一线药物,全球大约有5亿人在使用nsaids,其是仅次于抗生素,维生素的第三大类药物。nsaids最主要的抗炎机制是抑制体内前列腺素(pg)的合成,但由于影响了体内正常pg的代谢合成,往往会使该些药物产生一系列副作用。有研究表明,一些nsaids还存在如阻断nf-kb,p38mapk,creb等体内炎症信号传导通路的治疗机制。随着nsaids在风湿性疾病、炎性疾病、疼痛、软组织疾病、心脑血管疾病,以及老年痴呆病等广泛应用,其发挥的社会、经济价值也日益增大。新型疗效高、副作用少的nsaids研发,越来越受到医药科研机构和研究者的重视。
专利发明者通过前期研究,从一株海洋真菌acremoniumsp.s004-tvg02-11发酵物中制备并鉴定了一类新化合物(式i~式v),并通过初步体外抗炎活性筛选,发现其展现出良好的抑制炎性信号因子释放活性,具有进一步研究开发的潜力。
技术实现要素:
本发明的目的之一在于公布一类式i~式v所示的萜类化合物。
本发明的目的之二在于提供该类化合物的制备方法。
本发明的目的之三在于揭示该类化合物在开发抗炎药物方面的用途。
本发明在第一方面提供式i~式v所示化合物:
本发明第二方面提供上述化合物的制备方法,包括如下步骤:
1)利用深海真菌acremoniumsp.s004-tvg02-11作为工程菌种,经过固体发酵培养,获得含上述化合物的发酵物;
2)将发酵物通过硅胶、凝胶、hplc等色谱手段分离与纯化,从菌株发酵物中制备上述化合物;
3)本发明第三方面本通过测试上述化合物对脂多糖(lps)诱导raw264.7细胞产生的炎性介质一氧化氮(no)的影响,初步验证了其抗炎活性。
附图说明
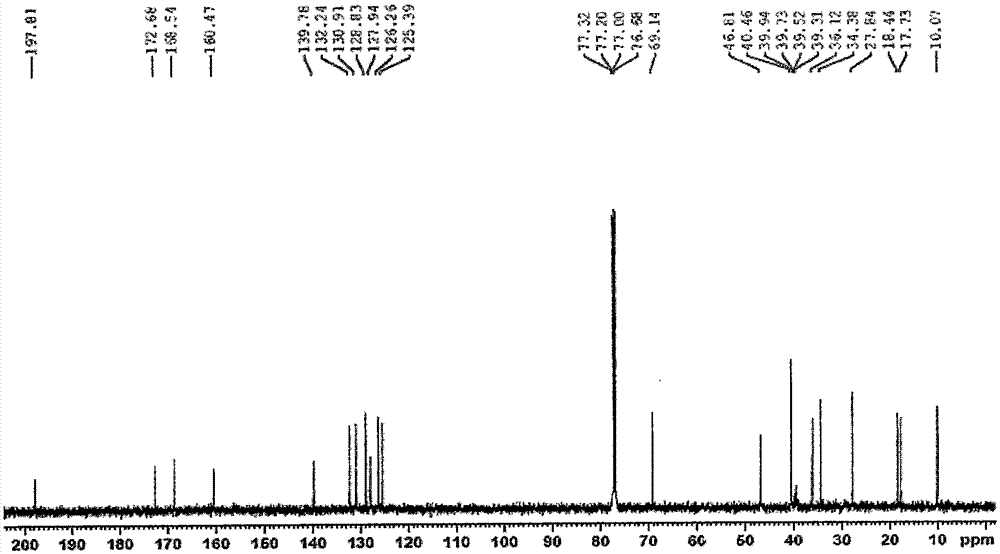
图1:式i化合物的1h-nmr谱;
图2:式i化合物的apt谱;
图3:式i化合物的hsqc谱;
图4:式i化合物的1h-1hcosy谱;
图5:式i化合物的hmbc谱;
图6:式i化合物的高分辨质谱;
具体实施方案:
根据本发明所公开的技术内容,为了让本领域技术人员将更好的理解本专利实质,提供下述实施方案。
实例1:真菌acremoniumsp.s004-tvg02-11的固体发酵培养
1.菌株背景
菌株acremoniumsp.s004-tvg02-11分离纯化自南大西洋海底沉积物,菌种保藏于北京大学天然药物及仿生药物国家重点实验室海洋天然产物研究组。
2.固体培养基的制备:
将100ml人工海水与100g大米加入500ml三角瓶中,静置12h,后于121℃高压湿热灭菌30min,放凉待用。
3.菌株发酵:
在pda(马铃薯、葡萄糖、琼脂)培养皿上挑取长有新鲜acremoniumsp.s004-tvg02-11的琼脂片(1~2cm2),接种于大米培养基上,25℃下避光恒温培养40d,得到发酵产物。
实例2:式i~式v的制备
发酵产物捣碎后用乙酸乙酯超声萃取3次,每次1.5h,减压浓缩得粗浸膏(2.8g)。浸膏用等比例硅胶(160~200目)拌样,利用减压硅胶柱色谱以石油醚/乙酸乙酯为流动相梯度洗脱。硅胶柱色谱石油醚/乙酸乙酯(5∶1,v/v)洗脱组分(0.6g)用ods柱色谱以甲醇/水为流动相(50~90%,v/v)梯度洗脱,分成3个洗脱组分。组分2(120mg)半制备高效液相色谱以60%乙腈/水为流动相梯度洗脱,纯化得到式i化合物(10.0mg)、式ii化合物(14.5mg)、式iii化合物(3.6mg)、式iv化合物(5.2mg)和式v化合物(8.0mg)。化合物理化数据如下:
式i化合物:uv(meoh)λmax(logε)274(4.27);ecd(c4.2×10-4m,meoh)λmax(δε)239(+6.82),278(+8.05),343(+4.96);ir(kbr)νmax3435,2935,1729,1664,1630,1444,1375,1247,1163,970cm-1;hresimsm/z341.1751[m-h2o+h]+(calcdforc21h25o4,341.1753),hresimsm/z359.1858[m+h]+(calcdforc21h27o5,359.1858),hresimsm/z381.1674[m+na]+(calcdforc21h26o5na,381.1678)。
式ii化合物:uv(meoh)λmax(logε)301(4.16);ecd(c3.6×10-4m,meoh)λmax(δε)224(+11.37),275(+9.32),374(+2.24);ir(kbr)νmax3430,2924,1729,1656,1625,1239,1163,970cm-1;hresimsm/z341.1754[m-h2o+h]+(calcdforc21h25o4,341.1753),hresimsm/z359.1856[m+h]+(calcdforc21h27o5,359.1858),hresimsm/z381.1670[m+na]+(calcdforc21h26o5na,381.1678)。
式iii化合物:uv(meoh)λmax(logε)259(4.23),274(4.02);ecd(c2.7×10-4m,meoh)λmax(δε)246(+13.34),280(-7.28),344(+4.42);ir(kbr)νmax2926,2850,1732,1664,1631,1243,1161,969cm-1;hresimsm/z373.2015[m+h]+(calcdforc22h29o5,373.2015),hresimsm/z395.1832[m+na]+(calcdforc22h28o5na,395.1834)。
式iv化合物:uv(meoh)λmax(logε)224(3.95),244(3.82),300(3.61);ecd(c5.6×10-4m,meoh)λmax(δε)221(+82.78),253(-24.6),281(+6.75);ir(kbr)νmax3459,2921,2851,1735,1660,1628,1366,1230,1163,968cm-1;hresimsm/z341.1754[m-h2o+h]+(calcdforc21h25o4,341.1753),hresimsm/z359.1863[m+h]+(calcdforc21h27o5,359.1858),hresimsm/z381.1681[m+na]+(calcdforc21h26o5na,381.1678)。
式v化合物:uv(meoh)λmax(logε)220(3.93),247(3.47),303(3.73);ecd(c5.3×10-4m,meoh)λmax(δε)222(+82.56),254(-15.26),281(+6.74);ir(kbr)νmax3449,2968,2936,1732,1657,1618,1165,969cm-1;hresimsm/z357.1704[m-h2o+h]+(calcdforc21h25o5,357.1702),hresimsm/z375.1816[m+h]+(calcdforc21h27o6,375.1808),hresimsm/z397.1632[m+na]+(calcdforc21h26o6na,397.1632)。
作为示例,式i化合物的详细核磁谱及高分辨质谱见附图说明图1~图6。
实例3:式i~式v化合物的抗炎活性研究:
实验材料:小鼠raw364.7细胞株购自上海细胞研究所;测试化合物由实验室自行分离纯化(纯度>98%);胎牛血清,rpmi1640培养基为gibcobrl公司产品;no,griess试剂盒为建成生物工程研究所产品。
细胞培养:raw364.7细胞株在含有10%胎牛血清,100u/ml青霉素,0.1mg/ml硫酸链霉素的rpmi1640培养基培养,培养温度为37℃,5%二氧化碳(co2),湿度为95%。
测试化合物对lps诱导小鼠raw364.7细胞株产生no的影响:将对数生长期的raw364.7细胞株接种于12孔培养板中,设空白对照组,lps模型组(加入终浓度为10μg/ml的lps),0.78,1.56,3.12,6.25,12.5,25,50,100,以及200μm不同浓度的测试化合物(药物加入后60min再加入终浓度10μg/ml的lps),进行实验。继续培养24h,收集细胞。用硝酸还原法按照griess试剂盒的要求测定no含量,实验重复3次。
测试结果如下表:
结果表明:式i~式v化合物具有显著的抑制no释放活性。