聚乙二醇化7‑脱氢胆固醇衍生物的制作方法
本发明涉及聚乙二醇化7-脱氢胆固醇衍生物(Pegylated 7-dehydrocholesterol derivatives)。更特别地,本发明涉及聚乙二醇化7-脱氢胆固醇衍生物,其具有得到改善的稳定性和溶解度并在体内经过水解而提供维生素D,且还涉及用于减少皱纹和抗老化的含有所述聚乙二醇化7-脱氢胆固醇衍生物的组合物。
背景技术:
维生素D具有两种类型,维生素D2(钙化醇)和维生素D3(胆钙化醇,化合物B),这两种物质在肝脏和肾脏进行代谢而转化成它们的活性形态(骨化三醇,化合物C)。7-脱氢胆固醇(7-DHC,化合物A)为维生素D3的维生素原形态,经过阳光照射会被转化成维生素D3。
通常,维生素D3促进钙吸收以强化骨密度,因此它被用作骨质疏松症的治疗剂及用于老年人或居住在难以获得充足日照的北半球居民的补充剂。
已知,作为维生素D的前体的所述7-脱氢胆固醇具有强效的皮肤抗老化和抗氧化活性,且具有防紫外线的效果,因此被用作功能性化妆品的原材料【参见韩国专利申请公开号2001-0002281】。此外,美国专利申请公开号2013-0017234公开了,7-脱氢胆固醇由于能使参与骨骼形成中的Col-1、ALP、OSX、OC、BMP-2和IL-5因子进行表达而具有用于治疗关节炎的可能性。此外,韩国专利号10-0568600通过临床试验公开了7-脱氢胆固醇具有优异的毛发保护效果。
因此我们期待,通过在皮肤外层上持续提供7-脱氢胆固醇,可增加胆钙化醇的生成,以预防骨质疏松症及预防以异常皮肤的皮屑为特点的牛皮癣和如特应性皮炎的皮肤疾病,同时还能提供隔离紫外线吸收及抗老化的效果。
然而,7-脱氢胆固醇在除皮肤以外的区域上极不稳定,且因光照而被转化成各种物质,这些物质尽管几乎没有副作用却难以转化成维生素D3。此外,在除皮肤之外区域上,7-脱氢胆固醇会被转化成焦骨化醇(pyrocalciferol)或光甾醇(lumisterol)和异光甾醇(isopyrocalciferol),使得活性降低。
为了克服上述问题,美国专利号5,342,833公开了具有新特性的新型胆钙化醇,即活性维生素D衍生物,用于治疗皮肤疾病和牛皮癣。此外,美国专利号5,747,478公开了通过利用氧化镁和柠檬酸钠来稳定活化的胆钙化醇。
然而,对7-脱氢胆固醇的稳定化的研究停滞不前,究其原因,在于7-脱氢胆固醇受紫外线和温度的影响而易于转化成其他物质,且存在与空气中的氧气反应而发生结构变性。
此外,如上所述,现有的专利仅仅公开了7-脱氢胆固醇的制药稳定性或展示作为活性形态的胆钙化醇的研究,但并没有涉及7-脱氢胆固醇的合成稳定性的公开。
技术实现要素:
技术问题
本发明人为了克服上述的7-脱氢胆固醇对化学制品、紫外线、温度的不稳定性及与空气接触时的不稳定性且在水中具有极低的溶解度等问题,经过研究发现,7-脱氢胆固醇与聚乙二醇的偶联物(conjugation)可以提高在有机溶剂或水溶液中的溶解度,且可以提升在皮肤内向细胞传递的效果,且其特性的改善可以促进功效的提高,从而增强7-脱氢胆固醇的溶解度和在长期保存中的稳定性。
因此,本发明的一个目的在于,提供具有改善的溶解度和稳定性的聚乙二醇化7-脱氢胆固醇衍生物。
本发明的另一目的在于,提供用于减少皱纹及抗老化的组合物,该组合物包含所述聚乙二醇化7-脱氢胆固醇衍生物。
技术方案
本发明涉及以下化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物:
其中,R为氢或C1-C6烷基,
G为-XCOCH2(CH2)mCO-、-XCH2(CH2)mCO-、-XCONHCYCO-、-XCOCYNHCO(CH2)mCH2CO-或–XCH2(CH2)mCONHCYCO-,
X为O、NH或S,
Y为氢、C1-C6烷基、(CH2)m′CH2NHCO(CH2)mCH2(OCH2CH2)nOR、(CH2)m′CH2NHCOCH2(CH2)mCO(OCH2CH2)nOR或(CH2)m′CH2NHCOCH2(CH2)mCO-DHC,
n为1-700之间的整数,优选为3-200之间的整数,且
m和m′分别独立地为1-3之间的整数,优选为1。
这里使用的术语“C1-C6烷基”是指具有1-6个碳原子的直链或支链的碳氢化合物,包括甲基、乙基、正丙基、异丙基、正丁基、正丁基、仲丁基、叔丁基、正戊基、正己基等,不限于此。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(1A)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
m为1-3之间的整数,优选为1。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(1B)的化合物:
其中,R为氢或C1-C6烷基,
n为1-700之间的整数,优选为3-200之间的整数,且
m为1-3之间的整数,优选为1。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2A)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
Y1为C1-C6烷基。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2B)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,
m为1-3之间的整数,优选为1,且
Y1为C1-C6烷基。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2C)的化合物:
其中,R为氢或C1-C6烷基,
n为1-700之间的整数,优选为3-200之间的整数,
m为1-3之间的整数,优选为1,且
Y1为C1-C6烷基。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2D)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
m和m′分别独立地为1-3之间的整数,优选为1。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2E)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
m和m′分别独立地为1-3之间的整数,优选为1。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2F)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
m和m′分别独立地为1-3之间的整数,优选为1。
在本发明的一个实施例中,所述聚乙二醇化7-脱氢胆固醇衍生物可以为以下化学式(2G)的化合物:
其中,R为氢或C1-C6烷基,
X为O或NH,
n为1-700之间的整数,优选为3-200之间的整数,且
m和m′分别独立地为1-3之间的整数,优选为1。
本发明的聚乙二醇化7-脱氢胆固醇衍生物可通过以下反应式1-5中所示的方法制备而成。所述反应式的方法仅仅用于说明用于本发明中的具代表性的方法,而反应式中的单元操作顺序、试剂和反应条件可以作适应性改变。
【反应式1】
其中,R、X、n和m与上述化学式(I)中的定义一致。
根据反应式1,化学式(4)的化合物和化学式(5)的化合物可分别经过与化学式(7a)的化合物或化学式(6)的化合物进行缩合反应,而获得化学式(1A)的聚乙二醇化7-脱氢胆固醇衍生物。此外,化学式(4)的化合物可经过与化学式(7b)的化合物进行缩合反应,而获得化学式(1B)的聚乙二醇化7-脱氢胆固醇衍生物。
化学式(5)的化合物和化学式(7a)的化合物可分别通过化学式(4)的化合物或化学式(6)的化合物与酸酐进行反应而制成,且化学式(7b)的化合物可根据已知方法使用X为O的化学式(6)的化合物作为起始物质进行制备,或可商购获得【请见:J.M.Harris et.al,Advanced Drug Delivery Reviews,2002,54,459-476】。
此外,化学式(6)的化合物可商购获得或可通过已知方法进行制备【请见:andler and Karo,Polymer Synthesis,Academic Press,New York,Vol.3,pages 138-161】。
【反应式2】
其中,R、X、n和m与上述化学式(I)中的定义一致。
Zb和Zc分别为保护基团,且
Y1为氢、C1-C6烷基或氨基酸残基。
根据反应式2,化学式(6)的化合物可被活化而获得化学式(8)的化合物,化学式(8)的化合物经过与化学式(9)的化合物进行反应而获得化学式(10)的聚乙二醇衍生物。此外,化学式(10)的化合物可经过与化学式(4)的化合物进行缩合反应而获得化学式(2A)的聚乙二醇化7-脱氢胆固醇衍生物。
此外,化学式(6)的化合物可经过与化学式(12)的化合物进行缩合反应而获得化学式(13)的化合物。然后,化学式(13)的化合物经过去保护而获得化学式(14)的化合物,且化学式(14)的化合物可经过与化学式(5)的化合物进行缩合反应而获得化学式(2B)的聚乙二醇化7-脱氢胆固醇衍生物。
进一步,在某些情况下,可有选择地使用具有保护基团的化合物,如化学式(11)的化合物,当Y1为氨基酸残基时,其可以被保护基团取代或未被取代。
【反应式3】
其中,R、n和m与上述化学式(I)中的定义一致。
L为卤素、琥珀酰亚胺或咪唑,且
Y1为氢、C1-C6烷基或氨基酸残基。
根据反应式3,化学式(7b)的化合物可被活化而获得化学式(15b)的化合物,化学式(15b)的化合物经过与化学式(9)的化合物进行反应而获得化学式(16)的聚乙二醇衍生物。化学式(16)的化合物可经过与化学式(4)的化合物进行缩合反应而获得化学式(2C)的聚乙二醇化7-脱氢胆固醇衍生物。
【反应式4】
其中,R、X、n、m和m′与上述化学式(I)中的定义一致。
L为卤素、琥珀酰亚胺或咪唑,且
Za和Zb分别为保护基团。
根据反应式4,化学式(6)的化合物可经过与被保护基团取代或未被取代的化学式(17)的化合物进行反应而获得化学式(18)的化合物。化学式(18)的化合物可经过去保护而获得化学式(19)的化合物,化学式(19)的化合物可经过与化学式(7b)的化合物进行反应而获得作为侧链式聚乙二醇衍生物的化学式(20)的化合物。化学式(20)的化合物可经过去保护而获得化学式(21)的化合物,化学式(21)的化合物可经过与化学式(5)的化合物进行缩合反应而获得化学式(2D)的聚乙二醇化7-脱氢胆固醇衍生物。
【反应式5】
其中,R、X、n、m和m′与上述化学式(I)中的定义一致,且
Za为保护基团。
根据反应式5,化学式(8)的化合物可经过与被保护基团取代或未被取代的化学式(22)的化合物进行反应而获得化学式(23)的化合物。化学式(23)的化合物可经过去保护而获得化学式(24)的化合物,化学式(24)的化合物经过与化学式(15b)的化合物进行反应而获得化学式(25b)的化合物。化学式(25b)的化合物可经过与化学式(4)的化合物进行缩合反应而获得化学式(2E)的聚乙二醇化7-脱氢胆固醇衍生物。
此外,化学式(24)的化合物可经过与通过活化化学式(7a)的化合物而获得的化学式(15a)的化合物进行反应,而获得化学式(25a)的化合物,且化学式(25a)的化合物可经过与化学式(4)的化合物进行缩合反应,而获得化学式(2F)的聚乙二醇化7-脱氢胆固醇衍生物。
【反应式6】
其中,R、X、n、m和m′与上述化学式(I)中的定义一致,且
Za为保护基团。
根据反应式6,化学式(8)的化合物可经过与被保护基团取代或未被取代的化学式(22)的化合物进行反应,而获得化学式(23)的化合物,且化学式(23)的化合物可经过与化学式(4)的化合物进行缩合反应,而获得化学式(26)的化合物,化学式(26)的化合物可经过去保护而获得化学式(27)的化合物。化学式(27)的化合物可经过与化学式(5)的化合物进行缩合反应,而获得化学式(2G)的聚乙二醇化7-脱氢胆固醇衍生物。
在所述反应式中,所述缩合反应可优选地在存在缩合剂和有机胺催化剂的溶剂内进行。
所述缩合剂的例子可包括N,N,N',N'-四甲基-(苯并三唑-1-基)-uronium四氟硼酸盐(TBTU)、N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(EDC)、N,N'-二异丙基(DIC)和N,N'-二环己基碳(DCC),但不限于此。
此外,所述有机胺催化剂的例子可包括异丙基乙胺(DIPEA)和4-二甲氨基吡啶(DMAP),但不限于此。
所述溶剂的例子可包括无水有机溶剂,例如选自二氯甲烷、苯、甲苯、四氢呋喃和乙醚中的至少一种,但不限于此。此外,可将水或缓冲液用作所述溶剂,或与水混溶的有机溶剂,如可将乙腈、二甲基甲酰胺等与水一起混合使用。
上述反应可在冷却或加热温度下进行。
同时,所述保护基团的例子可包括Boc、Fmoc、CBz、tBuCO、Trt、Me、Et等,但不限于此。
此外,所述去保护反应可在存在酸或碱的有机溶剂内进行。所述有机溶剂可包括四氢呋喃(THF)、二氯甲烷(DCM)、甲醇、二甲基甲酰胺(DMF)等,但不限于此。此外,所述酸或碱的例子可包括三氟乙酸(TFA)、盐酸、硫酸、乙酸、哌啶、氢氧化钠等,但不限于此。
在反应式3和5中,如果必要,所述被活化的离去基团的取代反应可以在无水有机溶剂内,通过与有机胺催化剂,与亚硫酰氯、草酰氯、N-羟基琥珀酰亚胺、羰二咪唑等进行反应来实施。
本发明的化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物,与7-脱氢胆固醇相比,在水溶液内的溶解度得到提高,且对光和热的稳定性得到意想不到的改善。
因此,本发明的化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物可在体内水解而起到用于供应维生素D的前体、7-脱氢胆固醇的来源的作用,从而可被有效地用在用于减少皱纹和抗老化的化妆品组合物、药物组合物和功能食品中。
本发明还涉及用于减少皱纹和抗老化的化妆品组合物,该组合物包含化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。
本发明的化妆品组合物可包含约0.0001-10wt%,优选为0.01-1wt%量的作为活性成分的化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。所述活性成分的量可根据使用目的而定。
除了化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物之外,所述本发明的化妆品组合物还可包含本领域常用的化妆品成分,例如,如抗氧化剂、稳定剂、增溶剂、维生素、色素和香料的常用佐剂,以及载体。
本发明的化妆品组合物可被制成本领域常用的任何剂型,例如,溶液、悬浮液、乳液、膏剂、凝胶、霜剂、粉末、喷雾剂等。
在所述化妆品组合物被制成膏剂、霜剂或凝胶的情况下,所述载体的例子包括动物油、植物油、蜡、石蜡、淀粉、黄芪胶、纤维素衍生物、聚乙二醇、硅、膨润土、二氧化硅、滑石、氧化锌等。
在所述化妆品组合物被制成粉末或喷雾剂的情况下,所述载体的例子包括乳糖、滑石粉、硅石、氢氧化铝、硅酸钙、聚酰胺粉末等。特别地,当所述剂型为喷雾剂时,所述化妆品组合物可进一步包含氯氟烃、丙烷/丁烷或二甲醚的推进剂。
在所述化妆品组合物被制成溶液或乳液的情况下,所述载体的例子包括溶剂、增溶剂和乳化剂,如水、乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苄醇、苯甲酸苄酯、丙二醇、1,3-丁基二醇油、甘油脂肪酸酯、聚乙二醇、山梨糖醇脂肪酸酯等。
在所述化妆品组合物被制成悬浮液的情况下,所述载体的例子包括如水、乙醇和丙二醇的液体稀释剂,如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇酯和聚氧乙烯山梨糖醇酯的悬浮剂,微晶纤维素,铝金属氢氧化物,膨润土,琼脂,西黄蓍等。
本发明的化妆品组合物可应用于化妆品,如化妆水、乳液、霜、精华液、面膜、粉底、彩妆、防晒霜、两用粉饼、散粉、压缩粉底、底妆、遮瑕妆、眼影、唇膏、唇彩、修唇膏和眉笔。
本发明进一步涉及用于减少皱纹和抗老化的药物组合物,该组合物包含所述化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。
本发明的药物组合物可通过口服(如,通过口部或吸入服用)或肠胃外(如,注射给药、透皮吸收给药、直肠给药)途径进行给药,且所述注射可以为静脉注射、皮下注射、肌内注射和腹腔注射。本发明的药物组合物可被制成片剂、胶囊剂、颗粒剂、细字幕(fine subtilae)、粉剂、舌下表、栓剂、软膏、注射剂、乳剂、悬浮液、糖浆、喷雾剂等。本发明的药物组合物的这些各类剂型可根据已知方法通过使用本领域常用的药学上可接受的载体进行制备。所述药学上可接受的载体的例子可包括赋形剂、粘合剂、崩解剂、润滑剂、防腐剂、抗氧剂、等渗剂、缓冲剂、包衣剂、甜味剂、增溶剂、碱、分散剂、润湿剂、悬浮剂、稳定剂、着色剂等。
尽管根据剂型的种类会有所不同,本发明的药物组合物包含约0.1-10wt%,优选为0.1-1wt%的量的化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。
本发明的药物组合物的具体剂量可根据待治疗的包括人在内的哺乳动物的分类、体重、性别、疾病的严重程度、医嘱等来确定。优选地,基于受试者体重60公斤,用于口服的每日剂量可以在5-60μg的范围内。所述总的每日剂量可以根据疾病的严重程度、医嘱和其他条件进行一次给药或分几次给药。
此外,本发明涉及用于减少皱纹和抗老化的功能食品,该功能食品包含所述化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。
本发明的功能食品的种类不受特别限制。例如,所述功能食品可以为口服剂型,如粉末、颗粒剂、片剂、胶囊剂、悬浮液、乳液、糖浆,或者所述功能食品可被添加到如糖果、饼干、口香糖、冰淇淋、面条、面包、饮料的通常食品内。
本发明的功能食品可以根据其形式通过常用方法进行制备,且所述功能食品可适当地包含可被接受为食品材料的载体,例如,填充剂、增量剂、粘合剂、润湿剂、崩解剂、甜味剂、调味剂、防腐剂、表面活性剂、润滑剂、赋形剂等。
尽管根据所述功能食品的种类会有所不同,所述功能食品可包含约0.0001-10wt%,优选为0.1-1wt%的量的化学式(I)的聚乙二醇化7-脱氢胆固醇衍生物。
有益效果
本发明的聚乙二醇化7-脱氢胆固醇衍生物具有得到改善的稳定性和水中溶解度,且表现出减少的毒性。
因此,本发明的聚乙二醇化7-脱氢胆固醇衍生物可有效地用作用于减少皱纹和抗老化的化妆品组合物、药物组合物和功能食品中供应维生素D的良好来源。
此外,本发明的聚乙二醇化7-脱氢胆固醇衍生物可被各种体内酶转化成活性维生素D,从而能持续地提供如抗氧化、减少皱纹和美白的生物活性。
附图说明
图1为展示了实施例1的化合物(MP350DHC)和作为对比化合物的7-脱氢胆固醇(DHC)在恒温40℃下的热稳定性的图。
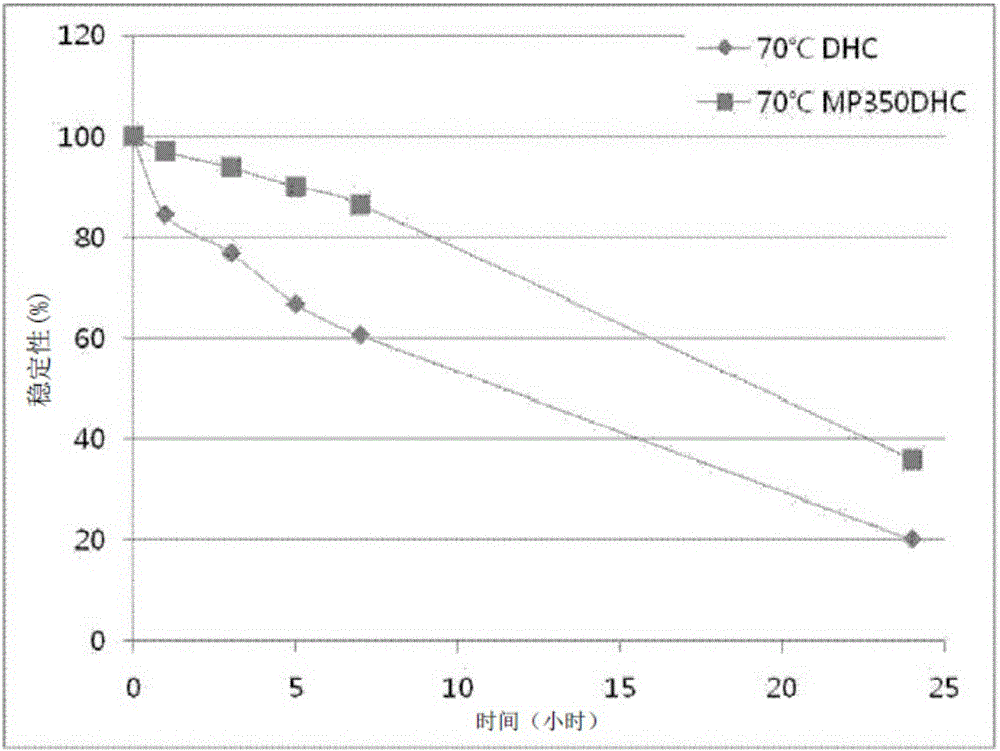
图2为展示了实施例1的化合物(MP350DHC)和作为对比化合物的7-脱氢胆固醇(DHC)在恒温70℃下的热稳定性的图。
图3为展示了实施例1的化合物(MP350DHC)和作为对比化合物的7-脱氢胆固醇(DHC)的光稳定性的图。
具体实施方式
通过以下实施例,进一步说明本发明,但不会限制本发明的范围。
实施例1:mPEG350-S-DHC酯的制备(化学式(1A)的化合物,其中R为甲基,X为O,n为7.25(平均值),且m为1)
实施例1-1:7-脱氢胆固醇琥珀酸酯的制备(化合式(5)的化合物,其中m为1)
在120ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(DHC)(6.45g,16.8mmol),其中加入三乙胺(3.39g,33.5mmol)和4-二甲氨基吡啶(0.82g,6.7mmol)而获得溶液。其中,加入琥珀酸酐(化合式(3)的化合物,其中m为1)(3.35g,33.5mmol),然后在室温下搅拌12小时。所述反应溶液依次用3.5%HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩。将残留物用硅胶柱层析(乙酸乙酯:己烷=1:2)进行提纯,而获得7.2g目标化合物。
1H NMR 400MHz(CDCl3)δ5.59(dd,1H),5.41(dd,1H),4.75(m,1H),2.72(dt,2H),2.64(dt,2H),2.52(d,1H),2.39(t,1H),2.18-1.85(m,6H),1.82-1.50(m,6H),1.48-0.93(m,11H),0.97(s,6H),0.90(d,3H),0.89(d,3H)0.64(s,3H)。
实施例1-2:mPEG350-S-DHC酯的制备(化学式(1A)的化合物,其中R为甲基,X为O,n为7.25(平均值),且m为1)
在10ml二氯甲烷内溶解实施例1-1的7-脱氢胆固醇琥珀酸酯(化学式(5)的化合物,其中m为1)(1.1g,2.30mmol)和mPEG350-OH(化学式(6)的化合物,其中R为甲基,n为7.25(平均值),且X为O)(0.8g,2.30mmol),向其中加入4-二甲氨基吡啶(0.42g,3.44mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(0.88g,4.59mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得1.77g目标化合物。
1H NMR 400MHz(CDCl3)δ5.59(dd,1H),5.40(dd,1H),4.74(m,1H),4.27(t,2H),3.72(t,2H),3.67(PEG backbone),3.57(t,2H),3.40(s,3H),2.67(dt,2H),2.62(dt,2H),2.52(d,1H),2.38(t,1H),2.12-1.89(m,6H),1.75-1.53(m,6H),1.43-0.95(m,11H),0.97(s,6H),0.90(d,3H),0.88(d,3H)0.64(s,3H)。
实施例2:mPEG2K-S-DHC酯的制备(化学式(1A)的化合物,其中R为甲基,X为O,n为44.3(平均值),且m为1)
除了使用实施例1-1的7-脱氢胆固醇琥珀酸酯(82.8mg,0.22mmol)、mPEG2K-OH(化学式(6)的化合物,其中R为甲基,n为44.3(平均值),且X为O)(452mg,0.22mmol)、5ml二氯甲烷、4-二甲氨基吡啶(65.7mg,0.54mmol)和N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(123.8mg,0.65mmol)之外,重复进行实施例1-2的过程,而获得462mg目标化合物。
1H NMR 400MHz(CDCl3)δ5.57(m,1H),5.40(m,1H),4.72(m,1H),4.25(t,2H),3.83-3.45(PEG backbone),3.38(s,3H),2.70-2.56(m,5H),2.48(dt,1H),2.38(dt,1H),2.12-1.89(m,6H),1.75-1.53(m,6H),1.43-0.95(m,11H),0.95(s,6H),0.88(d,3H),0.84(d,3H)0.62(s,3H)。
实施例3:mTrEG-S-DHC酯的制备(化学式(1A)的化合物,其中R为甲基,X为O,n为3,且m为1)
在8ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(0.54g,1.40mmol)和甲氧基三乙二醇琥珀酸酯(化学式(7a)的化合物,其中R为甲基,n为3,X为O,且m为1;mTrEG-琥珀酸)(0.37g,1.40mmol),向其中加入4-二甲氨基吡啶(0.26g,2.11mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(0.67g,3.51mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得0.69g目标化合物。
1H NMR 400MHz(CDCl3)δ5.58(dd,1H),5.40(dd,1H),4.74(m,1H),4.28(t,2H),3.72(t,2H),3.68(m,6H),3.59(t,2H),3.40(s,3H),2.65(m,4H),2.52(dd,1H),2.39(t,1H),2.12-1.89(m,6H),1.75-1.53(m,6H),1.43-0.95(m,11H),0.97(s,6H),0.90(d,3H),0.88(d,3H)0.64(s,3H)。
实施例4:mPEG350-S-DHC酰胺的制备(化学式(1A)的化合物,其中R为甲基,X为NH,n为7.25(平均值),且m为1)
在6ml二氯甲烷内溶解实施例1-1中获得的7-脱氢胆固醇琥珀酸酯(346.2mg,0.714mmol)和mPEG350-NH2(化学式(6)的化合物,其中R为甲基,n为7.25(平均值),且X为NH;平均分子量为350)(250mg,0.714mmol),向其中加入4-二甲氨基吡啶(87.3mg,0.714mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(410.8g,2.14mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得508mg目标化合物。
1H NMR 400MHz(CDCl3)δ6.35(s,1H),5.57(dd,1H),5.39(dd,1H),4.72(m,1H),3.66(PEG back-bone),3.47(t,2H),3.39(s,3H),2.65(dt,2H),2.48(d,1H),2.37(t,1H),2.08-1.89(m,6H),1.74-1.50(m,6H),1.42-0.96(m,11H),0.96(s,6H),0.88(d,3H),0.87(s,3H),0.63(s,3H)。
实施例5:mPEG2K-P-DHC的制备(化学式(1B)的化合物,其中R为甲基,X为NH,n为44.3(平均值),且m为1)
在100ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(0.32g,0.84mmol)和mPEG2K-丙酸(化学式(7b)的化合物,其中R为甲基,n为44.3(平均值),且m为1;平均分子量为2,000)(1.68g,0.84mmol),向其中加入4-二甲氨基吡啶(0.154g,1.26mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(0.322g,1.68mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得1.57g目标化合物。
1H NMR 400MHz(CDCl3)δ5.58(m,1H),5.40(m,1H),4.74(m,1H),3.84-3.47(PEG backbone),3.39(s,3H),2.67(dt,2H),2.60(dt,2H),2.52(d,1H),2.38(t,1H),2.12-1.89(m,6H),1.75-1.53(m,6H),1.43-0.95(m,11H),0.96(s,6H),0.89(d,3H),0.87(d,3H)0.63(s,3H)。
实施例6:mPEG2K-O-A-DHC的制备(化学式(2A)的化合物,其中R为甲基,X为O,n为44.3(平均值),且Y1为甲基)
实施例6-1:mPEG2K-NPC的制备(化学式(8)的化合物,其中R为甲基,X为O,n为44.3(平均值))
在120ml二氯甲烷内溶解干燥的mPEG2K-OH(化学式(6)的化合物,其中R为甲基,n为44.3(平均值),且X为O)(30g,14.9mmol)而获得溶液,向其中加入4-硝基苯基氯甲酸酯(12g,59.7mmol)和吡啶(5.9ml,74.6mmol),然后在室温下搅拌20小时。所述反应溶液依次用150ml的1.0N HCl水溶液和150ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。所得混合物在二乙醚内进行沉淀,而获得33.5g的白色固体目标化合物。
实施例6-2:mPEG2K-Ala-OH的制备(化学式(10)的化合物,其中R为甲基,X为O,n为44.3(平均值),且Y1为甲基)
在100ml乙腈和60ml蒸馏水内溶解实施例6-1中获得的mPEG2K-NPC(16g,7.2mmol),而获得溶液。其中,加入H-Ala-OH(化学式(9)的化合物,其中Y1为甲基)(1.9g,21.7mmol)、二异丙基乙胺(1.5ml,21.7mmol),然后在室温下搅拌8小时。所述反应溶液用300ml二氯甲烷进行提取后,依次用300ml的1.0N HCl水溶液和300ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。所得混合物在二乙醚内进行沉淀,而获得白色固体目标化合物(18.8g,36.4mmol)。
实施例6-3:mPEG2K-O-A-DHC的制备(化学式(2A)的化合物,其中R为甲基,X为O,n为44.3(平均值),且Y1为甲基)
在100ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(0.2g,0.48mmol)和实施例6-2中获得的mPEG2K-Ala-OH(0.10g,0.23mmol),向其中加入4-二甲氨基吡啶(0.14g,1.14mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(0.2g,1.14mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得1.06g目标化合物。
1H NMR 400MHz(CDCl3)δ5.59(dd,1H),5.44(dd,1H),5.41(bs,1H),4.36(q,1H),4.22(t,2H),3.83(t,2H),3.77-3.52(PEG back-bone),3.48(t,2H),3.39(s,3H),2.80(dt,2H),2.55(d,2H),2.41(d,2H),2.19-1.77(m,6H),1.74-1.52(m,6H),1.43-1.08(m,11H),0.96(s,6H),0.89(d,3H),0.88(d,3H),0.63(s,3H)。
实施例7:mPEG2K-NH-A-DHC的制备(化学式(2B)的化合物,其中R为甲基,n为44.3(平均值),X为NH,Y1为甲基,且m为1)
实施例7-1:mPEG2K-NH-Ala-Fmoc的制备(化学式(13)的化合物,其中R为甲基,n为44.3(平均值),X为NH,Y1为甲基,且Zb为Fmoc)
在二甲基甲酰胺(DMF)内溶解mPEG2K-NH2(化学式(6)的化合物,其中R为甲基,n为44.3,且X为NH)(280mg,0.14mmol)、HOBt(94.6mg,0.70mmol)、二异丙基乙胺(90.5mg,0.70mmol)并搅拌10分钟,获得溶液。其中,加入通过混合Fmoc-Ala-OH(化学式(12)的化合物,其中Zb为Fmoc,Y1为甲基)(218.0mg,0.70mmol)和PyBOP(364.5mg,0.70mmol)并搅拌该混合物10分钟而获得的溶液,然后在室温下搅拌5小时。所述反应溶液依次用150ml的1.0N HCl水溶液和150ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。所得混合物在二乙醚进行沉淀,而获得301.1mg的白色固体目标化合物。
实施例7-2:mPEG2K-NH-Ala-H的制备(化学式(14)的化合物,其中R为甲基,n为44.3(平均值),X为NH,且Y1为甲基)
在6ml含有25%哌啶的DMF溶液内溶解实施例7-1中获得的mPEG2K-NH-Ala-Fmoc(300mg,0.13mmol),然后在室温下搅拌3小时。所述反应溶液在100ml二乙醚内进行沉淀,而获得0.26mg的白色固体目标化合物。
实施例7-3:mPEG2K-NH-A-DHC的制备(化学式(2B)的化合物,其中R为甲基,n为44.3(平均值),X为NH,Y1为甲基,且m为1)
在5ml二氯甲烷内溶解实施例1-1获得的7-脱氢胆固醇琥珀酸酯(120mg,0.24mmol)和mPEG2K-NH-Ala-H(250mg,0.12mmol),向其中加入4-二甲氨基吡啶(17.7mg,0.14mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(69.5mg,0.36mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得283mg目标化合物。
1H NMR 400MHz(CDCl3)δ5.59(dd,1H),5.44(m,3H),4.33(q,1H),4.23(m,1H),3.66(PEG backbone),3.48(t,2H),3.39(s,3H),2.72(dt,2H),2.64(dt,2H),2.52(d,1H),2.48(d,3H),2.39(t,1H),2.18-1.85(m,6H),1.82-1.50(m,6H),1.48-0.93(m,11H),0.97(s,6H),0.90(d,3H),0.89(d,3H)0.64(s,3H)。
实施例8:mPEG2K-P-Ala-DHC的制备(化学式(2C)的化合物,其中R为甲基,n为44.3(平均值),m为1,且Y1为甲基)
实施例8-1:mPEG2K-P-NHS的制备(化学式(15b)的化合物,其中R为甲基,n为44.3(平均值),m为1,且L为琥珀酰亚胺)
在7ml二氯甲烷内溶解mPEG-PA(化学式(7b)的化合物,其中R为甲基,n为44.3(平均值),且m为1)(1g,0.476mmol)。其中,加入N-羟基琥珀酰亚胺(0.27g,2.38mmol)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.45g,2.38mmol)、二甲氨基吡啶(0.18g,1.198mmol),然后在室温下搅拌5小时。所述反应溶液用100ml二氯甲烷进行提取后,依次用100ml的1.0N HCl水溶液和100ml饱和碳酸氢钠水溶液和100ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。使所得混合物在二乙醚进行沉淀,而获得0.94g的白色固体目标化合物。
实施例8-2:mPEG2K-P-Ala-OH的制备(化学式(16)的化合物,其中R为甲基,n为44.3(平均值),m为1,且Y1为甲基)
在5ml二氯甲烷内溶解实施例8-1中获得的mPEG2K-P-NHS(450mg,0.21mmol)而获得溶液。将该溶液缓缓加入到在2.5ml二氯甲烷和2.5ml二甲基甲酰胺内溶解H-Ala-OH(92.4mg,1.04mmol)和三乙胺(115.5mg,1.14mmol)的溶液中,然后在室温下搅拌3小时。所述反应溶液依次用1.0N HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得478mg目标化合物。
实施例8-3:mPEG2K-P-Ala-DHC的制备(化学式(2C)的化合物,其中R为甲基,n为44.3(平均值),m为1,且Y1为甲基)
在10ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(90.4mg,0.24mmol)和实施例8-2中获得的mPEG2K-P-Ala-OH(420mg,0.19mmol),向其中加入4-二甲氨基吡啶(35.9mg,0.29mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(93.9mg,0.49mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得457mg目标化合物。
1H NMR 400MHz(CDCl3)δ5.59(dd,1H),5.44(m,3H),4.26(q,1H),4.23(m,1H),3.66(PEG backbone),3.39(s,3H),2.60(t,2H),2.52(d,1H),2.39(t,1H),2.18-1.85(m,6H),1.82-1.50(m,6H),1.50(d,3H),1.48-0.93(m,11H),0.97(s,6H),0.90(d,3H),0.89(d,3H)0.64(s,3H)。
实施例9:α-mPEG2K-NH-γ-mPEG2K-P-Dab-DHC的制备(化学式(2D)的化合物,其中R为甲基,n为44.3(平均值),X为NH,m和m′分别为1)
实施例9-1:α-mPEG2K-NH-Dab(tBoc)-Fmoc的制备(化学式(18)的化合物,其中R为甲基,n为44.3(平均值),X为NH,m′为1,Za为tBoc的保护基团,且Zb为Fmoc的保护基团)
除了使用mPEG2K-NH2(400mg,0.20mmol)、HOBt(135.2mg,1.00mmol)、二异丙基乙胺(129.3mg,1.00mmol)、Fmoc-Dab(tBoc)-OH(化学式(17)的化合物,其中m′为1,Za为tBoc的保护基团,且Zb为Fmoc的保护基团)(264.4mg,0.60mmol)、PyBOP(520.6mg,1.00mmol)和40ml的DMF之外,重复进行实施例7-1的过程,而获得473mg的白色固体目标化合物。
实施例9-2:α-mPEG2K-NH-Dab-Fmoc的制备(化学式(19)的化合物,其中R为甲基,n为44.3(平均值),X为NH,m′为1,且Zb为Fmoc的保护基团)
在5ml二氯甲烷内溶解实施例9-1中获得的α-mPEG2K-NH-Dab(tBoc)-Fmoc(450mg,0.47mmol)而获得溶液。其中,加入5ml三氟乙酸,然后在室温下搅拌3小时。所述反应溶液中加入50ml二氯甲烷后,依次用50ml饱和碳酸氢钠水溶液和50ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。使所得混合物在二乙醚进行沉淀,而获得428mg的白色固体目标化合物。
实施例9-3:α-mPEG2K-NH-γ-mPEG2K-P-Dab-Fmoc的制备(化学式(20)的化合物,其中R为甲基,n为44.3(平均值),X为NH,m和m′分别为1,且Zb为Fmoc的保护基团)
在8ml二氯甲烷内溶解实施例9-2中获得的α-mPEG2K-NH-Dab-Fmoc(420mg,0.18mmol),其中加入mPEG2K-PA(374.9mg,0.18mmol)、4-二甲氨基吡啶(33.2mg,0.27mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(69.4mg,0.36mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得750mg目标化合物。
实施例9-4:α-mPEG2K-NH-γ-mPEG2K-P-Dab-H的制备(化学式(21)的化合物,其中R为甲基,n为44.3(平均值),X为NH,且m和m′分别为1)
在14ml含有25%哌啶的DMF溶液内溶解实施例9-3中获得的α-mPEG2K-NH-γ-mPEG2K-P-Dab-Fmoc(700mg,0.16mmol),然后在室温下搅拌3小时。使所述反应溶液在100ml二乙醚内进行沉淀,而获得651mg的白色固体目标化合物。
实施例9-5:α-mPEG2K-NH-γ-mPEG2K-P-Dab-DHC的制备(化学式(2D)的化合物,其中R为甲基,n为44.3(平均值),X为NH,且m和m′分别为1)
除了在10ml二氯甲烷内溶解实施例1-1中获得的7-脱氢胆固醇琥珀酸酯(64.2mg,0.13mmol)和实施例9-4中获得的α-mPEG2K-NH-γ-mPEG2K-P-Dab-H(550mg,0.13mmol),向其中加入4-二甲氨基吡啶(24.3mg,0.20mmol),然后使用N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(50.8mg,0.26mmol)之外,重复进行实施例7-3的过程,而获得587mg目标化合物。
1H NMR 400MHz(CDCl3)δ5.74(m,2H),5.59(d,1H),5.44(m,2H),4.35(m,1H),4.23(m,3H),3.84-3.66(PEG back-bone),3.57(m,6H),3.48(t,2H),3.39(s,6H),2.72(dt,2H),2.64(dt,2H),2.62(t,2H),2.53-2.39(m,4H),2.20-1.52(m,16H),1.41-1.06(m,11H),0.96(s,6H),0.89(d,3H),0.88(d,3H),0.63(s,3H)。
实施例10:α-mPEG2K-γ-mPEG2K-P-Dab-DHC的制备(化学式(2E)的化合物,其中R为甲基,n为44.3(平均值),X为O,m和m′分别为1)
实施例10-1:mPEG2K-Dab(tBoc)-OH的制备(化学式(23)的化合物,其中R为甲基,n为44.3(平均值),X为O,m′为1,且Za为tBoc)
除了使用将实施例6-1中获得的mPEG2K-NPC(2g,0.91mmol)溶解于15ml乙腈和10ml蒸馏水中而获得的溶液、H-Dab(tBoc)-OH(化学式(22)的化合物,其中m′为1,Za为tBoc)(0.59g,2.72mmol)和二异丙基乙胺(0.46ml,2.72mmol)之外,重复进行实施例6-2的过程,而获得1.67g目标化合物。
实施例10-2:mPEG2K-Dab-OH的制备(化学式(24)的化合物,其中R为甲基,n为44.3(平均值),X为O,且m′为1)
除了在10ml二氯甲烷中溶解实施例10-1中获得的mPEG2K-Dab(tBoc)-OH(1g,0.47mmol)并在其中加入三氟乙酸(10ml,0.13mmol)之外,重复进行实施例9-2的过程,而获得0.76g目标化合物。
实施例10-3:α-mPEG2K-γ-mPEG2K-P-Dab-OH的制备(化学式(25b)的化合物,其中R为甲基,n为44.3(平均值),X为O,且m和m′分别为1)
在5ml二氯甲烷内溶解实施例10-2中获得的mPEG2K-Dab-OH(0.34g,0.16mmol)和实施例8-1中获得的mPEG2K-P-NHS(0.35g,0.16mmol),而获得溶液。其中,加入87μl三乙胺,然后在室温下搅拌12小时。所述反应溶液中加入100ml二氯甲烷后,依次用100ml的1.0N HCl水溶液和100ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。使所得混合物在二乙醚进行沉淀,而获得0.54g的白色固体目标化合物。
实施例10-4:α-mPEG2K-γ-mPEG2K-P-Dab-DHC的制备(化学式(2E)的化合物,其中R为甲基,n为44.3(平均值),X为O,且m和m′分别为1)
在50ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(38.0mg,0.098mmol)和实施例10-3中获得的α-mPEG2K-γ-mPEG2K-P-Dab-OH(0.10g,0.049mmol),向其中加入4-二甲氨基吡啶(6.0mg,0.247mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(95mg,0.494mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得0.48g目标化合物。
1H NMR 400MHz(CDCl3)δ6.85(bs,1H),5.74(m,1H),5.59(d,1H),5.32(d,1H),4.35(m,1H),4.23(m,3H),3.84-3.66(PEG back-bone),3.49(t,2H),3.39(s,6H),2.53-2.39(m,4H),2.20-1.52(m,8H),1.41-1.06(m,11H),0.96(s,6H),0.89(d,3H),0.88(d,3H),0.63(s,3H)。
实施例11:α-mPEG5K-γ-mPEG5K-S-Dab-DHC的制备(化学式(2F)的化合物,其中R为甲基,n为113.0(平均值),X为O,m和m′分别为1)
实施例11-1:mPEG5K-S-NHS的制备(化学式(15a)的化合物,其中R为甲基,n为113.0(平均值),X为O,m为1,且L为NHS)
除了使用mPEG5K-SA(化学式(7a)的化合物,其中R为甲基,n为113.0(平均值),X为O,且m为1)(1.0g,0.20mmol)、N-羟基琥珀酰亚胺(0.16g,1.4mmol)、二甲氨基吡啶(73mg,0.6mmol)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(0.27g,1.4mmol)和7ml二氯甲烷之外,重复进行实施例8-1的过程,而获得0.93g的白色固体目标化合物。
实施例11-2:mPEG5K-Dab(tBoc)-OH的制备(化学式(23)的化合物,其中R为甲基,n为113.0(平均值),X为O,m′为1,且Za为tBoc)
除了在10ml乙腈和10ml蒸馏水中溶解mPEG5K-NPC(2g,0.384mmol)并在其中加入H-Dab(tBoc)-OH(0.17g,0.768mmol)和二异丙基乙胺(0.2ml,1.15mmol)之外,重复进行实施例10-1的过程,而获得1.7g目标化合物。
实施例11-3:mPEG5K-Dab-OH的制备(化学式(24)的化合物,其中R为甲基,n为113.0(平均值),X为O,且m′为1)
除了使用实施例11-2中获得的mPEG5K-Dab(tBoc)-OH(1.3g,0.254mmol)、13ml三氟乙酸和13ml二氯甲烷之外,重复进行实施例9-2的过程,而获得1.2g目标化合物。
实施例11-4:α-mPEG5K-γ-mPEG5K-S-Dab-OH的制备(化学式(25a)的化合物,其中R为甲基,n为113.0(平均值),X为O,且m和m′分别为1)
在15ml二氯甲烷内溶解实施例11-3中获得的mPEG5K-Dab-OH(0.79g,0.15mmol)和实施例11-1中获得的mPEG5K-S-NHS(0.8g,0.15mmol),而获得溶液。其中,加入0.1ml三乙胺,然后在室温下搅拌12小时。所述反应溶液中加入50ml二氯甲烷后,依次用50ml的1.0N HCl水溶液和50ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。使所得混合物在二乙醚进行沉淀,而获得1.35g的白色固体目标化合物。
实施例11-5:α-mPEG5K-γ-mPEG5K-S-Dab-DHC的制备(化学式(2F)的化合物,其中R为甲基,n为113.0(平均值),X为O,且m和m′分别为1)
在10ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(38.0mg,0.098mmol)和实施例11-4中获得的α-mPEG5K-γ-mPEG5K-S-Dab-OH(0.5g,0.049mmol),向其中加入4-二甲氨基吡啶(6.0mg,0.247mmol)。其中,缓缓加入N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(95mg,0.494mmol),然后在室温下搅拌12小时。所述反应溶液依次用1.0N的HCl水溶液、饱和碳酸氢钠水溶液和饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤,减压浓缩,并真空干燥,而获得0.49g目标化合物。
1H NMR 400MHz(CDCl3)δ6.79(bs,1H),5.69(m,1H),5.53(d,1H),5.30(d,1H),4.29(m,1H),4.17(m,3H),3.91-3.50(PEG backbone),3.45(t,4H),3.34(t,4H),3.34(s,6H),2.55-2.48(m,8H),2.1-1.62(m,14H),1.42-1.14(m,11H),0.95(s,6H),0.84(d,3H),0.82(d,3H),0.59(s,3H)。
实施例12:α-mPEG350-γ-DHC-Dab-DHC的制备(化学式(2G)的化合物,其中R为甲基,n为7.25(平均值),X为O,m和m′分别为1)
实施例12-1:mPEG350-NPC的制备(化学式(8)的化合物,其中R为甲基,X为O,且n为7.25(平均值))
在200ml二氯甲烷内溶解干燥的mPEG350-OH(化学式(6)的化合物,其中R为甲基,n为7.25(平均值),且X为O)((15g,42.86mmol)而获得溶液。其中,加入4-硝基苯基氯甲酸酯(12g,64.29mmol)和吡啶(5.0ml,64.29mmol),然后在室温下搅拌16小时。所述反应溶液依次用150ml的1.0N HCl水溶液和150ml饱和氯化钠水溶液进行清洗。然后,使所述有机相经过无水硫酸镁干燥,过滤和减压浓缩。所得混合物用甲醇和二氯甲烷经过硅胶柱层析获得18.8g的白色固体目标化合物。
实施例12-2:α-mPEG350-Dab(tBoc)-OH的制备(化学式(23)的化合物,其中R为甲基,X为O,n为7.25(平均值),m′为1,且Za为tBoc的保护基团)
除了使用使用将实施例12-1中获得的mPEG350-NPC(1.0g,1.94mmol)溶解于20ml乙腈和20ml蒸馏水中而获得的溶液和二异丙基乙胺(0.50g,3.88mmol)且使所得混合物经过硅胶柱层析之外,重复进行实施例6-2的过程,而获得0.98g目标化合物。
实施例12-3:α-mPEG350-Dab(tBoc)-DHC的制备(化学式(26)的化合物,其中R为甲基,X为O,n为7.25(平均值),m′为1,且Za为tBoc的保护基团)
除了在10ml二氯甲烷内溶解化学式(4)的7-脱氢胆固醇(582.6mg,0.098mmol)和实施例12-2中获得的α-mPEG350-Dab(tBoc)-OH(900mg,1.51mmol),其中加入4-二甲氨基吡啶(208.2mg,1.70mmol)并使用N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(435.5mg,2.27mmol),然后使所得混合物经过硅胶柱层析之外,重复进行实施例6-3的过程,而获得1.23g目标化合物。
实施例12-4:α-mPEG350-Dab-DHC的制备(化学式(27)的化合物,其中R为甲基,X为O,n为7.25(平均值),且m′为1)
除了加入将实施例12-3中获得的α-mPEG350-Dab(tBoc)-DHC(250mg,0.26mmol)溶解于2.5ml二氯甲烷内而获得的溶液和2.5ml三氟乙酸,并使所得混合物经过硅胶柱层析之外,重复进行实施例9-2的过程,而获得194mg目标化合物。
实施例12-5:α-mPEG350-γ-DHC-Dab-DHC的制备(化学式(2G)的化合物,其中R为甲基,n为7.25(平均值),X为O,且m和m′分别为1)
除了在5ml二氯甲烷内溶解实施例1-1中获得的7-脱氢胆固醇琥珀酸酯(56.3mg,0.12mmol)和实施例12-4中获得的α-mPEG350-Dab-DHC(100mg,0.12mmol),其中加入4-二甲氨基吡啶(21.3mg,0.17mmol),然后使用N-(3-二甲基氨基丙基)-N'-乙基-碳二亚胺(44.5mg,0.23mmol)之外,重复进行实施例7-3的过程,而获得141mg目标化合物。
1H NMR 400MHz(CDCl3)δ6.85(bs,1H),5.74(m,1H),5.59(d,2H),5.44(m,2H),4.35(t,2H),4.33(m,2H),4.22(m,1H),3.84-3.66(PEG back-bone),3.39(s,3H),2.72(dt,2H),2.64(dt,2H),2.53-2.39(m,6H),2.23-1.51(m,14H),1.41-1.06(m,22H),0.97(s,12H),0.88(d,6H),0.87(d,6H),0.63(s,6H)。
表1展示了在实施例1-12中获得的本发明的聚乙二醇化7-脱氢胆固醇衍生物的化学结构。
【表1】
实验实施例1:溶解度测试
在100ml蒸馏水中分别溶解100mg的实施例1和5的化合物及作为对比材料的7-脱氢胆固醇,然后在室温下搅拌1小时。重复该过程,直到各化合物达到饱和,过滤那些没有溶解的部分,而分别制备饱和水溶液。
然后,将所述饱和水溶液放入称重空容器(A)内,进行称重(B)。然后,所述容器内的饱和水溶液经过减压浓缩和真空干燥后,进行称重(C)。根据以下方程式1,计算各溶液的溶解度,将其结果显示于表2中。
【方程式1】
【表2】
从表2中可确认,与7-脱氢胆固醇相比,实施例1和5的聚乙二醇化7-脱氢胆固醇衍生物具有意想不到的优异的水中溶解度。
实验实施例2:热稳定性测试
将实施例1的化合物以10mM的浓度溶解于二甲基亚砜内,以制备溶液。作为对比材料,将7-脱氢胆固醇以10mM的浓度溶解于二甲基亚砜和甲醇(9:1)的混合液内,而制备另一溶液。将制备的溶液分成每组量为1.5ml的测试溶液,分别避光保存在恒温40℃和70℃下。待经过一定时间后,将每组测试溶液用甲醇稀释,而制备1mM的样品。在以下条件下,分别用高效液相色谱法(HPLC)分析所述样品。其结果在图1和图2中展示。
检测仪:Agilent HPLC 1260
柱:C18(150×4.6mm/5um)
洗脱液:乙腈:甲醇=6:4
柱的温度;30℃
解析度(%)=[Ctx/Ct0]×100(%)
Ct0=实施例1的溶液在0时的峰面积
Ctx=实施例1的溶液在X时的峰面积。
从图1和图2中可确定,与7-脱氢胆固醇相比,实施例1的聚乙二醇化7-脱氢胆固醇衍生物具有优异的热稳定性。
实验实施例3:光稳定性测试
将实施例1的化合物溶解于二甲基亚砜内,而制备实施例1的化合物的浓度为10mM的溶液。作为对比材料,将7-脱氢胆固醇溶解于二甲基亚砜和甲醇(9:1)的混合液内,而制备7-脱氢胆固醇的浓度为10mM的另一溶液。将制备的溶液分成小组而置于板孔内,每组150μl,然后曝光在紫外线(中波,315nm,宽度:12cm)。待经过一定时间后,将每组测试溶液用甲醇稀释,而制备1mM的样品。在以下条件下,分别用高效液相色谱法(HPLC)分析所述样品。其结果在图3中展示。
检测仪:Agilent HPLC 1260
柱:C18(150×4.6mm/5um)
洗脱液:乙腈:甲醇=6:4
柱的温度;30℃
解析度(%)=[Ctx/Ct0]×100(%)
Ct0=实施例1的溶液在0时的峰面积
Ctx=实施例1的溶液在X时的峰面积。
从图3中可确定,实施例1的聚乙二醇化7-脱氢胆固醇衍生物与7-脱氢胆固醇相比具有优异的光稳定性。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新型罗汉果醇衍生物单体的制作方法
- 通过预先占位调控邻位碳硼烷衍生物结构的方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗菌药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 毛栲利素衍生物的制备方法及其抗菌活性的新用图
- 6-o-脱甲基侧厚壳桂碱衍生物及其制备和抗病毒活性应用及抗癌活性的制作方法
- 一种聚乙二醇中吡啶衍生物的合成方法
- 棉酚衍生物和它们的制备,在农药上的应用及抗癌活性的制作方法
- 用于治疗或预防神经精神病疾病的含有黄酮-6-c-葡萄糖衍生物作为活性成分的药物组合物的制作方法
- 具有抗癌活性的6-氧代-1,6-二氢-哒嗪衍生物与吉非替尼的组合的制作方法
- 2,3′-脱水-2′-脱氧-5-氟尿苷衍生物与细胞毒活性、制备方法及应用
- 2,3′-脱水-2′-脱氧-5-氟尿苷衍生物与细胞毒活性、制备方法及应用
- 具有抗肿瘤活性的哌啶酮衍生物及其制备方法
- 一种支化聚乙二醇的脂质衍生物及其组成的脂质膜结构体的制作方法