用于制备具有人工内共生体的宿主细胞的系统的制作方法
本发明总体上涉及用于制备具有人工内共生体的宿主细胞的系统。本发明还涉及利用本发明的系统来制备具有内共生体的宿主细胞的方法。
背景技术:
线粒体、叶绿体和其它膜结合细胞器向真核细胞添加可遗传的功能性,例如光合作用。所述细胞器(由它们的退化环状DNA来识别)被认为是内共生地衍生的。
细菌存在广泛的功能,这些功能在各种真核细胞中不存在。例如,1975年,Blakemore鉴定出趋磁细菌(MTB),其沿地磁场定向和漂浮(Blakemore,R.,Magnetotactic bacteria,Science24:377-379(1975);(该篇文献出于所有目的以其全文形式在此被援引加入本文))。这些趋磁细菌产生被称为磁小体的磁结构,所述磁小体由被脂质膜包住的磁铁矿(Fe3O4)或硫复铁矿(Fe3S4)组成。自它们最初被发现以来,已有大量的MTB种类得以识别。
技术实现要素:
本发明涉及用于制备具有人工内共生体的宿主细胞的系统。在一个实施例中,本发明的系统包括宿主细胞、人工内共生体、和用于将人工内共生体引入宿主细胞的装置。在一个实施例中,本发明的系统包括宿主细胞、人工内共生体、用于将人工内共生体引入宿主细胞的装置、和用于富集具有人工内共生体的宿主细胞的装置。在一个实施例中,系统还可包括用于检测含有人工内共生体的宿主细胞的装置。在一个实施例中,本发明的系统包括宿主细胞、人工内共生体、用于将人工内共生体引入宿主细胞的装置、和用于检测含有人工内共生体的宿主细胞的装置。在一个实施例中,用于引入人工内共生体的装置可以是磁性装置、加速装置、注射装置、电场装置、配体-受体装置、浓缩装置、化学装置、膜融合装置和/或吞噬体逃逸装置。在一个实施例中,用于检测含有人工内共生体的宿主细胞的装置可用于测量宿主细胞获得的人工内共生体的效率、浓度和/或数量。在一个实施例中,在应用低频交变磁场后,用于检测的装置测量来自含有人工内共生体的宿主细胞的热响应。在一个实施例中,用于检测的装置利用MRI或NMR来测量宿主细胞中的人工内共生体。在一个实施例中,用于检测的装置利用磁测量法(magnometry)、高热、EPR、莫斯鲍尔(Mossbauer)、SQUID或其它磁测量来测量宿主细胞中的人工内共生体。在一个实施例中,人工内共生体表达GFP或其它光学活性报道子,而用于检测的装置进行光学测量,测量由GFP或其它光学活性报道子产生的光的量。在一个实施例中,人工内共生体表达非光学报道子,而用于检测的装置测量非光学报道子或来自非光学报道子的信号、分子或产物。
在一个实施例中,用于引入人工内共生体的装置是磁性装置,被设置成使得人工内共生体朝向宿主细胞移动。在一个实施例中,磁性装置可以是永磁体或电磁体。在一个实施例中,磁性装置被放置在靠近或邻近包含宿主细胞和人工内共生体的容器处。在一个实施例中,磁性装置被设计成跨容器产生人工内共生体进入宿主细胞的相似量的加载。在一个实施例中,在容器中人工内共生体与宿主细胞发生接触的那部分的加载量是相似的。在一个实施例中,磁性装置被设计成提供的磁场强度在人工内共生体被引入宿主细胞的容器中是相似的。在一个实施例中,磁性装置被设计成和/或操作成提供的磁场强度跨容器是相似的。在一个实施例中,磁性装置被设计成和/或操作成在容器的底部或底板上方提供的磁场梯度跨容器是相似的。在一个实施例中,跨容器的磁场强度是均一的。在一个实施例中,在每个容器中的磁场分布是相似的。在一个实施例中,在每个容器中的磁场分布是均一的。在一个实施例中,系统具有多个容器,并且在每个容器中的磁场分布是相似的。在一个实施例中,系统具有多个容器,并且容器与容器间的磁场分布是均一的。在一个实施例中,在多容器系统中,容器与容器间的人工内共生体进入宿主细胞的加载量是相似的。在一个实施例中,多个容器被设置为本领域公知的多孔平板形式,包括具有2、6、12、24、48孔等等的形式。在一个实施例中,平板是2×3阵列的6孔平板。在一个实施例中,容器是适于规模化或工业化应用的容器,例如,烧瓶、发酵罐或生物反应器。
本发明还涉及利用本发明的系统制备具有人工内共生体的宿主细胞的方法。在一个实施例中,将宿主细胞和人工内共生体放置在同一容器中,使其受控于用于将人工内共生体引入宿主细胞的装置,并然后获得包含人工内共生体的宿主细胞。在一个实施例中,将宿主细胞和人工内共生体放置在同一容器中,使其受控于用于将人工内共生体引入宿主细胞的装置,并然后从用于富集具有人工内共生体的宿主细胞的装置获得包含人工内共生体的宿主细胞。在一个实施例中,将宿主细胞和人工内共生体放置在同一容器中,使其受控于用于将人工内共生体引入宿主细胞的装置,并然后利用用于检测包含人工内共生体的宿主细胞的装置分析包含人工内共生体的宿主细胞。在一个实施例中,宿主细胞粘附至容器表面。在一个实施例中,宿主细胞悬浮生长并且不贴附至容器的表面。在一个实施例中,宿主细胞群体既有悬浮细胞又有粘附细胞,并且发现有悬浮和贴附至容器的表面的宿主细胞。在一个实施例中,宿主细胞是粘附和悬浮细胞的异质群体。
本发明还涉及用于制备具有人工内共生体的宿主细胞的试剂盒。本发明的试剂盒包括用于制备具有人工内共生体的宿主细胞的系统的消耗项。试剂盒还可包括需要不时更换的本发明的系统的项目。在一个实施例中,本发明的试剂盒包括用于本发明的系统的一个、两个、三个或更多项目。
附图说明
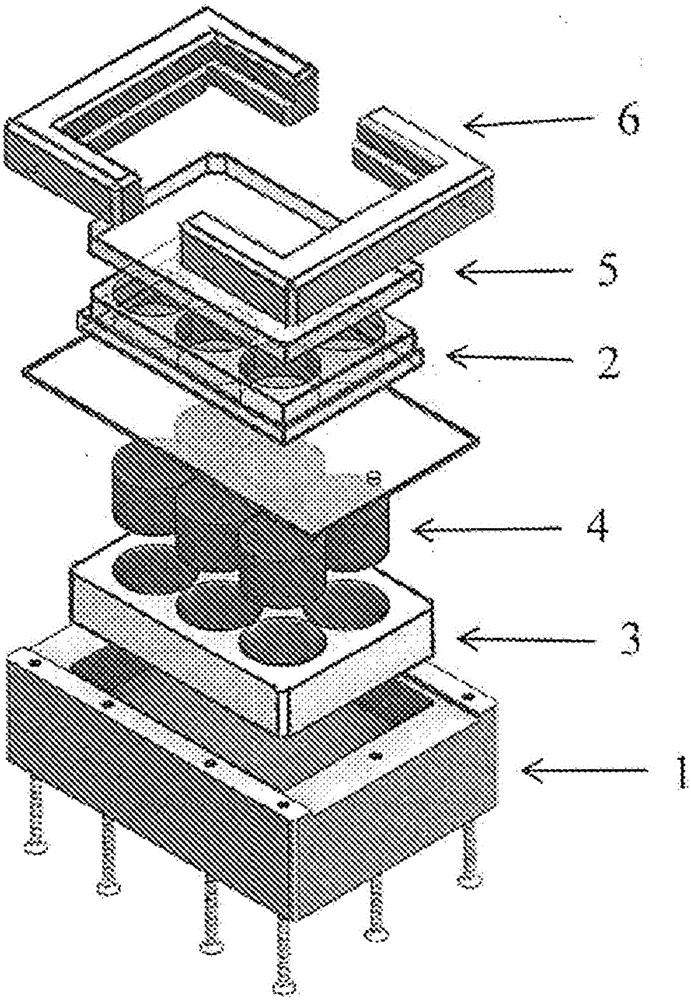
图1A-C是具有用于将人工内共生体引入宿主细胞的磁性装置的系统的示意性示图。图1A是系统的鸟瞰图,而图1B是系统的分解图。图1C示出了用于容纳磁性装置的可替换的插入物,使系统适应于可替换形式的平板。
图2示出了本发明的磁性装置。
图3示出了注射了含有gfp+AMB-1的MDA-MB-231细胞的荷瘤小鼠的MRI图像。
具体实施方式
本发明披露了用于制备具有人工内共生体的宿主细胞的系统。
定义
如本文所使用的,术语“人工内共生体”是指通过人为干预被引入或已被引入宿主细胞的单细胞生物,并且通过至少五次细胞分裂已被转移或可被转移到宿主细胞的子(代)细胞。在一个实施例中,人工内共生体可通过至少三次或四次细胞分裂被转移。在一个实施例中,人工内共生体可以通过至少一次或两次细胞分裂被转移。人工内共生体给予宿主细胞希望的表型,所述表型通过至少一次、两次、三次、四次或五次细胞分裂在宿主细胞的子(代)细胞中保留。单细胞生物可以将一种或多种多肽、一种或多种核酸、一种或多种脂质、一种或多种碳水化合物、一种或多种氨基酸或一种或多种其它因子分泌到宿主细胞和/或从宿主细胞转运这些物质。单细胞生物和宿主细胞之间的这种通讯可导致针对宿主细胞的希望的表型。
如本文所使用的,术语“细胞生命周期”是指涉及真核细胞的生长、复制和分裂的系列事件。它被分成五个阶段,即其中细胞是静止的G0期、其中细胞在尺寸上增大的G1和G2期、其中细胞复制其DNA的S期、以及其中细胞经历有丝分裂和分裂的M期。
如本文所使用的,术语“子(代)细胞”是指通过细胞的分裂形成的细胞。
如本文所使用的,术语“必需分子”是指细胞生长或存活所需的分子。
如本文所使用的,术语“荧光蛋白”是指吸收一种波长的光子并且发射另一波长的光子的蛋白质。
如本文所使用的,术语“基因修饰”是指改变细胞的DNA以便改变细胞的可观察到的或可测量的特性或特征。
如本文所使用的,术语“宿主细胞”是指其中可驻留人工内共生体的真核细胞。
如本文所使用的,术语“细胞内内共生体”是指在真核生物的细胞内度过其至少一部分的自然生命周期的单细胞生物体。
如本文所使用的,术语“细胞内病原体”是指自然感染宿主生物体而导致宿主生物体被感染疾病的细菌,并且在感染期间一些细菌进入宿主细胞,细菌在宿主细胞中生长和繁殖。
如本文所使用的,术语“荧光素酶”是指从化学事件例如化学发光或生物发光发射光子的蛋白质。
如本文所使用的,术语“磁体/磁铁”或“磁性装置”表示产生磁场的组成或装置。磁体/磁铁或磁性装置可以是永磁体或电磁体。
如本文所使用的,术语“磁小体”是指由套或膜封闭的磁铁矿(即,Fe3O4)或硫复铁矿(Fe3S4)的颗粒,或者为单独的颗粒、或者呈颗粒链、或者呈颗粒的其它排列方式。
如本文所使用的,术语“趋磁细菌”或“MTB”是指利用磁场来定向其漂浮模式的细菌类别。
如本文所使用的,术语“磁性细菌”是指能够响应外部磁场的细菌。
如本文所使用的,术语“哺乳动物”是指温血的脊椎动物,所有这些动物均有毛发并哺乳它们的幼子。
如本文所使用的,术语“表型”是指由于个体的基因型与环境的相互作用而引起的个体的可观察的特征集。
如本文所使用的,术语“报道子”是指赋予宿主细胞容易被测得的表型的多肽或分子。“光学报道子”是指可以光学测量的多肽或分子。
如本文所使用的,术语“分泌”是指分子或信号从膜的一侧移动到另一侧。
如本文所使用的,术语“选择剂”是指在没有可选标记的情况下,对人工内共生体和/或宿主细胞是致死的或抑制的分子、多肽或一组培养条件。
如本文所使用的,术语“可选标记”是基因,当被引入细胞时赋予适合选择的特性。
除非提供了明确的定义,本文使用的所有其它技术和科学术语具有和本领域技术人员的通常理解相同的含义。
单数术语“一个/种(a)”、“一个/种(an)”和“所述/该(the)”包括复数的所指物,除非上下文中另外明确指出。类似地,单词“或(or)”旨在包括“和(and)”(并且反之亦然),除非上下文另外明确指出。关于物质的浓度或水平所给出的数值限度旨在为近似值。因此,当浓度表示为至少(例如)10μg时,意图将该浓度理解为至少近似或大约10μg。
人工内共生体
本发明的人工内共生体包括能够在真核细胞中存活的细菌。在一个实施例中,人工内共生体向宿主细胞引入表型。在一个实施例中,由人工内共生体引入的该表型在子细胞中被保留。在一个实施例中,宿主细胞保留表型达至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20天。在一个实施例中,人工内共生体可在宿主子细胞中稳定地保持表型经过至少1次细胞分裂、或至少2次细胞分裂、或至少3次细胞分裂、或至少4次分裂、或至少5次分裂、或至少6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次细胞分裂。在另一个实施例中,人工内共生体可在子细胞中稳定地保持表型经过3-5次分裂、或5-10次分裂、或10-15次分裂、或15-20次分裂。
在本发明的一个实施例中,人工内共生体是变形菌。在本发明的一个实施例中,人工内共生体是α-变形菌。在当前基于16S rRNA的分类体系中,α-变形菌被认为是变形菌门内的一个纲,并且被细分为7个主要的亚群或目(柄杆菌目(Caulobacterales),根瘤菌目(Rhizobiales),红细菌目(Rhodobacterales),红螺菌目(Rhodospirillales),立克次体目(Rickettsiales),鞘脂单胞菌目(Sphingomonadales)和短小盒菌目(Parvularculales)(Gupta,R.S.,Phylogenomics and signature proteins for the alpha Proteobacteria and its main groups,BMC Microbiology,7:106(2007),(该篇文献出于所有目的以其全文形式在此被援引加入本文))。
涵盖α-变形菌内的所有主要群的大量的α-变形菌基因组已经被测序,提供了可用来鉴定具有α-变形菌内的不同更高等分类群(例如科、目等)的区别特征的独特的基因或蛋白组的信息。(Id.)。
α-变形菌的一个示例是趋磁细菌(MTB)。MTB是属于变形菌门和硝化螺旋菌门的不同亚群的多样化的细菌种群,并且大部分表现在α-变形菌中。MTB具有革兰氏阴性细胞壁结构(内膜、周质和外膜)。它们栖息于具有垂直化学浓度梯度的水体或沉淀物,主要发现于好氧/缺氧界面处,并因此被分类为微需氧菌、厌氧菌、兼性需氧菌或这三者的某一组合。所有MTB都是化能有机异养型的,尽管一些海洋菌株也可以化能自养地生长(Bazylinski等人,2004;Williams等人,2006)。所有的MTB包含磁小体,其是细胞内结构,包括被磷脂双层膜包封的磁铁晶体(Gorby等人,1988)。
自从1975年Blakemore首次发现MTB,大量MTB种类已为本领域普通技术人员所知(Blakemore,R.,Magnetotactic bacteria,Science 24:377-379(1975);(这篇文献出于所有目的以其全文形式在此被援引加入本文))并且代表了一群微生物(Faivre,D.&Schüler,D.,Magnetotactic bacteria and magnetosomes,Chemistry Reviews 108:4875-4898(2008);(这篇文献出于所有目的以其全文形式在此被援引加入本文))。已经在变形菌门和硝化螺旋菌门的不同亚群中鉴定出MTB,其中大多数种系型分组在α-变形菌中。目前,被16S rRNA序列相似性指定为α-变形菌的可培养的MTB菌株包括由Blakemore在1975年最初分离出的菌株,向磁磁螺菌(Magnetospirillum magnetotactium)(先前被称为向磁水生螺菌(Aquasprillium magnetotactium))、格瑞菲斯瓦尔德磁螺菌(M.gryphiswaldense)、趋磁螺菌(M.magneticum)菌株AMB-1、多形磁螺菌(M.polymorphum)、磁螺菌(Magnetosprillum sp.)MSM-4和MSM-6、海洋趋磁球菌(Magnetococcus marinus)、海洋弧菌菌株MV-1和MV-2、海洋螺菌菌株MMS-1、和趋磁球菌(Magnetococcus sp.)菌株MC-1,以及其它菌株。
可用作人工内共生体的其它单细胞生物包括,例如,鱼腥藻属(Anabaena)、念珠藻属(Nostoc)、固氮生物(Diazotroph)、蓝藻细菌(Cyanobacteria)、束毛藻属(Trichodesmium)、拜叶林克氏菌属(Beijerinckia)、梭菌属(Clostridium)、绿色硫细菌、固氮菌科(Azotobacteraceae)、根瘤菌(Rhizobia)、弗兰克氏菌属(Frankia)、黄杆菌属(flavobacteria)、甲烷八叠球菌目(Methanosarcinales)、盐杆菌目(Halobacteriales)的好氧嗜盐古生菌(Archaea)、盐厌氧菌目(Halanaerobiales)的发酵厌氧菌(低G+C种类的厚壁菌门(Firmicutes))、红色需氧的盐水杆菌属(Salinibacter)(拟杆菌门(Bacteroidetes)分支)、海杆菌属(Marinobacter)、盐单胞菌属(Halomonas)、皮肤球菌属(Dermacoccus)、考克氏菌属(Kocuria)、小单孢菌属(Micromonospora)、链霉菌属(Streptomyces)、威廉西亚菌属(Williamsia)、冢村氏菌属(Tskamurella)、交替单胞菌属(Alteromonas)、科尔韦尔氏菌属(Colwellia)、冰居菌属(Glaciecola)、假交替单胞菌属(Pseudoalteromonas)、希瓦氏菌属(Shewanella)、极地杆菌属(Polaribacter)、假单胞菌属(Pseudomonas)、嗜冷杆菌(Psychrobacter)、降烟碱菌(Athrobacter)、冰冻小杆菌属(Frigoribacterium)、栖地下菌属(Subtercola)、微杆菌属(Microbacterium)、红球菌属(Rhodoccu)、芽孢杆菌属(Bacillus)、拟杆菌属(Bacteroides)、丙酸杆菌属(Propionibacterium)、梭杆菌属(Fusobacterium)、克雷伯菌属(Klebsiella)、卵磷脂酶阳性梭状芽孢杆菌(Clostridia)、韦荣球菌属(Veillonella)、梭杆菌属(Fusobacteria)、着色菌科(Chromatiaceae)、绿色硫细菌(Chlorobiceae)、红螺菌科(Rhodospirillaceae)、硫杆菌属(thiobacilli)、亚硝化单胞菌属(nitrosomonas)、硝化杆菌属(nitrobacter)、聚球菌属(Synechococcus)(如细长聚球藻(Synechococcus elongates))、产甲烷菌、产乙酸菌、硫酸盐还原剂、和乳酸菌。
许多这些单细胞生物体的基因组已经或正在被测序,包括例如:低温绿僵菌(M.frigidum)、布氏拟甲烷球菌(M.burtonii)、共生梭菌(C.symbiosum)、冷红科尔韦尔氏菌(C.psychrerythraea)、游海假交替单胞菌(P.haloplanktis)、湖渊盐红菌(Halorubrum lacusprofundi)、杀鲑弧菌(Vibrio salmonicida)、深海发光杆菌(Photobacterium profundum)、紫色希瓦氏菌(S.violacea)、冷海希瓦氏菌(S.frigidimarina)、嗜冷杆菌属(Psychrobacter sp.)273-4、深海希瓦氏菌(S.benthica)、冷单胞菌属(Psychromonas sp.)CNPT3、莫里特拉氏菌属(Moritella sp.)、嗜冷脱硫小杆菌(Desulfotalea Psychrophila)、微小杆菌属(Exiguobacterium)255-15、嗜冷黄杆菌(Flavobacterium psychrophilum)、扭曲冷弯曲菌(Psychroflexus torquis)、丝状极地杆菌(Polaribacter filamentous)、伊氏极地杆菌/海冰菌(P.irgensii)、鲑鱼肾杆菌(Renibacterium salmoninarum)、雷弗森菌(Leifsonia)相关PHSC20-c1、嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)、嗜酸热原体菌(Thermoplasma acidophilum)、嗜苦古菌(Picrophilus torridus)、头寇岱硫化叶菌(Sulfolobus tokodaii)、和亚铁原体属(Ferroplasma)acidarmanus。
很多细胞内病原体包括位于其基因组的基因组岛,基因组岛包含编码例如粘附因子的致病基因,粘附因子允许细胞内病原体贴附至靶真核细胞,并触发细胞内病原体的吞噬作用(Juhas,M.,van der Meer,J.R.,Gaillard,M.,Harding,R.M.,Hood,D.W.,Crook.D.W.,Genomic islands:tools of bacterial horizontal gene transfer and evolution,FEMS Microbiol.Rev.,33:376-393(2009);该篇文献出于所有目的以其全文形式在此被援引加入本文)。很多毒力因子利用Ⅲ型或Ⅳ型分泌系统。一些毒力因子被分泌入真核宿主细胞并在靶真核细胞内改变膜运输,一些毒力因子与涉及细胞凋亡的宿主蛋白相互作用(Dubreuil,R.和Segev,N.,Bringing host-cell takeover by pathogenic bacteria to center stage,Cell.Logis.,1:120-124(2011);上述文献出于所有目的以其全文形式在此被援引加入本文)。
在一个实施例中,人工内共生体排除已知是细胞内病原体或细胞内内共生体的单细胞生物。
修饰的人工内共生体
在一个实施例中,对α-变形菌进行修饰以增强其作为人工内共生体的功能。基因修饰人工内共生体的方法是本领域公知的。在一个实施例中,修饰可以涉及通过改变启动子或核糖体结合序列、或删除或沉默人工内共生体中的某些基因来提高或降低蛋白质类或RNA的产生。在一个实施例中,修饰涉及突变,所述突变改变人工内共生体中的多肽,使人工内共生体的希望的特性。例如,人工内共生体的希望的特性可以是营养物、因子、辅因子或依赖于宿主细胞的其它分子。在一个实施例中,希望的特性允许人工内共生体产生营养物、因子、辅因子或宿主细胞需要的其它分子。在一些实施例中,希望的特性在宿主细胞中产生表型,而在其它实施例中希望的特性不在宿主细胞中产生表型。
在一个实施例中,对人工内共生体的鞭毛蛋白进行修饰,使得鞭毛蛋白不再被表达。在一个实施例中,对单细胞生物进行修饰,使其不再合成优选由真核宿主细胞提供的必需分子。在一个实施例中,对单细胞生物进行基因修饰,使其细胞周期与真核宿主细胞的细胞周期相协调,以便单细胞生物的拷贝数可以维持在将表型传递给子细胞的足够的水平。
已经开发了分子生物学工具,用于广泛存在于AMB-1和格瑞菲斯瓦尔德磁螺菌(M.gryphiswaldense)菌株MSR-1的MTB的基因操作(回顾于Jogler,C.和Schtiler,D.的Magnetoreception and Magnetosomes in Bacteria,New York,Springer(2007),p 134-138(所述文献出于所有目的以其全文形式在此被援引加入本文))。两种其它磁螺菌属(Magnetospirillum)菌株和趋磁球菌(Magnetococcus sp.)菌株MC-1的基因组最近也已被测序。在一个实施例中,来自这些菌株或其他MTB菌株的基因,目前可培养或不可培养的、已测序的或未测序的、已知的或未知的,都可用于本发明。
在一个实施例中,用胆固醇依赖的溶细胞素(CDC)修饰本发明的人工内共生体,CDC发现于许多革兰氏阳性病原体中,例如单核细胞增生李斯特氏菌(Listeria monocytogenes)(李斯特菌素O或LLO)。在一个实施例中,LLO是重组产生的。在一个实施例中,将LLO添加至人工内共生体,以便LLO包覆人工内共生体。在一个实施例中,人工内共生体和0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0或5.0μM LLO混合。LLO的浓度范围可以在0.1-5.0μM、或0.1-1.0μM、1.0-5.0μM、或1.0-2.0μM内。在一个实施例中,人工内共生体是MTB,并且MTB被LLO包覆。在一个实施例中,人工内共生体被适合的血清白蛋白包覆,例如牛血清白蛋白或其它适合的载体蛋白。在用血清白蛋白或其它载体蛋白包覆后,LLO被包覆到人工内共生体上。在一个实施例中,血清白蛋白或其它载体蛋白来自与宿主细胞相同的物种。
在一个实施例中,人工内共生体被修饰以重组表达LLO。在一个实施例中,人工内共生体被修饰以重组表达和分泌LLO。在一个实施例中,MTB被修饰以重组表达LLO。在一个实施例中,MTB被修饰以重组表达和分泌LLO。
在一个实施例中,人工内共生体和提高宿主细胞中溶酶体的pH的试剂混合。在一个实施例中,试剂是例如巴弗洛霉素、莫能菌素、尼日利亚菌素、金刚烷胺、氯喹、甲胺或氯化铵。在一个实施例中,试剂使用的浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0或10.0μM。试剂可以在0.1-10.0μM、或0.1-1.0μM、或1.0-10.0μM、或1.0-5.0μM范围内使用。在一个实施例中,甲胺、氯化铵或其它所述试剂的使用浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0或10.0mM。所述试剂可以在0.1-10mM、0.1-1.0mM、或1.0-10.0mM、或1.0-5.0mM浓度范围内使用。
核酸
本发明的核酸可以包括表达载体,例如质粒、或病毒载体、或线性载体、或整合入染色体DNA的载体。表达载体可以包含能够使载体在一个或多个选定的宿主细胞中复制的核酸序列。所述序列对于多种细胞是公知的。来自质粒pBBR1MCS和pBBR1MCS-2(Kovach等人,1995,Gene,166:175-176;所述文献出于所有目的以其全文形式在此被援引加入本文)的复制起点适合于大多数革兰氏阴性细菌。在真核宿主细胞中,例如哺乳动物细胞,表达载体可被整合进宿主细胞染色体,在那里表达载体和宿主染色体一起复制。类似地,表达载体可被整合进原核细胞的染色体,在那里载体和染色体一起复制。
表达载体一般还包含选择基因,也被称为可选标记。对于原核和真核细胞(包括本发明的宿主细胞),可选标记在本领域是公知的。该基因编码对于在选择性培养基中生长的经转化的宿主细胞的存活或生长必需的蛋白质。未被包含选择基因的载体转化的宿主细胞不会在培养基中存活。典型的选择基因编码的蛋白质:(a)赋予对抗生素或其它毒素例如氨苄青霉素、新霉素、甲氨蝶呤或四环素的抗性,(b)补充营养缺陷型的不足,或(c)供给不能从复合培养基中获得的关键养分,例如,编码杆菌(Bacilli)的D-丙氨酸消旋酶的基因。选择方案的一个示例利用药物来阻止宿主细胞的生长。那些用异源基因成功转化的细胞产生赋予抗药性的蛋白质,并因此在筛选方案中存活。其它用于细菌或真核(包括哺乳动物)系统的可选标记在本领域是公知的。在一些实施例中,可选标记是由人工内共生体分泌的蛋白质或由被人工内共生体分泌入宿主细胞的核酸编码的蛋白质。
用于产生异源多肽的表达载体还可以包含诱导型启动子,该诱导型启动子被宿主RNA聚合酶识别并且可操作地链接至编码靶蛋白的核酸。具有适合的增强子、内含子、和其它调控序列的诱导型或组成型启动子(或调控区)在本领域是公知的。
在一些实施例中,可能希望修饰多肽。技术人员将在给定的核酸构建中确认产生变化的许多方式。所述公知的方法包括定点诱变、利用简并寡核苷酸的PCR扩增、将包含核酸的细胞暴露于诱变剂或射线、化学合成想要的寡核苷酸(例如,结合连接和/或克隆以生成大核酸)和其它公知的技术。参见例如,Giliman和Smith,1979,Gene,8:81-97;Roberts等人,1987Nature 328:731-734(所述两篇文献出于所有目的以其全文形式在此被援引加入本文)。
在一些实施例中,编码本发明的多肽的重组核酸被修饰以便为特定细胞提供优选的密码子,增强选定细胞中的核酸的翻译。
本发明的多核苷酸还包括包含与本发明的多核苷酸基本上等同的核苷酸序列的多核苷酸。根据本发明的多核苷酸可具有与本发明的多核苷酸至少约80%、更通常至少约90%、并且甚至更通常至少约95%的序列一致性。本发明还提供了包含核苷酸序列的多核苷酸的补体,所述核苷酸序列与上述编码多肽的多核苷酸具有至少约80%、更通常至少约90%、并且甚至更通常至少约95%的序列一致性。多核苷酸可以是DNA(基因组的、cDNA、扩增的、或合成的)或RNA。用于获得所述多核苷酸的方法和算法对于本领域技术人员来说是公知的,并且可以包括例如用于确定可常规地分离具有希望的序列一致性的多核苷酸的杂交条件的方法。
根据本发明编码蛋白质类似物的核酸(即,其中一个或多个氨基酸被设计为不同于野生型多肽)可以利用定点诱变或PCR扩增(其中引物具有希望的点突变)产生。对于适合的诱变技术的详细描述,参见Sambrook等人,1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,和/或Ausubel等人主编,1994,Current Protocols in Molecular Biology,Green Publishers Inc.,和Wiley and Sons,N.Y.,Chemical synthesis using methods described by Engels et al.(使用Engels等人描述的方法的化学合成),1989,Angew.Chem.Intl.Ed.,卷28,716-734页;(所有文献出于所有目的以其全文形式在此被援引加入本文),也可用于制备所述核酸。
“重组变体”是指不同于天然存在的多肽通过利用重组DNA技术产生的氨基酸插入、缺失和取代的任何多肽。通过比较具体多肽的序列和同源肽的序列并且使高度同源区域中的氨基酸序列改变的数目最小化,可以发现确定哪些氨基酸残基可以被替换、插入或缺失而不废除感兴趣的活性(例如酶活性或结合活性)的指导原则。
优选地,氨基酸“取代”是将一个氨基酸用具有相似结构和/或化学性质的另一氨基酸替换的结果,即保守的氨基酸替换。氨基酸取代可以在涉及的残基的极性、电荷、溶解度、疏水性、亲水性、和/或两亲特性相似性的基础上进行。例如,非极性(疏水性)氨基酸包括丙氨酸、亮氨酸、异亮氨酸、缬氨酸、脯氨酸、苯丙氨酸、色氨酸和甲硫氨酸;极性中性氨基酸包括甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺和谷氨酰胺;带正电荷的(碱性)氨基酸包括精氨酸、赖氨酸和组氨酸;以及带负电荷的(酸性)氨基酸包括天冬氨酸和谷氨酸。
“插入”或“缺失”通常在约1到5个氨基酸范围内。通过利用重组DNA技术在多肽分子中系统地进行氨基酸的插入、缺失或取代并测定所得到的重组变体的活性,可以实验确定允许的变异。
可替代地,在功能改变是希望的情况下,可以工程化插入、缺失或非保守性改变,以产生改变的多肽或嵌合的多肽。所述改变可以,例如,改变本发明的多肽的一种或多种生物功能或生物化学特性。例如,所述改变可以改变多肽特性,例如配体结合亲和力或降解/转换率。此外,所述改变可被选择,以便产生更适合于在选定用于表达的宿主细胞中表达、扩大等等的多肽。
可替代地,编码这些相同或相似多肽的重组变体可以通过利用遗传密码的“冗余”来合成或选择。可引入不同的密码子替换,例如产生不同限制位点的沉默变化,以优化具体原核或真核系统中进入质粒或病毒载体或表达的克隆。多核苷酸序列中的突变可以反映在多肽或添加至多肽的其他肽的结构域中,以修饰该多肽的任何部分的特性,以便改变例如配体结合亲和力或降解/转换率之类的特性。
在一种优选方法中,编码新型核酸的多核苷酸经由定点诱变而改变。该方法使用编码希望的氨基酸变体的多核苷酸序列的寡核苷酸序列,以及在改变的氨基酸两侧足够邻近的核苷酸,以便在被改变的核苷酸的任一侧形成稳定的双链体。一般而言,定点诱变的技术对于本领域技术人员来说是公知的,并且该技术在公开文献中进行了例示,例如Edelman等人,1983,DNA,2:183,(所述文献出于所有目的以其全文形式在此被援引加入本文)。一种用于在多核苷酸序列中产生位点特异性改变的通用且有效的方法由Zoller和Smith发表于Nucleic Acids Res.10:6487-6500,1982(所述文献出于所有目的以其全文形式在此被援引加入本文)。
还可以利用PCR来产生新型核酸的氨基酸序列变体。当少量的模板DNA被用作起始材料时,在序列上与模板DNA中的相应区域稍有不同的引物可以产生希望的氨基酸变体。PCR扩增产生产物DNA片段群,这些片段不同于在由引物指定的位置编码靶点的多核苷酸模板。产物DNA片段替换质粒中的相应区域,并且这给予了希望的氨基酸变体。
另外一种产生氨基酸变体的技术是盒式诱变技术,披露于Wells等人的Gene 34:315,1985(所述文献出于所有目的以其全文形式在此被援引加入本文);以及本领域公知的其它诱变技术,例如,上述Sambrook等人公布的技术和Ausubel等人的Current Protocols in Molecular Biology公布的技术(所述文献出于所有目的以其全文形式在此被援引加入本文)。
宿主细胞
本发明提供了包含人工内共生体的真核宿主细胞,其中人工内共生体赋予宿主细胞表型。在一个实施例中,该人工内共生体是可遗传的。
在一些实施例中,本发明的宿主细胞是动物细胞。在一些实施例中,宿主细胞是哺乳动物细胞,例如小鼠、大鼠、兔、仓鼠、人、猪、牛或犬。小鼠常规充当其他哺乳动物(尤其是人类)的模型(参见,例如,Hanna,J.,Wernig,M.,Markoulaki,S.,Sun,C.,Meissner,A.,Cassady,J.P.,Beard,C.,Brambrink,T.,Wu,L.,Townes,T.M.,Jaenisch,R.,Treatment of sickle cell anemia mouse model with iPS cells generated from autologous skin,Science,318:1920-1923(2007);Holtzman,D.M.,Bales,K.R.,Wu,S.,Bhat,P.,Parsadanian,M.,Fagan,A.,Chang,L.K.,Sun,Y.,Paul,S.M.,Expression of human apolipoprotein E reduces amyloid-βdeposition in a mouse model of Alzheimer's disease,J.Clin.Invest.,103(6):R15-R21(1999);Warren,R.S.,Yuan,H.,Matli,M.R.,Gillett,N.A.,Ferrara,N.,Regulation by vascular endothelial growth factor of human colon cancer tumorigenesis in a mouse model of experimental liver metastasis,J.Clin.Invest.,95:1789-1797(1995);(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。动物细胞包括,例如,成纤维细胞、上皮细胞(肾脏、乳腺、前列腺、肺)、角质形成细胞、肝细胞、脂肪细胞(adopicytes)、内皮细胞、和造血细胞。
在一些实施例中,宿主细胞是癌细胞,包括人类癌细胞。存在对于本领域普通技术人员来说公知的许多癌细胞系,包括普通的上皮肿瘤细胞系,例如Coco-2、MDA-MB231和MCF7,非上皮肿瘤细胞系,例如HT-1080和HL60,以及NCI60细胞系组(参见例如,Shoemaker,R.,The NCI60 human tumor cell line anticancer drug screen,Nature Reviews Cancer 6,813-823(2006);(所述文献出于所有目的以其全文形式在此被援引加入本文))。另外,本领域普通技术人员熟悉从原发性肿瘤获得癌细胞。癌细胞还包括,例如,实体瘤细胞类型、造血癌细胞、癌、肉瘤、白血病、淋巴瘤、神经胶质瘤,以及特异组织相关癌,如前列腺癌、乳腺癌、肺癌、结肠直肠癌、胰腺癌、黑色素瘤、胶质母细胞瘤、肝癌、以及癌细胞系的NCI60组中的癌细胞的类型。
在其它实施例中,宿主细胞是干细胞。本领域普通技术人员熟悉各种干细胞类型,包括例如,胚胎干细胞、诱导型多能干细胞、造血干细胞、神经干细胞、表皮神经嵴干细胞、乳腺干细胞、肠干细胞、间充质干细胞、嗅觉成体干细胞、睾丸细胞和祖细胞(例如,神经细胞、成血管细胞、成骨细胞、成软骨细胞、胰腺细胞、表皮细胞)。
在一个实施例中,宿主细胞是发现于包括人在内的哺乳动物的循环系统中的细胞。例如,红细胞、血小板、浆细胞、T细胞、自然杀伤细胞等等,及其前体细胞。作为一个组,这些细胞被定义为本发明的循环宿主细胞。本发明可以与这些循环细胞一起使用。在一个实施例中,宿主细胞是T细胞。在另一个实施例中,宿主细胞是B细胞。在一个实施例中,宿主细胞是嗜中性粒细胞。在一个实施例中,宿主细胞是巨核细胞。
在一个实施例中,宿主细胞是植物细胞。在一些实施例中,宿主细胞是单子叶或双子叶植物的细胞,包括但不限于,玉米、小麦、大麦、黑麦、燕麦、水稻、大豆、花生、豌豆、小扁豆和苜蓿、棉花、油菜籽、加拿大油菜(canola)、胡椒、向日葵、马铃薯、烟草、番茄、茄子、桉树、树、观赏植物、多年生草、或饲料作物。在其它实施例中,宿主细胞是藻类,包括但不限于小球藻属、衣藻属、栅藻属、等鞭金藻属(Isochrysis)、杜氏藻属(Dunaliella)、扁藻属、微拟球藻属、或无绿藻属(Prototheca)的藻类。在一些实施例中,宿主细胞是真菌细胞,包括但不限于,酵母菌属(Saccharomyces)、克鲁维酵母属、念珠菌属、毕赤酵母属、德巴利酵母属、汉逊酵母属、耶氏酵母属(Yarrowia)、接合酵母属、或裂殖酵母属的真菌。
在另一个实施例中,至少一种来自宿主细胞的基因被遗传改变。在一些实施例中,利用本领域普通技术人员所知的对靶宿主细胞类型特异性的适当的分子生物学技术,通过宿主细胞的遗传修饰,可以在人工内共生体和宿主细胞之间建立相互营养依赖(活体营养),对某一必需大分子产生宿主细胞对人工内共生体的依赖,由此建立对于活体营养的环境压力。在另一个实施例中,通过遗传改变宿主细胞以消除宿主细胞合成各种代谢物、辅因子、维生素、核苷酸、或其它必需分子的能力,可以建立人工内共生体对宿主细胞的营养依赖。在所述实施例中,必需分子可以由人工内共生体提供。在另一个实施例中,可以修饰编码酶丝氨酸羟甲基转移酶的宿主细胞基因,该酶在用于氨基酸产生的3-磷酸甘油酸生物合成途径的末端将丝氨酸转化为甘氨酸。
制备具有人工内共生体的宿主细胞的系统
本发明的系统允许将人工内共生体引入宿主细胞。在一个实施例中,本发明的系统包括人工内共生体、宿主细胞、用于将人工内共生体引入宿主细胞的装置、和用于富集具有内共生体的宿主细胞的装置。在一个实施例中,本发明的系统包括人工内共生体、宿主细胞、用于将人工内共生体引入宿主细胞的装置、和用于检测包含人工内共生体的宿主细胞的装置。
用于引入人工内共生体的装置包括用于帮助将人工内共生体引入宿主细胞的装置。用于引入的装置的示例包括用于帮助引入的磁性装置、用于帮助引入的加速装置、用于帮助引入的电场装置、用于帮助引入的注射装置、用于帮助引入的配体-受体装置、用于帮助引入的浓缩装置、用于引入的化学装置、用于引入的吞噬体逃逸装置、和用于帮助引入的膜融合装置。用于引入的一些装置可能落入这些类别中的一个以上。
在一个实施例中,本发明的磁性装置是磁铁/磁体。在一个实施例中,磁铁/磁体可以是永磁体或电磁体。在一个实施例中,一个或多个磁铁/磁体适合和容器一起使用。在一个实施例中,容器可以在微量滴定皿、(有盖)培养皿、细胞培养皿、细胞培养瓶或本领域普通技术人员所知的其它装置中。在一个实施例中,微量滴定皿具有6、24、48、96、384、1536、3456或9600个孔(或容器)。在一个实施例中,微量滴定皿包括任何商业上可获得的形式。在一个实施例中,磁性装置被设计为适合一个微量滴定板,或可被设计为适合多个微量滴定板。在本实施例中,磁性装置可以是单个磁体/磁铁或可以是多个磁体/磁铁,尺寸适用于各孔,或尺寸适合于单个平板或多个平板,或尺寸适合于平板中的一些数量的孔。在一个实施例中,磁性装置适合与试管或其它容器一起使用。在本实施例中,试管包括任何商业上可获得的管,包括微量离心管、玻璃、派热克斯玻璃(Pyrex)、塑料或其它试管。在本实施例中,磁性装置可以适合与单个管或多个管一起使用。当使用多个管时,管可以固定在支架中,并且磁性装置会被设计为与支架相兼容。在一个实施例中,容器容纳适合于应用的一定量的液体。在一个实施例中,容器容纳至少0.1ml、至少0.5ml、至少1.0ml、至少2.0ml、至少5.0ml、至少10.0ml、至少25.0ml、至少40.0ml、至少50.0ml、至少100ml、或至少1000ml、或2、3、4、5、6、7、8、9或10升、或20、30、40、50、60、70、80、90或100升、或200、300、400、500、600、700、800、900或1,000升、或2,000、3,000、4,000、5,000、6,000、7,000、8,000、9,000或10,000升、或20,000、30,000、40,000或50,000升。在本实施例中,磁性装置会被设计为与容器相匹配。在本实施例中,磁性装置是一个或多个磁体/磁铁。
在一个实施例中,磁性装置在容器中产生高磁场梯度。在一个实施例中,磁性装置跨单个容器(如微量滴定皿的单个孔)提供相似的磁场强度和在容器上的沿垂直方向移动的高梯度。在一个实施例中,磁性装置跨系统中的每个容器提供相似的磁场强度和梯度,例如,跨系统中的微量滴定皿或多孔培养板的每个孔或每个管。在一个实施例中,磁性装置跨系统中的每个板提供均匀的磁场强度。
在一个实施例中,磁性装置具有下列特性:(1)大场强度和梯度,(2)跨系统中每个单个容器的相似的场强度和梯度,和(3)跨系统的每个容器的相似的场强度和梯度。在一个实施例中,磁性装置是磁性装置的阵列。在一个实施例中,磁性装置阵列的周期性匹配容器阵列中的孔的周期性。在一个实施例中,磁性装置是NdFeB永磁体或电磁体,稍稍伸过容器的边缘。在一个实施例中,NdFeB永磁体具有层,其中至少一些层与其它层相比具有减小的区域/面积。在一个实施例中,NdFeB永磁体的顶层最大,并且每个随后的层与其上面的层相比具有减小的区域/面积。在一个实施例中,NdFeB永磁体的每一层具有和其它层相同的厚度。在一个实施例中,NdFeB永磁体的至少一些层具有不同的厚度。
在一个实施例中,磁性装置产生0.01-1Tesla的磁场强度。在一个实施例中,磁性装置产生0-100Hz的振荡磁场。在一个实施例中,磁性装置产生具有低频率(约2Hz)和小振幅的磁铁振荡(约0.5-3mm)的磁场。在一个实施例中,磁性装置产生振荡磁场,例如,利用NanoTherics Ltd.的产品产生振荡磁场。还可以例如通过改变电磁体的电流或通过机械振动永磁体来产生振荡磁场。
在一个实施例中,增大磁性细菌的密度以便增大磁性细菌向真核宿主细胞的移动。在本实施例中,磁性细菌共同和磁场相互作用,产生较高流速。如果磁性细菌紧密聚集成团,会看到该团的磁力是单个磁性细菌所经历的磁力的很多倍。
在一个实施例中,系统包括磁屏蔽材料,以保护使用者和其它设备/装置免受磁性装置的磁场的影响。所述磁屏蔽材料包括,例如,Giron磁屏蔽薄膜(Giron Magnetic Shielding film)、MagnetShield、PaperShield、以及本领域公知的和/或商业上可获得的其它材料。在一个实施例中,磁屏蔽材料被设置成使得邻近本发明的系统的设备/装置免受系统中磁性装置的磁场的影响。在一个实施例中,NdFeB永磁体是圆柱形的。在一个实施例中,NdFeB永磁体的层是圆柱形的。
在一个实施例中,用于帮助引入的加速装置是离心机或使人工内共生体加速的其它装置。在一个实施例中,磁体/磁铁或磁性装置可用于使人工内共生体加速。在本实施例中,人工内共生体可以是磁性细菌。在一个实施例中,电穿孔或磁场用于使人工内共生体加速。(Potrykus,I.,Gene transfer methods for plants and cell cultures,Ciba Found Symp 154,198-208;discussion 208-112(1990);Wolbank,S等人,Labeling of human adipose-derived stem cells for non-invasive in vivo cell tracking,Cell Tissue Bank8,163-177(2007);(这两篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。在一个实施例中,可以通过用加速的分子或细菌而无需载体颗粒轰击细胞或组织来实现细胞内传递。(Lian,W.N.,Chang,C.H.,Chen,Y.-J.,Dao,R.-O.,Luo,Y.-C.,Chien,J.-Y.,Hsieh,S.-L.,Lin,C.-H.,Intracellular delivery can be achieved by bombarding cells or tissues with accelerated molecules or bacteria without the need for carrier particles,Experimental Cell Research,313(1):53-64(2007);Heng,B.C.和Cao,T.,Immunoliposome-mediated delivery of neomycin phosphotransferase for the lineage-specific selection of differentiated/committed stem cell progenies:Potential advantages over transfection with marker genes,fluorescence-activated and magnetic affinity cell-sorting,Med.Hypotheses,65(2):334-336(2005);Potrykus(1990)Ciba Found Symp,卷1,54:198;(这两篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,电穿孔被用作电场装置以帮助人工内共生体的引入(Potrykus,I.,Gene transfer methods for plants and cell cultures,Ciba Found Symp154,198-208;discussion 208-112(1990);Wolbank,S.等人,Labeling of human adipose-derived stem cells for non-invasive in vivo cell tracking,Cell Tissue Bank 8,163-177(2007);(这两篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,注射装置用于帮助将人工内共生体引入宿主细胞。在一个实施例中,注射装置是微量注射器。各种微量注射器、微量注射器系统和微量注射技术对于本领域技术人员来说是公知的。微量注射是可用的最有效的转移技术(基本上100%)(Id.;Xi,Z.和Dobson,S.,Characterization of Wolbachia transfection efficiency by using microinjection of embryonic cytoplasm and embryo homogenate,Appl.Environ.Microbiol.,71(6):3199-3204(2005);Goetz,M.,Bubert,A.,Wang,G.,Chico-Calero,I.,Vazquez-Boland,J.A.,Beck,M.,Slaghuis,J.,Szalay,A.A.,Goebel,W.,Microinjection and growth of bacteria in the cytosol of mammalian host cells,Proc.Natl.Acad.Sci.USA,98:12221-12226(2001);Microinjection and Organelle Transplantation Techniques:methods and applications,J.E.Celis,A.Graessmann和A.Loyter主编,Academic Press(1986);(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,配体-受体装置用于帮助将人工内共生体引入宿主细胞。一些内共生体、病原体或寄生虫具有它们自身进入细胞的方法,而这些自然过程可以被利用,用于人工内共生体的内化,导致所谓共生体的产生。这些自然过程可能涉及细菌在其细胞表面表达的宿主细胞受体和配体。在一个实施例中,人工内共生体被修饰成在细胞表面重组表达配体,并且修饰的人工内共生体通过该途径进入宿主细胞。所述内共生体或寄生虫配体的示例包括来自单核细胞增生李斯特菌(Listeria monocytogenes)的InlA和InlB以及来自鼠疫耶尔森菌(Yersinia pestis)的Pla(Mengaud,J.,Ohayon,H.,Gounon,P.,Mege,R.M.,Cossart,P.,E-cadherin is the receptor for internalin,a surface protein required for entry of L.monocytogenes into epithelial cells,Cell 1996,84:923-32;Braun,L.,Ghebrehiwet,B.,Cossart,P.,gClq-R/p32,a Clq-binding protein,is a receptor for the InlB invasion protein of Listeria monocytogenes,EMBO J 2000;19:1458-66;Shen,Y.,Naujokas,M.,Park,M.,Ireton,K.,InIB-dependent internalization of Listeria is mediated by the Met receptor tyrosine kinase,Cell 2000,103:501-10;Lahteenmaki,K.,Kukkonen,M.,Korhonen,T.K.,The Pla surface protease/adhesin of Yersinia pestis mediates bacterial invasion into human endothelial cells,FEBS letters 2001,504:69-72;Cowan,C.,Jones,H.A.,Kaya,Y.H.,Perry,R.D.,Straley,S.C.,Invasion of epithelial cells by Yersinia pestis:evidence for a Y.pestis-specific invasin.,Infection and Immunity 2000,68:4523-30;Advances in Molecular and Cellular Microbiology,Richard J.Lamont主编,2004,Intracellular Niches of Microbes:A Pathogens Guide Through the Host Cell,Ulrich Schaible和Albert Haas主编,2009,Wiley-VCH,Weinheim,712页;(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。其它本领域公知的侵袭蛋白和基因也可以用于本发明,以促进将人工内共生体引入宿主细胞。例如,李斯特菌溶解素O(Listeriolysin O,LLO)可被工程化入人工内共生体,以促进人工内共生体从宿主细胞吞噬小体的释放。在一个实施例中,李斯特菌溶解素O(Listeriolysin O,LLO)起源于单核细胞增生李斯特菌(Listeria monocytogenes),或其它本领域公知的具有相似的溶解素蛋白类的病原体。
细胞内细菌已演化了机制以在宿主细胞中存活和复制。细胞内细菌可以通过吞噬作用进入宿主细胞,并且初生的吞噬小体被导入内吞途径。携带非病原体的吞噬小体会遵循与溶酶体区室融合的途径,导致细菌降解。病原体已形成了不同的策略以避免这种命运。包括志贺氏菌(Shigella)、李斯特菌(Listeria)和弗朗西斯氏菌(Francisella)在内的一些病原菌从吞噬小体逃脱进入宿主细胞的胞液。尽管这些病原体避免了内吞途径和驻留在营养缺乏的空泡区室中的挑战,多数表征的细胞内病原体留在膜结合区室内,并且修饰该生态位以利于它们的存活和复制。这些因子可以在人工内共生体中表达,以帮助人工内共生体的存活。
从吞噬小体逃脱是细菌驱动的过程,并且病原体共享用于逃脱的共同机制,这些机制由吞噬小体内的特异性环境提示触发。细胞溶质病原体依赖于分泌的酶的产生,以便从吞噬小体逃脱并到达胞液/细胞溶质。这些分泌的酶包括李斯特菌溶解素O(Listeriolysin O,LLO)、磷脂酰肌醇特异性磷脂酶C(phosphatidylinositol specific phospholipase C,PI-PLC)、单核细胞增生李斯特菌的磷脂酰胆碱特异性磷脂酶C(phosphatidylcholine-specific phospholipase C,PC-PLC)、弗氏志贺菌(Shigella flexneri)的Ⅲ型分泌系统效应物IpaB(溶血素)的分泌、类鼻疽伯克氏菌(Burkholderia pseudomallei)的未知功能BPSS1539的蛋白的分泌、普氏立克次体(Rickettsia prowazekii)的溶血素C和磷脂酶的分泌、土拉弗朗西斯菌(Francisella tularensis)的IglC、MglA和FTT1103。
宿主细胞侵入的细菌分泌的其它细菌因子是侵袭素(多数是酶)。侵袭素利于细菌的复制和传播,并且在直接邻近细菌的局部起作用。侵袭素的示例包括透明质酸酶(链球菌Streptococci,葡萄球菌Staphylocci)、胶原酶(梭菌Clostridium)、神经氨酸酶(弧菌Vibrio和志贺氏菌Shigella)、凝固酶(葡萄球菌Staphlylococcus)、杀白细胞素(葡萄球菌Staphylococcus)、链球菌溶血素(链球菌Streptococcus)、溶血素(梭菌Clostridia)、卵磷脂酶(梭菌Clostridia)、磷脂酶(梭菌Clostridia)、炭疽EF(炭疽杆菌Bacillus anthracis)、百日咳ASC(百日咳博德特氏杆菌Bordetella pertussis)、和内化素(单核细胞增生李斯特菌L.monocytogenes的InlA、InlB)。
在一个实施例中,修饰的人工内共生体在其表面表达配体,该配体和宿主细胞受体相互作用,允许修饰的人工内共生体内化。所述配体的示例是来自单核细胞增生李斯特菌(Listeria monocytogenes)的InlA和InlB以及来自鼠疫耶尔森菌(Yersinia pestis)的Pla。
在一个实施例中,浓缩装置使宿主细胞附近的人工内共生体的局部浓度增加。在一个实施例中,浓缩装置还使宿主细胞的局部浓度增加。用于增加局部浓度的装置的示例包括过滤器、膜、真空泵、其它干燥装置、柱、离心机和磁体/磁铁。在一个实施例中,随着流体通过过滤器或膜,包含宿主细胞和人工内共生体的体积减少,其中过滤器或膜留住宿主细胞和人工内共生体但允许流体通过。在一个实施例中,通过使用真空装置和/或干燥装置进行蒸发,包含宿主细胞和人工内共生体的体积减少。
在一个实施例中,膜融合装置用于帮助将人工内共生体引入宿主细胞。在一个实施例中,人工内共生体通过脂质体介导的过程被引入宿主细胞。当被包裹入脂质体时,线粒体和叶绿体已被有效地引入真核细胞(Bonnett,H.T.Planta 131,229(1976);Giles,K.;Vaughan,V.;Ranch,J.;Emery,J.,Liposome-mediated uptake of chloroplasts by plant protoplasts,In Vitro Cellular&Developmental Biology-Plant,16(7)581-584;(这两篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。许多脂质体融合方案和媒介/试剂是可用的并且可被本领域技术人员使用而无需过度的实验(参见,例如,Ben-Haim,N.,Broz,P.,Marsch,S.,Meier,W.,Hunziker,P.,Cell-specific integration of artificial organelles based on functionalized polymer vesicles,Nano Lett.,8(5):1368-1373(2008);所述文献出于所有目的以其全文形式在此被援引加入本文)。细胞内传递可以通过用加速的分子或细菌轰击细胞或组织来实现而无需载体颗粒(Lian,W.,Chang,C.,Chen,Y.,Dao,R.,Luo,Y.,Chien,J.,Hsieh,S.,Lin,C.,Experimental Cell Research,313(1):53-64(2007);Heng,B.C.&Cao,T.,Immunoliposome-mediated delivery of neomycin phosphotransferase for the lineage-specific selection of differentiated/committed stem cell progenies:Potential advantages over transfection with marker genes,fluorescence-activated and magnetic affinity cell-sorting,Med.Hypotheses,65(2):334-336(2005);Potrykus(1990)Ciba Found Symp,卷1,54:198;(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。此外,脂质体摄取可以通过操纵孵化环境、改变脂质体电荷、受体介导以及磁性增强来强化(参见,例如,Pan等人,Int.J.Pharm.,358:263(2008);Sarbolouki,M.N.&Toliat,T.,Storage stability ofstabilized MLV and REV liposomes containing sodium methotrexate(aqueous&lyophilized),J.Pharm.Sci.Techno.,52(10):23-27(1998);Elorza,B.,Elorza,M.A.,Sainz,M.C.,Chantres,J.R.,Comparison of particle size and encapsulation parameters of three liposomal preparations,J.Microencapsul.10(2):237-248(1993);Mykhaylyk,O.,Sánchez-Antequera,Y.,Vlaskou,D.,Hammerschmid,E.,Anton,M,,Zelphati,O.and Plank,C.,Liposomal Magnetofection,Methods Mol.Bio.,605:487-525(2010)(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。红细胞介导的转运和脂质体融合相似,并且跨越测试的所有细胞类型已经表明具有高效率和效能(Microinjection and Organelle Transplantation Techniques,Celis等人主编,Academic Press:NewYork,1986(所述文献出于所有目的以其全文形式在此被援引加入本文))。通常,通过渗透压冲击方法或电穿孔方法加载红细胞(Schoen,P.,Chonn,A.,Cullis,P.R.,Wilschut,J.,和Schuerrer,P,Gene transfer mediated by fusion protein hemagglutinin reconstituted in cationic lipid vesicles,Gene Therapy 6:823-832(1999);Li,L.H.,Hensen,M.L.,Zhao,Y.L.,Hui,S.W.,Electrofusion between heterogeneous-sized mammalian cells in a pellet:potential applications in drug delivery and hybridoma formation,Biophysical Journal,71:479-486(1996);Carruthers,A.,&Melchior,D.L.,A rapid method of reconstituting human erythrocyte sugar transport proteins,Biochem.,23:2712-2718(1984);(这三篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。可替换地,可以通过用单细胞生物体加载造血祖细胞并诱导它们分化并扩展入包含单细胞生物体的红细胞来间接加载红细胞。
在一个实施例中,自然方式用于将人工内共生体引入宿主细胞。可以通过多种本领域技术人员已知的方法将本发明的人工内共生体引入宿主细胞,所述方法包括但不限于自然吞噬作用、诱发性吞噬作用、巨胞饮、其它细胞摄取过程、等等(参见Microinjection and Organelle Transplantation Techniques,Celis等人主编,Academic Press,New York,1986以及在其中的参考文献(出于所有目的以其全文形式在此被援引加入本文))。自然的吞噬细胞已显示出摄取细菌,包括MTB(Burdette,D.L.,Seemann,J.,Orth,K.,Vibrio VopQ induces PI3-kinase independent autophagy and antagonizes phagocytosis,Molecular microbiology,73:639(2009);Wiedemann,A.,Linder,S.,Grassi,G.,Albert,M.,Autenrieth,I.,Aepfelbacher,M.,Yersinia enterocolitica invasin triggers phagocytosis viaβ1integrins,CDC42Hs and WASp in macrophages,Cellular Microbiology,3:693(2001);Hackam,D.J.,Rotstein,O.D.,Schreiber,A.,Zhang,W.,Grinstein,S.,Rho is required for the initiation of calcium signaling and phagocytosis by Fcγreceptors in macrophages,J.of Exp.Med.,186(6):955-966(1997);Matsunaga,T.,Hashimoto,K.,Nakamura,N.,Nakamura,K.,Hashimoto,S.,Phagocytosis ofbacterial magnetite by leucocytes,Applied Microbiology and Biotechnology,31(4):401-405(1989)(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,化学装置用于帮助将人工内共生体引入宿主细胞。在一个实施例中,用化学物处理宿主细胞,以使宿主细胞获取人工内共生体的能力提高。在一个实施例中,用化学物处理人工内共生体,以使人工内共生体被引入宿主细胞的能力提高。在一个实施例中,宿主细胞和人工内共生体均用化学物处理。近期研究显示,当和不同因子(介质和化学因子、生物因子(例如杆状病毒、蛋白因子、基因敲入等)共培养时,非吞噬细胞类型可被诱导以内吞细菌(参见例如,Salminen,M.,Airenne,K.J.,Rinnankoski,R.,Reimari,J.,Valilehto,O.,Rinne,J.,Suikkanen,S.,Kukkonen,S.,Yla-Herttuala,S.,Kulomaa,M.S.,Vihinen-Ranta,M.,Improvement in nuclear entry and transgene expression of baculoviruses by disintegration ofmicrotubules in human hepatocytes,J.Virol.,79(5):2720-2728(2005);Modalsli,K.R.,Mikalsen,S.,Bukholm,G.,Degre,M.,Microinjection of HEp-2cells with coxsackie B1 virus RNA enhances invasiveness of Shigella flexneri only after prestimulation with UV-inactivated virus,APMIS,101:602-606(1993);Hayward,R.D.&Koronakis,V.,Direct nucleation and bundling of actin by the SipC protein of invasive Salmonella,The EMBO Journal,18:4926-4934(1999);Yoshida,S.,Katayama,E.,Kuwae,A.,Mimuro,H.,Suzuki,T.,Sasakawa,C.,Shigella deliver an effector protein to trigger host microtubule destabilization,which promotes Rac1 activity and efficient bacterial internalization,The EMBO Journal,21:2923-2935(2002);Bigildeev等人,J.Exp Hematol.,39:187(2011);Finlay,B.B.&Falkow,S.,Common themes in microbial pathogenicity revisited,Microbiol.and Mol.Biol.Rev.,61:136-169(1997)(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,化学穿孔(chemical poration)用于帮助人工内共生体的引入。在一个实施例中,用透性化试剂处理宿主细胞膜。在一个实施例中,透性化试剂选自,例如,去垢剂(如Trtiton X-100)、洋地黄皂苷、孔形成多肽(例如链球菌溶血素O)、皂苷、和其它本领域公知的透化处理宿主细胞膜的试剂。在一个实施例中,低渗溶液被用于化学穿孔方法以诱导流体和人工内共生体流入宿主细胞。在一个实施例中,低渗条件和细胞透性化试剂结合,以帮助将人工内共生体引入宿主细胞。描述所述化学穿孔方法的参考文献包括例如,Medepalli,K.,Alphenaar,B.W.,Keynton,R.S.,Sethu,P.,A new technique for reversible permeabilization of live cells for intracellular delivery of quantum dots,Nanotechnol.,24:205101(2013);Hapala,I.,Breaking the barrier:methods for reversible permeabilization of cellular membranes,Crit.Rev.Biotechnol.,17:105-122(1997);Miyamoto,K.,Yamashita,T.,Tsukiyama,T.,Kitamura,N.,Minami,N.,Yamada,M.,Imai,H.,Reversible membrane permeabilization of mammalian cells treated with digitonin and its use for inducing nuclear reprogramming by Xenopus egg extracts,CloningStem Cells,10:535-542(2008);Johnson,J.A.,Gray,M.A.,Karliner,J.S.,Chen,C-H.,Mochly-Rosen,D.,An improved permeabilization protocol for introduction of peptides into cardiac myocytes:application to protein Kinase C research,Circ.Res.,79:1086-1099(1996);这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文。
在一个实施例中,自然方式还包括巨胞饮(macropinocytosis)或“细胞饮用”(“cell drinking”),是一种大量细菌和病毒用于细胞内进入所采用的方法(Zhang(2004)In:Molecular Imaging and Contrast Agent Database,(MICAD)[在线数据库];Bethesda(MD):National Library of Medicine(US),NCBI;2004-2011(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。存在各种方案,可用来诱导细胞摄取细菌。一些试剂/媒介,例如核酸、蛋白质、药物和细胞器,已被封装进脂质体并递送至细胞(Ben-Haim,N.,Broz,P.,Marsch,S.,Meier,W.,Hunziker,P.,Cell-specific integration of artificial organelles based on functionalized polymer vesicles,Nano Lett.,8(5):1368-1373(2008);Lian,W.,Chang,C.,Chen,Y.,Dao,R.,Luo,Y.,Chien,J,,Hsieh,S.,Lin,C.(这些公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
在一个实施例中,用于富集具有内共生体的宿主细胞的装置/方式可以是选择剂、选择性培养基、利用人工内共生体引入的表型检测和分类宿主细胞的装置(如细胞分选仪)、基于人工内共生体赋予宿主细胞的表型分离宿主细胞的色谱柱等等。在一个实施例中,选择剂可以是抗生素或者对人工内共生体或对宿主细胞有毒性的或抑制性的其它试剂。对人工内共生体有毒性的或抑制性的选择剂会杀死或抑制暴露于试剂的人工内共生体,被宿主细胞摄取的人工内共生体可以受宿主细胞的保护而免受试剂的影响。对宿主细胞有毒性的或抑制性的选择剂可以被人工内共生体(或者修饰的人工内共生体)脱毒,并因此包含人工内共生体的宿主细胞可以对选择剂有抗性。在一个实施例中,使用的选择性培养基缺少宿主细胞生长所需的且宿主细胞不能制备的营养素。在本实施例中,人工内共生体(或修饰的人工内共生体)向宿主细胞提供缺失的营养素,并因此具有人工内共生体的宿主细胞可以在选择性培养基上生长。
在一个实施例中,人工内共生体赋予宿主细胞表型,使得具有人工内共生体的宿主细胞与缺乏人工内共生体的宿主细胞分离。例如,如果人工内共生体包含荧光蛋白或荧光素酶,其可以赋予宿主细胞发光表型。利用基于发射的光检测和分类/分选的细胞分选仪,该发光表型可用于将具有人工内共生体的宿主细胞和没有人工内共生体的宿主细胞分离开。在一个替换的示例中,人工内共生体是磁性细菌,向宿主细胞赋予磁性表型。通过各种方式,该磁性表型可用于富集具有人工内共生体的宿主细胞。例如,磁场可用于减缓具有人工内共生体的宿主细胞的流动,或者磁场可用于优选地沉淀具有人工内共生体的宿主细胞,或者磁场可用于优选地截留具有人工内共生体的宿主细胞。在一个实施例中,磁性柱用于富集包含人工内共生体的宿主细胞,所述人工内共生体已向宿主细胞赋予磁性表型。
在一个实施例中,系统具有用于检测具有人工内共生体的宿主细胞的装置。在一个实施例中,用于检测的装置可以是检测由人工内共生体向宿主细胞赋予的表型的装置。人工内共生体可向宿主细胞提供新特性,例如光学特性(如光发射)或磁性特性,或者人工内共生体可以改变细胞的特性,例如,表面蛋白的表达、大小、附着能力、表面电荷、重量、密度、形状、对选择剂的抗性、代谢某种营养物的能力、等等。用于检测这些新的或改变的宿主细胞特性的装置/方式是本领域公知的,并且包括例如,可以检测发射自人工内共生体的光的光学装置,或可以检测来自人工内共生体的磁小体的磁性特性的装置,例如MRI系统、磁粒子成像(MPI)系统、磁性弛豫开关(MRS)系统、磁共振波谱仪、超导量子干涉仪(SQUID)、磁力计、核磁共振(NMR)系统和电子顺磁共振(EPR)系统,以及穆斯堡尔分光计、磁性圆二色光谱系统、荧光激活细胞分选系统(FACS)和自动细胞计数仪。
在一个实施例中,人工内共生体的检测作为质量控制(“QC“)和/或质量保证(“QA”)步骤进行,以测量引入宿主细胞的人工内共生体的效率、浓度和/或数量。在一个实施例中,人工内共生体是磁性细菌,并且测量具有磁性细菌的宿主细胞的磁性特性以量化引入宿主细胞的磁性细菌(人工内共生体)的效率、浓度和/或数量。在一个实施例中,人工内共生体将光学特性引入宿主细胞,并且QC和/或QA步骤测量光的量或其它光学特性以测量引入宿主细胞的人工内共生体的效率、浓度和/或数量。在一个实施例中,进行间接测量来量化引入宿主细胞的人工内共生体的效率、浓度和/或数量。例如,可以利用与宿主细胞内的人工内共生体反应的试剂来测量人工内共生体。或者,系统可以测量保留在培养基中的残留人工内共生体,作为对引入宿主细胞的人工内共生体的量度。在一个实施例中,试剂是对人工内共生体特异性的,例如抗体。在一个实施例中,试剂与分泌入宿主细胞的人工内共生体制备的产物相互作用。在一个实施例中,抗体是利用整个人工内共生体或人工内共生体的特异性抗原制备的多克隆或单克隆抗体。在一个实施例中,抗体识别人工内共生体表面的一个或多个抗原。在一个实施例中,抗体是识别AMB-1上的表面抗原的多克隆兔抗体(兔用整个AMB-1进行免疫)。在一个实施例中,人工内共生体是磁性细菌(可以如上文所述修饰),并且利用本领域公知的技术用多克隆兔抗体来检测真核宿主细胞中的磁性细菌(Immunocytochemical Methods and Protocols,Methods in Molecular Biology,卷115(Lorette C.Javois主编),1999年1月15日,出于所有目的以其全文形式在此被援引加入本文)。例如,在向真核宿主细胞引入磁性细菌之后,宿主细胞可以被固定和透化,允许荧光标记的抗体进入宿主细胞以标记磁性细菌(Immunocytochemical Methods and Protocols,Methods in Molecular Biology,卷115(Lorette C.Javois主编),1999年1月15日,出于所有目的以其全文形式在此被援引加入本文)。从抗体结合获得的信号的强度可随后用于测量宿主细胞中的磁性细菌。可替换的,抗体可以是未标记的,通过识别抗磁性细菌抗体的第二抗体来进行结合到磁性细菌的抗体的检测(Immunocytochemical Methods and Protocols,Methods in Molecular Biology,卷115(Lorette C.Javois主编),1999年1月15日,出于所有目的以其全文形式在此被援引加入本文)。在一个实施例中,第二抗体可以用报道子标记。
在一个实施例中,用于检测的装置测量温度,而置于交变磁场中时具有人工内共生体的宿主细胞的热响应被用于评价人工内共生体。在一个实施例中,交变磁场具有的频率在约100kHz到500kHz的范围内。人工内共生体(例如磁性细菌)吸收来自交变磁场的能量并以热能的形式消散该能量。在一个实施例中,热能的释放可被测量并用于量化宿主细胞中的人工内共生体。在一个实施例中,本发明的系统作为QA/QC步骤进行该热测量,以确保对于应用合适数量的人工内共生体驻留在宿主细胞中。
在一个实施例中,用于检测的装置测量宿主细胞的光散射。在一个实施例中,用于检测的装置测量当包含人工内共生体(例如磁性细菌)的宿主细胞经受磁场时的光散射。在本实施例中,当宿主细胞包含足够的磁性细菌时,具有磁性细菌的宿主细胞会在磁场中定向成低光散射或高光散射定向。这允许量化已接收到足够人工内共生体的宿主细胞以允许在磁场中定向。在一个实施例中,本发明的系统作为QA/QC步骤进行该光散射检测测量,以确保对于应用在宿主细胞内包含合适数量的人工内共生体。
在一个实施例中,用于检测的装置测量由人工内共生体产生的报道子(如GFP或荧光素酶)的特性(如光学特性)。在一个实施例中,来自报道子的信号被测量并用于量化宿主细胞中的人工内共生体。在一个实施例中,报道子在人工内共生体中组成性地表达。在一个实施例中,报道子通过诱导型调控区(例如那些本领域公知的调控区)表达,并且系统提供诱导条件并随后测量报道子。在一个实施例中,本发明的系统作为QA/QC步骤进行报道子的该测量,以确保对于应用合适数量的人工内共生体驻留在宿主细胞中。
在一个实施例中,QA/QC测量将获得的信号与通过已知数量的报道子制得的标准曲线进行比较。在一个实施例中,本发明的系统进行QA/QC测量,并利用来自标准曲线的信息确定是否有合适数量的人工内共生体驻留在宿主细胞中。
用于检测宿主细胞中的人工内共生体的试剂盒和方法
本发明的试剂盒包括会用于本发明的系统的可消耗的项目。试剂盒包括在使用系统时被消耗的或需要定期更换的系统的项目。用于系统的可消耗的项目包括例如,人工内共生体、宿主细胞、培养基/介质、选择剂、容器、磁性柱、组织培养处理皿、人工内共生体特异性抗体、用于检测宿主细胞中的人工内共生体的其它试剂和配件(如容器)以及诸如此类。将被定期更换的项目包括例如,用于系统的柱、用于微量注射的针以及诸如此类。
在一个实施例中,本发明的试剂盒包括用于本发明的系统的一个、两个、三个、四个或更多可消耗品。在一个实施例中,试剂盒包括人工内共生体,或具有培养基的人工内共生体,或人工内共生体、培养基/介质和选择剂。在一个实施例中,试剂盒的培养基/介质能够杀死细菌或显著破坏细菌,例如,培养基/介质可包含庆大霉素。这样只有宿主细胞内部的人工内共生体将会存活。
在一个实施例中,试剂盒包括磁性细菌、磁性细菌特异性抗体、磁体/磁铁、选择剂和报道子,或者试剂盒可以包括前述的任何组合。试剂盒还可以包含磁性柱。在一个实施例中,用报道子修饰试剂盒的磁性细菌。在一个实施例中,报道子是GFP。在一个实施例中,用荧光标记来标记试剂盒中的抗体。在一个实施例中,试剂盒包括用于检测抗磁性细菌抗体的第二抗体。在一个实施例中,选择剂包含在磁性柱中。在一个实施例中,试剂盒包括磁性细菌和磁体/磁铁。
本发明从以下实验细节将会获得更好地理解。不过,本领域技术人员会很容易理解,所讨论的具体方法和结果仅仅是对本发明的说明,而所附权利要求书作了更完整地描述。
实例
实例1:包含具有报道子的人工内共生体的宿主细胞
A.gfp+AMB的构建
用于eGFP的表达载体,一个包括gfp基因上游的SD(Shine-Dalgarno)序列,一个不包括SD序列,被克隆进隐蔽性广宿主范围载体pBBR1MCS-2中(Kovach,M.E.等人,Four new derivatives of the broad-host-range cloning vector pBBR1MCS,carrying different antibiotic-resistance cassettes,Gene,166:175-176(1995),(所述文献出于所有目的以其全文形式在此被援引加入本文))。用该构建转化AMB(ATCC 700264)(Matsunaga,T.等人,Complete genome sequence of the facultative anaerobic magnetotactic bacterium Magnetospirillum sp.strain AMB-1,DNARes.,12:157-166(2005);Burgess,J.G.等人,Evolutionary relationships among Magnetospirillum strains inferred from phylogenetic analysis of 16S rDNA sequences,J.Bacteriol.175:6689-6694(1993);Matsunaga,T.等人,Gene transfer in magnetic bacteria:transposon mutagenesis and cloning of genomic DNA fragments required for magnetosome synthesis.J.Bacteriol.,174:2748-2753(1992);Kawaguchi,R.等人,Phylogeny and 16s rRNA sequence of Magnetospirillum sp.AMB-1,an aerobic magnetic bacterium,Nucleic Acids Res.,20:1140(1992)(这四篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。
使用供体大肠杆菌通过接合作用实现转化,如披露于Goulian,M.,van der Woude,M.A.,A simple system for converting lacZ to gfp reporter fusions in diverse bacteria,Gene,372:219-226(2006);Scheffel,A.,Schüler,D.,The Acidic Repetitive Domain of the Magnetospirillum gryphiswaldense MamJ Protein Displays Hypervariability but Is Not Required for Magnetosome Chain Assembly,J.Bacteriol.,September,189(17):6437-6446(2007)(这两篇公开文献的每一篇出于所有目的以其全文形式在此被援引加入本文))。交配反应在确定的微需氧条件下在缺少DAP的情况下培养10天,以筛选阳性转化子。
接合作用之后,具有和不具有SD(Shine-Dalgarno)序列的gfp+AMB转化子成功显示GFP荧光。包含SD序列的转化子比不具有该序列的转化子显示更高水平的GFP荧光。当在100×放大率在488nm激发观察时,所得到的荧光没有离开gfp+AMB细胞。
用MRI分析gfp+AMB的磁性特性。使用1.5T仪器使gfp+AMB悬浮在琼脂塞(agar plugs)中,以优化和表征成像特性。
在带有两个皮下肿瘤的小鼠中测试细胞可视化,其中一个肿瘤在其左侧腹,一个在其右侧腹。将包含引入的gfp+AMB的1.5×106MDA-MB231细胞直接注射进小鼠左侧腹的肿瘤中。将等量的没有引入细胞的对照MDA-MB231细胞注射进小鼠的右侧腹。使用具有T2w脉冲序列的台式1T MRI对小鼠进行成像。得到的图像显示,在小鼠左侧肿瘤处有暗区,该部位注射了包含引入的gfp+AMB的MDA-MB231细胞,但在小鼠右侧的肿瘤处没有信号,其中对照MDA-MB231细胞被注射入右侧肿瘤。这些结果在图3中示出。
B.显微注射入小鼠胚胎细胞
将gfp+AMB微量注射入在二细胞期的170个小鼠胚胎中的每个胚胎的一个细胞中。每个细胞注射入在对数标尺(log scale)上可达到~105gfp+AMB的六个浓度,通过565nm的光密度估计。跨越不同的注射浓度,微量注射后的细胞死亡率是恒定的。比较了注射有最高浓度(105MTB/细胞)的细胞的叠加荧光的图像和差分干涉对比(DIC)图像。未被注射的对照组显示低水平的自发荧光。比较了在给定时间点8-细胞胚胎中不同水平面的切片。在每个胚胎中,源自被注射的细胞的所有四个细胞均显示明显的荧光,而源自未被注射的内部对照的四个细胞均没有显示显著的荧光。
注射后允许胚胎发育三天。在每个浓度水平,胚胎存活达到整三天,发育到256个细胞囊胚期,并且看起来对移植来说足够健康。每个囊胚中的大量细胞显示显著的荧光,证明随着包括真核宿主细胞的胚胎发育到囊胚期,人工内共生体跨越多次细胞分裂被转移到子(代)细胞。图2示出了一个所述的囊胚,其中小图A示出了囊胚的差分干涉对比(DIC)图像,而小图B示出了同一图像的灰度荧光捕获,显示遍及囊胚的大量细胞中的荧光。
通过测量起始自胚胎的八细胞期的随时间变化的不同点的整个胚胎中的总GFP荧光,共聚焦显微镜被用来量化遍及四个单个胚胎的GFP的总表达。图3示出了随时间变化的胚胎荧光的变化。这表明人工内共生体的拷贝数在子细胞中维持至少七代,因而随着胚胎从2-细胞期发育至256-细胞囊胚期,宿主细胞的荧光表型得以保持。
这些结果证明,当通过微量注射递送时,在三天的实验过程中,gfp+AMB没有被立即清除或降解,并且对发育胚胎没有毒性。微量注射的胚胎正常分裂,表明gfp+AMB没有显示致病标记或分泌毒性化合物。它们跨越许多次细胞分裂被转移到子(代)细胞中,被包含在细胞质中,是点状的并且很好地分布,并且在子代宿主细胞中保持拷贝数,使得真核宿主细胞的荧光表型在子细胞中保持经历至少七代。这些结果证明AMB可以在细胞内稳定保持,并且在超过至少七次细胞分裂中被转移到子细胞中。
实例2:用于制备具有人工内共生体的宿主细胞的磁系统
在本实施例中,磁系统用于制备包含磁性细菌的宿主细胞。系统包括修饰的人工内共生体、宿主细胞、NdFeB N52级磁体、组织培养皿、具有和不具有选择剂的宿主细胞培养基、具有选择剂的磁性柱、和FACS分选仪。
通过使人工内共生体Magnetospirillum magneticum AMB-1(700264TM)和包含具有卡那霉素抗性并在表达盒中携带eGFP的可转移性质粒的大肠杆菌菌株BW29437交配,来修饰该人工内共生体。分离出卡那霉素阳性的M.magneticum AMB-1菌落,并且通过荧光显微镜验证GFP表达。
通过将gfp+AMB-1放入0.6μM LLO溶液中,用李斯特菌溶解素O蛋白(LLO)处理gfp+AMB-1。gfp+AMB-1在LLO溶液中室温孵育达10-30分钟,并然后用PBS洗涤gfp+AMB-1细胞。
宿主细胞是乳腺癌细胞系MDA-MB231。6孔组织培养皿和NdFeB N52级磁铁用于帮助将用LLO包覆的修饰的M.magneticum gfp+AMB-1引入MDA-MB231宿主细胞。培养基是补充有10%胎牛血清的DMEM。培养基还可以包含庆大霉素或链霉素作为选择剂。包含庆大霉素或链霉素或用庆大霉素或链霉素孵育的磁性柱(Miltenyi Biotec)用于系统中,以便将具有用LLO包覆的修饰的gfp+M.magneticum AMB-1的MDA-MB231宿主细胞和不具有人工内共生体的MDA-MB231宿主细胞分离。荧光激活细胞分选仪(FACS)用于确定人工内共生体在MDA-MB231宿主细胞中的存在,并且将具有荧光人工内共生体的MDA-MB231宿主细胞与缺少荧光人工内共生体的宿主细胞分离。
MDA-MB231宿主细胞在6孔组织培养皿中生长至40-70%汇合度,并且用在补充有10%胎牛血清的1mlDMEM培养基中再悬浮的包覆有LLO的1.5×1010gfp+M.magneticum AMB-1覆盖。然后将该皿安装在NdFeB N52级磁铁上。细胞在磁铁上孵育达3小时。该孵育后,细胞被置于具有庆大霉素或链霉素的培养基中。随后48小时孵育以除去未结合的细菌,宿主细胞受胰蛋白酶作用并通过磁性柱。在移去磁铁后通过用生长培养基洗脱,将具有人工内共生体的宿主细胞从磁性柱中分离。使分离的宿主细胞通过FACS分选仪。FACS分选仪富集包含荧光人工内共生体的MDA-MB231宿主细胞。
这些分离的具有人工内共生体的宿主细胞可用于任何数目的下游应用。
实例3:用于制备具有人工内共生体的宿主细胞的加速系统
在本实施例中,加速系统用于制备包含磁性细菌的宿主细胞。系统包括修饰的人工内共生体、宿主细胞、离心机、组织培养皿、具有和不具有选择剂的宿主细胞培养基、磁性柱、和FACS分选仪。
通过使人工内共生体Magnetospirillum magneticum AMB-1(700264TM)和包含具有卡那霉素抗性并在表达盒中携带eGFP的可转移性质粒的大肠杆菌菌株BW29347交配来修饰该人工内共生体。分离出卡那霉素阳性的gfp+M.magneticum AMB-1菌落,并且通过荧光显微镜验证GFP表达。
宿主细胞是MDA-MB231细胞。6孔组织培养皿和Sorvall Legend RT或相似的台式离心机用于帮助将gfp+M.magneticum AMB-1引入MDA-MB231宿主细胞。培养基是补充有10%胎牛血清的DMEM。培养基还可以包含庆大霉素或链霉素作为选择剂。磁性柱(Miltenyi Biotec)用于系统中,以便将具有gfp+M.magneticum AMB-1的MDA-MB231宿主细胞和不具有人工内共生体的MDA-MB231宿主细胞分离。FACS分选仪用于确定人工内共生体在MDA-MB231宿主细胞中的存在,并且将具有荧光人工内共生体的MDA-MB231宿主细胞和缺少荧光人工内共生体的宿主细胞分离。
MDA-MB231宿主细胞在6孔组织培养皿中生长至40-70%汇合度,并且用在补充有10%胎牛血清的1ml DMEM培养基中再悬浮的1.5×1010gfp+M.magneticum AMB-1覆盖。该皿随后被安装在Sorvall Legend RT离心机上。细胞在离心机中以2000rpm旋转达10分钟,并然后孵育达3小时。该孵育后,将细胞置于具有庆大霉素或链霉素的培养基中,并且在孵育48小时后通过磁性柱。在移去磁铁后通过用生长培养基洗脱,将具有人工内共生体的宿主细胞从磁性柱分离。分离的宿主细胞随后通过FACS分选仪。FACS分选富集包含荧光人工内共生体的MDA-MB231宿主细胞。
这些分离的具有人工内共生体的宿主细胞可用于任何数目的下游应用。
实例4:用于制备具有人工内共生体的宿主细胞的多孔磁系统
图1A示出了利用磁性装置将人工内共生体引入宿主细胞的系统。系统包括大底座(1),具有多孔容器(2),用于容纳真核宿主细胞和人工内共生体(例如磁性细菌)。
图1B示出了系统的分解图,具有大底座(1)、具有多个容器(或孔)的板(2)、用于容纳磁性装置(4)的可替换的插入物(3)、多孔板的顶部(5)、和用于定向多孔板的缓冲器/减震器(bumper)(6)。
图1C示出了用于12孔板的容纳12个磁性装置(而非6个)的可替换形式的插入物(7)。
图2示出了磁性装置,它是NdFeB永磁体,由三层制成,其中顶层最大,并且随后的每层具有比前一层更小的面积/区域。NdFeB永磁体的顶层的直径比用于磁性装置的容器的直径更大。磁性装置的设计产生的磁场强度跨多孔板的单独孔是相似的。在本实施例中,可替换的插入物可以制成与磁性装置紧密配合(即,每个腔具有匹配磁性装置的层的台阶)。在一个实施例中,磁性装置被固定至可替换的插入物中的腔。在一个实施例中,磁性装置通过粘合剂固定至腔。
当系统用于引入人工内共生体时,可采用以下步骤。宿主细胞被引入6孔板的孔中。宿主细胞粘附至孔的表面和/或悬浮在培养基中。在引入人工内共生体例如MTB之前,宿主细胞可以经受生长期。人工内共生体(MTB)被添加至包含宿主细胞的孔,并且6孔板被置于图1A的系统中。宿主细胞和MTB一起在磁性装置上孵育1-16小时,并且然后将板从系统中移除。通过洗涤宿主细胞,除去没有进入宿主细胞的MTB。可选地,通过使具有和不具有MTB的宿主细胞在磁性柱上通过,将具有MTB的宿主细胞与不具有MTB的宿主细胞(或不具有足量的MTB以产生希望的表型)分离,其中具有MTB的宿主细胞更为缓慢地通过柱,因为引入的MTB与磁性柱相互作用而阻碍其所驻留的细胞的流动。具有MTB的宿主细胞被分离,并然后可用于任何数目的下游应用。
本文讨论和引用的所有公开文献、专利以及专利申请均以其全文形式在此被援引加入本文。应当理解,所披露的发明并不局限于所述的具体的方法、方案和材料,因为这些可以改变。还应当理解,本文使用的术语仅是为了描述具体实施例的目的,并不旨在限制本发明的范围,本发明的范围仅由所附权利要求书进行限制。
本领域技术人员利用至多常规实验会认识到或能够确定本文所述的本发明的具体实施例的许多等同情况。所述等同情况旨在由所附权利要求书涵盖。
- 还没有人留言评论。精彩留言会获得点赞!