新型药剂及其用途的制作方法
本发明涉及新型化合物TMZ-CD154和治疗疾病的方法,所述方法中使用了所述新型分子TMZ-CD154。特别地,TMZ-CD154用于调节具有免疫相关疾病如癌症和感染性疾病之患者的免疫应答。本发明还涉及用所述TMZ-CD154在体外活化细胞的方法,之后出于治疗目的或者出于诊断目的使用所述活化的细胞。
背景技术:
在过去的几十年中,基因转移技术在例如癌症的治疗中已得到广泛的研究。在2012年,Glybera成为了第一个获得临床使用批准的基因疗法治疗。Glybera通过递送并入腺相关病毒血清型1(adeno-associated virus serotype 1,AAV1)病毒载体的人脂蛋白脂肪酶(lipoprotein lipase,LPL)基因的完整拷贝弥补了脂蛋白脂肪酶的缺陷。
基因疗法的目的是将功能性/治疗性基因引入靶细胞,如肿瘤细胞中。
WO 2012/038607描述了在细胞中产生CD40L并在对象中提高肿瘤特异性免疫应答和凋亡的方法。CD40L(也称为CD40配体、CD154或gp39)是属于肿瘤坏死因子家族的II型跨膜蛋白。
WO 02/36769描述了CD40L-CD40嵌合体。相对于本发明的核苷酸序列,该嵌合体含有另一蛋白质的胞内信号传导区,而本发明缺少胞内信号传导能力。
Blaser等(Clin.Immunology 2005,117,231-237)和Hsu等(Journal of Biological Chemistry,1997,272,911-915)描述了天然存在的CD40L,在Blaser等的情况下,其证明了突变导致功能失调的蛋白质。Hsu等描述,天然CD40L可被切割以释放胞外结构域。然而,被释放的CD40L作为三聚体不稳定。
WO 94/10308和WO 2007/120368提及可溶性多聚体CD40L分子,其不保留于质膜中,而是从细胞释放或用作重组产生的分子以用于患者的全身性用途。这些可溶性分子与本发明的TMZ-CD154的比较表明,TMZ-CD154发出更强的活化信号,这有可能是因为其保留在质膜中。
CD154为跨膜分子,其在与CD40受体结合后可三聚化。结合导致CD154阳性和CD40阳性细胞的相互刺激。CD154也可被切割并分泌,但之后以可溶性CD154(sCD154)单体起作用。结合膜的或sCD154活化树突状细胞(dendritic cell,DC)以成为有效的抗原呈递细胞,并与效应细胞(如T细胞和自然杀伤(natural killer,NK)细胞)活化所谓的Th1型免疫应答。所述Th1型免疫应答在肿瘤免疫中发挥关键的作用并且因此是活性肿瘤免疫疗法的关键。CD154可通过尚未完全确立的方式在CD40阳性肿瘤细胞中诱导凋亡。然而,一些报道声称,这是由于TRAF3-JNK通路依赖性的胱天蛋白酶9(caspase-9)活化,而其他研究涉及死亡配体的自体分泌或旁分泌产生,其可诱导胱天蛋白酶8(caspase-8)活化(Loskog和Eliopoulos,Semin Immunol 2009)。CD40在其尾端不具有死亡结构域,这为多种解释留出了空间。如果CD154为膜结合的,则凋亡诱导已经表现得更加有效,这可能是因为该受体/配体系统在结合后的三聚化。在招募了癌症患者的临床试验中CD154已被用作可溶性分子,但全身性暴露可导致提高的肝脏酶,其在肿瘤转移中将CD154局部递送(例如通过使用腺病毒血清型5基因转移)时尚未被发现(Vonderheide JCO,2001;等CCR 2010)。全长CD154也已被用于溶瘤病毒(Fernandes等CCR 2009;Gomes等CCR 2009;Terada等GT 2006;Diaconu等CR 2012)并在患者中测试安全性(Pesonen等CR 2012)。通过遗传工程在T细胞中表达的CD154分子可产生淋巴增殖性疾病(Brown等Nat Med 1998)。因此,转移全长CD154基因并且具有感染细胞能力的载体可以以这样的方式反应,其可引起预料不到的不良毒性。
因此,存在开发CD154衍生物的需要,该衍生物保留对于凋亡和肿瘤抑制的有益性质,而不具有不期望的不良毒性。
发明简述
本发明人开发了膜结合的三聚化CD154衍生物,其缺乏胞内信号传导结构域。该衍生物是比对应的单体CD154更强的免疫调节物(immunmodulator),其不会引起内部CD154信号传导,并且不会引起全身性CD154介导的毒性。
TMZ-CD154的描述
该发明涉及经改造形式的CD154,其中CD154的胞外和跨膜结构域与寡聚化结构域相融合(图1)。该经改造的CD154会保持膜结合形式并具有功能胞外结构域,但不会含有胞内信号传导结构域。相反,所述寡聚化结构域会使翻译的经改造的CD154寡聚化并且该蛋白质复合体会保持膜结合。
作为一个实例,我们产生了三聚化膜结合含有异亮氨酸拉链的CD154分子,称为TMZ-CD154(trimerized membrane-bound isoleucine zipper-containing CD154)。TMZ-CD154形成寡聚体化(优选三聚体化)CD154的分子,其缺少胞内结构域且定位于细胞膜上。在细胞中表达的TMZ-CD154导致在细胞表面上稳健检测到该分子以及相比于野生型CD154的该分子的最小分泌。表达TMZ-CD154的细胞活化树突状细胞(DC),如通过均一的CD83表达和高IL12产生所示。IL12产生与野生型CD154同样高并且高于如果DC被可溶性多聚CD154分子刺激的情况,从而证明了将TMZ-CD154保留于膜中的跨膜区域的益处。此外,在CD40连接后表达CD154的细胞中的CD154信号传导不明确,但在表达CD154的T细胞中可诱导增殖条件。因此,TMZ-CD154将具有CD154刺激的CD40阳性细胞的有益性质而不活化在表达TMZ-CD154的细胞内的下游信号传导通路,其可引起在例如经改造的T细胞中的失控生长或其他依赖于经改造的细胞类型的未知事件。这是重要的,尤其是如果将所述分子递送至可受到内部CD154信号传导影响的细胞(如T细胞)的情况下。
如本文所描述的,本发明不限于TMZ-CD154,而其他具有关键构造单元(building block)的核苷酸/蛋白质也在本发明的范围内。为了说明的目的,使用TMZ-CD154作为本发明多个方面的一个实例:
i)核苷酸或蛋白质形式的TMZ-CD154,
ii)用于医药的TMZ-CD154,
iii)插入遗传载剂(vehicle)、细胞、人工细胞或者天然或人工载剂中的TMZ-CD154,
iv)插入遗传载剂、细胞、人工细胞或者天然或人工载剂中以用于医药的TMZ-CD154,
v)TMZ-CD154或插入遗传载剂、细胞、人工细胞或者天然或人工载剂中的TMZ-CD154,其用于治疗包括但不限于以下的疾病:人和/或兽医中的癌症、感染性疾病、淋巴增殖性疾病、炎症、慢性炎症、自身免疫性或变态反应,
vi)包含TMZ-CD154的药物组合物,
vii)包含插入遗传载剂、细胞、人工细胞或者天然或人工载剂中的TMZ-CD154的药物组合物,
viii)用于在细胞中产生TMZ-CD154的方法。
发明描述
基于本文所报道的观察,尤其是鉴于涉及TMZ-CD154的结果,本发明涉及包含以下结构的核苷酸序列
OD-(L)-TD-ED(5’至3’)
其中OD为寡聚化结构域,
L为接头,其任选地存在,
TD为跨膜结构域,并且
ED为CD154的胞外结构域,
条件是所述核苷酸序列不包含对应于SEQ ID NO:16的等同核苷酸序列的胞内CD154区域。
所述跨膜结构域可来源于CD154或来源于任何II型跨膜蛋白质。
所述胞外结构域可选自
i)SEQ ID NO:11,即SEQ ID NO:1的199-846位残基,
ii)SEQ ID NO:11,即SEQ ID NO:1的199-846位残基,但其中SEQ ID NO:1的397-420位核酸残基的一个或更多个已缺失或更换为另外的核酸以避免所述分子的切割,
iii)SEQ ID NO 12,即SEQ ID NO:3的127-846位残基,
iv)SEQ ID NO:13,即SEQ ID NO:4的127-844位残基,
v)SEQ ID NO:14,即SEQ ID NO:5的127-844位残基,
vi)核苷酸序列,其与i)至v)中任一项限定的序列具有至少95%、98%或99%的序列同一性,或者
vi)来自哺乳动物的对应胞外CD154结构域。
本发明的核苷酸序列包含三个强制元件,其从5’末端至3’提供了结构OD-TD-ED,并且同时其缺少胞内信号传导。CD40L的胞外结构域将与跨膜区域融合以使其保留在细胞表面上以用于增强信号传导;以及与三聚化结构域融合以用于使信号传导最大化。可在OD与TD之间插入接头。
TMZ-CD154的目的在于,在与CD40+细胞相互作用后,在携带TMZ-CD154的细胞中将CD40L三聚化并使其保留于质膜中而不赋予胞内信号传导。目的是传递信号,而不是获得往复信号(reciprocal signal)。
天然存在的CD40L在体内不以稳定的方式保持三聚化结构,其弱化了信号传导。
根据本发明的核苷酸序列可用于体内的基因疗法,例如(并且如本文的实施例中所述)通过瘤内注射携带所述核苷酸序列(例如TMZ-CD154基因)的病毒,去除胞内区域(例如CD40L的胞内区域)是重要的。体内注射会导致在活化期间的短时间内在所有感染细胞中表达该核苷酸序列,所述细胞包括肿瘤浸润的T细胞、可天然表达CD40L的细胞。在T细胞中过表达野生型CD40L导致失控的T细胞增殖,以及因此小鼠中的淋巴增殖性疾病。去除所述胞内区域对于安全性方面是重要的。TMZ-CD154在人T细胞中不诱导失控的T细胞增殖,而且该不良反应也未在以CD40L处理的小鼠中注意到。特别地,本发明涉及CD40L或CD154衍生物,其具有以下结构:
OD-(L)-TD-ED,其中OD为寡聚化结构域,L为接头,其任选地存在,TD为跨膜结构域,并且ED为胞外结构域。因此,与CD40L(CD154)相比,本发明的核苷酸序列不具有胞内结构域,但具有寡聚化结构域,其在跨膜结构域和胞外结构域之前。因此,不存在CD40L(CD154)的胞内结构域。
在下表中给出了本文所提及的序列的总览。
序列表
一般来说,所述核苷酸序列为缺少胞内区域的CD154,并且如上文所示,该CD154可来源于哺乳动物,包括人、马、犬、猫等。人CD154是优选的。设想CD154的一个或更多个残基可缺失或替换。在下表中以及以人CD154(以蛋白质提供)的说明提供了哪些残基可被替换为另外的残基的指示。替换/缺失模式的任何组合均在本申请的范围内。因此,下表中所示的CD154(缺少胞内区域)的一个或更多个氨基酸可根据所述的具体变化而被替换/缺失。
为了防止分子切割,CD154(蛋白质)的一些氨基酸也可被替换。SEQ ID NO:26给出了这样的序列的一个实例,其中所述变化如下(基于全长人CD150):Q114P、K115R、D117E、Q118E、N119D和P120S。对应于SEQ ID NO:26的蛋白质的核苷酸序列(但缺少胞内区域)也在本发明的范围内。
人CD154氨基酸序列中的天然变化
参考:UniProtKB/Swiss-Prot/P29965(CD40L_HUMAN)
如上文所提及,跨膜结构域可为任何跨膜蛋白质,尤其来源于CD154、人OX40配体或人CD70。
因此,所述跨膜结构域可与以下序列具有至少90%的序列同一性
i)SEQ ID NO:17,即SEQ ID NO 1的127-198位残基,
ii)SEQ ID NO:20,即人OX40的跨膜结构域,或者
iii)SEQ ID NO:22,即人CD70的跨膜结构域。
或者其可与SEQ ID NO:17、SEQ ID NO:20或SEQ ID NO:22具有至少95%、96%、97%、98%、99%或100%的序列同一性。
作为一个实例,所述跨膜结构域具有SEQ ID NO:17,即SEQ ID NO:1(TMZ-CD154)的127-198位残基。
所述寡聚化结构域通常为异亮氨酸拉链或T4纤维蛋白(fibrin)的三聚化结构域。作为一个实例,所述寡聚化结构域为具有SEQ ID NO:23,即SEQ ID NO:1的10-108位残基的异亮氨酸拉链。
所述核苷酸序列可还包含Kozak序列,例如对应于SEQ ID NO:1的1-9位残基。
所述Kozak序列为短核苷酸序列,其产生于真核mRNA以增强翻译过程的起始。当用于基因疗法的环境中时为了增强TMZ-CD154的翻译,TMZ-CD154基因序列位于Kozak序列之后。如果TMZ-CD154单独表达或作为含有免疫调节物或其他分子之额外基因的转录本的第一基因,则Kozak序列将存在。因此,在该情况下,根据本发明的核苷酸可具有或可不具有Kozak序列。这两种形式均在本发明的范围内。
通过举例的方式,根据本发明的核苷酸序列可与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5具有至少90%或至少95%的序列同一性。具体地,根据本发明的核苷酸序列可与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5具有至少98%的序列同一性,或与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5的核苷酸相同。
根据本发明的核苷酸序列也可与免疫调节物组合。适合的免疫调节物的实例为4-1BB配体基因,或抗IL6R scFv的基因。
类似地,根据本发明的核苷酸序列可与信号传导通路调节物(如抗IL6R scFv)组合;或其可与信号传导通路阻断物(blocker)组合。因此,根据本发明的核苷酸序列可与SEQ ID NO:6或SEQ ID NO:8(分别为TMZ-CD154/4-1BBL基因和TMZ-CD154/alL6R scFv基因)具有至少95%、98%或100%的序列同一性。
根据本发明的核苷酸序列的用途详细描述于本文中。整体上所述核苷酸序列可用于医药和/或用作诊断工具。
本发明还涉及由本文所限定的核苷酸序列编码的蛋白质。
与根据本发明的核苷酸序列的限定相似,本发明的蛋白质可限定为包含以下结构的蛋白质
OD-(L)-TD-ED
其中OD为对应于寡聚化结构域的氨基酸序列,
L为接头,其任选地存在,
TD为对应于跨膜结构域的氨基酸序列,以及
ED为对应于CD154胞外结构域的氨基酸序列,
条件是所述蛋白质不包含对应于胞内CD154区域的氨基酸序列,所述区域对应于氨基酸序列SEQ ID NO:15。
CD154的所述胞外结构域可选自
i)SEQ ID NO:24,
ii)SEQ ID NO:24,但其中对应于SEQ ID NO:1的397-420位核苷酸残基的氨基酸序列MQKGDQNP的一个或更多个氨基酸已缺失或更换为另外的氨基酸以避免所述分子的切割,
iii)对应于SEQ ID NO 12,即SEQ ID NO:3的127-846位残基之核苷酸残基的氨基酸残基,
iv)对应于SEQ ID NO:13,即SEQ ID NO:4的127-844位残基之核苷酸残基的氨基酸残基,
v)对应于SEQ ID NO:14,即SEQ ID NO:5的127-844位残基之核苷酸残基的氨基酸残基,
vi)氨基酸序列,其与i)至v)中任一项限定的序列具有至少95%、98%或99%的序列同一性,或者
vi)来自哺乳动物的对应胞外CD154结构域。
所述跨膜结构域可来源于CD154或任何II型跨膜蛋白质。其可与SEQ ID NO:18、SEQ ID NO:19或SEQ ID NO:21(优选SEQ ID NO:18)具有至少90%、95%、98%或100%的序列同一性。
根据本发明的蛋白质缺少胞内区域,如CD154或CD40的胞内区域。
在核苷酸方面中描述的细节和特点也适用于蛋白质方面,然而,考虑到蛋白质方面,分子的相关部分为对应于所描述的核苷酸的氨基酸序列或由本文所描述的核苷酸编码的氨基酸序列。
通过举例的方式,根据本发明的蛋白质可包含ED,其与SEQ ID NO:24具有至少90%或至少95%的序列同一性。此外,在上文的表中给出了ED中可能的改变的综述。如上文所述,任何这样的改变和改变的组合都旨在包括于本发明的范围内。
更具体地,所述寡聚化结构域可为异亮氨酸拉链结构域或T4纤维蛋白的三聚化结构域。
如上文所提及的,所述跨膜结构域可来源于CD154或任何II型跨膜蛋白质的跨膜结构域。具体地,对应于所述跨膜结构域的氨基酸序列与SEQ ID NO:18、SEQ ID NO:19(来源于OX40配体的TD)或SEQ ID NO:21(来源于CD70的TD)具有至少90%、95%、98%或100%的序列同一性。作为一个实例,根据本发明的蛋白质的跨膜结构域可为SEQ ID NO:18或蛋白质,其中SEQ ID NO:18的一个或更多个残基可缺失或替换为另外的氨基酸。这样的残基的实例为aa14和/或aa16,其中例如M14R和/或G15R(对应于全长CD154中的M36R和G38R)。
特别地,根据本发明的蛋白质可与SEQ ID NO:2具有至少90%、95%或98%的序列同一性,例如与SEQ ID NO:2具有100%的序列同一性。
根据本发明的蛋白质的用途详细描述于本文中。整体上所述蛋白质可用于医药和/或用作诊断工具。
对核苷酸和蛋白质两种形式的TMZ-CD154均特别感兴趣。
涉及结构和序列时有关TMZ-CD154的细节
TMZ-CD154基因含有CD154的胞外和跨膜结构域,其与寡聚化结构域融合但缺少胞内CD154区域。更具体地,所述TMZ-CD154基因与SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5之一具有至少90%的序列同一性。特别地,所述TMZ-CD154基因与SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5之一具有至少95%的序列同一性。尤其是,所述TMZ-CD154基因为SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5之一。
SEQ ID NO:2对应于SEQ ID NO:1的氨基酸序列。本发明还涵盖的是TMZ-CD154蛋白,其与SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的核苷酸序列之一的对应蛋白质序列具有至少90%的序列同一性。特别地,所述TMZ-CD154蛋白与SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的核苷酸序列之一的对应蛋白质序列具有至少95%的序列同一性。尤其是,所述TMZ-CD154蛋白对应于SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4或SEQ ID NO:5的核苷酸序列的对应蛋白质序列。尤其是,所述蛋白质与SEQ ID NO:2具有至少90%或至少95%的序列同一性。尤其是,所述TMZ-CD154蛋白具有SEQ ID NO:2的蛋白质序列。
所述TMZ-CD154结构域可为人来源,但也可来源于其它物种,包括但不限于犬、猫和马。该转基因可用于自体、同种异体或异种形式。例如,人TMZ-CD154可用于治疗人、猫、犬和/或马的疾病。
所述寡聚化结构域可为异亮氨酸拉链结构域但也可为其它使TMZ-CD154分子寡聚化而不干扰膜定位的结构域。许多蛋白质寡聚化或具体地三聚化并且含有可用的序列。例如,可使用T4纤维蛋白或其他天然地三聚化的分子的三聚化结构域。
所述跨膜结构域可来源于CD154分子或者其他展现一个或更多个跨膜区域或经设计的区域的分子,以增强在膜中的CD154的保持。跨膜区域可为单个或多个跨膜α螺旋、β桶、短杆菌肽A的β螺旋,但也可为其他结构。
载剂
本发明还涉及载剂,其包含本文所限定的核苷酸序列。所述载剂可为任何适合的载剂,包括质粒、病毒载体、转座子、细胞、人工细胞和人工载剂。
当在下文中使用TMZ-CD154时,其本身涵盖TMZ-CD154以及根据本发明的其他核苷酸(和蛋白质,如果相关)。
用于TMZ-CD154转移的载剂可为但不限于质粒、复制缺陷的病毒载体、能够复制的病毒、转座子、细胞、人工细胞或人工载剂。
本文所限定的TMZ-CD154可作为DNA、cDNA、RNA、mRNA、寡核苷酸或蛋白质递送至本文所描述的载剂内。
质粒
用于根据本发明的核苷酸序列(尤其是TMZ-CD154)转移的载剂可为质粒、微环质粒衍生物或自我复制的质粒或微环。
所述质粒载体可为,但不限于,由环状DNA序列组成的基础质粒,其具有ORI位点、限制性酶、启动子和根据本发明的核苷酸序列(尤其是TMZ-CD154序列),所述序列具有起始和终止密码子。
所述质粒也可为所谓的微环质粒衍生物,其具有有限的或无原核载体部分,但含有根据本发明的核苷酸序列,尤其是TMZ-CD154序列。
含有根据本发明的核苷酸,尤其是TMZ-CD154序列的质粒可为所谓的自我复制的质粒或微环,其含有S/MAR-元件或其他使得能够在细胞中的所述质粒或微环自我复制的部分。
病毒载体
所述载体可为复制缺陷的病毒载体或者能够复制的病毒,其含有根据本发明的核苷酸序列,例如TMZ-CD154。
对于复制缺陷的病毒载体,我们意指由于涉及病毒复制的基因的缺失而不能够通过其自身的方式复制的病毒。例如,可从腺病毒科的病毒缺失早期基因1(E1)以产生复制缺陷的病毒载体。为了支持复制病毒的生长,丢失的基因/相关的蛋白质需要通过,但不限于以下方式提供:在生产细胞系(如293、293T、911、C6(Crucell)生产细胞系)中的E1基因插入。该丢失的基因/相关的蛋白质也可分别地提供给产生病毒的细胞系。例如,来源于逆转录病毒科的复制缺陷载体的质粒可与含有缺失基因的基因/蛋白质一起转染入生产细胞中。
对于能够复制的病毒,我们意指能够通过其自身方式在任何其感染的细胞或特定来源的细胞中复制的病毒。后者可为条件性复制的病毒,其中复制由仅在特定细胞中或特定环境下活化的启动子驱动。这样的细胞可为肿瘤细胞或器官特异性细胞,并且这样的环境可为由于增殖而上调的启动子活性,例如端粒酶启动子(TERT)或被破坏的视网膜母细胞瘤Rb通路。
如上文所述,该复制缺陷的病毒载体或能够复制的病毒,可在病毒基因组中具有其他缺失以为转基因(如TMZ-CD154)提供更多空间或去除基因区段,否则所述基因区段会损害治疗效果或转基因的表达。例如,由于上文提到的原因,可从腺病毒科的病毒部分或完全地缺失早期基因3(E3)。
如上文所述,该复制缺陷的病毒载体或能够复制的病毒,可具有添加的启动子以驱动复制或转基因的表达,以及隔离子或类似物以保护该启动子或转基因免于抑制作用,以增强转基因的翻译,或者提高或增强溶瘤病毒之溶瘤功能的特异性。例如,病毒载体可含有来源于但不限于巨细胞病毒(CMV)、劳斯肉瘤病毒(RSV)、鼠干细胞病毒(MSCV)和/或人延伸因子1a(elongation factor-1a,EF-1a)启动子的启动子。
如上所述的复制缺陷的病毒载体或能够复制的病毒可为但不限于以下病毒科中的成员:腺病毒科、乳多空病毒科、细小病毒科、疱疹病毒科、痘病毒科、肝DNA病毒科、Anelloviridae科、逆转录病毒科、呼肠孤病毒科、小RNA病毒科、杯状病毒科、披膜病毒科、沙粒病毒科、黄病毒科、正粘病毒科(Orthomycoviridae)、副粘病毒科、布尼亚病毒科、弹状病毒科、丝状病毒科、冠状病毒科、星状病毒科、玻那病毒科、动脉炎病毒科、肝炎病毒科。
如上所述的复制缺陷的病毒载体或能够复制的病毒可为但不限于DNA病毒的成员,所述DNA病毒例如腺病毒科、乳多空病毒科、细小病毒科、疱疹病毒科、痘病毒科、肝DNA病毒科、Anelloviridae科。
如上所述的复制缺陷的病毒载体或能够复制的病毒也可为但不限于RNA病毒的成员,所述RNA病毒例如逆转录病毒科、呼肠孤病毒科、小RNA病毒科、杯状病毒科、披膜病毒科、沙粒病毒科、黄病毒科、正粘病毒科、副粘病毒科科、布尼亚病毒科科、弹状病毒科、丝状病毒科、冠状病毒科、星状病毒科、玻那病毒科、动脉炎病毒科、肝炎病毒科。
如上所述的复制缺陷的病毒载体或能够复制的病毒可为腺病毒科、细小病毒科、痘病毒科、逆转录病毒科、披膜病毒科的成员。
如本文的实施例中所示例的,如本文所描述的复制缺陷的病毒载体或能够复制的病毒为腺病毒科的成员。
如本文所描述的复制缺陷的病毒载体或能够复制的病毒可为嵌合病毒。对于嵌合病毒,我们意指如上述的病毒,其由以下构成:a)本文所述的病毒科内的两个或更多个不同的病毒部分,b)来自不同病毒的两个或更多个不同的病毒部分,或c)“a”与“b”的混合物或d)病毒载体,其可具有来自其他物种的基因。例如,来源于CMV病毒的启动子可插入来自其他病毒科的病毒载体中,或者病毒载体可展现人基因或启动子。
如本文所描述的复制缺陷的病毒载体或能够复制的病毒可为如上所述的嵌合病毒,尤其是由腺病毒血清型5骨架组成的嵌合病毒,其中纤维轴(fiber shaft)和节(knob)来源于腺病毒血清型35。
因此,根据本发明的载剂可为病毒,其为腺病毒血清型5/35病毒。该腺病毒5/35病毒可具有在E1A基因上游的E2F启动子区/结合位点,其可含有在E1A基因上游的Sp-1位点、E1A Δ24缺失、E3 Δ6.7K/gp19K以及包含pCMV的转基因盒,并且转基因插入L5基因区域之后。
转座子
遗传载剂也可为转座子。对于转座子,我们意指来源于可转座元件(TE、转座子或反转座子)的载体。例如,但不限于,睡美人转座子系统(Sleeping Beauty transposon system)或PiggyBac转座子系统。
细胞、人工细胞或人工载剂
如本文所限定的包括TMZ-CD154的核苷酸序列可插入并展示于细胞、人工细胞或人工载剂上。这些细胞/载剂可用作核苷酸序列或翻译的蛋白质(例如TMZ-CD154)向疾病(如肿瘤)部位的简单递送载剂。如果细胞受到核苷酸序列/翻译的蛋白质(例如TMZ-CD154)的直接影响,则细胞载剂可用作核苷酸序列/翻译的蛋白质(例如TMZ-CD154)的递送以及由于该核苷酸序列/翻译的蛋白质(例如TMZ-CD154)细胞展现出的新性质而用作细胞疗法两者。
TMZ-CD154经改造的细胞可为,但不限于,肿瘤细胞(例如肿瘤细胞疫苗)、免疫系统的细胞(如T细胞、树突状细胞、单核细胞和巨噬细胞),以及其他细胞类型(如成纤维细胞、间充质基质细胞、内皮细胞、上皮细胞)。
TMZ-CD154经改造的细胞可为肿瘤细胞,其对患者为自体或同种异体的。该经改造的细胞可用作癌症患者的细胞疫苗。
TMZ-CD154经改造的细胞为来源于如上所述的免疫系统的自体或同种异体细胞以用于治疗患者。例如,该细胞可为淋巴来源的,如天然杀伤细胞(NK细胞)或靶向抗原的T细胞,其通过选择并扩增天然存在的抗原识别T细胞,或者通过基因改造的T细胞(例如表达嵌合抗原受体的T细胞、靶向抗原的T细胞受体或等同物)产生。
对于“抗原”,我们意指通过T细胞经由T细胞受体、嵌合抗原受体或等同物识别的靶标,所述等同物例如但不限于,治疗癌症的肿瘤特异性或相关抗原、治疗感染性疾病的微生物抗原,或者也存在微生物抗原的癌细胞。例如,EB病毒(Ebstein-Barr virus,EBV)可表达于B细胞来源的癌症中并且因此,EBV抗原可用作癌细胞靶标。同样的,乳头状瘤病毒和CMV已经与癌症相关联。
核苷酸序列(例如TMZ-CD154)改造的细胞也可为骨髓来源的,例如但不限于,单核细胞、树突状细胞和巨噬细胞。这些细胞可为选定的天然存在的细胞、离体产生自祖细胞的细胞和/或基因改造的细胞,以获得增强的或新的性质。例如,该细胞可以与细胞因子或其他刺激物(如其他细胞、抗原、蛋白质、抗体、肽、核苷酸、RNA、DNA等)培养或用基因载剂进行改造以获得新的性质。
核苷酸序列(例如TMZ-CD154)改造的细胞也可为除了肿瘤细胞和免疫细胞以外的自体或同种异体细胞,例如但不限于,干细胞、成纤维细胞、间充质基质细胞、内皮细胞和上皮细胞。该细胞可为天然存在的细胞或通过祖细胞的培养产生的细胞。该细胞可已经进行离体培养和/或与细胞因子或其他刺激物(如其他细胞、抗原、蛋白质、抗体、肽、核苷酸、RNA、DNA等)刺激,或者用基因载剂进行改造以获得新的性质。
根据本发明的核苷酸序列(例如TMZ-CD154)可通过人工细胞展示或递送。对于人工细胞,我们意指可具有特定细胞功能的一些重要生物学特征的实体。其可为脂质膜、质膜或人工膜中包围的囊泡,其1)包含本文所述的TMZ-CD154,以使其转运并释放于疾病部位如肿瘤,2)在膜上携带本发明的核苷酸序列(例如TMZ-CD154)以在疾病部位或体外活化CD40阳性细胞。
根据本发明的核苷酸序列(例如TMZ-CD154)也可通过天然或人工载剂展示或递送。对于天然或人工载剂,我们意指例如在表面或内核装载了TMZ-CD154的脂质体、珠、纳米颗粒或囊泡的不同组合物以用于例如TMZ-CD154的迅速或缓慢的释放。囊泡可为例如从表达核苷酸序列(例如TMZ-CD154)的细胞纯化的外体。
包含根据本发明的核苷酸序列(例如TMZ-CD154)的遗传载剂的使用
如本文所限定的,用根据本发明的核苷酸序列(例如TMZ-CD154)改造的遗传载剂、细胞、人工细胞、天然或人工载剂可用于细胞的体外刺激,然后所述细胞用作细胞疗法或用作对之后将用于细胞疗法的细胞的刺激物。例如,用肿瘤或病毒肽脉冲的TMZ-CD154改造的树突状细胞可用作癌症或感染性疾病的细胞疗法。
如本文所限定的,用核苷酸序列(例如TMZ-CD154)改造的遗传载剂、细胞、人工细胞、人工载剂可用于细胞的体外刺激,然后所述细胞用于细胞疗法。例如,TMZ-CD154改造的树突状细胞可用于在癌症或感染性疾病的T细胞疗法之前,对靶向肿瘤或病毒的T细胞的体外刺激与扩增。
此外,如本文所限定的,用核苷酸序列(例如TMZ-CD154)改造的遗传载剂、细胞、人工细胞、人工载剂用于细胞的体外刺激,所述细胞用于健康个体的患者的体外分析。例如,TMZ-CD154改造的树突状细胞可用于肿瘤或病毒特异性T细胞的体外扩增,以评估该细胞群在血液和组织活检物中的存在与功能。
TMZ-CD154和本文所限定的其他序列可以以DNA、cDNA、RNA、mRNA、寡核苷酸或蛋白质的形式用作治疗剂。在下文中以TMZ-CD154为例例举用途,但根据本发明的其他核苷酸和蛋白质也可用于所描述的用途。
用于医药的TMZ-CD154
TMZ-CD154可用于医药。尤其是TMZ-CD154可用于癌症的治疗。
如本文所限定的TMZ-CD154可用于治疗癌症,例如来源于上皮细胞(癌)、结缔组织(肉瘤)、生殖细胞(精原细胞瘤和无性细胞瘤)、前体或胚胎细胞(母细胞瘤)或者造血细胞(淋巴瘤和白血病)的那些。
如本文所限定的TMZ-CD154也可用于治疗
i)非造血性癌症,例如来源于上皮细胞(癌(carcinoma))、结缔组织(肉瘤)、生殖细胞(精原细胞瘤和无性细胞瘤)、前体或胚胎细胞(母细胞瘤)的那些,
ii)来源于上皮细胞(癌)的癌症,例如腺癌、鳞状细胞癌、腺鳞癌、未分化癌、大细胞癌或小细胞癌,
iii)癌,其来源于胰腺中的细胞,例如但不限于导管腺癌,
iv)癌,其来源于卵巢,如卵巢癌,
v)癌,其来源于膀胱,
vi)癌,其来源于肺,
vii)癌,其来源于肝,
viii)癌,其来源于肾,如肾细胞癌,
ix)癌,其来源于结肠,
x)癌,其来源于乳腺,
xi)癌,其来源于皮肤。
xii)神经内分泌肿瘤,不依赖于其位置,
xiii)癌症,其来源于前列腺,
xiv)癌症,其来源于脑,如胶质母细胞瘤,
xv)癌症,其来源于间充质来源的细胞,例如来自骨、软骨、脂肪、肌肉和血管或造血组织的那些(肉瘤),
xvi)肉瘤,其来源于骨如骨肉瘤,或软骨如软骨肉瘤,
xvii)肉瘤,其来源于脂肪如脂肪肉瘤,或平滑肌如平滑肌肉瘤,
xviii)软组织肉瘤,包括腺泡状软组织肉瘤、血管肉瘤、叶状囊肉瘤、隆突性皮肤纤维肉瘤、硬纤维瘤、促结缔组织增生性小圆细胞肿瘤、促结缔组织增生性小圆细胞肿瘤、上皮样肉瘤、骨骼外软骨肉瘤、骨骼外骨肉瘤、纤维肉瘤、血管外皮细胞瘤、血管肉瘤、卡波西肉瘤、平滑肌肉瘤、淋巴肉瘤、未分化的多形性肉瘤、恶性外周神经鞘肿瘤、神经纤维肉瘤、横纹肌肉瘤和滑膜肉瘤,
xix)尤因氏肉瘤,
xx)造血性癌症,例如来源于造血细胞的那些(淋巴瘤和白血病),
xxi)造血性癌症,例如来源于淋巴系的造血细胞的那些,例如但不限于,霍奇金或非霍奇金淋巴瘤,或者T细胞淋巴瘤,
xxii)造血性癌症,例如来源于淋巴系的造血细胞的那些,例如但不限于,非霍奇金淋巴瘤,
xxiii)造血性癌症,例如来源于淋巴系的造血细胞的那些,例如但不限于,B细胞白血病如慢性髓性白血病和前体B细胞急性成淋巴细胞性白血病,
xxiv)造血性癌症,例如来源于骨髓系的造血细胞的那些,例如但不限于,急性髓性白血病或慢性髓性白血病,
xxv)未知原发位置的癌症,
xxvi)局部原发癌症,
xxvii)局部晚期癌症,
xxviii)单发转移(single metastases),
xxix)扩散传播的癌症疾病。
xxx)感染性疾病,
xxxi)病毒感染,例如但不限于,巨细胞病毒(CMV)感染、EB病毒(EBV)感染或腺病毒感染,
xxxii)病毒感染,例如但不限于,人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染,
xxxiii)病毒感染,例如但不限于,流感病毒或RS病毒,
xxxiv)淋巴增殖性病症,例如但不限于,华氏巨球蛋白血症,
xxxv)免疫功能障碍,例如高IgM综合征,
xxxvi)免疫功能障碍,其中进行的免疫反应需要向Th1型免疫倾斜,
xxxvii)如本文所限定的人类医学中的疾病,
xxxviii)如本文所限定的人类成年患者的疾病,
xxxix)如本文所限定的人类儿科患者的疾病,
xxxx)治疗如本文所限定的兽医中的疾病,
xxxxi)如本文所限定的犬的疾病,
xxxxii)如本文所限定的猫的疾病,
xxxxiii)如本文所限定的马的疾病。
使用TMZ-CD154与免疫调节物的组合
本文所限定的TMZ-CD154可与一种或更多种其他活性分子组合。该分子可不与或与相同的或不同的载体系统使用。
适合的活性分子在下文中提及。
所述活性分子可为DNA、cDNA、RNA、mRNA、核苷酸或蛋白质形式的其他免疫调节基因。其他活性剂可为一种或更多种野生型免疫调节物,例如属于肿瘤坏死因子(TNF)/肿瘤坏死因子受体(TNFR)超家族的野生型免疫调节物。
本文所限定的TMZ-CD154也可与野生型4-1BB配体组合使用,和/或与野生型细胞因子或细胞因子受体组合使用。
另外或者替代地,本文所限定的TMZ-CD154可与一种或更多种白细胞介素组合。白细胞介素可为白细胞介素-2、7、15和/或21。因此,与本文所限定的TMZ-CD154组合的活性剂可为白细胞介素-2、白细胞介素-7、白细胞介素-15或白细胞介素-21。
本文所限定的TMZ-CD154也可与一种或更多种野生型生长因子或者一种或更多种生长因子受体组合。这样的受体可为野生型转化生长因子-β(TGFb)受体、TGFb受体诱饵,或显性阴性TGFb受体。
本文所限定的TMZ-CD154也可与上文所限定的分子组合,但其是从野生型形式修饰而来的。例如,核苷酸或氨基酸可已被改变,但它们仍表现出相同或改善的免疫刺激功能,或者该分子可已被改变和/或与其他结构域融合以创建嵌合蛋白质。例如,4-1BB配体胞外结构域和跨膜结构域可与TMZ结构域融合,以创建膜结合的三聚化4-1BB配体。
本文所限定的TMZ-CD154可与4-1BB配体胞外结构域和跨膜结构域组合,该4-1BB配体胞外结构域和跨膜结构域可与TMZ结构域融合,以创建膜结合的三聚化4-1BB配体。
本文所限定的TMZ-CD154也可与诱饵分子组合以阻断、改变或活化信号传导通路。该诱饵分子可为抗体、来源于抗体的单链片段、受体、配体,或其部分。
上文所限定的诱饵分子可为这样的诱饵分子,其会阻断或改变白细胞介素-6(IL6)受体/IL6连接。
因此,该诱饵分子可为靶向IL6受体的scFv,或靶向IL6分子的scFv。
替代或另外地,上文所限定的诱饵分子可为这样的诱饵分子,其会阻断STAT3通路、gremlin-1、IL10/IL10受体连接,或精氨酸酶I。
本文所限定的TMZ-CD154可与在本文所限定的相同载剂系统(遗传、细胞或人工载剂)中与上文所限定的任何调节物组合。例如,TMZ-CD154核苷酸序列可与在遗传载体中的4-1BB配体核苷酸序列为反式。
TMZ-CD154与另一调节物的组合可反式地位于载体系统中并由IRES序列或类似序列分隔以允许这两个基因的表达,或者TMZ-CD154与另一调节物的组合可反式地位于载体系统中并由2A肽的序列或类似序列分隔,这允许这两个调节物为单个基因转录本,其在翻译后分离为两个实体。
TMZ-CD154与一个或更多个免疫调节物之用于医药的组合
根据本发明的核苷酸或蛋白质,尤其是本文所限定的TMZ-CD154可与本文所限定的任何调节物在本文所限定的不同载剂系统(遗传、细胞或人工载剂)中组合,但一起使用以治疗疾病。例如,两个分别携带TMZ-CD154和4-1BB配体的载剂可在治疗但不限于癌症或感染性疾病期间同时或在不同时间点使用。
载剂可为装有TMZ-CD154的腺病毒载体并且另一个载剂可为装有4-1BB配体的腺病毒载体。
一个载剂也可为装有TMZ-CD154的腺病毒载体并且另一个载剂可为装有抗IL6受体scFv的腺病毒载体。
或者,一个载剂也可为装有TMZ-CD154的腺病毒载体并且另一个载剂可为装有4-1BB配体的另一个载体系统,或者
一个载剂也可为装有TMZ-CD154的腺病毒载体并且另一个载剂可为装有抗IL6受体scFv的另一个载体系统。
载剂也可为装有与蛋白质4-1BB配体组合的TMZ-CD154的腺病毒载体,或者
载剂可为装有与阻断IL6受体的抗体或scFv组合的TMZ-CD154的腺病毒载体,或者
载剂可为装有与阻断IL6的抗体或scFv组合的TMZ-CD154的腺病毒载体。
用于与批准的治疗组合使用的TMZ-CD154
根据本发明的核苷酸和蛋白质,例如本文所限定的TMZ-CD154,也可与批准的针对疾病的治疗组合,例如不同药物、放射性疗法或手术。
因此,根据本发明的核苷酸和蛋白质(例如本文所限定的TMZ-CD154)可与例如以下组合
i)批准的免疫调节疗法
ii)批准的基于抗体的治疗剂,例如但不限于,曲妥珠单抗(抗Her2)、利妥昔单抗(抗CD20)、托珠单抗(抗IL6R)、伊匹单抗(抗CTLA-4)、纳武单抗(抗PD1)和派姆单抗(抗PD1),
iii)批准的免疫来源细胞疗法,例如但不限于,T细胞疗法(天然靶向肿瘤,如扩增的肿瘤浸润淋巴细胞,或者遗传改造的,如CAR T细胞或TcR改造的T细胞)、NK细胞疗法或者树突状细胞疫苗,
iv)批准的T细胞疗法(天然靶向肿瘤的T细胞,如扩增的肿瘤浸润淋巴细胞,或者遗传改造的,如CAR T细胞或TcR改造的T细胞),
v)批准的NK细胞疗法,
vi)批准的树突状细胞疫苗,
vii)批准的疫苗,例如但不限于,肿瘤细胞疫苗、肿瘤或病毒抗原肽或者其他病毒或细菌抗原,
viii)批准的肿瘤细胞疫苗,
ix)批准的肿瘤或病毒抗原肽,
x)批准的病毒或细菌抗原,例如但不限于,pp65 CMV肽或全长蛋白质、卡介苗(bacillus Calmette-Guérin,BCG)或未甲基化的CpG核苷酸,
xi)批准的免疫调节物,包括但不限于,咪喹莫特、干扰素(如IFNγ、IFNα)、白细胞介素/细胞因子(如IL2)和生长因子(如GM-CSF),
xii)批准的癌症治疗剂,包括烷化剂、抗代谢物、抗微管剂、拓扑异构酶抑制剂和细胞毒性抗生素,
xiii)批准的针对癌症的化学疗法,例如但不限于,烷化剂包括氮芥、苯达莫司汀、环磷酰胺、美法仑、苯丁酸氮芥、异环磷酰胺、白消安、N-亚硝基-N-甲基脲、卡莫司汀、洛莫司汀、司莫司汀、福莫司汀、链脲霉素、dacarbaxine、米托唑胺、替莫唑胺(tomoxolomide)、塞替派、丝裂霉素、地吖醌、顺铂、卡铂、奥沙利铂、甲基苄肼和六甲蜜胺,
xiv)环磷酰胺,
xv)苯达莫司汀,
xvi)替莫唑胺。
xvii)顺铂、卡铂或奥沙利铂,
xviii)批准的针对癌症的化学疗法,例如但不限于,抗代谢物,如抗叶酸剂、氟嘧啶、脱氧核苷类似物和硫嘌呤,
xix)抗叶酸剂,如甲氨蝶呤或培美曲塞,
xx)氟嘧啶,如氟尿嘧啶或卡培他滨,
xxi)脱氧核苷类似物,如阿糖胞苷、吉西他滨、地西他滨、vidaza、氟达拉滨、奈拉滨、克拉屈滨、氯法拉滨或喷司他丁,
xxii)吉西他滨,
xxiii)硫嘌呤,如硫鸟嘌呤或巯基嘌呤,
xxiv)批准的针对癌症的化学疗法,例如但不限于,抗微管剂,如长春花生物碱、紫杉烷类或其他阻断微管形成或稳定微管的药物,
xxv)长春新碱、长春碱、长春瑞滨、长春地辛或长春氟宁,
xxvi)紫杉醇或多西他赛,
xxv)依托泊苷、替尼泊苷或其他阻断微管形成或稳定微管的药剂,
xxvi)批准的针对癌症的化学疗法,例如但不限于,拓扑异构酶抑制剂,
xxvii)伊立替康、拓扑替康或喜树碱,
xxviii)批准的针对癌症的化学疗法,例如但不限于,细胞毒性抗生素,
xxix)多柔比星、柔红霉素、吡柔比星、阿柔比星、米托蒽醌,
xxx)批准的癌症治疗,包括放射性疗法,如外部射线放射疗法、近程放射疗法和放射性同位素疗法,
xxxi)外部射线放射疗法,如常规的外部射线放射疗法、立体定向放射、虚拟仿真(virtual simulation)、三维适形放射疗法/强度调控放射疗法、粒子疗法和螺旋疗法(auger therapy),
xxxii)近程放射疗法,
xxxiii)放射性同位素疗法,
xxxiv)批准的癌症治疗剂,包括血管发生抑制剂,
xxxv)贝伐单抗或阿柏西普,
xxxvi)批准的癌症治疗剂,包括通路抑制剂,
xxxvii)以下的抑制剂:EGFR、RET、突变的BRAF、酪氨酸激酶、mTOR、Hedgehog、Smo、PI3K、MEK、AKT、RAF、Rac1、PARP、PIM、cMET、STAT3、JAK2、p38MAPK、NOTCH、BCL-2、IAP、p53、GSK2、Chk1、CDK4/6、PDGFR、IGF-1R、DKK1、CF-1R或TWEAK:Fn14,
xxxviii)突变的BRAF的抑制剂,包括V600E,如威罗菲尼,
xxxix)酪氨酸激酶抑制剂,例如但不限于,伊马替尼、达沙替尼、尼洛替尼和舒尼替尼,
xxxx)STAT3抑制剂,
xxxxi)Rac-1抑制剂,
xxxxii)BCL-2抑制剂,
xxxxiii)凋亡抑制物的抑制剂,例如但不限于,ABT-737或navitoclax,
xxxxv)批准的抗病毒治疗剂,
xxxxvi)批准的抗病毒治疗剂,包括但不限于,阿巴卡韦、阿昔洛韦(aciclovir)、阿昔洛韦(acyclovir)、阿德福韦、阿扎那韦、boceprevirertet、西多福韦、达芦那韦、地拉韦啶、依法韦伦、恩替卡韦、膦甲酸(foscarnet)、更昔洛韦、拉米夫定、奥司他韦、万乃洛韦、缬更昔洛韦,
xxxxvii)阿昔洛韦、阿昔洛韦、膦甲酸、更昔洛韦或缬更昔洛韦,
xxxxviii)膦甲酸、更昔洛韦和缬更昔洛韦。
施用途径
原则上,在达到所预期的效果的条件下,可使用任何施用途径。一般来说,设想肠胃外施用。
因此,根据本发明的核苷酸序列可通过肠胃外施用途径施用,如通过静脉注射、通过经皮注射、通过直接注射入患病器官或组织中,或者通过瘤内注射。在后面的情况中,所述施用可通过图像引导注射入肿瘤中来进行。
药物组合物
本发明还涉及药物组合物,其用于治疗免疫相关的疾病如癌症和感染性疾病。这样的疾病的实例在本文中给出。本发明的药物组合物包含如本文所限定的遗传载剂中的如本文所限定的TMZ-CD154。
所述组合物可设计为经口、肠胃外或粘膜施用。因此,所述施用可为经口、舌下、施加于口腔粘膜,或其可为静脉内、皮下、肌内、腹膜内、鞘内(intrahecal)、瘤内等,或其可施加于皮肤或粘膜表面,包括眼、颊、鼻、阴道和直肠粘膜。然而,考虑肠胃外施用途径是最有效的,尤其是直接注射入患病区域如直接注射入肿瘤或转移区中。
所述组合物可为固体、半固体或液体形式。
合适的固体组合物包括散剂、颗粒剂、丸剂、胶囊剂、片剂(包括包衣的片剂)、小药囊(sachet)、植入物、药物递送装置、薄膜等。
合适的半固体组合物包括凝胶剂、糊剂、乳膏剂、软膏剂、阴道剂(vagitory)、栓剂等。
合适的液体或流体组合物包括溶液、分散剂、乳剂、混悬剂、洗剂、喷雾剂、气雾剂。
适于注射的药物组合物包括无菌水性溶液或分散剂。其也可以为液体的形式,当其局部注射入例如肿瘤中时固化。其也可以为植入物、插入物或递送装置的形式。
对于肠胃外使用,该组合物可为例如液体形式,其在如水、乙醇、丙二醇、异丙醇、甘油、植物油(像例如芝麻油、花生油等)的溶剂或分散介质中的遗传载剂中含有TMZ-CD154。可添加添加剂,像例如缓冲剂、pH调节剂、增溶剂、稳定剂、防腐剂等。此外,其可含有赋形剂,所述赋形剂对于待注射的组合物是可药用的。这些可特别地为等渗、无菌的盐水溶液(磷酸盐、氯化钠),或者干燥的,尤其是冻干的组合物,依据情况添加无菌水或生理盐水或者其他溶剂或分散介质后,其重构为待用的组合物。
有利地,这些添加剂可溶解于溶剂中。为增强稳定性,将该组合物填入小瓶中后可将其冷冻并在真空下去除水。然后,将该干燥的冻干粉末密封于小瓶中并可提供配套的注射用水小瓶以在使用前重构该液体。
所述组合物也可以冷冻的组合物存在,在治疗前将其解冻。其可例如为含有病毒载体的组合物。这样的组合物可以以其自身使用,或可添加添加剂,如包含例如缓冲物质、pH调节剂、张力调节剂等的水性介质。
所述组合物可方便地以单位剂量形式存在并可通过制药领域中任何公知的方法制备。这样的方法包括以下步骤:将包含一种过更多种辅助成分的载体(carrier)与活性分子(由载剂携带的TMZ-CD154)缔合。一般来说,通过均匀且紧密地将活性分子与液体载体或精细粉碎的固体载体或两者缔合来制备组合物,并且之后若必要,将产物成型。
如上文所提及,包含在遗传载剂中的根据本发明的核苷酸序列或蛋白质(例如TMZ-CD154)可以以药物组合物的形式经口施用。根据待治疗的病症和患者以及施用途径,可以以不同的剂量施用组合物。
例如,本发明的化合物可以以片剂、胶囊剂、珠剂(ovules)、酏剂、溶液或混悬剂的形式经口、口腔含化或舌下施用,其可含有矫味剂或着色剂,以立即、延缓或控制释放地施加。
这样的片剂可含有赋形剂如微晶纤维素、乳糖、柠檬酸钠、碳酸钙、磷酸氢钙和甘氨酸,崩解剂如淀粉(优选玉米、马铃薯或木薯淀粉)、乙醇酸淀粉钠、交联羧甲基纤维素钠和某些复杂的硅酸盐,以及制粒粘合剂如聚乙烯吡咯烷酮、羟丙基甲基纤维素(HPMC)、羟丙基纤维素(HPC)、蔗糖、明胶和阿拉伯胶。此外,可包含润滑剂如硬脂酸镁、硬脂酸、山嵛酸甘油酯和滑石。
也可利用相似类型的固体组合物作为明胶胶囊中的填料。该情况下优选的赋形剂包括乳糖、淀粉、纤维素、奶糖(milk sugar)或高分子量聚乙二醇。对于水性混悬剂和/或酏剂,本发明的化合物可与多种甜味剂或矫味剂、着色物质或染料组合,与乳化剂和/或悬浮剂组合以及与稀释剂(例如水、乙醇、丙二醇和甘油)组合,及其组合。
可通过压制或模制,任选地用一种或更多辅助成分制作片剂。可通过在合适的机器中将自由流动形式的活性成分压制来制备压制的片剂,所述形式如散剂或颗粒剂,其任选地与粘合剂(例如聚维酮、明胶、羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如乙醇酸淀粉钠、交联聚维酮、交联羧甲基纤维素钠)、表面活性剂或分散剂混合。可通过在合适的机器中将用惰性液体稀释剂润湿的粉末化化合物的混合物模制来制得模制的片剂。该片剂任选地可被包被或划痕(score)并可如此配制以提供活性成分的缓慢或受控的释放,其中以多种比例使用例如羟丙基甲基纤维素以提供所需的释放谱。
根据本发明所使用的适合用于经口施用的组合物可以以分散单位存在,如胶囊剂、囊剂(cachet)或片剂,每个均含有预定量的活性成分;以散剂或颗粒剂存在;以水性液体或非水性液体中的溶液或混悬剂存在;或者以水包油的液体乳剂或油包水的液体乳剂存在。活性成分也可以大丸剂(bolus)、冲剂(electuary)或糊剂存在。
应当理解的是,除了上文特别提到的成分之外,关于考虑的制剂类型,本发明的制剂可包含本领域中其他常规的物质,例如适用于经口施用的制剂可包含矫味剂。
如本文的实施例中所示,根据本发明的核苷酸序列可用于组合物中,其为水性组合物的形式,其中水性介质为通常用于注射的生理可接受的介质。这样的水性介质可为0.9%的氯化钠、林格氏溶液或Tris/甘油缓冲溶液。
当通过病毒递送TMZ-CD154时(例如参见本文的实施例),含有根据本发明的核苷酸的病毒可通过超速离心(使用例如氯化铯)纯化,并将浓缩的病毒透析至Tris/甘油缓冲溶液中(含有20mM Tris,25mM氯化钠,2.5%w/v甘油,pH调节至pH 8.0)。因此,将核苷酸在该缓冲液中施用,并且如果必要,可将该缓冲液用相同的Tris/甘油缓冲溶液或用于体内施用的合适溶液(例如一种或其他上述溶液)稀释。
本领域技术人员将能够基于本文的公开内容和/或在Remington’s Pharmaceutical Sciences,第18版.Mack Publishing Company,1990或更新的版本的指导下制备适于根据本发明使用的组合物。
本发明的药物组合物也可含有与本文提及的一种或更多种免疫调节物相组合的TMZ-CD154或与本文提及的一种或更多种其他治疗活性剂相组合的TMZ-CD154。这样的组合物可含有相同制剂中的所有活性因素(例如,以单位剂量的形式,该单位剂量含有所有活性分子),或者其可为包装的形式,其含有一组制剂,每个均含有一种或更多种的活性分子(例如以包装的形式含有两个不同的制剂,一个含有载剂中的TMZ-CD154,而另一个含有其他活性分子;或者以包装的形式含有例如两个不同的制剂,其中一个含有载剂中的TMZ-CD154和免疫调节物,而另一个含有另外的活性分子)。
TMZ-CD154分子的待施用剂量将根据具体的分子、包含该分子的载剂、涉及的疾病、对象、疾病的性质和严重性、对象的生理状况、以及所选择的施用途径而变化。
合适的剂量可由本领域技术人员容易地确定。
根据施用方法和TMZ-CD154的形式(例如,用作蛋白质或基因疗法),组合物可含有以重量计自0.1%,优选自5%至95%,更优选以重量计自10%至60%的本发明的化合物。腺病毒载体的浓度范围可为1x10e6至1x10e14病毒颗粒每mL。如果通过瘤内注射或静脉内输注施用,每个治疗的建议剂量可优选地为1x10e9至1x10e13病毒颗粒每mL。
本领域技术人员将认识到,本发明化合物个体剂量的最优量和间隔将由所治疗的病症的性质和程度,施用的形式、途径和部位,以及所治疗的具体对象的年龄和状况确定,并且医师将最终确定合适的待使用剂量。该剂量可以以尽量合适的频率重复。如产生副作用,则可根据通常的临床实践改变或减少给药的量和/或频率。
在下文对TMZ-CD154在医药中,尤其是在癌症免疫疗法中的用途进行了举例说明。
癌症免疫疗法
肿瘤免疫学和癌症免疫疗法
免疫系统可通过与其识别并杀伤病毒感染的细胞以拯救宿主抵抗致命性感染的相同机制识别并杀伤肿瘤细胞。类似于病毒感染的细胞,肿瘤细胞为自体细胞,并且病毒或肿瘤相关表位存在于细胞上的主要组织相容性复合体I(major histocompatibility complex I,MHC-1)上,对应于CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)。病毒感染的细胞和肿瘤细胞两者均可通过下调MHC分子阻止CTL识别,MHC分子使得该细胞成为天然杀伤(NK)细胞的靶标。然而,病毒起始活化先天免疫防御应答,改变抗原呈递细胞如树突状细胞(DC)以活化抗病毒免疫,而肿瘤细胞不诱导相同程度的刺激。事实上,在癌症进展期间,肿瘤和其基质产生抑制免疫细胞的物质。通过阻断DC成熟并且促进分化以及吸引免疫抑制性细胞至肿瘤微环境而限制肿瘤免疫。这些抑制性细胞通常为M2巨噬细胞,多种未成熟髓样细胞(统称为骨髓来源的抑制细胞(myeloid-derived suppressor cell,MDSC))以及调节性T细胞(Treg)。这样的细胞产生抑制性细胞因子和生长因子如IL10、TGFβ、前列腺素E2、精氨酸酶I和骨髓过氧化酶。在肿瘤微环境中,活化的CTL迅速地被这些因子抑制而变为无反应性的(可逆的未应答状态),或死亡。
癌症免疫疗法的关键是破坏肿瘤耐受性(例如,破坏无反应性)并将进行中的2型免疫应答转变为1型。1型的特征在于T辅助细胞1(Th1)淋巴细胞、CTL、NK细胞以及M1巨噬细胞的活化,以及在于细胞因子库,如IFNγ、IL12、IL21以及TNF。
最近将靶向CTLA4和PD1/PDL1的检查点阻断抗体用于黑素瘤和其他实体恶性肿瘤以及将嵌合抗原受体(chimeric antigen receptor,CAR)T细胞用于B细胞恶性肿瘤的成功极大地加强了癌症免疫疗法领域。通过刺激免疫系统以治疗癌症的新概念目前正得到研究。这些概念之一是利用溶瘤病毒作为基因递送载剂的免疫刺激基因疗法。
免疫刺激基因疗法
免疫刺激基因疗法的目的在于将编码免疫刺激蛋白质的基因转移至肿瘤区域中。第一个在实验模型中使用免疫刺激基因疗法的研究以有前景的结果发表于九十年代末。在临床试验中也使用了不同的方法但许多未能表现出功效。然而,这些研究是在这样的知识得以增加之前进行的,即浸润肿瘤的抑制性免疫细胞以及使用降低这些免疫抑制性细胞水平的预条件化或支持性的化学疗法辅助免疫应答的可能性。此外,相比于传统的化学疗法或辐照,对免疫疗法的应答按照不同的过程。由于炎症引起的肿瘤的起始肿胀可能被错误地解释为导致治疗过早中断的进程。预条件化/支持性化学疗法与对如何解读数据的了解的组合将有可能如其对其他免疫疗法所具有的作用那样为免疫刺激基因疗法铺平道路。相比于可溶性免疫刺激细胞因子、生长因子和抗体的全身性递送,基因疗法可根据所使用的载体经过数天至数周表达免疫刺激转基因从而递送至确切的部位。这导致肿瘤中的高浓度免疫刺激蛋白质,减少了由于对于自体细胞耐受性的非必要撤销而造成的毒性,该毒性可见于全身性免疫活化后。
通过使用非常多种载剂将治疗性的免疫刺激基因递送至肿瘤。通常使用复制缺陷的腺病毒,因为其可携带大的转基因盒。不幸的是,因为腺病毒不整合入宿主细胞的基因组中,所以转基因表达的持续时间是有限的。整合的缺少增加了安全性,因为宿主细胞诱变的风险不太可能存在。此外,人类对于操作腺病毒感染的设备齐全。例如,大多数个体由于腺病毒而患有上呼吸道感染并且已产生了针对若干血清型的抗体,并且T细胞对所有均有交叉反应。对于免疫刺激基因疗法,病毒的免疫刺激作用可通过活化载有肿瘤抗原的DC上的TLR辅助形成抗肿瘤应答。然而,在瘤内递送后,病毒感染针道中的细胞,并且需要提高病毒的感染以延长转基因的表达。这可通过使用溶瘤病毒作为基因递送载剂来达到。
溶瘤病毒(OV)疗法
某些病毒感染细胞、增殖并在释放新的病毒体的过程中通过裂解杀伤细胞的能力意味着其可用作癌症治疗剂。为了将溶瘤作用限制于肿瘤细胞,通过加入优先在肿瘤中有活性的启动子限制病毒复制基因的表达。为得到全部的受益,OV应感染全部肿瘤细胞,若肿瘤已经转移,则这可能是一个挑战。因为扩散至远端肿瘤的全身性病毒可受到免疫系统的限制,所以正试图开发出免疫原性较弱的OV。
除了降低OV的免疫原性,另一个方法是通过向OV基因组中添加免疫刺激基因来利用并增强病毒固有的免疫刺激能力。装有免疫刺激转基因的溶瘤腺病毒成功地将它们递送至肿瘤并带有针对转移性疾病的全身性抗肿瘤免疫应答活性。组合的溶瘤和免疫刺激的全部功效难以在鼠模型中测定,因为溶瘤限于鼠细胞中而免疫刺激作用不能够在免疫缺陷小鼠的异体移植模型中评估。已经有至少一篇公开的研究对患有晚期癌症的患者使用了携带全长人CD40L基因的溶瘤腺病毒,证明了可行性和安全性。有其他正在进行的研究使用了带有GM-CSF的溶瘤病毒和带有GM-CSF(talimogene laherparepvec)的单纯疱疹病毒,其已经完成了患有黑素瘤患者的III期注册试验。
预条件化或支考性化学疗法
预条件化或支持性化学疗法经常提供给接受免疫疗法的患者以降低抑制性肿瘤基质细胞如Treg和MDSC,否则其可阻碍预期的免疫活化。此外,化学疗法诱导的淋巴细胞或髓样细胞消耗可诱导骨髓细胞因子的产生,其恢复免疫细胞群(即通过稳态复制),并有利于抗肿瘤应答的活化。根据诊断和化学疗法的类型,肿瘤生长也可受到影响。已经对进行免疫疗法的患者提供了节拍式(metronomic)环磷酰胺以试图控制抑制性免疫细胞。这样的支持性化学疗法方案如果不减弱所需的抗肿瘤应答,则可具有重要的价值。所关注的该支持性化学疗法之一可能是吉西他滨。
吉西他滨为核苷模拟物,其在DNA复制期间替换胞苷,并导致生长停滞和凋亡。吉西他滨也靶向核糖核苷酸还原酶,从而阻断该酶的功能。目前其作为手术的辅助治疗以及作为对晚期肿瘤的单独治疗两者是胰腺癌护理的标准。尽管吉西他滨对晚期转移肿瘤的治疗仅仅是姑息的,然而若干研究,包括我们自己的研究,已经表明用吉西他滨治疗的患者具有显著更低水平的免疫抑制分子TGF、Treg和MDSC,而DC、单核细胞和活化的T细胞的数目则提高。最近示出,吉西他滨减少了MDSC向肿瘤的募集并加速了抗肿瘤T细胞应答的发生,这辅助了与溶瘤呼肠孤病毒的联合疗法。在小鼠中,吉西他滨减少了MDSC并增强了免疫疗法的功效。
因此,吉西他滨护理标准与免疫疗法的组合可能对于这些患者是有益的。
包含TMZ-CD40L的研究性产品LOAd703
LOAd703是针对癌症的新型免疫疗法。其为溶瘤腺病毒血清型5,具有来自于血清型35的纤维(轴和节)(Ad5/35)以提高与细胞的结合并从而提高其感染性。由于E1A上游的E1Ad24和多个E2F结合结构域,病毒复制和溶瘤作用被限制于具有功能障碍的视网膜母细胞瘤(Rb)通路的细胞。Rb在正常细胞中结合转录因子E2F从而阻断其诱导促使细胞周期从G1向S期转变之基因的转录的固有能力。在Rb磷酸化后,E2F被释放以刺激细胞增殖。人肿瘤具有广泛的改变Rb蛋白和/或因子的突变,所述Rb蛋白质和/或因子导致Rb的高磷酸化。因此,在肿瘤细胞中,E2F自由地驱动病毒的转录。由于过量的病毒复制,该病毒感染并通过溶瘤作用杀伤肿瘤细胞,而健康的非恶性细胞可被感染但不会产生新的病毒颗粒。因此,LOAd703不会杀伤健康的细胞。LOAd703具有带有两个免疫刺激基因(TMZ-CD40L和4-1BBL)的转基因盒,其由CMV启动子驱动。所述CMV启动子不是受限于组织的并且所述免疫刺激基因可在所有被LOAd703感染的细胞中表达。因此,LOAd703靶向肿瘤和其基质两者。因为该病毒通过瘤内注射施用,所述该转基因的表达位于肿瘤区域。
示意性基因构建体
LOAd703的复制通过E1AΔ24控制,E1AΔ24将病毒的复制限制在具有受干扰的(高磷酸化的)视网膜母细胞瘤蛋白的细胞中,该蛋白质通常见于恶性细胞中。此外,E2F启动子区域和Sp-1位点已插入于E1A之前。这些复制限制将促进病毒在肿瘤细胞中复制并最终驱动肿瘤进入溶瘤作用并死亡。LOAd703病毒可感染正常细胞但不会复制或杀伤正常细胞。另一些修饰包括E3区域中的6.7K和gp19K缺失。6.7K抑制细胞中的TRAIL受体1和2,而gp19K在内质网(endoplasmatic reticulum,ER)中捕捉MHC。共同地,这二者减弱T细胞识别并杀伤病毒感染的细胞的能力。因为LOAd703的目的是增强免疫原性,所以这些区域被从腺病毒基因组中去除。将位于L5区域中的血清型5纤维轴和节区域改变为来自于血清型35病毒的轴和节区域,这提高了病毒的转导,因为35纤维结合于丰富地表达于正常和恶性人细胞两者上的受体CD46,而Ad5纤维限制于对于柯萨奇病毒-腺病毒受体呈阳性的细胞。在L5区域之后,插入了由巨细胞病毒启动子(pCMV)驱动的具有TMZ-CD40L和4-1BBL基因的转基因盒。当细胞感染后,LOAd703病毒将因此诱导TMZ-CD40L和4-1BBL的表达。该表达由CMV启动子驱动并且不依赖于病毒复制。在瘤内注射后,在肿瘤内任何被感染的细胞可表达该转基因。
TMZ-CD40L转基因为经修饰的人CD40配体(CD40L;CD154),其缺少胞内信号传导结构域并替代地将胞外和跨膜结构域与异亮氨酸拉链融合。这创建了膜结合的三聚化CD40L分子,其在TMZ-CD40L表达细胞中缺少胞内信号传导,但仍然结合并将信号传递至其他表达其受体CD40的细胞。在病理条件下,即当细胞受到胁迫或活化时,CD40L通常表达于许多细胞类型上。CD40L对CD40+细胞的刺激导致基于CD40+细胞的身份的不同作用。未成熟DC表达CD40并且在CD40L刺激后,该DC分化为成熟的表型,其表达增强水平的主要组织相容性复合体(MHC)分子、共刺激分子和细胞因子。这样的成熟DC是优异的T细胞(Th1和CTL)、NK细胞和M1巨噬细胞的刺激物。CD40+内皮细胞提高了对于T细胞连接与血细胞渗出重要的分子的表达,从而促进了T细胞的募集。然而,CD40+肿瘤细胞具有偏斜的(skewed)CD40胞内信号传导通路并且在CD40L刺激后,大多数肿瘤细胞的生长受到抑制或进入凋亡。此外,在用CD40L基因疗法(AdCD40L)治疗的膀胱癌患者中,CD40L介导的信号传导在肿瘤的微环境中可间接降低Treg的水平。在鼠模型中,髓样细胞群从抑制性CD11b+Gr1int/低和M2细胞向CD11b+Gr1高以及M1髓样细胞倾斜。
4-1BB配体(4-1BBL;CD137L)转基因为全长人4-1BBL基因。其与表达于活化的T细胞和NK细胞上的其受体4-1BB(CD137)结合。4-1BBL对T细胞和NK细胞的刺激通过凋亡抑制剂(如BCL-xL)的上调保护细胞免于活化诱导的细胞死亡(AICD)。4-1BBL刺激也促进有效的淋巴细胞增殖。41BBL是CTL和NK细胞两者的良好的体外刺激物,但对于肿瘤模型中的体内功效,41BBL与其他免疫增强物的组合似乎是关键的。在描述于下文中的我们的临床前实验设置中,CD40L与4-1BBL刺激的组合,以及腺病毒骨架对Toll样受体(TLR)的刺激有效地刺激了DC、T细胞和NK细胞。
因此,LOAd703表达CD40L和4-1BBL,并且因此具有两个主要的效应机制:1)通过溶瘤作用或CD40介导的凋亡诱导细胞死亡,以及2)通过CD40L、41BBL和腺病毒骨架活化免疫系统。主要的效应物臂可能是免疫活化,但通过溶瘤作用诱导的细胞死亡由于释放肿瘤抗原导致肿瘤抗原特异性免疫刺激,进一步强化了抗肿瘤应答。
缩写
aCTLA4 抗细胞毒性T淋巴细胞抗原4
Ad 腺病毒
AICD 活化诱导的细胞死亡
CD 分化簇
CD40L CD40配体,CD154
CMV 巨细胞病毒
CTL 细胞毒性T淋巴细胞
DC 树突状细胞
GM-CSF 粒细胞巨噬细胞集落刺激因子
IFNg 干扰素γ
IL 白细胞介素
LOAd Lokon溶瘤腺病毒
MDSC 骨髓来源的抑制细胞
NK 天然杀伤
PCR 聚合酶链式反应
PDAC 胰腺导管腺癌
PD1 程序性死亡受体1
PDL1 程序性死亡受体配体1
Rb 视网膜母细胞瘤
TCR T细胞受体
TGFb 转化生长因子β
Th T辅助细胞
TLR Toll样受体
TMZ-CD40L 三聚化膜结合CD40L
TNFa 肿瘤坏死因子α
Treg 调节性T细胞
VP 病毒颗粒
4-1BBL 4-1BB配体,CD137配体
定义
Ad5/35:术语“Ad5/35”意指溶瘤血清型5腺病毒载体,其中纤维和轴的节来自于Ad血清型35。
抗原:术语“抗原”为由T细胞通过T细胞受体、嵌合抗原受体或其等同物识别的靶标。
cDNA:术语“cDNA”意指DNA分子,其可通过逆转录从获自细胞的成熟、经剪接的mRNA分子制备。cDNA缺少可存在于对应基因组DNA中的内含子序列。起始的、主要的RNA转录本为mRNA的前体,其在表现为成熟的经剪接的mRNA之前通过一系列步骤(包括剪接)进行加工。
编码序列:术语“编码序列”意指多核苷酸,其直接地确定TMZ-CD154或其变体的氨基酸序列。编码序列的边界通常通过开放阅读框确定,其以起始密码子如ATG、GTG或TTG开始并以终止密码子如TAA、TAG或TGA结束。编码序列可为基因组DNA、cDNA、合成DNA、或其组合。
表达:术语“表达”包括任何涉及TMZ-CD154的产生的步骤,包括但不限于,转录、转录后修饰、翻译、翻译后修饰,以及分泌。
宿主细胞:术语“宿主细胞”意指任何细胞类型,其对于用核酸构建体或包含如本文所述的多核苷酸的转化、转染、转导等易感。
有效地连接:术语“有效地连接”意指这样的构造,其中控制序列位于相对于多核苷酸的编码序列合适的位置上,以使得所述控制序列指导所述编码序列的表达。
复制起点:术语“复制起点”意指在基因组中复制起始的特定序列。其可涉及活生物体(如原核生物和真核生物)的DNA的复制,或者病毒(如双链RNA病毒)中的DNA或RNA复制。
能够复制的病毒载体:术语“能够复制的病毒载体”为能够以其自身方式在任何其感染的细胞中或在特定来源的细胞中复制的病毒。
复制缺陷的病毒载体:术语“复制缺陷的病毒载体”为由于涉及病毒复制的基因缺失而不能够以其自身方式复制的病毒。
序列同一性:术语“序列同一性”意指两个氨基酸序列或两个核苷酸序列之间的相关性。核苷酸查询的算法:blastn、megablst、discontiguous megablast。蛋白质查询的算法:blastp、psi-blast、phi-blast、delta-blast。
病毒载体:术语“病毒载体”意指将遗传材料递送至细胞中的工具。
术语“包含/包括”应以广泛含义理解,但涵盖术语“含有”、“由...组成”并与分子结构相联系,该结构可展示为,即没有任何其他要素。
附图说明
图1:A)示意图,其证明TMZ-CD154分子。B)示意图,其证明在细胞质膜(PM)上的三聚化TMZ-CD154分子,其与或不与相邻靶细胞上的CD40受体相互作用。
图2:用含有TMZ-CD154的质粒或空模拟质粒转染293细胞。A)培养2天后,将细胞裂解并通过凝胶电泳和Western印迹分析蛋白质混悬液以检测TMZ-CD154。将样品分为2组,其中第一组在还原样品缓冲液(R)中煮沸,而另一组不煮沸并在凝胶电泳之前与非还原样品缓冲液混合。B)培养2天后将一部分细胞通过流式细胞术分析以证明TMZ-CD154表达。C)使用ELISA分析来自用表达TMZ-CD154、野生型CD154或无转基因(模拟)的Ad5/35病毒转导的Panc01、BxPc3、MiaPaca2和PaCa3细胞的上清液,分析可溶性CD154向上清液中的释放。D)使用腺病毒血清型5/35用TMZ-CD154分子转导T细胞。对照未经转导或用空(模拟)病毒转导。将细胞在具有或不具有IL2下培养48小时。
图3:将树突状细胞(A)和MiaPaCa2(B)细胞用100MOI的Ad5/35-TMZ-CD154病毒(红色线)、模拟病毒(绿色线)转染或不转染(灰色线)。也用2种其他形式的与4-1BBL(橙色线)或scFv aIL6R(蓝色线)组合的Ad5/35-TMZ-CD154病毒转导DC。24小时后,通过流式细胞术分析细胞的TMZ-CD154的表达。未转导或模拟转导的细胞不表达TMZ-CD154,而Ad5/35-TMZ-CD154转导的细胞证明了稳健的表达,相比于DC其在肿瘤细胞中表达更高。
图4:用Ad5/35-TMZ-CD154条件性能够复制的(溶瘤)病毒(CRC)、模拟溶瘤病毒(CRC)、复制缺陷模拟病毒(RD)转导胰腺癌肿瘤细胞系或不转导。将转导的细胞种接种于96孔板中并使用MTS生存力测定分析存活以通过以下的溶瘤作用确定细胞死亡的水平:A)Panc01、B)MiaPaCa2或C)BxPC3。D)对淋巴瘤细胞系(Karpas 422)进行相同的测定。
图5:将未成熟树突状细胞与293细胞共培养,用TMZ-CD154、可溶性三聚化(st)CD154(CD40L)、多聚化可溶性CD154(CD40L)或模拟质粒转染,或不转染。共培养2天后,通过流式细胞术分析细胞的CD83表达(A)。收集上清液并使用ELISA分析IL-12表达(B)。
图6:将未成熟树突状细胞用Ad5/35-TMZ-CD154病毒或模拟病毒转导或不转导(仅DC)。培养2天后,通过流式细胞术分析细胞的HLA-DR、CD86、CD70和CD83表达(A)。收集上清液并使用ELISA分析IL-12表达(B)。
图7:将来自于CMV+供体的单核细胞与树突状细胞培养,所述树突状细胞用Ad5/35-TMZ-CD154病毒转导并用CMV pp65肽脉冲11天。在第11天通过流式细胞术分析细胞的CD3+CD8+四聚体+CMV-特异性T细胞的存在。仅0.5%的T细胞在培养前为CMV特异性的,而在培养后超过60%的T细胞为CMV特异性的。
图8:将来自于马的单核细胞用具有人CD154基因的腺病毒载体转导并培养。一周后,相比于模拟转导细胞(左),淋巴细胞群扩增(A,右)。收集上清液并使用抗马MCP-1ELISA分析。模拟病毒活化MCP-1但CD154病毒提供改善的表达。
图9:将Panc01细胞系经皮下在缺少功能免疫系统的Nu/Nu小鼠中生长。向肿瘤注射1x的表达TMZ-CD154的1x10e9VP溶瘤腺病毒或PBS。示出了自病毒注射的时间内的%肿瘤生长。
图10:用含有与4-1BBL(A,B)或aIL6R scFv(C,D)组合的TMZ-CD154的质粒转染293细胞并通过流式细胞术分析CD154(A,C)或4-1BBL(B)的表达。通过ELISA分析表达具有myk-标签之aIL6R scFv的细胞的上清液以确定aIL6R的表达(D)。
图11:用具有与4-1BBL相组合的TMZ-CD154的Ad5/35病毒转导DC,或者细胞不经转导或用空模拟病毒转导。共培养2天后通过流式细胞术分析细胞的TMZ-CD154和4-1BBL表达。
图12:用仅具有TMZ-CD154或具有与4-1BBL或aIL6R scFv相组合的TMZ-CD154的Ad5/35病毒转导人未成熟树突状细胞,或者细胞不经转导或用空模拟病毒转导。共培养2天后通过流式细胞术分析细胞的CD83表达。
图13:用仅具有TMZ-CD154或具有与4-1BBL或aIL6R scFv相组合的TMZ-CD154的Ad5/35病毒转导人未成熟树突状细胞,或者细胞不经转导或用空模拟病毒转导。共培养2天后通过流式细胞术分析细胞的CD70表达。
图14:用仅具有TMZ-CD154或具有与4-1BBL或aIL6R scFv相组合的TMZ-CD154的Ad5/35病毒转导人未成熟树突状细胞,或者细胞不经转导。共培养2天后通过luminex分析上清液以比较组之间IFNg(A)、IL12(B)、TNFa(C)和IL21(D)的水平。
图15:由单核细胞扩增CMV特异性T细胞,所述单核细胞通过扩增具有经转导的树突状细胞的CD14-细胞由CMV阳性血液供体制备,所述树突状细胞用CMV pp65肽脉冲。用模拟病毒、仅具有TMZ-CD154或具有与4-1BBL或aIL6R scFv相组合的TMZ-CD154的Ad5/35病毒转导所述树突状细胞。在第11天,收获细胞并使用流式细胞术对四聚体阳性(CMV特异性)T细胞的百分比进行分析,并与A中扩增前的值进行比较。在B中,示出了不同组中的扩增细胞的总数。含有TMZ-CD154和4-1BBL两者的Ad5/35病毒(LOAd703)也可在培养物中扩增NK细胞(C)。
图16:将胰腺细胞系PaCa3单独培养或与100μM吉西他滨培养(G)。也用仅表达TMZ-CD154或表达与4-1BB配体或aIL6R scFv相组合的TMZ-CD154的Ad5/35病毒转导PaCa3细胞。最后,用100μM吉西他滨培养经转导的细胞。将细胞接种于96孔板中并使用MTS生存力测定分析存活以确定通过溶瘤作用、通过吉西他滨、或者通过溶瘤作用与吉西他滨组合的细胞死亡水平。*表示p<0.05的差异。B)Panc02鼠胰腺肿瘤细胞在C57BL6小鼠中生长并用携带TMZ-CD154+4-1BBL的溶瘤病毒处理,每周2次,6x+/-每周(3x)吉西他滨(25mg/kg)。示出了肿瘤生长。C)如上述的(A)转导Panc01人胰腺细胞,并用或不用紫杉醇(2μM)培养。*表示p<0.05的差异。
图17:用携带鼠CD154基因的腺病毒载体的1瘤内输注处理具有生长中的MB49膀胱癌肿瘤细胞的C57BL/6小鼠。24小时后取组织活检物以进行免疫组织化学通过共焦显微术检测CD11b和GR-1细胞(A),并在机械破裂为单个细胞混悬液后进行流式细胞术检测CD3+CD107a+肿瘤浸润的T细胞。
图18:用含有具有或不具有4-1BBL或aIL6R之一的TMZ-CD154的Ad5/35病毒转导人内皮细胞(HUVEC),或用不具有转基因的病毒(模拟)转导,或不转导。培养48小时后通过流式细胞术分析细胞的E选择素和ICAM-I表达,E选择素和ICAM-I对于淋巴细胞连接和经由内皮向发炎组织的血细胞渗出是重要的。
图19:溶瘤作用限制于肿瘤细胞。用LOAd703、缺少转基因的LOAd(-)病毒,以及经由E1/E3缺失而缺少复制能力的Ad5/35模拟病毒转导肿瘤细胞(图中示为Panc01)和健康的对照外分泌胰腺细胞,或不转导。将细胞在96孔板中重复地培养并使用MTS测定分析生存力。低生存力导致低吸光度。
图20:血液循环模型中的毒性测试。测试来自5个健康供体血液对LOAd703的反应性。血液在不影响补体的肝素化循环(2ml/循环)中循环4小时。在测定之前以及以高剂量(1x10e8VP)或低剂量(1x10e7VP)添加LOAd703之后4小时取血浆样品。作为阴性对照,将PBS添加至循环并将抗CD28抗体用作阳性对照。AdCD40L为LOAd703的相似病毒,其已用于临床并以高剂量(1x10e8VP)测试。
图21:用AdCD40L处理在C57BL6小鼠中皮下生长的B16肿瘤,其后输注识别B16肿瘤的pmel T细胞。然后通过流式细胞术分析肿瘤的T细胞的存在。A)pmel T细胞可浸润肿瘤,然而,若用AdCD40L(组合)预处理肿瘤,则pmel T细胞的浸润显著提高。B)在AdCD40L处理的肿瘤中,相比于未用AdCD40L预处理的肿瘤,天然的和pmel T细胞两者均提高,并且它们表达活化标志物CD107a。
图22:以剂量水平一1x10e11 VP和剂量水平二5x10e11 VP使用Ad5/35-TMZ-CD154/4-1BBL(LOAd703)的单剂量疗法的处理时间表。蓝色和白色框代表1周。
图23:以剂量水平5x10e11 VP使用Ad5/35-TMZ-CD154/4-1BBL(LOAd703)的重复剂量疗法的处理时间表。蓝色和白色框代表1周。
本发明以下文的非限制性实施例进行举例说明。
实施例
材料和方法
TMZ-CD154基因序列
为了例示本文所限定的TMZ-CD154分子的基因序列,我们已经构建了人、马、犬和猫的这样的TMZ-CD154基因序列。
SEQ ID NO:1(DNA),SEQ ID NO:2(蛋白质)
人
人三聚化膜结合CD154
1-9 Kozak序列
10-108 异亮氨酸拉链
109-126 接头
127-198 跨膜结构域人CD154
199-846 胞外结构域人CD154
CD154之tm和ec结构域的氨基酸序列标记为灰色
SEQ ID NO:3
马TZM-CD154(粗体为CD154结构域)
TMZ-CD154马氨基酸序列
SEQ ID NO:4
犬TZM-CD154(粗体为CD154结构域)
TMZ-CD154犬氨基酸序列
SEQ ID NO:5
猫TZM-CD154(粗体为CD154结构域)
TMZ-CD154猫氨基酸序列
质粒构建
通过AcaClone使用免费的pDraw32软件构建基因序列,然后用在5’基因和腺病毒侧翼区前的CMV启动子(也含有限制性位点5’SspI和3’ScaI)合成以用于在两端同源重组至腺病毒载体中。当用质粒转染实现基因表达时,在3’Ad侧翼区后合成Poly A位点。在GenScriptInc.合成基因片段并亚克隆至pUC57-Kan质粒中。
腺病毒载体构建
用SspI和ScaI酶消化具有转基因盒的pUC57质粒,并通过标准凝胶电泳和纯化分离条带。将基因盒通过同源重组插入腺病毒骨架质粒中。将具有正确插入物的集落扩增并用限制性模式分析和测序确认基因序列。将具有基因盒的腺质粒(adenoplasmid)转染至293细胞中以产生病毒。在A549细胞上进行噬菌斑测定以产生单病毒克隆。在A549细胞上进一步扩增病毒并用CsCI梯度离心纯化。将最终的病毒颗粒在20mM TRIS、25mM NaCl和2.5%的甘油中配制。测定物理(O.D.)效价和功能效价(抗六邻体染色)。
细胞系
细胞系HEK 293、B16和A549购自ATCC,而Karpas 422、PancO1、MiaPaCa2、PaCa3和BxPC3为来自Karolinska研究所的友好馈赠。MB49细胞系是来自新加坡国立大学医院的馈赠。293细胞在来自于Life Technologies之基于DMEM的培养基(10%FBS、1%除虫链霉素、0.1%丙酮酸钠)中培养。A549培养于Roswell Park Memorial研究所(RPMI)1640培养基GlutaMAXTM中,其补充了10%FBS、1%PeSt、1%HEPES和0.1%丙酮酸钠。MiaPaca2和PanC01培养于具有10%FBS和1%PeSt的DMEM中。BxPC3培养于补充了1%FBS和1%Pest的RPMI 1640培养基GlutaMAXTM中。细胞生长培养基中的所有组分均来自于Life Technologies。
Buffy包衣的制备
Buffy包衣购自Uppsala大学医院血液库。通过ficoll离心制备单核细胞。简言之,用磷酸盐缓冲盐水(PBS)1∶1稀释buffy,并温和地添加至含有10mLficoll的50mLFalcon管中而不使这两层混合。将管以1500rpm不间断地离心20分钟。之后通过抽吸将白血细胞层转移至新管并用PBS离心洗涤。将所制备的细胞新鲜地使用或在含有DMSO的冷冻培养基中冷冻于液氮箱中以供未来使用。
未成熟树突状细胞的制备
根据来自制造商(Miltenyi Biothech)的方案,使用MACS珠系统CD14微珠从来自buffy包衣制备物的单核细胞分选CD14+单核细胞。将CD14-细胞(包括T细胞)冷冻。然后将CD14+细胞于RPMI培养基(10%FBS、1%青霉素/链霉素)中稀释至1x10e6细胞/mL的浓度。分别添加GM-CSF和IL-4至终浓度50ng/mL和25ng/mL。一周内每两天添加具有GM-CSF和IL-4的新鲜培养基。培养一周后,单核细胞分化为未成熟的CD14-CD1a+树突状细胞。
T细胞的刺激
用OKT-3(抗CD3)抗体(1μg/ml)和IL2(100U/ml)刺激外周血单核细胞。第3天,T细胞已扩增并如下所述用腺病毒载体转导,并且将细胞用或不用新鲜的IL2培养48小时。
使用质粒的转染
用PBS离心(1500rpm,5分钟)洗涤293细胞。将细胞(0.75x10e6/组)在培养基中重悬并接种在6孔板中,并且培养过夜。第二天,将5μg的质粒混合入8μL聚乙烯亚胺的100μL OptiMEM(Life Technologies)混悬液中并孵育20分钟。然后将该质粒混悬液滴加入具有293细胞的孔中。将细胞培养不同的时间点以用于FACS分析、收获上清液并与未成熟树突状细胞共培养。
使用腺病毒载体的转导
将待用腺病毒载体转导的细胞在无血清培养基中洗涤。向每个10mL锥形管加入1x10e6细胞并在1500rpm离心5分钟。弃去上清液并将细胞在约150μL每管的剩余培养基中重悬。将25ffu/细胞至100ffu/细胞的腺病毒添加至试管,其后将其在37℃细胞培养箱中以5%CO2孵育2小时。添加含有血清的细胞培养基并将细胞进一步孵育且用于不同的测定(不同时间点的流式细胞术、凝胶电泳/Westren印迹、与未成熟树突状细胞的共培养等)。
流式细胞术
将待通过流式细胞术分析的细胞在PBS中洗涤并在试管中离心以用于流式细胞术(BD Biosciences)。将上清液移除并将剩余的细胞通过涡旋重悬。将稀释于含有1%牛血清白蛋白(BSA)的PBS中的抗体或四聚体添加至细胞混悬液并在室温下孵育5分钟或在4℃孵育30分钟。检测人CD154、CD83、HLA-DR、CD86、CD70、CD14、CD1a、CD3、CD8、CD107a和4-1BB配体,以及鼠Gr-1和CD11b的抗体购自BioLegend,不相关的同种型匹配对照也是如此。CMV pp65四聚体购自Nordic BioSite。将染色的细胞用含有1%BSA的PBS洗涤并使用在PBS中的1%多聚甲醛(PFA)以总体积300μL/管固定。使用来自BD Biosciences的FACS Canto II分析细胞。使用来自TreestarInc.的FlowJo软件进行数据分析。
上清液分析
分析细胞培养物上清液之来自于未转导的、转导的或转染细胞的人可溶性CD154、人IL-12、马MCP1和针对人IL-6R的scFv的释放。通过ELISA使用来自于eBioScience Inc.的sCD40L铂试剂盒分析sCD154。使用来自BioLegend的MCP1试剂盒分析马MCP1。通过自制ELISA检测IL-12p70。简言之,将96孔板用1μg/mL的来自于BioLegend的纯化抗人IL-12(p70)抗体在4℃包被过夜。通过添加具有1%牛血清白蛋白(BSA)(Sigma-Aldrich)的PBS在37℃下进行1小时封闭。然后将样品在包被的孔中于37℃下孵育2小时,之后在37℃以1μg/mL的浓度添加生物素抗人IL-12/IL-23p40抗体(BioLegend),持续1小时。在37℃将抗生物素蛋白缀合的辣根过氧化物酶(Dako A/S)以1∶4000稀释并添加至板,在暗处持续1小时。通过使用TMB(Dako)并在Emax精确微板读取仪(Molecular Devices)读取在450nm的吸光度完成该测定的显影。通过自制ELISA检测插入scFv的Myk-标签分析针对人IL-6R的scFv。简言之,将板用重组人IL-6R包被并且随后与样品孵育。在用1%BSA-PBS洗涤后将板与抗myk-HRP抗体孵育,其可在随后通过添加底物和过氧化物酶(Dako)检测。通过分光光度法分析颜色的偏移。另外,根据公司的方案使用luminex分析上清液的多种细胞因子。使用了检测以下分析物的试剂盒:IFNg、Il12、TNFa和IL21。
凝胶电泳和Western印迹
从用上述质粒转染的细胞制备裂解液。将细胞在冰冷的1xPBS中洗涤并在含有M-PER哺乳动物蛋白质提取试剂的裂解缓冲液中重悬,其补充有1%Halt磷酸酶抑制剂混合物和1%蛋白酶抑制剂混合物(Thermo Scientific)。通过Coomassie Plus蛋白质测定试剂盒根据制造商的方案测量细胞裂解液的蛋白质浓度。将10μg的样品上样于来自BioRad的凝胶上。将样品在含有巯基乙醇(还原)或不含有巯基乙醇(非还原)的样品缓冲液中混合。还将还原的样品在上样前在95℃煮沸5分钟。将凝胶在110V下运行50分钟并且使用凝胶转印堆叠(Gel transfer stack)在iBlot机器(Life Technologies)中转印至膜。将膜在室温(RT)下封闭1小时,然后向该膜添加1∶500稀释的CD154抗体(H215)(Santa Cruz Biotechnology Inc)并在4℃孵育过夜。作为二抗将山羊抗兔IgG-HRP(Life Technologies)以1∶2000的稀释度使用并在RT下孵育1小时。通过添加ECL溶液Clarity Western ECL底物(BioRad)显影膜并将其在V3Western WorkflowTM(BioRad)中曝光。
生存力测定
使用来自于Promega的CellTiter 96水性一体溶液细胞增殖测定(CellTiter 96 Aqueous One Solution Cell Proliferation Assay)(MTS)确定含有TMZ-CD154转基因的病毒的溶瘤能力。根据制造商的方案使用该测定。简言之,用病毒转导肿瘤细胞,然后将其以四个重复孔/组,10000细胞/孔接种于96孔板中。健康供体外分泌细胞获自来自于Uppsala大学医院的胰岛细胞制备物的多余材料,并用作限制性肿瘤细胞复制的对照。将板培养并在转导后的不同时间点24小时、48小时和72小时进行分析。添加20μL试剂盒的试剂并将板孵育1.5小时。通过分光光度法测量A490的吸光度。
T细胞活化及扩增
根据用于病毒转导的方案将来自CMV阳性供体的未成熟DC用不同的病毒载体转导、不转导或用TNFa(40ng/mL)和Poly IC(30μg/mL)刺激。第二天,收获细胞并转移至管,并且通过PBS离心(1500rpm,5分钟)洗涤。弃去上清液并添加CMV pp65肽(10μg)以及β2微球蛋白(1μg),此后将细胞于37℃下孵育4小时。将细胞用PBS洗涤2次,然后在培养基中稀释至浓度为1x10e5细胞/mL。平行地,解冻来自相同供体的CD14-单核细胞并用PBS离心(1500rpm,5分钟)洗涤。将细胞在培养基中稀释至浓度为1x10e6细胞/mL。将所制备的未成熟DC及CD14-单核细胞(包括T细胞)以1∶10的比例在T-25瓶中(5mL/瓶至10mL/瓶)共培养11天。在第11天通过流式细胞术分析扩增的T细胞的T细胞标志物以及对CMV pp65四聚体的反应性。
动物实验
雌性C57BL/6野生型或Nu/Nu小鼠获自Taconic M&B。将人Panc01肿瘤细胞注射至免疫缺陷的Nu/Nu小鼠中。当肿瘤可检测时,向每只小鼠肿瘤注射1x具有TMZ-CD154的1x10e9 VP病毒。在不同时间点测量肿瘤体积。将鼠Panc02肿瘤细胞注射入野生型小鼠中。用携带鼠TMZ-CD154+4-1BBL的腺病毒每周2次处理小鼠(1x10e9VP/小鼠)。吉西他滨(25mg/kg)每周给药一次。监测肿瘤尺寸。原位模型:将小鼠麻醉并插入导管(INSYTE.w24Gx3/4;BD Biosciences)。将膀胱与100μl的0.1μg/ml聚-L-赖氨酸(PLL,分子量70000至150000)(Sigma-Aldrich)预孵育以增强肿瘤细胞粘附。然后将MB49细胞(2.Sx10e5/小鼠)植入膀胱中。小鼠接受复制缺陷的鼠Ad5-CD154或Ad5-模拟物(1x10e8ffu)的局部膀胱内处理。在载体灌注之前,将膀胱用转导增强物氧氯苯磺酸WCS-90(0.1%溶液)(United-Guardian)预洗涤3次并用PBS洗涤1次。为了测定在膀胱肿瘤内的髓样细胞及T细胞的量,处理24小时后,取出肿瘤,在液氮中快速冷冻,之后染色并通过免疫组织化学评估CD11b+Gr-1+细胞的存在。将该肿瘤的一部分机械破裂为单细胞并通过流式细胞术分析以测定浸润的T细胞数目。pmel模型:B16肿瘤细胞在C57BL6小鼠中皮下生长。将小鼠分为4组。第一组仅接受作为阴性对照的PBS。第二组用AdCD40L处理,第三组用pmel T细胞处理,而第四组首先用作为pmel T细胞疗法之引发物(primer)的AdCD40L处理。Uppsala,Sweden,Dnr的地区伦理委员会批准了所有动物实验:C86/10和C54/13。
免疫组织化学
将包埋于OCT(Tissue-Tek Sakura)中的快速冷冻组织的6μm切片在冰冷的丙酮(Sigma-Aldrich)中固定10分钟并在PBS中平衡。将载片在含有10%的正常山羊血清(Dako)的PBS以及非特异性大鼠IgG2b(BD Biosciences,5μg/ml)中封闭2小时,之后与稀释于封闭溶液中的一抗(2μg/ml,PE缀合的大鼠抗小鼠CD11b(克隆M1/70,BD Biosciences),FITC缀合的大鼠抗小鼠Gr-1(克隆RB6-8C5,BD Biosciences))在RT下孵育1小时。将细胞核用2μg/ml Hoechst 33342(Sigma-Aldrich)复染,随后用PBS充分洗涤并用Fluoromount G(Southern Biotech)封片。通过使用PlanApochromat 20x/0.75物镜(Nikon)在配备了Nikon DXM 1200照相机的Nikon Eclipse E100显微镜(Nikon Instruments Europe)上获取覆盖每个样品的一个完整肿瘤切片的显微图片。用ImageJ(NIH)分析图像。为了测定CD11b+Gr-1+细胞的数目,通过手动设定阈值限定双阳性区域并且计数该区域内的细胞核和感兴趣区域(region of interest,ROI)。细胞数目表示为与总ROI相关。
血液循环模型
使全血在经肝素化的管中循环(2ml/管)。注射病毒并在孵育4小时后取样品以进行补体和细胞因子活化的分析。之前的样品用作对照。用PBS或用活化抗体抗CD28注射对照循环。
实施例1
使用质粒基因载剂的TMZ-CD154基因转移和表达
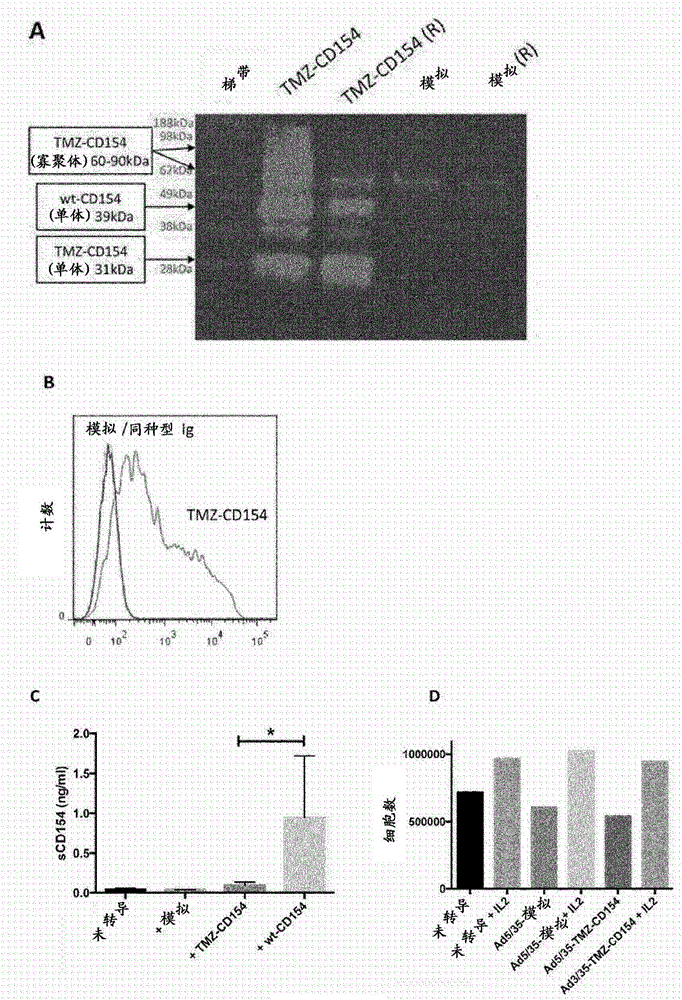
为了例示质粒基因转移系统可用于在转移TMZ-CD154基因,从而导致转染细胞中TMZ-CD154的表达,我们构建了质粒-TMZ-CD154基因载剂并测试了其递送TMZ-CD154至细胞的能力。通过将人TMZ-CD154基因插入描述于“材料和方法”中的pUC57-Kan表达质粒中构建质粒-TMZ-CD154。然后将质粒(5μg)转染入293细胞(1x106)中并在转染后第2天测定转染细胞上的TMZ-CD154表达。第一,将一部分细胞通过标准RIPA缓冲液裂解并通过凝胶电泳和Western印迹分析(图2A)。将用TMZ-CD154或模拟质粒转染的293细胞各分为2组。每组中的一个不在还原样品缓冲液中煮沸而另一个被煮沸并含有还原样品缓冲液。以此方式,该TMZ-CD154可被鉴定为单体(还原)或寡聚体(非还原)。具有模拟转染细胞的这两组均为CD154阴性。在TMZ-CD154组中,如所预期的,单体TMZ-CD154在还原和非还原两组中均可检测到。然而,比在还原组中的量少。仅在非还原组中,可检测到TMZ-CD154寡聚体。有趣的是,野生型CD154在这两组中均可检测到其单体形式,表明TMZ-CD154表达也触发野生型CD154的表达。第二,通过流式细胞术分析将剩余的细胞。使用质粒-TMZ-CD154的293细胞的转染导致稳健的TMZ-CD154细胞表面表达,而模拟对照质粒不导致TMZ-CD154表达(图2B)。第三,通过ELISA分析来自未转导或用表达TMZ-CD154、野生型CD154、或无转基因(模拟)的病毒转导的肿瘤细胞的上清液以测定CD154向培养基中的释放。结果证明,相比于野生型CD154,TMZ-CD154在细胞上清液中未大量释放(图2C)。CD154通常驱动T细胞活化和增殖。TMZ-CD154缺少胞内信号传导结构域,并且证明TMZ-CD154不会在表达TMZ-C154的T细胞中引起失控的自体增殖,在用Ad5/35-TMZ-CD154、Ad5/35-模拟物转导或不转导之前,将T细胞用OKT-3和IL2活化。将细胞用或不用IL2培养48小时,并测定细胞数目。在图2D中示出,IL2驱动T细胞的扩增而TMZ-CD154的添加不会诱导额外的增殖。T细胞不会在没有IL2的添加下,不依赖于TMZ-CD154的存在增殖。
实施例2
使用病毒基因载剂的TMZ-CD154基因转移和表达
为了例示病毒基因载剂转移系统可用于转移TMZ-CD154基因,从而导致其在细胞中表达,我们构建了基于腺病毒的基因载剂(Ad5/35-TMZ-CD154)。Ad5/35-TMZ-CD154用于转导293细胞,并且TMZ-CD154基因的表达可随后在这些细胞的细胞表面上稳健地检测到,而模拟对照病毒不能诱导TMZ-CD154表达(图3A)。
实施例3
在肿瘤细胞上的TMZ-CD154基因转移和表达
为了例示肿瘤细胞可被改造以表达TMZ-CD40L,我们使用Ad5/35-TMZ-CD154载体将TMZ-CD154转移至来源于胰腺癌的肿瘤细胞系(Panc01)。当用Ad5/35-TMZ-CD154而非用模拟对照载体转导后,该转导的细胞系表达TMZ-CD154(图3B)。如之前所示,在实验模型中表达CD154的肿瘤细胞可有效地用作肿瘤细胞疫苗(Loskog A等JU 2001),并用于刺激体外DC活化和T细胞扩增(Loskog A等CGT 2002;Loskog等JI 2004;Loskog等CII 2006)。
实施例4
评估溶瘤Ad5/35-TMZ-CD154载体的细胞杀伤功效
为了例示肿瘤细胞可被溶瘤Ad5/35-TMZ-CD154载体裂解,用Ad5/35-TMZ-CD154(MOI 100ffu/细胞)转导肿瘤细胞(A)Panc01、B)MiaPaCa2、C)BxPC3、D)Karpas-422。在第3天,在描述于“方法和材料”中的细胞生存力测定中分析细胞的生存力,并且该结果清楚地证明所述溶瘤Ad5/35-TMZ-CD154载体比使用复制缺陷病毒或相比于未转导细胞更好地杀伤肿瘤细胞(图4)。使用Panc01细胞系的情况下,具有复制能力的Ad5/35-TMZ-CD154组示出比对应的有复制能力的Ad5/35-模拟质粒增强的细胞毒性,且另两个细胞系也在TMZ-CD154组中示出该提高的细胞毒性,但差异未达到显著。该病毒在淋巴瘤细胞系Karpas-422中相同地有效。
实施例5
在树突状细胞上的TMZ-CD154基因转移和表达
为了例示抗原呈递细胞(如树突状细胞)可被TMZ-CD154活化,我们进行了人细胞的活化研究。从外周血单核细胞分选单核细胞,使用CD14MACS小珠以描述于“方法与材料”中的Buffy包被制备外周血单核细胞。然后将该单核细胞与IL-4和GM-CSF培养7天以使其分化为未成熟树突状细胞。然后将该未成熟树突状细胞与用质粒-TMZ-CD154或模拟对照转染的293细胞共培养。2天后,收获细胞和上清液并通过流式细胞术(CD83活化标志物)和ELISA(IL-12活化标志物)对树突状细胞的活化状态进行分析。结果证明,经TMZ-CD154刺激的树突状细胞成熟为活化的表型,其提高了CD83表达并产生了高水平的IL-12(图5A,B)。该结果也证明,包括TMZ-CD154的膜结合CD154诱导了更高程度的树突状细胞的活化,因为TMZ-CD154刺激的树突状细胞比三聚化可溶性(stCD40L)或多聚化形式的CD154(多聚体sCD40L)表达显著更高量的IL-12。
实施例6
用Ad5/35-TMZ-CD154转导树突状细胞
A.为了例示抗原呈递细胞(如树突状细胞)可用Ad5/35-TMZ-CD154载体转导,将未成熟树突状细胞用该载体或模拟对照转导。结果证明,用Ad5/35-TMZ-CD154转导的树突状细胞成熟为表达CD83的活化树突状细胞,从而产生IL-12(图6A,B)。该Ad5/35-TMZ-CD154活化的DC也提高了HLA-DR、CD86和CD70表达(图6A)。
B.为了例示由TMZ-CD154活化的抗原呈递细胞(如树突状细胞)可诱导抗原特异性T细胞应答(如抗病毒CMV-特异性T细胞),将用Ad5/35-TMZ-CD154或模拟对照转导的树突状细胞与pp65 CMV肽培养并且与自体T细胞共培养,如“方法和材料”中所描述。扩增11天后,通过四聚体染色和流式细胞术测定pp65特异性T细胞的水平。结果表明TMZ-CD154活化的树突状细胞能够活化并扩增pp-65特异性T细胞(图7)。
实施例7
之前已示出人表达CD154的腺病毒可诱导犬来源的免疫细胞的活化(von Euler等JIT 2008)并且在表达CD154的腺病毒的情况下马的PBMC也表现出活化,因为淋巴细胞群在病毒转导PBMC之后扩增(参见“方法和材料”)(图8A)。此外,MCP-1在转导的PBMC的上清液中增加(图8B)。
实施例8
体内肿瘤生长控制
为了例示Ad5/35-TMZ-CD154可控制体内肿瘤生长,将具有人异体移植Panc01肿瘤的小鼠用Ad5/35-TMZ-CD154或PBS 1x处理。在第7天测量肿瘤体积。结果证明,由于病毒的溶瘤能力,Ad5/35-TMZ-CD154可抑制体内肿瘤发展(图9)。该病毒的免疫学作用不能够在鼠模型中评估,因为人TMZ-CD154不与鼠CD40交叉反应。此外,该病毒在鼠肿瘤中不复制,因此,人异体移植模型必须用于免疫缺陷型小鼠。
实施例9
TMZ-CD154与其他免疫调节物在载体系统中的组合
为了例示TMZ-CD154可与其他免疫调节物组合,将质粒与腺病毒载体系统中的TMZ-CD154基因构建体与4-1BB配体基因或抗IL6R scFv的基因一起改造。
SEQ ID NO:6(DNA),SEQ ID NO:7(蛋白质)
TMZ-CD154/4-1BBL基因
1-6:Kozak序列
7-768:4-1BBL
769-831:T2A肽
832-1668:TMZ-CD154
SEQ ID NO:8(DNA),SEQ ID NO:9(蛋白质)
TMZ-CD154/aIL6R scFv基因
1-6:Kozak序列
7-59:SigPep
60-798:aIL6R scFv
799-861:T2A肽
862-1698:TMZ-CD154
实施例10
TMZ-CD154/4-1BBL/aIL 6R scFv基因在细胞中的表达
A.为了例示质粒-TMZ-CD154/4-1BBL和质粒-aIL6R scFv可用于转移TMZ-CD154/4-1BBL/aIL6R scFv基因并诱导其在细胞中的表达,将质粒-TMZ-CD154/4-1BBL和质粒-aIL6R scFv用于转染293细胞。结果证明,用以这些质粒转染后,所有转基因均可表达(图10)。参见“方法和材料”。
B.为了例示TMZ-CD154可与由2A肽分离的另一个基因反式地表达,使用Ad5/35-TMZ-CD154/4-1BBL转导树突状细胞。结果证明,用这些病毒载体转导后,这两个转基因均可表达。参见“方法和材料”。
实施例11
通过将TMZ-CD154与4-1BB配体或aIL6R scFv组合活化树突状细胞
为了例示TMZ-CD154与4-1BB配体的组合可活化抗原呈递细胞如树突状细胞,将未成熟树突状细胞用Ad5/35-TMZ-CD154、Ad5/35-TMZ-CD154/4-1BBL或Ad5/35-TMZ-CD154/aIL6R scFv载体转导,用模拟载体转导或不转导。结果证明,表达该转基因后,该经转导的树突状细胞成熟并被活化,如其CD83的表达所示(图12)。此外,相比于单独的TMZ-CD154,这些组合的病毒导致树突状细胞中上调的CD70,即便含有TMZ-CD154的病毒导致比如果树突状细胞被空模拟病毒刺激时更高的CD70表达(图13)。此外,该经转导的树突状细胞在Ad5/35-TMZ-CD154/4-1BBL组中表达更高水平的IFNg和IL12(图14)。参见“方法和材料”。
实施例12
抗原特异性T细胞的活化
为了例示由TMZ-CD154/4-1BBL的组合或TMZ-CD154/aIL6R的组合所刺激的树突状细胞可活化抗原特异性T细胞,将以Ad5/35-TMZ-CD154/4-1BBL载体或Ad5/35-TMZ-CD154/aIL6R scFv载体转导的,以pp65 CMV肽片周期性脉冲的树突状细胞与自体T细胞共培养。在11天的扩增后,测定活化的pp65特异性T细胞的数量。该结果表明,相比于特定供体的单核细胞中的抗原特异性T细胞数目,以Ad5/35-TMZ-CD154/4-1BBL或Ad5/35-TMZ-CD154/aIL6R scFv刺激的树突状细胞可活化并扩增抗原特异性T细胞(图15A)。以含有TMZ-CD154和4-1BB配体两者或aIL6R scFv的病毒转导的树突状细胞比以含有单独TMZ-CD154的病毒转导的树突状细胞在扩增后诱导更高数量的细胞(图15B)。带有TMZ-CD154和4-1BB配体两者的病毒也使培养物中的NK细胞扩增(图15C)。见“方法和材料”。
实施例13
与其他处理组合的TMZ-CD154
为了例示TMZ-CD154可与其他疗法相组合,将肿瘤细胞以Ad5/35-TMZ-CD154、Ad5/35-TMZ-CD154/4-1BBL或A5/35-TMZ-CD154/aIL6R单独地以及与吉西他滨(100μM)组合地处理。该结果证明,Ad5/35-TMZ-CD154可与其他治疗相组合,而不会失去其杀死癌细胞的能力,并且与其他治疗的组合增加了肿瘤细胞的死亡(图16A)。使Panc02小鼠胰腺肿瘤细胞在C57BL6小鼠中生长并以携带TMZ-CD154+4-1BBL的溶瘤腺病毒处理,每周2次,6x+/-每周(3x)吉西他滨(25mg/kg)。随着时间评估肿瘤生长。C)将Panc01人类胰腺细胞如上述(A)转导并用或不用紫杉醇(2μM)培养。*表示p<0.05的差异。见“方法和材料”。
实施例14
人类TMZ-CD154不能活化小鼠CD40。因此将小鼠CD154插入Ad5载体以证明在体内Ad-CD154介导的免疫活化可用于通过减少骨髓来源的抑制细胞的存在使肿瘤对T细胞治疗预敏化,所述抑制细胞允许T细胞浸润并在肿瘤微环境中存活。该结果表明,以Ad-CD154处理的肿瘤减少了骨髓来源的抑制细胞的数量(图17A)并增强其吸引和活化肿瘤浸润性T细胞的能力(图17B)。见“方法与材料”。事实上,TMZ-CD154可单独或与4-1BBL一起上调内皮细胞表面的E选择素与ICAM-I。E选择素与ICAM-I对于通过提升粘附及血细胞渗出招募淋巴细胞是重要的。
实施例15-关于LOAd703临床前数据的总述
溶瘤能力
LOAd703诱导肿瘤细胞溶瘤的能力已在一组胰腺癌细胞系中得到评估。所有以LOAd703转导的细胞系均表达TMZ-CD40L和41BBL转基因并随时间看到剂量依赖的细胞死亡。如通过流式细胞术检测膜联蛋白V所示,该细胞主要死于凋亡。然而,即使检测到转基因的表达(DC,T细胞),健康的供体免疫细胞如DC、T细胞或NK细胞也不会死于LOAd703介导的溶瘤作用。此外,LOAd703不在正常外分泌胰腺细胞中复制,证明了该OV的复制为受调控的(图19)。LOAd703的复制不限于胰腺癌细胞,也可以靶向其他肿瘤,因为大多数肿瘤具有失调的Rb通路。因此,LOAd703可有效地诱导其他来源于B细胞淋巴瘤或肺腺癌的肿瘤细胞系的溶瘤作用。另外,由于LOAd703介导的溶瘤作用造成的肿瘤细胞死亡可由化疗增强,所述化疗如通常用于患有胰腺癌之患者的吉西他滨或紫杉醇(图16)。
LOAd703用于以单一剂量或多个剂量(达6x)在建立了皮下人类胰腺癌肿瘤的异体移植小鼠中进行瘤周注射。LOAd703可诱导仅依赖于溶瘤作用的肿瘤衰退,因为异体移植模型利用了免疫缺陷小鼠。在激进的模型中(更大的肿瘤),吉西他滨可显著提升LOAd703的功效。这些数据为应当将LOAd703与用于患有胰腺癌之患者的标准护理吉西他滨组合使用提供了理论基础。
免疫刺激效果
对人类单核细胞来源的树突状细胞的LOAd703转导诱导其成熟,如细胞表面标志物(如CD83和CD70)的上调所示(图12和13)。该成熟的DC也表达并释放Th1增强性细胞因子IL12、TNFα、IL21和IFNγ(图14)。被活化的DC可继而诱导特异性T细胞反应并诱导T细胞及NK细胞两者的扩增(图15)。因此,LOAd703可有效地诱导Th1介导的针对肿瘤细胞的免疫。在全血中对LOAd703的即时反应在健康供体血液循环模型中得到了证明,其中向在体外循环的全血加入了病毒。该结果证明,LOAd703血清型5/35病毒不诱导即时的补充活化或细胞因子的释放,并与已经用于患者的编码CD40L的腺病毒血清型5病毒相当(图20)。
不幸的是,不能在动物模型中对LOAd703的免疫刺激效果进行研究,因为小鼠细胞缺乏CD46(病毒摄取的受体)。即便可以高的病毒每细胞比例加强体外的转导,但难以达到有效的体内转导所需的高的病毒/细胞剂量。然而,表达鼠TMZ-CD40L和41BBL的鼠形式的LOAd703(mLOAd703)被用于胰腺癌的鼠模型中。将鼠肿瘤细胞在体外转导以表达2个转基因,鼠TMZ-CD40L和4-1BBL。之后将经转导的肿瘤细胞注射到小鼠中并监视小鼠的肿瘤生长。该CD40L+4-1BBL+肿瘤细胞活化了抗肿瘤免疫并确实形成了肿瘤。缺少CD40L和4-1BBL的对照肿瘤在14天内形成肿瘤。
因为内皮细胞表达CD40,其可对CD40L信号传导产生反应。在使用人类内皮细胞(HUVEC)的模型中,我们证明了当以LOAd703转导后,HUVEC细胞上调了针对T细胞粘附、滚动以及渗出的受体(图18)。因此,LOAd703可增强T细胞向肿瘤薄壁组织的浸润,从而防止肿瘤特异性T细胞活性中的常见问题肿瘤浸润性淋巴细胞向基质的定位,。LOAd703不在体外转导小鼠细胞,因为如上所述,小鼠细胞缺少CD46。血清型5腺病毒对于转导小鼠细胞更优。因此,我们使用了携带小鼠CD40L的Ad5病毒以证明转导后HUVEC细胞表达对于T细胞粘附、滚动与渗出关键的受体,以及体内基因转移至肿瘤确实诱导了活化的T细胞的大规模浸润,表明LOAd703可也有效地用于在T细胞疗法之前处理肿瘤(图21)。
体内毒性数据的总述
装载了人类免疫刺激性基因的基于腺病毒的溶瘤病毒的完全功效和可能的毒性难以使用动物模型评估。首先,腺病毒在小鼠细胞中不会充足地复制。因此,溶瘤作用需在免疫缺陷型小鼠中的使用人类肿瘤细胞的异体移植模型中确定。脱靶毒性,例如病毒的扩散导致对健康细胞的转导与可能的溶解,不能在小鼠中确定。然而,体外数据表明,LOAd703不在包括外分泌胰腺细胞的正常细胞中复制。因为人类CD40L不对小鼠细胞反应,由于转基因表达的毒性也减弱了。另外,因为小鼠肿瘤细胞不表达CD46,该病毒转导被限制于体外环境中,其中每细胞的病毒颗粒可提升以绕开CD46的需求。因此,对体外转导的表达小鼠TMZ-CD40L和4-1BBL的鼠胰腺癌细胞进行小鼠的皮下注射以确定转基因表达的可能的毒性。在进行重复(3x)注射后未见不良反应。
也将LOAd703重复注射(4x)于带有肿瘤的叙利亚仓鼠中。腺病毒在叙利亚仓鼠中表现了一些溶瘤活性,然而,人类转基因未最优地作用,并且在仓鼠中检测充分定义的抗肿瘤免疫反应的工具极少。然而,在处理的仓鼠中未发现不良反应。
实施例16-TMZ-CD154+4-1BBL(LOAd703)的理论证据
开发了用于临床试验的实验方案,以获得TMZ-CD154+4-1BBL的有效性的理论证据。该Ad5/35-TMZ-CD154/4-1BBL溶瘤病毒在GMP条件下产生并会被用作研究性医疗产品以治疗患有被诊断为1-3处转移的胰腺癌的患者,以启动他们的第一个标准护理吉西他滨治疗。在该研究中,将通过图像引导的瘤内注射递送病毒(500μl),而在其他更具扩散性的疾病的研究中可考虑全身性递送。该I/IIa期试验将依据安全性特性评估最多17至26位患者。简而言之,第一组患者将接受伴随其标准护理吉西他滨治疗的单剂量的Ad5/35-TMZ-CD154/4-1BBL(1x10e11 VP)。下一组将接受升高剂量的5x10e11 VP Ad5/35-TMZ-CD154/4-1BBL(图22)。若单剂量安全,则下一组将接受伴随标准护理的重复剂量(6x)的Ad5/35-TMZ-CD154/4-1BBL(5x10e11VP/治疗)(图23)。将监控患者以获得安全性、肿瘤控制的功效、病毒的药代动力学和抗病毒抗体的信息,以及对免疫的活化进行监控,包括鉴定免疫细胞表型和检测血清或血浆以及对蛋白质标志物如细胞因子进行活组织检测。成功的I/IIa期试验将导致随机化的IIb期研究,以比较吉西他滨单独相对于吉西他滨与Ad5/35-TMZ-CD154/4-1BBL的组合。
在下文中将进一步描述该研究。
研究产物:LOAd703
活性物质:经修饰的腺病毒血清型5/35,其含有以CMV启动子驱动的具有人类转基因的转基因盒,该转基因为膜结合性CD40配体(TMZ-CD40L)和全长4-1BBL。
执行者:德克萨斯州,休斯顿,Baylor医学院。
剂量:每次注射于500μl悬液中的1-5x1011病毒颗粒(VP)。于500μl悬液中的更高浓度的病毒颗粒可引发病毒颗粒的聚集,因此并不推荐。
剂型:LOAd703腺病毒颗粒于混悬液中,每管650μl,1x1012VP/ml,(低剂量;2x1011VP/ml)。
施用
通过图像引导瘤内注射500μl的悬液中的LOAd703病毒来递送LOAd703。依据肿瘤的位置,可根据研究者的自行考虑使用不同的成像技术。
对于瘤周注射可容易达到的肿瘤,优选地,LOAd703可通过腹部超声引导的对肿瘤转移的经皮注射完成。其他肿瘤可经由内窥镜超声引导注射更好地达到。其他成像技术如计算机断层扫描(CT)引导注射也可根据研究者的自行考虑使用.
I/IIa期剂量的理论基础
起始剂量为每次治疗的单次注射500μl悬液中的1x1011 VPLOAd703。该理论基础基于前身AdCD40L的瘤内注射的先前经验,AdCD40L已安全地以500μl悬液中的2.5x1011VP的剂量重复注射(4-8次)。因为LOAd703与AdCD40L不同是溶瘤病毒,所以选择了较低的起始剂量。若该剂量在2位登记患者中安全,则下一个剂量水平为500μl悬液中的5x10e11 VP的单一剂量,其将提供于另外2位患者。下3位患者将接受以所选择剂量的每2周6次LOAd703瘤内注射。若安全,将对该研究IIa期部分中的10位患者使用多剂量以在更大组内确认安全性。
因为当重复暴露于刺激时免疫系统的反应会提升,我们未预期在单一剂量的患者中的持久的功效或毒性。因此,我们使用单一剂量在剂量扩大过程中选择了2+2设计,并且对于多重剂量的标准,使用了3位患者,以在进入IIa期之前确认安全性。
若确认了剂量限制性毒性(dose-limiting toxicity,DLT),则可完成剂量的调整。
患者群体
胰腺导管腺癌(Pancreatic ductal adenocarcinoma,PDAC)是最具侵袭性的癌症之一,并且具有所有主要癌症中最高的致死率。即使胰腺癌是孤儿指示(orphan indication),该病也是美国第四致死的癌症。开始时其极少有征兆,因此患者常在该肿瘤已经扩散时才得以诊断。其具有高度的药物抵抗谱,并且极少有药物展现显著的生存有益性。目前的标准治疗是吉西他滨,但与其他药物如紫杉醇的组合疗法最近被批准用于转移性胰腺癌。10%至20%的已诊断患者患有局部癌症但其中仅20%经过带有辅助性化疗的手术。胰腺癌的1年存活率为约20%并且在5年后,仅6%仍在世。然而,仅考虑适合手术的患者亚群,第5年的总体存活率则为20%。
在本研究中,含有局部晚期疾病(单一病灶)的患者以及患有晚期但有很少(2-3)病灶的患者将被登记。
研究目的与终点
诊断为患有PDAC的患者具有有限的治疗选择以及较差的预后,即使肿瘤仍局限与胰腺或已转移至仅极少的位点。局部免疫刺激性基因疗法对于具有单一或很少的病灶但具有高风险谱的患者可能有其价值。这些患者将接受其标准护理疗法(吉西他滨),其将不仅以肿瘤为靶点,也会减弱抑制性免疫细胞的水平。LOAd703将施用于一个单一的病灶。腺病毒颗粒本身将与病原相关分子模式(如TLR2和TLR9,其导致炎症反应)相互作用。溶瘤作用将辅助抗原呈递细胞如DC的抗原摄取并允许新的病毒子感染附近细胞以延长免疫刺激性转基因的表达。尽管TMZ-CD40L可活化DC使其吞没肿瘤抗原以刺激新的CTL、NK细胞及M1巨噬细胞的应答,并且活化内皮细胞以增加淋巴细胞进入薄壁组织,而4-1BBL可重新刺激先前存在的肿瘤浸润性T细胞及NK细胞以辅助根除肿瘤细胞,以及当进入肿瘤中时延长新的经刺激的免疫细胞的存活。之后所产生的免疫性也可作用于远端肿瘤细胞以减小肿瘤生长速度或甚至阻止新的转移病灶的形成。
目的
I期
I期的目的是以2个剂量水平、每剂量2位患者,以及在标准护理治疗期间对3位患者的选定剂量的6个重复注射,确定图像引导的LOAd703瘤内注射的可行性及安全性。
IIa期
IIa期的目的为确定与标准护理治疗组合的重复的LOAd703疗法的安全性及效果。
终点
I期
I期部分的终点为评估毒性。
1.通过使用物理检测、血液学和临床化学分析的评判标准的毒性。
2.使用定量实时PCR检测的血液和活组织检查(仅多重剂量)中的LOAd703病毒拷贝。
3.使用ELISA检测血液中的抗腺病毒抗体。
4.通过ELISA和/或基于复合方法如ProSeek检测的血液及肿瘤裂解物(仅多重剂量)中的免疫学蛋白质谱。
5.通过流式细胞术及ELISPOT检测的免疫学细胞谱。
6.通过依赖局域肿瘤定位的合适的成像并通过监测肿瘤标志物CA19-9检测对肿瘤的影响。
IIa期
IIa期部分的终点为对肿瘤的影响和安全性。
1.通过使用物理检测、血液学和临床化学分析的评判标准的毒性。
2.使用定量实时PCR检测的在活组织检查和血液中的LOAd703病毒拷贝。
3.使用ELISA检测血液中的抗腺病毒抗体。
4.通过ELISA和/或基于复合方法如ProSeek检测的血液及肿瘤裂解物中的免疫学蛋白质谱。
5.通过流式细胞术及ELISPOT检测的免疫学细胞谱。
6.通过局域肿瘤定位的合适的成像并通过监测肿瘤标志物CA 19-9检测的对肿瘤的影响。
试验设计
试验设计概述
该试验由具有单一和多个剂量的剂量扩大的I期,以及具有选自I期的剂量水平的多个剂量的确认性IIa期组成。7位患者将入选I期,除非DLT需要剂量调整以及进入IIa期之前的额外的组。因此,在I期中可治疗最多7位至16位患者。在IIa期部分中将入选最多10位患者。通过应用Gehan的方法学,在治疗IIa期的10位患者后,尽管事实上该治疗实际赋予了超过30%的OR,但在至少一位患者中,LOAd703不正确地缺少效果(OR)的风险低于5%。总计,该研究预期治疗最多17位至26位患者。
I期
患者将被告知该研究并签署知情同意书,由此他们进入筛选期以确认合格,包括健康状况和放射学的采样。患者将启动他们的吉西他滨(1000mg/m2)标准护理的第一个3周的循环,随后为1周的休息。在休息的这周中,首先2位患者将接受1剂量的图像引导的1x1011VP LOAd703的瘤内注射,并且随后的2位患者接受1剂量的5x1011 VP LOAd703(图22)。随后的2位患者的治疗可在首先的2位患者经过最后的随访没有剂量限制毒性(DTL)后开始。患者将在病毒处理后停留过夜以进行观察。之后,患者将继续另外3周的吉西他滨的循环以及1周的休息。将采集血液样品以评估毒性、病毒药代动力学(例如扩散至血液)和免疫反应,如图22所示。在研究筛选及最后的随访期间,患者将进行放射学,此后他们将脱离研究。
若单一剂量方案是安全的,接下来的3位患者将接受每2周的多重(6x)瘤内注射,其与他们的吉西他滨标准护理疗法平行(图23)。如果在首先的4位单一剂量患者的剂量扩大期间,LOAd703注射后未发生立即的反应,则接受多重剂量的患者不需要停留过夜但将在病毒注射后根据研究者的自行考虑观察至少4小时,并可在之后离开医院。
活组织检查将在第一周之前和最后的LOAd703注射之后一周进行。将在不同时间点采集血液样品以评估毒性、病毒药代动力学(例如扩散至血液)和免疫反应,如图23所示。每2个月将使用成像测定肿瘤尺寸。在第6个月,患者将进行最后的随访分析,并且之后他们将脱离研究。在参加该试验后,患者将根据医院的临床常规继续他们的标准护理方案。
当3位患者已受到安全剂量的多重病毒注射治疗后,即根据当所有这些患者自最后的病毒剂量之后过去至少2周判断,试验的IIa期部分可以启动。
若在剂量扩大或多个剂量中发生了DLT,则必须调整剂量。
IIa期
患者将被告知该研究并签署知情同意书,之后他们进入筛选期以确认合格,其包括健康状况和成像的采样。患者将启动他们的吉西他滨(1000mg/m2)标准治疗的第一个3周的循环,随后为1周的休息。在休息的周中,患者将启动以图像引导的瘤内注射选定剂量LOAd703的LOAd703治疗。该LOAd703注射将每两周提供一次并与他们的标准护理吉西他滨治疗平行。将提供6个病毒剂量。
组织检验将在第一周之前及最后的LOAd703注射后一周进行。将在不同时间点采集血液样品以评估毒性、病毒药代动力学(例如扩散至血液)和免疫反应,如图23所示。每2个月,将通过放射学测定肿瘤尺寸。在第6个月,患者将进行最后的随访分析,并且之后他们将脱离研究。在参加该试验后,患者将根据医院的临床常规继续他们的标准护理方案。总共10位患者将在IIa期接受治疗。
研究时长
患者将参与该研究2个月(单一剂量)至6个月(多重剂量)。总共将入选17至26位患者。该研究预计将在2年内完成。
研究结束
该研究的结束定义为进行该试验的最后的患者的最后来访日期。
一些具体实施方案
1.包含以下结构的核苷酸序列
OD-(L)-TD-ED
其中
OD为寡聚化结构域,
L为接头,其任选地存在,
TD为来源于CD154或来源于任何II型跨膜蛋白质的跨膜结构域,以及
ED为CD154的胞外结构域,其选自
i)SEQ ID NO:11,即SEQ ID NO:1的199-846位残基,
ii)SEQ ID NO:11,即SEQ ID NO:1的199-846位残基,但其中SEQ ID NO:1的397-420位核酸残基的一个或多个已缺失或更换为另外的核酸以避免所述分子的切割,
iii)SEQ ID NO 12,即SEQ ID NO:3的127-846位残基,
iv)SEQ ID NO:13,即SEQ ID NO:4的127-844位残基,
v)SEQ ID NO:14,即SEQ ID NO:5的127-844位残基,
vi)核苷酸序列,其与i)至v)中任一项限定的序列具有至少95%、98%或99%的序列同一性,或者
vi)来自哺乳动物的对应胞外CD154结构域,
条件是所述核苷酸序列不包含胞内CD154区域,其对应于SEQ ID NO:16的等同核苷酸序列。
2.根据项1的核苷酸序列,其中所述跨膜结构域来源于CD154、人OX40配体或人CD70。
3.根据项2的核苷酸序列,其中所述跨膜结构域与以下序列具有至少90%的序列同一性
i)SEQ ID NO:17,即SEQ ID NO 1的127-198位残基,
ii)SEQ ID NO:20,即人OX40配体的跨膜结构域,或者
iii)SEQ ID NO:22,即人CD70的跨膜结构域。
4.根据项3的核苷酸序列,其中所述跨膜结构域与SEQ ID NO:17、SEQ ID NO:20或SEQ ID NO:22具有至少95%、96%、97%、98%、99%或100%的序列同一性。
5.根据项4的核苷酸序列,其中所述跨膜结构域具有SEQ ID NO:17。
6.根据前述任一项的核苷酸序列,其中所述寡聚化结构域为异亮氨酸拉链或T4纤维蛋白的三聚化结构域。
7.根据项6的核苷酸序列,其中所述寡聚化结构域为具有SEQ ID NO:23,即SEQ ID NO 1的10-108位残基的异亮氨酸拉链。
8.根据前述任一项的核苷酸序列,其还包含Kozak序列。
9.根据项8的核苷酸序列,其中所述Kozak序列对应于SEQ ID NO:1的1-9位残基。
10.根据前述任一项的核苷酸序列,其与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5具有至少90%的序列同一性。
11.根据前述任一项的核苷酸序列,其与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5具有至少95%或98%的序列同一性。
12.根据前述任一项的核苷酸序列,其与SEQ ID NO:1、SEQ ID NO.3、SEQ ID NO:4或SEQ ID NO:5具有100%的序列同一性。
13.根据前述任一项的核苷酸序列,其与免疫调节物组合。
14.根据前述任一项的核苷酸序列,其中所述免疫调节物为4-1BB配体基因,或抗IL6R scFv的基因。
15.根据前述任一项的核苷酸序列,其与信号传导通路调节物组合。
16.根据前述任一项的核苷酸序列,其中所述信号传导通路调节物为抗IL6R scFv。
17.根据项1至14中任一项的核苷酸序列,其与信号传导通路阻断物组合。
18.根据项14的核苷酸序列,其与SEQ ID NO:6或SEQ ID NO:8具有至少95%、98%或100%的序列同一性。
19.根据前述任一项的核苷酸序列,其用于医药。
20.根据前述任一项的核苷酸序列,其用作诊断工具。
21.蛋白质,其由事1至20中任一项所限定的核苷酸序列编码。
22.包含以下结构的蛋白质
OD-(L)-TD-ED
其中
OD为对应寡聚化结构域的氨基酸序列,
L为接头,其任选地存在,
TD为对应于跨膜结构域的氨基酸序列,以及
ED为对应于CD154胞外结构域的氨基酸序列,其选自
i)对应于SEQ ID NO 11,即SEQ ID NO:1的199-846位残基之核苷酸的氨基酸残基,
ii)对应于SEQ ID NO 11,即SEQ ID NO:1的199-846位残基之核苷酸的氨基酸残基,但其中对应于SEQ ID NO:1的397-420位核苷酸残基的一个或更多个氨基酸残基已缺失或更换为另外的氨基酸以避免所述分子的切割,
iii)对应于SEQ ID NO 12,即SEQ ID NO:3的127-846位残基之核苷酸的氨基酸残基,
iv)对应于SEQ ID NO:13,即SEQ ID NO:4的127-844位残基之核苷酸的氨基酸残基,
v)对应于SEQ ID NO:14,即SEQ ID NO:5的127-844位残基之核苷酸的氨基酸残基,
vi)氨基酸序列,其与i)至v)中任一项限定的序列具有至少95%、98%或99%的序列同一性,或者
vi)来自哺乳动物的对应胞外CD154结构域,
条件是所述蛋白质不包含对应于胞内CD154区域的氨基酸序列,其对应于氨基酸序列SEQ ID NO:15。
23.根据项22的蛋白质,其中ED与SEQ ID NO:24具有至少90%或至少95%的序列同一性。
24.根据项21至23中任一项的蛋白质,其中所述寡聚化结构域为异亮氨酸拉链结构域或T4纤维蛋白的三聚化结构域。
25.根据项21至24中任一项的蛋白质,其中所述跨膜结构域来源于CD154或任何II型跨膜蛋白质的跨膜结构域。
26.根据项22至25中任一项的蛋白质,其中对应于所述跨膜结构域的氨基酸序列与SEQ ID NO:18具有至少90%、95%、98%或100%的序列同一性。
27.根据项22至26中任一项的蛋白质,其中SEQ ID NO:18的一个或更多个残基可缺失或更换为另外的氨基酸。
28.根据项27的蛋白质,其中所述残基为aa14和/或aa16。
29.根据项21至28中任一项的蛋白质,其与SEQ ID NO:2具有至少90%、95%或98%的序列同一性。
30.根据项21至29中任一项的蛋白质,其与SEQ ID NO:2具有100%的序列同一性。
31.根据项21至30中任一项的蛋白质,其用于医药。
32.根据项21至31中任一项的蛋白质,其用于本文所限定的疾病治疗。
33.与药物物质(drug substance)组合的如项21至32中任一项所限定的蛋白质,,其用于医药,所述药物物质选自抗癌剂、免疫调节物和如本文所限定的其他药物物质。
34.载剂,包含如项1至20中任一项所限定的核苷酸序列。
35.根据项34的载剂,其选自质粒、病毒载体、转座子、细胞、人工细胞和人工载剂。
36.根据项34或35的载剂,其为病毒的形式。
37.根据项36的载剂,其中所述病毒为腺病毒血清型5/35病毒。
38.根据项37的载剂,其中腺病毒5/35病毒具有在E1A基因上游的E2F启动子区/结合位点,可具有在E1A基因上游的Sp1位点、E1A Δ24缺失、E3Δ6.7K/gp19K,并且包含pCMV和转基因的转基因盒插入于L5基因区域之后。
39.根据项34至38中任一项的载剂,其包含如SEQ ID NO:1中所限定的TMZ-CD154核苷酸。
40.根据项34至39中任一项的载剂,其还包含4-1BB配体基因或抗IL6R scFv的基因。
41.两种或更多个如项34至40中任一项所限定的载剂的组合。
42.两个载剂的组合,其中第一载剂如项34至41中任一项所限定并且第二载剂包含免疫调节物,例如4-1BB配体基因或抗IL6R scFv的基因。
43.根据项34至42中任一项的载剂,其用于医药。
44.根据项34至43中任一项的载剂,其用于本文所限定的疾病治疗。
45.根据项34至43中任一项的载剂,其用于癌症治疗。
46.根据项34至43中任一项的载剂,其用于实体瘤治疗。
47.根据项34至43中任一项的载剂,其用于胰腺癌治疗。
48.如项34至44中任一项所限定的载剂,其与药物物质组合以用于医药,所述药物物质选自抗癌剂、免疫调节物和如本文所限定的其他药物物质。
- 还没有人留言评论。精彩留言会获得点赞!