人类癌症中的TERT和BRAF突变的制作方法
本申请声明要求权益来自于2014年8月提交的美国临时申请号为62/0349668的专利申请,2014年4月7日提交的美国临时申请号为61/976109的专利申请,和2014年4月1日提交的美国临时申请号为61/973584的专利申请。这里对这些中的每一个都通过引用将其整体并入本文。
政府利益声明
本发明受到编码为R01CA134225和ROlCAl13507的美国政府研究基金的支持,基金由美国国立卫生研究院授予的。政府对本发明具有一定的权利。
技术领域
本发明涉及癌症领域。更具体地,本发明提供了与某些癌症突变有关的方法及组合体。
是以索引方式对电子方式提交的材料的整合
该申请包含一序列表,其已经通过EFS-Web网址电子提交,为一个ASCII文本形式的文件,名字为“P12971-03_ST25.txt”。序列大小为1,259字节,文件是2015年4月1日创建的,在此以索引方式将其完整并入。
背景技术:
乳头状甲状腺癌(PTC)是一种常见的内分泌恶性肿瘤,占甲状腺恶性肿瘤的80-85%。它可以被进一步分为常规型(CPTC),滤泡型(FVPTC),高大细胞变体(TCPTC)和一些罕见其它变体,其中CPTC是最常见的。虽然PTC一般而言治愈性很高,大约10%的病人有发展快和侵袭性高的肿瘤,伴有高疾病复发和死亡率。这种疾病行为的广泛性往往给PTC的处理和临床危险分层和决策造成困惑。侵袭性高的PTC给预后和治疗造成了挑战。有人建议,新的基于分子的处理,将有助于解决这一挑战。但是,这一特殊PTC病人群体的分子机制,特别是遗传背景,有待于更好的确定
技术实现要素:
本发明是基于,或至少部分地基于,第一示范即BRAF突变和TERT启动子突变的共存是一个独特的遗传背景,该两突变的共存决定了某些人类癌症,如乳头状甲状腺癌(PTC),中有部分病人的病情尤其严重。该研究使用PTC作为代表性的人类癌症模型来检验一假说,即BRAF基因突变和TERT启动子突变的共存是驱动某些人类癌症有特别侵袭性的一个独特而强大的遗传机制。
相应地,在一个方面,本发明提供了治疗甲状腺癌患者的方法。在一个实施方案中,用于治疗患有侵袭性甲状腺癌,包括(a)从所述受试者获得生物样品;(b)对从受试者获得的样本测定并确定(ⅰ)在端粒酶逆转录酶(TERT)基因的启动子中的1 295 228C>T(C228T)突变,其对应于从翻译起始位点-124C>T;(ⅱ)1 295 250 C>T(C250T)突变,其对应于在TERT启动子从翻译起始位点-146C>T;和/或(iii)T1799A BRAF基因突变,其导致一个V600E氨基酸改变;(c)查找到有C228T,C250T和/或V600E突变共存的病人,这样的病人因此会有或可能产生侵袭性强的甲状腺癌;(d)相应的对于这样的并人用一种或多种治疗方式针对性地治疗其侵袭性的甲状腺癌。在一个具体的实施方案中,步骤(b)的测定包括对包含从翻译起始点的-124和-146的TERT启动子片段及含有T1799A位点的BRAF基因片段进行测序。
在另一具体实施方案中,步骤(b)的测定包括以下步骤:
(ⅰ)提取所述生物样品的DNA;
(ⅱ)使DNA与TERT基因和BRAF基因特异的引物杂交;
(iii)通过聚合酶链反应(PCR),扩增包含-124和-146(从翻译起始位点算起)的TERT的启动子区域和包含T1779A核苷酸位点的BRAF基因的区域;和
(iv)测序扩增产物以确定C228T,C250T和/或V600E突变的存在。在某些实施方案中,TERT引物包含SEQ ID NO:2和/或SEQ ID NO:3。在某些具体的实施方案中,BRAF引物包含SEQ ID NO:4和/或SEQ ID NO:5。
在具体实施方案中,侵袭性的甲状腺癌的治疗包括一个或多个方式,包括甲状腺切除,放射性碘治疗和它们的组合。在进一步的实施方案中,治疗方法包括向受试者施用TERT抑制剂或BRAF突变体抑制剂或MEK抑制剂(抑制MAP激酶途径)或TERT抑制剂与后两种抑制剂的组合。在又一个实施方案中,侵略性甲状腺癌是乳头状甲状腺癌(PTC),也可以是含有BRAF V600E突变和TERT启动子突变的未分化甲状腺癌。
在另一个实施方案中,本发明提供了用于治疗鉴定为具有C228T和/或C250T和/或BRAF基因T1799A/V600E突变的患者的方法。治疗包括对具有侵袭性甲状腺癌适当的治疗方式。这样的治疗可以有一个或多个形式,包括甲状腺切除和放射性碘治疗,TERT抑制剂,BRAF突变体酶抑制剂,MEK抑制剂和它们前述的所有组合。在某些实施方案中,侵袭性甲状腺癌是乳头状甲状腺癌(PTC)或未分化甲状腺癌。
在另一个方面,本发明提供了鉴定受试者为具有或可能发展成侵袭性甲状腺癌和治疗它们的方法。在一个实施方案中,用于鉴定受试者为具有或可能发展成侵袭性甲状腺癌,包括以下步骤和方法。
(a)获得来自所述受试者的生物样品;
(b)对从受试者获得的生物样品检测,以确定(ⅰ)1 295 228C>T(C228T)突变,其对应于端粒酶逆转录酶(TERT)基因启动子上的-124C>T(从翻译起始位点起),(ⅱ)1 295 250 C>T(C250T)突变,其在TERT启动子的翻译起始位点起的-146C>T,和/或(iii),引起V600E氨基酸改变的BRAF基因的T1799A突变;
(c)识别的C228T,C250T和/或V600E突变以鉴定具有发展为侵袭性甲状腺癌的病人。在一个更具体的实施方案中,步骤(b)的测序包含-124和-146(从翻译起始位点算起)TERT启动子区的序列及包含T1799A核苷酸位点的BRAF基因序列。
在又一个具体的实施方案中,步骤(b)的测定包括以下步骤
(ⅰ)提取所述生物样品的DNA;
(ⅱ)用对TERT基因和BRAF基因特异的引物与DNA样本杂交;
(iii)通过聚合酶链反应(PCR),扩增包含TERT启动子中-124和-146(从翻译位点算起)和包含T1779A核苷酸位点的BRAF基因的区域;
(iv)测序扩增产物以确定C228T,C250T和V600E突变的存在。
在进一步的实施方案中,该方法进一步包括施用适于患有或可能发展成侵袭性甲状腺癌的受试者的治疗方法的步骤。在具体实施方案中,侵袭性的甲状腺癌的治疗有多个方式,包括甲状腺切除和放射性碘治疗及它们的组合。在进一步的实施方案中,治疗方法包括向受试者施用TERT抑制剂或BRAF突变体抑制剂或MEK抑制剂(抑制MAP激酶途径)或TERT抑制剂与后两种抑制剂的组合。
在又一个实施方案中,侵袭性甲状腺癌是乳头状甲状腺癌(PTC),也可以是含有BRAF V600E突变和TERT启动子突变的未分化甲状腺癌。
在另一个实施方案中,本文所述的突变可以在患者的DNA中鉴测到,继而可给患者建议或实施合适的治疗。在进一步的实施方案中,可开处方要求从患者样品中检测和诊断这里所描述的TERT和/或BRAF突变。在另一个实施方案中,可对病人含有本文中所描述的TERT和/或BRAF突变的患者推荐,给于处方何施某些合适的特定治疗。
因此,在另一个方面,本发明给癌症患者提供了含有针对C228T TERT突变,C250T TERT突变,和V600E BRAF突变的治疗方法及组合的治疗方法。在又一个方面,本发明提供了鉴定受试者为有C228T TERT突变,C250T TERT突变,V600E BRAF突变及其组合的能发展成侵袭性癌的病人,依此给与相应合理治疗。这样的癌症的实例包括,但不限于,黑素瘤,结肠癌,脑肿瘤,白血病(特别是多毛细胞白血病),肺癌,卵巢癌,子宫癌,子宫颈癌,鼻咽癌,胰腺癌,乳头状颅咽管瘤。BRAF突变和TERT启动子突变的知识可以更好的帮助对这些癌进行风险分层和预后评估,就象帮助处理PTC一样。
在本文中所描述的方法中,测定TERT/BRAF突变所用的生物样品可以是任何适当的样品,包括,但不限于,血,外周血,血清,血浆,脑脊液,尿液,唾液,粪便,滑膜流体和组织。在某些特定实施方案中,所述样品是细针抽吸活检。在其它实施方案中,所述样品可以是尿样。
附图说明
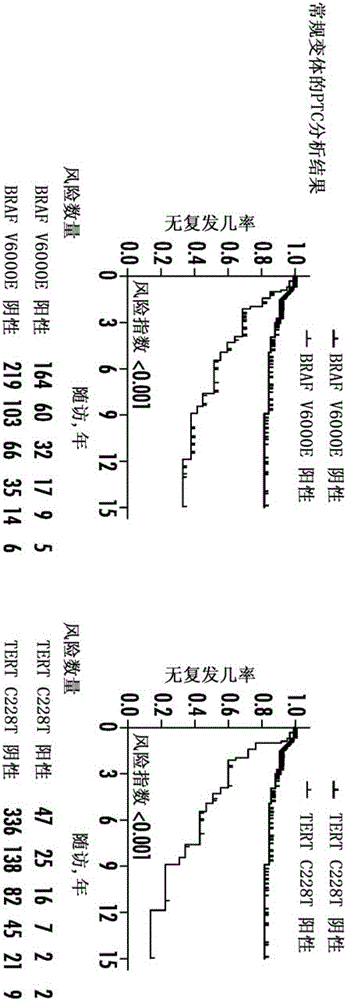
图1A和1B,Kaplan-Meier法分析BRAF V600E对患者的乳头状甲状腺癌(PTC)无病生存期的影响,并TERT C228T突变。图1A显示对患者的所有类型的PTC的综合分析结果。图1B显示常规变体的PTC的分析结果。在图1A和图1B中,左侧部分显示患者的肿瘤无复发存活与BRAF V600E突变的关系,右侧部分显示患者肿瘤无复发存活如TERT C228T突变的关系。在每个面板中,蓝线代表无突变的阴性患者,红色线代表有突变的阳性患者。
图2A和2B,Kaplan-Meier法分析BRAF V600E和TERT C288T单独或者共存时对患者的乳头状甲状腺癌(PTC)无病生存率的影响。图2A现示所有类型的PTC的分析结果。图2B显示仅常规变体的PTC的分析结果。图2A和图2B的四组患者分别为:没有任何突变的病人(黑线),只有TERT C228T突变(绿线),只有BRAF V600E突变(蓝线),两种突变共存(红线)。
图3,BRAF V600E的Kaplan-Meier生存分析,显示BRAF突变与黑色素瘤患者的生存下降有显著相关性。
图4,TERT C228T/C250T的Kaplan-Meier生存分析,显示TERT突变与黑色素瘤患者的生存下降有显著相关性。
图5A-5D,BRAF V600E或TERTC228T与病人存活率下降之间的关联。图5A和5B-显示所有PTC的情况。图 6C和D-显示传统型PTC的情况。
图6A和6B,BRAF V600E和TERT C228T突变在患者存活率下降中的的协同效应。图6A,显示所有PTC,图 6B,显示常规型PTC。
具体实施方式
应该理解的是,本发明并不限定于在此描述的具体的方法和内容成分,因为这些可以变化。它也应当理解,本文使用的术语仅用于描述具体实施方案的目的,无意限制本发明的范围。也须指出,如本文和所附权利要求书中所使用的,单数形式“一”,“一个”和“该”包括复数参考,除非上下文另有明确说明。例如,对“蛋白质”术语的引用是对一种或多种蛋白质的引用,包括对其已知的本领域技术人员认可的当量用语或意思。
除非另有定义,本文使用的所有技术和科学术语具有如同本发明所属的领域中普通技术人员通常所理解的相同的含义。本文对具体的方法,装置和材料都做了描述。任何类似或等同于本文描述的方法和材料可以在实践或测试本发明中使用。
本文引用的所有出版物包括所有期刊文章,书籍,手册,公开的专利申请和已授权的专利文献。此外,本文提供了对某些术语和短语的意思的说明,这见于书中所述具体定义中,实例中,和附录权益要求声明中。所给定义并不意味着在本质上设限制,而是提供帮助对本发明的某些方面有更清楚的了解。
定义
范围可以被表示如本文从“约”一个具体值,和/或到“约”另一个具体值。术语“约”在本文中用于指大约,大致的周围的区域。当与一个数值范围一起使用术语“约”时,它通过延伸高于和低于所规定的数值的边界修改该范围。除非特别说明或从上下文显而易见,本文所用的术语“约”应理解为一个范围在现有技术中的正常耐受性,例如在2个标准差的范围内。“约”可以被理解为10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%,0.1%,0.05%,或0.01%之内规定值。除非上下文清楚的另有意思,本文提供的所有数值可以由术语“约”修饰。
一个“激动剂”是一种类型的调制物,并且指的是可以结合目标靶点并可以使其激活的一个或多个功能的试剂。例如,蛋白质的激动剂可以结合蛋白质和在没有它的天然或同源配体的情况下激活蛋白质。
本文中所使用的,“拮抗剂”是一种类型的调节剂,可与术语“抑制剂”互换使用。在某些非限制性实施方案中,术语是指能结合目标靶点(例如,蛋白质),并能对其抑制的一个或多个功能的试剂。例如,酶蛋白的拮抗剂可以结合蛋白质和抑制蛋白质的酶活性。
本文中所使用的,术语“抗体”中提到的任何免疫球蛋白分子,其与特定抗原反应时使用。其意图是,术语包括任何免疫球蛋白(例如,IgG抗体,IgM抗体,IgA的,IgE的,IgD的,等等)从任何来源获得(例如,人类,啮齿动物,非人灵长类动物,山羊,牛,马,绵羊等)。特定类型/抗体的实例包括多克隆,单克隆,人源化的,嵌合的,人的,或其它人合适的抗体方式。“抗体”还包括任何本文所述抗体的任何片段或衍生物。在具体的实施方案中,抗体可以针对TERT升高和用作TERT调节剂。在其他实施方案中,抗体可以针对BRAF升高和用作BRAF调节剂。
本文所用术语“有效”,是指足以实现所期望的,预期的或意图的结果。更具体地,本文所提供的一个“治疗有效量”指的是本发明TERT和/或的BRAF的调接剂量,指无论是单独使用或与另一种治疗剂的组合,有必要提供所需的治疗效果的量。例如,一个有效量来预防,减轻,或改善疾病症状或延长被治疗的受试者的存活。在一个具体的实施方案中,本文所提供的术语“治疗有效量”指的是TERT和/或BRAF调节剂的量,能发挥所需的治疗效果,例如,能有效地预防,减轻或改善的量,能治疗疾病或延长受试者的存活。在一个具体的实施方案中,疾病或病症是癌症。在一个更具体的实施方案中,所述癌症是甲状腺癌。如本领域技术人员可以理解的,因受治疗者而异,取决于年龄所需的确切量,受试者的一般状况,病症的严重程度而改变,来确定化合物和/或施用的组合物,和类似物及其量。适当的“治疗有效量”在任何个别情况下,可以由本领域的普通技术人员中的一个通过参考相关文本和文献和/或通过使用常规实验来确定。
“高严格条件”是指进行杂交与来自使用长度为至少40个核苷酸的DNA探针所得,在含有0.5M NaHP04,pH 7.2的,7%的SDS,1mM EDTA的缓冲可比条件,和1%BSA(级分V)中,在65℃,或含48%甲酰胺缓冲液,4.8XSSC,0.2摩尔Tris-CL,pH值7.6,lXDenhardt的溶液,10%硫酸葡聚糖,和0.1%SDS,温度定在42℃。其他条件为高严格性杂交,如用于聚合酶链反应,mRNA(Northern)杂交,DNA(Southern)杂交,或原位杂交,DNA的测序等的条件,由本领域和分子生物学领域中公知的。(参见,例如,F.Ausubel等,在分子生物学方法,约翰·威利父子,纽约,N.Y.,1998)。
术语“抑制剂”是一种类型的调节剂器和与术语互换使用“拮抗剂”。术语“抑制剂”包括任何类型的分子或试剂的任何直接或间接抑制靶基因或蛋白质的表达或活性。抑制剂可以是任何类型的化合物,如小分子,抗体或反义化合物。在某些实施方案中,靶基因或蛋白质是TERT。该术语还包括具有除了抑制TERT活性的活性的试剂。在另一个实施方案中,靶基因或蛋白质是BRAF。该术语还包括具有除了抑制BRAF活性的活性的试剂。BRAF抑制剂的例子包括Sorafenib(Bay43-9006,Nexavar),Vemurafenib(PLX4032),BDC-0879,PLX-4720,Dabrafenib(Tafinlar),and LGX818。在又一实施方案中,靶基因或蛋白质是MEK,其在BRAF/MEK/MAP激酶通路的蛋白质,下游于BRAF(丝裂原活化蛋白激酶激酶也称为MAP2K,MEK,MAPKK)。MEK抑制剂的实例包括trametinib,selumetinib(AZD6244),trametinib,CI1040,PD0325901,RDEA119(refametinib,BAY 869766)。在又一实施例中,组合使用BRAF和TERT抑制剂是更有效的。在又一实施方案中,治疗靶向目标同时为TERT和BRAF/MEK,使用其相应的抑制剂。
如本文所用,术语“调节”表示直接或间接地控制或影响的能力,并通过非限制性实例的方式,可替代的意思是抑制或刺激,激动或拮抗,阻碍或促进,增强或减弱。因此,术语“端粒酶调节剂”是指调节TERT的表达和/或活性的试剂。
术语“BRAF“调节剂”指的是调节BRAF基因的表达和/或蛋白活性的试剂。调节剂可以是有机的或无机的,小分子到大分子量单独的化合物,它们的混合物和诸如肽,核酸,或寡核苷酸抑制剂,激动剂,拮抗剂,和生物聚合物的组合。调节剂可以是天然产物或天然存在的小分子有机化合物。特别是,调节剂可以是碳水化合物;单糖;寡糖;多糖;氨基酸;肽;寡肽;多肽;蛋白;受体;核酸;核苷;核苷酸;寡核苷酸;多核苷酸包括DNA和DNA片段,RNA和RNA片段和类似物;脂质;维甲酸;类固醇;糖;糖蛋白;蛋白多糖等;和合成的类似物或衍生物,包括肽模拟物,小分子有机化合物等,以及它们的混合物。根据本发明鉴定的调节剂对本文所公开的疾病的治疗应优先选用。
本文所用短语“核酸”指的是天然存在的或合成的寡核苷酸或多核苷酸,无论是DNA或RNA或DNA-RNA杂交,单链或双链,有义或反义,其能够杂交到互补核酸酸通过沃森-克里克碱基配对。本发明的核酸还可以包括核苷酸类似物(例如,BrdU的),和非磷酸二酯核苷间键(例如,肽核酸(PNA)或thiodiester键)。具体地,核酸可以包括,但不限于,DNA,RNA的cDNA,基因组DNA,单链DNA,双链DNA或它们的任意组合。
“任选的”或“任选地”是指可以或不可以出现随后描述的事件或情况,并且该描述包括其中事件或情况发生和实例。
术语“患者”,“个体”或“受试者”在本文中可互换使用,并且指哺乳动物,特别是人。所述患者可具有轻微的,中度或严重的疾病或病症。患者可以是未曾治疗过的,或对某种形式的治疗有反应,或难治的。患者可以是需要治疗的或需要基于特定的症状或家族史的诊断的个体。在一些情况下,术语可以指治疗实验动物,兽医应用,并在动物模型中的疾病,包括的发展,但不限于啮齿动物包括小鼠,大鼠和仓鼠;和灵长类动物。特别是,该术语也包括诊断患有BRAF和/或TERT介导的疾病,障碍或病症的哺乳动物。“正常受试者”是指不具有癌症的个体,也可以是对癌症有易感性增加的个体。
这里使用的“多肽”是指任何肽,寡肽,多肽,基因产物,表达产物,或蛋白质。多肽是由连续氨基酸。术语“多肽”包括天然存在的或合成的分子。此外,如本文所用的术语“多肽”是指氨基酸通过肽键或修饰的肽键,例如,肽等排等相互连接,并且可以含有除20种基因编码的氨基酸的其他修饰的氨基酸酸。所述多肽可以通过天然过程,如翻译后加工,或通过本领域公知的化学修饰技术修饰。修饰可以在多肽的任何地方发生,包括肽骨架,氨基酸侧链和氨基或羧基末端。同一类型的修饰可以在给定多肽的几个位点可以存在于相同或不同程度。此外,给定多肽可以有很多类型的修饰。修饰包括,但不限于,乙酰化,酰化,ADP-核糖基化,酰胺化,共价交联或环化,黄素的共价附着,血红素部分的共价附着,核苷酸或核苷酸衍生物的共价附着,脂质的共价连接或脂质衍生物,磷脂酰肌醇的共价附着,二硫键形成,脱甲基化,形成半胱氨酸或焦谷氨酸,甲酰化,γ-羧化,糖基化,GPI锚形成,羟基化,碘化,甲基化,肉豆蔻,氧化,聚乙二醇化,蛋白水解加工,磷酸化,异戊烯化,外消旋化,硒化,硫酸化,和转移RNA介导氨基酸添加到蛋白质中,如精氨酰化。见蛋白结构和分子特性,第二版,T.E。克赖顿,W.H。Freeman和Company,纽约(1993);蛋白质的翻译后共价修饰,B.C.约翰逊编,学术出版社,纽约,第1-12(1983)。
由“探针”,“引物”,或寡核苷酸是指确定序列可以碱基配对的单链DNA或RNA分子,其中包含的互补序列(的第二DNA或RNA分子“目标”)。所得杂交体的稳定性取决于发生的碱基配对的程度。的碱基配对的程度,如在探针和目标分子和杂交条件的严格程度之间的互补性的程度是受参数。杂交的严格程度是通过参数,如温度,盐浓度,和如甲酰胺的有机分子的浓度的影响,并通过公知的本领域技术人员中的方法来确定。特异于TERT和/或者BRAF基因的核酸(例如,基因和/或mRNA的)探针或引物具有至少80%-90%的序列互补性,优选至少91%-95%的序列互补性,更优选至少96%-99%的序列互补性,和最优选100%的序列互补性,以与它们杂交的TERT或者BRAF基因的核酸的区域。探针,引物,和寡核苷酸可以是可检测地标记的,无论是放射性的或非放射性,通过公知的本领域技术人员的技术中的方法。探针,引物,和寡核苷酸用于涉及核酸杂交的方法,如:核酸测序,反向通过聚合酶链式反应,单链构象多态性(SSCP)分析,限制性片段多态性(RFLP转录和/或核酸扩增)分析,mRNA(Southern)杂交,DNA(Northern)杂交,原位杂交,电泳迁移率变动分析(EMSA)。
术语“样本”,“患者样品”,“生物样品”,和类似物,包括各种从患者,个体或受试者获得样品类型,并且可在诊断或监测试验中使用。病人样品可来自健康受试者或有癌的患者中获得。此外,从患者获得的样品可以被划分和仅一部分可用于诊断。此外,样品,或其部分,可被条件下储存,以保持用于以后的分析样品。该定义明确涵盖血液和生物起源的其它液体样品(包括但不限于,外周血,血清,血浆,脐带血,羊水,脑脊髓液,尿液,唾液,粪便和滑液),固体组织样品如如活检标本或组织培养物或由其衍生的细胞和它们的后代。在某些实施方案中,样品包含血液。在其他实施方案中,样品包含血清。在一个具体的实施方案中,样品包含等离子体。在另一个实施方案中,使用了精液样本。在进一步的实施方案中,使用粪便样品。在具体的实施方案中,可以在肿瘤组织进行测试TERT启动子和/或BRAF突变,包括手术组织,针活检组织(例如,甲状腺结节针活检标本),体液(例如,穿刺活检洗液,脑脊髓液,尿等),用于对癌症诊断,预后和治疗的指导,如甲状腺癌和含有本文描述共存的BRAF和TERT突变的其它癌症。在某些实施方案中,所述样品是从细针穿刺活检获得的。
在某些实施方案中,样品包含尿液。事实上,TERT突变可以在尿作为用于膀胱癌的诊断,预测和治疗的分子标记来检测。见Hurstetal.,EuropeanUrology 65,367-69(2014)("Comprehensive Mutation Analysis of the TERT Promoter in Bladder Cancer and Detection of Mutations in Voided Urine");and Rochakonda et al.,Proc.Natl.Acad.ci.USA 110(43),17426-17431(Oct.2013)("TERT Promoter Mutations in Bladder Cancer Affect Patient Survival and Disease Recurrence Through Modification by a Common Polymorphism")。
“样品”的定义中还包括在以任何方式采购或处理之后的样品,如通过离心,过滤,沉淀,透析,层析,治疗用试剂,洗涤,或富集某些细胞群。术语还涵盖临床样品,并且还包括培养中的细胞,细胞上清液,组织样品,器官,和类似物。样品也可以包括新鲜冷冻和/或福尔马林固定,石蜡包埋的组织块,如从临床或病理活检制备的块,对于通过免疫组织化学病理分析或研究制备。
术语“特异性结合”,“特异于”,和相关的语法变体是指此种配对物种如抗体/抗原,酶/底物,受体/激动剂,和外源凝集素/碳水化合物其可以通过共价介导之间发生了结合或者非共价相互作用或共价和非共价相互作用的组合。当两个物种的相互作用产生非共价结合的复合物,发生的结合一般是静电,氢键合,或亲脂相互作用的结果。
因此,“特异性结合”的发生配对的物种之间那里是产生在两者之间互动的约束具有一个抗体/抗原或酶/底物相互作用的特性复杂。具体地,特异性结合的特征是结合一对的一个成员的一个特定的物种,并没有其他物种家庭到结合成员的相应部件所属的化合物的范围内。因此,例如,抗体典型地结合至单一表位,并于家族蛋白的内没有其他的表位。在一些实施方案中,抗原和抗体之间的特异性结合将具有至少10-6M的结合亲和力。
在其它实施方案中,抗原和抗体将具有亲和力结合至少10-7M,10-8M 10-9M,10-10M,10-11M或10-12M。
由“特异性杂交”指的是探针,引物,或寡核苷酸在高严格的条件下识别和物理上与一个基本上互补的核酸相互作用(即,碱基对)(例如,TERT核酸),并且基本上不与其它核酸碱基配对。
所需的药理学和/或生理学效果。效果可以是完全或部分预防疾病或其症状,即是预防性,和/或对疾病和/或不利的影响因素部分或完全治愈,即是治疗性的。“治疗”,如本文所用,涉及的疾病的任何治疗的受试者,特别是人类,并且包括:(1)预防疾病,可能是易患该疾病但还没有被诊断的受试者中发生作为;(b)抑制疾病,即,阻止其发展;和(c)缓解疾病,例如,使疾病,例如回归,以完全或部分地除去该疾病的症状。在一个具体的实施方案中,所述疾病或病症是癌症。在具体的实施方案中,癌症是甲状腺癌。在进一步的实施方案中,癌症包括膀胱癌和成胶质细胞瘤。
术语“TERT相关疾病,障碍或病症”或“TERT-介导的疾病,障碍或病症”,并与异常TERT活性相关等类的疾病,障碍或病症。在一个具体的实施方案中,所述疾病或病症是癌症。在一般情况下,该术语是指涉及TERT活性的任何异常状态。异常状态的例子可以是一个遗传缺陷。
术语“BRAF相关疾病,障碍或病症”或“BRAF介导的疾病,病症或状况”,并与异常BRAF基因的活性相关联的像的平均疾病,障碍或病症。在一个具体的实施方案中,所述疾病或病症是癌症。在一般情况下,该术语是指涉及BRAF基因的活性的任何异常状态。例如,异常状态可以是由于一个遗传缺陷。
BRAF V600E和TERT启动子突变作为生物标志物。
本发明的发明人发现,BRAF V600E和某些TERT启动子区突变提供一个独特的遗传背景下,预测和鉴定侵袭性最恶的人甲状腺癌。甲状腺癌可以包括滤泡甲状腺癌(FTC),甲状腺乳头状癌(PTC),传统的PTC,滤泡型PTC(FVPTC),高大细胞PTC(TCPTC)。在具体的实施方案中,突变是用于预测和确定侵袭性最恶的PTC的。
因此,在某些实施方案中,BRAF和TERT启动子突变可用于鉴定具有或处于发展的癌症,特别是有侵袭性最恶的癌症的风险的个体。在进一步的实施方案中,BRAF和TERT启动子突变可用于鉴定处于危险的个体具有或发展侵袭性甲状腺癌,包括TCPTC,PDTC,ATC和PTC。在某些实施方案中,侵略性甲状腺癌是PTC。突变可以在具有或没有被诊断出患有癌症受试者进行标识。在其他实施方案中,本文描述的可用于检查BRAF和TERT启动子突变方法和组合也可用于其它癌症,包括黑色素瘤,结肠癌,脑肿瘤,白血病(特别是多毛细胞白血病),肺癌,卵巢癌,子宫癌,子宫颈癌,鼻咽癌,胰腺癌,乳头状颅咽管瘤。
在某些实施方案中,DNA可从来自受试者的生物样品中分离出来。DNA可以提取并使用任何合适的技术的生物样品纯化。许多DNA提取和/或纯化技术在本领域中是已知的,有些以商业产品的形式存在(例如,熔体TM总核酸分离系统,MagMAXTMFFPE总核酸分离试剂盒,MagMAXTM总核酸分离试剂盒,QIAamp DNA试剂盒,全方位纯TM基因组DNA纯化系统,WaterMasterTMDNA纯化试剂盒)。试剂如和TR我也可用于提取和/或纯化的DNA。DNA可使用蛋白酶K和/或RNA酶进一步纯化。
在进一步的实施方案中,引物/探针可用于扩增包含启动子的TERT基因的一个区域。更具体地,引物/探针能够扩增包含启动子区域中的1 295 228 C>T和/或1 295 250 C>T(称为C228T和C250T分别),其对应于从在端粒酶的启动子的翻译起始位点逆转录酶(TERT)基因的-124C>T和-146C>T。在一个实施方案中,引物包含SEQ ID N0:2中所示的核酸序列。在另一个实施方案中,引物包含SEQ ID N0:3中所示的核酸序列。一种引物组可包含于SEQ ID N0:2和SEQ ID NO:3中所示的核酸序列。
在某些实施方案中,引物/探针可用于扩增包含T1799A(V600E)突变位点的BRAF基因区域。在一个实施方案中,引物包含SEQ ID N0:4中所示的核酸序列。在另一个实施方案中,引物包含SEQ ID N0:5中所示的核酸序列。一种引物组可包含于SEQ ID N0:4和SEQ ID NO:5中所示的核酸序列。
在具体实施方案中,使引物特异性地与来自受试者DNA的TERT或BRAF基因杂交。引物和DNA从而形成一个引物:DNA复合。在某些实施方案中,杂交条件是使得引物的形成:DNA复合是检测步骤本身,即,在仅有突变时(TERT C228T,TERT C250T和/或BRAF基因铊部799A(V600E)),才形成复合物。在其他实施方案中,引物:DNA复合物是使用聚合酶链反应扩增,以检测突变的存在。在某些实施方案中,所述突变是通过测序检测。
如本文所述,在某些实施方案中,引物可用于支持DNA扩增反应。引物将能够以序列特异性的方式典型地被扩展。以序列特异性方式的引物的延伸,包括其中所述核酸分子的序列或组合物的引物杂交的任何方法或以其他方式相关联的指示或影响由引物的延伸产生的产物的组合物或序列。因此一个序列特异性方式的引物延长包括,但不限于,聚合酶链反应,DNA测序,DNA延伸的DNA聚合,RNA的转录或反转录。
该扩增的序列特异性决定的方式和引物技术和条件是优选的。在某些实施方案中,引物用于DNA扩增反应,如PCR或直接测序。据了解,在某些实施方案中,引物也可使用非酶技术,其中,例如,用于延长引物的核苷酸或寡核苷酸修饰,使得它们将发生化学反应,以序列特异性方式使引物延伸。典型的是,让引物杂交本文公开的多核苷酸序列或区域,或者它们杂交与本文公开的多核苷酸序列区域的互补多核苷酸序列。
在某些实施方式中,用于与本文公开的多核苷酸序列反应的引物或探针可以是任何大小,其用途是支持理想的引物的酶操作,如DNA扩增或探针或引物的简单杂交。典型的引物或探针将至少为6,7,8,9,10,20,30,40,50,60,70,80,90,100,125,150,175,200,225,250,275,300,325,350,375,400,425,450,475,500,550,600,650,700,750,800,850,900,950,1000,1250年,1500年,1750年,2000年,2250,25002750,3000,3500,或4000个核苷酸长,或在其之间任意的长度。
特异于TERT基因的扩增引物可被设计用来产生包括TERT C228T和/或TERTC250T位点的扩增产物。同样的,对于BRAF基因的扩增引物可被设计来产生包括T17799A(V600E)位点的扩增产物。这样的扩增产物可以是任何适当的长度,包括但不限于,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118,119,120,121,122,123,124,125,126,127,128,129,130,131,132,133,134,135,136,137,138,139,140,141,142,143,144,145,146,147,148,149,150,151,152,153,154,155,156,157,158,159,160,161,162,163,164,165,166,167,168,169,170,171,172,173,174,175,176,177,178,179,180,181,182,183,184,185,186,187,188,189,190,191,192,193,194,195,196,197,198,199,200,201,202,203,204,205,206,207,208,209,210,211,212,213,214,215,216,217,218,219,220,221,222,223,239,240,241,242,243,244,245,246,247,248,249,250,251,252,253,254,255,256,257,258,259,260,261,262,263,264,265,266,267,268,269,270,271,272,273,274,275,276,277,278,279,280,281,282,283,284,285,286,287,288,289,290,291,292,293,294,295,296,297,298,299,和300或更多个核苷酸。
探针或本发明的引物可通过公知的本领域技术人员的常规技术来制备。例如,该探针可以使用固相合成使用市售设备来制备。修饰的寡核苷酸也可以通过类似的方法容易地制备。探针也可以直接在固体支持根据本领域的标准方法来合成。当所述多核苷酸探针是一种核酸阵列的一部分,合成的多核苷酸的这种方法是特别有用的。
因此,本发明还提供了预测,诊断和预后试剂盒,包括简并扩增TERT和/或BRAF基因的引物和包含扩增方案和结果的分析指示靶核酸。试剂盒可以包括用于执行至少一个基因的PCR扩增,包括TERT和/或者BRAF基因的组件。在一个实施方案中,试剂盒包括用于产生包括TERT C228T和/或TERTC250T基因的扩增产物的引物。类似地,对于BRAF基因的扩增引物可被设计为产生包括T1799A(V600E)位点的扩增产物。在一个具体的实施方案中,引物包括SEQ ID NO:2,SEQ ID NO:3,SEQ ID NO:4和/或SEQ ID NO:5。在另一个实施方案中,试剂盒还可以包括生物收集/储存容器中。在具体的实施方案中,试剂盒包括阳性对照DNA,阴性对照和/或一个主混合物用于进行PCR扩增。在另一个实施方案中,试剂盒包括用于测序的扩增产物组成。在一个具体的实施方案中,试剂盒包括用于扩增的PCR产物的正向/反向测序的混合。在某些实施方案中,一个单独的PCR试剂盒和一个独立的测序试剂盒被提供。另外,试剂盒也可包括用于两个PCR扩增和测序的组件。该试剂盒还可以包括用于进行扩增和/或测序方案的说明。
在更具体的实施方案中,该试剂盒可以包括缓冲剂,酶,以及用于执行扩增产物的扩增和分析的容器。该试剂盒还可以是筛选,诊断或预后试剂盒,包括其它工具,例如DNA微阵列的一个组成部分。在一些实施方案中,试剂盒还提供了一个或多个控制模板,核酸从正常组织中分离,例如样品,和/或一系列表示在TERT和/或BRAF基因不同的方差的样品。
在一个实施方案中,试剂盒提供了能够扩增TERT基因的不同区域中的至少一种引物。该试剂盒还包括能扩增BRAF基因的区域中的至少一种引物。所述试剂盒可以包括用于多种基因差异表达的分析的附加引物的生物样品中的一种反应或几个平行的反应。在试剂盒的引物可以被标记,例如荧光标记,以便于扩增产物和核酸方差随后分析的检测。
在一个实施方案中,多于一个的突变/变异可以在一个分析来检测。因此,一个组合工具包将包括能够扩增的TERT基因的不同区段的引物。所述试剂盒还可以包括能够扩增另一基因,其中包括BRAF基因的片段的引物。可将引物差异化标记,例如,使用不同的荧光标记,从而为方差之间的区分。所包含的试剂盒中的引物可以包括从互补序列选择为TERT或者BRAF基因的编码序列的引物。
在某些实施方案中,患者可以通过添加生物样品从患者到所述试剂盒获得的(例如,血液,血清,尿液等),并检测所述TERT启动子突变(多个),例如,由一个被诊断或确定方法,该方法包括以下步骤:(i)从患者采集血液或血清;(ii)将来自患者的血液的DNA;(iii)加入从患者的诊断试剂盒的DNA,和(iv)检测(或不)的BRAF和TERT启动子突变。在该示例性方法中,引物被带入与患者的DNA的接触。引物的形成:DNA复合物可以,例如,被PCR扩增,并且在一些实施方案中,测序,以检测(或不)的BRAF和TERT启动子突变。在其它试剂盒和诊断实施方案中,血液或血清不需要从患者收集的(即,它已经被收集)。此外,在其他实施方案中,所述样品可包括组织样品,尿液或临床样品。
无需进一步详细说明,可一相信本领域的技术人员,利用前面的描述,可最大限度的利用本发明。下面的实施例仅是说明性的,而不以任何方式限制本文公开内容的其余部分。
例子
下面的提出一些实例,以便为本领域中的普通技术人员提供如何的化合物,组合体,物品,装置和/或所描述和要求保护的本文方法制成并评价,此完整的公开和描述是纯说明性的,并非旨在限制发明人其发明的范围。虽然已作出努力以确保相对数字的准确性(例如,量,温度等),但会有一些误差和偏差。除非另外指出,否则,份是重量份,温度为摄氏度或处于环境温度,并且压力处于或接近大气压。有许多变化和反应条件,例如,组分浓度,所需溶剂,溶剂混合物,温度,压力和其它反应范围和条件,可用于优化由所述方法获得的产物纯度和产率的组合。只有合理和常规的实验将需要优化这样的工艺条件。
例1:共存BRAF V600E和TERT启动子突变是一个独特的遗传背景,预测并标志侵袭性最恶的人类癌症。
目的:探讨BRAF V600E突变和TERT启动子突变CHR5:1,295,228C>T(C228T)单独和共存在乳头状甲状腺癌(PTC)的预后价值。
患者和方法:在507例(365women和142名男性)PTC的临床病理结果BRAF和TERT C228T突变关系的回顾性研究,年龄45.9±14.0年24个月(四分8-78个月,中位随访)。
结果:共存的BRAF V600E和TERT C228T突变比单种突变与PTC的高风险的临床病理特征更相关。肿瘤复发分别为25.8%(50/194)[77.60(95%CI 58.81-102.38)每1000人年]与[每1000人年22.88(95%CI 16.00-32.72)]在BRAF 9.6%突变阳性与[每1000人年108.55(95%CI 75.43-156.20)]阴性的患者[HR(95%CI)3.22(2.05-5.07)和47.5%(61分之29)]与11.4%(51/446)[30.21(95%CI 22.96-39.74)每1000人年]在TER Tmutation阳性与阴性患者[HR(95%CI)3.46(2.19-5.45)]。有共存的基因突变患者的复发率为68.6%(24/35)[211.76(95%CI 141.94-315.94)],相对于没有基因突变的患者复发率8.7%(25/287)[21.60(95%CI14.59-31.97)],对应的危害指数[HR(95%CI)8.51(4.84-14.97)]。后者在多临床辅因子调整后仍显著。无病的患者生存曲线显示温和回落,而BRAF V600E和TERTC228T两个并存的突变组急剧下降。
结论:BRAFV600E和TERT C228T突变的共存形成一种新的遗传背景,其决定了PTC最差的临床结果,有独特的预后和治疗指导意义。
材料和方法
病人和临床数据。该研究共纳入507例患者(365女性和142名男性),年龄在45.9±14.0年,都是在约翰霍普金斯医院做甲状腺全切除术治疗的PTC病人,和临床跟踪从1990年至2012年,随访中位数是24个月(四分位8-78个月)。根据个体所需,病人经历了治疗性颈清扫术和放射性碘消融。研究符合以前提出的下列指征和标准。人口统计数据及基本资料显示于表1中。得到医院审查委员会的批准和病人的知情同意后,我们获得了甲状腺瘤标本,进行基因分析和回顾性收集临床病理资料。PTC在我们的病人病理诊断均正式成立。PTC的疾病阶段被定义根据美国联合委员会癌症分期系统。肿瘤复发是由组织学/细胞学/碘定义影像学证实复发/持续PTC瘤。随访时间定义为从最初的治疗到甲状腺疾病复发的发现,或在无疾病复发的病例中时间间隔到最近的临床随访。在所有的病人种,突变分析结果没有影响手术及放射性碘治疗的方案设计实施,遗传的分析是治疗后进行。
突变分析。基因组DNA从原PTC肿瘤用标准的苯酚-氯仿提取和乙醇沉淀方法分离并进行传统的Sanger测序来检测BRAF V600E和TERT C228T突变。对于BRAF V600E。聚合酶链反应(PCR)和条件如前所述(Xing et al.J.CLIN Endocrin.Metab.90:6373-79,2005)用于扩增含有BRAF的基因外显子15突变热点,接着是是Sanger测序大染料反应。对于TERT C228T,用PCR扩增含有C228T热点TERT启动子的一个片段(Xing et al.ENDOCR-RELAT Cancer.20:603-10,2013)。
C228T和C25OT突变都产生一个11-碱基的核苷酸拉伸5'CCCCTTCCGGG-3'(SEQ ID NO:1)。简言之,TERT启动子的一个片段采用DNA引物和PCR扩增5'-AGTGGATTCGCGGGCACAGA-3'(SEQ ID NO:2)(正向)和5'-CAGCGCTGCCTGAAACTC-3'(SEQ ID NO:3)(反向)。这导致了235碱基对的PCR产物,含有TERT突变C228T和C250T,此在黑素瘤研究证明的(Hometal.2013,Huangetal.2013)。大约40-50ng基因组DNA在PCR中,用在95℃下初始变性步骤为3分钟进行,随后95℃变性的十个周期为30秒,55℃退火30秒,和68℃延伸1分钟。然后将其随后的除了伸长相同的设置30个循环额外5秒每个循环。将PCR用在68℃7分钟的最终延伸步骤完成。通过凝胶电泳以下PCR产物的质量确认,测序进行PCR在约翰使用Big Dye终止v3.1循环测序现成反应试剂盒(Applied Biosystems公司),并在ABI PRISM 3730自动下一代遗传分析仪(Applied Biosystems)中霍普金斯大学的测序设备。当一个突变通过使用有义引物大染料测序鉴定,使用反义引物,以确认突变重复该反应。
BRAF V600E突变分析是循前人所述的(Hu et al,2006)。
(正向)和GGCCAAAAATTTAATCAGTGGA(SEQ ID NO:5):简言之,将包含对T1799A(V600E)突变位点的BRAF基因的外显子15用引物TCATAATGCTTGCTCTGATAGGA(4-SEQ ID N0)PCR扩增(反向),得到212bp的产物。PCR设置包括95℃5分钟一个循环;95℃两个周期l的分钟,60℃的L-分钟,和72℃的L-分钟;95℃两个周期对于L分钟,58℃对于L分钟,72℃1分钟;和35个循环的95℃1分钟,56℃1分钟,和72℃1分钟,接着在72℃的延伸步骤5分钟。通过琼脂糖凝胶电泳质量确认后,如以上针对TERT突变描述的PCR产物进行大染料反应和测序分析。所有的突变使用正向和反向引物,都得以确认。
统计分析。分类数据进行了总结与频率和百分比。连续数据进行了总结与手段±标准差(如正态分布)或中位数和四分位距(如果不是正态分布)。采用x2检验,或对于小细胞大小不一,Fisher精确检验进行分类变量的比较。独立t检验和Wilcoxon-Mann-Whitney检验,分别用于正常和非正常分布的连续变量。与数秩检验和Cox比例风险回归Kaplan-Meier生存曲线分析,复发的时间审查患者或者,如果没有复发,最后随访时,被用来比较通过突变无复发生存率状态。PTC复发突变的独立作用做Cox回归分析检查。所有的P值分别为双面和P<0.05被视为统计学显著。用Stata(Stata/SEversion 10.1for windows;StataCorp,College Station,Texas,USA)和GraphPad Prism(version6for Windows;GraphPad Software,Inc.,San Diego,CA,USA)做统计分析。
结果
PTC中BRAF V600E和TERT C228T突变。我们研究了507例PTC中BRAF V600E和TERT C228T突变,包括多个亚型PTC(表5)。BRAF V600E发生在164/383(42.8%)的CPTC,15/103(14.6%)FVPTC,14/19(73.7%)TCPTC,和1/2(50%)的柱状的PTC。总的发生率为38.3%(194/507)。TERT C228T发生在47/383(12.3%)CPTC,8/103(7.8%)FVPTC,5/19(26.3%)TCPTC,和1/2(50.0%)的柱状PTC,总的发生率为12.0%(61/507)。BRAF突变与TERT C228T的显著相关(表6)。具体而言,对所有PTC的整体分析,TERT C228T发现在26/313(8.3%)BRAF突变阴性的病例发现,但在35/194(18.0%)BRAF基因突变阳性病例,相反,BRAF基因突变发先在159/446(35.7%)TERT突变阴性病例,但35/61(57.4%)TERT突变阳性病例[比值比(OR)(95%CI):2.43(1.40-4.21);P=0.001]。同样的结果也在CPTC中发现(表6)。BRAF和TERT突变共存在35/507(6.9%)所有PTC中和28/383(7.3%)CPTC中(表5)。
BRAF V600E和TERT C228T突变与PTC的临床的关系。在507PTC(表1)的全面分析,发现BRAF V600E突变几个高风险的临床病理特征,包括患者的男性被显著相关,较大的肿瘤大小,甲状腺外浸润,血管浸润,淋巴结转移,和阶段III/IV。肿瘤复发是30/313(9.6%)[22.88(95%CI:16.00-32.72)每1000人年复发]在BRAF突变阴性的患者与50/194(25.8%)[77.60(95%CI:58.81-102.38),每1000人年]复发的BRAF基因突变阳性的患者[HR(95%CI):3.22(2.05-5.07);P<0.001](表7)。同样,TERT C228T与这些临床病理特征显著相关联,并也与老年患者的年龄和远处转移复发相关(表1)。在TER T突变阴性的情况下肿瘤复发是51/446(11.4%)[30.21(95%CI:22.96-39.74)每1000人年复发],而突变阳性肿瘤复发是29/61(47.5%)108.55(95%CI:75.43-156.20),每1000人年][HR(95%CI):3.46(2.19-5.45);P<0.001](表7)。BRAF V600E和肿瘤复发相对于TERT C228T的HR为高度显著,在调整病人的年龄和性别后仍然显著。如所料,调整病理指证后,失去了显著意义(表7)。
对CPTC(表1和表7)单独进行分析,获得了类似的结果。例如,无论是BRAF V600E和TERT C228T突变都与几个高风险的临床病理特征有关。较高的肿瘤复发率和每1000人年复发都与BRAF V600E或TERT C228T突变有关。BRAF V600E肿瘤复发的HR(95%CI)为3.10(95%CI:1.85-5.20)(P<0.001),HR(95%CI),TERT C228T为3.32(95%CI:2.00-5.52)(P<0.001)。
单独BRAF V600E或单独TERT C228T或者二者共存对PTC的临床病理的影响。对所有PTC的分析(表2),同两种突变都阴性相比,BRAF V600E单独时与大的肿瘤,甲状腺外浸润,淋巴结转移,疾病分期III/IV和肿瘤复发相关。TERT C228T单独时显著与淋巴结转移有关,但与其他临床病理特征有微不足道的关联。形成呈鲜明对照的是,BRAF V600E和TERT C228T的共存时,几乎与所有经典的高风险特性以及远处转移何复发都有紧密相关性。病人若携带BRAF和TERT两个突变,复发率最高,是24/35(68.6%)[211.76(95%CI:141.94-315.94)每1000人复发年],相对于无突变病人的复发率25/287(8.7%)[21.60(95%CI:14.59-31.97)每1000人年],风险指数为HR 8.51[(95%CI):(4.84-14.97);P<0.001](表3)。
在CPTC分析中(表2)可以看到类似的BRAF V600E和TERT C288T突变的作用。同两突变阴性相比,BRAF V600E与高风险的临床病理特征以及肿瘤复发显著相关。TERT C228T单独与血管侵袭和淋巴结转移相关显著,但其他参数无统计学意义。相比之下,BRAF V600E和TERT C228T的共存与所有的高风险的临床病理特征有显著相关。在BRAF V600E和TERT C228T的共存病人,肿瘤复发是20/28(71.4%)[191.85(95%CI:123.77-297.36)每1000人年复发],而复发在突变阴性组只有18/200(9.0%)[22.23(95%CI:14.00-35.28),每1000人年],对应的危险指数HR是7.7395%CI:4.07-14.67;P<0.001](表3)。
相对于BRAF或TERTC228T单个突变,两突变的共存对甲状腺复发的作用有显著的进一步递增(表4)。具体而言,对所有PTC的分析中,含有共存基金的肿瘤复发是24/35(68.6%)[211.76(95%CI141.94-315.94),每1000人年复发],相对于只有BRAF突变中复发率26/159(16.3%)[48.96(95%CI:33.34-71.91)每1000人年][HR(95%CI):3.62(2.07-6.33);P<0.001],和只有TERT突变时复发率5/26(19.2%)[32.5(13.53-78.09)每1000人年][HR(95%CI):6.16(2.29-16.61);P<0.001]。事实上,PTC复发在两个突变共存时远高于BRAF和TERT基因单个突变之和,说明两个突变共存的作用对复发有强大的协同效应。在单独对CPTC的分析时,得到了类似的结果(表4)。
BRAF V600E和TERT C228T对PTC患者无病生存的影响。我们用Kaplan-Meier和log-rank对患者基因型和无病生存率进行了分析。在所有的PTC(图1A)的分析中,肿瘤无复发生存率曲线在BRAF V600E(左图)或TERT C228T(右图)阴性患者温和下降。有BRAF突变(左图)或TERT突变(右图)时,曲线进一步下降。对CPTC(图1B)的分析,获得了类似的结果。
图2A显示BRAF V600E或TERTC228T或他们共存时对PTC患者肿瘤复发的影响。从无突变,到TERT突变,到BRAF突变,再到BRAF和TERT突变共存,曲线依次下降,但共存的BRAF和TERT突变组的曲线下降非常尖锐。几乎相同的结果在CPTC也观察到了(图2B)。
表3所显示调整经典临床病理危险因素后BRAF V600E和TERT C228T突变的影响。相对于突变阴性组,肿瘤复发的HR对BRAF基因突变为2.24(95%CI:1.29-3.88),调整患者性别和年龄后变为2.16(95%CI:1.24-3.75)仍显著,调整其它因素后变为不显著。复发HR对TERTC228T单独时不显著,95%可信范围越过1.0.呈鲜明对照,复发HRs在BRAF和TERT突变共存时是8.51(95%CI:4.84-14.97),做病人年龄和性别调整后,其维持在8.41(95%CI:4.44-15.94),显著;进一步做其它危险因素调整后,仍然显著,维持在3.10(95%CI:1.24-7.75)。
分析CPTC得到似的结果(表3)。例如,在两个突变共存对CPTC未调整,调整后的第一级,以及调整为第二的肿瘤复发的HR为7.73(95%CI:4.07-14.67),7.50(95%CI为:3.71-15.17)和4.39(95%CI:1.42-13.54),均显著。
讨论
本研究发现了BRAF V600E和TERT C228T突变的共存,它确定和定义了侵袭性最恶的乳头状甲状腺癌的新的遗传背景。两种突变共存时的复发比没有突变显著高,甚至在对经典的临床病理危险因素的多元调整后仍然显著。PTC复发在共存BRAF和TERT基因突变时比单独突变或与单独的两个突变相关的复发的总和也高,显示了共存两个突变的增量和协同作用。这些结果在所有PTC和CPTC亚型和整体分析相似,确立两个突变共存是一个重要的新的遗传背景,对PTC的最坏侵袭性有重要意义。
BRAF基因和TERT启动子突变的这种协同效应可以在分子水平得以解释。TERT通过维持染色体的端粒,增加细胞的永生保持染色体的长度,和促进细胞增殖,降低的细胞凋亡。转基因小鼠模型过量表达TERT显示增加肿瘤的发展和发生恶变。与此一致的发现是TERT在人类癌症的作用,包括甲状腺癌。TERT C228T赋予E-26(ETS)转录因子结合基序(GGA[A/T]或CCGGAA),因而增加了TERT启动子的转录活性。作为MAP激酶途径上调的ETS系统的活化,BRAF V600E和TERT C228T共存形成的独特机制上调TERT的表达。的确,这两个突变的共存用在PTC的TERT蛋白的表达升高有关。这种在加重癌的发展中BRAF和TERT的合作用很是有趣,这类似于p53基因突变和TERT的诱导表达协同促进癌症发展的转基因小鼠模型中的发现。与TERT C228T在PTC的临床病理较差预后的发现一致,最近TERT启动子突变发现与脑肿瘤相关的患者的死亡率,膀胱癌复发,和喉癌患者存活差有密切关系。
许多研究已经证明,在PTC的BRAF V600E导致在肿瘤侵袭性作用,甚至病人的死亡,但一些研究未能对此证明。在本研究中,肿瘤复发的HR在病人的年龄和性别多元调整后显著下跌。此统计的结果不应该被解释为缺乏BRAF突变的的作用。在生物学方面,BRAF突变使用不同的分子机制,以促进侵袭性的肿瘤行为。有些肿瘤的行为,尤其是淋巴结转移,是PTC复发的主要来源。所以,并不奇怪,统计调整可人为地(误导性地)减低BRAF突变的效果。本研究是一个较大的分析PTC中的BRAF突变的作用的研究,但或许需更大标本研究才能显示BRAF突变的独立作用。相对照的是,在经经典临床病理因素的多元分析后,共存BRAF突变和TERT突变对甲状腺癌的作用仍然很大。
当把BRAF突变分开,TERT作用变失去显著性,表明TERT突变需要额外的遗传变异合作推动PTC的侵袭性。我们以前报道TERT C228T在ATC,PDTC和甲状腺癌的细胞系发生率很高,此高发生率在数次后续文献报道中得以证实。甲状腺癌的细胞系通常是未分化的并常含有多种遗传改变,包括BRAF突变。因此可能他们的侵略性来自共存TERT启动子突变及其它遗传改变,类似于在本研究中发现他们的合作驱动。我们在美国患者的结果与我们最近在中国患者发现的BRAF B600E和TERT启动子突变共存导致PTC的高侵袭性的结果是一致的。
患者在该研究随访时间相对较短。但是,PTC患者的最初几年内通常会出现复发。因此,2年的中位数应该已经广泛捕获了PTC的复发事件。无病生存曲线(图1和2)表明,随着时间的推移,该突变阳性和阴性曲线的分离变得更为突出,表明在后续年份突变对PTC复发的影响更是深刻的。因此,2年的中位随访时间有可能导致BRAF对PTC复发的影响和TERT突变影响的低估。随访时间分别为某些群体有所不同。然而,这种变化是由Cox比例修正和回归分析,因为这些标准统计方法含有时间为变量到模型中。为了进一步校正时间的变化,我们也还报告了每1000人年复发。
总之,这项研究确定了共存BRAF V600E和TERT C228T突变作为PTC高侵袭性高复发的新的遗传背景,而两个突变分别单独对PTC的侵袭性的影响相对较小。这些遗传模式,通过对PTC的患者分成不同的风险群体,具有重要的预后和治疗指导意义。
实施例2:两个基因突变在黑色素细胞瘤共存—TERTC228/250T启动子突变和BRAF V600E突变之间的显着关联。
表8.TERTC228/250T和BRAFV600E突变在黑色素细胞瘤中的相关性
在表9到11中:“O”为无事件发生;“1”为事件发生。
在下面表9的分析中,患者被分成两个组:一,BRAF野生型(非基因突变);二,BRAF基因突变。与组一比较,组二的死亡轻微显著增高,表明BRAF突变对黑素瘤患者的死亡有轻微显著的预测能力。“1”为病人死亡,“0”为没有死亡。
表9.BRAF突变在黑素瘤患者死亡中的作用
以下表10分析中,患者被分成两个组:一,正面(1)为TERT C228T/C250T突变;二,负(0)为野生型TERT。TERT突变组患者死亡显著高,表明TERT启动子突变的显著预测能力在黑素瘤患者的死亡率。
表10.TERT启动子突变在黑素瘤患者死亡中的作用
在下面表11的分析,黑素瘤患者分为四组一,人,没有突变;二,只有BRAF V600E突变;三,只有TERT C228T/C250T突变;四,TERT C228T/C250T和BRAF V600E两者并存。与一组比较,二组单独或三组单独的死亡率都不显著,但四组显著。换句话说,TERT启动子和BARF突变共存时更显著地与患者死亡有关。因此,这些结果表明共存的TERT启动子和BRAF突变对的黑色素瘤有不良影响(患者死亡),二者的共存对因黑色素瘤相关的死亡有很高的预测力。
表11.TERT启动子和BRAF突变对黑色素瘤患者死亡的协同作用
例3:TERT启动子突变在甲状腺细针穿刺诊断中的应用
甲状腺癌是一种常见的内分泌恶性肿瘤,它的发生率近年在全球迅速上升(Howlader等2014;杰马尔等2011)。在美国,有甲状腺癌的62980新病例,并从这种癌症估计2014年1890人死亡(Howlader等,2014)。甲状腺癌的诊断通常由甲状腺结节,这是非常普遍的,在成年人们对体检和人民60年超年龄超过50-70%,约5-10%可见的评价开始(古斯,等人2009;Mazzaferri 1993)。因此,甲状腺结节恶性肿瘤的临床评价是甲状腺行医,其中诊断主要方法是细针穿刺活检(FNAB)的重大任务。细针穿刺(FNAB)在大多数患者中是准确的,因为它可以提供良性或恶性甲状腺肿瘤(玻和Walts 2012)的一个可靠的诊断。但是,在病例的25-30%中,FNAB产生不确定的细胞学研究结果,留下甲状腺结节的诊断本组中的困境。以约25%的用于与FNAB不确定细胞学相关恶性肿瘤的整体风险,本组病人通常被推荐用于甲状腺和,作为结果,这些患者大多不得不牺牲良性甲状腺肿瘤的甲状腺(库珀等,2009)。随着甲状腺结节此诊断的挑战,也有与甲状腺癌的预后的问题。虽然大多数患者甲状腺癌是无痛的预后良好,某些情况下,似乎注定预后差与疾病的复发和增加患者的死亡率。甲状腺癌的预测风险分层通常一直基于临床风险因素,这往往是不准确的和术前无法使用。
近年来,甲状腺癌基于分子的诊断和预后的方法已被广泛地研究和应用一些分子标记,并证明临床上是有用的(Xing et al,2013b)。这些诊断包括基因表达分类(亚历山大等人2012年),遗传标记面板(尼基福罗夫,等2011年)和galctin-3(Bartolazzi,等,2008)和prognostically BRAF V600E突变(Xing等2014A;Xing等人2013a)。但是,这些标记物的诊断和预后准确性,仍然有待改进。
最近发现甲状腺癌中两个TERT启动子突变对此显示了希望:CHR 5:1,295,228C>T和CHR 5:1,295,250C>T(这里称为分别C228T和C250T,),其分别代表-124C>T核苷酸改变和-146C>T(从TERT基因ATG翻译起始位点算起)。这些突变通过增加TERT启动子的转录活性在人类癌症中起重要作用(坎,等人2013;黄等人2013)。在我们的甲状腺癌的这项研究中(刘等人2013年),TERT启动子突变发现在0.0%(0/85)良性甲状腺肿瘤,11.7%(30/257)乳头状甲状腺癌(PTC),,13.9%(11/79)滤泡性甲状腺癌(FTC),37.5%(3/8)低分化甲状腺癌,和46.3%(25/54)未分化甲状腺癌(ATC)甲.这些结果表明TERT启动子突变与甲状腺癌恶性程度有关。
我们这些发现在其他人随后的研究(Melo等人2014;Vinagre等人2013年;刘等人2016年)得到了证实。如本文所述,我们的研究表明,TERT启动子突变和BRAF V600E突变协同识别PTC最高的复发率(Xing等人2014b)。
这些研究有力地表明,TERT启动子突变是甲状腺癌的潜在新诊断和预后标志物。在这里,我们进行了第一次研究,以评估直接在甲状腺结节和甲状腺癌术前评价预后的诊断,可在甲状腺细针穿刺细胞学检查标本检测评估,证明了术前检测TERT启动子突变的价值。
材料和方法
FNAB样本和DNA提取。如前所述,术前获得308FNAB标本FNAB对甲状腺结节的308例患者谁接受甲状腺切除术的建立甲状腺癌,细胞学不确定的甲状腺结节或症状甲状腺肿大(Xing等2009;邢等,2004)。用蛋白酶K消化,酚-氯仿提取,乙醇沉淀的标准方法从细针抽吸活检标本分离基因组DNA。这项研究是基于一个机构审查委员会批准的方案进行,并得到适当的书面知情同意书的患者。
DNA测序以鉴别TERT启动子和BRAF V600E突变。标准聚合酶链反应(PCR)技术进行直接的基因组DNA测序以确定TERT启动子突变进行(参见Liu等人。2013年)。简言之,TERT启动子的一个片段,其包含的位点TERT启动子突变C228T和C250T,通过PCR扩增基因组DNA使用引物5'AGTGGATTCGCGGGCACAGA 3'(正向)FNAB标本(SEQ ID NO:2)和5'CAGCGCTGCCTGAAACTC 3'(反向)(SEQ ID NO:3)。含约40-50纳克基因组DNA /反应的标准反应混合物的PCR反应在95℃下进行3分钟,初始变性进行,随后10个循环95℃变性30秒,55℃退火30秒,和68℃延伸1分钟。然后将其延长长为每个周期中增加5秒,并在68℃用伸长的完成为7分钟的相同的设置30个循环。PCR产物的质量确认通过凝胶电泳来实现和使用Big Dye终止剂v3.1循环测序反应试剂盒(Applied Biosystems公司),并在我们的机构测序在ABI PRISM 3730自动下一代遗传分析仪(Applied Biosystems公司)进行测序的PCR设施。
BRAF V600E突变的鉴定类似地通过直接的基因组DNA测序获得(见邢等人,2005)。简单地说,进行PCR以扩增含有用于使用引物TCATAATGCTTGCTCTGATAGGA(有义)的T1799A(V600E)突变位点的BRAF基因的外显子15(SEQ ID NO:4)和GGCCAAAAATTTAATCAGTGGA(反义)(SEQ ID NO:5)。这就产生了一个212-bp的PCR产物。在PCR设置包括95℃5分钟,一个循环;95℃两个周期1分钟,60℃1分钟,72℃1分钟;95℃两个周期为1分钟,58℃1分钟,72℃1分钟;95℃35个循环1分钟,56℃1分钟,72℃1分钟,随后在72℃的延伸5分钟。通过凝胶电泳质量确认后,将PCR产物进行大染料反应和测序分析。
甲状腺细针穿刺FNAB标本上TERT启动子突变测试的诊断潜力。我们分析了来自308患者活检甲状腺结节证实术后病理诊断术前获得的两个TERT启动子突变和BRAF V600Emutation 308FNAB试样的状态。其中包括111PTC,FTC 18和179良性甲状腺结节(包括腺瘤11l例,55例结节增生,和桥本氏甲状腺炎的13例)。如表12所示,没有TERT启动子突变在任何179良性甲状腺结节被发现。TERT启动子突变C228T和C250T发现在9例甲状腺癌症中,包括5PTC和4FTC。总的发生率为7.0%(129分之9,这比在癌肿瘤测的发生病率稍低(刘等人2013;Liu等人2014;梅洛等人2014;Vinagre等人2013年),可能反映细针穿刺细胞学检查标本直接基因测序稍低的敏感性,如前所讨论的(邢等,2004)。BRAF V600E突变现在37.8%(42/111)的PTC穿刺样本,比PTC肿瘤标本的检测的发生率稍低(Xing,2005;Xing,2006),再次反映了FNAB标本直接基因测序少稍逊的敏感性(Xing等,2004)。BRAF V600E阳性PTC还可含有TERT启动子突变,包括TERT C228T或TERT C250T。TERT启动子和BRAF V600E突变的综合发生率在PTC的甲状腺结节为40.5%(45/111)。对PTC和FTC的甲状腺结节整体分析时,BRAF V600E是32.6%(42/129)和TERT和BRAF突变综合发生率为38.0%(49/129号)。基于这些结果,TERT启动子突变对FNAB标本甲状腺癌的诊断的特异性为100%,灵敏度为7.0%。当TERT启动子突变与BRAF V600E联合使用,诊断的特异性仍然是100%,灵敏度上升到38.0%。这也表示TERT突变的检测使单独BRAF突变的诊断敏感度增加了(表12)。因此,对FNAB TERT启动子突变术前检查可以帮助甲状腺癌的确切诊断,帮助甲状腺结节的诊断评估。
表12.甲状腺细针穿刺标本上TERT启动子突变和BRAF V600E突变的诊断性检测
脚注:*良性甲状腺结节包括腺瘤111例,55例结节增生,而桥本甲状腺炎的13例。
**PTC含有TERT C228T和BRAF V600E突变;其它含有TERT C250T和BRAF V600E突变。PTC,甲状腺乳头状癌;FTC,滤泡甲状腺癌。
结果
甲状腺FNAB标本上测TERT启动子突变的预后潜力。测试FNAB标本的TERT启动子突变阳性的甲状腺结节,大多是甲状腺癌的表现的有高危险特征的,如淋巴结转移,甲状腺外浸润,远处转移,肿瘤复发,甚至病人死亡五例PTC的TERT启动子突变阳性的甲状腺结节的四有这样的结果。具体而言,病人1(MX225),对TERT C228T术前细针穿刺细胞学检查,是一名51岁男子,在其中甲状腺有一个2.0厘米PTC,伴有甲状腺外侵袭和20/85颈部淋巴结转移。患者2(MX 249),对TERT C228T术前细针穿刺细胞学检查阳性,这也是一个51岁的男子,在其中甲状腺后一个3.5公分的肿瘤具有混合PTC和ATC,伴有甲状腺外浸润和11/18的淋巴结有转移。手术后的成像显示肺部广泛转移。他在诊断一年后死亡。患者3(MX279),TERTC228T和BRAF V600E突变的术前细针穿刺细胞学检查都为阳性,这是是一名54岁的男子,在其中甲状腺发现个2.5厘米PTC,在右侧甲状腺叶,有高细胞成分,并有7/16淋巴结转移,入侵气管,还转移复发,在右后髂骨,并且在初始治疗后31个月转移至肺部,对放射性碘不敏感。患者4(MX466),C250T和BRAF V600E术前细针穿刺细胞学检查双重阳性,这是一名74岁的男子,其甲状腺发现多灶性PTC,最大者为3.0厘米,左甲状腺叶血管浸润,有4/11淋巴结转移。即使甲状腺放射碘治疗后,促甲状腺激素刺激的甲状腺球蛋白仍在上升,这是在写这篇文章的时候进行的最后的诊断评估。患者5(MX525),术前细针穿刺细胞学检查TERT C228T突变阳性,是一个47岁的男子,其甲状腺右侧叶含一2.5厘米PTC,无淋巴结清除。在于初始治疗55个月后没有明显的疾病复发。两例对TERT启动子和BRAF V600E突变共有的患者都出现疾病复发。
四例FTC的TERT启动子突变阳性的甲状腺结节的三个表现较差临床结果。具体来说,患者1(MX39),对TERT C228T术前细针穿刺细胞学检查阳性,是一个54岁的女性,在其甲状腺发现6.5厘米的FTC,她目前临床上在被随访。患者2(MX66),对TERT C250T术前细针穿刺细胞学检查阳性,是一名77岁的男子,其甲状腺莉发现一个8.0-厘米FTC在左甲状腺叶,血清甲状腺球蛋白逐渐上升。一个6.0厘米的复发性FTC在左颈部和一个肺部转移灶初始治疗后11年被发现的。患者3(MX238),术前细针穿刺细胞学检查TERTC 228T突变阳性,这是一个74岁的男子,其甲状腺癌伴有丰富的甲状腺外和血管侵润,右甲状腺叶有一个5.0厘米FTC。放射性碘治疗全身扫描显示广泛骨转移至颅底,胸骨,近端右上肢,右肱骨近端,胸椎和腰椎,左侧后下肋骨,右肩胛,盆骨,双侧股骨。患者在从FTC转移的初步诊断和治疗后10个月死亡。患者4(MX488),TERT C250T术前细针穿刺细胞学检查阳性,是一个67岁的女性,其甲状腺含有一个1.5厘米FTC,在甲状腺左叶,随访32个月后无复发。
总体而言,TERT阳性的病人表现出侵袭性的肿瘤行为和差的临床结果,包括疾病的复发和在一些患者的死亡,甲状腺结节的术前FNAB测试TERT启动子突变阳性率问哦7/9(78%),这些病人的甲状腺癌预后很差。
讨论
这个研究第一次直接调查对甲状腺FNAB标本术前测试TERT启动子突变,以协助甲状腺癌的的诊断和预后评估。在本研究中发现,分化型甲状腺癌TERT启动子突变(PTC和FTC)的发生率比原发肿瘤的一般报道的频率略低,反映了对细针穿刺细胞学检查标本直接测序敏感度少差(Xing等人,2004年)。此试验的灵敏度可预期通过使用更灵敏的检测方式,例如在Mutector比色法测定得到改善(Xing deng ren,2009;邢等2004)或实时轻循环仪PCR和荧光解链曲线分析(Nikiforov的等2011)。不过,本研究主要证实例行细针穿刺细胞学检查样本检测TERT启动子突变的可行性。与BRAF V600E突变相比,TERT启动子突变的发生率在甲状腺癌相对较低。因此,单独TERT启动子突变检测对细针穿刺细胞学检查诊断的敏感性较低。然而,当TERT启动子突变与其它突变组合使用时,其诊断敏感度增加。特别是当使用更灵敏的测试方法和TERT启动子突变在结合目前已知的分子标志物,如BRAF突变,ras突变,和RET-PTC和PAX8/重排,其中有一个灵敏度测试这可能是正确的接近90%的FNAB细胞学不确定的甲状腺结节(尼基福罗夫等,2011)。目前的研究已经证实,TERT启动子的突变可增加BRAF V600E突变的诊断敏感性,对甲状腺癌的确切诊断细胞学中的不确定甲状腺结节很有帮助。因此,可预期,采用TERT启动子突变会改善对甲状腺癌的诊断的遗传分子标记的诊断的敏感性(Nikiforov的等2011),可提高上述灵敏度至90%以上。TERT启动子突变的检测也可能提高基因表达的分类谱(Alexander等人2012)和半乳凝素3(Bartolazziet人,2008年)的诊断值。重要的是,在大量的良性FNAB标本,我们没有发现任何TERT启动子的突变,与原发肿瘤的类似研究结果是一致。与最近的几项研究相似(Liu等人2013;Liu等人2014;Melo等人2014;Vinagre等人2013年),从而表现出100%的诊断特异性。这意味着,在细针抽吸活检的标本上检测TERT启动子突变可帮助甲状腺癌有一个明确的诊断。因此,细针抽吸活检,与当前已建立的分子标记的检测一起使用特别恰当,TERT启动子突变的检测将很有可能是提高当前甲状腺结节诊断评估的一个有用的诊断方法。
数项研究证明了侵袭性临床病理特征与TERT启动子突变的关联(Liu等人2013;Liu等人2014;Melo等人2014;兴等人2014b)。与这些原发性肿瘤的研究结果一致,本研究表明,TERT启动子突变阳性甲状腺结节不仅100%为恶性肿瘤,且这些癌症大多也表现高的侵袭性和不良的预后。这些多是侵袭性肿瘤,含有侵袭性行为,包括淋巴结转移,甲状腺外和局部浸润,远处转移,肿瘤复发或患者死亡。7/9(78%)TERT启动子突变阳性的甲状腺结节是侵袭性强的癌。在507例PTC的患者中,我们最近的研究证实TERT启动子和BRAF突变的共存与PTC的特别侵袭性相关,包括与大幅增加复发危险(邢等人2014b)有关。与这些发现符合,本研究发现的PTC有两例有双突变,这两例都具有极高侵袭性和疾病复发。本研究在FNAB标本上直接检测TERT启动子突变,结果首次提供直接证据证明术前测试这些突变能预示高危险的甲状腺癌。术前TERT启动子突变检测结果将有利于患者手前更准确的危险评估,以帮助更好的治疗病人。
总之,术前在FNAB上联合测试BRAF V600E和TERT启动子突变是一种新的分子测试,对甲状腺癌的诊断和预后富有帮助。这是一个有潜力的第一项研究,其结果将为TERT启动子突变整合到目前使用的甲状腺分子检测以协助甲状腺结节诊断及术前危险分层分析和指导甲状腺癌的处理提供重要依据。
参考文献
1.Alexander EK,Kennedy GC,Baloch ZW,CibasES,ChudovaD,DiggansJ,Friedman L,Kloos RT,LiVolsi VA,Mandel SJ,et al.2012 Preoperative diagnosis ofbenign thyroid nodules with indeterminate cytology.New England Journal of Medicine367705-715.
2.Bartolazzi A,Orlandi F,Saggiorato E,Volante M,Arecco F,Rossetto R,Palestini N,Ghigo E,Papotti M,Bussolati G,et al.2008 Galectin-3-expressionanalysis in the surgical selection of follicular thyroid nodules with indeterminatefine-needle aspiration cytology:a prospective multicentre study.Lancet Oncology9543-549.
3.Bose S&Walts AE 2012 Thyroid fine needle aspirate:a post-Bethesda update.Adv Anat Pathol 19160-169.
4.Cooper DS,Doherty GM,Haugen BR,Kloos RT,Lee SL,Mandel SJ,Mazzaferri EL,Mclver B,Pacini F,Schlumberger M,et al.2009 Revised AmericanThyroid Association management guidelines for patients with thyroid nodules anddifferentiated thyroid cancer.Thyroid 191167-1214.
5.Guth S,Theune U,Aberle J,Galach A&Bamberger CM 2009 Very highprevalence of thyroid nodules detected by high frequency(13MHz)ultrasoundxamination.European Journal of Clinical Investigation 39699-706.
6.Hom S,Figl A,Rachakonda PS,Fischer C,Sucker A,Gast A,Kadel S,Moll I,Nagore E,Hemminki K,et al.2013 TERT promote rmutations in familial and sporadicmelanoma.Science 339959-961.
7.Howlader N,Noone AM,Krapcho M,Garshell J,Miller D,Altekruse SF,KosaryCL,Yu M,Ruhl J,Tatalovich Z,et al.2014 SEER Cancer Statistics Review,1975-2011,National Cancer Institute.Bethesda,MD,http://seer.cancer.gov/csr/1975_2011/,based on November 2013 SEER data submission,posted to the SEER website,April2014.
8.Huang FW,Rodis E,Xu MJ,Kryukov GV,Chin L&Garraway LA 2013 Highlyrecurrent TERT promoter mutations in human melanoma.Science 339957-959.
9.Jemal A,Bray F,Center MM,Ferlay J,Ward E&Forman D 2011 Global cancerstatistics.CA:A Cancer Journal for Clinicians 61 69-90.
10.Liu X,Bishop J,Shan Y,Pai S,Liu D,Murugan AK,Sun H,El-Naggar AK&Xing M 2013 Highly prevalent TERT promoter mutations in aggressive thyroid cancers.Endocrine-Related Cancer 20 603-610.
11.Liu X,Qu S,Liu R,Sheng C,Shi X,Zhu G,Murugan AK,Guan H,Yu H,Wang Y,et al.2014 TERT promoter mutations and their association with BRAF V600Emutation and aggressive clinicopathological characteristics of thyroid cancer.Journal of Clinical Endocrinology and Metabolism 99 El130-1136.
12.Mazzaferri EL 1993 Management of asolitary thyroid nodule.N Engl J Med328553-559.
13.Melo M,da Rocha AG,Vinagre J,Batista R,Peixoto J,Tavares C,Celestino R,Almeida A,Salgado C,Eloy C,et al.2014 TERT promoter mutations are a majorindicator of poor outcome in differentiated thyroid carcinomas.Journal of ClinicalEndocrinology and Metabolism 99 E754-765.
14.Nikiforov YE,Ohori NP,Hodak SP,Carty SE,LeBeau SO,Ferris RL,Yip L,Seethala RR,Tublin ME,Stang MT,et al.2011 Impact of mutational testing on thediagnosis and management of patients with cytologically indeterminate thyroidnodules:a prospective analysis of 1056 FNA samples.Journal of ClinicalEndocrinology and Metabolism 96 3390-3397.
15.Vinagre J,Almeida A,Populo H,Batista R,Lyra J,Pinto V,Coelho R,Celestino R,Prazeres H,Lima L,et al.2013 Frequency of TERT promoter mutationsin human cancers.Nature Communications 42185.
16.Xing M,Alzahrani AS,Carson KA,Shong YK,Kim TY,Viola D,Elisei R,Bendlova B,Yip L, Mian C,et al.2014 a Association between BRAF V600 Emutationand recurrence of papillary thyroid cancer.Journal of Clinical Oncology[Inpress].
17.Xing M,Alzahrani AS,Carson KA,Viola D,Elisei R,Bendlova B,Yip L,Mian C,Vianello F,Tuttle RM,et al.2013 a Association between BRAF V600E mutation andmortality in patients with papillary thyroid cancer.JAMA-Journal of the AmericanMedical Association 30 91493-1501.
18.Xing M,Clark D,Guan H,Ji M,Dackiw A,Carson KA,Kim M,Tufaro A,Ladenson P,Zeiger M,et al.2009 BRAF mutation testing of thyroid fine-needleaspiration biopsy specimens for preoperative risk stratification in papillary thyroidcancer.Journal of Clinical Oncology 27 2977-2982.
19.Xing M,Haugen BR&Schlumberger M 2013b Progress in molecular-based management of differentiated thyroid cancer.Lancet 38 11058-1069.
20.Xing M,Liu R,Liu X,Murugan AK,Zhu G,Zeiger MA,Pai S&Bishop J 2014bBRAF V600E and TERT Promoter Mutations Cooperatively Identify the MostAggressive Papillary Thyroid Cancer With Highest Recurrence.Journal of ClinicalOncologypii:JCO.2014.55.5094.[Epub ahead of print].
21.Xing M,Tufano RP,Tufaro AP,Basaria S,Ewertz M,Rosenbaum E,Byrne PJ,Wang J,Sidransky D&Ladenson PW 2004 Detection of BRAF mutation onfineneedle aspiration biopsyspecimens:a new diagnostic tool for papillary thyroid cancer.Journal of Clinical Endocrinology and Metabolism 89 2867-2872.
22.Xing M, Westra WH, Tufano RP, Cohen Y,Rosenbaum E, Rhoden KJ, CarsonKA,Vasko V,Larin A,Tallini G,et al.2005 BRAF mutation predicts a poorer clinicalprognosis for papillary thyroid cancer.Journal of Clinical Endocrinology andMetabolism 90 6373-6379.
23.Xing M 2005 BRAF mutation in thyroid cancer.Endocrine-Related Cancer12245-262.
24.Xing M 2007 BRAF mutationin papillar ythyroid cancer:pathogenicrole,molecularbases,and clinical implications.Endocrine Reviews28742-762.
例4:TERT启动子和BRAF突变协同促进促进甲状腺乳头状癌相关的病人死亡率。
TERT C228T突变是有希望的预后甲状腺肿瘤一个新的遗传机制,但在甲状腺癌患者的死亡率其特定的预后价值尚未确立。本研究探讨TERT C228T突变在乳头状甲状腺癌(PTC)相关的死亡率的作用,特别是相对于BARF V600E突变状态。
方法TERT启动子突变C228T和BRAF V600E在PTC的基因组DNA上用Sanger测序检测,并与PTC相关患者死亡关系作分析。
结果。研究包含有有609名患者(女性436和173名男性,年龄46.1±14.1岁)。端粒酶C228T和BRAF V600E突变分别发现在66(10.8%)和225(36.9%)的病人中。有18患者死亡(3.0%)。死亡发生在13/225(5.8%)BRAF突变阳性和5/384(1.3%)BRAF阴性病例中(P=0.002)和11/66(16.7%)TERT突变阳性与7/543(1.3%)TERT阴性病例(P<0.001)。死亡发生在2/355(0.6%)的没有任何突变(N)的病人,5/188(2.7%)例只有BRAF基因突变的病人(B),3/29(10.3%)例只有TERT突变病人(T)和8/37(21.6%)含有共存的TERT和BRAF突变(T+B)的病人。这些分别对应1.37每1000人年死亡人数(95%CI,0.34-5.50),7.49(3.12-17.99),18.26(5.89-56.63),和58.61(29.31-117.19)。相应P值是:B对N,0.052;T对N,0.004;B+T对N,<0.001;相应调整病人的年龄和性别后的HR分别为5.13(0.93-28.26),20.03(3.01-133.14)和19.22(3.70-99.86)。对464传统PTC亚型的分析获得了类似的结果。BRAF和TERT启动子突变的共存所引发的高度复发与PTC的放射性碘亲和力的丧失有关。
表13.BRAFV600E及TERTC228T和乳头状甲状腺癌病人相关的死亡
表14.各种基因突变状态与甲状腺癌病人有关的死亡的相关性—所有PTC的分析
*对病人年龄和性别实施多元矫正
表15.各种基因突变状态与甲状腺癌病人有关的死亡的相关性—只对传统亚型PTC的分析
*对病人年龄和性别实施多元矫正
结论。这个大型研究表明,TERT启动子突变与PTC相关的死亡率有极强的相关性,尤其是与BRAF突变共存时。这两个突变共存是一个独特的遗传背景,其决定了PTC患者预后的极高的恶化发展的风险。
TERT C228T和BRAF V600E突变除了促进先前研究所发现的侵袭性临床病理特点外,它们还促进PTC相关的病人的死亡。TERT启动子和BRAF突变的共存协同地鉴定一组死亡率最高的PTC病人。
- 还没有人留言评论。精彩留言会获得点赞!