细胞穿透肽和使用其输送生物活性物质的方法与流程
本公开涉及将在细胞中发挥作用的生物活性物质输送到细胞内的系统。
背景技术:
一般而言,由于生物活性聚合物质如蛋白质和DNA不能通过磷脂双层,因此其无法通过细胞膜进入细胞。然而,已知细胞穿透肽在没有受体或其他分子的帮助下能够穿过细胞膜。
细胞穿透肽也被称为PTD(蛋白转导域)或MTS(膜易位序列),其能够与货物例如蛋白质、DNA、RNA等联合或混合,并将货物经过细胞膜输送到细胞内以及细胞质、细胞器和细胞核内(Endoh和Ohtsuki,2010;Joliot和Prochiantz,2004;Mogi和Kondo,2010)。
在HIV-1(人体免疫缺陷病毒-1)感染期间,tat是被发现穿透细胞膜的第一个蛋白质。由其衍生的TAT肽(YGRKKRRQRRR)是最为常用的和最为积极研究的(Mann,D.A.等人,EMBO J 10:1733-1739,1991)。
β-半乳糖苷酶、辣根过氧化物酶、核糖核酸酶A、假单胞菌外毒素A(Pseudomonas exotoxin,PE)易位域等已使用TAT肽输送到细胞内,用于其功能和细胞内定位的研究(Fawell,S.等人,PNAS 91:664-668,1994)。已经发现,TAT肽通过与细胞膜上的硫酸乙酰肝素的相互作用进入细胞,之后进行涉及脂筏的内吞作用(Jehangir S.W.等人,Nature Med 10:310-315,2004)。
另外,由16个氨基酸构成、源自果蝇发育中的触角足同源异形蛋白和基本转录因子的穿膜肽(penetratin,Antp),源自由HSV-1(单纯性疱疹病毒1型)表达的VP22蛋白的细胞穿透肽VP22,由27个氨基酸构成且已被人工合成的运输肽(transportan),通过人工重复精氨酸残基获得、被认为在细胞穿透肽中起到最重要的作用的多聚精氨酸等是众所周知的细胞穿透肽。
由于这些现有的细胞穿透肽是源自病毒如HIV-1的蛋白质、源自由其他物种如果蝇所表达的蛋白质或基于之前已知的细胞穿透肽的氨基酸序列分析人工合成的蛋白质,因此用于人体时,其可以引起例如免疫应答的副作用。
另外,由于其由相对长的氨基酸链构成,因此其更可能引起不需要的免疫应答。并且,由于其可以影响待输送蛋白质的结构和功能,因此与待输送到细胞内的生物活性物质的连接效率通常是低的。
技术实现要素:
技术问题
本公开旨在提供细胞穿透肽,与现有的细胞穿透肽相比其不太可能引起免疫应答,并表现出输送生物活性物质的优异效果,以及用于输送生物活性物质的组合物、用于基因疗法的组合物、用于输送生物活性物质的方法和使用其进行基因疗法的方法。
技术方案
本公开提供了细胞穿透肽,其具有(X1)n-X2-(半胱氨酸)-(X3)m的序列。n为3至14的整数,m为4至14的整数,X1和X3各自独立为精氨酸、赖氨酸或组氨酸,X2为丙氨酸、甘氨酸、脯氨酸、色氨酸、苯丙氨酸、亮氨酸、异亮氨酸、甲硫氨酸、缬氨酸、精氨酸、赖氨酸或组氨酸。
本公开还提供融合产物,其中细胞穿透肽和生物活性物质融合。
本公开还提供用于将生物活性物质输送到细胞或组织内的组合物,其含有作为活性成分的融合产物。
本公开还提供用于基因疗法的组合物,其含有作为活性成分的细胞穿透肽和生物活性物质的融合产物。
本公开还提供表达重组蛋白的重组表达载体,其中细胞穿透肽和生物活性物质融合。
本公开还提供重组表达载体,其含有编码细胞穿透肽的DNA和编码生物活性蛋白的DNA。
本公开还提供用于输送生物活性物质的方法,其包括:通过使细胞穿透肽和生物活性物质结合以制备输送复合体的步骤;将所制备的输送复合体注射到非人类哺乳动物的体内或细胞内的步骤。
本公开还提供用于基因疗法的方法,其包括:通过使细胞穿透肽和遗传物质结合以制备输送复合体的步骤;将所制备的输送复合体注射到非人类哺乳动物的体内或细胞内的步骤。
有益效果
本公开的细胞穿透肽可以有效输送蛋白质到人体细胞和组织内,与在商业上用作细胞穿透肽的TAT相比可以更有效地输送蛋白质,还可以有效用于输送生物活性物质例如蛋白质、遗传物质、化学化合物等到细胞内,该生物活性物质可以用于治疗目的。
附图说明
图1显示编码AP-EGFP的789-bp双链DNA片段的1%琼脂糖凝胶电泳的结果,在AP-EGFP中AP与制备实施例2的EGFP连接。
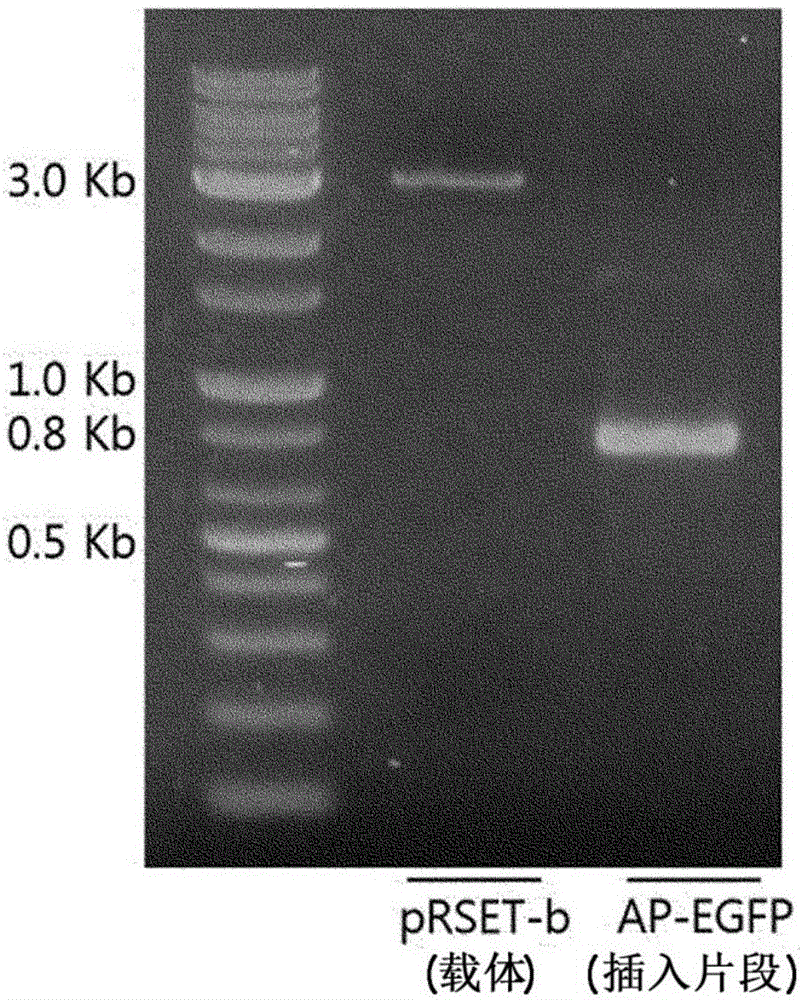
图2显示了用NheI和HindIII限制酶处理制备实施例3的AP-EGFP DNA片段(789bp)和pRSET-b载体(2.9Kb),用于插入AP-EGFP DNA片段,并通过1%琼脂糖凝胶电泳定量DNA的量的结果。
图3显示用制备实施例3的pRSET-b载体转化DH5α大肠杆菌(E.Coli),在pRSET-b载体中插入编码AP-EGFP的DNA片段,在液体LB培养基中培养选自在平板LB培养基上培养的菌落,通过质粒迷你制备分离DNA,并进行1%琼脂糖凝胶电泳的结果。
图4显示通过用NheI和HindIII限制酶处理制备实施例3中分离的质粒DNA并进行1%琼脂糖凝胶电泳的验证结果,所述质粒DNA由编码AP-EGFP(789bp)的DNA片段和pRSET-b载体(2.9Kb)构成。
图5为制备实施例3的pRSET-b载体的示意图,其中插入AP-EGFP。
图6显示制备实施例4的经纯化的AP-EGFP蛋白,作为阴性对照的、不连接细胞穿透肽的EGFP蛋白,以及作为阳性对照的、是最广为人知的细胞穿透肽的TAT-EGFP蛋白的12%SDS凝胶电泳的结果。
图7显示测试实施例1中通过流式细胞仪的荧光强度分析结果,该测试实施例1显示了AP-EGFP蛋白以浓度依赖性、时间依赖性的方式输送到Jurkat细胞内。
图8显示了在测试实施例2中通过流式细胞仪的荧光强度分析结果,该测试实施例2对比了输送AP到Jurkat细胞内的效率和作为阳性对照的现有细胞穿透肽的效率。
图9显示了在测试实施例3中通过流式细胞仪的荧光强度分析结果,该测试实施例3对比了输送占AP绝大部分的精氨酸到细胞内的效率以及具有较少精氨酸残基的那些的效率。
图10显示了测试实施例3中通过流式细胞仪的荧光强度分析结果,该测试实施例3通过将构成AP的色氨酸(X2)、半胱氨酸和赖氨酸(X3中的第一个氨基酸)分别用丙氨酸替代,对比其对输送AP到细胞内的效率的影响。
图11显示了测试实施例3中通过流式细胞仪的荧光强度分析结果,该测试实施例3通过将构成AP的色氨酸(X2)、半胱氨酸和赖氨酸(X3中的第一个氨基酸)分别用精氨酸替代,对比其对输送AP到细胞内的效率的影响。
图12显示了测试实施例4中通过流式细胞仪的荧光强度分析结果,该测试实施例4对比了AP到细胞内的输送效率与作为阳性对照的现有细胞穿透肽的输送效率随培养基温度和血清浓度变化的变化。
图13显示了测试实施例5中通过流式细胞仪的荧光强度分析结果,该测试实施例5对比了AP-EGFP到细胞内的输送效率与作为阳性对照的现有细胞穿透肽的输送效率随肝素和MβCD(甲基-β-环糊精)浓度变化的变化。
图14显示了显示测试实施例6中将AP-EGFP输送到HeLa细胞内的荧光显微图像。
图15显示了显示测试实施例7中将AP-EGFP输送到小鼠器官细胞中的荧光显微图像。
最佳实施方式
本公开提供了具有(X1)n-X2-(半胱氨酸)-(X3)m的序列的细胞穿透肽。
n为3至14的整数,特别是3至6的整数,m为4至14的整数,特别是4至7的整数。
该细胞穿透肽由特别地9个至14个、更特别地9个至12个、最特别地9个至10个氨基酸构成。当氨基酸数小于下限时,细胞穿透效应迅速下降。而当其超出上限时,免疫应答的可能性增加。
在细胞穿透肽中,X1和X3各自独立为带正电荷的氨基酸:精氨酸(Arg,R)、赖氨酸(Lys,K)或组氨酸(His,H),特别是精氨酸或赖氨酸。(X1) n由n个带正电荷的氨基酸X1形成。该n个氨基酸可以为相同的或不同的带正电荷氨基酸。类似地,(X3)m由m个带正电荷的氨基酸形成,m个氨基酸可以彼此不同。
在细胞穿透肽中,X2为非极性的或带正电荷的氨基酸:丙氨酸(Ala,A)、甘氨酸(Gly,G)、脯氨酸(Pro,P)、色氨酸(Trp,W)、苯丙氨酸(Phe,F)、亮氨酸(Leu,L)、异亮氨酸(Ile,I)、甲硫氨酸(Met,M)、缬氨酸(Val,V)、精氨酸(Arg,R)、赖氨酸(Lys,K)或组氨酸(His,H),特别地丙氨酸、色氨酸或精氨酸。
特别地,细胞穿透肽可以由SEQ ID NO 1、SEQ ID NO 5、SEQ ID NO 8或SEQ ID NO 12的氨基酸序列构成。
本公开还提供融合产物,其中细胞穿透肽和生物活性物质融合。
生物活性指输送到身体或细胞或有机体内的物质的活性,其与生理现象或治疗目的相关。生物活性物质可以为蛋白质、遗传物质、脂肪、碳水化合物或化学化合物。遗传物质可以为DNA或RNA,化学化合物可以为抗癌药物、用于免疫性疾病的治疗剂、抗病毒剂、抗生素或生长因子、发育因子或分化因子。
由于细胞穿透肽是非常小的肽,其能够最小化与生物活性物质的可能生物干扰。细胞穿透肽和生物活性物质的融合产物可以通过经静脉内、腹膜内、肌内、皮下、皮内、鼻、粘膜注射、吸入或口服途径输送到体内。
当将需要的融合产物输送到特定细胞、组织或器官内时,可以通过将生物活性物质和配体的细胞外蛋白片段结合形成融合产物,该配体可以选择性地与特定细胞、组织器官特异性表达的受体或单克隆抗体(mAb)或其变体结合,该单克隆抗体或其变体可以选择性地与受体或配体结合。通过使用表达载体的克隆技术间接连结,或通过肽和生物活性物质之间的化学或物理共价键或非共价键直接连接,细胞穿透膜和生物活性物质的结合可以在核苷酸水平实现。
本公开还提供用于将生物活性物质输送到细胞内的组合物,和用于基因疗法的组合物,其含有作为活性成分的融合产物。
该组合物使得不能容易穿过细胞膜的生物活性物质穿过细胞膜并直接作用于细胞。因此,该组合物可以提供药物输送系统开发中的开创性机遇。
基于该组合物的总重量,组合物含有0.0001重量%至50重量%的融合产物。
除融合产物之外,组合物可以含有一种或更多种表现相同或相似功能的活性成分。
除活性成分之外,组合物可以通过还包含一种或更多种药学上可接受的给药载体而制备。药学上可接受的载体可以为盐水、无菌水、林格氏溶液、缓冲盐水、葡萄糖溶液、麦芽糖糊精溶液、甘油、乙醇和脂质体中的一种或更多种,如果需要可以加入其他常用的添加剂例如抗氧化剂、缓冲剂、抑菌剂等。此外,通过另外添加稀释剂、分散剂、表面活性剂、黏合剂或润滑剂,可以将其配制为例如水溶液、悬浮液、乳液等的可注射制剂、药丸、胶囊、颗粒或片剂。为了特异性作用于靶器官,靶器官-特异性抗体或配体可以与载体结合。另外,组合物可以根据特定疾病或成分,通过Remington's Pharmaceutical Sciences(最新版),Mack Publishing Company,Easton PA中描述的方法进行配制。
通过经静脉内、腹膜内、肌内、皮下、皮内、鼻、粘膜的注射、吸入或口服途径,可以将组合物输送到体内。给药剂量可以根据受试者的体重、年龄、性别和饮食、给药时间、给药方法、排泄速率、疾病严重程度等而变化。每日剂量可以约为0.01mg/kg至100mg/kg,特别地0.5mg/kg至10mg/kg,可以每日给药一次或多次。
本公开还提供表达重组蛋白的重组表达载体,其中细胞穿透肽与生物活性蛋白和重组表达载体融合,所述重组表达载体含有编码细胞穿透肽的DNA和编码生物活性蛋白的DNA。
可以将生物活性蛋白输送到细胞内或体内,并可以表现出与生理现象或治疗目的相关的活性。
重组蛋白载体可以含有细胞穿透肽的序列、生物活性蛋白序列和促进融合蛋白纯化的标签序列,例如连续的组氨酸密码子、结合麦芽糖的蛋白质密码子、Myc密码子等,并且还可以含有例如用于提高融合产物溶解性的融合配偶体。为了重组蛋白整体结构和功能的稳定性或者由每个基因编码的蛋白质的柔性,重组蛋白载体还可以含有间隔区氨基酸或碱基序列。间隔区的实例包括但不限于:AAY(P.M.Daftarian等人,J Trans Med 2007,5:26)、AAA、NKRK(R.P.M.Sutmuller等人,J Immunol.2000,165:7308-7315)或一个或更多个赖氨酸残基(S.Ota等人,Can Res.62,1471-1476;K.S.Kawamura等人,J Immunol.2002,168:5709-5715)。此外,还可以含有用于识别将序列输送到细胞内的标记或报道基因序列,所述序列被酶特异性切割以从重组蛋白去除不需要部分或表达调控序列,但不限于此。
用于重组表达载体的表达调控序列可以为调控域,其包含对细胞、组织或器官特异性的启动子,靶DNA和/或RNA选择性地输送至该细胞、组织或器官或在其中表达。
本公开还提供用于输送生物活性物质的方法,其包括:通过使细胞穿透肽和生物活性物质结合以制备输送复合体的步骤;将所制备的输送复合体注射到体内或细胞内的步骤。
通过使用表达载体的克隆技术间接连接,或通过肽和生物活性物质之间的化学或物理共价键或非共价键直接连接,细胞穿透肽和生物活性物质之间的结合可以在核苷酸水平实现。肽和生物活性物质的输送复合体可以通过经静脉内、腹膜内、肌内、皮下、皮内、鼻、粘膜的注射、吸入或口服途径进入体内或细胞内。该输送方法不仅可以应用于输送至培养的细胞,也可以应用于一般的体内输送,即输送至动物细胞、动物组织或动物体。
本公开还提供用于基因疗法的方法,其包括:通过使细胞穿透肽和遗传物质结合以制备输送复合体的步骤;将所制备的输送复合体注射到非人类哺乳动物的体内或细胞内的步骤。
通过化学或物理共价键或非共价键的直接连接,可以结合细胞穿透肽和遗传物质。遗传物质的输送复合体可以经由与上述相同的途径注入体内或细胞内。该治疗方法不仅可以应用于输送至培养的细胞,也可以应用于一般的体内输送,即输送至动物细胞、动物组织或动物体。
由于DNA在载体生物例如逆转录酶病毒或腺病毒中不是包装的,因此遗传物质的输送复合体为无致免疫性的和非炎性的,且不受质粒尺寸的限制。因此,其可以用于任意实际尺寸的重组基因表达结构。
本发明实施方式
以下会通过具体实施例详细地描述本公开。然而,以下实施例仅出于举例说明的目的,对本领域技术人员明显的是本公开的范围不受实施例的限制。
制备实施例1:肽的合成和纯化
合成具有SEQ ID NO 1至SEQ ID NO 12的氨基酸序列的肽。
在合成对应氨基酸序列的正义寡脱氧核苷酸和反义寡脱氧核苷酸之后,接着在95℃用3分钟去除二级结构或三级结构(变性),通过将温度变为50℃然后变为72℃而制备双链DNA。为了插入pRSET-b载体,将限制酶特异性序列插入除正义寡脱氧核苷酸和反义寡脱氧核苷酸之外的5’位点和3’位点。然后通过转化到大肠杆菌中使序列扩增为大量。在确认序列的完整性之后,在大肠杆菌中诱导表达。
为了融合具有SEQ ID NO 1的氨基酸序列的肽(下文也称为“AP”)和增强型绿色荧光蛋白(EGFP),构建了允许在AP的N末端连接EGFP的引物。在经PCR制备AP-EGFP基因之后,将其插入到载体(pRSET-b)中。使蛋白质在大肠杆菌中表达并纯化以测量细胞内输送效应。
制备实施例2:编码具有在N末端连接EGFP的AP的双链DNA的制备
通过将编码具有氨基酸序列SEQ ID NO 1的肽的DNA碱基序列添加到编码增强型绿色荧光蛋白(下文也称为“EGFP”)N末端部分的DNA碱基序列来构建正向引物。
SEQ ID NO 13的正向引物包含用于在5’末端DNA克隆的NheI限制酶识别位点和在AP和EGFP的碱基序列之间的BamHI限制酶识别位点。同时,构建SEQ ID NO 14的反向引物用于通过PCR扩增AP-EGFP。反向引物含有编码EGFPC末端部分的DNA碱基序列。为了DNA克隆,将HindIII限制酶识别位点插入引物的5’末端。
使用含有EGFP基因作为模板的pRSETb载体和使用SEQ ID NO 13和SEQ ID NO 14的引物进行PCR。在95℃下初步热变性3分钟之后,使用PCR仪(Bio-Rad)进行PCR30个循环(在95℃下进行模板的热变性20秒→在50℃下进行引物和模板之间的聚合20秒→在72℃下延伸30秒)。
使获得的AP-EGFP扩增产物经受1%琼脂糖凝胶电泳。证实扩增了789-bp DNA片段(图1)。
制备实施例3:插入AP-EGFP的pRSETb载体的制备
为了表达AP-EGFP蛋白,使用限制酶和连接酶使制备实施例2制备中的789-bp DNA片段插入蛋白表达载体pRSETb。
用NheI和HindIII(NEB)酶处理制备实施例2中扩增的DNA片段以使DNA的5’/3’末端是黏性的。同时,用相同的限制酶处理pRSETb以制备具有NheI和HindIII插入位点的线性pRSETb载体。每个酶反应之后,使用PCR纯化试剂盒(Cosmo Genetech)分离产物。
在25℃用T4连接酶(NEB)处理经分离的AP-EGFP双链DNA片段和pRSET-b载体2小时。通过1%琼脂糖凝胶电泳分析AP-EGFP双链DNA片段和pRSET-b载体的浓度(图2)。
使获得的插入AP-EGFP的pRSETb载体转化到DH5α大肠杆菌中,选择经转化的大肠杆菌,其在含有50μg/mL作为抗生素的氨苄青霉素的平板LB培养基上培养时形成菌落。将经选择的大肠杆菌菌落再次培养在含有50μg/mL氨苄青霉素的液体LB培养基中,然后使用质粒迷你分离试剂盒(Cosmo Genetech)分离质粒载体(图3)。
为了确认经分离的载体为插入AP-EGFP的pRSETb载体,将其用NheI和HindIII限制酶处理,然后用1%琼脂糖凝胶电泳分析。结果是,确认了789个碱基对的AP-EGFP DNA片段插入到2.9千碱基对的pRSET-b载体中(图4)。这还可以通过DNA碱基序列分析仪(Bionics)确认。插入AP-EGFP的pRSETb载体的结构如图5所示。
制备实施例4:AP-EGFP蛋白在大肠杆菌中的表达和纯化
将制备实施例3的插入AP-EGFP的pRSETb载体转化到大肠杆菌BL21(DE3)star pLysS中。在50mL液体LB培养基中,在37℃下培养在含有34μg/mL氯霉素和50μg/mL氨苄青霉素作为抗生素的平板LB培养基上形成的菌落10小时,然后转移至500mL新鲜液体LB培养基。在相同温度下培养直至由分光光度计测量的大肠杆菌数量达到O.D 0.5,将IPTG(异丙基β-D-1-硫代半乳糖苷)添加至浓度为1mM,再将大肠杆菌在设置为20℃和150rpm的摇床中培养14小时。由大肠杆菌表达的蛋白质含有pRSET-b载体的AP-EGFP上游的6X-His标签。将蛋白质如下进行纯化。
将培养基离心,然后在自然条件下悬浮在裂解缓冲液(0.5M的NaCl,5mM的咪唑,20mM的Tris-HCl,pH8.0)中。使大肠杆菌在裂解缓冲液中悬浮10分钟以破坏细胞壁和细胞膜。然后,使用超声波细胞粉碎机VCX-130(Sonics&Materials)破坏细胞然后离心。将分离的上清液经由0.45-μm过滤器(Advantec)过滤一次,使其在室温下结合于Ni-NTA琼脂糖(Qiagen)1小时。然后仅使结合于Ni-NTA琼脂糖的蛋白质产物结合于组氨酸柱(His-column,Bio-Rad)。用20mM的咪唑溶液洗涤之后,用250mM的咪唑溶液洗脱蛋白质。最后,使用PD-10脱盐柱(Amersham Biosciences)从洗脱的蛋白质产物中纯化AP-EGFP(图6)。
测试实施例1:AP-EGFP蛋白进入Jurkat细胞的输送效率对比,该Jurkat细胞是永生化人T细胞
将在制备实施例4中纯化的AP-EGFP蛋白质输送到Jurkat细胞中,该Jurkat细胞是永生化人T细胞,并研究其效率。使用RPMI培养基(HyClone)培养Jurkat细胞,然后转移至含有350μL的RPMI培养基的24孔板(SPL Life Sciences),在100μL的RPMI培养基中每个孔有1×106个细胞。然后,在将蛋白质与50μL的D-PBS(Welgene)混合至500μL的总体积之后,在以下不同条件下用蛋白质处理细胞。除非指明否则下文中,用5μM的每种蛋白处理细胞,然后在5%的CO2培养箱中在37℃下培养1小时。
首先,在用1μM浓度的AP-EGFP蛋白处理之后,将细胞在5%的CO2培养箱中在37℃下培养1小时。作为对照,使用不含AP和TAT-EGFP蛋白的EGFP蛋白质作为现有细胞穿透肽。1小时之后,将所有细胞回收并转移至试管。在进行离心之后,去除上清液。用1mL的D-PBS洗涤细胞、悬浮、然后离心的步骤重复2次。洗涤之后,将获得的细胞最后再悬浮于500μL的D-PBS,通过使用FACS计(FACSCanto II,BD Science)的流式细胞仪测量细胞内荧光来测量蛋白质进入细胞的输送效率。结果是,确认了AP-EGFP蛋白质以浓度依赖方式输送到Jurkat细胞内。
然后,在用5μM浓度的AP-EGFP蛋白处理之后,将细胞在5%的CO2培养箱中在37℃下培养30分钟至4小时。在如上文所述地洗涤细胞之后,通过流式细胞仪测量细胞内荧光。结果是,确认了AP-EGFP蛋白质以浓度依赖方式输送到Jurkat细胞内(图7)。
测试实施例2:与先前已知的细胞穿透肽的输送效率对比
为了与先前已知的细胞穿透肽的输送效率对比,以与测试实施例1相同的方式,在相同浓度和相同时间下,将每种蛋白质输送到Jurkat细胞内。
使用未与细胞穿透肽连接的EGFP蛋白作为阴性对照,使用其中EGFP(增强型绿色荧光蛋白)与各自细胞穿透肽连接的TAT-EGFP、R9-EGFP和Hph-1作为阳性对照。结果是,确认了本发明发现/研发的AP序列相比TAT以更高效率将蛋白质输送到Jurkat细胞内(图8)。
测试实施例3:取决于氨基酸的置换、删除或添加的蛋白质输送效率对比
为了研究构成AP的每种氨基酸的作用,制备不同变体并用于分析对比。
(1)取决于末端氨基酸删除的蛋白质输送效率对比
首先,制备将一个精氨酸从AP的N末端删除的变体(AP_D1,SEQ ID NO 2),将一个精氨酸从C末端删除的变体(AP_D2,SEQ ID NO 3),以及将一个精氨酸分别从N末端和C-末端删除的变体(AP_D3,SEQ ID NO 4),将其与作为对照的EGFP、AP-EGFP、TAT-EGFP和R9-EGFP对比。
结果是,发现了当缺失一个精氨酸时,即当X1的数小于3或当X2的数小于4时,与AP相比输送效率明显下降。因此,确认了氨基酸X1和X2的数的下限在将AP蛋白质输送到细胞内的重要意义(图9)。
(2)取决于X2、半胱氨酸或X3置换的蛋白质输送效率对比
为了研究色氨酸(X2)、半胱氨酸和赖氨酸(X3的第一个氨基酸),通过将每种氨基酸置换为丙氨酸或精氨酸而制备变体。由于丙氨酸不带电荷、且最简单并具有小尺寸,其适合作为对照。
使用具有带正电荷的精氨酸的变体作为对照用于与由9个精氨酸构成的R9对比效率。结果是,丙氨酸变体和精氨酸变体显示出相似的模式。由于当色氨酸被其他氨基酸置换时未观察到效率明显不同,因此确认其对于AP的功能作用没有显著贡献。当精氨酸被其他氨基酸置换时,效率大幅下降。认为带正电荷的精氨酸起到积极作用。当半胱氨酸被其他氨基酸置换时,观察到效率最大下降。这表明半胱氨酸在AP中起到非常重要的功能作用(图10和图11)。
测试实施例4:AP的细胞穿透机制
为了研究AP是否如最广为人知的现有细胞穿透肽TAT那样通过内吞作用输送到细胞内,测量细胞内输送取决于温度的变化,研究其受其他蛋白质影响是否取决于培养基的血清浓度。使用未与细胞穿透肽连接的EGFP作为阴性对照,使用TAT-EGFP作为阳性对照。
在4℃、25℃和37℃的温度下,如上文所述用5μM的每种蛋白质分别处理Jurkat细胞1小时。结果是,确认了不同于TAT,细胞内输送未受温度影响。这说明不同于TAT,AP不是通过能量依赖性的内吞作用输送。此外,确认了在所有温度下输送效率高于TAT(图12上)。
另外,当RPMI培养基中的血清浓度分别为0%和10%时,分别分析每种蛋白质(5μM)的输送效率。在用每种蛋白质处理后,将细胞在37℃下培养1小时。使用未与细胞穿透肽连接的EGFP作为阴性对照,使用TAT-EGFP作为阳性对照。
结果是,确认了AP-EGFP蛋白经过细胞膜输送到细胞内的效率随血清浓度下降而下降。这表明细胞穿透肽受到与其他蛋白质的竞争或相互作用的影响,并再次确认根据本公开的AP作为细胞穿透肽的功能。在每种血清浓度下,AP显示出比阳性对照更高的输送效率(图12下)。
测试实施例5:取决于肝素和MβCD浓度的AP-EGFP细胞内输送效率
(1)取决于肝素浓度的AP-EGFP细胞内输送效率
期望用肝素处理会直接或间接影响该相互作用,所述肝素可以干扰细胞穿透肽和细胞表面硫酸乙酰肝素的结合,用0μm/mL、10μg/mL、20μg/mL和50μg/mL不同浓度的肝素(来自猪小肠黏膜的肝素钠盐,Sigma)处理Jurkat细胞30分钟,然后用10μM的AP-EGFP处理,AP-EGFP的最终体积用D-PBS制成100μL。使用TAT-EGFP作为用于对比的阳性对照。然后在5%的CO2培养箱中、37℃下培养细胞1小时。1小时之后,将所有细胞回收并转移至试管。在进行离心之后,去除上清液。用1mL的D-PBS洗涤细胞、再悬浮然后离心的步骤重复2次。在洗涤之后,将获得的细胞最后再悬浮于500μL 的D-PBS,通过使用FACS计(FACSCanto,BD Science)流式细胞仪测量细胞内荧光来测量蛋白质进入细胞的输送效率。结果是,确认了AP-EGFP蛋白质以浓度依赖方式输送到Jurkat细胞内。
结果是,确认了AP-EGFP的细胞内输送效率随肝素浓度明显下降(图13上)。
(2)取决于MβCD浓度的AP-EGFP细胞内输送效率
另外,期望AP-EGFP的细胞内输送会受内吞作用的影响,所述内吞作用与构成细胞膜磷脂双层的脂筏有关,通过使用已知为从细胞膜去除胆固醇的MβCD(甲基-β-环糊精)处理预先抑制脂质介导的内吞作用。在冰上用0mM、3mM或5mM的MβCD处理Jurkat细胞20分钟之后,将细胞用10的AP-EGFP处理1小时。使用TAT-EGFP作为用于对比的阳性对照。结果是,确认了AP-EGFP的细胞内输送效率随MβCD浓度明显下降(图13下)。
这还说明细胞穿透肽直接或间接受与其他蛋白质的竞争和相互作用的影响,并再次确认根据本公开的AP作为细胞穿透肽的功能。
测试实施例6:将AP-EGFP输送到HeLa癌细胞中
在测试实施例1中通过流式细胞仪确认了将AP蛋白质有效输送到细胞内。为了研究AP是否实际上和蛋白质一同输送到细胞内以及其在细胞内存在于哪里,将AP-EGFP输送到HeLa细胞内并使用共聚焦显微镜进行分析,该HeLa细胞是宫颈癌细胞。
在将1×105个HeLa细胞接种在12孔板(SPL Life Sciences)的每个孔内的圆形盖玻片(Marinfield)上之后,将细胞在DMEM培养基(HyClone)中培养18小时,以使得细胞附着于盖玻片。在通过抽吸完全丢弃培养基并添加450μL的新鲜DMEM后,将细胞用制备实施例5中纯化的AP-EGFP蛋白(5μM)处理,该蛋白通过与D-PBS混合使得终体积为50μL。然后在5%的CO2培养箱中、37℃下培养细胞30分钟。然后,通过抽吸完全丢弃培养基以去除细胞外蛋白质之后,用1mL的D-PBS洗涤细胞。将该步骤重复5次。然后,将细胞用1mL甲醛(37%的甲醛溶液,福尔马林,Sigma)固定。在固定之后,将细胞用1mL的D-PBS洗涤5次。然后,将细胞核用稀释为1:4000的500μL的Hoechst着色剂(Hoechst AG)着色。10分钟后,将细胞用1mL的D-PBS洗涤5次。将所制备的盖玻片使用封片剂(Sigma)固定在载玻片上,使用荧光显微镜AX-10(Carl Zeiss)观察绿色荧光蛋白的定位和细胞内输送。结果是,确认了连接AP的绿色荧光蛋白通过细胞膜输送到细胞内并存在于细胞质中(图14)。
测试实施例7:AP-EGFP到小鼠器官内的输送
在测试实施例1中通过流式细胞仪确认了AP蛋白质被有效输送到细胞内,在测试实施例6中AP-EGFP被输送到HeLa癌细胞内。为了研究AP在实际体内环境下是否被输送,如果是的话,可以输送至何种器官的量是多少,将5mg的AP-EGFP蛋白经腹腔注射到6周龄的雌性C57BL/6小鼠。2小时后,取例如脑、心、肾、肝、肺、脾、肠等的器官并用4%的多聚甲醛固定。在用D-PBS洗涤2至3次后,使用OCT化合物制备冻块。在使用低温保持器制备6μm厚的切片后,在荧光显微镜下观察切片样品以确认AP-EGFP输送到器官细胞内。将切片样品用Hoechst着色剂着色10分钟,然后通过与荧光蛋白重叠研究细胞内输送。使用未与细胞穿透肽连接的EGFP作为对照。结果是,确认了与EGFP相比,连接AP的绿色荧光蛋白被更好地输送到脑、心、肾、肝、肺、脾、肠等的细胞内(图15)。
工业应用
本公开的细胞穿透肽可以用于输送生物活性物质例如蛋白质、遗传物质、化学化合物等到细胞内,该生物活性物质可以用于治疗目的。
<110> 汉阳大学校产学协力团
<120> 细胞穿透肽和使用其输送生物活性物质的方法
<130> HPC4440
<160> 14
<170> KopatentIn 2.0
<210> 1
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 1
Arg Arg Arg Trp Cys Lys Arg Arg Arg
1 5
<210> 2
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 2
Arg Arg Trp Cys Lys Arg Arg Arg
1 5
<210> 3
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 3
Arg Arg Arg Trp Cys Lys Arg Arg
1 5
<210> 4
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 4
Arg Arg Trp Cys Lys Arg Arg
1 5
<210> 5
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 5
Arg Arg Arg Ala Cys Lys Arg Arg Arg
1 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 6
Arg Arg Arg Trp Ala Lys Arg Arg Arg
1 5
<210> 7
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 7
Arg Arg Arg Trp Cys Ala Arg Arg Arg
1 5
<210> 8
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 8
Arg Arg Arg Arg Cys Lys Arg Arg Arg
1 5
<210> 9
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 9
Arg Arg Arg Trp Arg Lys Arg Arg Arg
1 5
<210> 10
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 10
Arg Arg Arg Trp Cys Arg Arg Arg Arg
1 5
<210> 11
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 11
Arg Arg Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 12
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 细胞穿透肽
<400> 12
Arg Arg Arg Arg Cys Arg Arg Arg Arg
1 5
<210> 13
<211> 68
<212> DNA
<213> 人工序列
<220>
<223> EGFP正向引物
<400> 13
ctagctagcc gccggcgctg gtgcaaacgc cgccggggat ccgtgagcaa gggcgaggag 60
ctgttcac 68
<210> 14
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> EGFP反向引物
<400> 14
caagctttta cttgtatagc tcgtc 25
- 还没有人留言评论。精彩留言会获得点赞!