与抗CD38抗体联用的组合疗法的制作方法
本发明涉及与抗CD38抗体联用的组合疗法。
背景技术:
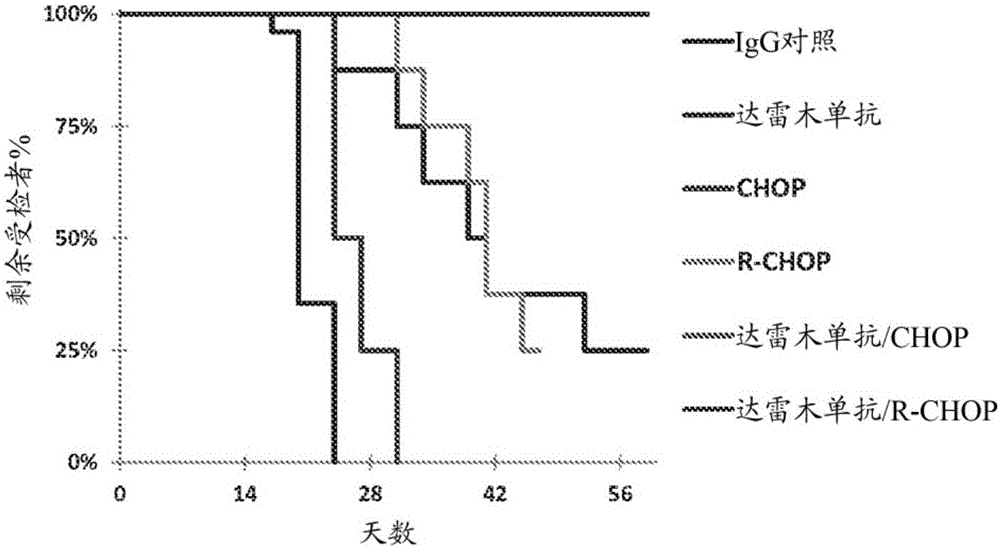
:CD38是多功能蛋白,其功能表现为受体介导的粘附和信号传导,以及经由其胞外酶活性介导钙动员,催化环状ADP核糖(cADPR)和ADPR的形成。CD38介导淋巴细胞的细胞因子分泌和激活以及增殖(Funaro等人,JImmunology145:2390-6,1990;Terhorst等人,Cell771-80,1981;Guse等人,Nature398:70-3,1999)。CD38还经由其NAD糖水解酶活性来调节细胞外NAD+水平,这牵涉到调整调节性T细胞区室(Adriouch等人,14:1284-92,2012;Chiarugi等人,NatureReviews12:741-52,2012)。除了经由Ca2+进行的信号传导之外,CD38信号传导还经由与T细胞和B细胞上的抗原-受体复合物或其它类型受体复合物(例如MHC分子)的交互应答而发生,从而CD38不仅参与若干细胞应答,而且参与IgG1的转换和分泌。CD38是造血细胞(诸如髓质胸腺细胞、活化T细胞和B细胞、静息NK细胞和单核细胞、淋巴结生发中心成淋巴细胞、血浆B细胞、滤泡内细胞和树突细胞)上表达的II型跨膜糖蛋白。一部分正常骨髓细胞、特别是前体细胞以及脐带细胞是CD38阳性的。除了淋巴前体细胞之外,CD38还在红细胞和血小板上表达,并且表达还见于一些实体组织,诸如肠、脑、前列腺、骨骼和胰腺。成熟静息T细胞和B细胞表达有限的乃至不表达表面CD38。CD38还在多种恶性血液病中表达,包括多发性骨髓瘤、白血病和淋巴瘤,诸如B细胞慢性淋巴细胞白血病、T细胞和B细胞急性淋巴细胞白血病、华氏巨球蛋白血症、原发性系统性淀粉样变性、套细胞淋巴瘤、幼淋巴细胞/髓细胞白血病、急性髓性白血病、慢性髓性白血病、滤泡性淋巴瘤、伯基特淋巴瘤、大颗粒淋巴细胞(LGL)白血病、NK细胞白血病和浆细胞白血病。CD38在不同起源的上皮/内皮细胞上的表达已有描述,包括前列腺中的腺上皮细胞、胰腺中的胰岛细胞、腺体(包括腮腺)中的导管上皮细胞、支气管上皮细胞、睾丸和卵巢中的细胞,以及结直肠腺癌中的肿瘤上皮细胞。可能涉及CD38表达的其它疾病包括例如肺部支气管上皮癌、乳腺癌(由乳腺导管和小叶中的上皮层恶性增殖演变而来)、由β细胞演变而来的胰腺肿瘤(胰岛瘤)、从肠上皮细胞演变而来的肿瘤(例如,腺癌和鳞状细胞癌)、前列腺中的癌,以及睾丸中的精原细胞瘤和卵巢癌。在中枢神经系统中,成神经细胞瘤表达CD38。B细胞恶性肿瘤可出现于通常产生B细胞的所有淋巴组织。大多数患B细胞恶性肿瘤的患者最初被诊断为患有与骨髓或淋巴结相关的疾病。在发生骨髓侵犯的情况下,转化的B细胞频繁通过血液循环,在整个外周淋巴组织中广泛扩散。然而,B细胞恶性肿瘤还可出现在一些非淋巴组织中,诸如甲状腺、胃肠道、唾液腺和结膜。众所周知的B细胞恶性肿瘤包括B细胞慢性淋巴细胞白血病、套细胞淋巴瘤、伯基特淋巴瘤、滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤、多发性骨髓瘤、霍奇金淋巴瘤、毛细胞白血病、原发性渗出性淋巴瘤和艾滋病相关的非霍奇金淋巴瘤(NHL)。B细胞恶性肿瘤占确诊淋巴瘤的85%以上。NHL是一个粗略分类,泛指淋巴细胞(B细胞或T细胞)转为恶性后不可控增殖形成肿瘤块时源自淋巴系统的淋巴瘤。总体上,NHL涵盖了约30种不同亚型的淋巴瘤,这些亚型具有一系列表型和预后。预计到2019年,主要市场国家的NHL发病数将达到140,000例以上。弥漫性大B细胞淋巴瘤(DLBCL)是最常见的侵袭性NHL亚型,占淋巴细胞肿瘤的30%至40%,并且涵盖生物学上和临床上不同组的疾病。基因表达谱研究表明,可根据基因表达谱将DLBCL分成两组;这些组被称为生发中心B细胞样(GCB)淋巴瘤和活化B细胞样(ABC)淋巴瘤。用于治疗DLBCL的标准治疗法通常称为CHOP,即环磷酰胺、羟基柔红霉素(多柔比星)、长春新碱和泼尼松的组合,或者R-CHOP,即抗CD20抗体利妥昔单抗和CHOP的组合。另外,在缓解之后,可考虑造血干细胞移植。即使采取当前的治疗方法,侵袭性NHL高危人群在5年内的生存率也可能低至30%。因此,需要对NHL和B细胞恶性肿瘤进行有效治疗和组合治疗。技术实现要素:本发明的一个实施方案是一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性调节来诱导体外杀伤表达CD38的细胞。附图说明图1A示出了弥漫性大B细胞淋巴瘤(DLBCL)的来源于患者的模型中达雷木单抗(Daratumumab)在单独使用或者与CHOP或R-CHOP联用时的疗效。将切除的DLBCL肿瘤植入SCID/Beige小鼠中。在肿瘤达到大约125-250mm3时开始治疗。每周一次以20mg/kg施用达雷木单抗,共施用三周。使用以下给药方案,在第0天施用一次CHOP和R-CHOP,但泼尼松在第0-4天施用:CHOP:(环磷酰胺(CTX):30mg/kgi.v.;多柔比星:2.5mg/kgi.v;长春新碱:0.4mg/kgi.v);泼尼松:0.15mg/kgp.o;R-CHOP:利妥昔单抗20mg/kgi.p.第0天。每三天测量一次肿瘤体积。Y轴代表肿瘤体积±SEM。图1B示出了相对于图1A的研究的肿瘤接种后天数标绘的中位生存时间。图2示出了非霍奇金淋巴瘤的临床前模型中达雷木单抗在单独使用或与CHOP联用时的疗效。将基质胶中的2×105个NAMALWA细胞植入NODSCID小鼠中,并且在主要肿瘤尺寸达到大约189mm3时开始治疗。每周一次以10mg/kg施用达雷木单抗,共施用三周。使用以下剂量在第0-5天时每天施用一次CHOP:环磷酰胺(CTX):5mg/kgi.v.;多柔比星:0.5mg/kgi.v;长春新碱:0.08mg/kgi.v.,泼尼松:0.03mg/kgp.o。每三天测量一次肿瘤体积。Y轴代表肿瘤体积±SEM。图3示出了DLBCL的临床前模型中达雷木单抗在单独使用或与CHOP联用时的疗效。将5×106个SU-DHL-6细胞植入NODSCID小鼠中,并且在主要肿瘤尺寸达到大约154mm3时开始治疗。每周一次以10mg/kg施用达雷木单抗,共施用四周。使用以下剂量在第0-5天时每天施用一次CHOP:环磷酰胺(CTX):5mg/kgi.v.;多柔比星:0.5mg/kgi.v;长春新碱:0.08mg/kgi.v.,泼尼松:0.03mg/kgp.o。以平均值±SEM绘制肿瘤尺寸曲线图。图4示出了弥漫性大B细胞淋巴瘤(DLBCL)的来源于患者的模型中达雷木单抗在与CHOP或R-CHOP(同时或依次施用,直到研究的第45天)联用时的疗效。每周在第0天或第7天以20mg/kg施用一次达雷木单抗,共施用三周。使用以下给药方案,在第0天施用一次CHOP,但泼尼松在第0-4天施用:CHOP:(环磷酰胺(CTX):30mg/kgi.v.;多柔比星:2.5mg/kgi.v;长春新碱:0.4mg/kgi.v);泼尼松:0.15mg/kgp.o。在第0天或第7天以20mg/kgi.p.施用利妥昔单抗。以平均值±SEM绘制肿瘤尺寸曲线图。CNTO3930:同种型对照。括号中的值指示给药的日子。该数据代表第44天从正在进行的研究获得的结果。图5示出了DLBCL的来源于患者的模型中达雷木单抗在与CHOP或R-CHOP(同时或依次施用,直到研究的第101天)联用时的疗效。给药方案与图4相同。以平均值±SEM绘制肿瘤尺寸曲线图。CNTO3930:同种型对照。括号中的值指示给药的日子。以如下方式确定肿瘤体积的统计学差异:采用双侧单因素方差分析,然后用邓尼特多重比较检验将单一试剂治疗组与对照和含标准试剂的组合进行比较。*相对于对照P<0.05,相对于CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)P<0.05;DLBCL,弥漫性大B细胞淋巴瘤。IHC,免疫组织化学;i.v.,静脉内;i.p.,腹膜内。具体实施方式“CD38”是指人CD38蛋白(别名:ADP核糖基环化酶1、cADPr水解酶1、环ADP核糖水解酶1)。人CD38具有SEQIDNO:1所示的氨基酸序列。如本文所用,术语“抗体”含义广泛且包括:免疫球蛋白分子,包括多克隆抗体;单克隆抗体,包括鼠、人、人适应性、人源化和嵌合单克隆抗体;抗体片段;双特异性或多特异性抗体;二聚体、四聚体或多聚体抗体;以及单链抗体。免疫球蛋白可根据重链恒定结构域氨基酸序列被指定为五种主要种类,即IgA、IgD、IgE、IgG和IgM。IgA和IgG进一步亚分类为同种型IgA1、IgA2、IgG1、IgG2、IgG3和IgG4。任何脊椎动物物种的抗体轻链可基于其恒定结构域的氨基酸序列被分配到两种完全不同的类型中的一种下,即κ(κ)和λ(λ)。术语“抗体片段”是指免疫球蛋白分子的一部分,其保留重链和/或轻链抗原结合位点,诸如重链互补决定区(HCDR)1、2和3,轻链互补决定区(LCDR)1、2和3,重链可变区(VH)或轻链可变区(VL)。抗体片段包括:Fab片段,即由VL、VH、CL和CHI结构域组成的单价片段;F(ab)2片段,即包含在铰链区通过二硫键连接的两个Fab片段的双价片段;由VH和CHI结构域组成的Fd片段;由抗体单臂的VL和VH结构域组成的Fv片段;结构域抗体(dAb)片段(Ward等人,Nature341:544-546,1989),其由VH结构域组成。VH结构域和VL结构域可被改造并经由合成接头连接在一起以形成各种类型的单链抗体设计,其中在VH结构域和VL结构域由单独的单链抗体构建体表达的情况下,VH/VL结构域在分子内或分子间配对,以形成单价抗原结合位点,诸如单链Fv(scFv)或双价抗体;例如在国际专利公布WO1998/44001、WO1988/01649、WO1994/13804和WO1992/01047中有所描述。使用本领域的技术人员熟知的技术获得这些抗体片段,并筛选出效用方式与全长抗体相同的片段。短语“分离抗体”是指基本上不含具有不同抗原特异性的其它抗体的抗体或抗体片段(例如,特异性结合CD38的抗体)。然而,特异性结合CD38的分离抗体可能对其它抗原具有交叉反应性,诸如人CD38的直系同源抗原,如食蟹猕猴(Macacafascicularis)CD38。此外,分离抗体可基本上不含其它细胞物质和/或化学物质。抗体可变区由被三个“抗原结合位点”中断的“框架”区组成。使用不同术语来定义抗原结合位点,诸如:三个在VH(HCDR1、HCDR2、HCDR3)中且三个在VL(LCDR1、LCDR2、LCDR3)中的互补决定区(CDR),其基于序列变异性(Wu和Kabat,JExpMed132:211-50,1970;Kabat等人,SequencesofProteinsofImmunologicalInterest,第5版,PublicHealthService,NationalInstitutesofHealth,Bethesda,Md.,1991);或三个在VH(H1、H2、H3)中且三个在VL(L1、L2、L3)中的“超变区”、“HVR”或“HV”,是指抗体可变结构域中的在结构上超变的区,如Chothia和Lesk所定义(Chothia和Lesk,MolBiol196:901-17,1987)。其它术语包括“IMGT-CDR”(Lefranc等人,DevComparatImmunol27:55-77,2003)和“特异性决定残基用途”(SDRU)(Almagro,MolRecognit17:132-43,2004)。国际ImMunoGeneTics(IMGT)数据库(http://www_imgt_org)提供了抗原结合位点的标准化编号和定义。CDR、HV与IMGT划分之间的对应性在Lefranc等人,DevComparatImmunol27:55-77,2003中有所描述。如本文所用,“Chothia残基”是抗体VL和VH残基,其根据Al-Lazikani来编号(Al-Lazikani等人,JMolBiol273:927-48,1997)。“框架”或“框架序列”是可变区的除了被定义为抗原结合位点的那些序列之外的其余序列。因为抗原结合位点可以由如上所述的各种术语定义,所以框架的精确氨基酸序列取决于如何定义抗原结合位点。“人源化抗体”是指其中抗原结合位点来源于非人物种且可变区框架来源于人免疫球蛋白序列的抗体。人源化抗体在框架区中可包含置换,使得该框架可能不是表达的人免疫球蛋白或种系基因序列的精确拷贝。“人适应性”抗体或“人框架适应性(HFA)”抗体是指根据美国专利公布US2009/0118127中所描述的方法适应化的人源化抗体。通过如下方式将人适应性抗体人源化:基于CDR1和CDR2环及一部分轻链CDR3环的最大CDR与FR相似性、长度相容性和序列相似性,来选择受体人框架。“人抗体”是指具有重链可变区和轻链可变区的抗体,其中框架和抗原结合位点均来源于人起源的序列。如果所述抗体包含恒定区,则该恒定区也来源于人起源的序列。人抗体包含“来源于”人起源序列的重链可变区或轻链可变区,其中抗体的可变区来源于使用人种系免疫球蛋白或重排免疫球蛋白基因的系统。此类系统包括在噬菌体上展示的人免疫球蛋白基因文库,以及转基因非人动物,诸如携带如本文所述的人免疫球蛋白基因座的小鼠。在与人种系或重排免疫球蛋白序列进行比较时,人抗体可包含由于例如天然存在的体细胞突变或者在框架或抗原结合位点中特意引入置换所引起的氨基酸差异。通常,人抗体的氨基酸序列与由人种系或重排免疫球蛋白基因编码的氨基酸序列具有至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%的同一性。在一些情况下,人抗体可包含由人框架序列分析得到的共有框架序列(例如Knappik等人,JMolBiol296:57-86,2000中所述);或结合到展示在噬菌体上的人免疫球蛋白基因文库中的合成HCDR3(例如Shi等人,JMolBiol397:385-96,2010和国际专利公布WO2009/085462中所述)。人抗体的定义中不包括抗原结合位点来源于非人物种的抗体。分离的人源化抗体可以是合成的。虽然人抗体来源于人免疫球蛋白序列,但可使用诸如噬菌体展示的系统结合合成的CDR和/或合成的框架来生成该人抗体,或者可对其进行体外诱变以改善抗体特性,从而得到并非天然存在于体内整套人抗体种系内的抗体。如本文所用,术语“重组抗体”包括通过重组方法制备、表达、构建或分离的所有抗体,诸如:从动物(例如,小鼠)分离的抗体,即人免疫球蛋白基因的转基因或转染色体,或从其制备的杂交瘤分离的抗体(在下文中进一步描述);从经转化以表达抗体的宿主细胞分离的抗体;从重组的、组合的抗体文库分离的抗体;以及通过涉及将人免疫球蛋白基因序列与其它DNA序列剪接在一起的任何其它方法制备、表达、构建或分离的抗体,或使用Fab臂交换体外生成的抗体,诸如双特异性抗体。如本文所用,术语“单克隆抗体”是指单分子组合物的抗体分子制剂。单克隆抗体组合物显示出对于特定表位的单一结合特异性和亲和力,或就双特异性单克隆抗体而言,显示出对于两种不同表位的双重结合特异性。如本文所用,术语“表位”意指抗原的与抗体特异性结合的部分。表位通常由部分(moiety)(诸如氨基酸或多糖侧链)的化学活性(诸如,极性、非极性或疏水性)表面基团构成,并且可以具有特定三维结构特征以及特定电荷特征。表位可由形成构象空间单元的连续和/或不连续氨基酸构成。对于不连续表位,来自抗原的线性序列的不同部分的氨基酸因蛋白质分子的折叠而在三维空间上靠近。如本文所用,“变体”是指因一处或多处修改(例如置换、插入或缺失)而不同于参考多肽或参考多核苷酸的多肽或多核苷酸。“协同”、“协同作用”或“协同的”意指超过组合的预期加性效应。如本文所用,术语“与……联用”意指两种或更多种治疗剂可以在混合物中一起、作为单一试剂同时地或作为单一试剂以任何顺序依次地施用于受检者。术语“治疗”或“处理”是指治疗处理和预防或防御措施,其中目标是防止或减缓(减轻)非期望的生理变化或障碍,诸如肿瘤或肿瘤细胞的发展或扩散。有益的或期望的临床结果包括症状的减轻、疾病程度的减弱、疾病的稳定(即,未恶化)状态、疾病进展的延迟或减慢、疾病状态的改善或缓和,以及缓解(不论是部分缓解还是完全缓解),不论是可检测的还是不可检测的。“治疗”也可意指与受检者未接受治疗时的预期生存期相比延长生存期。需要治疗的个体包括已患有病症或障碍的个体以及易患病症或障碍的个体或者要预防病症或障碍的个体。“抑制生长”(例如,涉及细胞,诸如肿瘤细胞)是指与本领域技术人员熟知的适当对照条件下生长的相同细胞的生长相比,在与治疗剂或者治疗剂或药物的组合接触时体外或体内细胞生长的可测量下降。体外或体内细胞生长的抑制可为至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、99%或100%。细胞生长的抑制可通过多种机制发生,例如通过抗体依赖性细胞介导的毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡、坏死或细胞增殖抑制。“治疗有效量”指在所需剂量和时间段有效实现所需治疗结果的量。治疗有效量可根据一些因素而变化,诸如个体的疾病状态、年龄、性别和重量,以及治疗剂或治疗剂组合在个体中引发所需应答的能力。有效治疗剂或治疗剂组合的示例性指标包括,例如:患者健康状况的改善,肿瘤负荷的减少,肿瘤生长的遏止或减慢,和/或癌细胞没有向身体其它部位转移的情况。本发明提供了用于治疗患有CD38阳性恶性血液肿瘤的患者的方法。本发明依据这一发现:在恶性血液病的相关肿瘤模型中,与CHOP或R-CHOP联合施用的抗CD38抗体提供了体内协同有效的疗效。本文所公开的本发明的一个实施方案(包括在下列带有编号的实施方案中)是一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性调节来诱导体外杀伤表达CD38的细胞。在本文所公开的本发明的一些实施方案中(包括在下列带有编号的实施方案中),抗CD38抗体通过ADCC或CDC来诱导体外杀伤表达CD38的细胞。“CD38阳性恶性血液肿瘤”是指以存在表达CD38的肿瘤细胞为特征的恶性血液病,包括白血病、淋巴瘤和骨髓瘤。此类CD38阳性恶性血液肿瘤的示例包括:前体B细胞成淋巴细胞性白血病/淋巴瘤和B细胞非霍奇金淋巴瘤;急性早幼粒细胞白血病、急性成淋巴细胞性白血病和成熟B细胞肿瘤,诸如B细胞慢性淋巴细胞白血病(CLL)/小淋巴细胞性淋巴瘤(SLL)、B细胞急性淋巴细胞白血病、B细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、套细胞淋巴瘤(MCL)、滤泡性淋巴瘤(FL)(包括低度恶性、中度恶性和高度恶性FL)、皮肤滤泡中心淋巴瘤、边缘区B细胞淋巴瘤(MALT型、淋巴结型和脾型)、毛细胞白血病、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、浆细胞瘤、多发性骨髓瘤、浆细胞白血病、移植后淋巴增生性疾病、华氏巨球蛋白血症、浆细胞白血病和间变性大细胞淋巴瘤(ALCL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是多发性骨髓瘤。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是弥漫性大B细胞淋巴瘤(DLBCL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是非霍奇金淋巴瘤。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是急性成淋巴细胞性白血病(ALL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是滤泡性淋巴瘤(FL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是伯基特淋巴瘤(BL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD-38阳性恶性血液肿瘤是套细胞淋巴瘤(MCL)。在本文所公开的本发明的一个实施方案中(包括在下列带有编号的实施方案中),CD38阳性恶性血液肿瘤是多发性骨髓瘤、急性成淋巴细胞性白血病(ALL)、非霍奇金淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、滤泡性淋巴瘤(FL)或套细胞淋巴瘤(MCL)。B细胞非霍奇金淋巴瘤的示例是淋巴瘤样肉芽肿病、原发性渗出性淋巴瘤、血管内大B细胞淋巴瘤、纵隔大B细胞淋巴瘤、重链病(包括γ重链病、μ重链病和α重链病)、免疫抑制剂治疗所诱发的淋巴瘤(诸如环孢菌素诱发的淋巴瘤和氨甲蝶呤诱发的淋巴瘤)。在本发明的一个实施方案中(包括在下列带有编号的实施方案中),涉及表达CD38的细胞的疾病是霍奇金淋巴瘤。涉及表达CD38的细胞的疾病的其它示例包括来源于T细胞和NK细胞的恶性肿瘤,包括:成熟T细胞和NK细胞肿瘤,包括T细胞幼淋巴细胞白血病、T细胞大颗粒淋巴细胞白血病、侵袭性NK细胞白血病、成人T细胞白血病/淋巴瘤、结外NK/T细胞淋巴瘤、鼻型、78肠病型T细胞淋巴瘤、肝脾T细胞淋巴瘤、皮下脂膜炎样T细胞淋巴瘤、母细胞性NK细胞淋巴瘤、蕈样真菌病/塞扎里综合征、原发性皮肤CD30阳性T细胞淋巴增生性疾病(原发性皮肤间变性大细胞淋巴瘤C-ALCL、淋巴瘤样丘疹病、交界性病变)、血管免疫母细胞性T细胞淋巴瘤、外周T细胞淋巴瘤非特指型和间变性大细胞淋巴瘤。来源于骨髓细胞的恶性肿瘤的示例包括急性髓性白血病(包括急性早幼粒细胞白血病)和慢性骨髓增殖性疾病(包括慢性髓性白血病)。任何抗CD38抗体都可用于如本文所公开的本发明的方法中(包括在下列带有编号的实施方案中),前提条件是抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性调节来诱导体外杀伤表达CD38的细胞。抗CD38抗体的可变区可得自现有的抗CD38抗体,并且使用标准方法克隆为全长抗体。可使用的结合CD38的示例性可变区在例如国际专利公布WO05/103083、WO06/125640、WO07/042309、WO08/047242、WO12/092612、WO06/099875和WO11/154453A1中有所描述。可使用的示例性抗CD38抗体是达雷木单抗。达雷木单抗包含分别以SEQIDNO:4和5示出的重链可变区(VH)和轻链可变区(VL)氨基酸序列,分别为SEQIDNO:6、7和8的重链CDRHCDR1、HCDR2和HCDR3,以及分别为SEQIDNO:9、10和11的轻链CDRLCDR1、LCDR2和LCDR3,并且是IgG1/κ亚型。达雷木单抗重链氨基酸序列以SEQIDNO:12示出,而轻链氨基酸序列以SEQIDNO:13示出。SEQIDNO:1MANCEFSPVSGDKPCCRLSRRAQLCLGVSILVLILVVVLAVVVPRWRQQWSGPGTTKRFPETVLARCVKYTEIHPEMRHVDCQSVWDAFKGAFISKHPCNITEEDYQPLMKLGTQTVPCNKILLWSRIKDLAHQFTQVQRDMFTLEDTLLGYLADDLTWCGEFNTSKINYQSCPDWRKDCSNNPVSVFWKTVSRRFAEAACDVVHVMLNGSRSKIFDKNSTFGSVEVHNLQPEKVQTLEAWVIHGGREDSRDLCQDPTIKELESIISKRNIQFSCKNIYRPDKFLQCVKNPEDSSCTSEISEQIDNO:2SKRNIQFSCKNIYRSEQIDNO:3EKVQTLEAWVIHGGSEQIDNO:4EVQLLESGGGLVQPGGSLRLSCAVSGFTFNSFAMSWVRQAPGKGLEWVSAISGSGGGTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYFCAKDKILWFGEPVFDYWGQGTLVTVSSSEQIDNO:5EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDWO2015/130728A1ASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIKSEQIDNO:6SFAMSSEQIDNO:7AISGSGGGTYYADSVKGSEQIDNO:8DKILWFGEPVFDYSEQIDNO:9RASQSVSSYLASEQIDNO:10DASNRATSEQIDNO:11QQRSNWPPTFSEQIDNO:12EVQLLESGGGLVQPGGSLRLSCAVSGFTFNSFAMSWVRQAPGKGLEWVSAISGSGGGTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYFCAKDKILWFGEPVFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGKSEQIDNO:13EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC可使用的另一示例性抗CD38抗体是mAb003,其包含分别为SEQIDNO:14和15的VH和VL序列,并且在美国专利7,829,693中有所描述。SEQIDNO:14QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAFSWVRQAPGQGLEWMGRVIPFLGIANSAQKFQGRVTITADKSTSTAYMDLSSLRSEDTAVYYCARDDIAALGPFDYWGQGTLVTVSSASSEQIDNO:15DIQMTQSPSSLSASVGDRVTITCRASQGISSWLAWYQQKPEKAPKSLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYNSYPRTFGQGTKVEIK可使用的另一示例性抗CD38抗体是mAb024,其包含分别为SEQIDNO:16和17的VH和VL序列,在美国专利7,829,693中有所描述。SEQIDNO:16EVQLVQSGAEVKKPGESLKISCKGSGYSFSNYWIGWVRQMPGKGLEWMGIIYPHDSDARYSPSFQGQVTFSADKSISTAYLQWSSLKASDTAMYYCARHVGWGSRYWYFDLWGRGTLVTVSSSEQIDNO:17EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPTFGQGTKVEIK可使用的另一示例性抗CD38抗体是MOR-202(MOR-03087),其包含分别为SEQIDNO:18和19的VH和VL序列,在美国专利8,088,896中有所描述。SEQIDNO:18QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYYMNWVRQAPGKGLEWVSGISGDPSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLPLVYTGFAYWGQGTLVTVSSSEQIDNO:19DIELTQPPSVSVAPGQTARISCSGDNLRHYYVYWYQQKPGQAPVLVIYGDSKRPSGIPERFSGSNSGNTATLTISGTQAEDEADYYCQTYTGGASLVFGGGTKLTVLGQ用于本文所公开的本发明方法中(包括在下列带有编号的实施方案中)的抗CD38抗体也可从头选自例如噬菌体展示文库,其中噬菌体被改造以表达人免疫球蛋白或其部分,诸如Fab、单链抗体(scFv)或者未配对或配对抗体可变区(Knappik等人,JMolBiol296:57-86,2000;Krebs等人,JImmunolMeth254:67-84,2001;Vaughan等人,NatureBiotechnology14:309-314,1996;Sheets等人,PITAS(USA)95:6157-6162,1998;Hoogenboom和Winter,JMolBiol227:381,1991;Marks等人,JMolBiol222:581,1991)。CD38结合可变结构域可分离自例如噬菌体展示文库,其将抗体重链可变区和轻链可变区表达为具有噬菌体pIX外壳蛋白的融合蛋白,如Shi等人,J.Mol.Biol.397:385-96,2010和PCT国际公布WO09/085462中所述。可筛选抗体文库中结合人CD38细胞外结构域的那些,进一步表征所得的阳性克隆,从克隆溶解物分离Fabs,随后克隆为全长抗体。此类用于分离人抗体的噬菌体展示法在本领域已建立。参见例如:美国专利5,223,409;美国专利5,403,484;以及美国专利5,571,698、美国专利5,427,908、美国专利5,580,717、美国专利5,969,108、美国专利6,172,197、美国专利5,885,793;美国专利6,521,404;美国专利6,544,731;美国专利6,555,313;美国专利6,582,915;以及美国专利6,593,081。抗体的Fc部分可介导抗体效应子功能,诸如抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)或补体依赖性细胞毒性(CDC)。此类功能可通过如下方式介导:Fc效应子结构域结合于具有吞噬或裂解活性的免疫细胞上的Fc受体,或Fc效应子结构域结合于补体系统的成分。通常,Fc结合细胞或补体成分所介导的效应导致靶细胞(例如,表达CD38的细胞)的抑制和/或耗竭。人IgG同种型IgG1、IgG2、IgG3和IgG4表现出效应子功能的差异能力。ADCC可由IgG1和IgG3介导,ADCP可由IgG1、IgG2、IgG3和IgG4介导,并且CDC可由IgG1和IgG3介导。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体为IgG1、IgG2、IgG3或IgG4同种型。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体通过ADCC来诱导体外杀伤表达CD38的细胞。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体通过CDC来诱导体外杀伤表达CD38的细胞。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体通过ADCP来诱导体外杀伤表达CD38的细胞。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体通过细胞凋亡来诱导体外杀伤表达CD38的细胞。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体通过ADCC和CDC来诱导体外杀伤表达CD38的细胞。虽然不希望受有关作用机制的任何具体理论的束缚,但预计本发明的抗CD38抗体将通过ADCC、CDC、ADCP、细胞凋亡或CD38酶活性体内调节来诱导体内杀伤表达CD38的细胞。“抗体依赖性细胞毒性”或“抗体依赖性细胞介导的细胞毒性”或“ADCC”是诱导细胞死亡的机制,该机制依赖于抗体包被的靶细胞与具有裂解活性的效应细胞(诸如自然杀伤细胞、单核细胞、巨噬细胞和中性粒细胞)经由效应细胞上表达的Fcγ受体(FcγR)发生的相互作用。例如,NK细胞表达FcγRIIIa,而单核细胞表达FcγRI、FcγRII和FcvRIIIa。效应细胞通过分泌膜孔形成蛋白和蛋白酶而具有的活性会导致抗体包被的靶细胞诸如表达CD38的细胞发生死亡。为评估抗CD38抗体的体外ADCC活性,可将抗体与免疫效应细胞联合加入到表达CD38的细胞中,所述免疫效应细胞可被抗原抗体复合物激活,从而使靶细胞发生细胞溶解。通常根据从裂解细胞中释放的标记物(例如放射性底物、荧光染料或天然胞内蛋白)来检测细胞溶解。用于此类测定法的示例性效应细胞包括外周血单核细胞(PBMC)和NK细胞。示例性靶细胞包括表达CD38的Daudi细胞(CCL-213TM)或B细胞白血病或淋巴瘤肿瘤细胞。在示例性测定法中,用20μCi的51Cr标记靶细胞2小时,然后充分冲洗。可将靶细胞的细胞浓度调节到1×106个细胞/ml,并添加各种浓度的抗CD38抗体。以40:1的效应子:靶细胞比率添加Daudi细胞,由此开始测定。在37℃下温育3小时后,通过离心终止测定,然后在闪烁计数器中测量从裂解细胞中释放的51Cr。可按通过将3%高氯酸加入靶细胞中诱导的最大裂解%来计算细胞毒性的百分比。用于本发明的方法中的抗CD38抗体可诱导ADCC达对照(通过3%高氯酸诱导的细胞裂解)的约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。“抗体依赖性细胞吞噬作用”(“ADCP”)是指通过吞噬细胞(诸如巨噬细胞或树突细胞)的内化作用消除抗体包被的靶细胞的机制。可通过如下方式评估体外ADCP:使用单核细胞来源的巨噬细胞作为效应细胞,并使用表达CD38的Daudi细胞(CCL-213TM)或者B细胞白血病或淋巴瘤肿瘤细胞作为靶细胞,所述靶细胞被改造成表达GFP或其它标记分子。效应子:靶细胞比率可为例如4:1。可在含或不含抗CD38抗体的情况下,将效应细胞与靶细胞一起温育4小时。在温育后,可使用细胞消化液(accutase)分离细胞。可使用偶联至荧光标记物的抗CD11b抗体和抗CD14抗体鉴定巨噬细胞,并且可使用标准方法根据CD11+CD14+巨噬细胞中的GFP荧光%来确定吞噬百分比。用于本发明的方法中的抗CD38抗体可诱导ADCP达约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。“补体依赖性细胞毒性”或“CDC”是指诱导细胞死亡的机制,其中靶标结合抗体的Fc效应子结构域结合并活化补体成分C1q,继而激活补体级联,导致靶细胞死亡。补体的活化也可导致补体成分沉积在靶细胞表面上,这些补体成分通过结合白细胞上的补体受体(例如,CR3)来促进ADCC。可例如通过如下方式在体外测量表达CD38的细胞的CDC:将Daudi细胞以1×105个细胞/孔(50μl/孔)接种到RPMI-B(补充有1%BSA的RPMI)中,将50μl抗CD38抗体以0-100μg/ml之间的最终浓度加入到孔中,将反应在室温下温育15分钟,将11μl的混合人血清加入到孔中,然后将反应在37℃下温育45分钟。可使用标准方法在FACS测定法中检测碘化丙啶染色细胞%作为裂解细胞百分比(%)。用于本发明的方法中的抗CD38抗体可诱导CDC达约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。单克隆抗体诱导ADCC的能力可通过改造其低聚糖成分来增强。人IgG1或IgG3在Asn297处被熟知的双分枝G0、G0F、G1、G1F、G2或G2F形式的大多数聚糖N-糖基化。由未经改造的CHO细胞产生的抗体通常具有约至少85%的聚糖岩藻糖含量。从连接到Fc区的双分枝复合物型低聚糖去除核心岩藻糖,可经由改善的FcγRIIIa结合来增强抗体的ADCC,而不会改变抗原结合或CDC活性。此类抗体可使用据报道能引起具有双分枝复合物型Fc低聚糖的相对较高去岩藻糖基化抗体表达的不同方法实现,诸如:控制培养物渗透压(Konno等人,Cytotechnology64:249-65,2012),应用变体CHO细胞系Lec13作为宿主细胞系(Shields等人,JBiolChem277:26733-40,2002),应用变体CHO细胞系EB66作为宿主细胞系(Olivier等人,MAbs;2(4),2010;印刷前电子版;PMID:20562582),应用大鼠杂交瘤细胞系YB2/0作为宿主细胞系(Shinkawa等人,JBiolChem278:3466-3473,2003),引入特异性针对α1,6-岩藻糖基转移酶(FUT8)基因的小干扰RNA(Mori等人,BiotechnolBioeng88:901-908,2004),或共表达β-1,4-N-乙酰基葡糖胺转移酶III和高尔基体α-甘露糖苷酶II或强效α-甘露糖苷酶I抑制剂几夫碱(kifunensine)(Ferrara等人,JBiolChem281:5032-5036,2006,Ferrara等人,BiotechnolBioeng93:851-861,2006;Xhou等人,BiotechnolBioeng99:652-65,2008)。由用于本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体所引发的ADCC,也可通过抗体Fc中的某些置换来增强。示例性置换为例如在氨基酸位置256、290、298、312、356、330、333、334、360、378或430(根据EU索引对残基进行编号)处的置换,如美国专利6,737,056中所述。在本文所述的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含抗体Fc中的置换。在本文所述的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含抗体Fc中的氨基酸位置256、290、298、312、356、330、333、334、360、378或430(根据EU索引对残基进行编号)处的置换。本发明的另一个实施方案(包括在下列带有编号的实施方案中)是一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞,其中抗CD38抗体与包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL)的抗体(达雷木单抗)竞争结合CD38。可使用熟知的体外方法评估抗体与具有SEQIDNO:4的VH和SEQIDNO:5的VL的达雷木单抗对于结合CD38的竞争。在一个示例性方法中,通过重组表达CD38的CHO细胞可与未标记的达雷木单抗一起在4℃下温育15分钟,然后与过量的荧光标记的测试抗体一起在4℃下温育45分钟。在PBS/BSA中洗涤后,可使用标准方法通过流式细胞术来测量荧光。在另一示例性方法中,人CD38的细胞外部分可包被在ELISA板的表面上。可在约15分钟内加入过量的未标记达雷木单抗,随后可加入生物素酰化测试抗体。在PBS/吐温中洗涤后,可使用辣根过氧化物酶(HRP)缀合的链霉亲和素检测生物素酰化测试抗体的结合,并使用标准方法检测信号。显而易见的是,在竞争测定法中,达雷木单抗可带有标记,而测试抗体不带标记。测试抗体与达雷木单抗竞争,此时达雷木单抗抑制测试抗体的结合或测试抗体抑制达雷木单抗的结合达20%、30%、40%、50%、60%、70%、80%、85%、90%、95%或100%。可使用已知方法,通过例如肽作图或氢/氘保护测定法进一步限定测试抗体的表位。本文所公开的本发明的另一个实施方案(包括在下列带有编号的实施方案中)是治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用与人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)和EKVQTLEAWVIHGG区(SEQIDNO:3)结合的抗CD38抗体以及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞。抗体的表位包括具有以SEQIDNO:2或SEQIDNO:3示出的序列的这些区中的一些或所有残基。在本文所公开的一些实施方案中(包括在下列带有编号的实施方案中),抗体表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少一个氨基酸以及EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少一个氨基酸。在本文所公开的一些实施方案中(包括在下列带有编号的实施方案中),抗体表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少两个氨基酸以及EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少两个氨基酸。在本文所公开的一些实施方案中(包括在下列带有编号的实施方案中),抗体表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少三个氨基酸以及EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少三个氨基酸。在本文所公开的一些实施方案中(包括在下列带有编号的实施方案中),抗CD38抗体结合于表位,该表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少KRN,并且包含EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少VQLT(SEQIDNO:20)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体结合于表位,该表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少KRN,并且包含EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少VQLT(SEQIDNO:20)。结合于人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)和EKVQTLEAWVIHGG区(SEQIDNO:3)或最小限度地结合于如上所示的残基KRN和VQLT(SEQIDNO:20)的示例性抗体,是具有如上所述的某些VH、VL和CDR序列的达雷木单抗。结合于人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)和EKVQTLEAWVIHGG区(SEQIDNO:3)的抗体可例如通过如下方式生成:使用标准方法并如本文所述的那样,利用具有以SEQIDNO:2和3示出的氨基酸序列的肽来免疫小鼠。可例如按上文所述测定达雷木单抗与测试抗体之间对于结合CD38的竞争,来进一步评估抗体。在本文所述的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体能够以一系列亲和力(KD)结合人CD38。在根据本发明的一个实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体以高亲和力结合CD38,例如,由表面等离子体共振或Kinexa方法确定,KD等于或小于约10-7M,诸如但不限于1-9.9(或其中的任何范围或值,诸如1、2、3、4、5、6、7、8或9)×10-8、10-9、10-10、10-11、10-12、10-13、10-14、10-15或其中的任何范围或值,如本领域技术人员所实践。一种示例性亲和力等于或小于1×10-8M。另一种示例性亲和力等于或小于1×10-9M。在本文所述的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体具有岩藻糖含量为大约在0%至约15%之间(例如15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%)的双分枝聚糖结构。在本文所述的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体具有岩藻糖含量为约50%、40%、45%、40%、35%、30%、25%、20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的双分枝聚糖结构。Fc中的置换和减少的岩藻糖含量可增强抗CD38抗体的ADCC活性。“岩藻糖含量”意指Asn297处糖链内的岩藻糖单糖的量。岩藻糖的相对量为含岩藻糖的结构相对于所有糖结构的百分比。这些结构可通过多种方法进行表征和定量,例如:1)使用经N-糖苷酶F处理的样品(例如,复合结构、混合结构及低聚甘露糖结构和高甘露糖结构)的MALDI-TOF,如国际专利公布WO2008/077546中所述;2)酶促释放Asn297聚糖,随后衍生化并通过具有荧光检测的HPLC(UPLC)和/或HPLC-MS(UPLC-MS)进行检测/定量;3)对天然或经还原的mAb进行完整蛋白分析,同时进行或不进行用EndoS或其它酶对Asn297聚糖的处理,所述酶在第一GlcNAc单糖和第二GlcNAc单糖之间引发裂解,留下连接至第一GlcNAc的岩藻糖;4)通过酶消化(例如,胰蛋白酶或内肽酶Lys-C)将mAb消化为成分肽,随后通过HPLC-MS(UPLC-MS)进行分离、检测和定量;或5)用PNGaseF在Asn297处进行特异性酶促去糖基化,从而将mAb低聚糖与mAb蛋白分离。可通过各种互补技术在所释放的低聚糖上标记荧光团,分离并鉴定所释放的低聚糖,这些技术允许:采用基质辅助激光解吸电离(MALDI)质谱法,通过比较实验质量与理论质量来对聚糖结构进行精细表征;通过离子交换HPLC(GlycoSepC)确定唾液酸化程度;通过正相HPLC(GlycoSepN),根据亲水性标准分离和定量低聚糖形式;以及通过高效毛细管电泳激光诱导荧光(HPCE-LIF)分离和定量低聚糖。如本申请中所用,“低岩藻糖”或“低岩藻糖含量”是指抗体的岩藻糖含量为约0%-15%。如本文所用,“正常岩藻糖”或“正常岩藻糖含量”是指抗体的岩藻糖含量大约高于50%,通常大约高于60%、70%、80%或高于85%。用于所述方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体,可通过细胞凋亡诱导CD38阳性细胞体外杀伤。用于评估细胞凋亡的方法是熟知的,并且包括例如使用标准方法的膜联蛋白IV染色。用于本发明的方法中的抗CD38抗体可在约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%的细胞中诱导细胞凋亡。用于所述方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体,可通过CD38酶活性调节来诱导CD38阳性细胞杀伤。CD38是多功能胞外酶,其具有ADP核糖基环化酶1活性,催化由NAD+形成环ADP核糖(cADPR)和ADPR的过程,并且还起到将NAD+和cADPR水解成ADPR的作用。CD38还催化酸性条件下NADP+的烟酰胺基团与烟酸的交换,产生NAADP+(烟酸-腺嘌呤二核苷酸磷酸)。用于本发明方法中的抗CD38抗体对人CD38的酶活性的调节,可在Graeff等人,J.Biol.Chem.269,30260-30267(1994)中所述的测定法中进行测量。例如,可将底物NGD+与CD38一起温育,并且可在添加各种浓度的抗体后的不同时间点,通过分光光度法,在340nM的激发波长和410nM的发射波长下监测环GDP核糖(cGDPR)生成的调节。可根据Munshi等人,J.Biol.Chem.275,21566-21571(2000)所述的HPLC方法确定cADPR合成的抑制。用于本发明的方法中的抗CD38抗体可抑制CD38酶活性达至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。在本文所述的本发明的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含分别为SEQIDNO:6、7和8的重链互补决定区(HCDR)1(HCDR1)、2(HCDR2)和3(HCDR3)序列。在本文所述的本发明的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含分别为SEQIDNO:9、10和11的轻链互补决定区(LCDR)1(LCDR1)、2(LCDR2)和3(LCDR3)序列。在本文所述的本发明的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL)。在本文所述的本发明的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含SEQIDNO:12的重链和SEQIDNO:13的轻链。在本文所述的本发明的一些方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体包含这样的重链和轻链,所述重链的氨基酸序列与SEQIDNO:12的氨基酸序列具有95%、96%、97%、98%或99%同一性,所述轻链的氨基酸序列与SEQIDNO:13的氨基酸序列具有95%、96%、97%、98%或99%同一性。与包含SEQIDNO:12的重链和SEQIDNO:13的轻链的抗体基本上相同的抗体可用于本发明的方法中,以及下列带有编号的实施方案的每一者中的一些实施方案中。如本文所用,术语“基本上相同”意指被比较的两个抗体重链或轻链氨基酸序列是相同的或具有“非显著性差异”。非显著性差异是指抗体重链或轻链中有1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸被置换,这些置换不会对抗体的特性造成不利影响。百分比同一性可以例如通过使用VectorNTIv.9.0.0(Invitrogen,Carlsbad,CA)的AlignX模块的默认设置进行配对比对而确定。本发明的蛋白质序列可以用作查询序列以针对公共或专利数据库进行检索,以例如鉴定相关序列。用来进行此类检索的示例性程序是使用默认设置的XBLAST或BLASTP程序(http_//www_ncbi_nlm/nih_gov)或GenomeQuestTM(GenomeQuest,Westborough,MA)软件包。可对用于本发明方法中的抗CD38抗体进行的示例性置换为例如用具有相似电荷、疏水性或立体化学特性的氨基酸进行的保守置换。还可作出保守置换以改善抗体特性,例如稳定性或亲和力,或改善抗体效应子功能。可例如对抗CD38抗体的重链或轻链作出1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸置换。此外,重链或轻链中的任何天然残基还可以用丙氨酸来置换,如此前对于丙氨酸扫描诱变所述的(MacLennan等人,ActaPhysiolScandSuppl643:55-67,1998;Sasaki等人,AdvBiophys35:1-24,1998)。所需的氨基酸置换可以由本领域技术人员在需要此类置换时确定。氨基酸置换可以例如通过PCR诱变来进行(美国专利4,683,195)。可使用熟知方法生成变体文库,例如使用随机(NNK)或非随机密码子(例如DVK密码子,其编码11个氨基酸(Ala、Cys、Asp、Glu、Gly、Lys、Asn、Arg、Ser、Tyr、Trp),并在文库中筛选具有所需特性的变体。可使用本文所述的方法检测所生成的变体对CD38的结合,及其体外诱导ADCC、ADCP或细胞凋亡的能力。在一些实施例中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体为双特异性抗体。可将现有抗CD38抗体的VL和/或VH区或者如上文所述从头鉴定的VL和VH区改造成双特异性全长抗体。可使用诸如以下专利中所述的那些技术,通过调节两条单特异性抗体重链之间的CH3相互作用以形成双特异性抗体,从而制备此类双特异性抗体:美国专利7,695,936;国际专利公布WO04/111233;美国专利公布US2010/0015133;美国专利公布US2007/0287170;国际专利公布WO2008/119353;美国专利公布US2009/0182127;美国专利公布US2010/0286374;美国专利公布US2011/0123532;国际专利公布WO2011/131746;国际专利公布WO2011/143545;或美国专利公布US2012/0149876。可在其中结合本发明的抗体的VL区和/或VH区的另外的双特异性结构是例如双可变结构域免疫球蛋白(国际专利公布WO2009/134776),或包括多种二聚化结构域以连接具有不同特异性的两个抗体臂的结构,诸如亮氨酸拉链或胶原二聚化结构域(国际专利公布WO2012/022811、美国专利5,932,448、美国专利6,833,441)。本发明的另一个实施方案是一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体诱导体外抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节,其中CD38阳性恶性血液肿瘤是多发性骨髓瘤、急性成淋巴细胞性白血病(ALL)、非霍奇金淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、滤泡性淋巴瘤(FL)或套细胞淋巴瘤(MCL)。与标准治疗CHOP或R-CHOP相比,抗CD38抗体与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)联用的治疗方案可在体内肿瘤杀伤中提供协同疗效,因此与单独使用的CHOP或R-CHOP相比,其可为患者群体提供有益效果。本发明还提供了一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞,其中所述受检者对采用至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合的治疗表现出抵抗性,或已获得对这种治疗的抵抗性。本发明还提供了一种治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞,其中所述受检者已因副作用而停止采用至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合的治疗。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱、泼尼松、异环磷酰胺、卡铂或依托泊苷。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱和泼尼松的组合(CHOP)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是异环磷酰胺、卡铂和依托泊苷的组合(ICE)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中抗CD20抗体是利妥昔单抗奥法木单抗维妥珠单抗、奥瑞珠单抗、奥比妥珠单抗(GA-101)、PRO13192或奥卡妥珠单抗(ocratuzumab)(AME-133v)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中抗CD20抗体是利妥昔单抗。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱和泼尼松的组合(CHOP),并且抗CD20抗体是利妥昔单抗奥法木单抗维妥珠单抗、奥瑞珠单抗、奥比妥珠单抗(GA-101)、PRO13192或奥卡妥珠单抗(AME-133v)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是异环磷酰胺、卡铂和依托泊苷的组合(ICE),并且抗CD20抗体是利妥昔单抗奥法木单抗维妥珠单抗、奥瑞珠单抗、奥比妥珠单抗(GA-101)、PRO13192或奥卡妥珠单抗(AME-133v)。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱和泼尼松的组合(CHOP),并且抗CD20抗体是利妥昔单抗。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,受检者对采用至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性,其中所述至少一种化学治疗剂是异环磷酰胺、卡铂和依托泊苷(ICE)的组合,并且抗CD20抗体是利妥昔单抗。可使用各种定性和/或定量方法来确定受检者是否对采用至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或者已发展出对这种治疗的抵抗性,或易发展出对这种治疗的抵抗性。可能与抵抗性相关的症状包括例如:患者健康状况的下降或平稳,肿瘤尺寸的增加,癌细胞数量的增多,肿瘤或肿瘤细胞的生长下降受阻或减缓,和/或身体中的癌细胞从一个部位扩散到其它器官、组织或细胞。与肿瘤相关的各种症状的复发或恶化也可指示受检者已发展出或易发展出对至少一种化学治疗剂和抗CD20抗体的抵抗性。与癌症相关的症状可根据癌症的类型而有所差别。例如,与B细胞恶性肿瘤相关的症状可包括:颈部、腹股沟或腋窝的淋巴结肿大,发烧,盗汗,咳嗽,胸痛,原因不明的消瘦,腹部肿胀或疼痛,或者饱腹感。使用Cheson标准(Cheson等人,JClinOncology25:579-586,2007)对恶性淋巴瘤的缓解进行标准化,其中可使用指导准则确定受检者是否已发展出对至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合的抵抗性。由其美国选定药名(USAN)标识的抗体的重链和轻链氨基酸序列通常可通过美国医学会在http://_www_ama-assn_org上获得,或通过CAS登记号获得,或以国际非专利药名(INN)在http://_www_drugs_com/inn_html上获得。在本文所述的本发明的一些实施方案中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,患有CD38阳性恶性血液肿瘤的受检者对于CD16的位置158处的苯丙氨酸是纯合的(FcγRIIIa-158F/F基因型),或对于CD16的位置158处的缬氨酸和苯丙氨酸是杂合的(FcγRIIIa-158F/V基因型)。CD16也称为Fcγ受体IIIa(FcγRIIIa)或低亲和力免疫球蛋白γFc区受体III-A同种型。已证实FcγRIIIa蛋白残基位置158处的缬氨酸/苯丙氨酸(V/F)多态性影响FcγRIIIa对人IgG的亲和力。与FcγRIIIa-158V/V相比,具有FcγRIIIa-158F/F或FcγRIIIa-158F/V多态性的受体展示出减弱的Fc接合及因此减轻的ADCC。人类N-连接的低聚糖上不含或含少量岩藻糖,提高了抗体诱导ADCC的能力,这是由于抗体对人FcγRIIIa(CD16)的结合得以改善(Shields等人,JBiolChem277:26733-40,2002)。可使用常规方法分析患者的FcγRIIIa多态性。本发明还提供了治疗患有CD38阳性恶性血液肿瘤的受检者的方法,该方法包括向对其有需要的患者联合施用抗CD38抗体及环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP),其中抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞,其中所述受检者对于CD16的位置158处的苯丙氨酸是纯合的,或对于CD16的位置158处的缬氨酸和苯丙氨酸是杂合的。施用/药物组合物在本发明的方法中,并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体可在包含抗CD38抗体和药学上可接受的载体的合适药物组合物中提供。载体可为抗CD38抗体与之一起施用的稀释剂、佐剂、赋形剂或溶媒。此类溶媒可以是液体,诸如水和油,包括那些来源于石油、动物、植物的油或合成的油,诸如花生油、大豆油、矿物油和芝麻油等。例如,可使用0.4%盐水和0.3%甘氨酸。这些溶液是无菌的,并且通常不含颗粒物。它们可通过熟知的常规灭菌技术(例如过滤)进行灭菌。组合物可根据需要含有药学上可接受的辅助物质,以接近生理条件,诸如pH调节剂和缓冲剂、稳定剂、增稠剂、润滑剂和着色剂等。此类药物制剂中的本发明分子或抗体的浓度可广泛改变,即从小于约0.5重量%,通常到至少约1重量%至多达15重量%或20重量%,并且将根据所选择的具体施用方式,主要基于所需剂量、流体体积、粘度等进行选择。包含其它人蛋白如人血清白蛋白在内的合适的溶媒和制剂在例如Remington:TheScienceandPracticeofPharmacy,第21版,Troy,D.B.编辑,LipincottWilliamsandWilkins,Philadelphia,PA2006,第5部分,PharmaceuticalManufacturing,第691-1092页中有所描述,特别参见第958-989页。本发明的方法中抗CD38抗体的施用方式可为任何合适的途径,诸如非肠道施用,例如,真皮内、肌肉内、腹膜内、静脉内或皮下、肺、粘膜(口腔、鼻内、阴道内、直肠)或技术人员了解的其它方式,如本领域众所周知的。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可通过任何合适的途径施用给患者,例如,通过静脉内(i.v.)输注或推注进行肠胃外施用,肌肉内施用,或皮下施用,或腹膜内施用。可在例如15、30、60、90、120、180或240分钟内,或1、2、3、4、5、6、7、8、9、10、11或12小时内给予静脉内输注。向患有CD38阳性恶性血液肿瘤的患者给予的剂量足以缓解或至少部分地遏止正在治疗的疾病(“治疗有效量”),并且有时可为0.005mg/kg至约100mg/kg,例如约0.05mg/kg至约30mg/kg,或约5mg/kg至约25mg/kg,或约4mg/kg,约8mg/kg,约16mg/kg或约24mg/kg,或例如约1、2、3、4、5、6、7、8、9或10mg/kg,但可甚至更高,例如约15、16、17、18、19、20、21、22、23、24、25、30、40、50、60、70、80、90或100mg/kg。也可以给予固定的单位剂量,例如,50、100、200、500或1000mg,或者可以根据患者的体表面积确定剂量,例如,500、400、300、250、200或100mg/m2。通常可施用介于1和8次之间的剂量(例如,1、2、3、4、5、6、7或8次)以治疗CD38阳性B细胞恶性肿瘤,但是可以给予9、10、11、12、13、14、15、16、17、18、19、20或更多的剂量。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可以在一天、两天、三天、四天、五天、六天、一周、两周、三周、一个月、五周、六周、七周、两个月、三个月、四个月、五个月、六个月或更长时间之后重复施用。也可以重复治疗疗程,按照慢性施用一样。重复施用可为相同剂量或不同剂量。例如,本发明的方法中的抗CD38抗体可通过静脉内输注以8mg/kg或以16mg/kg按一周的时间间隔施用8周,接着以8mg/kg或以16mg/kg按每两周一次的方式再施用16周,然后以8mg/kg或以16mg/kg按每四周一次的方式施用。在本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中可通过维持疗法来施用抗CD38抗体,诸如一周一次,持续6个月或更长时间。例如,本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可以在治疗开始后第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39或40天中的至少一天,或者另选地,在第1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20周中的至少一周,或其任何组合,采用单次剂量或者每24、12、8、6、4或2小时一次的分次剂量,或其任何组合,以约0.1-100mg/kg的量作为日剂量提供,诸如0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg/天。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体也可以预防性地施用,以降低罹患癌症的风险,延迟癌症进展中事件的发作,和/或在癌症缓解后降低复发的风险。这对于肿瘤难以定位而由于其它生物因素已知患有肿瘤的患者可尤其有用。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可冻干储存,并在使用之前在合适的载体中复原。此项技术已被证实对常规的蛋白制剂有效,并且可采用熟知的冻干和复原技术。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)联合施用。例如,CHOP及其单独的成分可按如下文献中所述那样施用:Moharhmad等人,Gun.CancerRes25:4950,2000;McKelvey等人,Cancer1484-1493;1976;Armitage等人,J.Clin.Oncol.2:898-902,1984;Skeel,R.T.,HandbookofCancerGliemotherapy,第3版,Little,Brown&Co.,1991:343。典型的施用途径是腹膜内(i.p.)、静脉内(i.v.)或口腔(p.o.)。给药方案可为每天、每隔一天或每四天给药。CHOP组分的典型剂量如下:环磷酰胺,最多至30mg/kg单次剂量i.v.或i.p.,或20mg/kg每天一次,持续八天i.v.或i.p.;多柔比星,最多至6mg/kg单次剂量i.v.或i.p.;长春新碱,0.2至0.5mg/kg单次剂量i.p.或i.v.;泼尼松,最多至10mg/kg/天,作为单一药剂,p.o.。例如,可以如下剂量施用CHOP:环磷酰胺30mg/kg,多柔比星2.5mg/kg,长春新碱0.4mg/kg,泼尼松0.15mg/kg。可每21天给予一次CHOP,持续不同的周期数。可以静脉内输注方式给予环磷酰胺、多柔比星和长春新碱。可以片剂形式给予泼尼松,在每个周期开始时每天口服一次,共服用五天。在本发明的方法中并且在下列带有编号的实施方案中的每一者中的一些实施方案中,抗CD38抗体与CHOP的组合可在任何方便的时间段内施用。例如,除泼尼松外,抗CD38抗体和CHOP可在同一天、甚至在同一静脉内输注中施用给患者。然而,抗CD38抗体和CHOP也可以隔天或隔周或隔月等施用。在一些方法中,抗CD38抗体和CHOP可在足够接近的时间施用,使得它们同时以可检测水平存在于正在治疗的患者体内(例如,血清中)。在一些方法中,在一定时间段内由多个剂量组成的抗CD38抗体的整个疗程之后或之前是由多个剂量组成的CHOP疗程。可在施用抗CD38抗体和CHOP之间使用1、2或若干天或若干周的恢复期。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)联合施用。本发明的方法中以及下列带有编号的实施方案的每一者中的一些实施方案中的抗CD38抗体可与环磷酰胺、多柔比星、长春新碱、泼尼松和抗CD20抗体利妥昔单抗(R-CHOP)联合施用。利妥昔单抗可按375mg/m2的剂量以静脉内输注方式给予,并且可每周施用一次,共施用4或8剂量。抗CD38抗体和CHOP的组合可连同任何形式的放射疗法和/或外科手术一起施用,所述放射疗法包括外照射、调强放射疗法(IMRT)和任何形式的放射外科手术,包括伽玛刀、射波刀、直线加速器和组织间放射(例如,植入放射性粒子、GliaSite球囊)。放射疗法可用于患有大包块病变(肿瘤尺寸超过约10cm)的患者或用于对非化学疗法候选者的患者进行姑息性治疗。虽然已概括地描述了本发明,但是本发明的实施方案还将在以下的实施例中进一步公开,所述实施例不应理解为限制权利要求的范围。本发明的其它实施方案下文根据本文别处的公开内容陈述了本发明的某些其它实施方案。上文陈述为与本文所公开的发明相关的本发明的实施方案的特征还涉及这些其它带有编号的实施方案中的每一者。1.一种抗CD38抗体,所述抗CD38抗体用于与环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)联合治疗患有CD38阳性恶性血液肿瘤的受检者。2.用于与抗-CD38抗体联合治疗患有CD38阳性恶性血液肿瘤的受检者的环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)。3.用于治疗患有CD38阳性恶性血液肿瘤的受检者的抗CD38抗体、环磷酰胺、多柔比星、长春新碱和泼尼松(CHOP)的组合。4.根据实施方案1所述使用的抗CD38抗体、根据实施方案2所述使用的CHOP、或根据实施方案3所述的组合,其中所述抗CD38抗体通过抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬作用(ADCP)、补体依赖性细胞毒性(CDC)、细胞凋亡或CD38酶活性体外调节来诱导体外杀伤表达CD38的细胞,优选地其中抗CD38抗体通过ADCC或CDC诱导体外杀伤表达CD38的细胞。5.根据实施方案1或4所述使用的抗CD38抗体、根据实施方案2或4所述使用的CHOP、或根据实施方案3或4所述使用的组合,其中所述抗CD38抗体与包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL)的抗体竞争结合CD38。6.根据实施方案1、4或5所述使用的抗CD38抗体,根据实施方案2、4或5所述使用的CHOP,或根据实施方案3、4或5所述使用的组合,其中所述抗CD38抗体与包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL)的抗体竞争结合CD38。7.根据实施方案1或4-6中任一项所述使用的抗CD38抗体、根据实施方案2或4-6中任一项所述使用的CHOP、或根据实施方案3-6中任一项所述使用的组合,其中所述抗CD38抗体结合于表位,所述表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少一个氨基酸,并且包含人CD38的EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少一个氨基酸。8.根据实施方案7所述使用的抗CD38抗体、CHOP或组合,其中所述抗CD38抗体结合于表位,所述表位包含人CD38(SEQIDNO:1)的SKRNIQFSCKNIYR区(SEQIDNO:2)中的至少KRN,并且包含人CD38的EKVQTLEAWVIHGG区(SEQIDNO:3)中的至少VQLT(SEQIDNO:20)。9.根据实施方案1或4-8中任一项所述使用的抗CD38抗体、根据实施方案2或4-8中任一项所述使用的CHOP、或根据实施方案3-8中任一项所述使用的组合,其中所述抗CD38抗体:(i)是IgG1、IgG2、IgG3或IgG4同种型;(ii)具有岩藻糖含量为约50%、40%、45%、40%、35%、30%、25%、20%、15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或0%的双分枝聚糖结构;(iii)当根据EU索引对残基进行编号时,在抗体Fc中的氨基酸位置256、290、298、312、356、330、333、334、360、378或430处包含置换;和/或(iv)以1×10-9或更小、1×10-10或更小、1×10-11或更小、或者1×10-12或更小的亲和力结合于CD38。10.根据实施方案1或4-9中任一项所述使用的抗CD38抗体、根据实施方案2或4-9中任一项所述使用的CHOP、或根据实施方案3-9中任一项所述使用的组合,其中所述抗CD38抗体包含:(i)分别为SEQIDNO:6、7和8的重链互补决定区(HCDR)1(HCDR1)、2(HCDR2)和3(HCDR3)序列;(ii)分别为SEQIDNO:9、10和11的轻链互补决定区(LCDR)1(LCDR1)、2(LCDR2)和3(LCDR3)序列;(iii)包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL);(iv)包含氨基酸序列与SEQIDNO:12的氨基酸序列具有95%、96%、97%、98%或99%同一性的重链,以及氨基酸序列与SEQIDNO:13的氨基酸序列具有95%、96%、97%、98%或99%同一性的轻链;或(v)包含SEQIDNO:12的重链和SEQIDNO:13的轻链。11.根据实施方案1或4-10中任一项所述使用的抗CD38抗体、根据实施方案2或4-10中任一项所述使用的CHOP、或根据实施方案3-10中任一项所述使用的组合,其中所述CD38阳性恶性血液肿瘤是多发性骨髓瘤、急性成淋巴细胞性白血病(ALL)、非霍奇金淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)、伯基特淋巴瘤(BL)、滤泡性淋巴瘤(FL)或套细胞淋巴瘤(MCL),特别地其中所述CD38阳性恶性血液肿瘤是DLBCL。12.根据实施方案1或4-11中任一项所述使用的抗CD38抗体、根据实施方案2或4-11中任一项所述使用的CHOP、或根据实施方案3-11中任一项所述使用的组合,其中:(i)所述受检者对采用至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合进行的治疗表现出抵抗性,或已获得对这种治疗的抵抗性;和/或(ii)所述受检者已因副作用而停止采用至少一种化学治疗剂或者至少一种化学治疗剂与抗CD20抗体的组合的治疗。13.根据实施方案12所述使用的抗CD38抗体、CHOP或组合,其中所述抗CD20抗体是利妥昔单抗奥法木单抗维妥珠单抗、奥瑞珠单抗、奥比妥珠单抗(GA-101)、PRO13192或奥卡妥珠单抗(AME-133v),特别地其中所述抗CD20抗体是利妥昔单抗。14.根据实施方案12或13所述使用的抗CD38抗体、CHOP或组合,其中所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱、泼尼松、异环磷酰胺、卡铂或依托泊苷,任选地其中:(i)所述至少一种化学治疗剂是环磷酰胺、多柔比星、长春新碱和泼尼松的组合(CHOP);或(ii)所述至少一种化学治疗剂是异环磷酰胺、卡铂和依托泊苷的组合(ICE)。15.根据实施方案1或4-14中任一项所述使用的抗CD38抗体、根据实施方案2或4-14中任一项所述使用的CHOP、或根据实施方案3-14中任一项所述使用的组合,其中所述抗CD38抗体、环磷酰胺、多柔比星、长春新碱和泼尼松同时地、依次地或单独地施用。16.根据实施方案1或4-15中任一项所述使用的抗CD38抗体、根据实施方案2或4-15中任一项所述使用的CHOP、或根据实施方案3-15中任一项所述使用的组合,其中所述受检者进一步用放射疗法进行治疗。17.根据实施方案1或4-16中任一项所述使用的抗CD38抗体、根据实施方案2或4-16中任一项所述使用的CHOP、或根据实施方案3-16中任一项所述使用的组合,其中:(i)所述抗CD38抗体包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL);(ii)所述抗CD38抗体是IgG1;并且(iii)其中所述CD38阳性恶性血液肿瘤是DLBCL。18.根据实施方案1或4-16中任一项所述使用的抗CD38抗体、根据实施方案2或4-16中任一项所述使用的CHOP、或根据实施方案3-16中任一项所述使用的组合,其中:(i)所述抗CD38抗体包含SEQIDNO:4的重链可变区(VH)和SEQIDNO:5的轻链可变区(VL);(ii)所述抗CD38抗体是IgG1;并且(iii)其中所述CD38阳性恶性血液肿瘤是伯基特淋巴瘤。实施例1在来源于患者的非霍奇金淋巴瘤(NHL)模型中联用达雷木单抗和CHOP的组合疗法方法ST1361是源自在转移性样品采集之前未行化疗的五十八岁西班牙裔男性的NHL-DLBCL(弥漫性大B细胞淋巴瘤)PDX(来源于患者的异种移植物)模型。患者在进行切除术之前已用R-CHOP治疗8个疗程,随后用R-ICE和R-GEMOX进行治疗。将肿瘤植入5-8周龄之间的免疫低下小鼠中。当肿瘤达到大约125-250mm3时(第0天),将动物随机分配到处理组和对照组,并且在第0天时开始给药。每周一次以20mg/kg施用达雷木单抗,共给药3周。在第0天施用一次下述浓度的CHOP和R-CHOP。CHOP(环磷酰胺:30mg/kg;多柔比星:2.5mg/kg;长春新碱:0.4mg/kg)-IV,第0天;泼尼松:0.15mg/kg,第0-4天;R-CHOP:利妥昔单抗20mg/kg-IP,第0天。在第0天开始,每周两次通过数显卡尺测量肿瘤体积,并且为每组记录数据,包括单独的和平均的估计肿瘤体积(平均TV±SEM)。该研究用于测量肿瘤生长抑制直到对照组终止,然后继续作为生存研究,以评估达雷木单抗疗效的持续时间。对于该研究,在第0天开始,每周两次通过数显卡尺测量肿瘤尺寸,并且为每组记录数据,包括单独的和平均的估计肿瘤体积(平均TV±SEM)。使用下式计算肿瘤体积(TV):TV=宽度2×长度×0.52。通过下式,使用初始(i)和最终(f)肿瘤测量值对每个处理组(T)与对照(C)计算肿瘤生长抑制%(%TGI)值:%TGI=1-Tf-Ti/Cf-C。结果与CHOP或R-CHOP联用的达雷木单抗在DLBCL的来源于患者的肿瘤模型中高度有效。在第31天,CHOP给药方案本身减缓肿瘤生长约27%,而达雷木单抗抑制肿瘤生长约71%。R-CHOP是更有效的疗法,肿瘤生长抑制达到82%。达雷木单抗与CHOP或R-CHOP的组合显示出肿瘤消退的效果,到研究结束时,所有动物都没有可检测的肿瘤。在第31天后,表1.处理平均肿瘤体积(mm3)±SEM%TGI同种型对照2192±160达雷木单抗744±23671%CHOP1634±15927%R-CHOP513±10482%达雷木单抗/CHOP0107%达雷木单抗/R-CHOP0107%%TGI:肿瘤生长抑制百分比达雷木单抗+CHOP和达雷木单抗+R-CHOP中100%的动物存活了下来,其它组则因肿瘤进展而损失动物。图1A示出了每个处理组随时间推移的肿瘤体积,并且图1B示出了随时间推移的中位生存率%。表1示出了一直到研究的第31天的%TGI。在第零天,每组的肿瘤体积为145-146mm3。甚至在研究开始的60天后,达雷木单抗和CHOP的组合导致了100%的TGI。在该研究中,在来源于患者的DLBCL模型中评估达雷木单抗的疗效。该患者受到R-CHOP治疗,最初对R-CHOP有反应,但后来因疾病进展而死亡。该研究的目标是确定达雷木单抗的添加是否将为DLBCL患者提供更大的有益效果。与单一疗法(达雷木单抗、CHOP或R-CHOP)相比,达雷木单抗添加到CHOP或R-CHOP中使得所有动物都出现肿瘤消退,而所有其它组中的动物则因疾病负荷而发生死亡。达雷木单抗与CHOP或R-CHOP的组合表现出的肿瘤生长抑制效应要大于加性效应。实施例2.在伯基特淋巴瘤中达雷木单抗与CHOP联用的疗效作为伯基特淋巴瘤的模型,利用NAMALWA细胞研究达雷木单抗在单独使用或与CHOP联用时的疗效。方法在补充有胎牛血清(10%v/v)和L-谷氨酰胺(2mM)的RPMI1640培养基中,在空气中的5%CO2气氛中于37℃下在体外维持Namalwa细胞。将细胞通过胰蛋白酶-EDTA处理进行每周两次常规继代培养。收获在指数生长期中生长的细胞,并且对其进行计数以用于肿瘤接种。为小鼠皮下注射0.1ml含基质胶的PBS(1:1)中的2×105个Namalwa细胞,并在平均肿瘤尺寸达到189mm3时开始治疗。肿瘤细胞接种的日期表示为第0天。主要终点是观察肿瘤生长是否可被延迟或患有肿瘤的小鼠是否可治愈。每周两次测量肿瘤尺寸,并且如实施例1中所述那样计算%TGI值。结果将动物分为四个处理组,按表2中所述的剂量施用溶媒(同种型对照)、达雷木单抗、CHOP或者达雷木单抗与CHOP的组合。表2.n,动物数目i.p腹膜内注射i.v.静脉内注射p.o.口服QD:每日给药一次QW:每周一次CTX:环磷酰胺图2示出了在伯基特淋巴瘤的NAMALWA模型中,达雷木单抗在单独使用或与CHOP联用时的疗效结果。在肿瘤接种后的不同时间点,不同处理组中肿瘤尺寸(作为肿瘤体积测量)的减小示于图2中。在肿瘤接种后的第26天,溶媒组(第1组)的平均肿瘤尺寸达到4,281mm3。在肿瘤接种后的第26天,采用10mg/kg达雷木单抗、CHOP及10mg/kg达雷木单抗与CHOP的组合进行的治疗分别在肿瘤尺寸方面产生了显著的抗肿瘤作用。平均肿瘤尺寸为3,017mm3(T/C值=70.46%,p值<0.001)、3,304mm3(T/C值=77.17%,p值=0.003)和2,303mm3(T/C值=53.79%,p值<0.001),同时在肿瘤尺寸为2,303mm3处的肿瘤生长延迟分别为2、1和4天。实施例3.在非霍奇金淋巴瘤中达雷木单抗与CHOP联用的疗效利用基于SU-DHL-6细胞系的NHL-DLBCL模型来研究达雷木单抗在单独使用或与CHOP联用时的疗效。方法在补充有20%胎牛血清(v/v)的RPMI1640培养基中,在空气中的5%CO2气氛中于37℃下在体外单独地维持SU-DHL-6细胞。对细胞进行每周两次常规继代培养。收获在指数生长期中生长的细胞,并且对其进行计数以用于肿瘤接种。在注射前24h,对NODSCID小鼠进行γ照射(200拉德)。在右胁部处为每只小鼠皮下接种0.1mL含基质胶的PBS(1:1)中的SU-DHL-6肿瘤细胞(5×106),以使肿瘤发展。在肿瘤尺寸达到大约154mm3时开始治疗。肿瘤细胞接种的日期表示为第0天。每周两次测量肿瘤尺寸,并且如实施例1中所述那样计算%TGI值。将动物分为四个处理组,并且按表3中所述的剂量施用溶媒、达雷木单抗、CHOP或者达雷木单抗与CHOP的组合。在肿瘤接种后的不同时间点,不同组中的肿瘤尺寸的结果示于图3中。在肿瘤接种后的第32天,溶媒组(第1组)的平均肿瘤尺寸达到4,281mm3。在肿瘤接种后的第32天,采用10mg/kg达雷木单抗及10mg/kg达雷木单抗与CHOP的组合进行的治疗分别在肿瘤尺寸方面产生了显著的抗肿瘤作用。平均肿瘤尺寸为1,946mm3(T/C值=45.45%,p值=0.006)和1,611mm3(T/C值=37.62%,p值=0.002),同时在肿瘤尺寸为1,500mm3处的肿瘤生长延迟分别为3和3.5天。与溶媒组相比,采用CHOP进行的治疗可减小肿瘤尺寸,但这种减小未达到显著的差异。表3.n,动物数目i.p.腹膜内注射i.v.静脉内注射p.o.口服QD:每日给药一次QW:每周一次CTX:环磷酰胺实施例4.联用达雷木单抗和CHOP或R-CHOP的依次或同时治疗在来源于患者的非霍奇金淋巴瘤(NHL)模型中提供了疗效利用在来源于患者的DLBCL肿瘤模型ST1361中同时或依次给药并根据实施例1中所述的方法,评估达雷木单抗在单独使用或者与CHOP或R-CHOP联用时的疗效。将动物分为多个处理组并按表4所示给药。在第0天或在7天间隔同时施用达雷木单抗和R-CHOP。表4.n,动物数目i.p腹膜内注射i.v.静脉内注射p.o.口服QD:每日给药一次QW:每周给药一次D0=第0天给药D0-4=在第d0-d4天每天给药一次结果图4示出了到研究的45天的响应治疗的肿瘤生长曲线结果。溶媒对照组中的肿瘤到第17天时平均肿瘤体积达到2134mm3。达雷木单抗+CHOP组中的肿瘤到第45天时消退到平均肿瘤体积为96mm3。在第0天同时用达雷木单抗和R-CHOP治疗的动物(第4组)中的肿瘤到第45天时完全消退。在第0天用R-CHOP治疗、然后在第7天用达雷木单抗治疗的动物(第5组)中的肿瘤显示出998mm3的平均肿瘤体积。在第0天用达雷木单抗治疗、然后在第7天用R-CHOP治疗的肿瘤(第6组)显示出633mm3的平均肿瘤体积。该研究继续进行多至101天。在第0天同时用达雷木单抗和R-CHOP治疗的动物(第4组)到第101天时肿瘤也完全消退。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1