细胞内能量水平提高的微生物和用其生产L‑氨基酸的方法与流程
本发明涉及具有提高的细胞内能量水平的重组微生物和使用所述微生物生产l-氨基酸的方法。
背景技术:
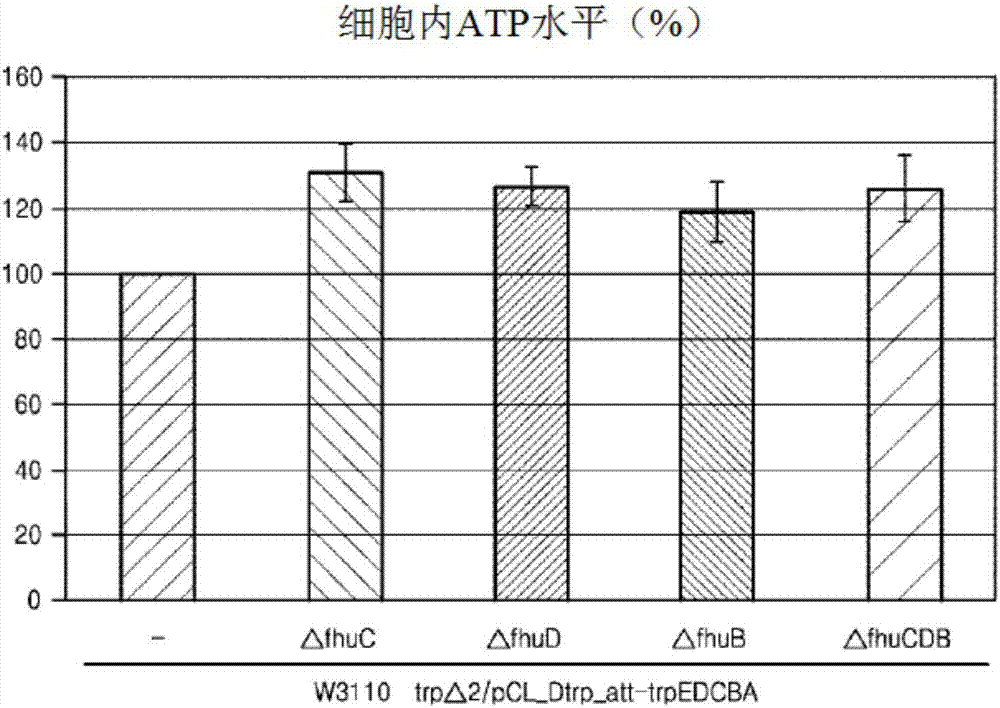
:为了使用微生物生产靶物质,主要使用了对靶物质特异的方法,例如增强对在靶物质的生成中所涉及的酶进行编码的基因的表达或者移除非必需的基因。例如,通过增强l-氨基酸的生物合成途径,已经研发了许多能够以高产率生产目标l-氨基酸的有用菌株(例如大肠杆菌)。为了使用微生物以高产率生产有用的靶物质,需要生成和维持足够的能量。为了诸如蛋白质、核酸等物质的体内生物合成,使用以nadh、nadph和atp(腺苷-5'-三磷酸)形式保存的能量。尤其,atp是将代谢反应中产生的化学能量传递到微生物的各种活动的一种能量载体。atp主要在微生物的代谢过程中产生。主要的细胞内atp生产途径是经由糖酵解过程发生的底物水平磷酸化反应,或使用在糖酵解过程中积累在nadh等中的还原力并通过电子传递链生产atp的氧化磷酸化反应。所产生的atp在体内活动中被消耗,例如在生物合成、运动、信号传导和细胞分裂。因此,用于生产有用的靶物质的工业微生物通常表现出高的atp需求。于是,已进行许多研究,以在有用的靶物质的大规模生产中,通过提高细胞内能量水平来提高生产能力(biotechnoladv(期刊《生物技术进展》)(2009)27:94-101)。铁是维持微生物体内平衡所必需的元素之一,并且大肠杆菌利用多种路径摄取铁(molmicrobiol(期刊《分子微生物学》)(2006)62:120-131)。摄取铁的一个路径是经由fhucdb复合物通道来摄取铁,所述fhucdb复合物由fhuc、fhud和fhub蛋白形成。最近,有研究人员揭示了,在细胞中存在过量l-色氨酸的情况下,调控参与l-色氨酸生物合成的基因的表达的trpr蛋白与l-色氨酸形成复合物,并且反过来,该复合物结合到fhucdb操纵子的调控区,这表明通过fhucdb蛋白复合物的铁摄取和l-色氨酸生物合成之间可能存在相关性。然而,尚未阐明fhucdb蛋白复合物在l-色氨酸生物合成中的功能及其对铁摄取的影响(natchembiol(期刊《自然化学生物学》)(2012)8:65-71)。本发明人已经研究了提高atp水平和提高有用的靶物质(诸如l-氨基酸)的生产能力的方法,并且他们发现通过使fhucdb基因缺失而使fhucdb蛋白复合物的功能被灭活后,可以提高细胞内atp水平,并因此可以提高靶物质的生产能力,从而完成本发明。技术实现要素:技术问题本发明的一个目的是提供具有提高的细胞内atp水平的微生物。本发明的另一个目的是提供使用具有提高的细胞内atp水平的微生物来生产靶物质的方法。技术方案在一个方面,本发明提供具有提高的细胞内atp水平的微生物。在本发明的一个具体实施方式中,微生物可以是具有如下特征的微生物:构成铁摄取系统的fhuc蛋白、fhud蛋白和fhub蛋白中的一个或多个的活性被灭活,并因此具有与未修饰的菌株相比提高的细胞内atp水平。本说明书中使用的术语“fhucdb”是铁摄取系统(fhu系统)的一个组成部分,铁摄取系统包含排布在一个操纵子中的fhua、fhuc、fhud和fhub的表达产物。fhua编码多功能omp(造骨牛奶蛋白)fhua(79kda),其中多功能ompfhua起到铁色素(ferrichrome)离子、噬菌体、细菌毒素以及抗生素的受体的作用。fhua对fe3+-铁色素是特异的,并且起到配体特异性门控通道的作用(proteinsci(期刊《蛋白质科学》)7,1636-1638)。fhu系统的其他蛋白质(即fhud、fhuc和fhub)对于铁摄取系统的功能来说也是必需的。周质蛋白fhud、膜结合蛋白fhuc和fhub形成fhucdb复合物,fhucdb复合物起到将铁色素和其他fe3+-氧肟酸盐化合物(fe3+-气杆菌素(aerobactin),fe3+-粪生素(coprogen))穿过细胞质膜从周质运输到细胞质中的功能(jbacteriol(期刊《细菌学杂志》)169,3844-3849)。经由fhucdb复合物摄取铁会消耗一分子atp,并且蛋白质复合物tonb-exbb-exbd为这种铁摄取过程提供能量(febslett(期刊《欧洲生物化学学会联合会快报》)274,85-88)。fhuc编码29kda的膜结合蛋白,并且与fhud和fhub一起形成铁摄取的通道。fhuc可以具有序列号5的氨基酸序列,并且具体地,fhuc可以由序列号1的核苷酸序列编码。fhud编码31kda的膜结合蛋白,并与fhuc和fhub一起形成铁摄取的通道。fhud可以具有序列号6的氨基酸序列,并且具体地,fhud可以由序列号2的核苷酸序列编码。fhub编码41kda的膜结合蛋白,并与fhuc和fhub一起形成铁摄取通道。fhub可以具有序列号7的氨基酸序列,并且具体地,fhub可以由序列号3的核苷酸序列编码。具体地,尽管蛋白质具有相同的活性,但是在不同个体的氨基酸序列之间可存在较小的差异。因此,fuhc、fhud和fhub可分别具有序列号5、6和7,但不限于此。也就是说,本发明中的fuhc,fhud和fhub可以是具有通过在上述氨基酸序列的一个或多个位置处的一个或多个氨基酸的取代、缺失、插入、添加或倒位而得到的氨基酸序列的变体,并且它们可以分别具有与序列号5、6和7的氨基酸序列的同源性为70%或更高、80%或更高、90%或更高、或者95%或更高的序列。此外,基于密码子简并性,在核苷酸序列中,可以通过对待表达上述蛋白质的生物体中优选的密码子加以考虑而在编码区中进行各种修饰,但不改变由编码区表达的蛋白质的氨基酸序列。上述核苷酸序列仅作为通过本领域技术人员公知的方法制备的各种核苷酸序列的实例提供,但不限于此。本说明书中使用的术语“同源性”指的是将对蛋白质进行编码的基因的氨基酸序列或核苷酸序列的两条序列对齐以使两条序列在特定比较区域最大限度地一致后所呈现的碱基或氨基酸残基之间的相似程度。如果同源性足够高,则相应基因的表达产物可以具有相同或相似的活性。序列相似的百分数可以使用已知的序列比较程序来确定,例如blast(ncbi(美国国立生物信息中心))、clcmainworkbench(clcbio公司)、megaligntm(dnastar公司)等。本说明书中使用的术语“微生物”指的是具有生产有用的靶物质(如l-氨基酸)的能力的原核微生物或真核微生物。例如,具有提高的细胞内atp浓度的微生物可以是埃希氏菌(escherichia)属、欧文氏菌(erwinia)属、沙雷氏菌(serratia)属、普罗威登斯菌(providencia)属、棒状杆菌(corynebacteria)属、假单胞菌(pseudomonas)属、钩端螺旋体(leptospira)属、沙门氏菌(salmonellar)属、短杆菌(brevibacteria)属、hypomononas属、色杆菌(chromobacterium)属或诺卡氏菌(norcardia)属或属于真菌或酵母菌的微生物。具体地,微生物可以是埃希氏菌属微生物,并且更具体地,微生物可以是大肠杆菌。本说明书中使用的术语“未修饰的菌株”指的是未通过分子生物学技术(例如突变或重组)进行修饰的微生物。具体地,未修饰的菌株是指在通过修饰而提高细胞内atp水平之前的微生物,其中所述修饰是指通过使构成铁摄取系统和fhucdb复合物的fhuc、fhud和fhub中的一种或多种被灭活来使细胞内atp消耗降低。也就是说,未修饰的菌株是指重组微生物的来源微生物。在本发明的一个具体实施方式中,可以使上述微生物的fhuc、fhud和fhub中的一种或多种被灭活,也可以使fhuc、fhud和fhub的组合被灭活,并且具体地,可以使fhuc、fhud和fhub均被灭活。本说明书中使用的术语“灭活”是指通过如下方式使相应蛋白质的活性被消除或弱化:由于编码相应蛋白质的基因的部分或全部的缺失、取代或插入而引起的突变;修饰表达调控序列以减少基因的表达;修饰染色体基因序列以弱化或消除蛋白质的活性;或它们的组合。具体地,编码蛋白质的基因的部分或全部的缺失可以通过如下方式来进行:经由细菌染色体插入载体,将编码染色体中的内源性靶蛋白的基因替换成其部分序列缺失的多核苷酸或标记基因。此外,可以使用诸如化学品或紫外线的诱变剂来诱导突变,从而获得具有相应基因缺失的突变体,但不限于此。本说明书中使用的术语“表达调控序列”,即调控基因表达的核苷酸序列,是指能够提高或降低个体中特定基因的表达的片段,并且可以包括启动子、转录因子结合位点、核糖体结合位点、调控转录和翻译终止的序列,但不限于此。具体地,用于引起基因表达降低的表达调控序列的修饰可以通过如下方式来进行:通过核苷酸序列的缺失、插入、保守性或非保守性取代或其组合来在表达调控序列中诱导突变,以进一步弱化表达调控序列的活性,或者用具有较弱活性的表达调控序列进行替换,但不限于此。在本发明的一个具体实施方式中,与未修饰的菌株相比,微生物可以是具有提高的靶物质的生产能力的埃希氏菌属微生物。在本发明的埃希氏菌属微生物中,构成fhucdb复合物的一种或多种蛋白质可以被灭活以使铁摄取途径失活,因此伴随经由该途径的铁摄取的atp消耗降低。结果,与未修饰的菌株相比,埃希氏菌属微生物具有提高的细胞内atp水平,因此微生物具有提高的靶物质生产能力。本说明书中使用的术语“具有提高的生产能力的微生物”是指与在修饰之前的亲本细胞或未修饰的菌株相比,具有提高的靶物质生产能力的微生物。本说明书中使用的术语“靶物质”包括通过提高微生物的细胞内atp水平来提高生产量的物质,但不限于此。靶物质可以具体地是l-氨基酸,更具体地,l-苏氨酸或l-色氨酸。在一个具体的实施方式中,微生物可以是具有l-色氨酸生产能力的大肠杆菌,其中其fhuc、fhud和fhub中的一种或多种被灭活,并且与未修饰的菌株相比,具有提高的细胞内atp水平。具有l-色氨酸生产能力的大肠杆菌可以通过如下方式来获得:提高l-色氨酸操纵子基因的表达;解除最终产物l-色氨酸的反馈抑制;或解除l-色氨酸操纵子基因对转录水平的抑制和减弱,但不限于此。在本发明的一个具体实施方式中,微生物可以是具有l-苏氨酸生产能力的大肠杆菌,其中其fhuc、fhud和fhub中的一种或多种被灭活,并且与未修饰的菌株相比,具有提高的细胞内atp水平。具有l-苏氨酸生产能力的大肠杆菌可以通过如下方式来获得:提高l-苏氨酸操纵子基因的表达;解除最终产物l-苏氨酸的反馈抑制或解除l-苏氨酸操纵子基因对转录水平的抑制和减弱,但不限于此。另一方面,本发明提供了生产l-氨基酸的方法,所述方法包括如下步骤:培养具有提高的细胞内atp水平的埃希氏菌属微生物;以及从所获得的微生物的培养液中分离l-氨基酸。本说明书中使用的术语“具有提高的细胞内atp水平的埃希氏菌属微生物”与上文所描述的相同。在根据本发明的一个具体实施方式的生产l-氨基酸的方法中,具有l-氨基酸生产能力的微生物的培养可以根据本领域已知的合适的培养基和培养条件来进行。培养过程可以由本领域技术人员根据所选择的微生物容易地调整。培过程的实例包括间歇式、连续式和补料分批式,但不限于此。用于培养的培养基必须满足培养特定微生物的要求。在文献(美国细菌学会(americansocietyforbacteriology)的“manualofmethodsforgeneralbacteriology(普通细菌学方法手册)”,washingtond.c.(华盛顿),usa(美国),1981)中描述了用于各种微生物的培养基。这些培养基包含各种碳源、氮源和微量元素成分。碳源包括碳水化合物,诸如葡萄糖、乳糖、蔗糖、果糖、麦芽糖、淀粉和纤维素;脂质,诸如大豆油、向日葵油、蓖麻油和椰子油;脂肪酸,诸如棕榈酸、硬脂酸和亚油酸;醇,诸如甘油和乙醇;和有机酸,诸如乙酸。这些碳源可以单独使用或组合使用,但不限于此。氮源包括有机氮源,例如蛋白胨、酵母提取物、肉汁、麦芽提取物、玉米浆(csl)和豆粉;以及无机氮源,例如尿素、硫酸铵、氯化铵、磷酸铵、碳酸铵和硝酸铵。这些氮源可以单独使用或组合使用,但不限于此。另外,培养基可以包含磷酸二氢钾、磷酸氢二钾和其相应的含钠盐作为磷源,但不限于此。此外,培养基可以包含金属,诸如硫酸镁或硫酸铁。此外,也可以添加氨基酸、维生素和适当的前体。此外,为了将培养物维持在需氧条件下,可以将氧气或含氧气体(例如空气)注入培养液中。培养物的温度通常可以为20℃-45℃,具体为25℃-40℃。可以继续培养,直至l-氨基酸(诸如l-苏氨酸或l-色氨酸)的产量达到所期望水平,并且具体地,培养时间可以为10小时-100小时。根据本发明的具体实施方式的生产l-氨基酸的方法可以包括从由此获得的微生物的培养液中进一步分离l-氨基酸。l-氨基酸的分离可以根据培养本发明的微生物的方法(例如间歇式、连续式和补料分批式)通过本领域已知的适当方法来从微生物的培养液中纯化或回收所需的l-氨基酸,但不限于此。有益效果通过根据本发明的与未修饰的菌株相比具有提高的细胞内atp浓度的埃希氏菌属微生物以及使用其制备靶物质的方法,较高的细胞内atp浓度会增强基因表达、生物合成、物质运输等,从而能够有效地生产有用的靶物质,包括蛋白质、l-氨基酸等。附图说明图1显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的大肠杆菌的细胞内atp水平;图2显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的具有l-色氨酸生产能力的野生型来源的大肠杆菌的细胞内atp水平;图3显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的具有l-苏氨酸生产能力的大肠杆菌的细胞内atp水平;图4显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的具有l-色氨酸生产能力的大肠杆菌的细胞内atp水平;图5显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的具有l-苏氨酸生产能力的大肠杆菌的l-苏氨酸生产能力;和图6显示了与未修饰的菌株相比的根据本发明的一个具体实施方式的具有l-色氨酸生产能力的大肠杆菌的l-色氨酸生产能力。具体实施方式下文中,将参考一些实施例更详细地描述本发明。然而,这些实施例仅仅用于说明性目的,并且本发明的范围不意图受这些实施例限制。实施例1:具有由fhuc、fhud和fhub基因编码的、被灭活的蛋白质的野生型大肠杆菌w3110的制备在该实施例中,通过同源重组,分别使野生型大肠杆菌w3110(39936tm)的fhuc、fhud和fhub基因缺失。待被缺失的fhuc、fhud和fhub基因分别具有序列号1、2和3的核苷酸序列,并且这些基因以序列号4的操纵子的形式存在。为了使fhuc、fhud和fhub缺失,采用了使用由datsenkoka等开发的lambdared重组酶的一步灭活方法(onestepinactivation)(procnatlacadsciusa.(美国国家科学院学报),(2000)97:6640-6645)。使用pucprmfmloxc的氯霉素基因作为确认在基因中的插入的标记物(韩国专利申请第2009-0075549号),其中pucprmfmloxc的氯霉素基因是通过将rmf启动子连接到puc19(newenglandbiolabs(纽英伦生物技术)(usa(美国)))并连接从pacyc184(newenglandbiolab)获得的突变的loxp-cmr-loxp盒来制备的。首先,使用pucprmfmloxc作为模板,并利用序列号8和9、10和11、12和13以及8和13的引物组合,进行含30个循环的初级(primary)聚合酶链式反应(下文中称为“pcr”),从而获得约1.2kb的pcr产物△fhuc1st、△fhud1st、△fhub1st和△fhucdb1st,其中,上述序列号8和9、10和11、12和13以及8和13具有fhuc和fhub基因的一部分和pucprmfmloxc基因的氯霉素抗性基因的部分序列,且每个循环包含在94℃下变性30秒、在55℃下退火30秒和在72℃下延伸1分钟。此后,将通过pcr获得的1.2kb的pcr产物△fhuc1st、△fhud1st、△fhub1st和△fhucdb1st在0.8%琼脂糖凝胶上进行电泳,然后洗脱并用作二级(secondary)pcr的模板。使用洗脱的初级pcr产物作为模板,并利用序列号14和15、16和17、18和19、14和19的引物组合,进行含30个循环的二级pcr,从而获得约1.3kb的pcr产物,即△fhuc、△fhud、△fhub和△fhucdb,其中,上述序列号14和15、16和17、18和19、14和19包含在初级pcr中获得的pcr产物的5'和3'区域的20bp的核苷酸序列,其中每个循环包含在94℃下变性30秒、在55℃下退火30秒和在72℃下延伸1分钟。将由此获得的pcr产物在0.8%琼脂糖凝胶上进行电泳,然后洗脱,并用于重组。根据datsenkoka等人开发的一步灭活方法(procnatlacadsciusa.,(2000)97:6640-6645)用pkd46载体转化的大肠杆菌w3110被制备成感受态后,通过引入由初级pcr和二级pcr获得的1.3kb的基因片段来进行转化。在含有氯霉素的lb培养基上培养菌株,并且选择具有氯霉素抗性的转化体。由所选菌株获得的基因组作为模板,并利用序列号20和21的引物来进行pcr后,确认到所扩增的大小分别为大约4.4kb、大约4.3kb、大约3.3kb和大约1.6kb,从而确认fhuc、fhud和fhub已单独或全部缺失。在从由此获得的具有氯霉素抗性的初级重组菌株去除pkd46后,引入pjw168载体(gene(期刊《基因》),(2000)247,255-264),以从菌株中去除氯霉素标记基因(gene,(2000)247,255-264)。使用序列号20和21的引物对最终获得的菌株进行pcr后,获得了约3.4kb、约3.3kb、约2.2kb和约0.6kb的pcr产物,从而确认fhuc、fhud和fhub基因已单独或全部缺失,并分别命名为大肠杆菌w3110_δfhuc、w3110_δfhud、w3110_δfhub和w3110_δfhucdb。实施例2:在由野生型大肠杆菌获得的、缺失fhuc、fhud和fhub基因的大肠杆菌中测定细胞内atp水平在该实施例中,利用实施例1中所制备的菌株而测量实际的细胞内atp水平。为此,采用kiyotakay.hara等研发的、使用荧光素酶的“细胞atp合成能力的定量测定方法(anefficientmethodforquantitativedeterminationofcellularatpsyntheticactivity)”(jbiomscre(生物分子筛选杂志),(2006)第11卷,no.3,第310-17页)。简言之,在含有葡萄糖的lb液体培养基中,分别对实施例1中所使用的大肠杆菌w3110(未修饰的菌株)和通过基因缺失而获得的大肠杆菌w3110_δfhucdb进行过夜培养。在培养后,通过离心分离而除去上清液,并用100mmtris-cl(ph7.5)洗涤所获得的菌体,然后用pb缓冲液(可渗透缓冲液:40%[v/v]葡萄糖,0.8%[v/v]tritonx-100)处理30分钟以使细胞内atp渗出至细胞外。接着,通过离心分离而除去上清液,并向细胞中加入荧光素作为荧光素酶底物后,使细胞反应10分钟。使用发光计测量荧光素酶的显色程度以定量测定atp水平。在图1中给出该结果。图1示出三次重复实验结果的平均值。如图1中所示,可确认:与未修饰的菌株大肠杆菌w3110相比,在实施例1中制备的大肠杆菌w3110_δfhuc、w3110_δfhud、w3110_δfhub和w3110_δfhucdb中的细胞内atp水平得到提高,其中由野生型大肠杆菌获得的fhuc、fhud和fhub分别单独缺失或全部缺失。实施例3:由fhuc、fhud和fhub基因编码的蛋白质被灭活的、由野生型获得的l-色氨酸生产菌株的制备和细胞内atp水平的测量在该实施例中,通过实施例1中的同源重组而使由野生型获得的大肠杆菌w3110trpδ2/pcl-dtrp_att-trpedcba菌株(生产l-色氨酸的菌株)(韩国专利公开第10-2013-0082121号)的fhuc、fhud和fhub基因分别单独缺失或全部缺失,以制备w3110trpδ2_δfhuc/pcl-dtrp_att-trpedcba、w3110trpδ2_δfhud/pcl-dtrp_att-trpedcba、w3110trpδ2_δfhub/pcl-dtrp_att-trpedcba和w3110trpδ2_δfhucdb/pcl-dtrp_att-trpedcba菌株。在由此制得的这些菌株中,采用与实施例2中相同的方式测量细胞内atp水平,并且在图2中给出该结果。如图2中所示,可确认:与未修饰的菌株和对照组菌株相比,在通过使源于野生型的l-色氨酸生产菌株的fhuc、fhud和fhub基因分别单独缺失或全部缺失来制备的菌株中的细胞内atp水平得到提高。实施例4:确认由fhuc、fhud和fhub基因编码的蛋白质被灭活的、由野生型获得的l-色氨酸生产菌株的效价使用葡萄糖作为碳源,对如实施例3所述的作为由野生型获得的l-色氨酸生产菌株的w3110trpδ2/pcl-dtrp_att-trpedcba和通过使fhuc、fhud和fhub基因分别单独缺失或全部缺失而所制得的具有提高的细胞内atp水平的菌株进行效价测定(titration)。分别按白金环的一次钩取量,将每个菌株接种在lb固体培养基上,并在37℃下在培养器中进行过夜培养,然后分别按白金环的一次钩取量接种到25ml的含有表1的组分的含葡萄糖的效价培养基中。然后,在37℃下和200rpm下在培养器中培养48小时。在表2中给出该结果。所有结果均表示三次重复实验结果的平均值。[表1]组分浓度(每升)葡萄糖60gk2hpo41g(nh4)2so415gnacl1gmgso4·h2o1g柠檬酸钠5g酵母提取物2gcaco340gl-苯丙氨酸0.15gl-酪氨酸0.1gph6.8[表2]*48小时后的测量值如表2中所示,可确认:与未修饰的菌株trpδ2/pcl-dtrp_att-trpedcba相比,通过使野生型l-色氨酸生产菌株w3110trpδ2/pcl-dtrp_att-trpedcba中的fhuc、fhud和fhub基因分别单独缺失或全部缺失而制得的具有提高的细胞内atp水平的菌株(实施例3)使l-色氨酸生产量提高了最高约63%。鉴于图2中确认的细胞内atp水平,这些结果表明,通过提高细胞内atp水平来提高了菌株的l-色氨酸生产能力。实施例5:由fhuc、fhud和fhub基因编码的蛋白质被灭活的l-苏氨酸生产菌株和l-色氨酸生产菌株的制备在该实施例中,通过实施例1所述的同源重组,分别使作为l-色氨酸生产菌株的大肠杆菌kccm10812p(韩国授权专利第0792095号)和l-苏氨酸生产菌株kccm10541p(韩国授权专利第0576342号)的fhuc、fhud和fhub基因缺失。作为具有l-色氨酸生产能力的未修饰的菌株,大肠杆菌kccm10812p是由具有l-苯丙氨酸生产能力的大肠杆菌变体(kfcc10066)获得的菌株,并且是具有l-色氨酸生产能力的重组大肠杆菌菌株,其特征在于染色体的色氨酸营养缺陷性被解除,phea、trpr、mtr和tnaab基因被减弱,并且arog和trpe基因被修饰。此外,作为具有l-苏氨酸生产能力的未修饰的菌株,大肠杆菌kccm10541p是由大肠杆菌kfcc10718(韩国专利公开第1992-0008365号)获得的菌株,并且是具有如下特征的大肠杆菌:对l-甲硫氨酸类似物的抗性、甲硫氨酸营养缺陷性、对l-苏氨酸类似物的抗性、异亮氨酸渗漏(leaky)缺陷性、对l-赖氨酸类似物的抗性、对α-氨基丁酸的抗性和l-苏氨酸产生能力。以与实施例1中相同的方式,分别在大肠杆菌kccm10812p和大肠杆菌kccm10541p中使待被缺失的fhuc、fhud和fhub基因缺失,从而制备得到l-苏氨酸生产菌株kccm10541p_δfhucdb和l-色氨酸生产菌株kccm10812p_δfhucdb。实施例6:在由fhuc、fhud和fhub基因编码的蛋白质被灭活的l-苏氨酸生产菌株和l-色氨酸生产菌株中测量atp水平在该实施例中,利用实施例5中所制得的菌株测量实际的细胞内atp水平。以与实施例2中相同的方式测量细胞内atp水平。在图3和4中给出其结果。图3和图4示出三次重复实验结果的平均值。使用缺失ysa和ydas基因的l-苏氨酸生产菌株(大肠杆菌kccm10541p_△ysa△ydas)和l-色氨酸生产菌株(大肠杆菌kccm10812p_△ysa△ydas)(韩国授权专利第1327093号)作为对照组,已知缺失ysa和ydas的l-苏氨酸生产菌株(大肠杆菌kccm10541p_△ysa△ydas)和l-色氨酸生产菌株(大肠杆菌kccm10812p_△ysa△ydas)具有比实施例5中使用的未修饰的菌株大肠杆菌kccm10812p和大肠杆菌kccm10541p更高的细胞内atp水平。如图3和4中所示,与未修饰的菌株和对照菌株相比,通过使l-苏氨酸生产菌株和l-色氨酸生产菌株的fhuc、fhud和fhub缺失而制备的如实施例5所述的菌株表现出提高的细胞内atp水平。实施例7:确认由fhuc、fhud和fhub基因编码的蛋白质的功能被灭活的l-苏氨酸生产菌株的效价(titer)使用葡萄糖作为碳源,对通过使作为l-苏氨酸生产微生物的大肠杆菌kccm10541p(韩国授权专利第0576342号)的fhuc、fhud和fhub基因缺失而制备得到的具有提高的细胞内atp水平的菌株(实施例5)进行效价测定(titration)。使用缺失ysa和ydas基因的l-苏氨酸生产菌株(大肠杆菌kccm10541p_△ysa△ydas)作为对照组,来比较效价测定结果。在33℃下在培养器中,将每个菌株接种在lb固体培养基上并进行过夜培养,然后按白金环的一次钩取量分别接种到含有表1的组分且含葡萄糖的25ml效价培养基中后,在33℃下和200rpm下在培养器中培养50小时。在表4和图5中给出其结果。所有结果均表示三次重复实验结果的平均值。[表3]组分浓度(每升)葡萄糖70gkh2po42g(nh4)2so425gmgso4·h2o1gfeso4·h2o5mgmnso4·h2o5mg酵母提取物2gcaco330g[表4]*30小时后的测量值**50小时后的测量值如表4中所示,可确认:根据本发明制备的l-苏氨酸生产大肠杆菌重组菌株表现出与未修饰的菌株相似的生理活性,并且与未修饰的菌株相比,l-苏氨酸产量提高了约9%。鉴于图2中确认的细胞内atp水平,这些结果表明,通过提高细胞内atp水平来提高了菌株的l-苏氨酸生产能力。实施例8:确认由fhuc、fhud和fhub基因编码的蛋白质被灭活的l-色氨酸生产菌株效价使用葡萄糖作为碳源,对通过使作为l-色氨酸生产微生物的大肠杆菌kccm10812p(韩国授权专利第0792095号)中的fhuc、fhud和fhub基因缺失而制备得到的具有提高的细胞内atp水平的菌株(实施例5)进行效价测定(titration)。使用缺失ysa和ydas基因的l-色氨酸生产菌株(大肠杆菌kccm10812p_△ysa△ydas)作为对照组,来以与实施例4中相同的方式测定效价。在表5和图6中给出该效价测定结果。所有结果均表示三次重复实验结果的平均值。[表5]*33小时后的测量值**48小时后的测量值如表5中所示,可确认:根据本发明制备的l-色氨酸生产大肠杆菌重组菌株表现出与未修饰的菌株相似的生理活性,并且与未修饰的菌株相比,l-色氨酸产量提高了约30%。鉴于图3中确认的细胞内atp水平,这些结果表明,通过提高细胞内atp水平来提高了菌株的l-色氨酸生产能力。根据本发明的重组菌株ca04-2801(kccm10812p_△fhucdb)于2013年11月15日被保藏于作为国际保藏机构的韩国微生物保藏中心(koreanculturecenterofmicroorganisms),保藏号为kccm11474p。基于上述描述,本领域技术人员将理解,本发明可以以不同的具体形式实现,而不改变其技术精神或必要特征。因此,应当理解,上述实施方式在所有方面都不是限制性的,而是示例性的。本发明的范围由所附权利要求限定,而不是由前述的详细说明限定,因此落入权利要求的含义和范围内以及其等同物内的所有改变和修改均旨在包含于本发明的范围中。序列目录freetext(自由文本)附件的序列目录中示出本说明书中所记载的序列号1至序列号21的序列。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1