得自类杆菌属的岩藻糖苷酶及其用途的制作方法
本发明主张以下优先权:美国临时申请案美国申请序号(USSN)62/003,136,申请于2014年5月27日、USSN 62/003,104,申请于2014年5月27日、USSN 62/003,908,申请于2014年5月28日,USSN 62/020,199申请于2014年7月2日及USSN 62/110,338,申请于2015年1月30日。其内容以全文引用方式并入本文中。
背景技术:
岩藻糖系糖偶联物的许多O-或N-连接寡糖结构的重要组份。含岩藻糖聚糖涉及诸多生物事件(包含发育及细胞凋亡),且涉及发炎、癌症及囊性纤维化的发病机制。糖偶联物的去岩藻糖基化系理解糖偶联物的生物效应的重要过程。
α-L-岩藻糖苷酶(α-岩藻糖苷酶)系糖苷外切酶,其负责通过水解岩藻糖中主要附接至半乳糖或N-乙酰基葡糖胺的α-(1,2)、α-(1,3)、α-(1,4)及α-(1,6)链接自糖偶联物的非还原端去除岩藻糖残基。
众所周知,人类血清IgG及治疗抗体可发生重度岩藻糖基化。已发现,抗体依赖性细胞毒性(ADCC)系负责治疗抗体的临床功效的重要效应物功能的一。在淋巴球受体(FccR)结合至抗体Fc区后,ADCC得以触发。ADCC活性取决于经由α-(1,6)链接附接至N-连接Fc寡糖的最内GlcNAc的岩藻糖的量。
技术实现要素:
因此,本发明提供用于在活体外改良岩藻糖的酶水解的组合物及方法。特定而言,本发明可用于有效裂解天然糖蛋白中的核心岩藻糖且糖蛋白并无变性或功能劣化。本发明的组合物及方法可促进Fc融合蛋白或抗体(例如治疗抗体)的Fc糖改造。本发明亦应用聚糖测序来辨别糖偶联物上的岩藻糖位置。糖偶联物可为糖脂、糖蛋白、寡糖或糖肽。
在一态样中,本发明系关于包括与SEQ ID NO:1具有至少85%序列一致性的多肽的α-岩藻糖苷酶。在一些实施例中,α-岩藻糖苷酶包括与SEQ ID NO:1具有至少88%序列一致性的多肽。在一些实施例中,α-岩藻糖苷酶包括与SEQ ID NO:1具有序列一致性的多肽。在某些实施例中,α-岩藻糖苷酶包括与SEQ ID NO:2具有序列一致性的多肽。SEQ ID NO:1及2共有88%序列一致性。
本文所阐述的岩藻糖苷酶可水解一或多种α(1,2)、α(1,3)、α(1,4)及α(1,6)-连接岩藻糖。岩藻糖可存在于糖偶联物中的N-及/或O-连接聚糖中。在某些实施例中,α-岩藻糖苷酶系重组类杆菌属(Bacteroides)α-岩藻糖苷酶。
在优选实施例中,α-岩藻糖苷酶展现4-9的最佳pH。
在另一态样中,本发明系关于包括上文所阐述α-岩藻糖苷酶的组合物。所述组合物可进一步包括至少一种糖苷酶。在一些实施例中,糖苷酶可为糖苷外切酶。糖苷外切酶包含但不限于唾液酸酶、半乳糖苷酶、α-岩藻糖苷酶及其变体。在一些实施例中,糖苷酶可为糖苷内切酶。糖苷内切酶包含但不限于内-β-N-乙酰基胺基葡萄糖苷酶(NAG)、EndoA、EndoF1、EndoF2、EndoF3、EndoH、EndoM、EndoS及其变体。
本发明组合物可用于在活体外对糖偶联物进行去岩藻糖基化。特定而言,本文所阐述的组合物可用于在活体外对糖蛋白进行核心去岩藻糖基化。在一些实施例中,核心去岩藻糖基化系核心α(1,6)去岩藻糖基化。在某些实施例中,核心去岩藻糖基化系核心α(1,3)去岩藻糖基化。去岩藻糖基化可在糖蛋白并无变性或功能劣化下实施。
本发明的另一态样提供在活体外对糖偶联物进行去岩藻糖基化的方法。发明性方法包括使糖偶联物与上文所阐述本发明的α-岩藻糖苷酶接触的步骤。糖偶联物包括一或多种选自α(1,2)、α(1,3)、α(1,4)及α(1,6)-连接岩藻糖的岩藻糖。岩藻糖可存在于糖偶联物中的N-及/或O-连接聚糖中。
在一些实施例中,糖偶联物系糖蛋白。在一些实施例中,糖蛋白包括核心岩藻糖。在一些实施例中,核心岩藻糖系核心α-(1,3)-连接岩藻糖或核心α-(1,6)-连接岩藻糖。
在一些实施例中,所述方法进一步包括使糖偶联物与至少一种糖苷酶接触。在某些实施例中,糖苷酶系糖苷内切酶。使用糖苷内切酶修剪N-聚糖中的寡糖的可变部分。本文所使用的糖苷内切酶的实例包含但不限于Endo-β-N-乙酰基胺基葡萄糖苷酶(NAG)、EndoA、EndoF1、EndoF2、EndoF3、EndoH、EndoM、EndoS及其变体。糖苷外切酶
对于核心去岩藻糖基化而言,可使用糖苷内切酶及α-岩藻糖苷酶依序或同时处理糖偶联物。核心去岩藻糖基化可为核心α(1,3)去岩藻糖基化或α(1,6)去岩藻糖基化。
本发明一或多个实施例的详细内容陈述于下文说明书中。根据下列图式及若干实施例的详细说明亦及随附申请专利范围,本发明的其他特征或优点将显而易见。
附图说明
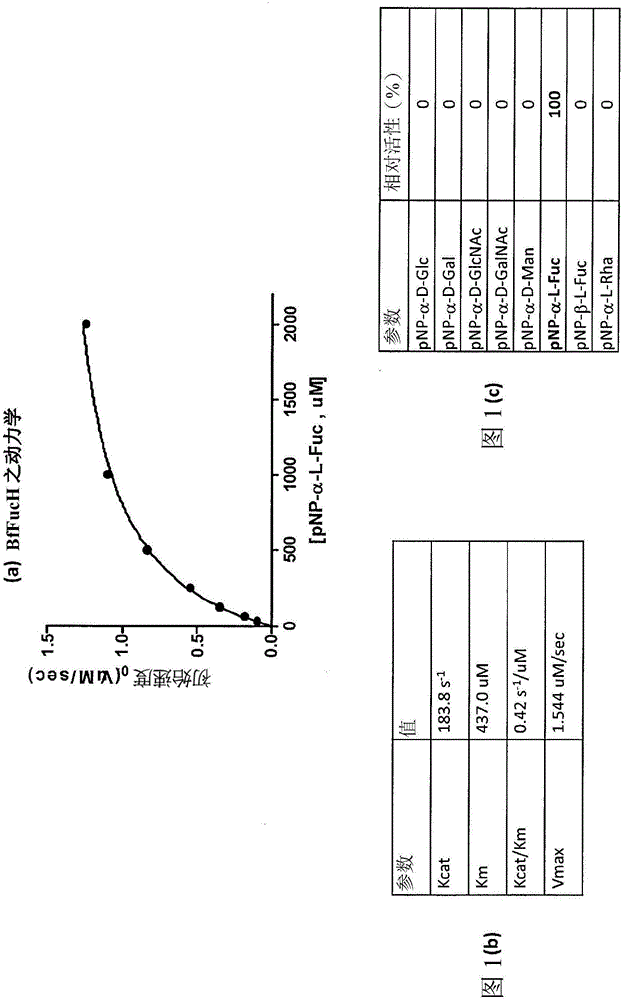
图1.展示BfFucH的生物化学性质。
图2.(a)BfFucH的pH特征(b)对BfFucH的酶活性的温度效应(c)对BfFucH的酶活性的金属离子效应。
图3.展示Rituxan的BfFucH处理的时间过程。
具体实施方式
在Fc聚糖中不存在核心岩藻糖残基已知会实质上增加IgG的ADCC活性,此乃因非岩藻糖基化抗体以显著增加的亲和力结合至FcgRIIIα受体。为改良FcgRIIIα结合及ADCC,已研发若干策略来减小IgG的岩藻糖基化,包含研发的废除或减小α-(1,6)岩藻糖基转移酶的表达程度的细胞系产生。减小岩藻糖基化的替代策略包含使用RNAi使α-(1,6)岩藻糖基转移酶基因沉默。然而,N-聚糖的核心去岩藻糖基化不能在活体外以酶方式达成,此主要系由于N-聚糖埋入两个Fc结构域之间。酶去岩藻糖基化效率因空间阻碍(亦即,α-岩藻糖苷酶至岩藻糖残基的接近由Fc结构域的位置阻断)而极低。
业内已知诸多α-岩藻糖苷酶。实例包含来自角蝾螺(Turbo cornutus)、白法螺(Charonia lampas)、类炭疽杆菌(Bacillus fulminans)、黑曲霉(Aspergillus niger)、产气荚膜梭菌(Clostridium perfringens)、牛肾(Glyko)、鸡肝的α-岩藻糖苷酶(Tyagarajan等人,1996,Glycobiology 6:83-93)及来自木薯单孢萎蔫病(Xanthomonas manihotis)的α-岩藻糖苷酶II(Glyko,PROzyme)。一些岩藻糖苷酶亦市面有售(尤其系Glyko,Novato,Calif.;PROzyme,San Leandro,Calif.;Calbiochem-Novabiochem公司,San Diego,Calif.)。这些α-岩藻糖苷酶不能有效裂解自N-连接聚糖的核心岩藻糖且糖蛋白并不首先变性。
WO 2013/12066揭示通过来自牛肾的α-岩藻糖苷酶对(Fucαl,6)GlcNAc-利妥昔单抗实施去岩藻糖基化。如WO 2013/12066中所阐述,将(Fucαl,6)GlcNAc-利妥昔单抗的反应混合物与来自牛肾的α-岩藻糖苷酶(自Prozyme购得)在37℃下一起培育20天以完全去除(Fucαl,6)GlcNAc-利妥昔单抗中的岩藻糖。业内已知免疫球蛋白的热不稳定性(Vermeer等人,Biophys J.Jan 78:394-404(2000))。Fab片段对热处理最敏感,而Fc片段对降低的pH最敏感。预计在延长热处理(例如在37℃下20天)之后,抗体显著损失对CD20的结合亲和力,如WO 2013/12066中所阐述。
当前已知α-岩藻糖苷酶的局限性已妨碍某些N-连接聚糖的有效处理。因此,仍需要适于Fc糖改造用于研发人类治疗剂的Fc融合蛋白或抗体的新α-岩藻糖苷酶。
本揭示内容系关于能够有效裂解来自N-连接聚糖的核心岩藻糖的细菌α-岩藻糖苷酶的意外发现。
本揭示内容系关于能够有效裂解来自N-连接聚糖的核心岩藻糖的细菌α-岩藻糖苷酶的意外发现。
在一些实例中,α-岩藻糖苷酶可为来自脆弱类杆菌(Bacteroides fragilis)的α-岩藻糖苷酶(BfFucH)。在一些实例中,α-岩藻糖苷酶可为来自多形类杆菌(Bacteroides thetaiotaomicron)的α-岩藻糖苷酶(BtFucH)。可自细菌、酵母、杆状病毒/昆虫或哺乳动物细胞表达α-岩藻糖苷酶。在一些实施例中,α-岩藻糖苷酶可为重组类杆菌属α-岩藻糖苷酶。在一些实施例中,α-岩藻糖苷酶可为自大肠杆菌(E.coli)表达的重组类杆菌属α-岩藻糖苷酶。
α-岩藻糖苷酶可水解一或多种α(1,2)、α(1,3)、α(1,4)及α(1,6)-连接岩藻糖。岩藻糖可存在于糖偶联物中的N-及/或O-连接聚糖中。岩藻糖可为核心α-(1,3)岩藻糖或核心α-(1,6)岩藻糖。
反应图1展示各种含岩藻糖糖偶联物。
适用于酶的受质的实例包含但不限于乳寡糖、癌症相关性碳水化合物抗原(例如Globo H)、刘易斯血型(a、b、x、y)及唾液酸基刘易斯a(SLea)及x(SLex)。与业内已知报导不同,α-岩藻糖苷酶可水解唾液酸基刘易斯a(SLea)及x(SLex)且并不裂解末端唾液酸。乳寡糖可具有α-(1,2)、α-(1,3)及/或α-(1,4)连接岩藻糖。
组合物
本发明亦系关于上文所阐述α-岩藻糖苷酶的组合物。α-岩藻糖苷酶包括与SEQ ID NO:1具有至少85%序列一致性的多肽。在一些实施例中,α-岩藻糖苷酶包括与SEQ ID NO:1有至少88%一致性的多肽具或其功能变体。在一些实施例中,α-岩藻糖苷酶包括具有SEQ ID NO:1的氨基酸序列的多肽。在一些实施例中,α-岩藻糖苷酶包括具有SEQ ID NO:2的氨基酸序列的多肽。SEQ ID NO:2与SEQ ID NO:1具有88%序列一致性。
如本文所阐述的变体多肽系彼等氨基酸序列自SEQ ID NO:1或2中的氨基酸序列有所变化者,但与包括具有SEQ ID NO:1或2的氨基酸序列的多肽的酶展现相同或类似功能。
如本文中所使用,关于序列的序列一致性百分比(%)定义为在比对序列且引入间隙(若需要)以达成最大百分比序列之后,候选多肽序列中与参考多肽序列中的氨基酸残基相同的氨基酸残基的一致性百分比。出于确定序列一致性百分比的目的,比对可以熟习此项技术者所熟知的多种方式来达成,例如使用可公开获得的计算机软件,例如BLAST、ALIGN或Megalign(DNASTAR)软件。彼等熟习此项技术者可测定用于量测比对的适当参数,包含在所比较序列的全长范围内达成最大比对所需要的任何算法。
应理解,本发明的α-岩藻糖苷酶的多肽可进行衍生或改质以有助于其分离或纯化。因此,在本发明的一实施例中,通过添加能够直接及特异性结合分离构件的配体来衍生或改质用于本发明的多肽。另一选择为,通过添加结合对的一个成员来衍生或改质多肽且分离构件包括通过添加结合对的另一成员来衍生或改质的试剂。可使用任何适宜结合对。在通过添加结合对的一个成员来衍生或改质用于本发明的多肽的一优选实施例中,多肽优选地加组胺酸卷标或加生物素卷标。通常,在基因层面上包含组胺酸或生物素卷标的氨基酸编码序列且蛋白质重组表达于大肠杆菌中。组胺酸或生物素标签通常存在于多肽的一端(在N-末端或C-末端处)。组胺酸标签通常系由6个组胺酸残基组成,但其可长于此长度(通常长达7、8、9、10或20个氨基酸)或较短(例如5、4、3、2或1个氨基酸)。另外,组胺酸标签可含有一或多种氨基酸取代、优选地如上文所定义的保守取代。
组合物应用
本发明组合物可用于活体外对糖偶联物进行去岩藻糖基化。本发明方法包括使糖偶联物与上文所述本发明的α-岩藻糖苷酶接触的步骤。糖偶联物包括一或多种选自α-(1,2)、α-(1,3)、α-(1,4)及α-(1,6)-连接岩藻糖的岩藻糖。岩藻糖可存在于糖偶联物中的N-及/或O-连接聚糖中。
在一些实施例中,糖偶联物系糖蛋白。在一些实施例中,糖蛋白包括核心岩藻糖。在一些实施例中,核心岩藻糖系核心α-(1,3)-连接岩藻糖或核心α-(1,6)连接岩藻糖。
在一些实施例中,所述方法进一步包括使糖偶联物与至少一种糖苷酶接触。在某些实施例中,糖苷酶系糖苷内切酶。使用糖苷内切酶剪掉N-聚糖中的寡糖的可变部分。本文所使用的糖苷内切酶的实例包含(但不限于)内-β-N-乙酰基胺基葡萄糖苷酶(NAG)、EndoA、EndoF1、EndoF2、EndoF3、EndoH、EndoM、EndoS及其变体。
对于核心去岩藻糖基化而言,可使用糖苷内切酶及α-岩藻糖苷酶依序或同时处理糖偶联物。核心去岩藻糖基化可为核心α(1,3)去岩藻糖基化或α(1,6)去岩藻糖基化。
本发明方法可用于自单株抗体进行Fc糖改造。改造的实例性方法阐述于例如Wong等人USSN12/959,351中,其内容以引用方式并入本文中。优选地,单株抗体系治疗性单株抗体。在一些实例中,制备均质糖基化单株抗体的方法包括以下步骤:(a)使单株抗体与α-岩藻糖苷酶及至少一种糖苷内切酶接触,由此得到具有单一N-乙酰基葡糖胺(GlcNAc)的去岩藻糖基化抗体,及(b)在适宜条件下向GlcNAc中添加碳水化合物部分。在某些实施例中,可通过使用Endo-GlcNAC酶及实例性岩藻糖苷酶,然后使用实例性Endo-S突变体及聚糖恶唑啉处理来制备聚糖。
在一个特定实例中,本发明方法的单株抗体系利妥昔单抗(Rituximab)。在某些实施例中,本发明方法的碳水化合物部分系选自由以下组成的群:Sia2(α2-6)Gal2GlcNAc2Man3GlcNAc、Sia2(α2-6)Gal2GlcNAc3Man3GlcNAc、Sia2(α2-3)Gal2GlcNAc2Man3GlcNAc、Sia2(α2-3)Gal2GlcNAc3Man3GlcNAc、Sia2(α2-3/α2-6)Gal2GlcNAc2Man3GlcNAc、Sia2(α2-6/α2-3)Gal2GlcNAc2Man3GlcNAc、Sia2(α2-3/α2-6)Gal2GlcNAc3Man3GlcNAc、Sia2(α2-6/α2-3)Gal2GlcNAc3Man3GlcNAc、Sia(α2-6)Gal2GlcNAc2Man3GlcNAc、Sia(α2-3)Gal2GlcNAc2Man3GlcNAc、Sia(α2-6)Gal2GlcNAc3Man3GlcNAc、Sia(α2-3)Gal2GlcNAc3Man3GlcNAc、Sia(α2-6)GalGlcNAc2Man3GlcNAc、Sia(α2-3)GalGlcNAc2Man3GlcNAc、Sia(α2-6)GalGlcNAc3Man3GlcNAc、Sia(α2-3)GalGlcNAc3Man3GlcNAc、Gal2GlcNAc2Man3GlcNAc及Gal2GlcNAc3Man3GlcNAc。
在一些实施例中,碳水化合物部分系糖恶唑啉。
本发明方法中的步骤(b)可引起糖链延伸。糖链延伸的一种方法系经由酶催化糖基化反应。业内众所周知,使用糖恶唑啉作为酶催化糖基化反应中的糖供体进行糖基化可用于合成寡糖,此乃因糖基化反应系加成反应且其进行并不伴随酸、水或诸如此类的任何消除。(Fujita等人,Biochim.Biophys.Acta 2001,1528,9-14)
步骤(b)中的适宜条件包含将反应混合物培育至少20分钟、30分钟、40分钟、50分钟、60分钟、70分钟、80分钟、90分钟或100分钟、优选地小于60分钟。培育优选地发生于室温下、更佳地在大约20℃、25℃、30℃、35℃、40℃或45℃下及最佳地在大约37℃下。
如本文中所使用,术语「岩藻糖」及「L-岩藻糖」可互换使用。
如本文中所使用,术语「核心岩藻糖」及「核心岩藻糖残基」可互换使用且系指在α1,3-位或α1,6-位连接至天门冬酰胺酸结合的N-乙酰基葡糖胺的岩藻糖。
如本文中所使用,术语「α-(1,2)岩藻糖苷酶」系指特异性催化来自寡糖的α-(1,2)连接L-岩藻糖残基的水解的糖苷外切酶。
如本文中所使用,术语「α-(1.4)岩藻糖苷酶」系指特异性催化来自寡糖的α-(1.4)连接L-岩藻糖残基的水解的糖苷外切酶。
如本文中所使用,术语「聚糖」系指多糖、寡糖或单糖。聚糖可为糖残基的单体或聚合物且可为直链或具支链。聚糖可包含天然糖残基(例如葡萄糖、N-乙酰基葡糖胺、N-乙酰基神经胺酸、半乳糖、甘露糖、岩藻糖、己糖、阿拉伯糖、核糖、木糖等)及/或改质糖(例如2′-氟核糖、2′-脱氧核糖、磷酸甘露糖、6′硫N-乙酰基葡糖胺等)。
如本文中所使用,术语「N-聚糖」、「N-连接聚糖」、「N-连接糖基化」、「Fc聚糖」及「Fc糖基化」可互换使用且系指由连接至含Fc多肽中天门冬酰胺残基的酰胺氮的N-乙酰基葡糖胺(GlcNAc)附接的N-连接寡糖。术语「含Fc多肽」系指包括Fc区的多肽(例如抗体)。
如本文中所使用,术语「糖基化模式」及「糖基化特征」可互换使用且系指以酶方式或以化学方式自糖蛋白或抗体释放且然后(例如)使用LC-HPLC或MALDI-TOF MS及诸如此类分析碳水化合物结构的N-聚糖物质的特征性「指纹」。例如参见Curren Analytical Chemistry,第1卷,第1期(2005),第28-57页中的综述;其全部内容以引用方式并入本文中。
如本文中所使用,术语「糖改造Fc」在本文中使用时系指捣c区上的N-聚糖以酶方式或以化学方式发生改变或改造。本文所用的术语「Fc糖改造」系指用于制备糖改造Fc的酶或化学制程。
在Fc区糖基化特征背景中的术语「均质」、「均匀」、「均匀地」及「均质性」可互换使用且欲指由一种期望N-聚糖物质代表的单一糖基化模式,其中并无痕量前体N-聚糖。
如本文中所使用,术语「IgG」、「IgG分子」、「单株抗体」、「免疫球蛋白」及「免疫球蛋白分子」可互换使用。
如本文中所使用,本文所用的术语「糖偶联物」涵盖至少一种个部分共价连接至至少一个另一部分的所有分子。所述术语具体涵盖具有共价附接糖部分的所有生物分子,包含(例如)N-连接糖蛋白、O-连接糖蛋白、糖脂、蛋白聚糖等。
如本文中所使用,术语「糖脂」系指含有一或多个共价连接糖部分(亦即聚糖)的脂质。糖部分可呈单糖、二糖、寡糖及/或多糖的形式。糖部分可包括糖残基的单一无支链链或可包括一或多种具支链。在某些实施例中,糖部分可包含硫酸根基及/或磷酸根基。在某些实施例中,糖蛋白含有O-连接糖部分;在某些实施例中,糖蛋白含有N-连接糖部分。
如本文中所使用,术语「糖蛋白」系指包含一或多种共价附接至其上的寡糖链(例如聚糖)的氨基酸序列。实例性氨基酸序列包含多肽、多肽及蛋白质。实例性糖蛋白包含糖基化抗体及抗体样分子(例如Fc融合蛋白)。实例性抗体包含单株抗体及/或其片段、多株抗体及/或其片段及含有Fc结构域的融合蛋白(例如含有IgGl的Fc区的融合蛋白或其糖基化部分)。
如本文中所使用,术语「N-聚糖」系指自糖偶联物释放但先前经由氮链接连接至糖偶联物的糖聚合物(参见下文N-连接聚糖的定义)。
如本文中所使用,术语「O-聚糖」系指自糖偶联物释放但先前经由氧链接连接至糖偶联物的糖聚合物(参见下文O-连接聚糖的定义)。
如本文中所使用,野生型酶的功能变体与野生型对等部分拥有相同酶活性且通常共有高氨基酸序列同源性(例如与野生型对等部分的氨基酸序列至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%一致)。使用Karlin及Altschul Proc.Natl.Acad.Sci.USA 87:2264-68,1990的算法(如Karlin及Altschul Proc.Natl.Acad.Sci.USA 90:5873-77,1993中所修改)测定两个氨基酸序列的「一致性百分比」。此一算法纳入Altschul等人,J.Mol.Biol.215:403-10,1990的NBLAST及XBLAST程序(2.0版)中。可使用XBLAST程序(评分=50,字长=3)实施BLAST蛋白质搜索以获得与所关注蛋白质分子同源的氨基酸序列。在两个序列的间存在间隙的情形下,可利用Gapped BLAST,如Altschul等人,Nucleic Acids Res.25(17):3389-3402,1997中所阐述。在利用BLAST及Gapped BLAST程序时,可使用各别程序(例如XBLAST及NBLAST)的缺设参数。功能变体可具有各种突变,包含一或多种氨基酸残基的添加、缺失或取代。此一变体通常在对于野生型酶的酶活性并不至关重要的区中含有突变且在功能结构域中可不含突变或仅含有y保守氨基酸取代。熟习此项技术者应认识到,可在硫辛酸连接酶突变体中进行保守氨基酸取代以提供功能等效变体,亦即这些变体保留特定硫辛酸连接酶突变体的功能能力。
如本文中所使用,「保守氨基酸取代」系指并不改变进行氨基酸取代的蛋白质中的相对电荷或大小特性的氨基酸取代。可根据熟习此项技术者已知的改变多肽序列的方法来制备变体,诸如发现于编辑这些方法的参考文献中者:例如Molecular Cloning:A Laboratory Manual,J.Sambrook等人编,第二版,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,New York,1989或Current Protocols in Molecular Biology,F.M.Ausubel等人编,John Wiley&Sons,Inc.,New York。氨基酸的保守取代包含在下列群组内的氨基酸中进行的取代:(a)M、I、L、V;(b)F、Y、W;(c)K、R、H;(d)A、G;(e)S、T;(f)Q、N;及(g)E、D。可经由常规技术制备涉及去糖基化系统的任一酶。在一个实例中,自天然来源分离酶。在其他实例中,通过常规重组技术制备酶。在需要时,可基于用于产生酶的宿主细胞对靶酶的编码序列实施密码子优化。举例而言,在使用大肠杆菌细胞作为经由重组技术产生酶的宿主时,可修改编码所述酶的基因,使其含有大肠杆菌中常用的密码子。本发明的一或多个实施例的详细内容陈述于下文说明中。由下列图式及若干实施例的详细说明及亦由随附申请专利范围,本发明的其他特征或优点将显而易见。
本发明包含下列实例以证明本发明的优选实施例。熟习此项技术者应了解,下列实例中揭示的技术代表本发明人发现在实践本发明中运行良好的技术,且因此可认为构成其实践的优选方式。然而,熟习此项技术者由本揭示应了解,在不背离本发明的精神及范围下,所揭示特定实施例中可作多种改变且仍获得相同或类似结果。
实例
实例1:蛋白质表达构筑体
通过PCR分别自脆弱类杆菌NCTC 9343基因组DNA(ATCC 25285)及多形类杆菌VPI-5482(ATCC 29148)扩增α-岩藻糖苷酶,且选殖至pET47b+(EMD Biosciences,San Diego,CA)(具有N端聚组胺酸(poly-histine)(具有内部AcTEV蛋白酶切割位点)。将研究中所使用的其他酶(例如Endo F1(基因库(GenBank):AAA24922.1)、Endo F2(基因库:AAA24923.1)、Endo F3(基因库:AAA24924.1)、Endo H(基因库:AAA26738.1)及PNGase F(基因库:J05449.1))针对大肠杆菌实施密码子优化,且分别选殖至pET28a(N端具有MBP融合)。所有纯系序列首先通过Applied Biosystems 3730DNA分析仪证实。
用于大肠杆菌中的蛋白质表达构筑体的通过列示于下表中。
a用于扩增每一基因的编码序列的正向(F)及反向(R)PCR反应的通过对。
b粗体下划线意指限制性酶识别位点。
c用于大肠杆菌的密码子优化。例如参见Puigbò等人,Nucleic Acids Research(2007)35(S2):W126-W130。
蛋白质表达及纯化
使用0.2mM异丙基β-D-半乳糖硫吡喃糖苷(IPTG)在16℃经24小时将蛋白质表达构筑体转变成用于蛋白质表达的BL21(DE3)(EMD Biosciences,San Diego,CA)。通过微射流机破裂细胞且然后离心。收集上清液且载于Ni-NTA琼脂糖管柱(QIAGEN GmbH,Hilden,Germany)上并使用10倍洗涤缓冲剂(磷酸钠缓冲剂(pH 7.0)、300mM氯化钠及10mM咪唑)洗涤。通过两倍洗脱缓冲剂(磷酸钠缓冲剂(pH 7.0)、300mM氯化钠及250mM咪唑)来采用洗脱,随后通过Amicon Ultra-15 10K(EMD Millipore Chemicals,Billerica,MA)将缓冲剂更换成反应缓冲剂。通过SDS-PAGE检验蛋白质纯度且通过蛋白质分析套组(Invitrogen,Carlsbad,CA)量测定量蛋白质浓度。对重组岩藻糖苷酶加his标签,随后实施Ni-NTA管柱纯化以得到60mg/L的产量且纯度大于95%。根据Brandford方法(Protein Assay;Bio-Rad,Hercules,CA,USA)使用牛血清白蛋白作为标准测定蛋白质浓度。通过SDS-PAGE检验酶的纯度及分子质量。
来自脆弱类杆菌的经纯化岩藻糖苷酶在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中展现约50kDa的分子质量,此接近于47.3kDa的理论分子量。
实例2:酶分析
酶特性
不同于来自哺乳动物或细菌的岩藻糖苷酶(其在酸条件(pH 4.0-6.0)下具有最佳pH),BfFucH在温和条件(pH 7.0-7.5)下实施良好。此外,BfFucH不受某些二价金属离子影响,且外源性添加金属离子并不影响活性。然而,Ni2+可显著减小酶活性60%。另外,Zn2+及Cu2+可完全废除酶活性。螯合剂EDTA展示对酶活性并无效应,从而指示金属离子并不参与催化反应。酶在室温及4℃下具有功能活性且较为稳定。
对N-连接聚糖的酶活性
可使用本文所阐述的岩藻糖苷酶测定N-聚糖中的岩藻糖位置。评估具有附接于不同位置处的各种岩藻糖的N-聚糖的BfFucH水解活性。制备两种合成糖肽0800F及0823F。两种糖肽具有分别在糖基化位点处结合至外GlcNAc及最内GlcNAc的岩藻糖。
酶分析揭示,岩藻糖可仅自试样0800F中的外GlcNAc释放,但在岩藻糖结合至最内GlcNAc的糖肽0823F中并不如此。此结果指示,N-聚糖中G0结构的空间阻碍可屏蔽且保护岩藻糖免受岩藻糖苷酶水解。与之相反,若使用BfFucH及内-β-N-乙酰基乙酰基胺基葡萄糖苷酶(endo M)同时以一锅式反应处理0823F,则可容易地去除核心岩藻糖。此结果指示,可使用α-岩藻糖苷酶辨别岩藻糖结合至聚糖的位置。
对寡糖的酶活性
大肠杆菌菌株的血清型O86、0128及O111的脂多糖(LPS)含有各种单糖,例如Gal、GalNAc及岩藻糖。通过甲醛去氢酶(FDH)偶合分析证实,BfFucH可以剂量依赖性方式自大肠杆菌O128:B12菌株的LPS释放L-岩藻糖。亦测试酶对各种受质(包含2'-岩藻糖基乳糖(2'FL)、3'-岩藻糖基乳糖(3’FL)、乳糖-N-岩藻五糖I(LNPT I)、Globo H、刘易斯a(Lea)、刘易斯x(Lex)、刘易斯b(Leb)、刘易斯y(Ley)、唾液酸基刘易斯a(SLea)、唾液酸基刘易斯x(SLex)及pNP(对-硝基苯酚)-α-L-岩藻糖苷)的酶活性。结果展示,α-岩藻糖苷酶能够水解所有受质。
实例3:糖蛋白的核心去岩藻糖基化
橙黄网胞盘菌(Aleuria aurantia)拥有广泛用作岩藻糖的特异性探针的岩藻糖特异性凝集素(AAL)。AAL识别且特异性结合至复合寡糖及糖偶联物的岩藻糖及末端岩藻糖残基。可使用AAL测定核心去岩藻糖基化。糖苷内切酶可用于修剪N-聚糖中的寡糖的可变部分。在处理糖苷内切酶混合剂(Endo F1、Endo F2、Endo F3及Endo H)的后,抗体(Humira或Rituxan)展示高AAL印迹信号,从而指示在抗体中存在核心岩藻糖。然而,在处理糖苷内切酶混合剂(Endo F1、Endo F2、Endo F3及Endo H)及BfFucH的组合之后,抗体(Humira或Rituxan)因核心岩藻糖水解而损失AAL印迹信号。这些结果显示,BfFucH对于核心去岩藻糖基化较为活跃。
材料及方法
除非另外陈述,否则自Sigma-Aldrich或Merck购买所有化合物及试剂。自(North Chicago,IL)购买抗肿瘤坏死因子-α(TNFα)抗体阿达木单抗(Adalimumab)自Genentech公司(South San Francisco,CA)/IDEC Pharmaceutical(San Diego,CA)购买抗人类CD20小鼠/人类嵌合IgG1利妥昔单抗自Wyeth Pharmaceuticals(Hampshire,UK)购买TNF受体-Fc融合蛋白Etanercept自Hoffmann-La Roche有限公司(Basel,Switzerland)购买阿法依伯汀(Epoetin beta)自EMD Serono公司(Boston,MA)购买干扰素β1a
自Carbosynth有限公司(Berkshire,UK)购买对-硝基苯基α-或β-单糖、刘易斯糖、血型糖及人类乳寡糖。自Chemicon(EMD Millipore Chemicals,Billerica,MA)购买针对IgG Fc区的一级抗体、及自Vector实验室(Burlingame,CA)购买生物素化橙黄网胞盘菌凝集素(AAL)及HRP-偶联链霉抗生物素。观察蛋白质印迹的化学发光且使用ImageQuant LAS 4000biomolecular成像仪系统进行量化。
BfFucH活性分析方法
在25℃下于50mM pH 7.0磷酸钠缓冲剂中使用pNP-α-L-Fuc(p-硝基苯基-α-L-Fuc)作为受质(作为标准分析条件)来量测酶活性。将α-L-岩藻糖苷酶活性的一个单位定义为在25℃下于50mM pH 7.0磷酸钠缓冲剂中每分钟自pNP-α-L-Fuc形成1μmol pNP及Fuc。自Michaelis-Menten方程式通过非线性回归分析且通过GraphPad Prism v5软件(La Jolla,CA)计算pNP-α-L-Fuc的米氏常数(Michaelis constant)(Km)、周转数(Kcat)及Vmax的值。
BfFucH的最佳pH的活性量测。
在上述标准酶分析中于pH范围4.0-10.0(包含乙酸钠、MES、MOPS、HEPES、Tris-HCl、CHES缓冲剂)中测定岩藻糖苷酶活性的最佳pH。一式三份实施所有反应进行统计学评估。
BfFucH的最佳二价金属离子的活性量测
在标准分析条件中实施金属需求分析。将酶与金属离子(Mg2+、Mn2+、Ca2+、Zn2+、Co2+或Ni2+、Fe2+、Cu2+)以5mM的最终浓度在存在及不存在EDTA下混合。一式三份实施所有反应通过进行统计学评估。
BfFucH的最佳温度的活性量测
通过将足够量的经纯化岩藻糖苷酶与pNP-α-L-Fuc在磷酸钠缓冲剂(pH 7.0)中一起培育来测定温度对酶活性的效应。为保持分析一致,所有组份皆充分混合且在分析温度下预加热10min,且通过添加酶来开始反应且通过多模式板读取器(SpectraMax M5,Molecular Devices)在恒定温度下记录。温度介于4℃至80℃的间。一式三份实施所有反应通过进行统计学评估。
基于岩藻糖去氢酶(FDH)的分析
基于岩藻糖去氢酶的分析自先前报导略有改变。不同于通过Sigma-Aldrich出售的来自假单胞菌属(Pseudomonas sp)的其他岩藻糖去氢酶(其仅在与NADP+反应下具有活性),来自百脉根根瘤菌(Mesorhizobium loti)的重组形式的FDH仅在NAD+下具有功能。通过在使用340nm激发时约450nm下的NADPH荧光且通过多模式板读取器(SpectraMax M5,Molecular Devices)在25℃下量测所形成NADH。通过使用此方法,在5min内量化各种寡糖(例如刘易斯糖及人类乳寡糖(HMO))中的岩藻糖基偶联物。
免疫球蛋白G、Fc-融合蛋白、EPO、干扰素(IFNβ1a)及流感血凝素(HA)的单-GlcNAc或GlcNAc-(Fucα-1,6)的生成
通过反应缓冲剂50mM磷酸钠缓冲剂(pH 7.0)缓冲剂交换所有糖蛋白。首先,添加糖苷内切酶混合剂溶液(包含EndoF1、EndoF2、EndoF3、EndoH及EndoS(1mg/mL))通过去除除结合至糖蛋白的Asn的GlcNAc外的所有N-聚糖链,随后添加适宜量的岩藻糖苷酶。在37℃下培育48小时通过完全去除结合至糖蛋白的GlcNAc的核心-岩藻糖。
- 还没有人留言评论。精彩留言会获得点赞!