表达人EPO的经遗传修饰的非人动物的制作方法
本申请要求2014年5月19日提交的美国临时申请No.62/000,460的权益,通过援引将其公开内容完整收入本文。
发明领域
本发明属于经遗传修饰的非人动物领域。
发明背景
经遗传修饰的小鼠,经修饰和移入的小鼠,及其在人疾病建模中的用途是本领域已知的。然而,迄今为止,生成模拟靶向人类红细胞谱系的细胞的病原体的人感染的经遗传修饰的小鼠很少成功。此类病原体(例如疟原虫,巴贝虫,和泰勒虫属的原生动物)可在人中引起危及生命的疾病。
例如,疟原虫属的原生动物引起疟疾。在2010年,全世界总共106个国家认为是疟疾流行的,估计有33亿人有风险发生该疾病。2010年全世界该疾病的负荷估计为2.16亿例病例及65.5万例估计死亡,其中86%是5岁以下的儿童。当前,用于预防和治疗疟疾的药物和疫苗仍然非常有限。另外,针对常用疟疾治疗剂的寄生虫抗性已经出现且呈现持续挑战。因此迫切需要开发用于控制和治疗靶向人红细胞的病原体的新药物和疫苗。
由于这些病原体中的许多不感染实验室啮齿动物的红血球,体内研究传统上限于由啮齿动物寄生虫伯氏疟原虫(Plasmodium berghei)ANKA引起的疟疾的研究或通过每天注射大量人红细胞而急性移入并通过注射受到寄生虫感染的红血球而重合或随后感染的NOD/SCID,NOD/SCID/IL2rg无效(NSG),或BXN小鼠的研究(Angulo-Barturen et al.(2008)A murine model of falciparum-malaria by in vivo selection of competent strains in non-myelodepleted mice engrafted with human erythrocytes.PLoS One 3:e2252;Jimenez-Diaz et al.(2009)Improved murine model of malaria using Plasmodium falciparum competent strains and non-myelodepleted NOD-scid IL2Rgnull mice engrafted with human erythrocytes.Antimicrob Agents Chemother 53:4533-4536;Badell et al.(2000)Human malaria in immunocompromised mice:an in vivo model to study defense mechanisms against Plasmodium falciparum.JEM 192(11):1653-1660;Moreno et al.(2006)The course of infections and pathology in immunomodulated NOD/LtSz-SCID mice inoculated with Plasmodium falciparum laboratory lines and clinical isolates.Int.J.Parasitol.36:361-369)。为了研究疟原虫和其它病原体对人的影响,及测试疫苗和药物预防感染和治疗受到这些和其它病原体感染的人的功效,具有经过遗传修饰使得对此类病原体感染易感或使得会更好地支持在感染之前急性移植入动物的人红细胞(如传统啮齿动物模型中进行的)的非人动物诸如小鼠会是有用的。
发明概述
提供了自动物基因组表达人EPO的经遗传修饰的非人动物。还提供了用于生成自非人动物基因组表达人EPO的非人动物的方法,及用于使用自非人动物基因组表达人EPO的非人动物的方法。这些动物和方法在本领域中有许多用途,包括例如人红细胞生成和红细胞功能的建模;红细胞的人病原体感染的建模;例如在健康或患病状态,调控红细胞生成和/或红细胞功能的药剂的体内筛选;对红细胞或红细胞祖先有毒性的药剂的体内筛选;预防,减轻,或逆转有毒药剂对红细胞或红细胞祖先的毒性影响的药剂的体内筛选;来自个体的红细胞或红细胞祖先的体内筛选以预测个体对疾病疗法的响应性。
在本发明的一些方面,提供了经遗传修饰的非人动物,其自所述非人动物的基因组表达人EPO。换言之,所述非人动物包含编码人EPO蛋白质的核酸序列。
在一些实施方案中,所述编码人EPO蛋白质的核酸序列与EPO基因启动子可操作连接。在一些实施方案中,所述EPO基因启动子是人EPO启动子。在其它实施方案中,所述EPO启动子是内源,即非人,EPO启动子。在某些此类实施方案中,所述内源EPO启动子在非人动物EPO基因基因座处。换言之,在某些实施方案中,所述编码人EPO蛋白质的核酸序列与非人动物EPO基因座处的非人动物EPO启动子可操作连接的。在一些此类实施方案中,所述可操作连接导致非人EPO基因基因座处的非人EPO基因中的无效突变。
在一些实施方案中,所述主题非人动物对于包含所述编码人EPO蛋白质的核酸序列的等位基因是杂合的。在其它实施方案中,所述非人动物对于包含所述编码人EPO蛋白质的核酸序列的等位基因是纯合的。
在一些实施方案中,所述编码人EPO蛋白质的核酸序列包含人EPO基因组编码和非编码序列。在其它实施方案中,所述编码人EPO蛋白质的核酸序列包含人EPO cDNA序列。
在一些实施方案中,所述主题非人动物表达一种或多种选自下组的别的人蛋白质:由在M-csf启动子控制下的核酸编码的M-CSF蛋白质,由在Il-3启动子控制下的核酸编码的IL-3蛋白质,由在Gm-csf启动子控制下的核酸编码的GM-CSF蛋白质,由在TPO启动子控制下的核酸编码的TPO蛋白质,和由在Sirpa启动子控制下的核酸编码的Sirpa蛋白质。在一些此类实施方案中,所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且所述非人动物对于所述非人基因是杂合无效的。在其它实施方案中,所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且所述非人动物对于所述非人基因是纯合无效的。在某些实施方案中,所述非人动物表达选自下组的人蛋白质,例如人源化蛋白质:人TPO,例如人源化TPO;人IL-3,例如人源化IL-3:人GM-CSF,例如人源化GM-CSF:人EPO,例如人源化EPO;和人Sirpa,例如人源化Sirpa;和其组合。
在一些实施方案中,主题经遗传修饰的非人动物是具有如下基因组的小鼠,所述基因组包含编码人蛋白质,例如人源化蛋白质的核酸序列,例如编码人EPO,例如人源化EPO;人Sirpa,例如人源化Sirpa;人IL-3,例如人源化IL-3;人GM-CSF,例如人源化GM-CSF;人M-CSF,例如人源化M-CSF;人TPO,例如人源化TPO;人IL-6,例如人源化IL-6;等的核酸,其分别与它的相应的非人动物启动子可操作连接,例如Sirpa,IL-3,GM-CSF,M-CSF,TPO,或IL-6启动子,其中所述动物表达所编码的人蛋白质和天然小鼠蛋白质。在其它实施方案中,主题经遗传修饰的非人动物是具有如下基因组的小鼠,所述基因组包含编码人蛋白质,例如人源化蛋白质的核酸序列,例如编码人EPO,例如人源化EPO;人Sirpa,例如人源化Sirpa;人IL-3,例如人源化IL-3;人GM-CSF,例如人源化GM-CSF;人M-CSF,例如人源化M-CSF;人TPO,例如人源化TPO的核酸,其分别与它的相应的非人动物启动子可操作连接,例如Sirpa,IL-3,GM-CSF,M-CSF,或TPO启动子,其中所述动物表达所编码的人蛋白质且不表达天然小鼠蛋白质。如此,在一些实施方案中,所述经遗传修饰的非人动物是小鼠且所述小鼠对于本文中公开的人基因,例如人源化基因中的一些或全部是杂合的。在一些实施方案中,所述经遗传修饰的非人动物是小鼠且所述小鼠对于本文中公开的人基因,例如人源化基因中的一些或全部是纯合的。
在一些实施方案中,主题非人动物对于内源免疫系统是免疫缺陷。在一些此类实施方案中,所述免疫缺陷是由Rag2和IL2rg之一或二者的缺陷引起的。
在一些实施方案中,主题经遗传修饰的免疫缺陷非人动物进一步包含人造血细胞的移入。在一些此类实施方案中,所述人造血细胞包含一种或多种选自下组的细胞:人CD34阳性细胞,人造血干细胞,人髓样细胞前体细胞,人类红细胞前体细胞,人髓样细胞,人树突细胞,人单核细胞,人粒细胞,人红细胞,人嗜中性粒细胞,人肥大细胞,人胸腺细胞,和人B淋巴细胞。
如本文中的实施例中证明的,包含与内源基因座处的EPO启动子可操作连接的编码人EPO蛋白质的核酸序列的移入有人造血细胞的经遗传修饰的免疫缺陷非人动物展现高水平的骨髓中的人红细胞生成和与不表达人EPO的对照小鼠相比骨髓中类红细胞谱系的人细胞的2至5倍升高。在一些实施方案中,包含与内源基因座处的EPO启动子可操作连接的编码人EPO蛋白质的核酸序列的移入有人造血细胞的经遗传修饰的免疫缺陷非人动物展现高水平的骨髓中的人红细胞生成和与不表达人EPO的对照小鼠相比骨髓中类红细胞谱系的人细胞的约2至约10倍升高,例如与不表达人EPO的对照小鼠相比骨髓中类红细胞谱系的人细胞的约2倍,约3倍,约4倍,约5倍,约6倍,约7倍,约8倍,约9倍,或约10倍升高。照此,在一些实施方案中,主题经移入的,经遗传修饰的免疫缺陷动物包含如下的骨髓,其中20%或更多的类红细胞(CD235+)是人类红细胞。在一些实施方案中,主题经移入的,经遗传修饰的免疫缺陷动物包含如下的骨髓,其中约10%或更多,例如约20%或更多,约30%或更多,约40%或更多,或约50%或更多的类红细胞(CD235+)是人类红细胞。
在一些此类实施方案中,主题经遗传修饰的动物是免疫缺陷小鼠,其包含与非人动物EPO基因座处的非人动物EPO启动子可操作连接的编码人EPO蛋白质的核酸,与非人动物TPO基因座处的非人动物TPO启动子可操作连接的编码人TPO蛋白质的核酸,与非人动物Il-3基因座处的非人动物Il-3启动子可操作连接的编码人Il-3蛋白质的核酸,与非人动物GM-CSF基因座处的GM-CSF启动子可操作连接的编码人GM-CSF蛋白质的核酸,和与非人动物M-CSF基因座处的非人动物M-CSF启动子可操作连接的编码人M-CSF蛋白质的核酸,例如Rag2-/-IL2rgy/-Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/h(“MITER-G”)小鼠。
在一些此类实施方案中,主题经遗传修饰的动物是免疫缺陷小鼠,其包含与非人动物EPO基因座处的非人动物EPO启动子可操作连接的编码人EPO蛋白质的核酸,与非人动物TPO基因座处的非人动物TPO启动子可操作连接的编码人TPO蛋白质的核酸,与非人动物Il-3基因座处的非人动物Il-3启动子可操作连接的编码人Il-3蛋白质的核酸,与非人动物GM-CSF基因座处的GM-CSF启动子可操作连接的编码人GM-CSF蛋白质的核酸,和与非人动物M-CSF基因座处的非人动物M-CSF启动子可操作连接的编码人M-CSF蛋白质的核酸,和与随机整合入非人动物基因组的非人动物SIRPa启动子可操作连接的编码人SIRPa蛋白质的核酸,例如Rag2-/-IL2rgy/-Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hhSIRPα+(“MISTER-G”)小鼠。在其它此类实施方案中,编码人SIRPa蛋白质,例如,人源化SIRPa蛋白质的核酸与非人动物基因座处的非人动物SIRPa启动子可操作连接,例如Rag2-/-IL2rgy/-Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hSIRPαh/h(“SupER-G”)小鼠。
在一些此类实施方案中,主题经遗传修饰的动物是免疫缺陷小鼠,其包含与非人动物EPO基因座处的非人动物EPO启动子可操作连接的编码人EPO蛋白质的核酸的一个等位基因(即,所述小鼠对于人EPO是杂合的),与非人动物SIRPa基因座处的非人动物SIRPa启动子可操作连接的编码人SIRPa蛋白质,例如人源化SIRPa蛋白质的核酸,与非人动物TPO基因座处的非人动物TPO启动子可操作连接的编码人TPO蛋白质的核酸,与非人动物Il-3基因座处的非人动物Il-3启动子可操作连接的编码人Il-3蛋白质的核酸,和与非人动物GM-CSF基因座处的GM-CSF启动子可操作连接的编码人GM-CSF蛋白质的核酸,例如Rag2-/-IL2rgy/-Tpoh/hIl3h/hGm-csfh/hEpoh/mSIRPαh/h(“TIES”)小鼠。
在一些实施方案中,当它们包含编码EPO蛋白质的核酸序列的仅一个拷贝时,及当它们包含内源M-csf时,包含与内源基因座处的EPO启动子可操作连接的编码人EPO蛋白质的核酸序列的移入有人造血细胞的经遗传修饰的免疫缺陷非人动物可展现更好的存活和人红细胞移入。这是因为得到敲入中的人M-CSF支持的高水平的人髓样细胞移入导致对小鼠红血球的破坏,这继而引起经移入的小鼠贫血和死亡。另外,人EPO等位基因的杂合性相对于对于人EPO是纯合的且对于小鼠EPO是无效的小鼠改善生育力,发育能力,和存活力。照此,在一些实施方案中,主题经移入的,经遗传修饰的免疫受损的动物相对于组成性表达EPO的小鼠,例如转基因小鼠,或包含两个拷贝的人EPO,例如EPOh/h的小鼠展现改善的存活力。在一些此类实施方案中,所述经遗传修饰的免疫缺陷非人动物是TIES小鼠(Rag2-/-IL2rgy/-Tpoh/hIl3h/hGm-csfh/hEpoh/mSIRPαh/h)。
在一些实施方案中,注射了氯膦酸盐脂质体的移入有人造血细胞的经遗传修饰的免疫缺陷非人动物显示与未注射的动物相比外周血中人类红细胞(CD235+)数目的1000倍升高。在一些实施方案中,注射了氯膦酸盐脂质体的移入有人造血细胞的经遗传修饰的免疫缺陷非人动物显示与未注射的动物相比外周血中人类红细胞(CD235+)数目的约10倍或更大,约50倍或更大,约100倍或更大,约500倍或更大,或约1000倍或更大升高。在这些人类红细胞中,10%或更多,20%或更多,30%或更多,40%或更多,或50%或更多可以是网织红细胞(红细胞前体,CD71+)。照此,在一些实施方案中,主题经移入的,经遗传修饰的免疫缺陷动物包含如下的外周血,其中1%或更多,例如5%或更多或10%或更多的类红细胞(CD235+)是人类红细胞,而且10%或更多,例如20%或更多,30%或更多,40%或更多,或50%或更多的那些人类红细胞是人网织红细胞(CD71+)。在一些此类实施方案中,主题经移入的,经遗传修饰的免疫缺陷非人动物是MISTER-G小鼠,SupER-G小鼠,或TIES小鼠。
在一些实施方案中,所述非人动物进一步包含靶向类红细胞谱系的人细胞的病原体感染。在一些此类实施方案中,所述病原体选自疟原虫(Plasmodium sp.),巴贝虫(Babesia sp.),和泰勒虫(Theileri sp.)。在一些实施方案中,所述感染是通过将寄生虫注射入非人动物而产生的。在一些实施方案中,所述感染是通过将受到寄生虫感染的人类红细胞注射入非人动物而产生的。在一些实施方案中,所述感染是通过将受到寄生虫感染的人类红细胞和健康人类红细胞注射入非人动物而产生的。
在本发明的一些方面,提供了用于鉴定抑制靶向类红细胞谱系的人细胞的病原体感染的药剂的方法。
在一些实施方案中,所述方法包括对经遗传修饰的非人动物施用候选药剂,其中所述动物包含与EPO基因启动子可操作连接的编码人EPO蛋白质的核酸序列,一种或多种在所述非人动物中导致免疫缺陷的基因突变,人造血细胞的移入,和靶向类红细胞谱系的人细胞的病原体的感染;并测定该药剂是否降低病原体感染的非人动物中所述病原体的量。
在一些实施方案中,所述方法包括使包含与EPO基因启动子可操作连接的编码人EPO蛋白质的核酸序列的移入有人造血细胞的,经遗传修饰的免疫缺陷非人动物与氯膦酸盐接触;对接触了氯膦酸盐的非人动物的施用候选药剂;对所述经遗传修饰的非人动物注射受到寄生虫感染的网织红细胞或红细胞;并测定该药剂是否预防所述非人动物的人网织红细胞和/或红细胞感染。
在一些实施方案中,所述病原体选自疟原虫,巴贝虫,和泰勒虫。在一些此类实施方案中,所述病原体选自镰状疟原虫(P.falciparum)和间日疟原虫(P.vivax)。在一些实施方案中,所述非人动物是哺乳动物。在一些此类实施方案中,所述哺乳动物是啮齿动物。在某些此类实施方案中,所述啮齿动物是小鼠。
在本发明的一些方面,提供了用于生成表达人EPO的小鼠的方法。在一些实施方案中,所述方法包括使小鼠多能干细胞与包含与EPO启动子序列可操作连接的人EPO蛋白质或其片段的编码序列的核酸序列接触,其中所述编码序列和EPO启动子序列形成侧翼为与内源小鼠EPO基因座同源的序列的盒;在促进该核酸序列通过同源重组在内源小鼠EPO基因座处整合入小鼠基因组的条件下培养该多能干细胞;并自包含编码人EPO蛋白质的核酸序列的小鼠多能干细胞生成小鼠。
在一些实施方案中,所述小鼠多能干细胞是胚胎干(ES)细胞或诱导的多能干(iPS)细胞。在一些实施方案中,所述小鼠多能干细胞对于Rag2和/或IL2rg是缺陷的。在一些实施方案中,所述EPO启动子序列是人EPO启动子的序列。在其它实施方案中,所述EPO启动子序列是内源非人EPO启动子的序列。在一些实施方案中,所述整合导致非人EPO基因基因座处的非人EPO基因的置换。在一些实施方案中,所述编码人EPO蛋白质的核酸序列包含人EPO基因组编码和非编码序列。在一些实施方案中,所述编码人EPO蛋白质的核酸序列包含人EPO cDNA序列。
在本发明的一些方面,提供了用于生成表达人EPO蛋白质且包含人造血系统的小鼠的方法。在一些实施方案中,所述方法包括将包含人造血祖细胞的细胞群体移植入通过本公开内容的方法生成的经遗传修饰的免疫缺陷小鼠。在一些实施方案中,所述移植包含尾静脉注射,胎肝注射,或眶后注射。在一些实施方案中,所述经遗传修饰的免疫缺陷小鼠在移植之前经过亚致死照射。在一些实施方案中,所移植的人造血祖细胞是CD34+细胞。在一些实施方案中,所述人造血祖细胞来自胎肝,成人骨髓,或脐带血。
在本发明的一些方面,提供了用于生成受到靶向类红细胞谱系的人细胞的人病原体感染的小鼠的方法。在一些实施方案中,所述方法包括依照本公开内容的方法生成表达人EPO蛋白质且包含人造血系统的小鼠,对经移入的小鼠注射氯膦酸盐,并对注射了氯膦酸盐的小鼠注射受到寄生虫感染的人红血球(PRBC)。在一些实施方案中,所述方法进一步包括将健康人红血球注射入所述小鼠。在一些实施方案中,所述寄生虫选自疟原虫,巴贝虫,和泰勒虫。在某些实施方案中,所述疟原虫选自镰状疟原虫和间日疟原虫。
附图简述
在结合附图阅读时自以下详细描述最好地理解本发明。应当强调,依照惯例,附图的各个特征不是按比例的。相反,为了清楚,各个特征的尺寸是任意扩大或缩小的。附图中包括下述图。
图1提供小鼠EPO(SEQ ID NO:2)与人EPO(SEQ ID NO:4)的蛋白质比对。标有下划线的残基是在这两种物种之间保守的残基。
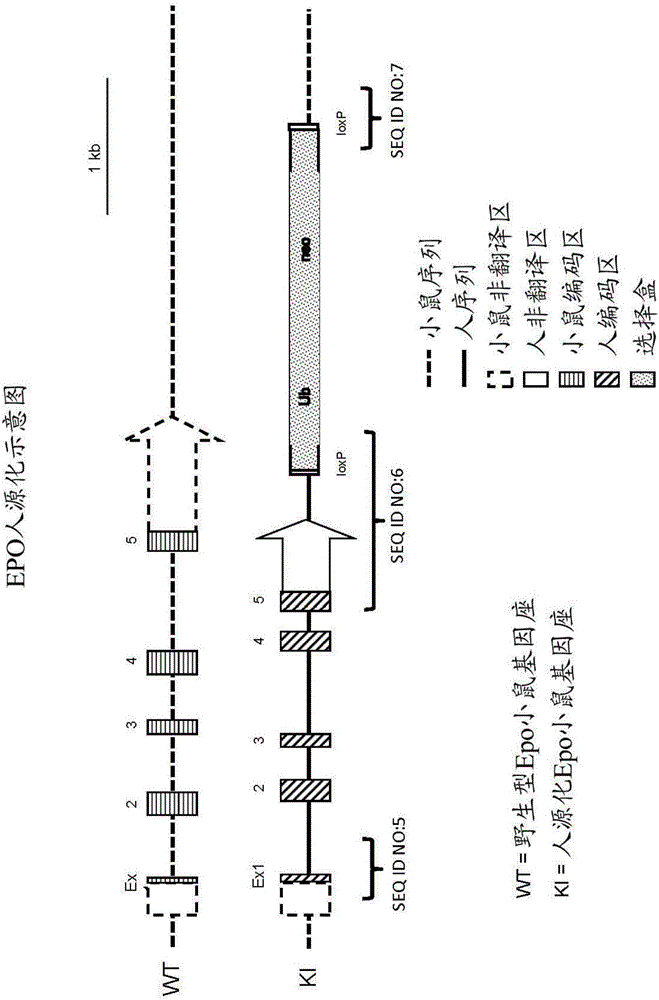
图2提供敲入编码人EPO的核酸序列之前和之后的野生型小鼠EPO基因座的示意图。
图3提供人EPO敲入等位基因的示意图。
图4提供敲入编码人源化Sirpa的核酸序列之前(上)和之后(下)的野生型小鼠Sirpa基因座的示意图。
图5,小图A和B,显示HSC移入的小鼠中人类红细胞的频率。(小图A)HSC移入包含自小鼠EPO基因座表达的人EPO(“hEPO+”)和/或作为小鼠基因组中的随机整合物表达的人SIRPa(“hSIRPa+”)所示组合的Rag2-/-Il2rg-/-Tpoh/hIL3h/hGmcsfh/hMcsfh/h小鼠(“MITRG小鼠”)之后6-8周骨髓中的人CD235a+红细胞移入。(小图B)在hEPO存在较之缺失下HSC移入的Rag2-/-I12rg无效Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hSIRPαh/h(“SupER-G”)小鼠较之Rag2-/-Il2rg无效Tpoh/hIl3h/hGmcsfh/hSirpah/h(“RGSKI-TI”)对照小鼠之后6-8周外周血中人CD235a+红细胞的频率。
图6,小图A和B,证明了氯膦酸盐处理增加HSC移入的小鼠中的循环人类红细胞和网织红细胞。在HSC移入之后7周,连续3-5天用每天眶后注射50μl氯膦酸盐脂质体处理SupER-G小鼠。通过FACS测量外周血中人CD235+细胞(红细胞和网织红细胞)(小图A)和CD235+/CD71+细胞(网织红细胞)(小图B)的频率。小图B:用氯膦酸盐处理之后的3只不同小鼠。
图7,小图A-C,图解自经移入的小鼠生成的人RBC如何对镰状疟原虫感染易感。对SupER-G小鼠移入胎肝或成人HSC。移入之后7周,连续3天用每天眶后注射50μl氯膦酸盐脂质体处理小鼠,之后收集血液。然后将血液样品与经过纯化的镰状疟原虫3D7血液阶段寄生虫感染RBC(99%纯度)共培养。感染后48小时将新鲜的人RBC添加入培养物并将感染培养物再维持10天。实施吉姆萨染色和定量PCR以量化寄生虫血症。人RBC对照:人RBC;小鼠RBC对照:来自未移入的小鼠的RBC;小鼠RBC搀混对照:搀混0.1%hRBC的来自未移入的小鼠的RBC。在小图A中,红色:抗人Band3;蓝色:Hoechst。在小图C中,从上到下列出的图例标识符对应于从左到右的条形图x轴。
图8显示在氯膦酸盐缺失下小鼠外周血中人RBC的破坏。用氯膦酸盐或PBS处理未移入的小鼠。对于氯膦酸盐处理,小鼠连续3天接受每天眶后注射50μl氯膦酸盐。对于PBS处理,仅仅在人RBC输注之前1小时投递500μl PBS。将人RBC输注入经过预处理的小鼠并在所示时间点收集外周血。显示了氯膦酸盐和PBS曲线。
发明详述
提供了自动物基因组表达人EPO的经遗传修饰的非人动物。还提供了用于生成自非人动物基因组表达人EPO的非人动物的方法,及用于使用自非人动物基因组表达人EPO的非人动物的方法。这些动物和方法在本领域中有许多用途,包括例如人红细胞生成和红细胞功能的建模;红细胞的人病原体感染的建模;例如在健康或患病状态,调控红细胞生成和/或红细胞功能的药剂的体内筛选;对红细胞或红细胞祖先有毒性的药剂的体内筛选;预防,减轻,或逆转有毒药剂对红细胞或红细胞祖先的毒性影响的药剂的体内筛选;来自个体的红细胞或红细胞祖先的体内筛选以预测个体对疾病疗法的响应性。在阅读下文更加完整描述的组合物和方法的详情后,本发明的这些和其它目的,优点和特征对于本领域技术人员而言会变得显而易见。
在描述本方法和组合物前,应当理解本发明不限于描述的具体方法和组合物,因为其当然可以有所变化。还应当理解,本文中所使用的术语仅为了描述具体的实施方案,而并不意图是限制性的,因为本发明的范围仅会以所附权利要求书为限。本发明不限于所讨论的特定实施方案,而是由授权权利要求来描述。
除非上下文另有明确说明,在提供数值范围的情况中,理解为还具体公开该范围的上限和下限之间的每个居间数值,间隔为下限的单位的十分之一。所述范围中的任何所述数值或居间数值和该所述范围中的任何其它所述或居间数值之间的每个更小范围涵盖在本发明内。该范围中可独立地包括或排除这些更小范围的上限和下限,而且上下限任一,无一或均包括在更小范围中的每个范围也涵盖在本发明内,服从所述范围中任何具体排除的上下限。在所述范围包括上下限之一或二者的情况中,排除上下限之一或二者的范围也包括在本发明中。
除非另有定义,本文中使用的所有技术和科学术语具有与本发明所属领域的普通技术人员的通常理解相同的含义。虽然可以在本发明的实施或测试中使用与本文中描述的方法和材料类似或等同的任何方法和材料,但是现在描述一些潜在和优选的方法和材料。通过提及将本文中提及的所有出版物收入本文以公开及描述引用的出版物有关的方法和/或材料。应当理解,在存在矛盾的情况下,本公开内容替代收录的出版物的任何矛盾公开内容。
如本领域技术人员在阅读本公开内容后会显而易见的,本文中描述并例示的每个单独实施方案具有离散组分和特征,其可以在不偏离本发明范围或精神的前提下容易地与任何其它几个实施方案的特征分开或组合。可以以叙述事件的次序或以逻辑上可能的任何其它次序实施任何叙述的方法。
必须注意到,如本文中及所附权利要求书中使用的,单数形式“一种”,“一个”和“该/所述”包括复数个提及物,除非上下文另有明确指示。如此,例如,提及“细胞”包括多个/种此类细胞,且提及“该/所述肽”包括提及一个/种或多个/种肽及本领域技术人员知道的其等同物,例如多肽,等等。
本文中讨论的出版物仅提供其在本申请提交目前的公开内容。本文中的内容均不应解释为承认凭借在先发明,本发明没有资格早于此类出版物。而且,提供的公开日可能不同于实际的公开日,可能需要独立确认。
经遗传修饰的非人动物
在本发明的一个方面,提供了经过遗传修饰而自它们的基因组表达一种或多种人蛋白质的非人动物。在本发明的一些方面,所述人蛋白质是人促红细胞生成素(hEPO)蛋白质(SEQ ID NO:4)。换言之,所述经遗传修饰的非人动物在它的基因组中包含编码人EPO(hEPO)蛋白质的核酸序列。例如,所述非人动物可以在它的基因组中包含包含人EPO基因组编码和非编码序列的核酸序列,例如染色体7核苷酸100318423-100321323处的序列或其部分。或者,所述非人动物可以在它的基因组中包含包含人EPO cDNA序列(SEQ ID NO:3)或其部分的核酸序列。在一些情况中,所述非人动物经过进一步遗传修饰,从而自所述非人动物的基因组表达一种或多种别的人蛋白质。在一些此类实施方案中,这些一种或多种别的人蛋白质是促进人造血细胞发育和/或功能的人蛋白质,例如人信号调节蛋白α(hSIRPa)蛋白质(NCBI基因ID:140885,GenBank登录号NM_080792.2,NM_001040022.1,NM_001040023.1),人白介素3(hIL-3)蛋白质(NCBI基因ID:3562,GenBank登录号NM_000588.3),人集落刺激因子2(粒细胞-巨噬细胞)(hGM-CSF)蛋白质(NCBI基因ID:1437,GenBank登录号NM_000758.3),人集落刺激因子1(巨噬细胞)(hM-CSF)蛋白质(NCBI基因ID:1435,GenBank登录号NM_000757.5,NM_172210.2,NM 172211.3,和NM_172212.2),人血小板生成素(hTPO)蛋白质(NCBI基因ID:7066,GenBank登录号NM_000460.3,NM_001177597.2,NM_001177598.2,NM_001289997.1,NM_001290003.1,NM_001290022.1,NM_001290026.1,NM_001290027.1,NM_001290027.1),人白介素6(hIL6)蛋白质(NCBI基因ID:3569,GenBank登录号NM_000600.3),等等。
熟练技术人员会领会,在“野生型”或“天然”人核酸和蛋白质外,术语“人核酸”和“人蛋白质”还涵盖野生型人核酸和蛋白质的变体。如本文中使用的,术语“变体”定义人多肽或核酸序列的分离的天然存在遗传突变体或人多肽或核酸序列的重组制备变异,它们与相应的野生型人核酸或多肽序列相比各含有一处或多处突变。例如,此类突变可以是一处或多处氨基酸替代,添加,和/或删除。术语“变体”还包括人同系物和直向同系物。在一些实施方案中,本发明的变体多肽与野生型人多肽具有70%或更高同一性,例如75%,80%,或85%或更高同一性,例如与野生型人多肽具有90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性。
可以使用本领域的任何便利技术(例如比对序列,使用例如公知可得的软件进行)测定两种序列间的百分比同一性。可以使用标准分子生物学技术(诸如定点诱变,PCR介导的诱变,定向进化,等等)来引入突变。本领域技术人员会认识到可以在不改变氨基酸序列的情况中引入一处或多处核酸替代,而且可以在不改变人蛋白质的功能特性的情况中引入一处或多处氨基酸突变。
可以在人蛋白质中做出保守氨基酸替代以生成人蛋白质变体。保守氨基酸替代表示公认的用一种氨基酸替代另一种具有相似特征的氨基酸。例如,每种氨基酸可以描述为具有一种或多种下述特征:电正性,电负性,脂肪族,芳香族,极性,疏水性和亲水性。保守替代是用一种具有规定的结构或功能特征的氨基酸替代另一种具有相同特征的氨基酸。酸性氨基酸包括天冬氨酸,谷氨酸;碱性氨基酸包括组氨酸,赖氨酸,精氨酸;脂肪族氨基酸包括异亮氨酸,亮氨酸和缬氨酸;芳香族氨基酸包括苯丙氨酸,甘氨酸,酪氨酸和色氨酸;极性氨基酸包括天冬氨酸,谷氨酸,组氨酸,赖氨酸,天冬酰胺,谷氨酰胺,精氨酸,丝氨酸,苏氨酸和酪氨酸;并且疏水性氨基酸包括丙氨酸,半胱氨酸,苯丙氨酸,甘氨酸,异亮氨酸,亮氨酸,甲硫氨酸,脯氨酸,缬氨酸和色氨酸;并且保守替代包括每组内氨基酸间的替代。氨基酸也可以就相对大小而言描述,通常认为丙氨酸,半胱氨酸,天冬氨酸,甘氨酸,天冬酰胺,脯氨酸,苏氨酸,丝氨酸,缬氨酸都是较小的。
人变体可以包含合成的氨基酸类似物,氨基酸衍生物和/或非标准氨基酸,例示性包括但不限于α-氨基丁酸,瓜氨酸,刀豆氨酸,氰丙氨酸,二氨基丁酸,二氨基庚二酸,二羟基苯丙氨酸,黎豆氨酸,高精氨酸,羟脯氨酸,正亮氨酸,正缬氨酸,3-磷酸丝氨酸,高丝氨酸,5-羟基色氨酸,1-甲基组氨酸,甲基组氨酸,和鸟氨酸。
人变体通常会由与编码野生型人蛋白质的核酸具有高度同一性的核酸编码。在一些实施方案中,编码人变体的核酸的互补物在高严格性条件下与编码野生型人的核酸特异性杂交。可以使用公知的方法分离或重组或合成生成编码人变体的核酸。
在“野生型”或“天然”人蛋白质及其“变体”以外,如本文中使用的,例如在“人EPO蛋白质(hEPO)”,“人SIRPa蛋白质(hSIRPa)”,“人IL-3蛋白质(hIL-3)”,“人GM-CSF蛋白质(hGM-CSF)”,“人M-CSF蛋白质(hM-CSF)”,“人TPO蛋白质(hTPO)”,和“人IL-6蛋白质(hIL-6)”的语境中,术语“人蛋白质”涵盖融合蛋白,即嵌合蛋白,它们包括野生型人蛋白质(或其变体)的一个或多个片段且保留野生型人蛋白质的一种或多种功能s,例如一种或多种信号传导和/或受体功能。包括野生型人蛋白质(或其变体)的一个或多个片段(例如与一个或多个非人肽或多肽组合的)的融合蛋白在本文中也可以称作“人源化蛋白质”。如此,术语“人SIRPα蛋白质”涵盖例如包括与野生型小鼠SIRPα蛋白质的信号传导域融合的野生型人SIRPα蛋白质的胞外域的氨基酸序列的蛋白质。
因此,编码人蛋白质的核酸序列是包括人蛋白质,例如野生型人蛋白质,野生型人蛋白质的变体,野生型人蛋白质(或其变体)的保留野生型人蛋白质的一种或多种功能,例如一种或多种信号传导和/或受体功能的片段,或包括野生型人蛋白质(或其变体)的一个或多个片段且保留野生型人蛋白质的一种或多种功能,例如一种或多种信号传导和/或受体功能的融合蛋白,例如嵌合蛋白的编码序列的多核苷酸。
典型地,在本公开内容的经遗传修饰的动物中,编码人蛋白质,例如hEPO蛋白质,hSIRPa蛋白质,hIL-3蛋白质,hGM-CSF蛋白质,hM-CSF蛋白质,hTPO蛋白质,hIL-6蛋白质,等的核酸是与一种或多种DNA调节元件可操作连接的。DNA调节元件包括提供和/或调节编码序列在宿主细胞中表达的转录和翻译控制序列,诸如启动子,增强子,多腺苷酸化信号,终止子,等等。例如,“启动子”或“启动子序列”指能够结合细胞中的RNA聚合酶并启动下游(3′方向)编码序列转录的DNA调节区。启动子序列在它的3′末端以转录起始位点为界且向上游(5′方向)延伸以包括以超出背景的可检测水平启动转录必需的最小数目的碱基或元件。在启动子序列内会找到转录起始位点以及负责RNA聚合酶结合的蛋白质结合域。真核启动子常常但非总是会含有“TATA”框和“CAT”框。对本公开内容特别感兴趣的是DNA调节元件,例如以相同的空间和时间表达样式(即,关于对相应的内源蛋白质观察到的,在相同的细胞和组织中及在相同的时间)推动人蛋白质转录的启动子。
在一些实施方案中,主题非人动物中编码人蛋白质的核酸序列是与该基因的人启动子可操作连接的,例如,如果人启动子推动人蛋白质在非人动物中的正确空间和时间表达的话。或者,主题非人动物中编码人蛋白质的核酸序列是与来自相应的非人动物基因的非人动物启动子可操作连接的。如此,例如,就表达hEPO蛋白质的非人动物而言,在一些实施方案中,编码hEPO蛋白质的核酸是与人EPO启动子可操作连接的。在其它情况中,编码人EPO蛋白质的核酸是与非人EPO启动子可操作连接的。在还有其它情况中,编码人EPO蛋白质的核酸是与内源非人EPO启动子可操作连接的。
在一些情况中,人蛋白质是自非人动物中相应的基因基因座表达的。在某些情况中,编码人蛋白质的核酸序列替换编码相应的非人动物蛋白质的核酸序列。在其它情况中,人蛋白质是自非人动物中除相应的非人基因的基因座以外的基因组位点表达的。如此,例如,就表达hEPO蛋白质的非人动物而言,在一些实施方案中,hEPO蛋白质是自非人动物基因组的EPO基因座表达的。在某些实施方案中,非人动物包含编码hEPO蛋白质的核酸序列对编码内源EPO的核酸序列的替换。在其它实施方案中,hEPO是自非人动物中除非人动物EPO基因座以外的基因组位点表达的。
在一些情况中,经遗传修饰的非人动物包含一个拷贝的编码人蛋白质的核酸序列。例如,非人动物对于编码人蛋白质的核酸序列可以是杂合的,即,基因座处的一个等位基因是经过遗传修饰的,而另一个等位基因是内源等位基因。在其它情况中,经遗传修饰的非人动物包含两个拷贝的编码人蛋白质的核酸序列。例如,非人动物对于编码人蛋白质的核酸序列可以是纯合的,即,双倍体基因组中的基因座的两个等位基因均是经过遗传修饰而编码人蛋白质的,例如两个等位基因均包含编码人蛋白质的核酸序列对编码内源蛋白质的核酸序列的替换。如此,例如,就表达hEPO蛋白质的非人动物而言,如上文讨论的,编码hEPO的核酸序列可以整合入非人动物EPO基因座。在一些此类实施方案中,经遗传修饰的非人动物对于编码hEPO蛋白质的核酸序列是杂合的,即经遗传修饰的非人动物包含一个包含编码hEPO的核酸的等位基因和一个编码内源EPO的等位基因。换言之,所述动物是EPOh/m动物,其中“h”代表包含人序列的等位基因而“m”代表内源等位基因。在其它此类实施方案中,经遗传修饰的非人动物对于编码hEPO蛋白质的核酸序列的是纯合的,即双倍体基因组中的基因座的两个等位基因均会包含编码hEPO蛋白质的核酸序列。换言之,所述动物是EPOh/h动物。
在一些情况中,所述非人动物还表达相应的非人动物蛋白质。例如,编码人蛋白质(例如hEPO)的核酸序列可以位于动物的基因组内除非人动物基因的基因座(例如mEPO基因座)以外的位点。作为第二个例子,编码人蛋白质(例如hEPO)的核酸序列可以位于相应的动物基因基因座(例如mEPO基因座),其中它以容许动物编码序列连续表达的方式整合入动物基因基因座,例如,人编码序列插入动物编码序列的上游或下游且两个编码序列之间包括2A肽序列或IRES序列。作为第三个例子,编码人蛋白质(例如hEPO)的核酸序列可以以破坏动物编码序列表达的方式位于相应的动物基因基因座(例如mEPO基因座),例如作为替换部分或整个动物编码序列,但是所述非人动物对于插入,即“敲入”等位基因育种成杂合的,即携带一个敲入等位基因和一个野生型等位基因。在其它情况中,所述非人动物不表达相应的非人动物蛋白质。例如,编码人蛋白质(例如hEPO)的核酸序列可以以破坏动物编码序列表达的方式位于相应的动物基因基因座(例如mEPO基因座),例如作为替换部分或整个动物编码序列,例如,通过替换非人动物编码序列,而且所述动物对于插入,即“敲入”等位基因是纯合的。
可以依照主题公开内容遗传修饰任何非人哺乳动物。非限制性例子包括实验室动物,家畜,牲畜等,例如诸如鼠,啮齿类,犬,猫,猪,马,牛,绵羊,非人灵长类等物种;例如小鼠,大鼠,家兔,仓鼠,豚鼠,牛,猪,绵羊,山羊,和其它转基因动物物种,特别是哺乳动物物种,如本领域中已知的。在其它实施方案中,所述非人动物可以是鸟,例如鸡形目(Galliformes)的,诸如鸡,火鸡,鹌鹑,雉,或山鹑;例如雁形目(Anseriformes)的,诸如鸭,鹅,或天鹅,例如鸽形目(Columbiformes)的,诸如家鸽(pigeon)或野鸽(dove)。在各种实施方案中,主题经遗传修饰的动物是小鼠,大鼠或家兔。
在一个实施方案中,非人动物是哺乳动物。在一些此类实施方案中,非人动物是小型哺乳动物,例如跳鼠总科(Dipodoidea)或鼠总科(Muroidea)的。在一个实施方案中,经遗传修饰的动物是啮齿类。在一个实施方案中,啮齿类选自小鼠,大鼠,和仓鼠。在一个实施方案中,啮齿类选自鼠总科。在一个实施方案中,经遗传修饰的动物来自选自下述的科:丽仓鼠科(Calomyscidae)(例如小鼠样仓鼠),仓鼠科(Cricetidae)(例如仓鼠,新世界(New World)大鼠和小鼠,田鼠),鼠科(Muridae)(真小鼠和大鼠,沙鼠,多刺小鼠(spiny mice),鬃毛大鼠(crested rats)),马岛鼠科(Nesomyidae)(攀爬小鼠(climbing mice),岩石小鼠(rock mice),白尾大鼠(white-tailed rat),马达加斯加(Malagasy)大鼠和小鼠),刺山鼠科(Platacanthomyidae)(例如多刺睡鼠(spiny dormice)),和鼢鼠科(Spalacidae)(例如鼹鼠(mole rates),竹鼠(bamboo rat),和鼢鼠(zokors))。在一个具体的实施方案中,经遗传修饰的啮齿类选自真小鼠或大鼠(鼠科),沙鼠,多刺小鼠,和鬃毛大鼠。
在一个实施方案中,主题经遗传修饰的非人动物是大鼠。在一个此类实施方案中,大鼠选自Wistar大鼠,LEA品系,Sprague Dawley品系,Fischer品系,F344,F6,和Dark Agouti。在另一个实施方案中,大鼠品系是选自下组的两种或更多种品系的混合物:Wistar,LEA,Sprague Dawley,Fischer,F344,F6,和Dark Agouti。
在另一个实施方案中,主题经遗传修饰的非人动物是小鼠,例如C57BL品系的小鼠(例如C57BL/A,C57BL/An,C57BL/GrFa,C57BL/KaLwN,C57BL/6,C57BL/6J,C57BL/6ByJ,C57BL/6NJ,C57BL/10,C57BL/10ScSn,C57BL/10Cr,C57BL/Ola等);129品系的小鼠(例如129P1,129P2,129P3,129X1,129S1(例如129S1/SV,129S1/SvIm),129S2,129S4,129S5,129S9/SvEvH,129S6(129/SvEvTac),129S7,129S8,129T1,129T2);BALB品系的小鼠(例如BALB/c);等等。参见例如Festing等(1999)Mammalian Genome 10:836,还可参见Auerbach等(2000)Establishment and Chimera Analysis of 129/SvEv-and C57BL/6-Derived Mouse Embryonic Stem Cell Lines。在一个实施方案中,经遗传修饰的小鼠是前述129品系和前述C57BL/6品系的混合物。在另一个实施方案中,小鼠是前述129品系的混合物,或前述BL/6品系的混合物。在又一个实施方案中,小鼠是BALB品系和另一种前述品系的混合物。
在一些实施方案中,主题经遗传修饰的非人动物还是免疫缺陷的。“免疫缺陷”包括动物的天然或内源免疫系统的一个或多个方面的缺陷,例如,所述动物是一种或多种类型的发挥功能的宿主免疫细胞缺陷的,例如非人B细胞数目和/或功能,非人T细胞数目和/或功能,非人NK细胞数目和/或功能,等缺陷的。
在主题动物中实现免疫缺陷的一种方法是亚致死照射。或者,可以通过本领域已知的多种基因突变任一来实现免疫缺陷,它们任一可以单独地或组合地育种成本公开内容的主题经遗传修饰的非人动物,或者可用作其中引入主题公开内容的遗传修饰的干细胞的来源。非限制性例子包括与IL2RG基因突变联合且特征在于淋巴细胞表型T(-)B(+)NK(-)的X连锁的SCID;与Jak3基因突变联合且特征在于淋巴细胞表型T(-)B(+)NK(-)的常染色体隐性SCID;特征在于淋巴细胞表型T(-)B(-)NK(-)的ADA基因突变;特征在于淋巴细胞表型T(-)B(+)NK(+)的IL-7R α链突变;特征在于淋巴细胞表型T(-)B(+)NK(+)的CD3δ或ε突变;特征在于淋巴细胞表型T(-)B(-)NK(+)的RAG1和RAG2突变;特征在于淋巴细胞表型T(-)B(-)NK(+)的Artemis基因突变;特征在于淋巴细胞表型T(-)B(+)NK(+)的CD45基因突变;和特征在于淋巴细胞表型T(-)B(-)的Prkdcscid突变。照此,在一些实施方案中,经遗传修饰的免疫缺陷非人动物具有一种或多种选自IL2受体γ链(Il2rγy/-)缺陷,Jak3缺陷,ADA缺陷,IL7R缺陷,CD3缺陷,RAG1和/或RAG2缺陷,Artemis缺陷,CD45缺陷,和Prkdc缺陷的缺陷。普通技术人员会知道免疫缺陷的这些和其它动物模型,它们任一可用于生成本公开内容的免疫缺陷动物。
在一些实施方案中,依照本发明的经遗传修饰的非人动物可用作能够自移入的人造血细胞发生人免疫细胞的人造血细胞的接受者。照此,在本发明的一些方面,主题经遗传修饰的动物是移入有人造血细胞的经遗传修饰的,免疫缺陷的,非人动物。
可以将本领域已知的或本文中描述的人造血细胞,人造血干细胞(HSC)和/或造血干祖细胞(HSPC)的任何来源移植入本公开内容的经遗传修饰的免疫缺陷非人动物。本领域已知的人造血细胞的一种合适来源是人脐带血细胞,特别是CD34阳性(CD34+)细胞。人造血细胞的另一种来源是人胎肝。另一种来源是人骨髓。还涵盖的是通过体细胞去分化(例如通过本领域已知方法)生成的诱导的多能干细胞(iPSC)和诱导的造血干细胞(iHSC)。用于将人细胞移植入非人动物的方法在本领域和在本文中别处有较好的描述,普通技术人员可以采用它们任一来得到主题经遗传修饰的经移入的非人动物。
移植的人造血细胞在经遗传修饰的非人动物产生一种或多种选自人CD34阳性细胞,人造血干细胞,人造血细胞,髓样细胞祖细胞,类红细胞祖细胞,髓样细胞,树突细胞,单核细胞,嗜中性粒细胞,肥大细胞,红细胞,及其组合的移入的人细胞。在一个实施方案中,所述人细胞在移入之后4个月,5个月,6个月,7个月,8个月,9个月,10个月,11个月,或12个月时存在。在一个具体实施方案中,所述人细胞包含类红细胞谱系的细胞。
在一些实施方案中,移植的人造血细胞在经遗传修饰的非人动物中产生移入的人造血-淋巴系统,其包含人造血干细胞和祖细胞,人髓样细胞祖细胞,人髓样细胞,人树突细胞,人单核细胞,人粒细胞,人嗜中性粒细胞,人肥大细胞,人红细胞,人胸腺细胞,人T细胞,人B细胞,和人血小板。在一个实施方案中,所述人造血-淋巴系统在移入之后4个月,5个月,6个月,7个月,8个月,9个月,10个月,11个月,或12个月时存在。在一个具体实施方案中,所述人造血-淋巴系统包含类红细胞谱系的细胞。
类红细胞谱系的细胞包括红细胞和产生红细胞的细胞。“红细胞”包括成熟红色血细胞,也称作红色细胞或红色血球。产生红细胞的细胞包括红细胞祖细胞,即增殖中的多效细胞,和红细胞前体,即注定变成红细胞的增殖中的或非增殖中的细胞。
红细胞是循环血液的主要细胞成分且运输氧作为它们的主要功能。每立方毫米血液中红细胞的数目通常维持在男性中450至550万和女性中420和480万。它随年龄,活动,和环境条件而变化。例如,升高至800万/mm3的水平正常情况下可发生于超出海平面10,000英尺以上时。红细胞正常情况下存活110至120天,此时它自血流移除并由网状内皮系统破坏。新的红细胞以略多于一天1%的速率生成;如此通常维持恒定水平。急性失血,溶血性贫血,或慢性氧剥夺可引起红细胞生成大大升高。
红细胞源自长骨的骨髓中的造血干细胞,经由连续细胞阶段而发育成红细胞,包括常见的髓样细胞祖细胞(CD123+,CD34+,c-kit+,Flt3+);巨核细胞-类红细胞祖细胞(CD34+,CD38+,CD45RA-);原成红细胞(也称作原正成红细胞(如果正常的话)或原巨成红细胞(如果异常的话);大CD71+,EpoR+,c-kit+,Terl19+祖细胞);嗜碱性成红细胞(胞质是嗜碱性的,核大有成块染色质,而且核仁已经消失);多染性成红细胞(也称作中间正成红细胞,其中核染色质显示结块增加且胞质开始获取血红蛋白和呈现嗜酸性色彩);正色性正成红细胞(失去核之前的最后阶段,其中核小且最终变成蓝黑色同质无结构块);和网织红细胞(循环中的CD235+,CD71+细胞;该细胞特征在于以前核的部位处线和粒的网样样式)。
成熟红细胞在外周涂片上表现为两面凹的,圆形的或卵形的盘,直径约6-8μm。它们含有血红蛋白且由于该细胞的两面凹陷而具有中央苍白区,而且可以通过流式细胞术或基于免疫组织化学的方法通过相对于非类红细胞升高的细胞表面标志物CD235和CD59表达容易地鉴定。
如例如本公开内容的图5小图A和图5小图B中展现的,在EPO启动子控制下来自本公开内容的经移入的非人动物的基因组的hEPO表达将骨髓中类红细胞谱系的人细胞(CD235a+)的数目提高平均约2倍(例如自约11%至约22%)。人Sirpa的表达增强这种效果,导致与不表达人EPO或人Sirpa任一的动物相比骨髓中人CD235a+细胞的占比升高平均3倍或更多(即自约11%至约33%)(图5小图A)。照此,本公开内容的表达hEPO的经移入的,免疫缺陷的,经遗传修饰的非人动物可用于研究人红细胞生成和开发调控(例如促进或阻抑)人红细胞生成的药物。
此外,如例如图6中展示的,与未处理对照相比,氯膦酸盐处理人HSC移入的表达hEPO的动物将这些动物的外周血中CD235+类红细胞(包括CD71+网织红细胞,图6,小图B)的数目提高1000倍,即达到外周中总红血球的约1%。重要的是,如例如图7中展现的,HSC移入的表达人EPO的动物中在这些移入水平生成的人红血球对镰状疟原虫感染易感。照此,本文中描述的表达hEPO的经遗传修饰的非人动物特别可用于生成靶向类红细胞谱系的人细胞的寄生虫感染(例如导致疟疾或疟疾样疾病的病原体)的动物模型。
因而,在本发明的一些方面,主题经遗传修饰的动物是移入有人造血细胞且包含人病原体感染的非人动物。这些实施方案中特别感兴趣的是靶向类红细胞谱系的人细胞的人病原体。此类病原体的非限制性例子包括疟原虫,巴贝虫,泰勒虫等属的原生动物。如下文更为详细描述的,可以使用本领域已知的或本文中描述的用于用感兴趣病原体感染动物的任何适宜方法用人病原体感染移入有人造血细胞的主题经遗传修饰的非人动物。如此感染的动物通常会显示寄生虫血症的迹象,包括吉姆萨染色的血涂片所示改变的形态学,及总红细胞浓度的剧烈降低(例如50%)和贫血。
生成主题经遗传修饰的小鼠的方法
在本发明的一些方面,提供了用于生成本公开内容的主题非人动物的方法。在实施所述主题方法时,生成包含与EPO启动子(例如非人动物EPO启动子,例如非人动物基因组的EPO基因座处的)可操作连接的编码hEPO蛋白质的核酸序列的非人动物。
可以使用用于生成经遗传修饰的动物的任何方便方法来实现包含与EPO启动子可操作连接的编码hEPO蛋白质的核酸序列的非人动物的生成,例如如本领域中已知的或如本文中描述的。
例如,可以将编码hEPO蛋白质的核酸以如下的形式掺入重组载体中,所述形式适合于插入宿主细胞基因组中并在非人宿主细胞中表达该人蛋白质。在各个实施方案中,重组载体包含以如下的方式与编码人蛋白质的核酸可操作连接的一种或多种调节序列,所述方式容许将核酸转录成mRNA并将mRNA翻译成人蛋白质,如上文描述的。应当理解,载体的设计可以取决于诸如要转染的宿主细胞的选择和/或要表达的人蛋白质的量等因素。
然后,可以使用多种方法之任一种来将人核酸序列导入动物细胞中以生成表达人基因的经遗传修饰的动物。此类技术是本领域中公知的,并且包括但不限于原核显微注射,胚胎干细胞的转化,同源重组和敲入技术。可以使用的用于生成经遗传修饰的动物的方法包括但不限于那些记载于Sundberg和Ichiki(2006,Genetically Engineered Mice Handbook,CRC Press),Hofker和van Deursen(2002,Genetically Modified Mouse Methods and Protocols,Humana Press),Joyner(2000,Gene Targeting:A Practical Approach,Oxford University Press),Turksen(2002,Embryonic stem cells:Methods and Protocols in Methods Mol Biol.,Humana Press),Meyer等(2010,Proc.Nat.Acad.Sci.USA 107:15022-15026),及Gibson(2004,A Primer Of Genome Science第2版Sunderland,Massachusetts:Sinauer),美国专利No.6,586,251,Rathinam等(2011,Blood 118:3119-28),Willinger等(2011,Proc Natl Acad Sci USA,108:2390-2395),Rongvaux等(2011,Proc Natl Acad Sci USA,108:2378-83)及Valenzuela等(2003,Nat Biot 21:652-659)的。
例如,可以通过将编码人蛋白质的核酸导入卵母细胞中(例如通过显微注射),并容许卵母细胞在雌性孕育动物中发育来创建主题经遗传修饰的动物。在优选的实施方案中,将表达构建体注射入受精的卵母细胞中。可以在交配后那天自排卵过度的雌性收集受精的卵母细胞,并注射表达构建体。将注射后的卵母细胞培养过夜或直接转移入0.5天p.c.假孕雌性的输卵管中。用于排卵过度,收获卵母细胞,表达构建体注射和胚胎转移的方法是本领域中已知的,并且记载于Manipulating the Mouse Embryo(2002,A Laboratory Manual,第3版,Cold Spring Harbor Laboratory Press)。可以通过DNA分析(例如PCR,Southern印迹,DNA测序,等)或者通过蛋白质分析(例如ELISA,Western印迹,等)对后代评估导入的核酸的存在。
作为另一个例子,可以使用公知的方法(诸如电穿孔,磷酸钙沉淀,脂转染,等)将包含编码人蛋白质的核酸序列的构建体转染入干细胞(例如ES细胞或iPS细胞)中。可以通过DNA分析(例如PCR,Southern印迹,DNA测序,等)或者通过蛋白质分析(例如ELISA,Western印迹,等)对细胞评估导入的核酸的存在。然后,可以将测定为已经掺入有表达构建体的细胞导入植入前胚胎中。关于可用于本发明组合物和方法的本领域中已知方法的详细描述参见Nagy等(2002,Manipulating the Mouse Embryo:A Laboratory Manual,第3版,Cold Spring Harbor Laboratory Press),Nagy等(1990,Development 110:815-821),美国专利No.7,576,259,美国专利No.7,659,442,美国专利No.7,294,754,及Kraus等(2010,Genesis 48:394-399)。
另外,如下文实施例中的一些中描述的,可以使用遗传工程技术构建核酸构建物(参见例如Valenzuela et al.(2003)High throughput engineering of the mouse genome coupled with high-resolution expression analysis,Nature Biotech.21(6):652-59和美国专利No.6,586,251),导入干细胞(例如ES细胞),并使用等位基因丢失和等位基因获取测定法测定正确打靶的克隆(Valenzuela et al.,见上文);可以使用正确打靶的ES细胞作为供体ES细胞,使用方法导入8细胞阶段的小鼠胚胎(参见例如美国专利No.7,294,754和Poueymirou et al.2007,F0generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech.25(1):91-99)。
可以使用经遗传修饰的建立者动物来培育别的携带遗传修饰的动物。可以将本公开内容的携带编码人蛋白质的核酸的经遗传修饰的动物与携带其它遗传修饰的其它经遗传修饰的动物,例如hSIRPa敲入小鼠,hIL-3敲入小鼠,hGM-CSF敲入小鼠,hM-CSF敲入小鼠,hTPO敲入小鼠,hIL-6敲入小鼠,等等进一步育种,或与敲除动物(例如一种或多种蛋白质缺陷的,例如不表达一种或多种其基因的非人动物,例如Rag2缺陷动物,I12rg缺陷动物)育种。
在另一个实施方案中,可以生成干细胞,例如ES细胞,使得它们包含数处遗传修饰,例如本文中描述的人源化或基因删除,而且可以将此类干细胞导入胚胎以生成具有数处遗传修饰的经遗传修饰的动物。
如上文讨论的,在一些实施方案中,主题经遗传修饰的非人动物是免疫缺陷动物。可以使用用于生成经遗传修饰的动物的任何方便方法生成免疫缺陷且包含一种或多种人蛋白质(例如hEPO,hSIRPa,hIL-3,hGM-CSF,hM-CSF,和/或hTPO)的经遗传修饰的非人动物,所述方法例如如本领域中已知的或如本文中描述的。例如,经遗传修饰的免疫缺陷动物的生成可以通过将编码人蛋白质的核酸导入包含突变体SCID基因等位基因的卵母细胞或干细胞来实现,所述等位基因在纯合子时会导致免疫缺陷,如上文和本文的实施例中极为详细描述的。然后,使用例如本文中描述和本领域中已知的方法用经修饰的卵母细胞或ES细胞生成小鼠,并交配以生成包含期望遗传修饰的免疫缺陷小鼠。作为另一个例子,可以在免疫胜任背景中生成经遗传修饰的非人动物,并与包含突变体基因等位基因的动物杂交,并使后代交配以创建表达至少一种感兴趣人蛋白质的免疫缺陷动物,所述等位基因在半合子或纯合子时会导致免疫缺陷。
在一些实施方案中,处理经遗传修饰的小鼠从而消除该小鼠中可能存在的内源造血细胞。在一个实施方案中,所述处理包含照射该经遗传修饰的小鼠。在一个具体实施方案中,亚致死照射新生的经遗传修饰的小鼠幼畜。在一个具体实施方案中,以4小时间隔2x 200cGy照射新生的幼畜。
本发明的各个实施方案提供在基本上所有它们的细胞中包括人核酸的经遗传修饰的动物,以及在一些但非所有它们的细胞中包括人核酸的经遗传修饰的动物。在一些情况中,例如靶向重组,一个拷贝的人核酸会整合入经遗传修饰的动物的基因组。在其它情况中,例如随机整合,彼此邻近或远离的多个拷贝的人核酸可整合入经遗传修饰的动物的基因组。
如此,在一些实施方案中,主题经遗传修饰的非人动物可以是包含如下基因组的免疫缺陷动物,所述基因组包括与相应的非人动物启动子可操作连接的编码人多肽的核酸,其中所述动物表达所编码的人多肽。换言之,主题经遗传修饰的免疫缺陷非人动物包含如下基因组,所述基因组包含编码至少一种人多肽的核酸,其中所述核酸与相应的非人启动子和聚腺苷酸化信号可操作连接的,且其中所述动物表达所编码的人多肽。
如上文讨论的,在一些实施方案中,主题经遗传修饰的非人动物移入有人造血细胞。可以将本领域已知的或本文中讨论的人造血细胞,人造血干细胞(HSC)和/或造血干祖细胞(HSPC)的任何来源移植入本公开内容的经遗传修饰的非人动物,例如脐带血,胎肝,骨髓,iPSC,等。在一个实施方案中,所述造血细胞选自人脐带血细胞和人胎肝细胞。要移植的细胞的量会是普通技术人员较好地了解,或者可以凭经验确定。在一个实施方案中,移入约1-2x 105个人CD34+细胞。可以使用本领域已知的任何便利技术将细胞移植入宿主主题非人动物,例如尾静脉注射,眶后注射,注射入新生肝,等等。可以在任何便利的缓冲溶液中将细胞移植入宿主,例如PBS,Dulbecco氏改良培养基,Iscove氏改良培养基,等等。在一些情况中,可以在例如如上文描述的移入之前照射动物以提高免疫缺陷。
如此移入的人造血细胞产生一种或多种选自CD34+细胞,造血干细胞,造血细胞,髓样细胞前体细胞,髓样细胞,树突细胞,单核细胞,粒细胞,嗜中性粒细胞,肥大细胞,胸腺细胞,T细胞,B细胞,血小板,红细胞,及其组合的人细胞。在一个实施方案中,所述人细胞在移之后入4个月,5个月,6个月,7个月,8个月,9个月,10个月,11个月,或12个月时存在。可以实施多种测定法任一来确认移入是成功的,包括例如针对各种感兴趣人造血细胞的流式细胞术测定法,血涂片,和免疫组织化学。
如上文讨论的,在一些实施方案中,用人病原体感染移入有人造血细胞的主题经遗传修饰的非人动物。这些实施方案中特别感兴趣的是靶向类红细胞谱系的人细胞的人病原体。此类病原体的非限制性例子包括疟原虫,巴贝虫,泰勒虫,等等属的原生动物。在一些实施方案中,所使用的病原体的株系是天然发生的株系。在某些实施方案中,所使用的株系已经针对它在人红细胞移入的免疫缺陷小鼠中能繁殖地生长的能力进行了体内选择,例如镰状疟原虫Pf3D70087/N9或Pf3D70087/N5株。
可以使用本领域已知的用于用靶向类红细胞谱系的细胞的病原体感染动物的任何方法感染主题经移入的免疫缺陷动物。例如,可以对主题经移入的免疫缺陷动物腹膜内接种受到寄生感染的红血球(PRBC)。参见例如Badell et al.(2000)Human malaria in immunocompromised mice:an in vivo model to study defense mechanisms against Plasmodium falciparum.JEM 192(11):1653-1660;和Moreno et al.(2006)The course of infections and pathology in immunomodulated NOD/LtSz-SCID mice inoculated with Plasmodium falciparum laboratory lines and clinical isolates.Int.J.Parasitol.36:361-369。又例如,可以对主题经移入的免疫缺陷动物血管内接种受到寄生感染的红血球。参见例如Angulo-Barturen et al.(2008)A murine model of falciparum-malaria by in vivo selection of competent strains in non-myelodepleted mice engrafted with human erythrocytes.PLoS One 3:e2252;和Jimenez-Diaz et al.(2009)Improved murine model of malaria using Plasmodium falciparum competent strains and non-myelodepleted NOD-scid IL2Rgnullmice engrafted with human erythrocytes.Antimicrob Agents Chemother 53:4533-4536。在一些实施方案中,所述感染是通过将寄生虫注射入非人动物而产生的,即不是在类红细胞的背景中。在一些实施方案中,在感染之前和/或期间对主题经移入的免疫缺陷动物体内化学消减吞噬细胞。在此类实施方案中,可以将选择性消减宿主吞噬细胞的任何化疗剂施用于主题动物,包括例如氯膦酸盐,例如如本文中的实施例中描述的;二氯亚甲基二膦酸酯,例如如Badell et al.,见上文和Moreno et al.,见上文中描述的;对多形核嗜中性粒细胞特异性的单克隆抗体,例如NIMP-R14,如Badell et al.,见上文和Moreno et al.,见上文中描述的;等等。
本公开内容的受到感染的经遗传修饰的非人动物中的百分比寄生虫血症可以通过本领域的任何便利方法来评估,例如吉姆萨染色的血涂片的显微镜检查,例如注射之后3天;或通过流式细胞术,例如通过测量核酸染料YOYO-1或细胞渗透性染料SYTO-16的发射,例如在TER-119单抗存在或缺失下。参见例如Jimenez-Diaz et al.Quantitative measurement of Plasmodium-infected erythrocytes in murine models of malaria by flow cytometry using bidimensional assessment of SYTO-16fluorescence.Cytometry A 2009,75:225-235。
主题经遗传修饰的小鼠的用途
在小鼠中在体内设置中研究人组织的能力打开了一系列可能的研究大道。主要限制阻碍了所述办法的应用,其中最重要的缺陷之一是小鼠因子没有能力支持人细胞。确实,在免疫系统中,人免疫细胞发育和功能所需要的许多必要因子是物种特异性的且不能由小鼠有效提供。因此决定遵循将小鼠基因用它们的人对应物替换的策略,使得能够实现更好的人细胞发育和功能且潜在使得相应的小鼠细胞发育和功能不能实现。通过将这种概念应用于人细胞因子EPO,本文中显示了用编码人EPO蛋白质的核酸序列替换编码小鼠EPO蛋白质的核酸序列改善小鼠中移入的人免疫系统中类红细胞谱系的细胞的发育和功能。
例如,例如图5处的实施例展现了来自在非人动物的基因组处的EPO启动子控制下的核酸序列的hEPO表达将人HSC移入的动物的骨髓中发育的类红细胞谱系的人细胞(CD235a+)的数目提高约2倍(即自约11%至约22%)。人Sirpa的表达增强这种效果,导致与不表达人EPO或人Sirpa任一的动物相比骨髓中人CD235a+细胞的占比升高总共3倍(即自约11%至约33%)(图4a)。此外,如例如图6中展现的,与未处理对照相比,氯膦酸盐处理人HSC移入的表达人EPO的动物将这些动物的外周血中CD235+类红细胞(包括CD71+网织红细胞,图6,小图B)的数目提高1000倍,即达到总红血球的约1%。重要的是,如例如图7中展现的,HSC移入的表达人EPO的动物中在这些移入水平生成的人红血球对疟原虫诸如镰状疟原虫感染易感。因而,本文中描述的表达人EPO的经遗传修饰的非人动物特别可用于生成对疟原虫感染易感的动物,或者会更好地支持在当前啮齿动物模型中在感染之前急性移植入动物的人红细胞的动物。
照此,本公开内容的经遗传修饰的非人动物在本领域中找到许多用途。例如,本公开内容的经移入的经遗传修饰的动物对于研究人红细胞生成和人红细胞的功能是有用的。作为另一个例子,本公开内容的经移入的经遗传修饰的小鼠提供了一种系统,可用于对候选药剂筛选期望的体内活性,例如用以鉴定能够例如在健康或患病状态(例如作为癌性细胞),在病原体感染期间等调控(即促进或抑制)人红细胞生成和/或人红细胞功能的药剂,例如用以鉴定新颖的治疗剂;或作为另一个例子,用以鉴定对类红细胞谱系的人细胞有毒性的药剂;及用以鉴定预防,减轻,或逆转有毒药剂对类红细胞谱系的人细胞的毒性影响的药剂;等等。作为又一个例子,本公开内容的经移入的经遗传修饰的动物提供了一种对于预测个体对疾病疗法的响应性有用的系统,例如通过提供用于筛选个体的免疫系统对药剂(例如治疗剂)的响应性的体内平台,用以预测个体对所述药剂的响应性。
作为一个非限制性例子,本公开内容的移入的经遗传修饰的小鼠可用于生成靶向人类红细胞的寄生虫(例如疟原虫,巴贝虫,泰勒虫,等等)的病原体感染的小鼠模型。感染的此类小鼠模型在研究(例如为了更好地了解人中感染的进展)和药物发现(例如为了鉴定针对此类寄生虫的感染提供保护或治疗此类寄生虫的感染的候选药剂)二者中会是有用的。
疟原虫属的原生动物是人中疟疾的原因。疟疾始于受到感染的按蚊属(Anopheles)蚊子的叮咬,经由它的唾液将原生动物引入循环系统,并最终到达肝,它们在那里成熟和繁殖。然后原生动物进入血流并感染处于各种成熟阶段的类红细胞谱系的细胞。
疟原虫的五个种能感染人和通过人传播。绝大多数死亡是由镰状疟原虫引起的,而间日疟原虫,卵形疟原虫(P.ovale),和三日疟原虫(P.malariae)引起一般更温和形式的疟疾,很少致命。认为这是至少部分由于每个种所靶定的细胞的类型:镰状疟原虫在所有成熟期的红血球(RBC)中生长,而,例如,间日疟原虫限于网织红细胞中的生长,它们只占外周中总RBC的大约1%-2%。另外,镰状疟原虫经不与任何其它人疟疾分享的即扣留(sequestration)的独特特性引起严重疟疾。在48小时无性血液阶段周期内,成熟形式改变受到感染红血球的表面特性,使它们粘附至血管(称作细胞粘附的过程)。这引起微循环阻塞并导致多种器官功能障碍。
疟疾的症状包括发热,发冷,头痛,出汗,疲劳,贫血,恶心,干性(非排痰性)咳嗽,肌肉和/或背痛,和脾肿大。与疟疾有关的其它症状和并发症包括脑部感染(脑炎),溶血性贫血,肾衰竭,肝衰竭,脑膜炎,肺水肿,和脾出血。一般而言,有风险发生疟疾的个体会在感染之后7天或更久,例如镰状疟原虫初始感染之后9至14天,间日疟原虫或卵形疟原虫初始感染之后12至18天,三日疟原虫初始感染之后18至40天,或诺氏疟原虫(P.knowlesi)初始感染之后11至12天开始显示症状。本领域用于治疗或预防疟疾的抗疟药包括氯喹(chloroquine),奎尼丁(quinidine),多西环素(doxycycline),四环素(tetracycline),克林霉素(clindamycin),阿托伐醌(atovaquone)加氯胍(proguanil)(Malarone),甲氟喹(Mefloquine),青蒿琥酯(artesunate),乙胺嘧啶(pyrimethamine)加磺胺多辛(sulfadoxine)(Fansidar)。
用于确定受试者是否已经受到疟原虫感染的方法是本领域公知的,而且包括例如使用血膜的血液显微镜检查,基于抗原的快速诊断性测试(RDT),例如基于免疫层析的RDT,通过聚合酶链式反应(PCR)检测寄生虫DNA,等。可使用任何便利方法来确定受试者的人红血球是否已经受到病原体感染。
感兴趣的病原体的另一个例子是巴贝虫属的原生动物。巴贝虫感染导致一种疟疾样疾病,称作巴贝虫病。巴贝虫病是一种媒介传播病,通常通过肩突硬蜱种(Ixodes scapularis)的蜱来传播。该疾病通常由人中的果氏巴贝虫(B.microti),犬中的罗氏巴贝虫(B.canis rossi)和犬巴贝虫(B.canis canis),牛(cow)中的牛巴贝虫(B.bovis),和小牛(cattle)中的双芽巴贝虫(B.bigemina)引起。感染人的果氏巴贝虫使用与莱姆病和埃里希体病相同的蜱媒介,而且可以与这些其它疾病联合发生。该原生动物还能通过输血来传播。
在人中,巴贝虫病可以是无症状的,或者特征在于范围从轻度发热和腹泻到高度发热,恶寒战栗,和严重贫血的症状。在严重病例中可发生器官衰竭,包括活性窘迫综合征。严重病例大多在具有脾切除术的人,或具有免疫缺陷的人,诸如HIV/AIDS患者中发生。治疗通常包含奎宁和克林霉素或阿托伐醌和阿奇霉素的双药方案。在巴贝虫病看来危及生命的情况中,实施换血输注,其中去除受到感染的红血球并用未受感染的红血球替换。
巴贝虫感染通过在吉姆萨染色的薄血涂片上鉴定寄生虫来进行确定性诊断。寄生虫在红细胞中作为成对裂殖子出现,其形成人中的“马耳他十字形成”或动物中的“两个梨挂在一起”。其它诊断方法包括外周血PCR,和针对巴贝虫的抗体(IgG,IgM)的血清学测试。
还有另一种疟疾样疾病,泰勒虫病,是由泰勒虫属的原生动物引起的。在人中,泰勒虫病是由微小泰勒虫(T.microti)引起的;在马中,是由马泰勒虫(T.equi)引起的(“马梨浆虫病”);在绵羊和山羊中,是由莱氏泰勒虫(T.lestoquardi)引起的;而在牛(cattle),非洲野牛(African buffalo),水牛(waterbuffalo),和公水牛(water buck)中,是由环形泰勒虫(T.annulata)引起的(“热带泰勒虫病”,也称作“地中海泰勒虫病”)或小泰勒虫(T.parva)(“东海岸热”,也称作“科立多病”)。泰勒虫病通过多种蜱物种传播至宿主,包括肩突硬蜱种(Ixodes scapularis),扇头蜱属(Rhipicephalus),矩头蝉属(Dermacentor),血蜱属(Haemaphysalis),和璃眼蜱属(Hyalomma)。该生物体在蜱中繁殖,即它前行通过它的生命阶段,并在蜱附着至宿主之后成熟及进入唾液。通常,在它变成感染性的之前,蜱必须附着几天。然而,如果环境温度较高的话,感染性子孢子能在地面上的蜱中发育,而且可以附着数小时内进入宿主。
人中的泰勒虫病通常呈现发热和溶血。泰勒虫感染通过在吉姆萨染色的薄血涂片上鉴定寄生虫来进行确定性诊断。
本公开内容的经移入的经遗传修饰的动物可用于筛选候选药剂以鉴定那些会预防(例如疫苗)或治疗疟原虫,巴贝虫,泰勒虫,和其它靶向人红细胞的寄生虫感染的。术语“治疗”,“处理”等等在本文中用于一般包括获得期望的药理学和/或生理学效果。效果可以是就完全或部分阻止疾病或其症状而言预防性的和/或可以是就部分或完全治愈疾病和/或可归于疾病的不利影响而言治疗性的。如本文中使用的,“治疗”包括哺乳动物中的疾病的任何治疗,而且包括:(a)阻止疾病在可能倾向于疾病但尚未诊断为具有疾病的受试者中发生;(b)抑制疾病,即阻滞它的发生;或(c)减轻疾病,即引起疾病消退。作为抗寄生虫治疗剂感兴趣的候选药剂包括那些可以在寄生虫感染之前,期间或之后施用的,和那些以有效量施用时抑制寄生虫对个体(即宿主)的影响的,例如通过杀死寄生虫或受到寄生虫感染的细胞,通过阻止寄生虫的繁殖,通过阻止由寄生虫生成的对个体有毒的因子(即毒素)的生成或作用,等。术语“个体”,“受试者”,“宿主”,和“患者”在本文中可互换使用且包括想要进行诊断,处理,或治疗的任何哺乳动物受试者,特别是人。
在生物学活性剂的筛选测定法中,使本公开内容的移入有人造血细胞的经遗传修饰的非人动物(例如经移入的Rag2-/-Il2rg无Epoh/m小鼠,经移入的Rag2-/-Il2rg无Tpoh/hIl3/Gmcsfhh/hEpoh/mSIRPαh/h(“TIES”)小鼠,经移入的Rag2-/-IL2rgy/-Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hhSIRPα+(“MISTER-G”)小鼠,经移入的Rag2-/-Il2rg无Tpoh/hMcsfh/hIl3/Gmcsfh//hEpoh/hSIRPa-tg+(“SupER-G”)小鼠等)与感兴趣的候选药剂接触,并通过监测一种或多种输出参数来评估候选药剂的效果。根据本领域中公知的方法,这些输出参数可以反映细胞的存活力,例如造血细胞的总数或特定造血细胞类型的细胞的数目,或细胞的凋亡状态,例如DNA片段化的量,细胞空泡化的量,细胞表面上磷脂酰丝氨酸的量等。或者/另外,输出参数可以反映细胞的分化能力,例如分化细胞的比例和分化细胞类型。或者/另外,输出参数可以反映细胞的功能,例如由细胞生成的细胞因子和趋化因子,由细胞生成的抗体(例如量或类型),细胞归巢和溢出至攻击部位的能力,细胞在体外或在体内调控(即促进或抑制)其它细胞的活性的能力,吸收血红蛋白的能力,等。根据与实施的研究的相关性,又一些参数可以反映药剂对感染的影响,例如动物中的病原体感染,例如小鼠中病原体的滴度,等。
参数是细胞的可量化组分,特别是可以精确测量的组分(是高通量系统中所期望的)。参数可以是任何细胞组分或细胞产物,包括细胞表面决定簇,受体,蛋白质或其构象或翻译后修饰,脂质,碳水化合物,有机或无机分子,核酸(例如mRNA,DNA,等)或自此类细胞组分衍生的部分或其组合。虽然大多数参数会提供定量读出,在一些情况中,半定量或定量结果会是可接受的。读出可以包括单一测定数值,或者可以包括均值,中值或方差,等。特征性地,由于相同测定法的多重性会对每个参数获得一个范围的参数读出数值。预期变率,并且会使用标准统计学方法及用于提供单一数值的常用统计学方法获得测试参数集中每个的数值范围。
用于筛选的感兴趣候选药剂包括已知的和未知的化合物,其涵盖许多化学种类,主要是有机分子(其可以包括有机金属分子),无机分子,遗传序列,疫苗,抗生素或怀疑具有抗生素特性的其它药剂,肽,多肽,抗体,已经批准用于人的药物的药剂,等。本发明的一个重要方面是评估候选药物,包括毒性测试;等等。
候选药剂包括包含对于结构相互作用(特别是形成氢键)必需的官能团的有机分子,并且通常至少包含胺,羰基,羟基或羧基基团,通常至少两种官能性化学基团。候选药剂经常包含用一种或多种上述官能团取代的环状碳或杂环结构和/或芳香族或多芳香族结构。还在生物分子(包括肽,多核苷酸,糖,脂肪酸,类固醇,嘌呤,嘧啶,衍生物,结构类似物或其组合)中找到候选药剂。包括的有药理学活性药物,遗传活性分子,等。感兴趣化合物包括化学治疗剂,激素或激素拮抗剂,等。适合于本发明的例示性药剂是那些记载于“The Pharmacological Basis of Therapeutics,”Goodman和Gilman,McGraw-Hill,New York,N.Y.,1996,第九版的。还包括毒素,和生物学和化学战剂,例如见Somani,S.M.(编),“Chemical Warfare Agents,”Academic Press,New York,1992。
用于筛选的感兴趣候选药剂还包括核酸,例如编码siRNA,shRNA,反义分子,或miRNA的核酸,或编码多肽的核酸。可用于将核酸转移入靶细胞中的许多载体是可得的。可以将载体以附加体维持,例如作为质粒,微环DNA,病毒衍生载体诸如巨细胞病毒,腺病毒,等,或者可以经由同源重组或随机整合将它们整合入靶细胞基因组中,例如逆转录病毒衍生载体诸如MMLV,HIV-1,ALV,等。可以直接对主题细胞提供载体。换言之,使多能细胞与包含感兴趣核酸的载体接触,使得载体被细胞摄取。
用于使细胞(例如培养中的细胞或小鼠中的细胞)与核酸载体接触的方法(诸如电穿孔,氯化钙转染,和脂转染)是本领域中公知的。或者,可以经由病毒对细胞提供感兴趣核酸。换言之,使细胞与包含感兴趣核酸的病毒颗粒接触。逆转录病毒(例如慢病毒)特别适合于本发明的方法。常用的逆转录病毒载体是“有缺陷的”,即不能生成生产性感染需要的病毒蛋白质。相反,载体的复制需要在包装细胞系中生长。为了生成包含感兴趣核酸的病毒颗粒,通过包装细胞系将包含核酸的逆转录病毒核酸包装入病毒壳体中。不同包装细胞系提供要掺入壳体中的不同包膜蛋白,此包膜蛋白决定病毒颗粒对细胞的特异性。包膜蛋白属于至少三种类型,即同向性(ecotropic),兼向性(amphotropic)和异向性(xenotropic)。包装有同向性包膜蛋白的逆转录病毒(例如MMLV)能够感染大多数鼠和大鼠细胞类型,并且通过使用同向性包装细胞系(诸如BOSC23)生成(Pear等(1993)P.N.A.S.90:8392-8396)。携带兼向性包膜蛋白的逆转录病毒(例如4070A(Danos等,见上文))能够感染大多数哺乳动物细胞类型,包括人,犬和小鼠,并且通过使用兼向性包装细胞系诸如PA12(Miller等(1985)Mol.Cell.Bio1.5:431-437);PA317(Miller等(1986)Mol.Cell.Biol.6:2895-2902);GRIP(Danos等(1988)PNAS 85:6460-6464)生成。用异向性包膜蛋白(例如AKR env)包装的逆转录病毒能够感染大多数哺乳动物细胞类型,鼠细胞除外。可以使用合适的包装细胞系来确保感兴趣细胞(在一些例子中为移入细胞,在一些例子中为宿主(即经遗传修饰的动物)的细胞)被包装病毒颗粒靶向。
用于对主题细胞提供感兴趣核酸的载体通常会包含适合于驱动感兴趣核酸表达(也就是转录活化)的启动子。这可以包括遍在起作用的启动子,例如CMV-β-肌动蛋白启动子,或诱导型启动子,诸如在特定细胞群体中有活性或者响应药物诸如四环素存在的启动子。转录活化意指转录会在靶细胞中在基础水平上升高至少约10倍,至少约100倍,更通常至少约1000倍。另外,用于对主题细胞提供再编程因子的载体可以包含后来必须去除的基因(例如使用重组酶系统诸如Cre/Lox),或破坏表达它们的细胞的基因(例如通过纳入容许选择性毒性的基因,诸如疱疹病毒TK,bcl-xs,等)。
用于筛选的感兴趣候选药剂还包括多肽。任选地,可以将此类多肽与提高产物溶解度的多肽域融合。可以经由限定的蛋白酶切割位点(例如TEV序列,其受到TEV蛋白酶切割)将该域与多肽连接。接头还可以包含一个或多个柔性序列,例如1至10个甘氨酸残基。在一些实施方案中,在维持产物溶解度的缓冲液中,例如在0.5至2M尿素存在下,在提高溶解度的多肽和/或多核苷酸存在下,等等情况下实施对融合蛋白的切割。感兴趣的域包括内体裂解域(endosomolytic domain),例如流感HA域;和帮助生成的其它多肽,例如IF2域,GST域,GRPE域,等。另外/或者,可以配制此类多肽以实现改善的稳定性。例如,可以将肽PEG化,其中聚乙烯氧基基团提供血流中延长的寿命。可以将多肽与另一种多肽融合以提供添加的功能性,例如提高体内稳定性。一般地,此类融合配偶体是一种稳定的血浆蛋白质,其在作为融合物存在时可以例如延长多肽的体内血浆半衰期,特别是此类稳定的血浆蛋白质是免疫球蛋白恒定域的情况。在大多数情况中(其中稳定的血浆蛋白质通常以多聚体形式找到,例如免疫球蛋白或脂蛋白,其中相同或不同多肽链通常是二硫化物和/或非共价连接的,以形成装配的多链多肽),也会以与稳定的血浆蛋白质前体具有基本上相同结构的多聚体生成和采用含有多肽的本文融合物。这些多聚体就它们包含的多肽药剂而言会是同质的,或者它们可以含有超过一种多肽药剂。
候选多肽药剂可以自真核细胞生成,或者可以由原核细胞生成。可以通过解折叠(例如热变性,DTT还原,等)将其进一步加工,并且可以使用本领域中已知的方法进一步重折叠。不改变一级序列的感兴趣修饰包括多肽的化学衍生化,例如酰化,乙酰化,羧化,酰胺化,等。还包括糖基化修饰,例如那些通过在其合成和加工期间或在进一步的加工步骤中修饰多肽的糖基化样式进行的;例如通过将多肽暴露于影响糖基化的酶,诸如哺乳动物糖基化或者去糖基化酶。还包括具有磷酸化氨基酸残基(例如磷酸酪氨酸,磷酸丝氨酸,或磷酸苏氨酸)的序列。可以使用普通的分子生物学技术和合成化学修饰多肽,从而改善其对蛋白水解降解的抗性或优化溶解度特性或使它们更适合作为治疗剂。此类多肽的类似物包括那些含有与天然存在L-氨基酸不同的残基(例如D-氨基酸或非天然存在合成氨基酸)的。可以用D-氨基酸替代一些或所有氨基酸残基。
可以使用本领域中已知的常规方法通过体外合成制备候选多肽药剂。多种商业合成装置是可得的,例如Applied Biosystems,Inc.,Beckman,等的自动化合成仪。通过使用合成仪,可以用非天然的氨基酸替代天然存在的氨基酸。特定的序列和制备方式会由便利,经济效果,需要的纯度,等决定。或者,可以依照重组合成的常规方法分离和纯化候选多肽药剂。可以制备表达宿主的裂解物,并使用HPLC,排阻层析,凝胶电泳,亲和层析,或其它纯化技术纯化裂解物。在很大程度上,关于与产品制备及其纯化的方法相关的污染物,使用的组合物会包含按重量计至少20%的期望产物,更通常按重量计至少约75%,优选地按重量计至少约95%,且对于治疗目的,通常按重量计至少约99.5%。通常,百分比会基于总蛋白质。
在一些情况中,要筛选的候选多肽药剂是抗体。术语“抗体”或“抗体模块”意图包括具有适合并识别表位的特定形状的任何含有多肽链的分子结构,其中一种或多种非共价结合相互作用稳定分子结构和表位之间的复合物。给定结构与其特定表位的特异性或选择性适合有时称为“锁匙”适合。原型抗体分子是免疫球蛋白,并且认为来自所有来源(例如人,啮齿类,家兔,牛,绵羊,猪,犬,其它哺乳动物,鸡,其它鸟类,等)的所有类型的免疫球蛋白(IgG,IgM,IgA,IgE,IgD等)是“抗体”。本发明中利用的抗体可以是多克隆抗体或单克隆抗体。通常在培养细胞的培养基中提供抗体。在下文极为详细讨论抗体生成和筛选。
可以从极其多种来源(包括合成或天然化合物的文库)获得候选药剂。例如,许多手段可用于随机和定向合成极其多种有机化合物,包括生物分子,包括表达随机化的寡核苷酸和寡肽。或者,细菌,真菌,植物和动物提取物形式的天然化合物的文库是可得的或容易生成的。另外,经由常规化学,物理和生物化学手段容易修饰天然或合成生成的文库和化合物,并且可以用于生成重组文库。可以将已知的药理学药剂进行定向或随机化学修饰,诸如酰化,烷基化,酯化,酰胺化(amidification),等以生成结构类似物。
如下对候选药剂筛选生物学活性,即对至少一份和通常多份样品施用药剂,有时与缺乏药剂的样品一起。测量响应药剂的参数变化,并且通过与用其它药剂等获得的参照样品(例如在药剂存在和缺乏下)比较来评估结果。在实施筛选以鉴定会预防,减轻或逆转病原体的作用的候选药剂的情况中,通常在致病因子存在下实施筛选,其中在最适合于要测定的结果的时间时添加致病因子。例如,在测试候选药剂的保护/预防能力的情况中,可以在病原体之前,与病原体同时,或者在受到病原体感染后添加候选药剂。作为另一个例子,在测试候选药剂逆转病原体作用的能力的情况中,可以在受到病原体感染后添加候选药剂。如上文提及的,在一些情况中,“样品”是已经移入有细胞的经遗传修饰的非人动物,例如对已经移入有人造血细胞的免疫缺陷动物(例如小鼠)提供候选药剂,所述免疫缺陷动物包含与EPO启动子可操作连接的编码人EPO的核酸。在一些例子中,样品是要移入的人造血细胞,即在移入免疫缺陷的经遗传修饰的动物前对细胞(例如网织红细胞,红细胞,等)提供候选药剂。
若要直接对经移入的经遗传修饰的动物施用候选药剂,则可以通过用于对小鼠施用肽,小分子和核酸的本领域中的许多公知方法之任一种施用药剂。例如,可以口服,粘膜,表面,皮内,或者通过注射,例如腹膜内,皮下,肌肉内,静脉内,或颅内注射等施用药剂。可以在缓冲液中施用药剂,或者可以将它掺入多种配制剂之任一种中,例如通过与合适的药学可接受媒介物组合进行。“药学可接受媒介物”可以是得到联邦或州政府的管理机构批准或美国药典或其它公认的用于哺乳动物(诸如人)的药典中列出的媒介物。术语“媒介物”指为了对哺乳动物施用而配制本发明化合物的稀释剂,佐剂,赋形剂,或载体。此类药用媒介物可以是脂质,例如脂质体,例如脂质体树状聚合物,液体,诸如水和油,包括石油,动物,植物或合成起源的,诸如花生油,大豆油,矿物油,芝麻油等,盐水;阿拉伯树胶,明胶,淀粉糊,滑石,角蛋白,胶体硅土,尿素,等。另外,可以使用辅助,稳定,增稠,润滑和着色剂。可以将药物组合物配制成固体,半固体,液体或气体形式的制剂,诸如片剂,胶囊剂,粉剂,颗粒剂,软膏剂,溶液剂,栓剂,注射液,吸入剂,凝胶剂,微球剂,和气雾剂。药剂在施用后可以是系统性的或者可以通过使用区域性施用,壁内施用,或使用作用为在植入部位处保留活性剂量的植入物局部化。可以配制活性剂以实现立即活性或者可以将其配制以实现持续释放。对于一些状况,特别是中枢神经系统状况,可能有必要配制药剂以穿越血脑屏障(BBB)。一种用于穿过血脑屏障(BBB)的药物投递的策略需要破坏BBB,通过渗透手段诸如甘露醇或白三烯,或以生物化学方式通过使用血管活性物质诸如缓激肽进行。在通过血管内注射施用组合物时,可以与药剂共施用BBB破坏剂。穿过BBB的其它策略可需要使用内源转运系统,包括窖蛋白-1介导的转胞吞,载体介导的转运蛋白诸如葡萄糖和氨基酸载体,受体介导的胰岛素或转铁蛋白转胞吞,和主动流出转运蛋白诸如p-糖蛋白。还可以将主动转运模块与本发明中使用的治疗性化合物缀合以促进转运穿过血管的内皮壁。或者,在BBB后药剂的药物投递可以通过局部投递,例如通过鞘内投递,例如经由Ommaya储器(参见例如美国专利No.5,222,982和5,385,582,通过提及将它们收入本文);通过推注,例如通过注射器,例如玻璃体内或颅内;通过连续输注,例如通过套管插入术,例如用对流(参见例如美国申请No.20070254842,通过提及将其收入本文);或者通过植入其上已经可逆性附加药剂的装置(参见例如美国申请No.20080081064和20090196903,通过提及将其收入本文)。
若在移入前对细胞提供药剂,则将药剂在溶液,或容易可溶形式中方便地添加至培养中的细胞的培养基。可以在流过系统中作为流(间断或连续),或者添加化合物推注(单次或递增)将药剂添加至其它情况下静态的溶液。在流过系统中,使用两种流体,其中一种是生理学中性溶液,而另一种是与添加的测试化合物相同的溶液。将第一种流体通过细胞,接着是第二种。在一种单一溶液方法中,将测试化合物的推注添加至细胞周围的培养基体积。培养基的组分的总体浓度不应随推注的添加或者在流过方法中的两种溶液间显著变化。
可以用不同药剂浓度平行运行多个测定法以获得对各种浓度的差异响应。如本领域中已知的,测定药剂的有效浓度通常使用源自1:10,或其它对数比例稀释的浓度范围。在必要时,可以用第二个稀释系列进一步细化浓度。通常,这些浓度中的一种充当阴性对照,即处于0浓度或低于药剂的检测水平或者处于或低于没有给出表型的可检测变化的药剂浓度。
可以在用药剂处理后的任何时间时实施经移入的经遗传修饰的动物中的细胞对候选药剂的响应的分析。例如,可以在与候选药剂接触后1,2,或3天,有时4,5,或6天,有时8,9,或10天,有时14天,有时21天,有时28天,有时1个月或更多,例如2个月,4个月,6个月或更多分析细胞。在一些实施方案中,分析包括在多个时间点时的分析。为分析选择时间点会基于要实施的分析类型,如普通技术人员会容易理解的。
分析可以包括测量本文中描述的或本领域中已知的任何参数以测量细胞存活力,细胞增殖,细胞身份,细胞形态学,和细胞功能,特别是在它们可以属于免疫细胞的细胞时。例如,可以使用流式细胞术来测定造血细胞的总数目或特定造血细胞类型的细胞数目。可以实施组织化学或免疫组织化学以测定细胞的凋亡状态,例如末端脱氧核苷酸转移酶dUTP切口末端标记(TUNEL)以测量DNA片段化,或免疫组织化学以检测膜联蛋白V对细胞表面上磷脂酰丝氨酸的结合。也可以采用流式细胞术来评估分化细胞类型和分化细胞的比例,例如用以测定造血细胞在药剂存在下存活和/或分化的能力。可以实施ELISA,Western,和Northern印迹以测定经移入的经遗传修饰的小鼠中表达的细胞因子,趋化因子,免疫球蛋白等的水平,例如用以评估移入细胞的功能,评估红细胞的存活,等。也可以实施测试免疫细胞功能的体内测定法,以及与感兴趣的特定疾病或病症(诸如贫血,例如镰状细胞贫血,等)相关的测定法。参见例如Current Protocols in Immunology(Richard Coico编,John Wiley&Sons,Inc.2012)及Immunology Methods Manual(I.Lefkovits编,Academic Press 1997),其公开内容通过提及收入本文。
因此,例如提供了用于测定药剂对病原体可感染或感染的类红细胞的影响的方法,其包括对已经移入有人网织红细胞和/或红细胞的人EPO小鼠(例如Rag2-/-IL2rg-/-EPOm/h小鼠)施用药剂;在药剂存在下随时间测量移入细胞的存活力的参数;并比较所述测量与自没有暴露于所述药剂的经移入的人EPO小鼠的测量。若在单次施用或在选定时间里两次或更多次施用药剂后药剂将小鼠的外周血中的人红细胞的感染和/或死亡降低至少20%,30%,40%或更多,在一些情况中50%,60%,70%或更多,例如80%,90%或100%,即至检测不到的量,则它测定为抗致病的。在一个具体的实施方案中,在移入人造血细胞后至少3天,至少1周,至少10天,例如在移入人造血细胞后2周,3周,或4周,例如在移入人造血细胞后6周,8周,10周或更久施用药物或药物组合。
在本文中别处提供了主题小鼠用途的其它例子。本公开内容中描述的经遗传修饰且经移入的小鼠的别的应用在阅读本公开内容后对于本领域技术人员会是显而易见的。
本公开内容的非限制性方面的例子
上文描述的本主题的各方面(包括各实施方案)可以是单独或与一个或多个其它方面或实施方案组合时有益的。并非限制前面的描述,下文提供了编号1-58的本公开内容的某些非限制性方面。正如本领域技术人员在阅读本公开内容后会明白的,可以使用每一个单独编号的方面或与任何在前或在后的单独编号的方面组合。这意图为各方面的所有此类组合提供支持且不限于下文明确提供的各方面的组合:
1.一种经遗传修饰的非人动物,其包含:
与EPO基因启动子可操作连接的编码人EPO蛋白质(hEPO)的核酸序列。
2.依照1的非人动物,其中所述EPO基因启动子是内源非人EPO启动子。
3.依照1的非人动物,其中所述可操作连接是与非人动物EPO基因座处的内源非人EPO启动子的。
4.依照3的非人动物,其中所述可操作连接导致所述非人EPO基因基因座处的非人EPO基因中的无效突变。
5.依照4的非人动物,其中所述非人动物对于包含所述编码hEPO的核酸序列的等位基因是杂合的。
6.依照4的非人动物,其中所述非人动物对于包含所述编码hEPO的核酸序列的等位基因是纯合的。
7.依照1-6任一项的非人动物,其中所述编码hEPO的核酸序列包含人EPO基因组编码和非编码序列。
8.依照1-6任一项的非人动物,其中所述编码hEPO的核酸序列包含人EPO cDNA序列。
9.依照1-8任一项的非人动物,其中所述非人动物表达一种或多种选自下组的别的人蛋白质:
由在M-csf启动子控制下的核酸编码的hM-CSF蛋白质,
由在Il-3启动子控制下的核酸编码的hIL3蛋白质,
由在Gm-csf启动子控制下的核酸编码的hGM-CSF蛋白质,
由在TPO启动子控制下的核酸编码的hTPO蛋白质,和
由在Sirpa启动子控制下的核酸编码的hSirpa蛋白质。
10.依照9的非人动物,其中所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且其中所述非人动物对于所述非人基因是杂合无效的。
11.依照9的非人动物,其中所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且其中所述非人动物对于所述非人基因是纯合无效的。
12.依照9的非人动物,其中所述人蛋白质至少包括hTPO,hIL3,hGM-CSF,和hSirpa。
13.依照1-12任一项的非人动物,其中所述非人动物是免疫缺陷的。
14.依照13的非人动物,其中所述免疫缺陷是由Rag2和I12rg之一或二者的缺陷引起的。
15.依照1-14任一项的非人动物,其中所述非人动物是哺乳动物。
16.依照15的非人动物,其中所述哺乳动物是啮齿动物。
17.依照16的非人动物,其中所述啮齿动物是小鼠。
18.依照1-17任一项的非人动物,其中所述非人动物进一步包含人造血细胞的移入。
19.依照18的非人动物,其中所述人造血细胞包含一种或多种选自下组的细胞:人CD34阳性细胞,人造血干细胞,人髓样细胞前体细胞,人类红细胞前体细胞,人髓样细胞,人树突细胞,人单核细胞,人粒细胞,人红细胞,人嗜中性粒细胞,人肥大细胞,人胸腺细胞,和人B淋巴细胞。
20.依照19的非人动物,其中所述非人动物包含氯膦酸盐。
21.依照20的非人动物,其中所述非人动物进一步包含靶向类红细胞谱系的人细胞的病原体的感染。
22.依照21的非人动物,其中所述病原体选自疟原虫(Plasmodium sp.),巴贝虫(Babesia sp.),和泰勒虫(Theileri sp.)。
23.一种用于鉴定抑制靶向类红细胞谱系的人细胞的病原体感染的药剂的方法,该方法包括:
a.对经遗传修饰的非人动物施用候选药剂,其中所述动物包含:
i.与EPO基因启动子可操作连接的编码人EPO蛋白质(hEPO)的核酸序列,
ii.一种或多种在所述非人动物中导致免疫缺陷的基因突变,
iii.人造血细胞的移入,和
iv.靶向类红细胞谱系的人细胞的病原体的感染,并
b.测定该药剂是否降低病原体感染的非人动物中所述病原体的量。
24.一种用于鉴定预防靶向类红细胞谱系的人细胞的病原体感染的药剂的方法,该方法包括:
a.使经遗传修饰的非人动物与氯膦酸盐接触,其中所述非人动物包含:
i.与EPO基因启动子可操作连接的编码人EPO蛋白质(hEPO)的核酸序列,
ii.一种或多种在所述非人动物中导致免疫缺陷的基因突变,和
iii.人造血细胞的移入,
b.对经遗传修饰的非人动物施用候选药剂,
c.对该经遗传修饰的非人动物施用受到寄生虫感染的网织红细胞或红细胞,并
d.测定该药剂是否预防所述非人动物的人网织红细胞和/或红细胞的感染。
25.依照23或24的方法,其中所述EPO基因启动子是内源非人启动子。
26.依照23或24的方法,其中所述可操作连接是与非人动物EPO基因座处的内源非人EPO启动子的。
27.依照26的方法,其中所述可操作连接导致所述非人EPO基因基因座处的非人EPO基因中的无效突变。
28.依照27的方法,其中所述非人动物对于包含所述编码hEPO的核酸序列的等位基因是杂合的。
29.依照27的方法,其中所述非人动物对于包含所述编码hEPO的核酸序列的等位基因是纯合的。
30.依照23-29任一项的方法,其中所述编码hEPO的核酸序列包含人EPO基因组编码和非编码序列。
31.依照23-29任一项的方法,其中所述编码hEPO的核酸序列包含人EPO cDNA序列。
32.依照23-31任一项的方法,其中所述非人动物表达一种或多种选自下组的别的人蛋白质:
由在M-csf启动子控制下的核酸编码的hM-CSF蛋白质,
由在Il-3启动子控制下的核酸编码的hIL3蛋白质,
由在Gm-csf启动子控制下的核酸编码的hGM-CSF蛋白质,
由在TPO启动子控制下的核酸编码的hTPO蛋白质,和
由在Sirpa启动子控制下的核酸编码的hSirpa蛋白质。
33.依照32的方法,其中所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且其中所述非人动物对于所述非人基因是杂合无效的。
34.依照33的方法,其中所述启动子是相应的非人动物基因基因座处的内源非人动物启动子,且其中所述非人动物对于所述非人基因是纯合无效的。
35.依照23-34任一项的方法,其中所述非人动物对于Rag2和Il2rg之一或二者是缺陷的。
36.依照23-35任一项的方法,其中所述人造血细胞包含一种或多种选自下组的细胞:人CD34阳性细胞,人造血干细胞,人髓样细胞前体细胞,人类红细胞前体细胞,人髓样细胞,人树突细胞,人单核细胞,人粒细胞,人红细胞,人嗜中性粒细胞,人肥大细胞,人胸腺细胞,和人B淋巴细胞。
37.依照23-36任一项的方法,其中所述病原体选自疟原虫,巴贝虫,和泰勒虫。
38.依照37的方法,其中所述病原体是疟原虫且所述疟原虫选自镰状疟原虫(P.falciparum)和间日疟原虫(P.vivax)。
39.依照23-38任一项的方法,其中所述非人动物是哺乳动物。
40.依照39的方法,其中所述哺乳动物是啮齿动物。
41.依照40的方法,其中所述啮齿动物是小鼠。
42.一种用于生成表达人EPO蛋白质(hEPO)的小鼠的方法,其包括:
使小鼠多能干细胞与包含与EPO启动子序列可操作连接的hEPO或其片段的编码序列的核酸序列接触,其中所述编码序列和EPO启动子序列形成侧翼为与内源小鼠EPO基因座同源的序列的盒,
在促进该核酸序列通过同源重组在内源小鼠EPO基因座处整合入小鼠基因组的条件下培养该多能干细胞;并
自包含编码hEPO的核酸序列的小鼠多能干细胞生成小鼠。
43.依照42的方法,其中所述小鼠多能干细胞是ES细胞或iPS细胞。
44.依照42或43的方法,其中所述小鼠多能干细胞对于Rag2和/或IL2rg是缺陷的。
45.依照42-44任一项的方法,其中所述EPO启动子序列是人EPO启动子的序列。
46.依照42-44任一项的方法,其中所述EPO启动子序列是内源非人EPO启动子的序列。
47.依照42-46任一项的方法,其中所述整合导致非人EPO基因基因座处的非人EPO基因的置换。
48.依照42-47任一项的方法,其中所述编码hEPO的核酸序列包含人EPO基因组编码和非编码序列。
49.依照42-48任一项的方法,其中所述编码hEPO的核酸序列包含人EPO cDNA序列。
50.一种用于生成表达人EPO蛋白质(hEPO)且包含人造血系统的小鼠的方法,其包括:
将包含人造血祖细胞的细胞群体移植入通过依照42-49任一项的方法生成的经遗传修饰的小鼠。
51.依照50的方法,其中所述移植包含尾静脉注射,胎肝注射,或眶后注射。
52.依照50或51的方法,其中所述经遗传修饰的小鼠在移植之前经过亚致死照射。
53.依照50-52任一项的方法,其中所述人造血祖细胞是CD34+细胞。
54.依照50-53任一项的方法,其中所述人造血祖细胞来自胎肝,成人骨髓,或脐带血。
55.一种用于生成受到靶向类红细胞谱系的人细胞的人病原体感染的小鼠的方法,其包括:
依照50-54的方法生成表达人EPO蛋白质(hEPO)且包含人造血系统的小鼠,
对该小鼠注射氯膦酸盐,并
对该小鼠注射受到寄生虫感染的人红血球(PRBC)。
56.依照55的方法,其中所述方法进一步包括将健康人红血球注射入该小鼠。
57.依照55的方法,其中所述寄生虫选自疟原虫,巴贝虫,和泰勒虫。
58.依照57的方法,其中所述寄生虫是疟原虫且所述疟原虫选自镰状疟原虫和间日疟原虫。
实施例
提出以下实施例以给本领域普通技术人员提供如何实施和使用本发明的完整公开内容和描述,而并不意图限制发明人视为其发明的范围,它们也不意图代表下述实验是实施的所有或唯一实验。已经努力确保使用数字(例如量,温度等)的准确性,但是应当考虑一些实验误差和偏差。除非另有说明,份是重量份,分子量是重量平均分子量,温度以摄氏度计,而压力为或接近大气压。
分子和细胞生物化学的通用方法可见于诸如下述标准教科书:Molecular Cloning:A Laboratory Manual,3rd Ed.(Sambrook et al.,HaRBor Laboratory Press 2001);Short Protocols in Molecular Biology;4th Ed.(Ausubel et al.eds.,John Wiley&Sons 1999);Protein Methods(Bollag et al.,John Wiley&Sons 1996);Nonviral Vectors for Gene Therapy(Wagner et al.eds.,Academic Press 1999);Viral Vectors(Kaplift&Loewy eds.,Academic Press 1995);Immunology Methods Manual(I.Lefkovits ed.,Academic Press 1997);和Cell and Tissue Culture:Laboratory Procedures in Biotechnology(Doyle&Griffiths,John Wiley&Sons 1998),通过援引将其公开内容收入本文。本公开内容中提到的用于遗传操作的试剂,克隆载体,和试剂盒可得自供应商,诸如BioRad,Stratagene,Invitrogen,Sigma-Aldrich,和ClonTech。
实施例1
人EPO敲入小鼠的生成。
用来自人促红细胞生成素基因基因座的编码序列(人NCBI基因ID:2056;HGNC:3415;NM_000799.2(SEQ ID NO:3)的RefSeq cDNA转录物和NP_000790(SEQ ID NO:4)的所编码的蛋白质)替换小鼠促红细胞生成素基因基因座处的编码序列(小鼠NCBI基因ID:13856;MGI:95407;NM_007942.2(SEQ ID NO:1)的RefSeq转录物cDNA和NP_031968(SEQ ID NO:2)的所编码的蛋白质)。
表1
具体而言,删除GRCm38:ch5:137482017:137485745(负链)处的小鼠基因组区域并在它的位置插入来自GRCh37:ch7:100318604:100321567(正链)的人基因组序列。这导致小鼠Epo基因的编码外显子1至5(整个编码区)被人EPO基因的外显子1至5加3’人非翻译区替换。总共3729nt小鼠序列被2964nt人序列替换。
简言之,使用遗传工程技术构建用于在单一靶向步骤中用人EPO基因替换小鼠EPO基因的靶向构建体(参见Valenzuela等(2003)见上文,和美国专利No.6,586,251)。分别自细菌人工染色体bMQ-386K4和RP11-797M3获得小鼠和人EPO DNA。将通过缺口修复克隆生成的APspXI线性化靶向构建体电穿孔入Rag2-/-IL2rgY/-ES细胞中,所述靶向构建体含有侧翼为小鼠EPO上游和下游同源臂的2964nt人EPO序列(从外显子1中的ATG延伸至外显子5中的终止密码子,即包括3’下游序列)和侧翼为lox的(floxed)neo选择盒(图2和图3)。小鼠EPO 5’非翻译区(UTR)和人EPO外显子1之间的接合处以SEQ ID NO:5提供,其中人基因的第一个核苷酸前面的最后一个小鼠核苷酸是下文表2中SEQ ID NO:5的非粗体部分中的“G”(在方括号中显示),而人序列的第一个核苷酸是下文表2中SEQ ID NO:5的粗体部分中的“A”(在方括号中显示)。
表2
人3’UTR和选择盒的5’末端之间的接合处以SEQ ID NO:6提供,其中人序列的最后一个核苷酸是下文表3中SEQ ID NO:6的粗体部分中的“C”(在单方括号中显示),而选择盒序列的第一个核苷酸是下文表3中SEQ ID NO:6的非粗体部分中的“C”(在双方括号中显示);下游接合区还含有3’端的loxP位点,其用于去除侧翼为lox的泛素启动子驱动的neo盒。
表3
选择盒的3’末端和小鼠基因组之间的接合处以SEQ ID NO:7提供,其中单方括号中显示的“C”是neo盒的最后一个核苷酸,而该盒后面的小鼠基因组的第一个核苷酸是双方括号中显示的“G”,如下文表4中显示的。
表4
通过天然等位基因丧失(LONA)测定法(Valenzuela等(2003)见上文)鉴定正确靶向的hEPOES细胞克隆,其中通过对小鼠EPO基因中靶向删除的序列特异性的两个TaqManTM定量聚合酶链式反应(qPCR)测定天然的,未修饰的EPO基因的拷贝数。qPCR测定法包含以下引物-探针组(以5’至3’书写):上游正向引物,CATCTGCGACAGTCGAGTTC(SEQ ID NO:8);上游反向引物,CCAGGGAGCTTACCGTGAC(SEQ ID NO:9);上游探针,FAM-AGGTACATCTTAGAGGCCAAGGAGGCA-BHQ(SEQ ID NO:10);下游正向引物,ACAGCCGAGTCCTGGAGAG(SEQ ID NO:11);下游反向引物,AAGCCCTGAGCGTGAGTTC(SEQ ID NO:12);下游探针,FAM-AGGCCAAGGAGGCCGAGAATATCACG-BHQ(SEQ ID NO:13);其中FAM指5-羧基荧光素荧光探针,而BHQ指黑洞淬灭剂型的荧光淬灭剂(Biosearch Technologies)。依照制造商的建议在384孔PCR板(MicroAmpTM光学384孔反应板,Life Technologies)中将自已经摄取靶向载体并且在其基因组中掺入的ES细胞克隆纯化的DNA与TaqManTM基因表达主混合物(Life Technologies)组合,并且在Applied Biosystems Prism 7900HT中循环,其收集PCR过程期间的荧光数据,并且测定阈循环(Ct),即积累的荧光达到预先设置的阈值的分数PCR循环。对每份DNA样品运行上游和下游EPO特异性qPCR和两个针对非靶向性参照基因的qPCR。计算每个EPO特异性qPCR和每个参照基因qPCR之间的Ct值差异(ΔCt),然后计算所有测定样品的每个ΔCt和中值ΔCt之间的差异以对每份样品获得ΔΔCt值。自下述公式计算每份样品中EPO基因的拷贝数:拷贝数=2·2-ΔΔCt。已经丧失其天然拷贝之一的正确靶向的克隆会具有等于1的EPO基因拷贝数。通过包含以下引物-探针组(以5’至3’书写)的TaqManTMqPCR测定法实施人源化等位基因中人EPO基因序列替换删除的小鼠EPO基因序列的确认:人正向引物,GAGCCCTGCACTGGACAAC(SEQ ID NO:14);人反向引物,TCCCATGAACGCTGAGAGTC(SEQ ID NO:15);和人探针,AGGGTCAAGGAGCCATAGACAGAATGGC(SEQ ID NO:16)。
用瞬时Cre表达载体电穿孔正确靶向的ES细胞以去除药物选择盒。为了生成包含人EPO且Rag2和Il2rg缺陷的小鼠,如上所述鉴定正确靶向的ES细胞,并且使用本领域中已知的技术将其导入植入前胚胎中。然后,将人EPO敲入(KI)小鼠回交以生成Rag2和Il2rg缺陷且表达人EPO的小鼠。
实施例2
人SIRPα小鼠的生成。
结合本文中描述的例子中的一些,如美国专利申请公开文本No.2013-0340105(通过援引将其公开内容收入本文)中描述的那样制备包括随机整合入经遗传修饰的小鼠的基因组的编码人SIRPα的核酸序列的经遗传修饰的小鼠。
结合本文中描述的例子中的一些,如下文描述的那样制备人SIRPα敲入小鼠。人SIRPα已知存在至少10种等位基因形式。在这个特定实施例中,采用人SIRPα变体1来人源化小鼠的内源SIRPα基因。
使用技术(参见例如美国专利No.6,586,251和Valenzuela et al.(2003),见上文)构建用于人源化SIRP(例如SIRPα)基因胞外区的打靶载体。
简言之,修饰小鼠细菌人工染色体(BAC)克隆bMQ-261H14以删除内源SIRPα基因的含有外显子2至4的序列并使用人BAC克隆CTD-3035H21插入人SIRPα基因的外显子2至4。将BAC克隆bMQ-261H14中与内源SIRPα基因外显子2至4对应的基因组DNA(~8555bp)用来自BAC克隆CTD-3035H21的含有人SIRPα基因外显子2至4的~8581bp DNA片段替换。BAC克隆CTD-3035H21中所含人SIRPα等位基因的序列分析揭示与人变体1对应的等位基因。将侧翼为loxP位点的新霉素盒添加至含有人SIRPα基因外显子2至4的~8581bp人DNA片段的末端(图4)。
上游和下游同源臂自小鼠BAC DNA分别在外显子2和4的5′和3′位置获得,并添加至~8581bp人片段-新霉素盒以创建最终的用于人源化内源SIRPα基因的打靶载体,其自5′至3′含有5′同源臂(含有内源SIRPα基因外显子2的5′的19kb小鼠DNA),~8581bp DNA片段(含有人SIRPα基因的外显子2至4),侧翼为loxP位点的新霉素盒,和3′同源臂(含有内源SIRPα基因外显子4的3′的21kb小鼠DNA)。打靶载体的靶向插入将新霉素盒定位在小鼠SIRPα基因外显子4和5之间的第五内含子中。打靶载体通过SwaI消化而线性化,然后用于细菌细胞中的同源重组以实现人SIRPα基因外显子2至4对小鼠SIRPα基因中外显子2至4的靶向替换(图4)。
使用靶向BAC DNA(上文描述的)电穿孔小鼠ES细胞以创建包含下述替换的经修饰ES细胞,所述替换为包含人SIRPα基因外显子2至4的基因组片段对内源小鼠SIRPα基因中外显子2至4的替换。使用TAQMANTM探针(Lie and Petropoulos,1998.Curr.Opin.Biotechnology 9:43-48)通过定量PCR来鉴定含有包含人SIRPα基因外显子2至4的基因组片段的阳性ES细胞。跨越上游插入点的核苷酸序列包括下述,其指示与插入点处存在的人SIRPα基因组序列连续连接的插入点上游的内源小鼠序列(下文圆括号内所含的):(AGCTCTCCTACCACTAGACTGCTGAGACCCGCTGCTCTGCTCAGGACTCGATTTCCAGTACACAATCTCCCTCTTTGAAAAGTACCACACATCCTGGGGT)GCTCTTGCATTTGTGTGACACTTTGCTAGCCAGGCTCAGTCCTGGGTTCCAGGTGGGGACTCAAACACACTGGCACGAGTCTACATTGGATATTCTTGGT(SEQ ID NO:17)。跨越新霉素盒5′末端处的下游插入点的核苷酸序列包括下述,其指示与插入点下游的盒序列连续的人SIRPα基因组序列(下文圆括号内所含的,loxP序列为斜体):GCTCCCCATTCCTCACTGGCCCAGCCCCTCTTCCCTACTCTTTCTAGCCCCTGCCTCATCTCCCTGGCTGCCATTGGGAGCCTGCCCCACTGGAAGCCAG(TCGAGATAACTTCGTATAATGTATGCTATACGAAGTTATATGCATGGCCTCCGCGCCGGGTTTTGGCGCCTCCCGCGGGCGCCCCCCTCCTCACGGCGA)(SEQ ID NO:18)。跨越新霉素盒3′末端处的下游插入点的核苷酸序列包括下述,其指示与内源SIRPα基因外显子4的3′的小鼠基因组序列连续的盒序列(下文圆括号内所含的):CATTCTCAGTATTGTTTTGCCAAGTTCTAATTCCATCAGACCTCGACCTGCAGCCCCTAGATAACTTCGTATAATGTATGCTATACGAAGTTATGCTAGC(TGTCTCATAGAGGCTGGCGATCTGGCTCAGGGACAGCCAGTACTGCAAAGAGTATCCTTGTTCATACCTTCTCCTAGTGGCCATCTCCCTGGGACAGTCA)(SEQ ID NO:19)。然后使用方法(参见例如美国专利No.7,294,754和Poueymirou et al.2007,F0generation mice that are essentially fully derived from the donor gene-targeted ES cells allowing immediate phenotypic analyses Nature Biotech.25(1):91-99,见上文)使用阳性ES细胞克隆植入雌性小鼠以生成一窝含有人SIRPα基因外显子2至4插入小鼠内源SIRPα基因的幼畜。
使用上文所述靶定ES细胞作为供体ES细胞并通过方法(见上文)导入8细胞阶段的小鼠胚胎。使用检测人SIRPα基因序列的存在的改良的等位基因测定法(Valenzuela et al.(2003),见上文)通过基因分型来鉴定携带内源SIRPα基因外显子2至4人源化的小鼠。
可以将携带人源化SIRPα基因构建物(即在小鼠SIRPα基因中含有人SIRPα外显子2至4)的小鼠与Cre删除小鼠株(参见例如国际专利申请公开文本No.WO 2009/114400)育种以去除例如在ES细胞阶段或在胚胎中未去除的由打靶载体引入的任何侧翼为lox的新霉素盒。任选地,在小鼠中保留新霉素盒。
实施例3
复合敲入小鼠的生成。
将人EPO敲入小鼠与表达其它感兴趣人基因(或是作为进入小鼠基因组的随机整合物或是作为敲入,即自相应的小鼠基因座)的小鼠杂交。例如,将Rag2-/-,IL-2rgY/-,hEPO KI小鼠与如上所述自小鼠TPO基因座表达人TPO(Rongvaux et al.,2011,Proc Natl Acad Sci USA,108(6):2378-2383),自小鼠IL-3/GM-CSF基因座表达人IL-3和人GM-CSF(Willinger et al,2011,Proc Natl Acad Sci USA,108(6):2390-2395),自小鼠M-CSF基因座表达人M-CSF(Rathinam et al,2011,Blood,118(11):3119-3128),和/或作为随机整合物(Strowig et al.,2011,Proc Natl Acad Sci USA,108(32):13218-13223)或自小鼠基因座表达人SIRPa的小鼠杂交以生成表达这些人蛋白质的组合(Rag2-/-Il2rg无效hSIRPah/hTpoh/hMcsfh/hIl3/Gmcsfh/hEpOh/h)的小鼠。表达人TPO,人IL-3,人GM-CSF,人M-CSF,和人SIRPa中一种或多种的经遗传修饰的小鼠极为详细地描述于美国专利No.8,541,646和8,847,004;美国专利申请公开文本No.2014/0134662;和PCT国际公开文本No.WO/2014/039782;通过援引将其公开内容收入本文。
实施例4
用于血液阶段的镰状疟原虫和间日疟原虫的人源化小鼠模型的开发
本文中证明了通过提供具有有限的自小鼠至人的交叉反应性的生长因子来遗传人源化鼠宿主能成功强化一般而言的人细胞移入和具体而言的人造血干细胞(HSC)移入的小鼠中的红细胞生成。
自它们的基因组表达人EPO(以增强终末红细胞生成)以及人TPO,MCSF,和IL-3(以增强HSC维持和早期红细胞生成)的MITERG小鼠特征在于人HSC移入的小鼠的骨髓中比不表达hEPO的小鼠更高水平的人红细胞生成(图5A,比较“hSIRPa-,hEPO+”(即“MITERG小鼠”)与“hSIRPa-,hEPO-”(即“MITRG小鼠”)),事实上等同于相同动物中的小鼠红细胞生成。然而,这些小鼠缺乏显著水平的循环人类红细胞(未显示的数据)。
假设了外周中低水平的循环人类红细胞源自小鼠巨噬细胞对外周人RBC的破坏(噬红细胞作用)。通过生成自小鼠基因组中除mSIRPa基因座以外的基因座即作为随机整合的转基因表达hSIRPa的小鼠,即作为hSIRPa-tg(Rag2-/-Il2rg无效Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hSIRPα-tg+,即“MISTER-G小鼠”)和作为敲入(KI)自mSIRPa基因座表达hSIRPa的小鼠,即作为hSIRPa KI(Rag2-/-Il2rg无效Tpoh/hMcsfh/hIl3h/hGmcsfh/hEpoh/hSIRPαh/h,即“SupER-G小鼠”),评估了SIRPa在这个过程中的作用。
例如作为MISTER-G小鼠中随机整合的转基因,人SIRPa的表达促进表达人EPO的人HSC移入的小鼠的骨髓中人类红细胞数目的进一步增多(图5,小图A,比较“hSIRPa+,hEPO+”与“hSIRPa-,hEPO+”)。人SIRPa的引入显著改善外周中大多数造血细胞的存活,其中外周血中人CD45+细胞(包括淋巴样和髓样细胞)的频率比在不表达hSIRPa的小鼠中观察到的提高至少10倍。然而,hSIRPa KI对于外周血中人RBC的移入水平具有很小的影响(图5,小图B)。
由于人SIRPα敲入不足以提高外周血中的人类红细胞,因而使用氯膦酸盐脂质体来消减巨噬细胞,具体是脾中的红髓巨噬细胞和肝中的Kupffer细胞。通过氯膦酸盐脂质体消减驻留组织的巨噬细胞之后,在SuPER-G小鼠中观察到类红细胞谱系的循环人细胞显著增多至总循环类红细胞的1%(图6,小图A)。另外,氯膦酸盐处理之后外周中的大多数人类红细胞是网织红细胞(CD71+)(图6,小图B)。这是一项令人兴奋的观察结果,因为它指示这些小鼠会是较好的候选者来支持优先感染网织红细胞的间日疟原虫感染。
类红细胞感染是疟原虫的生命周期的一个必要部分。然而,不同疟原虫种的成功体内感染所必需的人RBC的所需频率尚未确立。当前可得的镰状疟原虫的唯一体内模型基于将人RBC转移入免疫缺陷株诸如NOD/scid或NSG。在这些小鼠中,只有在每天注射大量人红细胞之后才能通过i.v.注射受到感染的红细胞实现裂殖子感染。在感染时,人RBC占这些动物中总红细胞数目的大约一半。
如上文证明的,移入有人造血干细胞(HSC)的SupER-G小鼠在骨髓中发育人类红细胞(图5B),和ii)氯膦酸盐处理提高经移入的SupER-G小鼠的外周中人类红细胞的频率(图6)。为了确定经移入的,氯膦酸盐处理的SupER-G小鼠是否在外周中包含足够数目的人类红细胞以维持成功的体内疟原虫感染,自移入有胎肝或成人HSC的SupER-G小鼠收集外周血,并在体外与镰状疟原虫株3D7感染的血液一起培养该血液。为了推动多轮寄生虫复制,48小时后将新鲜人红血球添加入感染培养物,预期通过再感染后续添加的人RBC而实现的扩增只会在自HSC移入的SupER-G小鼠收获的人RBC产生了镰状疟原虫的整个感染周期的情况中发生。感染之后12天,在所有来自经移入的SuPER-G小鼠的血液样品(“经移入的小鼠RBC,成人1”,“经移入的小鼠RBC,成人2”,和“经移入的小鼠RBC,胎肝”)中观察到寄生虫感染的晚期阶段和来自裂殖体的裂殖子的扩增,但是来自未移入的或通过注射急性移入0.1%hRBC的对照小鼠(“搀混对照”)的血液样品不然(图7A和未显示的数据)。通过吉姆萨染色和定量PCR观察到寄生虫血症的指数式增长(图7B)。这指示经移入的,用氯膦酸盐处理的SupER-G生成足够数目的人红血球以维持镰状疟原虫感染。自此,预期用镰状疟原虫和间日疟原虫裂殖子体内感染进行了氯膦酸盐给药的经移入的小鼠会是成功的。
实施例5
TIES小鼠(Rag2-/-Il2rg无效Tpoh/hIl3/Gmcsfh/hEpoh/mSIRPαh/h)
由于低生育力,发育无能和高死亡率,具有Epoh/h的小鼠对于感染研究是不理想的。反而,对于hEPO基因是杂合的小鼠(即Epoh/m,例如TIES小鼠)完全能够生成促红细胞生成素(EPO)及支持红细胞生成的所有阶段。通过在小鼠基因座处保留小鼠M-CSF基因而非用人M-CSF替换它,实现了存活力自8-10周进一步改进至4个月,因为得到人巨噬细胞集落刺激因子(M-CSF)敲入支持的高水平的人髓样细胞移入引起对小鼠红血球的破坏,这导致经移入的小鼠贫血和死亡。
与SupER-G小鼠一样,如果进行氯膦酸盐给药的话,TIES小鼠支持人红细胞生成且维持外周血中1%人类红细胞的频率。另外,氯膦酸盐处理之后外周中的大多数人类红细胞是网织红细胞(CD71+)。这提示这些小鼠会是较好的候选者来支持间日疟原虫感染。
证明了如果进行氯膦酸盐给药的话,经移入的TIES小鼠能维持外周血中1%人类红细胞的频率。另外,测定了TIES小鼠支持人RBC输注的能力。如图8中显示的,氯膦酸盐处理将输注的群体稳定化于外周中细胞总群体的超过20%。在输注之后约4小时实现的这些水平在输注之后维持至少12小时。预期这些RBC频率会足以支持不同种的疟原虫的体内感染。
上文仅例示本发明的原则。应当领会,本领域技术人员会能够想出各种排列,虽然本文中没有明确描述或显示,但是其体现本发明的原则,并且包含在其精神和范围内。此外,本文中叙述的所有例子和条件语言在原则上意图帮助读者了解本发明的原则和发明人促成技术进步的概念,而且应解释为不限于此类具体叙述的例子和条件。此外,本文中叙述本发明原则,方面和实施方案及其具体例子的所有陈述意图涵盖其结构和功能等同方案两者。因而,此类等同方案包括目前已知的等同方案和未来开发的等同方案两者,即,包括为实施相同功能而开发的,与结构无关的任何要素。因此,本发明的范围并不意图限于本文中显示及描述的例示性实施方案。而所附权利要求书体现本发明的范围和精神。
序列表
<110> 再生元制药公司(Regeneron Pharmaceuticals, Inc.)
耶鲁大学(Yale University)
生物医学研究院(Institute for Research in Biomedicine (IRB))
A·J·墨菲(Murphy, Andrew J.)
S·史蒂文斯(Stevens, Sean)
R·弗拉维尔(Flavell, Richard)
M·曼茨(Manz, Markus)
单亮(Shan, Liang)
<120> 表达人EPO的经遗传修饰的非人动物
<130> REGN-013WO
<150> US62/000,460
<151> 2014-05-19
<160> 19
<170> PatentIn version 3.5
<210> 1
<211> 715
<212> DNA
<213> 小鼠(Mus musculus)
<400> 1
gatgaagact tgcagcgtgg acactggccc agccccgggt cgctaaggag ctccggcagc 60
taggcgcgga gatgggggtg cccgaacgtc ccaccctgct gcttttactc tccttgctac 120
tgattcctct gggcctccca gtcctctgtg ctcccccacg cctcatctgc gacagtcgag 180
ttctggagag gtacatctta gaggccaagg aggcagaaaa tgtcacgatg ggttgtgcag 240
aaggtcccag actgagtgaa aatattacag tcccagatac caaagtcaac ttctatgctt 300
ggaaaagaat ggaggtggaa gaacaggcca tagaagtttg gcaaggcctg tccctgctct 360
cagaagccat cctgcaggcc caggccctgc tagccaattc ctcccagcca ccagagaccc 420
ttcagcttca tatagacaaa gccatcagtg gtctacgtag cctcacttca ctgcttcggg 480
tactgggagc tcagaaggaa ttgatgtcgc ctccagatac caccccacct gctccactcc 540
gaacactcac agtggatact ttctgcaagc tcttccgggt ctacgccaac ttcctccggg 600
ggaaactgaa gctgtacacg ggagaggtct gcaggagagg ggacaggtga catgctgctg 660
ccaccgtggt ggaccgacga acttgctccc cgtcactgtg tcatgccaac cctcc 715
<210> 2
<211> 192
<212> PRT
<213> 小鼠(Mus musculus)
<400> 2
Met Gly Val Pro Glu Arg Pro Thr Leu Leu Leu Leu Leu Ser Leu Leu
1 5 10 15
Leu Ile Pro Leu Gly Leu Pro Val Leu Cys Ala Pro Pro Arg Leu Ile
20 25 30
Cys Asp Ser Arg Val Leu Glu Arg Tyr Ile Leu Glu Ala Lys Glu Ala
35 40 45
Glu Asn Val Thr Met Gly Cys Ala Glu Gly Pro Arg Leu Ser Glu Asn
50 55 60
Ile Thr Val Pro Asp Thr Lys Val Asn Phe Tyr Ala Trp Lys Arg Met
65 70 75 80
Glu Val Glu Glu Gln Ala Ile Glu Val Trp Gln Gly Leu Ser Leu Leu
85 90 95
Ser Glu Ala Ile Leu Gln Ala Gln Ala Leu Leu Ala Asn Ser Ser Gln
100 105 110
Pro Pro Glu Thr Leu Gln Leu His Ile Asp Lys Ala Ile Ser Gly Leu
115 120 125
Arg Ser Leu Thr Ser Leu Leu Arg Val Leu Gly Ala Gln Lys Glu Leu
130 135 140
Met Ser Pro Pro Asp Thr Thr Pro Pro Ala Pro Leu Arg Thr Leu Thr
145 150 155 160
Val Asp Thr Phe Cys Lys Leu Phe Arg Val Tyr Ala Asn Phe Leu Arg
165 170 175
Gly Lys Leu Lys Leu Tyr Thr Gly Glu Val Cys Arg Arg Gly Asp Arg
180 185 190
<210> 3
<211> 1340
<212> DNA
<213> 人(homo sapiens)
<400> 3
cccggagccg gaccggggcc accgcgcccg ctctgctccg acaccgcgcc ccctggacag 60
ccgccctctc ctccaggccc gtggggctgg ccctgcaccg ccgagcttcc cgggatgagg 120
gcccccggtg tggtcacccg gcgcgcccca ggtcgctgag ggaccccggc caggcgcgga 180
gatgggggtg cacgaatgtc ctgcctggct gtggcttctc ctgtccctgc tgtcgctccc 240
tctgggcctc ccagtcctgg gcgccccacc acgcctcatc tgtgacagcc gagtcctgga 300
gaggtacctc ttggaggcca aggaggccga gaatatcacg acgggctgtg ctgaacactg 360
cagcttgaat gagaatatca ctgtcccaga caccaaagtt aatttctatg cctggaagag 420
gatggaggtc gggcagcagg ccgtagaagt ctggcagggc ctggccctgc tgtcggaagc 480
tgtcctgcgg ggccaggccc tgttggtcaa ctcttcccag ccgtgggagc ccctgcagct 540
gcatgtggat aaagccgtca gtggccttcg cagcctcacc actctgcttc gggctctggg 600
agcccagaag gaagccatct cccctccaga tgcggcctca gctgctccac tccgaacaat 660
cactgctgac actttccgca aactcttccg agtctactcc aatttcctcc ggggaaagct 720
gaagctgtac acaggggagg cctgcaggac aggggacaga tgaccaggtg tgtccacctg 780
ggcatatcca ccacctccct caccaacatt gcttgtgcca caccctcccc cgccactcct 840
gaaccccgtc gaggggctct cagctcagcg ccagcctgtc ccatggacac tccagtgcca 900
gcaatgacat ctcaggggcc agaggaactg tccagagagc aactctgaga tctaaggatg 960
tcacagggcc aacttgaggg cccagagcag gaagcattca gagagcagct ttaaactcag 1020
ggacagagcc atgctgggaa gacgcctgag ctcactcggc accctgcaaa atttgatgcc 1080
aggacacgct ttggaggcga tttacctgtt ttcgcaccta ccatcaggga caggatgacc 1140
tggagaactt aggtggcaag ctgtgacttc tccaggtctc acgggcatgg gcactccctt 1200
ggtggcaaga gcccccttga caccggggtg gtgggaacca tgaagacagg atgggggctg 1260
gcctctggct ctcatggggt ccaagttttg tgtattcttc aacctcattg acaagaactg 1320
aaaccaccaa aaaaaaaaaa 1340
<210> 4
<211> 193
<212> PRT
<213> 人(homo sapiens)
<400> 4
Met Gly Val His Glu Cys Pro Ala Trp Leu Trp Leu Leu Leu Ser Leu
1 5 10 15
Leu Ser Leu Pro Leu Gly Leu Pro Val Leu Gly Ala Pro Pro Arg Leu
20 25 30
Ile Cys Asp Ser Arg Val Leu Glu Arg Tyr Leu Leu Glu Ala Lys Glu
35 40 45
Ala Glu Asn Ile Thr Thr Gly Cys Ala Glu His Cys Ser Leu Asn Glu
50 55 60
Asn Ile Thr Val Pro Asp Thr Lys Val Asn Phe Tyr Ala Trp Lys Arg
65 70 75 80
Met Glu Val Gly Gln Gln Ala Val Glu Val Trp Gln Gly Leu Ala Leu
85 90 95
Leu Ser Glu Ala Val Leu Arg Gly Gln Ala Leu Leu Val Asn Ser Ser
100 105 110
Gln Pro Trp Glu Pro Leu Gln Leu His Val Asp Lys Ala Val Ser Gly
115 120 125
Leu Arg Ser Leu Thr Thr Leu Leu Arg Ala Leu Gly Ala Gln Lys Glu
130 135 140
Ala Ile Ser Pro Pro Asp Ala Ala Ser Ala Ala Pro Leu Arg Thr Ile
145 150 155 160
Thr Ala Asp Thr Phe Arg Lys Leu Phe Arg Val Tyr Ser Asn Phe Leu
165 170 175
Arg Gly Lys Leu Lys Leu Tyr Thr Gly Glu Ala Cys Arg Thr Gly Asp
180 185 190
Arg
<210> 5
<211> 226
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(115)
<223> 小鼠序列
<220>
<221> misc_feature
<222> (116)..(128)
<223> 人外显子1
<220>
<221> misc_feature
<222> (116)..(226)
<223> 人序列
<400> 5
tcttccaggc tagtggggtg atctggccct acagaacttc caaggatgaa gacttgcagc 60
gtggacactg gcccagcccc gggtcgctaa ggagctccgg cagctaggcg cggagatggg 120
ggtgcacggt gagtactcgc gggctgggcg ctcccgcccg cccgggtccc tgtttgagcg 180
gggatttagc gccccggcta ttggccagga ggtggctggg ttcaag 226
<210> 6
<211> 1054
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(115)
<223> 人外显子5
<220>
<221> misc_feature
<222> (1)..(926)
<223> 人序列
<220>
<221> misc_feature
<222> (927)..(1054)
<223> 选择盒的5'端
<400> 6
actccgaaca atcactgctg acactttccg caaactcttc cgagtctact ccaatttcct 60
ccggggaaag ctgaagctgt acacagggga ggcctgcagg acaggggaca gatgaccagg 120
tgtgtccacc tgggcatatc caccacctcc ctcaccaaca ttgcttgtgc cacaccctcc 180
cccgccactc ctgaaccccg tcgaggggct ctcagctcag cgccagcctg tcccatggac 240
actccagtgc cagcaatgac atctcagggg ccagaggaac tgtccagaga gcaactctga 300
gatctaagga tgtcacaggg ccaacttgag ggcccagagc aggaagcatt cagagagcag 360
ctttaaactc agggacagag ccatgctggg aagacgcctg agctcactcg gcaccctgca 420
aaatttgatg ccaggacacg ctttggaggc gatttacctg ttttcgcacc taccatcagg 480
gacaggatga cctggagaac ttaggtggca agctgtgact tctccaggtc tcacgggcat 540
gggcactccc ttggtggcaa gagccccctt gacaccgggg tggtgggaac catgaagaca 600
ggatgggggc tggcctctgg ctctcatggg gtccaagttt tgtgtattct tcaacctcat 660
tgacaagaac tgaaaccacc aatatgactc ttggcttttc tgttttctgg gaacctccaa 720
atcccctggc tctgtcccac tcctggcagc agtgcagcag gtccaggtcc gggaaacgag 780
gggtggaggg ggctgggccc tacgtgctgt ctcacacagc ctgtctgacc tctcgaccct 840
accgggcctg aggccacaag ctctgcctac gctggtcaat aaggtgtctc cattcaaggc 900
ctcaccgcag taaggcagct gccaacctcg agataacttc gtataatgta tgctatacga 960
agttatatgc atggcctccg cgccgggttt tggcgcctcc cgcgggcgcc cccctcctca 1020
cggcgagcgc tgccacgtca gacgaagggc gcag 1054
<210> 7
<211> 243
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(121)
<223> 选择盒的3'端
<220>
<221> misc_feature
<222> (122)..(243)
<223> 小鼠序列
<400> 7
gcctctgttc cacatacact tcattctcag tattgttttg ccaagttcta attccatcag 60
acctcgacct gcagccccta gataacttcg tataatgtat gctatacgaa gttatgctag 120
cgccaacccg ctaggacaag tgctgagtga gctggggcca ccgtttgagg aaacaggagc 180
cagtacagag gggttcccct ttaggggttg gtggcaatgg gcgaccctgg ttaatggatc 240
att 243
<210> 8
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 8
catctgcgac agtcgagttc 20
<210> 9
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 9
ccagggagct taccgtgac 19
<210> 10
<211> 27
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 10
aggtacatct tagaggccaa ggaggca 27
<210> 11
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 11
acagccgagt cctggagag 19
<210> 12
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 12
aagccctgag cgtgagttc 19
<210> 13
<211> 26
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 13
aggccaagga ggccgagaat atcacg 26
<210> 14
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 14
gagccctgca ctggacaac 19
<210> 15
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 15
tcccatgaac gctgagagtc 20
<210> 16
<211> 28
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<400> 16
agggtcaagg agccatagac agaatggc 28
<210> 17
<211> 200
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(100)
<223> 小鼠序列
<220>
<221> misc_feature
<222> (101)..(200)
<223> 人序列
<400> 17
agctctccta ccactagact gctgagaccc gctgctctgc tcaggactcg atttccagta 60
cacaatctcc ctctttgaaa agtaccacac atcctggggt gctcttgcat ttgtgtgaca 120
ctttgctagc caggctcagt cctgggttcc aggtggggac tcaaacacac tggcacgagt 180
ctacattgga tattcttggt 200
<210> 18
<211> 199
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(100)
<223> 新霉素盒的5'端
<220>
<221> misc_feature
<222> (101)..(199)
<223> 人序列
<220>
<221> misc_feature
<222> (106)..(139)
<223> LoxP
<400> 18
gctccccatt cctcactggc ccagcccctc ttccctactc tttctagccc ctgcctcatc 60
tccctggctg ccattgggag cctgccccac tggaagccag tcgagataac ttcgtataat 120
gtatgctata cgaagttata tgcatggcct ccgcgccggg ttttggcgcc tcccgcgggc 180
gcccccctcc tcacggcga 199
<210> 19
<211> 200
<212> DNA
<213> 人工序列
<220>
<223> 合成的多核苷酸序列
<220>
<221> misc_feature
<222> (1)..(100)
<223> 新霉素盒的3'端
<220>
<221> misc_feature
<222> (101)..(200)
<223> 小鼠外显子4
<400> 19
cattctcagt attgttttgc caagttctaa ttccatcaga cctcgacctg cagcccctag 60
ataacttcgt ataatgtatg ctatacgaag ttatgctagc tgtctcatag aggctggcga 120
tctggctcag ggacagccag tactgcaaag agtatccttg ttcatacctt ctcctagtgg 180
ccatctccct gggacagtca 200
- 还没有人留言评论。精彩留言会获得点赞!