细胞的不依赖于生长的检测的制作方法
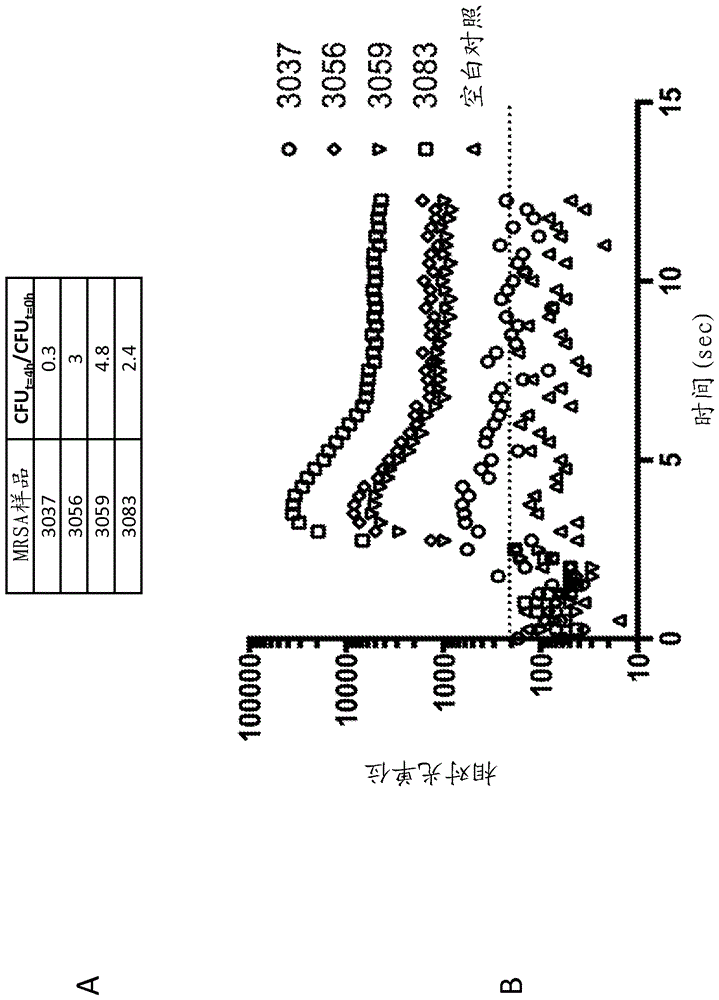
本申请要求于2014年6月13日提交的美国临时申请号62/011,660的利益;所述美国临时申请为了所有目的在此以其整体通过引用并入。序列表本申请含有已经以ASCII格式电子提交且在此以其整体通过引用并入的序列表。于2015年6月10日创建的所述ASCII拷贝命名为29449PCT_CRF_sequencelisting.txt,并且大小为25千字节。背景在研究实验室中,许多采用细胞的研究使用培养细胞进行,所述培养细胞通常显示出对数生长。然而,在自然界中,细胞很少处于对数生长率且通常处于静止状态。这种现象是用于检测细胞的临床诊断开发中的重要考虑,因为临床样品可以含有并非处于支持最佳生长的代谢状态的细胞。在一些情况下,可以获得在预期检测细胞的测定条件下不生长的细胞。像这样,当就直接来自临床或环境样品的细胞的存在进行测试时,采用不依赖于细胞生长而操作的测定通常可以是重要的。即使当细胞被分离且在实验室中进行培养时,仍可以存在其中分离细胞的个别品系可以显示出不同生长特征的情况。当此类细胞显示出次佳生长时,这可以导致不被一般要求生长的测定检测的细胞。WO2014/145899的实施例9例示了这种情况(参见第80页,第2行-第82页,第33行和图26B)。在该测定中,金黄色葡萄球菌(S.aureus)细胞就在克林霉素的存在下的生长进行监测。测定意图用于区分克林霉素敏感相对于抗性表型,其基于在克林霉素的存在下细菌的生长率进行确定。在测定中,因为分离物显示出次佳生长率,细菌的一个克林霉素抗性分离物被误解为克林霉素敏感的。像这样,一般要求最低限度生长量或最低限度生长率的测定可能无法检测在测定期间未显示出所需生长特征的靶细胞。相关专利申请包括:于2014年3月13日提交的PCT/US2014/026536,其为了所有目的在此以其整体通过引用并入。概述本文公开的是不依赖于细胞生长进行操作的细胞检测方法。虽然现有细胞检测方法获益于细胞生长,但本文公开的方法证实了不依赖于细胞生长的实施方案。本文公开的方法一般不依赖于生长-这对于检测处于不支持足够生长的代谢状态的细胞(例如在临床样品中遇到的细胞)和具有低于预期生长率的细胞品系可以是重要特点。本文公开的是用于细胞的不依赖于生长的检测的各种方法、系统和组合物。例如,本文公开的方法可以包括用于检测样品中的目标微生物的不依赖于生长的方法,其包括:使样品与多个非复制型转导颗粒(NRTP)接触,使得多个NRTP转导样品中的一种或多种目标微生物,其中多个NRTP包含报道核酸序列,并且其中一种或多种目标微生物的生长率小于对数期;提供用于活化报道核酸序列的条件;并且检测由报道核酸序列产生的信号,其中信号的存在指示一种或多种目标微生物的存在,并且其中信号的不存在指示一种或多种目标微生物的不存在。作为进一步的例子,本文公开的组合物可以包括包含多个非复制型转导颗粒(NRTP)和一种或多种目标微生物的样品或细胞培养物,任选地其中多个NRTP包含报道核酸序列,并且其中一种或多种目标微生物的生长率小于对数期。附图的几个视图的简述本发明的这些及其他特点、方面和优点就下述描述和附图而言将得到更佳理解,其中:图1-图1A概括了在测定结束时和在测定开始时MRSA的菌落形成单位(CFU)计数比率,其中大多数样品在4小时测定期间显示出最低限度生长(例如1-2次分裂),其中2个样品显示生长中的减少(48和60),一个样品显示无生长(51),并且3个样品显示小于0.4次分裂/小时(40、51和81)。图1B显示测试的所有样品均产生超过本底的阳性信号(相对光单位;RLU)。图2-图2A概括了在测定结束时和在测定开始时MRSA的CFU计数比率,其中大多数样品在4小时测定期间显示出最低限度生长(例如1-2次分裂),并且一个样品(3037)显示生长中的减少。图2B显示所有样品均在测定期间产生超过本底的阳性信号(RLU)。详述除非另有说明,否则在权利要求和说明书中使用的术语如下所述定义。如本文使用的,“报道核酸分子”或“报道核酸序列”指包含能够产生信号的DNA或RNA分子的核苷酸序列。报道核酸分子可以是天然存在的或者人工或合成分子。在一些实施方案中,报道核酸分子对于宿主细胞是外源的,并且可以作为外源核酸分子例如质粒或载体的部分引入宿主细胞内。在某些实施方案中,报道核酸分子可以与细胞中的靶基因互补。在其他实施方案中,报道核酸分子包含编码报道分子(例如报道酶、蛋白质)的报道基因。在一些实施方案中,报道核酸分子被称为“报道构建体”或“核酸报道构建体”。“报道分子”或“报道物”指对生物赋予可检测或可选择表型的分子(例如核酸或蛋白质)。可检测表型可以是例如比色的、荧光的或发光的。报道分子可以由下述表达:编码介导发光反应的酶(luxA、luxB、luxAB、luc、ruc、nluc)的报道基因、编码介导比色反应的酶(lacZ、HRP)的基因、编码荧光蛋白(GFP、eGFP、YFP、RFP、CFP、BFP、mCherry、近红外荧光蛋白)的基因、编码亲和肽(His-标签、3X-FLAG)的核酸分子、以及编码可检测标记物(ampC、tet(M)、CAT、erm)的基因。报道分子可以用作将核酸分子或外源序列(质粒)成功摄取到细胞内的标记物。报道分子还可以用于指示靶基因、靶核酸分子、靶细胞内分子或细胞的存在,如本文描述的。可选地,报道分子可以是核酸,例如适体或核酶。在本发明的一些方面,报道核酸分子与启动子可操作地连接。在本发明的其他方面,启动子可以被选择或设计为基于启动子在特定细胞(例如特定物种)而不是其他细胞中的活性,促成报道系统的反应性和交叉反应性。在某些方面,报道核酸分子包含复制起点。在其他方面,当基于复制起点在特定细胞(例如特定物种)而不是其他细胞中的活性,报道核酸分子在靶细胞内的复制促成报道信号产生或是报道信号产生所需的时,复制起点的选择可以类似地促成报道系统的反应性和交叉反应性。在一些实施方案中,报道核酸分子形成能够在病毒复制期间作为多联DNA包装到子代病毒内的复制子。“可检测的存活指示”指与细胞相关的指示剂,其可以被观察到且证实细胞是更多还是更少存活或者它的活力例如相对于对照细胞是否受影响,其中对照细胞可以是在不同时间点时的相同细胞或分开的细胞。例子包括一种或多种信号、一种或多种报道物、一种或多种标记物、其生长或缺乏、光(例如由萤光素酶发出的光)或其缺乏等。如本文使用的,“靶转录物”指DNA序列或mRNA分子的核苷酸序列的一部分,所述mRNA分子由靶细胞天然形成,包括在靶基因的转录期间形成的那种和其为初级转录产物的RNA加工产物的mRNA。靶转录物还可以被称为细胞转录物或天然存在的转录物。如本文使用的,术语“转录物”指由DNA或RNA模板序列或基因转录的核苷酸序列(DNA或RNA)的长度。转录物可以是由RNA模板转录的cDNA序列或由DNA模板转录的mRNA序列。转录物可以是蛋白质编码或非编码的。转录物还可以由经工程改造的核酸构建体进行转录。衍生自报道核酸分子的转录物可以被称为“报道转录物”。报道转录物可以包括报道序列和顺式阻遏序列。报道转录物可以具有形成互补性区域的序列,使得转录物包括形成双链体(例如分子间双链体区域)的两个区域。一个区域可以被称为“顺式阻遏序列”且具有与靶转录物和/或报道序列的一部分或全部的互补性。转录物的第二区域称为“报道序列”且可以具有与顺式阻遏序列的互补性。互补性可以是完全互补性或基本互补性。顺式阻遏序列的存在和/或与报道序列的结合可以形成报道转录物中的构象,所述构象可以阻断报道分子的进一步表达。报道转录物可以形成二级结构,例如发夹结构,使得在彼此互补的报道转录物内的区域可以与彼此杂交。当指核酸分子或外源序列(例如质粒、载体、构建体)时,“引入细胞内”意指促进摄取或吸收到细胞内,如本领域技术人员理解的。核酸构建体或转录物的吸收或摄取可以通过无辅助扩散或活性细胞过程,或者通过辅助试剂或装置包括经由细菌噬菌体、病毒和转导颗粒的使用来发生。该术语的含义并不限于体外细胞;核酸分子还可以被“引入细胞内”,其中细胞是活生物的部分。在此类情况下,引入细胞内将包括对生物的递送。例如,对于体内递送,本发明的核酸分子、构建体或载体可以注射到组织部位内或全身施用。体外引入细胞内包括本领域已知的方法,例如电穿孔和脂转染。进一步的方法在本文中描述或是本领域已知的。“质粒”是小DNA分子,其与细胞内的染色体DNA物理分开且可以不依赖于染色体DNA而复制。最通常作为小环状双链DNA分子在细菌中发现,质粒有时存在于古细菌和真核生物中。质粒被视为复制子,能够在合适宿主内自主复制。“载体”是用作媒介物以将外来遗传材料人工携带到另一种细胞内的核酸分子,它可在其中复制和/或表达。“病毒”是仅在其他生物的活细胞内复制的小传染剂。病毒颗粒(称为病毒粒子)包括两个或三个部分:i)由携带遗传信息的DNA或RNA分子制成的遗传材料;ii)保护这些基因的蛋白质外壳;以及在一些情况下,iii)围绕蛋白质外壳的脂质包膜。“MRSA”指甲氧西林抗性金黄色葡萄球菌。“MSSA”指甲氧西林敏感性金黄色葡萄球菌。术语“改善”指导致疾病状态例如疾病状态治疗的任何治疗有益结果,包括预防、严重性或进展中的减轻、缓解或其治愈。术语“原位”指在与活生物分开生长例如在组织培养中生长的活细胞中发生的过程。术语“体内”指在活生物中发生的过程。如本文使用的,术语“哺乳动物”包括人和非人两者,并且包括但不限于人、非人灵长类动物、犬、猫、鼠、牛、马和猪。“G”、“C”、“A”和“U”各自一般分别代表含有鸟嘌呤、胞嘧啶、腺嘌呤和尿嘧啶作为碱基的核苷酸。“T”和“dT”在本文中可互换使用,并且指其中核碱基是胸腺嘧啶例如脱氧胸腺嘧啶的脱氧核糖核苷酸。然而,应理解术语“核糖核苷酸”或“核苷酸”或“脱氧核糖核苷酸”还可以指如下文进一步详述的经修饰的核苷酸,或替代替换部分。技术人员熟知鸟嘌呤、胞嘧啶、腺嘌呤和尿嘧啶可以被其他部分替换,而基本上不改变包含具有此类替换部分的核苷酸的寡核苷酸的碱基配对概况。例如且不限于,包含肌苷作为其碱基的核苷酸可以与含有腺嘌呤、胞嘧啶或尿嘧啶的核苷酸碱基配对。因此,含有尿嘧啶、鸟嘌呤或腺嘌呤的核苷酸在本发明的核苷酸序列中可以由含有例如肌苷的核苷酸替换。包含此类替换部分的序列是本发明的实施方案。如本文使用的,当用于描述与第二核苷酸序列相关的第一核苷酸序列时,术语“互补的”指包含第一核苷酸序列的寡核苷酸或多核苷酸在某些条件下与包含第二核苷酸序列的寡核苷酸或多核苷酸杂交且形成双链体结构的能力,如技术人员应理解的。互补序列还描述为彼此结合且特征在于结合亲和力。例如,当两个序列在严格杂交条件下杂交(例如退火)时,第一核苷酸序列可描述为与第二核苷酸序列互补。杂交条件包括用于退火和/或洗涤步骤的温度、离子强度、pH和有机溶剂浓度。术语严格杂交条件指这样的条件,在其下第一核苷酸序列优先与其靶序列例如第二核苷酸序列杂交,并且与其他序列杂交至更少程度或完全不杂交。严格杂交条件是序列依赖性的,并且在不同环境参数下不同。一般地,严格杂交条件选择为比在限定离子强度和pH下核苷酸序列的热解链温度(Tm)低约5℃。Tm是在其下50%的第一核苷酸序列与完美匹配的靶序列杂交的温度(在限定离子强度和pH下)。关于核酸杂交的广泛指导在例如Tijssen(1993)LaboratoryTechniquesinBiochemistryandMolecularBiology--HybridizationwithNucleicAcidProbespartI,第2章,“Overviewofprinciplesofhybridizationandthestrategyofnucleicacidprobeassays,”Elsevier,N.Y.(“Tijssen”)中找到。可应用其他条件例如如生物内可能遇到的生理学相关条件。技术人员将能够根据杂交核苷酸的最终应用,确定对于两个序列的互补性测试最适当的条件组。这包括在第一和第二核苷酸序列的整个长度上包含第一核苷酸序列寡核苷酸或多核苷酸与包含第二核苷酸序列的寡核苷酸或多核苷酸的碱基配对。此类序列在本文中可以被称为就彼此而言“完全互补”。然而,当第一序列在本文中被称为就第二序列而言“基本上互补”时,两个序列可以是完全互补的,或它们可以在杂交后形成一个或多个,但一般不超过4、3或2个错配碱基对,同时保留在与其最终应用最相关的条件下杂交的能力。然而,当两个寡核苷酸设计为在杂交后形成一个或多个单链突出端时,就互补性测定而言此类突出端不应视为错配。例如,包含长度21个核苷酸的一种寡核苷酸和长度23个核苷酸的另一种寡核苷酸的dsRNA,其中更长的寡核苷酸包含与较短寡核苷酸完全互补的21个核苷酸的序列,对于本文描述的目的仍可被称为“完全互补的”。如本文使用的,“互补”序列还可以包括非沃森克里克碱基对和/或由非天然和经修饰的核苷酸形成的碱基对,或者完全由非沃森克里克碱基对和/或由非天然和经修饰的核苷酸形成的碱基对形成,到就其杂交能力而言的上述需求得到满足的程度。此类非沃森克里克碱基对包括但不限于G:U摆动或Hoogstein碱基配对。术语“互补的”、“完全互补的”和“基本上互补的”在本文中可以就dsRNA的两条链之间,或在dsRNA的反义链和靶序列之间,在单链RNA序列或单链DNA序列的互补链之间的碱基匹配而言使用,如由其使用的上下文将理解的。如本文使用的,“双链体结构”包含两个反向平行和基本上互补的核酸序列。核酸构建体中、两个转录物之间、转录物内的两个区域之间、或转录物和靶序列之间的互补序列可以形成“双链体结构”。一般而言,每条链的大多数核苷酸是核糖核苷酸,但如本文详细描述的,每条链或两条链还可以包括至少一个非核糖核苷酸,例如脱氧核糖核苷酸和/或经修饰的核苷酸。形成双链体结构的两条链可以是一个较大的RNA分子的不同部分,或它们可以是分开的RNA分子。当两条链是一个较大分子的部分且因此通过形成双链体结构的一条链的3'末端和分别的另一条链的5'末端之间的不间断核苷酸链连接时,连接的RNA链被称为“发夹环”。当两条链通过除形成双链体结构的一条链的3'末端和分别另一条链的5'末端之间的不间断核苷酸链连接以外的方式共价连接时,连接结构被称为“接头”。RNA链可以具有相同或不同数目的核苷酸。碱基对的最大数目是双链体的最短链中的核苷酸数目减去双链体中存在的任何突出端。一般地,双链体结构是长为15至30或25至30,或18至25,或19至24,或19至21,或19、20或21个碱基对。在一个实施方案中,双链体长为19个碱基对。在另一个实施方案中,双链体长为21个碱基对。当两种不同的siRNA组合使用时,双链体长度可以相同或可以不同。如本文使用的,术语“互补性区域”指与序列例如靶序列基本上互补的反义链上的区域,如本文定义的。当互补性区域与靶序列并非完全互补时,错配在末端区域中最耐受,并且如果存在的话,一般在一个或多个末端区域中,例如在5'和/或3'末端的6、5、4、3或2个核苷酸内。在两个或更多个核酸或多肽序列的上下文中,术语“同一性”百分比指当就最大对应性进行比较时,具有指定百分比的相同核苷酸或氨基酸残基的两个或更多个序列或子序列,如使用下文描述的序列比较算法之一(例如BLASTP和BLASTN或技术人员可获得的其他算法)或通过目视检查测量的。取决于应用,术语“同一性”可存在于待比较的序列的区域上,例如功能结构域上,或可选地,存在于待比较的两个序列的全长上。对于序列比较,通常一个序列充当测试序列与之比较的参考序列。当使用序列比较算法时,测试和参考序列输入到计算机内,需要时,指定子序列坐标,并且指定序列算法程序参数。序列比较算法随后基于指定的程序参数,计算关于测试序列相对于参考序列的序列同一性百分比。关于比较的最佳序列比对可以例如通过下述进行:Smith&Waterman,Adv.Appl.Math.2:482(1981)的局部同源性算法,Needleman&Wunsch,J.Mol.Biol.48:443(1970)的同源性比对算法,Pearson&Lipman,Proc.Nat'l.Acad.Sci.USA85:2444(1988)的相似性搜索方法,这些算法的计算机化实现(WisconsinGeneticsSoftwarePackage,GeneticsComputerGroup,575ScienceDr.,Madison,Wis.中的GAP、BESTFIT、FASTA和TFASTA),或目视检查(一般参见Ausubel等人,下文)。适合于确定序列同一性和序列相似性百分比的算法的一个例子是BLAST算法,其在Altschul等人,J.Mol.Biol.215:403-410(1990)中描述。用于执行BLAST分析的软件通过美国国家生物技术信息中心(NationalCenterforBiotechnologyInformation)(www.ncbi.nlm.nih.gov/)可公开获得。术语“足够量”意指足以产生所需效应的量,例如足以产生来自细胞的可检测信号的量。术语“治疗有效量”是有效改善疾病症状的量。治疗有效量可以是“预防有效量”,因为预防可以视为疗法。必须指出如说明书和所附权利要求中使用的,单数形式“一个/种”和“所述”包括复数参考,除非上下文另有明确说明。病毒的溶原性和裂解周期病毒在宿主细胞中经历溶原性和裂解周期。如果采用溶原性周期,则噬菌体染色体可以被整合到细菌染色体内,或它可在宿主中将其自身建立为稳定质粒,它可以保留在其中。如果溶素原的裂解周期被诱导,则噬菌体基因组从细菌染色体中被切除且起始裂解周期,这最终导致细胞的裂解和噬菌体颗粒的释放。裂解周期导致新噬菌体颗粒的产生,所述新噬菌体颗粒通过宿主裂解释放。某些温和噬菌体可以显示出裂解活性,并且关于这点的倾向可以随着改变宿主细菌而改变。为了举例说明这种现象,经由噬斑测定检查两种温和金黄色葡萄球菌噬菌体对十个MRSA临床分离物的裂解活性(表1)。噬菌体对10个临床MRSA分离物中的10个显示出裂解活性,并且对10个临床MRSA分离物中的六个显示出裂解活性。因此,依赖于噬菌体的天然溶原性周期的报道测定可以预期偶然显示出裂解活性。表1:金黄色葡萄球菌温和噬菌体和对十个临床MRSA分离物的裂解活性(由字母“x”指出)MRSA分离物1x2x3xx4xx5xx6x7xx8x9xx10xx另外,由于通过基于宿主和原噬菌体衍生的噬菌体抗性机制引起的噬菌体宿主范围中的限制,基于病毒的报道测定,例如基于噬菌体的报道物,可以具有有限的反应性(即分析包容性)。这些抗性机制靶向天然噬菌体核酸,这可以导致噬菌体DNA和功能的降解或以其他方式抑制。此类抗性机制包括切割噬菌体DNA的限制系统和靶向噬菌体衍生序列的CRISPR系统。裂解活性和噬菌体抗性两者对于基于报道噬菌体的测定均可是抑制性的。裂解活性可以通过下述抑制信号:在其生成可检测信号的能力方面破坏或以其他方式抑制细胞,并且因此通过减少可检测信号的量或阻止可检测信号的生成影响检测极限。噬菌体抗性机制可以限制噬菌体的宿主范围且限制基于噬菌体报道物的包容性,类似于通过减少可检测信号的量或阻止可检测信号的生成影响检测极限。通过在报道噬菌体中掺入噬菌体DNA引起的裂解活性和噬菌体抗性两者均可导致掺入这些噬菌体报道物的测定中的假阴性结果。非复制型转导颗粒(NRTP)、用于产生非复制型转导颗粒(NRTP)的方法和相关测定“转导颗粒”指能够将非病毒核酸分子递送到细胞内的病毒。病毒可以是细菌噬菌体、腺病毒等。“非复制型转导颗粒”指能够将非病毒核酸分子递送到细胞内的病毒,但不将其自身复制病毒基因组包装成转导颗粒。病毒可以是细菌噬菌体、腺病毒等。各种NRTP、制备各种NRTP的方法和使用NRTP的方法在下述中描述:于2014年3月13日提交的PCT/US2014/026536,其为了所有目的在此以其整体通过引用并入。此类产生NRTP的方法的例子包括采用溶原化病毒的破坏/补体系统,其中通过病毒包装机制识别的DNA序列被破坏(例如经由突变、缺失、插入等),并且破坏通过报道质粒补充。在这些系统中,当溶原化病毒的裂解周期被诱导时,系统产生病毒颗粒,但颗粒携带质粒DNA代替病毒DNA。在一些方面,关于使用NRTP作为报道分子的方法用于与靶向活细胞内的基因启动子的内源或天然诱导剂一起使用。在一些实施方案中,所述方法包括采用NRTP作为报道物,其中NRTP包含与启动子可操作地连接的报道基因,所述启动子控制靶基因在靶细胞内的表达。当包括报道基因的NRTP引入靶细胞内时,报道基因的表达是可能的,例如经由报道核酸分子中的靶基因启动子的诱导。在某些方面,报道核酸序列与组成型启动子可操作地连接。在一些方面,组成型启动子是金黄色葡萄球菌clpB启动子。在一些实施方案中,构建体(包括NRTP)包含可包括报道基因的报道核酸序列。报道基因可以编码报道分子,并且报道分子可以是可检测或可选择标记物。在某些实施方案中,报道基因编码报道分子,当在细胞表达时,所述报道分子产生可检测信号。在某些实施方案中,报道核酸序列编码标记物例如可检测或可选择标记物。术语“标记物”包含但不限于脂质、脂蛋白、蛋白质、细胞因子、趋化因子、生长因子、肽、核酸、基因和寡核苷酸,连同其相关复合物、代谢产物、突变、变体、多态性、修饰、片段、亚基、降解产物、元素以及其他分析物或样品衍生测量。标记物还可以包括突变蛋白质、突变核酸、拷贝数变化和/或转录物变体。在某些实施方案中,报道分子可以是荧光报道分子,例如但不限于绿色荧光蛋白(GFP)、增强型GFP、黄色荧光蛋白(YFP)、青色荧光蛋白(CFP)、蓝色荧光蛋白(BFP)、红色荧光蛋白(RFP)或mCherry以及近红外荧光蛋白。在其他实施方案中,报道分子可以是介导发光反应的酶(luxA、luxB、luxAB、luc、ruc、nluc等)。报道分子可以包括细菌萤光素酶、真核萤光素酶、适合于比色检测的酶(lacZ、HRP)、适合于免疫检测的蛋白质例如亲和肽(His-标签、3X-FLAG)、充当适体或展示酶活性的核酸(核酶)、或选择性标记物例如抗生素抗性基因(ampC、tet(M)、CAT、erm)。本领域已知的其他报道分子可以用于产生信号,以检测靶核酸或细胞。在其他方面,报道分子包含核酸分子。在一些方面,报道分子是具有特异性结合活性的适体或其展示酶活性(例如适体酶、DNA核酶、核酶)。细胞报道核酸序列的递送可以通过各种方式完成,所述各种方式包括电穿孔、化学、生物弹射和玻璃珠转化、转导、转染、载体、缀合,包括但不限于经由核酸递送媒介物递送,包括细菌噬菌体、病毒、原生质球、脂质体、病毒样颗粒、脂质-DNA复合物、脂复合物、聚合物-DNA复合物、聚合复合物等。在一些方面,本文公开的方法、系统和组合物包含与脂肪醛细菌萤光素酶底物试剂接触的样品,以例如产生信号。脂肪醛细菌萤光素酶底物试剂的例子可以包括十三醛以及本领域已知的其他相似的脂肪醛细菌萤光素酶底物试剂。各种碳链长的脂肪醛是合适的,包括己醛、庚醛、辛醛、壬醛、癸醛、十一醛、十二醛和/或十四醛。在一些方面,报道核酸序列可以产生信号。在某些方面,信号是发光信号。在一些方面,信号可以以由信号发出的相对光单位(RLU)进行测量。检测来自报道核酸序列的信号的各种装置是本领域已知的。用于检测光发射的装置包括光电倍增管、光电二极管和/或雪崩光电二极管。检测可以通过简单收集来自面积或体积的光信号和/或通过使面积或体积成像来完成。在一些方面,信号大于本底阈值,例如其中本底阈值由平均本底信号加上平均本底信号的0x、1x、2x或3x标准差进行计算。在一些方面,信号可以以小于或等于10000-1、1000-10、1000-100、100-1、10,000、1,000、500、400、300、200、100、90、80、70、60、50、40、30、20、10、9、8、7、6、5、4或3菌落形成单位(CFU)的检测极限(LoD)进行检测。在一些方面,信号可以以小于或等于五CFU的LoD进行检测,或信号可以以小于或等于三CFU的LoD进行检测,或信号可以以小于或等于二CFU的LoD进行检测,或信号可以以小于或等于一CFU的LoD进行检测。在某些方面,使用给定NRTP检测细胞的方法的灵敏度或特异性可以例如于2014年3月13日提交的PCT/US2014/026536中所述进行确定。在一些方面,方法就标准的基于细胞培养物测定产生至少80-100、80-90、90-100、85-95、90-95、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的检测特异性。在一些方面,方法就标准的基于细胞培养物测定产生至少80-100、80-90、90-100、85-95、90-95、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的检测灵敏度。在一些方面,方法就标准的基于细胞培养物测定实现至少80-100、80-90、90-100、85-95、90-95、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%检测特异性和至少80-100、80-90、90-100、85-95、90-95、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99或100%的检测灵敏度。细胞和样品本文公开的细胞可以包括原核细胞和真核细胞。在一些方面,细胞可以是微生物。术语“微生物”意指来自古细菌域(Archaea)、细菌域(Bacteria)、和真核生物域(Eucarya)的原核生物和真核生物微生物物种,后者包括酵母和丝状真菌、原生动物、藻类或更高等的原生生物。术语“微生物细胞”和“微生物(microbe)”可与术语微生物(microorganism)互换使用。微生物可以包括甲氧西林抗性金黄色葡萄球菌(MRSA)细胞、金黄色葡萄球菌、葡萄球菌属物种(Staphylococcusspp.)、肠杆菌科(Enterobacteriaceae)、肠球菌属物种(Enterococcusspp.)、链球菌属物种(Streptococcusspp.)、不动杆菌属物种(Acinetobacterspp.)、假单胞菌属物种(Pseudomonasspp.)、寡养单胞菌属物种(Stenotrophomonasspp.)或分枝杆菌属物种(Mycobacteriumspp.)。术语“样品”可以包括通过手段包括静脉穿刺、排泄、射精、按摩、活组织检查、针抽吸、灌洗样品、刮擦、手术切口、擦拭或干预或本领域已知的其他方法,取自环境或受试者的单一细胞或多个细胞或者体液等分试样。在一些方面,样品可以包括临床样品例如得自临床背景例如医院中的受试者的样品。在一些方面,样品是鼻拭子样品、直肠拭子样品、血液样品、阳性血培养样品、皮肤/软组织样品、支气管肺泡灌洗样品、痰样品、粪便样品、尿样品和/或经分离的微生物的样品。术语“受试者”涵盖细胞、组织或生物、人或非人,无论是在体内、离体还是体外、男性还是女性。抗微生物剂“抗微生物剂”指可以杀死一种或多种微生物、抑制一种或多种微生物的生长、或以其他方式减弱一种或多种微生物的存活力的化合物。抗微生物剂包括抗生素、抗真菌剂、抗原生动物剂、抗病毒剂和其他化合物。抗微生物剂可以包括头孢西丁、β-内酰胺、广谱β-内酰胺、氨基糖苷、安莎霉素、碳头孢烯、碳青霉烯、任何代的头孢菌素、糖肽、林可酰胺、脂肽、大环内酯、单环内酰胺、硝基呋喃、噁唑烷酮、青霉素、多肽、喹诺酮、氟喹诺酮、链阳性菌素、磺酰胺、四环素、利福平、分枝杆菌抗生素、氯霉素和莫匹罗星。在一些方面,本文公开的方法、系统和组合物可以包括与样品接触的抗微生物剂且检测通过NRTP的报道核酸序列产生的信号,以确定一种或多种目标微生物对抗微生物剂是敏感还是不敏感。在某些方面,抗微生物剂是抗生素。在一些方面,本文公开的方法、系统和组合物可以包括与样品接触的不同预定浓度的抗微生物剂且检测信号的量,以确定一种或多种目标微生物对抗微生物剂的最小抑制浓度。在某些方面中,抗微生物剂是抗生素。细胞生长本文公开的方法、系统和组合物通常是不依赖于生长的方法、系统和组合物,例如用于检测衍生自受试者的样品中的一种或多种细胞。例如,本文描述的方法可以包括从目标受试者中分离或获得样品,并且使本文描述的NRTP与样品(或包含样品的培养物)直接接触,用于检测可能存在于或不存在于样品中的目标细胞或细胞集合,与生长无关。用于确定生长的各种方法是本领域已知的,例如检测细胞的大量生长的方法,例如通过测量样品光密度中的增加和/或测量样品中的不连续细胞生长的方法,例如显微镜检查、自动显微镜检查和/或生物在固体培养基上的传统培养,以检测固体培养基上的细菌菌落的存在。各种培养条件可以用于以不依赖于生长的方式检测细胞,例如支持细胞转录并翻译的能力的一种或多种营养素制剂,与细胞复制率无关。在一些方面,培养条件包括有限营养素条件,例如由RoswellParkMemorialInstitute(RPMI)培养基(FisherScientificCompany,LLC)提供的那些。在一些方面,培养条件这样加以选择,使得它们模拟细胞在自然环境中的代谢状态。在一些方面,培养条件是有限的或包括样品的使用,所述样品处于与其在自然环境中的状态相似或相同的状态。在一些方面,微生物或微生物群体的生长率小于对数期。在一些方面,微生物或微生物群体的生长率可以小于或等于0.05、0.1、0.2、0.3、0.4、0.5、1、2或3次分裂/小时。在一些方面,微生物或微生物群体的生长率可以小于或等于1次细胞分裂/4小时时期、小于或等于2次细胞分裂/4小时时期、小于或等于3次细胞分裂/4小时时期、小于或等于4次细胞分裂/4小时时期、小于或等于5次细胞分裂/4小时时期、小于或等于6次细胞分裂/4小时时期、小于或等于7次细胞分裂/4小时时期、小于或等于8次细胞分裂/4小时时期、小于或等于9次细胞分裂/4小时时期、或者小于或等于10次细胞分裂/4小时时期。在一些方面,特别当微生物或微生物群体是或包括甲氧西林抗性金黄色葡萄球菌(MRSA)时,微生物或微生物群体的生长率可以小于或等于0.1次分裂/小时。在一些方面,微生物或微生物群体的生长可以表征为稳定期、小于稳定期、或大于稳定期但小于对数期。在一些方面,微生物或微生物群体可以不经历生长或经历无法检测的生长。在一些方面,微生物或微生物群体的生长可以是负的(例如发生比细胞分裂更大的细胞死亡)或稳态的(例如细胞死亡和分裂是相对相等的)。实施例下文是用于进行本发明的具体实施方案的例子。例子仅提供用于举例说明性目的,并且不预期以任何方式限制本发明的范围。已努力确保就使用的数目(例如量、温度等)而言的准确度,但当然应当允许一些实验误差和偏差。除非另有说明,否则本发明的实践将采用本领域技术内的蛋白质化学、生物化学、重组DNA技术和药理学的常规方法。此类技术在文献中充分说明。参见例如T.E.Creighton,Proteins:StructuresandMolecularProperties(W.H.FreemanandCompany,1993);A.L.Lehninger,Biochemistry(WorthPublishers,Inc.,当前版本);Sambrook,等人,MolecularCloning:ALaboratoryManual(第2版,1989);MethodsInEnzymology(S.Colowick和N.Kaplan编辑,AcademicPress,Inc.);Remington'sPharmaceuticalSciences,第18版(Easton,Pennsylvania:MackPublishingCompany,1990);Carey和SundbergAdvancedOrganicChemistry第3版(PlenumPress)第A和B卷(1992)。实施例1:检测/补充包装系统下文是用于产生非复制型转导颗粒的基于检测/补充的包装系统的设计和构建的例子。用于开发包装系统的材料在下文列出:细菌菌株:RN4220是限制缺陷型金黄色葡萄球菌菌株,其是NCTC8325的非溶原性衍生物,并且是关于大肠杆菌(E.coli)DNA的有效接受者。它首先在Kreiswirth,B.N.等人,Thetoxicshocksyndromeexotoxinstructuralgeneisnotdetectablytransmittedbyaprophage.Nature,1983.305(5936):第709-712页中描述。RN10616通过用细菌噬菌体使RN4220溶原化而衍生。Ubeda,C.等人,SpecificityofstaphylococcalphageandSaPIDNApackagingasrevealedbyintegraseandterminasemutations.MolecularMicrobiology,2009.72(1):第98-108页。ST24衍生自从RN10616中的溶原化细菌噬菌体中缺失小末端酶基因terS。Ubeda,C.等人,SpecificityofstaphylococcalphageandSaPIDNApackagingasrevealedbyintegraseandterminasemutations.MolecularMicrobiology,2009.72(1):第98-108页。载体:在本发明的一些实施方案中,可以用作关于盒的源质粒的质粒例子在Charpentier,E.,等人,NovelCassette-BasedShuttleVectorSystemforGram-PositiveBacteria.Appl.Environ.Microbiol.,2004.70(10):第6076-6085页中描述。下述GenBank登记号可以用于盒序列:●SEQIDNO:1(金黄色葡萄球菌pT181质粒起点或复制拷贝数变体pT181cop-623repC)●M21136(tetA(M))●SEQIDNO:2(PclpB启动子序列)●SEQIDNO:3(小末端酶(terS)基因序列)●L09137(ampColE1ori)●X06758(luxAB)●M62650(转录终止)。terS缺失:terS敲除菌株ST24的构建可以经由基于等位基因交换的策略完成,导致框内缺失,其去除小末端酶基因的大多数编码序列。这种策略的细节在Ubeda,C.等人,SpecificityofstaphylococcalphageandSaPIDNApackagingasrevealedbyintegraseandterminasemutations.MolecularMicrobiology,2009.72(1):第98-108页中描述。terS敲除菌株的示例性序列显示于SEQIDNO:4(下文序列表中所示)中。SEQIDNO:4是RN10616基因组序列基因座,其显示terS缺失和补充。载体构建:GW80A0001载体是大肠杆菌/金黄色葡萄球菌穿梭载体。载体含有金黄色葡萄球菌(pT181cop-623repC)和大肠杆菌(ColE1ori)复制起点,分别用于在大肠杆菌和金黄色葡萄球菌中的选择关于氨苄青霉素(amp)和四环素(tet(M))抗性的可检测标记物,包括其自身启动子的小末端酶(terS)基因序列,来自与组成型金黄色葡萄球菌PclpB启动子可操作地连接的哈氏弧菌(Vibrioharveyi)的luxA和luxB基因,以及转录终止序列(TT)。所得到的载体(pGW80A0001,SEQIDNO:5)可以以本领域技术人员已知的各种方式进行构建。在一个例子中,tet(M)盒和luxAB基因可以经由PCR扩增得自可公开获得的pCN36和pCN58载体(Charpentier,E.等人)。PclpB可以由PCR扩增得自金黄色葡萄球菌RN4220,并且terS可以经由PCR扩增得自RN10616。载体主链可以通过从可公开获得的载体pCN48(Charpentier,E.等人)中去除ermC基因而获得,并且最终载体pGW80A0001的各种组分可以经由适当设计的基于限制性酶的克隆装配到这种载体主链上。检测/补充包装系统:包装系统可以包括用载体pGW80A0001补充的terS敲除菌株ST24,以生成菌株GW24。如本领域技术人员已知的,构建这种系统的方式可以通过用载体pGW80A0001转化ST24来完成。载体pGW80A0001可以通过在5ug/mL四环素的存在下生长转化体,维持在经转化的ST24的培养物中。携带质粒DNA的转导颗粒的产生:携带载体pGW80A0001的非复制型转导颗粒可以经由丝裂霉素C诱导方法由GW24产生,所述丝裂霉素C诱导方法首先在大肠杆菌中得到证实,并且目前是用于由溶原化细菌获得原噬菌体的标准技术。Otsuji,N.等人,InductionofPhageFormationintheLysogenicEscherichiacoliK-12byMitomycinC.Nature,1959.184(4692):第1079-1080页。这种原噬菌体诱导方法导致裂解周期的诱导,其中原噬菌体从GW24基因组中切除,产生噬菌体结构元件,并且在子代噬菌体颗粒中包装pGW80A0001多联DNA。所得到的细胞裂解产物随后被收集且含有非复制型转导颗粒,各自由携带pGW80A0001DNA的线性多联体的细菌噬菌体颗粒组成。实施例2:基于非复制型转导颗粒的报道系统。上文描述的非复制型转导颗粒可以用于报道系统中,用于经由报道分子(例如luxAB)的表达检测活细菌的存在。当这种转导颗粒将报道载体(例如pGW80A0001)引入转导颗粒的宿主范围内的细胞内时,其中启动子(例如PclpB)由细胞转录机制识别的细胞能够驱动报道分子在该细胞内的表达。为了测试非复制型转导颗粒作为用于检测金黄色葡萄球菌细胞的存在的报道物的功能性,开发了各种MSSA/MRSA报道测定。在一个实施方案中,由金黄色葡萄球菌特异性细菌噬菌体开发非复制型转导颗粒,并且掺入处于组成型启动子的控制下的细菌萤光素酶基因luxAB。当非复制型转导颗粒将报道核酸递送到金黄色葡萄球菌内时,组成型启动子表达适合于在活金黄色葡萄球菌的存在下报道的luxAB。另外,抗生素头孢西丁在转导颗粒加入含有金黄色葡萄球菌细胞的样品之前、同时或之后添加。如果细胞并非对头孢西丁表型抗性(即并非MRSA),则发光减少或消除,指示细胞是MSSA。然而,如果细胞对头孢西丁表型抗性(即是MRSA),则观察到增加或可检测的发光,指示细胞是MRSA。实施例3:细胞的不依赖于生长的检测。例如,进行测试以评估细胞复制对检测靶细胞的能力的影响。如实施例1中所述的金黄色葡萄球菌转导颗粒和测定(还参见PCT/US2014/026536,实施例2)用于检测MRSA的测定中。转导颗粒引起活金黄色葡萄球菌细胞产生细菌萤光素酶,其能够介导使用光电倍增管监测的发光反应,所述光电倍增管测量通过发光反应发出的相对光单位(RLU)。当就MRSA进行测试时,测定采用头孢西丁,使得MSSA在测定中不产生发光信号,而MRSA的确产生发光信号。简言之,得自金黄色葡萄球菌抗微生物抗性网络(NetworkforAntimicrobialResistanceinStaphylococcusaureus)(NARSA)的MRSA的临床分离物的培养物在RoswellParkMemorialInstitute(RPMI)培养基(FisherScientificCompany,LLC)中的有限营养素培养条件下进行制备,以便产生其中细胞显示出有限代谢活性的细胞培养物-即模拟细胞在自然环境中的代谢状态。细胞培养物标准化至OD600=0.1且用于接种样品。样品与实施例2中所述的转导颗粒试剂(还参见PCT/US2014/026536,实施例7)和头孢西丁混合,并且在37℃下温育4小时,随后在添加脂肪醛细菌萤光素酶底物试剂(十三醛)后测试发光的产生。除运行发光测定之外,通过将每种样品的等分试样在TSB琼脂上铺平板,且计数在与在每个时间点时计数为样品中的总CFU的每种样品温育18-24小时后所得到的菌落数目,每种样品中的细菌量在添加转导颗粒/温育之前和在温育之后/添加底物之前进行定量。图1概括了得自测试的数据。图1a概括了在测定之后(t=4小时)和之前(t=0小时)的CFU比率。图1b概括了由图1a中概括的样品产生的信号,其中在~200RLU处的虚线是由平均本底信号加上其标准差的3倍计算的本底阈值。结果指出测定不需要细菌生长以检测靶细胞。在测定期间的细菌生长分析揭示在测定期间很少的生长至无生长,尽管MRSA中的信号产物的连续增加。如所示的,图1a概括了在测定结束时和在测定开始MRSA的CFU计数比率,其中大多数样品在4小时测定期间显示出最低限度生长(例如1-2次分裂),其中2个样品显示生长中的减少(48和60),一个样品显示无生长(51),并且3个样品显示小于0.4次分裂/小时(40、51和81)。如图1b中举例说明的,所有样品均在测定期间产生阳性信号。尽管显示出很少的生长至无生长,测试的所有样品均产生超过本底的阳性信号(RLU)。实施例4:来自临床样品的细胞的不依赖于生长的检测例如,进行测试以评估细胞复制对检测直接来自临床样品的靶细胞的能力的影响。如实施例1中所述的金黄色葡萄球菌转导颗粒和测定(还参见PCT/US2014/026536,实施例2)用于检测MRSA的测定中。转导颗粒引起活金黄色葡萄球菌细胞产生细菌萤光素酶,其能够介导使用光电倍增管监测的发光反应,所述光电倍增管测量通过发光反应发出的相对光单位(RLU)。当就MRSA进行测试时,测定采用头孢西丁,使得MSSA在测定中不产生发光信号,而MRSA的确产生发光信号。简言之,为了MRSA监督的目的通过医院机构从患者中收集的残余鼻拭子样品使用转导颗粒测定就MRSA的存在进行测试。样品与如实施例2中所述的转导颗粒试剂(还参见PCT/US2014/026536,实施例7)和头孢西丁混合,并且在37℃下温育4小时,随后在添加脂肪醛细菌萤光素酶底物试剂(十三醛)后测试发光的产生。除运行发光测定之外,通过将每种样品的等分试样在TSB琼脂上铺平板,且计数在与在每个时间点时计数为样品中的总CFU的每种样品温育18-24小时后所得到的菌落数目,每种样品中的细菌量在添加转导颗粒/温育之前和在温育之后/添加底物之前进行定量。图2概括了得自对于MRSA阳性的四个临床样品的数据。图2a概括了在测定之后(t=4小时)和之前(t=0小时)的CFU比率。图2b概括了由图2a中概括的四个临床样品产生的信号,其中在~200RLU处的虚线是由平均本底信号加上其标准差的3倍计算的本底阈值。结果指出测定不需要细菌生长以检测靶细胞。在测定期间的细菌生长分析揭示在测定期间很少的生长至无生长,尽管MRSA中的信号产物的连续增加。如所示的,图2a概括了在测定结束时和在测定开始MRSA的CFU计数比率,其中大多数样品在4小时测定期间显示出最低限度生长(例如1-2次分裂),并且一个样品(3037)显示生长中的减少。如图2b中举例说明的,所有样品均在测定期间产生阳性信号。尽管显示出很少的生长至无生长,测试的所有样品均产生超过本底的阳性信号(RLU)。虽然本发明已就优选实施方案和各种替代实施方案而言进行具体显示且描述,但相关领域技术人员应理解可以在其中作出形式和细节中的各种变化,而不背离本发明的精神和范围。本说明书的主体内引用的所有参考文献、发布的专利和专利申请为了所有目的通过引用在此以其整体通过引用并入。序列SEQIDNO:1金黄色葡萄球菌pT181质粒起点或复制拷贝数变体pT181cop-623repCSEQIDNO:2金黄色葡萄球菌PclpB启动子序列SEQIDNO:3含有天然terS基因的序列SEQIDNO:4RN10616基因组序列基因座,显示terS缺失和补充。terS=括号中的文本,缺失=有下划线的,补充=粗体SEQIDNO:5pGW80A0001完全序列。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1