2,3‑丁二醇的生成能力得到增强的重组微生物及利用其的2,3‑丁二醇的生产方法与流程
本发明涉及2,3-丁二醇的生成能力得到增强的重组微生物及利用其的2,3-丁二醇的生产方法。
背景技术:
作为具有4个碳和2个羟基(-oh)的醇的一种(ch3chohchohch3)的2,3-丁二醇,可化学性地催化转化为作为合成橡胶制备工序的原料物质的1,3-丁二烯(1,3-butadiene)和用于燃料添加剂及溶剂的甲基乙基甲酮(methylethylketone,mek)。(jietal.,biotechnol.adv.,29:351,2011)).并且,2,3-丁二醇与汽油(gasoline)相混合可适用于辛烷值增进剂(octanebooster),是在产业上极其重要的中间体(celinskaetal.,biotechnol.adv.,27:715,2009)。
2,3-丁二醇可通过化学合成工序和微生物发酵工序进行生产。然而,通过上述工序的2,3-丁二醇的生产成本非常高,因此还未实现商业规模的2,3-丁二醇的生产。另一方面,近来,与通过微生物发酵工序的2,3-丁二醇生产技术的飞跃发展一同,随着化石燃料物质的价格的急剧上涨和国际性的对环境污染的限制,对于通过微生物发酵的生物基2,3-丁二醇的生产的关心和研究开发的重要性逐渐增大。
基于生物的2,3-丁二醇的生产方法通过保留2,3-丁二醇生产能力的微生物的发酵,来将可再生的生物原料物质(biomass)转换为2,3-丁二醇。通过克雷伯氏菌(klebsiella)、肠杆菌(enterobacter)、芽孢杆菌(bacillus)、沙雷氏菌(serratia)种(species)等不同种类的微生物生产2,3-丁二醇(maddoxis,biotechnol.,6:269,1996)。尤其,肺炎克雷伯氏菌(k.pneumoniae)、产酸克雷伯氏菌(k.oxytoca)、多粘类芽孢杆菌(paenibacilluspolymyxa)生产相对多量的2,3-丁二醇,尤其,肺炎克雷伯氏菌与产酸克雷伯氏菌具有如下优点:培养容易,生长速度快,可从包含来源于木质类5碳糖的不同种类的生物原料物质生产2,3-丁二醇(jietal.,biotechnol.adv.,29:351,2011;chandeletal.,sustainablebiotechnol.,63,2010;jansenetal.,biotechnol.bioeng.,26:362,1984;jansenetal.,adv.biochem.eng.,27:85,1983)。
大致分为发酵工序最优化(温度、ph、溶解氧等)、微生物开发(微生物挖掘、生理学特性把握、突变、基因操作等)领域来进行通过微生物发酵工序的基于生物的2,3-丁二醇的生产研究。在发酵工序最优化方面,查明了可有效地生产2,3-丁二醇的温度、ph、溶解氧浓度等多种条件(jietal.,bioresour.technol.,100:3410,2009;nakashimadaetal.,j.biosci.bioeng.,90:661,2000;nakashimadaetal.,biotechnol.lett.,20:1133,1998)。但是,在上述条件下的通过微生物发酵工序的2,3-丁二醇生产仍然存在由于生产率(productivity)及收率(yield)低,因而难以直接适用于商业工序的问题。并且,还存在如下问题:在发酵中生成与2,3-丁二醇一同包含乳酸的有机酸(organicacids)和包含乙醇的乙醇(alcohols)等的多种副产物。副产物的生成不仅降低与生物原料物质相关的2,3-丁二醇的收率,并且从培养液回收2,3-丁二醇过程中需要莫大的分离及纯化费用。
因此,主要想减少副产物的方向进行与2,3-丁二醇生产相关的微生物开发研究。代表性地,ji等使作为物理/化学性突变方法的一种的紫外线(uv)露出于野生型产酸克雷伯氏菌菌株,来成功于对作为副产物的有机酸的生成进行一部分抑制(jietal.、biotechnol.lett.、30:731、2008)。除此之外,通过将离子束(ionbeam)方式适用于肺炎克雷伯氏菌菌株,来使生物质的消耗速度增加,从而还试图提高2,3-丁二醇的生产(maetal.,appl.microbiol.biotechnol.,82:49,2009)。但是,上述开发的菌株在2,3-丁二醇生产率、最终浓度(concentration)及收率方面仍然存在难以直接适用于商业工序的问题。
对此,本发明人在对2,3-丁二醇的生产率、浓度及收率高的重组微生物进行研究中,发现导入特定基因的重组微生物对2,3-丁二醇的选择度及生产率高,并且完成了本发明。
技术实现要素:
本发明要解决的技术问题
本发明的目的在于提供2,3-丁二醇的生成能力得到增强的重组微生物及利用其的2,3-丁二醇的生产方法。
技术方案
为了实现本发明,本发明提供2,3-丁二醇生产用重组微生物,用于生产2,3-丁二醇,促进用于将丙酮酸转换为α-乙酰乳酸的途径、用于将α-乙酰乳酸转换为乙偶姻的途径或用于将乙偶姻转换为2,3-丁二醇的途径。
并且,本发明提供2,3-丁二醇的生产方法,上述2,3-丁二醇的生产方法包括:对本发明的重组微生物进行接种的步骤;以及对上述重组微生物进行培养的步骤。
有益效果
本发明的重组微生物对2,3-丁二醇的生产率高。
附图说明
图1示出在2,3-丁二醇生成菌株中2,3-丁二醇的生物合成途径。
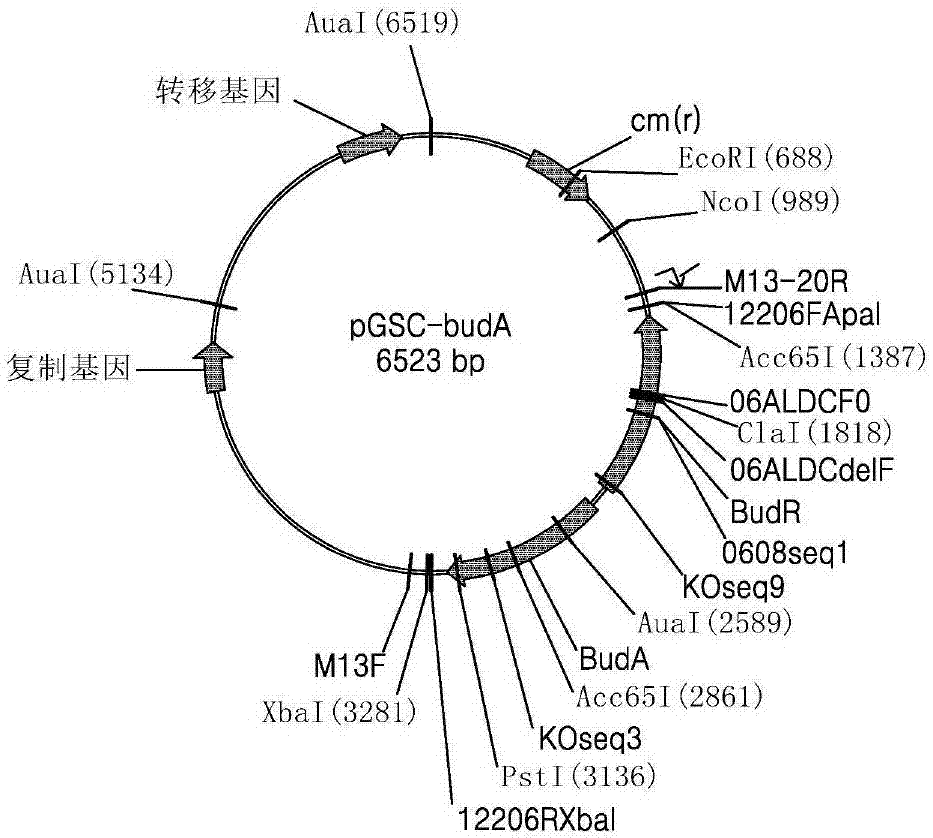
图2示出pgsc-buda质粒。
图3示出pgsc-budb质粒。
图4示出pgsc-budabc质粒。
图5为比较例1的野生型产酸克雷伯氏菌菌株(k.oxytocawildtype)的发酵结果。
图6为比较例2的重组产酸克雷伯氏菌菌株(产酸克雷伯氏菌(k.oxytoca)△ldha△pflb)的发酵结果。
图7为实施例1的重组产酸克雷伯氏菌菌株(野生型产酸克雷伯氏菌(k.oxytocawildtype)+pgsc-budrabc)的发酵结果。
图8为实施例2的重组产酸克雷伯氏菌菌株(产酸克雷伯氏菌△ldha△pflb+pgsc-budra)的发酵结果。
图9为实施例3的重组产酸克雷伯氏菌菌株(产酸克雷伯氏菌△ldha△pflb+pgsc-budrab)的发酵结果。
图10为实施例4的重组产酸克雷伯氏菌菌株(产酸克雷伯氏菌△ldha△pflb+pgsc-budrabc)的发酵结果。
具体实施方式
本发明涉及2,3-丁二醇生产用重组微生物,用于生产2,3-丁二醇,促进用于将丙酮酸转换为α-乙酰乳酸的途径、用于将α-乙酰乳酸转换为乙偶姻的途径或用于将乙偶姻转换为2,3-丁二醇的途径。
并且,本发明涉及2,3-丁二醇的生产方法,上述2,3-丁二醇的生产方法包括:对本发明的重组微生物进行接种的步骤;以及对上述重组微生物进行培养的步骤。
以下对本发明进行详细说明。
2,3-丁二醇生成能力得到增加的重组微生物
本发明的重组微生物为2,3-丁二醇生产用重组微生物,上述2,3-丁二醇生产用重组微生物用于生产2,3-丁二醇,促进用于将丙酮酸转换为α-乙酰乳酸的途径、用于将α-乙酰乳酸转换为乙偶姻的途径或用于将乙偶姻转换为2,3-丁二醇的途径。
并且,本发明的重组微生物为如下重组微生物:生产2,3-丁二醇的微生物,增加选自由乙酰乳酸合成酶、乙酰乳酸脱羧酶及乙偶姻还原酶组成的组中的一种以上的酶的活性。
并且,本发明的重组微生物为如下重组微生物:生产2,3-丁二醇的微生物,增加选自由乙酰乳酸合成酶、乙酰乳酸脱羧酶及乙偶姻还原酶组成的组中的两种以上的酶的活性。
并且,本发明的重组微生物为如下重组微生物:生产2,3-丁二醇的微生物,增加乙酰乳酸合成酶、乙酰乳酸脱羧酶及乙偶姻还原酶的活性。
并且,本发明的重组微生物可以为2,3-丁二醇生产用重组微生物,上述2,3-丁二醇生产用重组微生物在2,3-丁二醇生产微生物中,抑制用于将丙酮酸转换为乙酰辅酶a的途径、用于将丙酮酸转换为甲酸的途径或用于将丙酮酸转换为乳酸的途径,并促进用于将丙酮酸转换为α-乙酰乳酸的途径、用于将α-乙酰乳酸转换为乙偶姻的途径或用于将乙偶姻转换为2,3-丁二醇的途径。
在上述情况下,本发明的重组微生物可以为如下重组微生物:生产2,3-丁二醇的微生物,抑制用于将丙酮酸转换为乙酰辅酶a的途径、用于将丙酮酸转换为甲酸的途径及用于将丙酮酸转换为乳酸的途径,并促进用于将丙酮酸转换为α-乙酰乳酸的途径。
并且,在上述情况下,本发明的重组微生物可以为如下重组微生物,生产2,3-丁二醇的微生物,抑制用于将丙酮酸转换为乙酰辅酶a的途径、用于将丙酮酸转换为甲酸的途径及用于将丙酮酸转换为乳酸的途径,并促进用于将丙酮酸转换为α-乙酰乳酸的途径及用于将α-乙酰乳酸转换为乙偶姻的途径。
并且,在上述情况下,本发明的重组微生物可以为如下重组微生物,生产2,3-丁二醇的微生物,抑制用于将丙酮酸转换为乙酰辅酶a的途径、用于将丙酮酸转换为甲酸的途径及用于将丙酮酸转换为乳酸的途径,并促进用于将丙酮酸转换为α-乙酰乳酸的途径及用于将α-乙酰乳酸转换为乙偶姻的途径及用于将乙偶姻转换为2,3-丁二醇的途径。
并且,本发明的重组微生物可以为如下重组微生物:生产2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脱氢酶的活性,并增加乙酰乳酸合成酶的活性。
并且,本发明的重组微生物可以为如下重组微生物:生产2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脱氢酶的活性,并增加乙酰乳酸合成酶及乙酰乳酸脱羧酶的活性。
并且,本发明的重组微生物可以为如下重组微生物:生产2,3-丁二醇的微生物,抑制丙酮酸-甲酸裂解酶及乳酸脱氢酶的活性,并增加乙酰乳酸合成酶及乙酰乳酸脱羧酶及乙偶姻还原酶的活性。
并且,本发明的重组微生物对2,3-丁二醇的选择度、收率浓度及生产率高。并且由上述重组,本发明的重组微生物可以为与野生型微生物相比,如甲酸、乳酸等副产物的生成能力得到抑制的重组微生物。
乙酰辅酶a生物合成途径
本发明的重组微生物可以为利用具有乙酰辅酶a及乳酸生物合成途径的2,3-丁二醇生产微生物来制备重组微生物。本发明的乙酰辅酶a(acetyl-coa)生物合成途径意味着从微生物内特定代谢产物合成乙酰辅酶a的途径。本发明的乙酰辅酶a生物合成途径可成为从丙酮酸(pyruvate)合成乙酰辅酶a的途径等。
乳酸生物合成途径
本发明的重组微生物可以为利用具有乙酰辅酶a及乳酸生物合成途径的2,3-丁二醇生产微生物来制备重组微生物。本发明的乳酸(lactate)生物合成途径意味着从微生物内特定代谢产物合成乳酸的途径。本发明的乙酰辅酶a生物合成途径可成为从丙酮酸(pyruvate)合成乳酸的途径等。
2,3丁二醇生产微生物
本发明的重组微生物为遗传上对2,3丁二醇生产微生物进行重组来制备的重组微生物。例如,上述2,3丁二醇生产微生物可以为克雷伯氏菌(klebsiella)属、芽孢杆菌(bacillus)属、沙雷氏菌(serratia)属或肠杆菌(enterobacter)属的微生物,优选地,可以为产酸克雷伯氏菌(k.oxytoca)、肺炎克雷伯氏菌(k.pneumoniae)等,最优选地,可以为产酸克雷伯氏菌(k.oxytoca)。在2,3丁二醇的产业规模的生产中,利用产酸克雷伯氏菌制备本发明的重组微生物有利于利用肺炎克雷伯氏菌。
抑制用于将丙酮酸转化为乙酰辅酶a的途径
丙酮酸-甲酸裂解酶(pyruvate-formatelyase)用于调节丙酮酸向乙酰辅酶a的转换。通过抑制上述丙酮酸-甲酸裂解酶,来可抑制用于将丙酮酸转换为乙酰辅酶a的途径。可通过丙酮酸-甲酸裂解酶的表达抑制、丙酮酸-甲酸裂解酶的酶活性抑制等来实现上述丙酮酸-甲酸裂解酶的抑制。例如,使作为用于对丙酮酸-甲酸裂解酶进行编码的基因的pflb缺失或在上述基因中引起突变(使一部分碱基突变、取代或删除或导入一部分碱基来抑制正常的基因的表达等的突变),转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来抑制丙酮酸-甲酸裂解酶。
抑制用于将丙酮酸转换为甲酸的途径
丙酮酸-甲酸裂解酶(pyruvate-formatelyase)用于调节丙酮酸向甲酸的转换。通过抑制上述丙酮酸-甲酸裂解酶,来可抑制用于将丙酮酸转换为甲酸的途径。可通过丙酮酸-甲酸裂解酶的表达抑制、丙酮酸-甲酸裂解酶的酶活性抑制等来实现上述丙酮酸-甲酸裂解酶的抑制。例如,使作为用于对丙酮酸-甲酸裂解酶进行编码的基因的pflb缺失或在上述基因中引起突变(使一部分碱基突变、取代或删除或导入一部分碱基来抑制正常的基因的表达等的突变),转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来抑制丙酮酸-甲酸裂解酶。
抑制用于将丙酮酸转换为乳酸的途径
乳酸脱氢酶(lactatedehydrogenase)用于调节丙酮酸向乳酸的转换。通过抑制上述乳酸脱氢酶,可抑制用于将丙酮酸转换为乳酸的路径。上述乳酸脱氢酶的抑制可通过乳酸脱氢酶的表达抑制、乳酸脱氢酶的酶活性抑制等来实现。例如,使作为用于对乳酸脱氢酶进行编码的基因的ldha缺失或在上述基因中引起基因突变(使一部分碱基突变、取代或删除或导入一部分碱基来抑制正常的基因的表达等的突变),转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来抑制乳酸脱氢酶。
促进用于将丙酮酸转换为α-乙酰乳酸的途径
乙酰乳酸合成酶(acetolactatesynthase)通过调节丙酮酸向α-乙酰乳酸的转换,来参与α-乙酰乳酸的生成。可通过使上述乙酰乳酸合成酶的活性增加,来促进用于将丙酮酸转换为α-乙酰乳酸的途径。通过乙酰乳酸合成酶基因的扩增表达、乙酰乳酸合成酶的酶活性增加等,可实现上述乙酰乳酸合成酶的活性增加。例如,使作为对乳酸脱氢酶进行编码的基因的budb导入于微生物或在上述基因中引起突变(使一部分碱基突变、取代或删除或导入一部分碱基来扩增基因的表达等的突变),或在转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来增加乙酰乳酸合成酶的活性。
促进用于将α-乙酰乳酸转换为乙偶姻的途径
乙酰乳酸脱羧酶(acetolactatedecarboxylase)通过调节α-乙酰乳酸向乙偶姻的转换,来参与乙偶姻的生成。可通过使上述乙酰乳酸脱羧酶的活性增加,来促进用于将α-乙酰乳酸转换为乙偶姻的途径。通过乙酰乳酸脱羧酶基因的扩增表达、乙酰乳酸合成酶的酶活性增加等,可实现上述乙酰乳酸脱羧酶的活性增加。例如,使作为对乙酰乳酸脱羧酶进行编码的基因的buda导入于微生物或在上述基因中引起突变(使一部分碱基突变、取代或删除或导入一部分碱基来扩增基因的表达等的突变),或在转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来增加乙酰乳酸合成酶的活性。
促进用于将乙偶姻转换为2,3-丁二醇的途径
乙偶姻还原酶(acetoinreductase)通过调节乙偶姻向2,3-丁二醇的转换,来参与2,3-丁二醇的生成。可通过使上述乙偶姻还原酶的活性增加,来促进用于将乙偶姻还原酶转换为2,3-丁二醇的途径。通过乙偶姻还原酶基因的扩增表达、乙偶姻还原酶的酶活性增加等,可实现上述乙酰乳酸脱羧酶的活性增加。例如,使作为对乙偶姻还原酶进行编码的基因的budc导入于微生物或在上述基因中引起突变(使一部分碱基突变、取代或删除或导入一部分碱基来扩增基因的表达等的突变),或在转录过程或翻译过程中的基因表达调节等,本发明所属技术领域的普通技术人员可选择适当的方法来增加乙偶姻还原酶的活性。
2,3-丁二醇的生产方法
本发明的2,3-丁二醇的生产方法包括:对本发明的重组微生物进行培养的步骤;以及从上述培养液回收2,3-丁二醇的步骤。
培养
本发明的重组微生物在好氧条件下进行培养,优选地,在微好氧条件(microaerobiccondition)下进行。例如,一边提供氧,即,提供空气来进行上述培养,作为具体例,上述培养可通过搅拌来完成,但不局限于此。本发明的重组微生物可在复合培养基中进行培养,复合培养基的种类不受特别限制,通常本发明所属技术领域的普通技术人员可适当地选择在市场中销售、所使用的复合培养基来使用是显而易见的。
具体实施例
通过参照详细叙述的实施例,可明确本发明的优点及特征、及用于实现它们的方法。然而,本发明不局限于以下公开的实施例,而是以其他多种方式来实现,本实施例仅用于使本发明的公开完整,并且为了使本发明所属技术领域的普通技术人员完全地理解发明的范畴而提供,本发明仅由发明要求保护范围的范畴来进行定义。
<材料及方法>
准备作为野生型菌株的产酸克雷伯氏菌kctc12132bp,并将此用作比较例1的菌株,并且利用产酸克雷伯氏菌kctc12132bp,在以下1-1及1-3中制备了重组微生物。
产酸克雷伯氏菌kctc12132bp
保藏机关名称:韩国生命工学研究院
保藏号:kctc12132bp
保藏日期:2012年2月8日
-2,3-丁二醇的浓度(g/l):每单位体积生产的2,3-丁二醇的量
-2,3-丁二醇的收率(g/g):2,3-丁二醇的生产量(g)/碳源(g)×100
-2,3-丁二醇的生产率(g/l/h):每单位时间、单位体积生产的2,3-丁二醇的量
<1-1>制备缺失ldha及pflb的重组产酸克雷伯氏菌
制备包含靶基因的相同部位的脱氧核糖核酸(dna)片段
为了使产酸克雷伯氏菌的靶基因未活性化,利用细菌的重组机制,并利用聚合酶链式反应扩增了基因的同源区域(homologousregion)。之后,将包含同源区域的相关脱氧核糖核酸片段转移于细菌之后,利用基于位于脱氧核糖核酸片段的基因的同源区域和位于产酸克雷伯氏菌的染色体的基因之间的重组酶(recombinase)的重组机制去除靶基因。
首先,为了克隆产酸克雷伯氏菌的乳酸脱氢酶,利用seqidno.3及seqidno.4的引物对作为靶基因的ldha(seqidno.1)的同源区域1(seqidno.2)进行了聚合酶链式反应(pcr)扩增。并且,利用seqidno.6及seqidno.7的引物,对同源区域2(seqidno.5)进行了聚合酶链式反应扩增。之后,将同源区域1和同源区域2同时作为模板来进行聚合酶链式反应扩增,来完成了包含同源区域1与同源区域2的脱氧核糖核酸片段(seqidno.8)。
另一方面,为了克隆产酸克雷伯氏菌的丙酮酸甲酸裂解酶的相同区域,利用seqidno.11及seqidno.12的引物对作为靶基因的pflb(seqidno.9)的同源区域1(seqidno.10)进行了聚合酶链式反应(pcr)扩增。并且,利用seqidno.14及seqidno.15的引物,对同源区域2(seqidno.13)进行了聚合酶链式反应扩增。之后,将同源区域1和同源区域2同时作为模板来进行聚合酶链式反应扩增,来完成了包含同源区域1与同源区域2的脱氧核糖核酸片段(seqidno.16)(表1)。为了提高靶基因的重组概率,上述完成的脱氧核糖核酸片段可包含抗生素耐性基因等,为了去除染色体内重组的抗生素耐性基因,可包含对果聚糖蔗糖酶进行编码的sacb基因。
表1
制备缺失ldha及pflb的重组产酸克雷伯氏菌
利用电穿孔法(electroporation,25uf、200ω、18kv/cm),向产酸克雷伯氏菌的野生型转移了上述制备的氧核糖核酸片段,可利用微生物的重组机制,去除靶基因。
通过向产酸克雷伯氏菌野生型转移包含ldha基因的同源区域的氧核糖核酸片段,来制备了去除ldha基因的重组产酸克雷伯氏菌。并且从产酸克雷伯氏菌野生型中去除ldha基因之后,转移包含pflb基因的同源区域的脱氧核糖片段,来制备了在ldha基因中还去除pflb基因的产酸克雷伯氏菌。
利用如像这样制备的缺失ldha及pflb的产酸克雷伯氏菌kctc12132bp重组微生物(以下,被称为“比较例2”、“产酸克雷伯氏菌(产酸克雷伯氏菌(k.oxytoca)△ldha△pflb)”)来执行了重组工序及发酵实验。
<1-2>制备pgsc-buda质粒、pgsc-budab质粒及pgsc-budabc质粒
制备了使用于基因的表达扩增的重组质粒,上述基因用于对来源于产酸克雷伯氏菌的乙酰乳酸脱羧酶(buda)、乙酰乳酸合成酶(budb)及乙偶姻还原酶(budc)进行编码。
为了制备使产酸克雷伯氏菌的靶基因表达扩增的重组载体,需要克隆对包含限制酶位点、多克隆位点(multiplecloningsite)、氯霉素耐性基因的pbbr1mcs(kovachetal.、biotechniques、800-802、1994)质粒进行扩增的基因。将相关质粒克隆在细菌,在细胞内种利用质粒的复制机制扩增基因的表达。
为了克隆对产酸克雷伯氏菌的乙酰乳酸脱羧酶进行编码的基因(buda、seqidno.17)、对乙酰乳酸合成酶进行编码的基因(budb、seqidno.18)及对乙偶姻还原酶进行编码的基因(budc、seqidno.19),对靶基因进行了聚合酶链式反应扩增(表2)。此时,还同时导入作为调节(regulator)基因的budr(seqidno.20)。当进行扩增时,利用包含位于质粒的多克隆位点的限制酶位点(xbai、apai等)的引物来进行了扩增。利用位于多克隆位点的限制酶相同地处理包含各个基因的脱氧核糖核酸片段和质粒后,利用t4脱氧核糖核酸连接酶(t4dnaligase)接合上述两个片段来完成了pgsc-buda、pgsc-budab及pgsc-budabc质粒(图2至图4)
表2
<1-3>对乙酰乳酸脱羧酶、乙酰乳酸合成酶及乙偶姻还原酶进行编码的基因的表达扩增
扩增了对来源于产酸克雷伯氏菌的乙酰乳酸脱羧酶(buda)、乙酰乳酸合成酶(budb)及乙偶姻还原酶(budc)进行编码的基因的表达。
利用电穿孔法(electroporation,25uf、200ω、18kv/cm),对比较例1及比较例2的重组产酸克雷伯氏菌克隆了在上述1-2中制备的pgsc-buda质粒、pgsc-budab质粒及pgsc-budabc质粒。具体地,对野生型产酸克雷伯氏菌kctc12132bp(比较例1)克隆pgsc-budabc质粒来完成了上述基因的表达得到扩增的重组产酸克雷伯氏菌(以下,实施例1,被称为“野生型产酸克雷伯氏菌(k.oxytocawildtype)+pgsc-budabc”)。并且,对作为同时去除ldha和pflb的重组微生物的比较例2的产酸克雷伯氏菌分别克隆pgsc-buda质粒、pgsc-budab质粒及pgsc-budabc质粒,来完成了上述基因的表达分别得到扩增的重组产酸克雷伯氏菌(实施例2至实施例4)。此时,还同时导入作为调节基因的budr。进行电穿孔法之后,在30℃温度下,将上述重组产酸克雷伯氏菌培养1小时来进行稳定化之后,在37℃下在lb复合固体培养基中分别进行扩散(spreading)来培养了上述重组产酸克雷伯氏菌。之后,筛选在含有氯霉素的固体培养基中生长的菌落(colony)。接着,分离(miniprep)含于筛选的菌落的质粒,从而通过电泳确认了是否克隆基因。其结果,制备了以下重组微生物(表3)。
表3
<实验例1>缺失野生型微生物及ldha及pflb的重组微生物的2,3-丁二醇的生成能力
利用同时去除野生型克雷伯氏菌、ldha及pflb的比较例2的重组克雷伯氏菌菌株,对2,3-丁二醇的生产发酵能力进行了评价。
对同时去除比较例1的野生型产酸克雷伯氏菌、ldha及pflb的比较例2的重组产酸克雷伯氏菌执行了发酵。如下进行上述微生物的培养。
首先,将上述微生物接种于包含9g/l的葡萄糖的250ml的复合培养基,来在37℃温度下培养16小时之后,将上述培养液接种于3l复合培养基来执行。发酵条件为微好氧条件(micro-aerobiccondition;呼气流速:1vvm、搅拌速度:150rpm),90g/l的初始葡萄糖浓度、ph6.5及培养温度为37℃。向培养基内添加了25mg/l的氯霉素。发酵当中为了调节ph而使用了5n的naoh。对上述野生型克雷伯氏菌及重组克雷伯氏菌采集了发酵中的样品,并且通过测定采集的试样的光密度od600(opticaldensity)来测定了生长速度,在13000rpm条件下,对采集的试样离心分离10分钟之后,利用高效液相色谱分析法(hplc)分析了上层液的代谢产物及2,3-丙二醇的浓度。
其结果,在产酸克雷伯氏菌中去除乳酸脱氢酶(ldha)和丙酮酸-甲酸分解酶(pflb)的情况下,2,3-丁二醇生产量为39.49g/l,2,3-丁二醇的生产收率(2,3-丁二醇g/葡萄糖g)为0.45。上述比较例2的重组微生物的生产率(g/l/h)为0.58。当与比较例1的野生型菌株进行比较时,比较例2的重组微生物的乳酸、甲酸及乙醇显著减少,并2,3-丁二醇的生产能力变好,并且2,3-丁二醇的生产浓度、生产收率、生产率、选择度均得到改善了(表4)(图5及图6)。
表4
<实验例2>选择性的扩增表达buda、budab及budabc基因的重组微生物的2,3-丁二醇生产能力
对在上述1-3中制备的实施例1至实施例4的重组产酸克雷伯氏菌执行了发酵。
具体发酵如下:将作为实验对象的重组微生物接种于包含9g/l的葡萄糖的250ml的复合培养基,来在37℃温度下培养16小时之后,将上述培养液接种于3l复合培养基来执行。发酵条件为微好氧条件(micro-aerobiccondition;呼气流速:1vvm、搅拌速度:150rpm),90g/l的初始葡萄糖浓度、ph6.5及培养温度为37℃。向培养基内添加了25mg/l的氯霉素。发酵当中为了调节ph而使用了5n的naoh。对上述野生型克雷伯氏菌及重组克雷伯氏菌采集了发酵中的样品,并且通过测定采集的试样的光密度od600来测定了生长速度,在13000rpm条件下,对采集的试样离心分离10分钟之后,利用高效液相色谱分析法(hplc)分析了上层液的代谢产物及2,3-丙二醇的浓度。
其结果,可知在对野生型扩增表达budabc的情况下,与(实施例1)、比较例1(野生型)相比,2,3-丁二醇的收率、浓度增加了。但是,可知,乳酸(lactate)等副产物的生产量仍然与2,3-丁二醇相比多。
另一方面,当未去除基因pflb及ldha的实施例1与去除基因pflb及ldha的实施例4进行比较时,可确认如下:实施例4与实施例相比乳酸等的副产物降低效果优秀,2,3-丁二醇的收率、浓度及生产率更优秀(参照表4、图7及图10)。
并且,可知实施例2的重组微生物与比较例2的重组微生物(产酸克雷伯氏菌△ldha△pflb)相比2,3-丁二醇的收率及生产率显著增加。并且,若相互比较实施例2及实施例3的重组微生物,则可确认不仅扩增buda时,2,3-丁二醇的生产率能得到了改善,而且当扩增budb时,2,3-丁二醇的生产率能还得到了改善。并且,若比较实施例3及实施例4的重组微生物,则可确认当扩增budc时,2,3-丁二醇的生产率能得到了改善。最终,当对budabc均进行扩增表达的实施例4的重组微生物与比较例2的重组微生物进行比较时,可知2,3-丁二醇生产率能最得到改善了。
因此,可确认如下:在2,3-丁二醇生产中不仅用于降低副产物的基因pflb及ldha的去除重要,而且扩增基因的表达为非常重要,上述基因为对克雷伯氏菌的乙酰乳酸脱羧酶进行编码的基因、对乙酰乳酸合成酶进行编码的基因、对乙偶姻还原酶进行编码的基因(表5、图7至图10、图7:实施例1、图8:实施例2、图9:实施例3、图10:实施例4)。
表5
工业实用性
本发明涉及2,3-丁二醇生产用重组微生物,生产2,3-丁二醇的微生物,促进用于将丙酮酸转换为α-乙酰乳酸的途径、用于将α-乙酰乳酸转换为乙偶姻的途径或用于将乙偶姻转换为2,3-丁二醇的途径。
序列目录
seqidno.1为作为对产酸克雷伯氏菌的乳酸脱氢酶进行编码的基因的ldha的碱基序列。seqidno.2为ldha的同源区域1,seqidno.3及seqidno.4为用于ldha的同源区域1的扩增聚合酶链式反应的引物。seqidno.5为ldha的同源区域2,seqidno.6及seqidno.7为用于ldha的同源区域2的的扩增聚合酶链式反应的引物。seqidno.8为将ldha的上述同源区域1及同源区域2同时作为模板利用聚合酶链式反应进行扩增的脱氧核糖核酸片段。
seqidno.9为作为对产酸克雷伯氏菌的丙酮酸甲酸裂解酶进行编码的基因的pflb的碱基序列。seqidno.10为pflb的同源区域1,seqidno.11及seqidno.12为用于pflb的同源区域2的扩增聚合酶链式反应的引物。seqidno.13为pflb的同源区域2,seqidno.14及seqidno.15为用于pflb的同源区域2的的扩增聚合酶链式反应的引物。seqidno.16为将pflb的上述同源区域1及同源区域2同时作为模板利用聚合酶链式反应进行扩增的脱氧核糖核酸片段。
seqidno.17为作为对产酸克雷伯氏菌的乙酰乳酸脱羧酶进行编码的基因的buda的碱基序列。seqidno.18为作为对乙酰乳酸合成酶进行编码的基因的budb的碱基序列,seqidno.19为作为对乙偶姻还原酶进行编码的基因的budc的碱基序列,seqidno.20为作为调节(regulator)基因的budr的碱基序列。
- 还没有人留言评论。精彩留言会获得点赞!