HDL疗法标志物的制作方法
本申请按照35 U.S.C.§119(e)要求享有2014年5月2日提交的、美国临时申请第61/988,095号的优先权,通过引用将其全部内容并入本文。
2.序列表
本申请包含已通过ASCII格式电子提交的序列表,并在此通过以其整体引用并入本文。将在2015年4月22日创建的所述ASCII副本,命名为CRN-016WO_SL.txt并且大小是57,065个字节。
3.发明背景
3.1综述
循环的胆固醇经由血液中转运脂质的、脂质与蛋白质组成的血浆脂蛋白复合物颗粒运送。血浆中循环的脂蛋白颗粒具有以下四种主要类别并且均包括在脂肪转运系统中:乳糜微粒、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL)。乳糜微粒构成了肠内脂肪吸收的短寿命产物。VLDL尤其是LDL负责将胆固醇由肝(胆固醇在肝中合成或由饮食来源获得)递送至肝外的组织,包括动脉壁。相反,HDL介导胆固醇的逆转运(RCT),胆固醇脂质的去除,具体地,由肝外组织至肝,胆固醇在肝中储存、分解代谢、消除或再循环。HDL在炎症、转运氧化的脂质和白细胞介素中也起有益作用。
脂蛋白颗粒具有包含胆固醇(通常为胆固醇酯的形式)和甘油三酯的疏水核。该核为包含磷脂、未酯化的胆固醇和载脂蛋白的表层所围绕。载脂蛋白介导脂质转运,并且载脂蛋白中的一部分可与脂质代谢中涉及的酶相互作用。已经鉴别了至少十种载脂蛋白,其包括:ApoA-I、ApoA-II、ApoA-IV、ApoA-V、ApoB、ApoC-I、ApoC-II、ApoC-III、ApoD、ApoE、ApoJ和ApoH。还发现其它蛋白质如LCAT(卵磷脂:胆固醇酰基转移酶)、CETP(胆固醇脂转移蛋白)、PLTP(磷脂转移蛋白)和PON(对氧磷酶)也与脂蛋白有关。
心血管疾病,如冠心病、冠状动脉疾病和动脉粥样硬化在极大程度上与血清中升高的胆固醇浓度有关。例如,动脉粥样硬化是一种缓慢进展型疾病,其经由动脉壁内胆固醇(和胆固醇酯)的蓄积而表征。在巨噬细胞中的胆固醇和胆固醇酯的蓄积导致泡沫细胞的形成,其动脉粥样硬化斑块的标志。
令人信服的证据支持以下理论:在动脉粥样硬化病变中沉积的脂质主要来自于血浆LDL;因此,LDL已被普遍地认为是“有害的”胆固醇,相反,HDL血清浓度与冠心病成反比。事实上,HDL的较高血清浓度被认为是负向的风险因素。据假设,较高浓度的血浆HDL不仅保护性地对抗冠状动脉疾病,而且实际上可以诱导动脉粥样硬化斑块的消退(参见,例如,Badimon et al.,1992,Circulation 86(Suppl.III):86-94;Dansky and Fisher,1999,Circulation 100:1762-63;Tangirala et al.,1999,Circulation 100(17):1816-22;Fan et al.,1999,Atherosclerosis 147(1):139-45;Deckert et al.,1999,Circulation 100(11):1230-35;Boisvert et al.,1999,Arterioscler.Thromb.Vasc.Biol.19(3):525-30;Benoit et al.,1999,Circulation 99(1):105-10;Holvoet et al.,1998,J.Clin.Invest.102(2):379-85;Duverger et al.,1996,Circulation 94(4):713-17;Miyazaki et al.,1995,Arterioscler.Thromb.Vasc.Biol.15(11):1882-88;Mezdour et al.,1995,Atherosclerosis 113(2):237-46;Liu et al.,1994,J.Lipid Res.35(12):2263-67;Plump et al.,1994,Proc.Nat.Acad.Sci.USA91(20):9607-11;Paszty et al.,1994,J.Clin.Invest.94(2):899-903;She et al,1992,Chin.Med.J.(Engl).105(5):369-73;Rubin et al.,1991,Nature 353(6341):265-67;She et al.,1990,Ann.NY Acad.Sci.598:339-51;Ran,1989,Chung Hua Ping Li Hsueh Tsa Chih(also translated as:Zhonghua Bing Li Xue Za Zhi)18(4):257-61;Quezado et al.,1995,J.Pharmacol.Exp.Ther.272(2):604-11;Duverger et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(12):1424-29;Kopfler et al.,1994,Circulation;90(3):1319-27;Miller et al.,1985,Nature 314(6006):109-11;Ha et al.,1992,Biochim.Biophys.Acta 1125(2):223-29;Beitz et al.,1992,Prostaglandins Leukot.Essent.Fatty Acids 47(2):149-52)。因此,HDL已普遍被认为是“好”胆固醇(参见,例如,Zhang,et al.,2003 Circulation 108:661-663)。
HDL的“保护性”作用在大量研究中得以证实(例如,Miller et al.,1977,Lancet 1(8019):965-68;Whayne et al.,1981,Atherosclerosis 39:411-19)。在这些研究中,LDL升高的浓度似乎与增加的心血管风险相关,而较高的HDL浓度好像具有心血管保护作用。体内研究已经进一步证明了HDL的保护作用,其显示注入兔中的HDL可以阻碍胆固醇诱发的动脉病变的形成(Badimon et al.,1989,Lab.Invest.60:455-61)和/或者可以诱导所述动脉病变消退(Badimon et al.,1990,J.Clin.Invest.85:1234-41)。在对新靶标(TNT)研究的处理的事后分析中,预测HDL-CHOL是用他汀类治疗的患者中,甚至在LDL-CHOL小于70mg/dl的患者中的主要心血管事件。
在最近的临床试验中,烟酸和两个CETP抑制剂(Torcetrapib(Pfizer)and Dalcetrapib(Roche))在长期治疗中未能降低冠状动脉事件的发生率,虽然这些研究中的一些可能遭受了一些混杂因素(Boden et al.,2011,N Engl J Med 365:2255–2267;HPS2-THRIVE Collaborative Group,2013,Eur.Heart J.34:1279-1291;Barter et al.,2007,N Engl J Med 357:2109-2122;Schwartz et al.,2012,N.Engl.J.Med.367:2089-2099)。两个孟德尔遗传研究质疑了HDL-胆固醇和心血管疾病的风险之间的关联(Voight et al.,Lancet DOI:10.1016/S0140-6736(12)60312-2,published online May 17,2012;Holmes et al.,Eur Heart J doi:10.1093/eurheartj/eht571,published online January 27,2014)。这些研究进一步强调了这样的想法:功能性HDL颗粒的数目和逆向脂质转运的增强,而非HDL胆固醇(HDL-C)的升高是用于预防心血管事件的重要因素(Barter et al.,2007,N Engl J Med 357:2109-22;Group et al.,2010,N Engl J Med 362:1563-74;Nissen et al.,2007,The New England journal of medicine 356:1304-16)。的确,在超过5000名患者的MESA临床试验中,与CHD和心血管事件的发生率相关的最佳因素是HDL颗粒的数目,而不是HDL成分的胆固醇含量(即HDL-c)(Mackey et al.,2012,Journal of the American College of Cardiology 60:508-16;van der Steeg et al.,2008,Journal of the American College of Cardiology 51:634-42)。在有效的他汀类的治疗的设置中,HDL颗粒数目可能比化学测量的HDL-CHOL或ApoA-I更好的残余风险的标志物(Mora et al.2013,Circulation DOI:10.1161/CIRCULATIONAHA.113.002671)。
3.2反向脂质转运、HDL和载脂蛋白A-I
HDL颗粒的保护功能可以通过其在逆脂质转运(RLT)途径,也称为逆胆固醇转运(RCT)途径中的作用来进行解释。RLT(Tall,1998,Eur Heart J 19:A31-5)途径负责从动脉除去胆固醇并且将其运输到肝脏中以从体内消除它们,该途径主要涉及4个基本步骤。
第一步是通过新生HDL颗粒从动脉中去除胆固醇,该过程称为“胆固醇去除”。胆固醇是维护在囊泡运输和信号转导的调控中重要的结构域的膜组成成分。在大多数细胞中,胆固醇是不被分解代谢的。因此,细胞固醇流出的调节在细胞固醇稳态中发挥关键性的作用。细胞固醇可通过非调节的被动扩散机制和通过受体,如ABCA1和ABCG1转运体介导的活跃的,受调节的,能量依赖性过程两种流至胞外固醇受体。
LCAT(RCT中的关键酶)由肠和肝产生并在主要与HDL成分缔合的血浆中进行循环。LCAT将源自细胞的胆固醇转化为胆固醇酯,所述胆固醇酯在指定去除的HDL中被分离(参见Jonas 2000,Biochim.Biophys.Acta 1529(1-3):245-56)。胆固醇酯转移蛋白(CETP)与磷脂转移蛋白(PLTP)致力于循环的HDL群的进一步改造。CETP将LCAT生成的胆固醇酯运至其它的脂蛋白,特别是包括ApoB的脂蛋白,如VLDL和LDL。PLTP向HDL供应卵磷脂。HDL甘油三酯通过细胞外的肝甘油三酯脂肪酶进行代谢,并且脂蛋白胆固醇通过肝经由几种机制而除去。
HDL颗粒的功能特征主要通过它们的主要载脂蛋白组分如ApoA-I和ApoA-II而确定。还观察到与HDL缔合的微量ApoC-I、ApoC-II、ApoC-III、ApoD、ApoA-IV、ApoE、ApoJ。HDL根据RCT代谢级联或通路过程的重构状态而以多种不同的尺寸以及上述成分的不同混合物存在。
每个HDL颗粒通常包含至少1个分子的,并且通常包括2至4个分子的ApoA-I。如Prof.Gerd Assmann所描述的,HDL颗粒也可以只包括ApoE(γ-LpE颗粒),其还被认为负责胆固醇外流(参见,例如,von Eckardstein et al.,1994,Curr Opin Lipidol.5(6):404-16)。ApoA-I作为前原载脂蛋白A-I(preproapolipoprotein A-I)由肝和小肠合成,并作为原载脂蛋白A-I(proapolipoprotein A-I)(原ApoA-I(proApoA-I))分泌且快速地发生裂解从而产生血浆形式的ApoA-I,其是一种243个氨基酸的单多肽链(Brewer et al.,1978,Biochem.Biophys.Res.Commun.80:623-30)。在实验中直接注射入血流的前原ApoA-I也可以裂解为血浆形式的ApoA-I(Klon et al.,2000,Biophys.J.79(3):1679-85;Segrest et al.,2000,Curr.Opin.Lipidol.11(2):105-15;Segrest et al.,1999,J.Biol.Chem.274(45):31755-58)。
ApoA-I包含由连接体部分(经常为脯氨酸)间隔开的6至8个不同的22个氨基酸的α-螺旋或者功能性重复。该重复单元以两亲的螺旋形构型存在(Segrest et al.,1974,FEBS Lett.38:247-53)并赋予ApoA-I的主要生物学活性,即,脂质结合和卵磷脂胆固醇酰基转移酶(LCAT)活化。
ApoA-I与脂质形成以下三种类型的稳定复合物:称为前-β-1HDL的、贫脂质的小复合物;称为前-β-2HDL的、包含极性脂质(磷脂和胆固醇)的平盘状颗粒;以及称为球状或成熟HDL(HDL3和HDL2)的、包含极性和非极性脂质的球状颗粒。循环群中的大部分HDL包含ApoA-I和ApoA-II(“AI/AII-HDL成分”)。然而,只包含ApoA-I的HDL成分(“AI-HDL成分”)在RCT中表现更有效。一些流行病学研究证明了Apo-AI-HDL成分抗动脉粥样硬化的假设(Parra et al.,1992,Arterioscler.Thromb.12:701-07;Decossin et al.,1997,Eur.J.Clin.Invest.27:299-307)。
HDL颗粒由几种具有不同尺寸、脂质组成和载脂蛋白组成的颗粒群制成。可以根据它们的性能而进行分离,所述性能包括其水合密度、载脂蛋白组成和荷电特征。例如,前-β-HDL成分的特征为具有比成熟α-HDL少的表面电荷。由于这种电荷差异,而使得前-β-HDL和成熟α-HDL在琼脂糖凝胶中具有不同的电泳迁移率(David et al.,1994,J.Biol.Chem.269(12):8959-8965)。
前-β-HDL与成熟α-HDL的代谢也不同。前-β-HDL具有以下两种代谢归宿:由血浆除去以及通过肾代谢或者是重构成优先通过肝降解的中等尺寸HDL(Lee et al.,2004,J.Lipid Res.45(4):716-728)。
尽管由细胞表面转移胆固醇的机制(即,胆固醇外流)是未知的,但是仍认为贫脂质的复合物,前-β-1HDL是从RCT中涉及的外周组织转移的胆固醇的优选受体(参见Davidson et al.,1994,J.Biol.Chem.269:22975-82;Bielicki et al.,1992,J.Lipid Res.33:1699-1709;Rothblat et al.,1992,J.Lipid Res.33:1091-97;and Kawano et al.,1993,Biochemistry 32:5025-28;Kawano et al.,1997,Biochemistry 36:9816-25)。在胆固醇由细胞表面募集的这种过程中,前-β-1HDL快速地转化为前-β-2HDL。PLTP可以增加前-β-2HDL盘(disc)形成的速率,但缺少表明PLTP在RCT中的作用的数据。LCAT优先与盘状的小(前-β)HDL和球状的(即成熟)HDL反应,而将卵磷脂或其它磷脂的2-酰基转移至胆固醇的游离羟基残基以形成胆固醇酯(保留在HDL中)和溶血卵磷脂。LCAT反应需要ApoA-I作为活化剂;即,ApoA-I是LCAT的天然辅因子。在HDL中分离的胆固醇至其酯的转化防止了胆固醇重新进入细胞中,且净结果为胆固醇作为细胞的成分从细胞除去并且维持了HDL。
ApoAI-HDL成分(即,包括ApoA-I而无ApoA-II)中成熟HDL颗粒中的胆固醇酯经由肝除去并比源自包含ApoA-I和ApoA-II的HDL(A1/AII-HDL成分)的那些更有效地加工入胆汁中。这可部分地归因于ApoAI-HDL与肝细胞膜的更有效的结合。已经假定存在HDL受体,并且已将B类I型清除剂受体(SR-BI)鉴别为HDL受体(Acton et al.,1996,Science 271:518-20;Xu et al.,1997,Lipid Res.38:1289-98)。SR-BI在生成类固醇的组织(如,肾上腺)及肝中最大量表达(Landschulz et al.,1996,J.Clin.Invest.98:984-95;Rigotti et al.,1996,J.Biol.Chem.271:33545-49)。对于HDL受体的综述,参见Broutin et al.,1988,Anal.Biol.Chem.46:16-23。
经由ATP-结合盒转运子AI(ABCA1)的最初脂化对于血浆HDL的形成以及对于前-β-HDL颗粒的胆固醇外流能力而言是至关重要的(Lee and Parks,2005,Curr.Opin.Lipidol.16(1):19-25)。根据这些作者,这种最初的脂化使得前-β-HDL更有效地起胆固醇受体的作用并且防止了ApoA-I与预存在的血浆HDL颗粒快速缔合,从而得到前-β-HDL颗粒更强的胆固醇外流能力。
ABCA1缺乏是家族性主要低α-脂蛋白血症(Familial primary低α-脂蛋白血症)的潜在原因之一。家族性主要低α-脂蛋白血症是由负责HDL合成/成熟的基因之一,如ABCA1的遗传缺陷引起的,并且与非常低数目的高密度脂蛋白(HDL)颗粒相关联,也反映为非常低的载脂蛋白Al(ApoA-I)的血浆浓度。该疾病还通常与低HDL-胆固醇(HDL-C)或过早心血管疾病的阳性家族史相关联。
纯合的ABCA1缺乏症(Homozygous ABCA1 deficiency),也称为Tangier病,其特征在于HDL,载脂蛋白A-L(ApoA-1)的严重血浆缺失或不存在,和胆固醇酯在整个身体的组织中的蓄积(Puntoni et al,2012)。具有Tangier病的受试者表现为大,黄-橙色扁桃体和/或神经病。其他临床特征包括肝肿大,脾肿大,过早心肌梗塞或中风,血小板减少,贫血,和角膜混浊。
最近,第二个ATP结合盒转运体G1(ABCG1)被描述为介导细胞内胆固醇的体内稳态。ABCG1的表达通过与含有主要是球形的,中型到大型HDL颗粒,以及大型盘状HDL颗粒的胆固醇的相互作用增强了胆固醇的流出。作为ABCG1的受体,较大的颗粒与较小的HDL颗粒一样有效。
通过肝X受体转录因子增加了ATP结合盒转运体ABCA1和ABCG1(Costet et al.,2000,J Biol Chem 275:28240-5;Kennedy et al.,2001,J Biol Chem 276:39438-47),从而在通过ABCA1和ABCG1转运体两种调节胆固醇的流出中了起到了关键的作用。在体内,肝X受体通过胆固醇装载细胞中的特定氧化固醇激活。在巨噬细胞中,ABCA1和ABCG1是肝X受体的关键靶基因(Janowski et al.,1996,Nature 383:728-31)。虽然ABCA1促进胆固醇流出至胆固醇缺失和磷脂缺失的ApoA-L和apoE复合体,但ABCG1促进其流出至HDL颗粒(Duong et al.,2006,Journal of lipid research 47:832-43;Mulya et al.,2007,Arteriosclerosis,thrombosis,and vascular biology 27:1828-36;Wang et al.,2004,Proceedings of the National Academy of Sciences of the United States of America 101:9774-9)。ABCA1和ABCG1转运体表达的增加与胆固醇从质膜的内部到外部小叶的再分布相关,促进胆固醇从胆固醇装载的泡沫细胞流出到HDL颗粒(Pagler et al.,2011,Circulation research 108:194-200)。已经从动物研究证实了ABCA1和ABCG1的协调参与在介导细胞胆固醇流出。ABCA1在小鼠中的单一缺失导致动脉粥样硬化的中度增加,而且ABCG1的缺失没有影响;然而,组合缺失导致明显加快的病变发展(Yvan-Charvet et al.,2007,The Journal of clinical investigation 117:3900-8)。双敲除巨噬细胞表现出显著缺失的胆固醇流出至HDL和ApoA-I,和当用脂多糖处理时增加的炎症反应(Yvan-Charvet et al.,2008,Circulation 118:1837-47)。
最近也用微RNA(miRNA)研究了胆固醇稳态,微RNA是参与生理过程的小的内源性非蛋白质编码RNA(Rayner et al.,2010,Science(New York,N.Y.)328:1570-3;Najafi-Shoushtari et al.,2010,Science(New York,N.Y.)328:1566-9;Marquart et al.,2010,PNAS)。MIR-33,是位于编码固醇调控元件内结合因子-2的基因内的内含子miRNA,同时抑制ABCA1和ABCG1的肝表达,降低HDL-C的浓度(Yvan-Charvet et al.,2008,Circulation 118:1837-47;Marquart et al.,2010,PNAS),以及抑制巨噬细胞中的ABCA1表达,从而导致降低的胆固醇流出(Yvan-Charvet et al.,2008,Circulation 118:1837-47)。MIR-33的拮抗提高HDL-C,减少动脉粥样硬化的小鼠模型(雷纳等人,2011,临床研究杂志121:2921-31)的寡核苷酸。小鼠模型中通过寡核苷酸进行的MIR-33的拮抗提高HDL-C,并减少动脉粥样硬化(Rayner et al.,2011,The Journal of Clinical Investigation 121:2921-31)。
ABCA1和ABCG1受细胞内胆固醇含量高度调节。过载细胞脂质导致氧化固醇(oxysterol))的形成,其激活核肝X受体(LXR以诱导ABCA1和ABCG1的转录,因此导致胆固醇流出(Jakobsson et al.,2012,Trends in pharmacological sciences 33:394-404)。因此,胆固醇流出是通过HDL颗粒的胞外浓度和组成以及ABC转运体的活性两者来确定的。
有趣的是,看起来ABCA1的表达在已经装载了HDL颗粒的细胞介质的存在下(Langmann等,1999,生化和生物物理研究通讯257:29-33)下调(Langmann et al.,1999,Biochemical and biophysical research communications 257:29-33)。
作为细胞胆固醇稳态的关键调节的胆固醇流出对许多细胞功能,例如细胞增殖和造血干细胞的运动发挥了重要的调节步骤(Tall et al.,2012,Arterioscler Thromb Vasc Biol 32:2547-52)。
ATP结合盒转运体G4(ABCG4)介导胆固醇流出到HDL,这导致巨核细胞增殖(Murphy et al.,2013,Nature medicine 19:586-94)。
胆固醇流出调节单核细胞和巨噬细胞的炎症反应(Westerterp et al.,2013,Circulation research 112:1456-65),淋巴细胞的扩充(Sorci-Thomas et al.,2012,Arterioscler Thromb Vasc Biol 32:2561-5),通过内皮型一氧化氮合酶(eNOS)进行的一氧化氮(NO)的产生(Terasaka et al.,2010,Arterioscler Thromb Vasc Biol 30:2219-25),和来自胰腺β细胞的胰岛素产生(Kruit et al.,2012,Diabetes 61:659-64)。
CETP还可在RCT中起重要作用。CETP活性或其受体VLDL和LDL的变化在HDL群的“重构”中起重要作用。例如,在CETP不存在下,HDL变成不可清除的大颗粒。(对于RCT和HDL的综述,参见Fielding and Fielding,1995,J.Lipid Res.36:211-28;Barrans et al.,1996,Biochem.Biophys.Acta 1300:73-85;Hirano et al.,1997,Arterioscler.Thromb.Vasc.Biol.17(6):1053-59)。
HDL也在其它脂质和非极性分子的逆转运以及解毒作用中起重要作用,即,将脂质由细胞、器官和组织转运至肝进行分解代谢和排出。此类脂质包括鞘磷脂(SM)、氧化的脂质和溶血磷脂酰胆碱。例如,Robins和Fasulo(1997,J.Clin.Invest.99:380-84)已经证明了HDL刺激植物甾醇经由肝转运入胆汁分泌物中。
HDL的主要组分ApoA-I可以与SM于体外缔合。当使用牛脑SM(BBSM)对ApoA-I进行体外重构(reconstituted)时,在临近BBSM相变温度的温度28℃产生最大的重构率(Swaney,1983,J.Biol.Chem.258(2),1254-59)。在BBSM:ApoA-I比值为7.5:1或更低(wt/wt)时,形成了一种重构的均质HDL颗粒,每个颗粒包含三分子ApoA-I并且具有360:1的BBSM:ApoA-I摩尔比。该HDL颗粒在电子显微镜下为盘状的复合物,其类似于通过在磷脂/蛋白质升高的比值下将ApoA-I与磷脂酰胆碱进行重组而获得的复合物。然而,BBSM:ApoA-I比值为15:1(wt/wt)时,形成了具有较高磷脂:蛋白质摩尔比(535:1)的、较大直径的盘状复合物。这些复合物与使用磷脂酰胆碱形成的ApoA-I复合物相比,明显更大、更稳定并且对于变性更具抵抗力。
初期胆固醇受体(前-β-HDL以及γ-迁移ApoE包含脂蛋白)中鞘磷脂(SM)增多,表明SM可以增强这些颗粒促进胆固醇外流的能力(Dass and Jessup,2000,J.Pharm.Pharmacol.52:731-61;Huang et al.,1994,Proc.Natl.Acad.Sci.USA 91:1834-38;Fielding and Fielding 1995,J.Lipid Res.36:211-28)。
3.3.HDL和ApoA-I的保护机制
近来对于HDL保护机制的研究焦点在于载脂蛋白A-I(ApoA-I),即HDL的主要组分。较高血浆浓度的ApoA-I与冠状病变的缺失或减少有关(Maciejko et al.,1983,N.Engl.J.Med.309:385-89;Sedlis et al.,1986,Circulation 73:978-84)。
在实验动物中注入ApoA-I或HDL可产生显著的生物化学变化,以及降低动脉粥样硬化病变的程度及严重性。在Maciejko和Mao(1982,Arteriosclerosis 2:407a)、Badimon等人(1989,Lab.Invest.60:455-61;1989,J.Clin.Invest.85:1234-41)的最初报告之后,发现通过注入HDL(d=l.063-1.325g/ml)可显著地降低喂食胆固醇的兔中动脉粥样硬化病变的程度(降低45%)以及降低其胆固醇酯含量(降低58.5%)。他们还发现注入HDL使确定的病变出现接近50%的消退。Esper等人(1987,Arteriosclerosis 7:523a)已经证明,注入HDL可以显著地改变患有遗传性高胆固醇血症的、Watanabe兔的血浆脂蛋白组成,所述遗传性高胆固醇血症可发展成早期的动脉病变。在这些兔中,注入HDL可使保护性HDL与导致动脉粥样硬化的LDL之间的比值超过两倍。最近,CER-001,重组人载脂蛋白A-I改造的前-βHDL(apolipoprotein A-I engineered pre-βHDL)的几次输注能够在LDL受体敲除小鼠中减少血管炎症并促进饮食诱导的动脉粥样硬化的消退,此小鼠是用于家族性的高胆固醇血症的临床前模型(HDLTardy et al.,Atherosclerosis 232(2014)110-118)。
通过ApoA-I在体外发挥溶纤维蛋白活性的观察结果进一步强调了HDL在动物模型中预防动脉疾病的潜力(Saku et al.,1985,Thromb.Res.39:1-8)。Ronneberger(1987,Xth Int.Congr.Pharmacol.,Sydney,990)证明ApoA-I可以增加Beagle犬与Cynomologous猴的血纤蛋白溶解。发现在体外的人血浆中具有类似的活性。Ronneberger能够证实在经ApoA-I治疗的动物中,脂质沉积和动脉斑块形成的减少。
体外研究表明,ApoA-I与卵磷脂的复合物可以促进游离的胆固醇由培养的动脉平滑肌细胞外流(Stein et al.,1975,Biochem.Biophys.Acta,380:106-18)。HDL通过这种机制还可以减少这些细胞的增殖(Yoshida et al.,1984,Exp.Mol Pathol.41:258-66)。
也已证明使用包括ApoA-I或ApoA-II模拟肽的HDL灌注疗法通过ABCA1转运子而调节血浆HDL浓度,从而产生了治疗心血管疾病的效力(参见,例如,Brewer et al.,2004,Arterioscler.Thromb.Vasc.Biol.24:1755-1760)。
已经分离出ApoA-I的两种天然形成的人多态性,其中精氨酸残基被半胱氨酸取代。在载脂蛋白A-IMilano(ApoA-IM)中,这种取代出现在残基173,而在载脂蛋白A-I巴黎(ApoA-Ip)中,这种取代出现在残基151(Franceschini et al.,1980,J.Clin.Invest.66:892-900;Weisgraber et al.,1983,J.Biol.Chem.258:2508-13;Bruckert et al.,1997,Atherosclerosis 128:121-28;Daum et al.,1999,J.Mol.Med.77:614-22;Klon et al.,2000,Biophys.J.79(3):1679-85)。还已经分离了另外的ApoA-I的天然形成的人多态性,其中亮氨酸在144位被精氨酸取代。该多态性已经称为载脂蛋白A-I Zaragoza(ApoA-IZ)且与严重的α低脂蛋白血症和高密度脂蛋白(HDL)胆固醇逆转运的增强作用相关(Recalde et al.,2001,Atherosclerosis 154(3):613-623;Fiddyment et al.,2011,Protein Expr.Purif.80(1):110-116)。
包含ApoA-IM或ApoA-Ip的二硫化物连接的同源二聚体的重构HDL颗粒与包含野生型ApoA-I的重构HDL颗粒相比,其清除二肉豆蔻酰磷脂酰胆碱(DMPC)乳状液的能力及其促进胆固醇外流的能力相似(Calabresi et al.,1997b,Biochemistry 36:12428-33;Franceschini et al.,1999,Arterioscler.Thromb.Vasc.Biol.19:1257-62;Daum et al.,1999,J.Mol.Med.77:614-22)。在两种突变体中,杂合的个体降低了HDL的浓度,但是自相矛盾地是,其也降低了动脉粥样硬化的风险(Franceschini et al.,1980,J.Clin.Invest.66:892-900;Weisgraber et al.,1983,J.Biol.Chem.258:2508-13;Bruckert et al.,1997,Atherosclerosis 128:121-28)。尽管包含任一变体的重构HDL颗粒与包含野生型ApoA-I的重构HDL颗粒相比时具有降低的效力,但是其能够活化LCAT(Calabresi et al.,1997,Biochem.Biophys.Res.Commun.232:345-49;Daum et al.,1999,J.Mol.Med.77:614-22)。
ApoA-IM突变体作为常染色体显性性状遗传;并且已经鉴别了该家族内的八代载体(Gualandri et al.,1984,Am.J.Hum.Genet.37:1083-97)。单个ApoA-IM载体状态的特征为显著降低的HDL-胆固醇浓度。尽管单个载体显著降低HDL胆固醇浓度,但是其并未明显地表现出任何增加的动脉疾病风险。事实上,通过研究系谱档案(genealogical records)发现这些受试者受到“保护”而使其免于动脉粥样硬化(Sirtori et al.,2001,Circulation,103:1949-1954;Roma et al.,1993,J.Clin.Invest.91(4):1445-520)。
ApoA-IM在突变体载体中的、可能的保护作用机制似乎与ApoA-IM突变体的结构修饰有关,而在该结构中,缺失了一个α-螺旋并且增加了暴露的疏水性残基(Franceschini et al.,1985,J.Biol.Chem.260:1632-35)。多个α-螺旋紧密结构的缺失使该分子的柔韧性增加,而所述分子与正常的ApoA-I相比,更易于与脂质缔合。此外,脂蛋白复合物对变性更敏感,从而表明在突变体中,也可以改善脂质的递送。
Bielicki等人(1997,Arterioscler.Thromb.Vasc.Biol.17(9):1637-43)已经证明ApoA-IM与野生型ApoA-I相比,具有募集膜胆固醇的有限能力。此外,由ApoA-IM与膜脂质缔合而形成的初生HDL主要是7.4nm的颗粒,而不是由野生型ApoA-I形成的、较大的9nm和11nm的复合物。这些观察结果表明,在ApoA-I基本序列中Arg173→Cys173的取代干扰了细胞胆固醇募集和初生HDL组装的正常过程。该突变明显与从细胞除去胆固醇的降低的效力有关。因此,其抗动脉粥样硬化的性质可能与RCT无关。它也可能是由于其限制HDL成熟为小颗粒的能力。
归因于Arg173→Cys173取代的、最显著的结构变化是ApoA-IM的二聚作用(Bielicki et al.,1997,Arterioscler.Thromb.Vasc.Biol.17(9):1637-43)。ApoA-IM可以与自身形成同源二聚体而与ApoA-II形成异源二聚体。对于包含载脂蛋白混合物的血液成分的研究表明,循环中二聚体和复合物的存在是造成载脂蛋白消除半衰期延长的原因。已在突变体载体的临床研究中观察到此类消除半衰期的延长(Gregg et al.,1988,NATO ARW on Human Apolipoprotein Mutants:From Gene Structure to Phenotypic Expression,Limone S G)。其它研究表明,ApoA-IM二聚体(ApoA-IM/ApoA-IM)在体外的HDL颗粒互变中起抑制因子的作用(Franceschini et al.,1990,J.Biol.Chem.265:12224-31)。
3.4.目前用于血脂异常及相关病症的治疗
血脂异常障碍是与升高的血清胆固醇和甘油三酯浓度以及较低的血清HDL:LDL比值相关的疾病,并且其包括高脂血症(特别是高胆固醇血症)、冠心病、冠状动脉疾病、血管和血管周围疾病、以及诸如动脉粥样硬化的心血管疾病。也可以包括与动脉粥样硬化相关的综合征,比如由动脉机能不全引起的短暂性脑缺血发作或者间歇性跛行。目前具有大量可用于降低与血脂异常障碍相关的、高血清胆固醇和甘油三酯的治疗。但是,鉴于疗效、副作用和患病人群,而使得每种治疗具有各自的缺点和限制。某些血脂异常病症与HDL缺失相关,这是由于在负责HDL合成,成熟或消除的基因中的突变,所述血脂异常病症例如但不限于Tangier病,ABCA1缺陷,ApoA-I缺失,LCAT缺失或鱼眼病。这些病症可以重新编组到家族性原发性低α-脂蛋白血症(FPHA)的术语下。
胆汁酸结合树脂是一类中断胆汁酸从肠到肝的再循环的药物;例如考来烯胺(QuestranBristol-Myers Squibb),盐酸考来替泊(The Upjohn Company)和盐酸考来维仑(Daiichi-Sankyo Company)。当口服时,这些带正电荷的树脂结合肠中的带负电荷的胆汁酸。因为树脂不能从肠中吸收,所以它们与携带的胆汁酸一起排出。然而,这样的树脂的使用最多只将血清胆固醇水平降低约20%,并且与胃肠道副作用相关,包括便秘和某些维生素缺乏。此外,由于树脂结合其它药物,所以必须在摄取树脂之前至少一小时或四至六小时服用其它口服药物;从而使心脏病患者的药物方案复杂化。
他汀类(statins)是降胆固醇药物,其通过抑制胆固醇生物合成通路中所涉及的关键酶,即HMGCoA还原酶而阻断胆固醇的合成。他汀类有时可结合胆汁酸结合树脂使用,所述他汀类的例子如洛伐他汀辛伐他汀普伐他汀氟伐他汀和阿伐他汀他汀类显著降低血清胆固醇和血清LDL的浓度,并且延缓冠状动脉粥样硬化的进程。然而,血清HDL胆固醇的浓度仅中等地增加。LDL作用减弱的机制可能涉及VLDL浓度的降低以及LDL受体细胞表达的诱导,而其造成了产量减少和/或LDL分解代谢增强。包括肝和肾功能障碍的副作用与这些药物的使用有关(The Physicians Desk Reference,56th Ed.,2002,Medical Economics)。
烟酸(尼克酸)是一种水溶性的维生素B-复合物,其作为食物添加物和抗高血脂药使用。烟酸减少了VLDL的形成并且在降低LDL方面是有效的。在一些情况中,烟酸与胆汁酸结合树脂结合使用。当烟酸以足够的剂量使用时,可以增加HDL,但是当以这样高的剂量使用时,其有效性受到严重副作用的限制。是一种延长释放的烟酸形式,其与纯烟酸相比产生更少的副作用。烟酸/洛伐他汀是一种含有烟酸和洛伐他汀的制剂,其联合了每种药物的益处。ARBITER 6-HALTS(动脉生物学,其用于调查降低胆固醇6-HDL和LDL的治疗策略在动脉粥样硬化中的治疗效果)试验表明,烟酸,不仅有利于改变血脂,但能减少在颈动脉和冠状动脉中的斑块形成(Villines et al.,2010,J Am Coll Cardiol 55:2721-6)。不幸的是,由美国国立卫生研究院支持的大结果试验AIM-HIGH(动脉粥样硬化在具有低HDL/高甘油三酯的代谢综合征中的干预),在招募超过3000名患者后因为无效而停止(Investigators et al.,2011,N Engl J Med 365:2255-67)。HPS-THRIVE(心脏保护研究2-治疗HDL以减少血管事件的发生率)试验,研究了除辛伐他汀之外,缓释烟酸与laropiprant(前列腺素D2受体拮抗剂,可减少皮肤潮红的发病率)的组合在处于高心血管风险的25 673患者中的效应,已经显示烟酸laropiprant-组合对主要血管事件没有显著的好处(Group,2013,Eur Heart J 34:1279-91)。
一类新的增加HDL胆固醇的药物是CETP抑制剂。通过降低胆固醇酯从HDL转移到VLDL或LDL,CETP抑制剂产生了血浆HDL-胆固醇水平的显著的和持续增加,增加了30至140%(参照)。与他汀相关的LDL胆固醇保持不变(Dalcetrapib)或进一步降低约40%(torcetrapib,anacetrapib,or evacetrapib)。在ILLUMINATE(血脂水平管理的研究以理解其对动脉粥样硬化事件的影响)试验中,将添加了Torcetrapib的80mg的阿托伐他汀施用于15 067例患者,所述添加与增加的死亡率和发病率相关联(Barter et al.,2007,N Engl J Med 357:2109-22),尽管相比于单独的阿托伐他汀HDL胆固醇增加了80%,并且LDL-胆固醇降低了25%(Barter et al.,2007,N Engl J Med 357:2109-22)。另外两个试验中,RADIANCE 2(通过用新胆固醇-酯转移蛋白抑制剂成像来评级动脉粥样硬化改变)试验(Bots et al.,2007,Lancet 370:153-60),其使用B-模式颈动脉超声,以及在ILLUSTRATE(脂水平管理研究,其使用冠状动脉超声通过CETP的抑制和HDL的提高评估动脉粥样硬化的减少)试验(Nissen et al.,2007,N Engl J Med 356:1304-16)中,其使用冠脉血管内超声波,Torcetrapib并没有减少颈动脉内膜中层厚度,也没有降低冠状斑块体积,尽管存在血脂谱的有利变化。这些不利的结果很可能是由于脱靶效应,如血压增加,这可能与来自肾上腺的醛固酮的增加分泌相关(Hu et al.,2009,Endocrinology 150:2211-9;Forrest et al.,2008,British journal of pharmacology 154:1465-73)。已经开发了其他的CETP抑制剂如anacetrapib,dalcetrapib和evacetrapib,这些看起来缺少了torcetrapib的脱靶效应。这些化合物不影响醛固酮分泌。在DEFINE(确定用Anacetrapib进行的CETP抑制的功效和耐受性)试验中,与阿托伐他汀相比,anacetrapib使HDL胆固醇增加了约140%和使LDL胆固醇降低40%(Cannon et al.,2010,The New England journal of medicine 363:2406-15)。dal-OUTCOMES试验的间断分析,显示在ACS患者中与安慰剂相比,dalcetrapib没有益处,然而HDL胆固醇增加了约30%,和ApoA-I增加了18%,而LDL-胆固醇未改变(Schwartz et al.,2012,The New England journal of medicine 121105113014000)。缺少疗效被推定为与他汀类下调ABCA1相关(Niesor et al.poster 167presented at the American College of Cardiology,62nd annual scientific sessions March 9-11,2013,San Francisco,CA,USA)。
贝特类(Fibrates)是一类降脂质药物,其用于治疗各种形式的高脂血症(即,血清甘油三酯升高),所述高脂血症也可以与高胆固醇血症有关。贝特类似乎减少了VLDL成分并且适当地增加了HDL,但是,这些药物对于血清胆固醇的作用却是可变的。在美国,贝特类如氯贝丁酯非诺贝特和苯扎贝特已被批准作为降血脂药使用,但仍未获得批准用作高胆固醇血症药物。例如,氯贝丁酯是一种降血脂药,其(经由未知的机制)通过减少VLDL成分而起降低血清甘油三酯的作用。尽管在某些患者亚群中可以降低血清胆固醇,但是其对于药物的生物化学反应是可变的,并且不可能总是预知哪名患者将获得有利的结果。未表现出预防冠心病的疗效。化学和药理学相关的药物吉非贝齐是一种脂质调节剂,其中等地降低血清甘油三酯和VLDL胆固醇,并中等增加HDL胆固醇-HDL2和HDL3亚成分以及ApoA-I和A-II(即,AI/AMT-HDL成分)。但是,该脂质应答是不均匀的(heterogeneous),特别是在不同的患者群体中。此外,尽管在无冠心病史或无现存冠心病症状的、40-55岁之间的男性患者中观察到了冠心病的预防作用,但是还不清楚将这些结果以何种程度外推至其它的患者群体(如,妇女、老年人和较年轻的男性)。事实上,在患有确定的冠心病的患者中并未观察到疗效。严重的副作用与贝特类的使用有关,而所述副作用包括毒性作用,如恶性肿瘤(特别是胃肠癌)、胆囊疾病以及非冠状死亡发生几率的增加。
对于绝经后妇女中的中度的高胆固醇血症,可考虑口服雌激素替代疗法。然而,HDL的增加可能伴有甘油三酯的升高。当然,雌激素治疗受限于具体的患者群体(绝经后妇女)并且与严重的副作用有关,而所述副作用包括诱发恶性肿瘤、胆囊疾病、血栓栓塞性疾病、肝腺瘤、血压升高、葡萄糖耐受不良以及高钙血症。
其它可用于治疗高脂血症的药物包括依泽替米贝(Merck),其阻断或抑制胆固醇的吸收。但是,依泽替米贝的抑制剂已显示出某种毒性。
HDL以及与磷脂复合的、重组形式的ApoA-I可用作非极性或两亲性分子的吸收剂/清除剂,所述非极性或两亲性分子如胆固醇及衍生物(氧甾醇、氧化的甾醇、植物甾醇等)、胆固醇酯、磷脂及衍生物(氧化的磷脂)、甘油三酯、氧化产物和脂多糖(LPS)(参见,如,Casas et al.,1995,J.Surg.Res.Nov 59(5):544-52)。HDL还可以用作TNF-α及其它淋巴因子的清除剂。HDL还可以用作人血清对氧磷酶的载体,所述人血清对氧磷酶如PON-1、-2、-3。对氧磷酶是一种与HDL缔合的酯酶,其对于保护细胞组分对抗氧化是重要的。LDL的氧化在氧化应激过程中产生,其似乎与动脉粥样硬化的形成有直接关联(Aviram,2000,Free Radic.Res.33 Suppl:S85-97)。对氧磷酶似乎在动脉粥样硬化和心血管疾病的易受性方面起重要作用(Aviram,1999,Mol.Med.Today 5(9):381-86)。人血清对氧磷酶(PON-1)与高密度脂蛋白(HDL)结合。其活性与动脉粥样硬化呈负相关。PON-1水解有机磷酸酯并且可以通过抑制HDL和低密度脂蛋白(LDL)的氧化而保护免受动脉粥样硬化(Aviram,1999,Mol.Med.Today 5(9):381-86)。实验研究表明,这种保护作用与PON-1水解氧化的脂蛋白中的特异性脂质过氧化物的能力有关。保持或促进PON-1活性的干预可有助于延缓动脉粥样硬化与冠心病的发作。
HDL进一步具有抗血栓药和纤维蛋白原还原剂的作用以及作为失血性休克药物的作用(Cockerill et al.,WO 01/13939,2001年3月1日公布)。HDL,特别是ApoA-I,其已被证明促进败血症产生的脂多糖交换为包含ApoA-I的脂质颗粒,从而功能性地中和所述脂多糖(Wright et al.,WO9534289,1995年12月21日公布;Wright et al.,1999年7月27日发行的美国专利5,928,624;1999年8月3日发行的美国专利5,932,536)。
最近,不同的试验已经描述用增加HDL胆固醇的药物,如贝特类,烟酸或CETP抑制剂在使冠心病风险降低至比用他汀类单独治疗获得的风险(见上文)还要低中的困难。在人HDL代谢的几个先天性缺陷,以及在具有改变的HDL代谢的基因小鼠模型中,HDL-C的变化不与在心血管风险或动脉粥样硬化斑块大小的变化分别相关(Besler et al.,2012,EMBO molecular medicine 4:251-68;Voight et al.,2012,Lancet 6736:1-9;Frikke-Schmidt et al.,JAMA,June 4,2008-Vol 299,No.21;Holmes et al.,Eur Heart J first published online January 27,2014doi:10.1093/eurheartj/eht571)。因此,HDL作为治疗靶的致病作用和适合性是尚未确定的。这导致这样的结论,即在未来的临床试验中,HDL的功能,而不是简单的HDL胆固醇水平(作为生物标志物)可能对评估HDL在心血管疾病中的益处是关键的。当研究HDL的功能时,看起来HDL代谢是被高度调节的,因此我们可以假设,极端的改变,如HDL水平的强劲增长(例如用CETP抑制剂治疗实现的)可以推动下调,这将导致对心血管疾病的中度影响。这一假设由来自两个临床试验的结果进行了强调,其中使用了不同的重构的HDL并且其中没有观察到剂量反应关系。此外,在两个试验中均描述存在最高剂量对于斑块消退的效应比较低剂量低的趋势(Nissen et al.,2003,JAMA 290:2292-300;Tardif et al.,2007,JAMA 297:1675-82)。进一步分析了在最近的临床试验中CETP抑制剂,Dalcetrapib的有益效果的缺失,并导致这样的结论:一些他汀类可以具有对巨噬细胞上的ABCA1表达特定的下调作用,这能够削弱HDL在ACS患者中动脉粥样硬化斑块消退的益处。总而言之,这些观察结果允许推断出,HDL水平的适当增加或HDL(前betan HDL与球形HDL)的性质,或HDL颗粒的数目对于心血管疾病的成功治疗可能是关键的。
来自健康受试者的HDL可在脉管系统,并且特别是在内皮细胞上发挥几种保护作用(Besler et al.,2011,The Journal of clinical investigation 121:2693-708;Yuhanna et al.,2001,Nature medicine 7:853-7;Kuvin et al.,2002,American heart journal 144:165-72)。来自健康受试者的HDL刺激NO从培养中的人主动脉内皮细胞的释放和增加eNOS表达。(Besler et al.,2011,The Journal of clinical investigation 121:2693-708;Yuhanna et al.,2001,Nature medicine 7:853-7;Kuvin et al.,2002,American heart journal 144:165-72)HDL抑制粘附分子,如血管细胞粘附分子1(VCAM1)的表达,并因此抑制了单核细胞的粘附。(Nicholls et al.,2005,Circulation 111:1543-50;Ansell et al.,2003,Circulation 108:2751-6)。如上所述,HDL也发挥抗血栓效应。在小鼠颈动脉模型中,在血管损伤之后HDL增强内皮修复。从健康受试者获得的HDL在体外和在体内apoE缺陷小鼠中降低内皮细胞凋亡(Riwanto et al.,2013,Circulation 127:891-904)。这样的效应也在具有ABCA1突变的患者中观察到了(Attie et al.,2001,J Lipid Res 42:1717-26)。如通过乙酰胆碱的动脉内输注,和分别通过肱动脉的体积描记法或高分辨率超声和血流介导的血管扩张测量前臂血流量所观察到的,重构的HDL颗粒(ApoA-I/磷脂酰胆碱以1:150的摩尔比)的输注改善了受损的内皮功能(Spieker et al.,2002,Circulation 105:1399-402)。在随机双盲安慰剂对照试验(DAL-VESSEL)中,在具有冠状动脉心脏病(CHD)或者处于CHD的风险的患者中,CETP抑制剂(Dalcetrapib)减少CETP活性并增加HDL-C水平,而不影响NO依赖血管内皮功能,血压,或炎症和氧化应激的标志物(Lüscher et al.,2012,European heart journal 33:857-65)。一个假设,不像来自健康受试者的HDL,来自具有糖尿病,CAD,ACS或慢性肾功能不全的患者的HDL在血管效应中是功能失调,因为它们不再刺激来自培养中的内皮细胞的NO释放(Besler et al.,2011,The Journal of clinical investigation 121:2693-708;Sorrentino et al.,2010,Circulation 121:110-22;Speer et al.,2013,Immunity 1-15)。
然而考虑到产物的低的总产率以及在重组表达的蛋白培养中出现的蛋白降解,ApoA-I、ApoA-IM、ApoA-IP和其它变体以及重组的HDL目前受到大量的治疗性给药所需的载脂蛋白以及蛋白生产成本的限制(参见,例如Mallory et al.,1987,J.Biol.Chem.262(9):4241-4247;Schmidt et al.,1997,Protein Expression&Purification 10:226-236)。早期临床试验已经表明用于治疗心血管疾病的每次输注所给予的蛋白剂量范围为1.5-4g。完全治疗所需的输注次数是未知的(参见,例如Eriksson et al.,1999,Circulation 100(6):594-98;Carlson,1995,Nutr.Metab.Cardiovasc.Dis.5:85-91;Nanjee et al.,2000,Arterioscler.Thromb.Vasc.Biol.20(9):2148-55;Nanjee et al.,1999,Arterioscler.Thromb.Vasc.Biol.19(4):979-89;Nanjee et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(9):1203-14)。
重组人ApoA-I已经在异源性宿主中表达,然而成熟蛋白的产率不足以用于大规模治疗应用,特别是当与进一步降低产率且产生不纯产物的纯化方法结合时。
Weinberg et al.,1988,J.Lipid Research 29:819-824描述通过反相高效液相色谱由人血浆纯化的载脂蛋白A-I、A-II和A-IV以及它们的亚型的分离。
WO 2009/025754描述α-1-抗胰蛋白酶和ApoA-I由人血浆的蛋白分离和纯化。
Hunter et al.,2009,Biotechnol.Prog.25(2):446-453描述大肠杆菌中进行重组表达的ApoA-I Milano突变体的大规模纯化。
Caparon et al.,2009,Biotechnol.And Bioeng.105(2):239-249描述ApoA-I Milano由大肠杆菌宿主的表达和纯化,所述大肠杆菌宿主经遗传性工程化以删除两个宿主细胞蛋白以降低这些蛋白在纯化的载脂蛋白产物中的水平。
美国专利6,090,921描述使用阴离子交换色谱法将ApoA-I或者载脂蛋白E(ApoE)由含有ApoA-I和ApoE的人血浆成分纯化。
Brewer et al.,1986,Meth.Enzymol.128:223-246描述使用色谱技术进行载脂蛋白由人血液的分离和表征。
Weisweiler et al.,1987,Clinica Chimica Acta 169:249-254描述使用快速-蛋白液相色谱法进行ApoA-I和ApoA-II由人HDL的分离。
deSilva et al.,1990,J.Biol.Chem.265(24):14292-14297描述通过免疫亲和色谱法和反相高效液相色谱法进行载脂蛋白J的纯化。
目前正在开发脂蛋白和脂蛋白复合物用于临床应用,其中临床研究使用不同的基于脂蛋白的试剂,其确立了脂蛋白疗法的可行性(Tardif,2010,Journal of Clinical Lipidology 4:399–404)。一个研究评价了自体同源的去脂的HDL(Waksman et al.,2010,J Am.Coll.Cardiol.55:2727-2735)。另外的研究评价了ETC-216,其为重组ApoA-IM和棕榈酰基-油酰基-PC(POPC)的复合物(Nissen et al.,2003,JAMA 290:2292-2300)。CSL-111为由与大豆磷脂酰胆碱(SBPC)络合的血浆纯化的重建的人ApoA-I(Tardif et al.,2007,JAMA 297:1675-1682)。目前的探索药物已经显示出降低动脉粥样硬化斑块的效能,但是该作用伴随有次级效应,诸如转氨酶增加以及ApoA-I抗体的形成(Nanjee et al.,1999,Arterioscler.Vasc.Throm.Biol.19:979-89;Nissen et al.,2003,JAMA290:2292-2300;Spieker et al.,2002,Circulation 105:1399-1402;Nieuwdorp et al.,2004,Diabetologia 51:1081-4;Drew et al.,2009,Circulation 119,2103-11;Shaw et al.,2008,Circ.Res.103:1084-91;Tardiff et al.,2007,JAMA 297:1675-1682;Waksman,2008,Circulation 118:S 371;Cho,美国专利7,273,849 B2,2007年9月25日出版)。例如,ERASE临床试验(Tardiff et al.,2007,JAMA 297:1675-1682)采用两个剂量的CSL-111:40mg/kg和80mg/kg的ApoA-I。80mg/kg剂量组由于肝毒性(已知为严重的转氨酶升高)而需要终止。甚至在40mg/kg剂量组中,若干患者经历了转氨酶升高。毒性很有可能归因于剩余胆盐的存在,其是用于制造重构的HDL的去垢剂(由Wright等人的US 2013/0190226中所强调的)。
因此,存在以下需要:对于更有效地降低血清胆固醇、增加HDL血清水平、预防和/或者治疗血脂异常和/或者与血脂异常相关的疾病、病症和/或者障碍,同时最小化副作用,如肝毒性其增加甘油三酯、LDL-甘油三酯或者VLDL-甘油三酯的胆固醇降低药物的给药日程表的需要,以及用于鉴定此种给药日程表和监测接受此种治疗的受试者的方法的需要。
4.发明概述
在这个个体化用药的时代,药物基因组学与药学和基因组学的结合促进了所谓的“伴随诊断”的使用和审问,这是预期用于结合治疗性产品,以更好地告知治疗选择,起始,剂量定制,或避免的问题的诊断产品。本公开部分地涉及发现响应于用HDL治疗剂进行的受试者的治疗(如以下第6.1节中定义)的倒U形的剂量-效应曲线,所述疗法特别是HDL模拟物,去脂或脂质差的HDLs,或施用后通过下调胆固醇流出和逆脂质转运的组分,如ABCA1和ABCG1转运体和SREBP1(调节脂肪酸生物合成的转录因子)的作用机制提高HDL水平的其它化合物。这种作用机制的发现允许设计用于监测用HDL治疗剂治疗的伴随诊断测定和/或鉴定HDL治疗剂针对特定受试者或亚组或其他组的受试者的有效剂量。因此,本发明涉及,其中可以与接受用HDL治疗剂治疗的受试者共同使用的HDL标志物伴随诊断测定。在一些实施方案中,本公开涉及用于确定接受用HDL治疗剂治疗的受试者是否正在接收治疗有效量或最佳剂量的方法。在一些实施方案中,本公开涉及的方法用于确定接受用HDL治疗剂治疗的受试者是否正在接收治疗有效量或最佳剂量,同时优化了所述治疗的安全性。
如本文所述的方法可以在其中所述受试者正在用HDL治疗剂治疗某一状况下使用(如以下第6.1节中定义),或用于鉴定或优化针对HDL治疗的给药日程表以治疗患此状况的受试者。
本文还提供了预测受试者对用HDL治疗剂治疗的响应的可能性的方法。
在某些方面,本公开涉及治疗患有用HDL治疗剂治疗的状况的受试者,鉴定用于治疗状况的HDL治疗剂的合适的剂量,使患此状况的受试者中的胆固醇流通,或监测在受试者中HDL治疗剂的疗效。所述方法通常包括(例如按照给药日程表的一次或多次)对受试者施用HDL治疗剂和监测在来自个体的测试样品中至少一种HDL标志物基因表达的变化,在一些实施方案中两种或三种或更多种HDL标志物。任何变化可以是与受试者的自身基线,受试者之前的测量值和/或从个体的群体的一种或多种HDL标志物获得的对照比较得到的。个体的群体可以是任何合适的群体,例如,健康的个体,患状况的个体,遗传上匹配的个体等。在测量后,如果HDL治疗剂下调胆固醇流出途径的组分达到了使治疗功效衰减的程度,那么剂量,给药频率(dosing frequency)或两者可进行调整。在一些实施方案中,确定了不改变或甚至增加在受试者的循环单核细胞,巨噬细胞或单核细胞中的一种或多种HDL标志物的表达水平的剂量。
在一些实施方案中,该方法包括以下步骤:(a)从受试者或受试者群体获得第一测试样品;(b)测量测试样品中的一种或多种HDL标志物的表达水平(如以下第6.1节中所定义);(c)施用HDL治疗剂的剂量(或一系列剂量)至受试者或受试者群体;(d)获得来自受试者或受试者群体的第二测试样品;和(e)测量第二测试样品中的一种或多种HDL标志物的表达水平。在一些实施方案中,第一样品在用HDL治疗剂治疗之前获得。在其他实施方案中,受试者或受试者群体用不同于步骤(c)的剂量的一个剂量的HDL治疗剂治疗后获得第一样品。
在其他实施方案中,该方法包括以下步骤:(a)施用一剂的HDL治疗剂至受试者或受试者群体;(b)从受试者或受试者群体获得测试样品;和(c)测量测试样品中的一种或多种HDL标志物的表达水平,以确定表达水平是高于还是低于截留量(cutoff amount)。任选地,针对一个或多个额外剂量的HDL治疗剂重复步骤(a)至(c),直到确定了合适的剂量。额外剂量可包括更高/更低量的HDL治疗剂,更高/更低给药频率,或更多/更少的输注次数。
测试样品优选是外周血单核细胞或循环单核细胞或巨噬细胞的样品。它也可以是淋巴单核细胞或循环单核细胞或巨噬细胞的样品。样品可以获自,例如,未经处理的受试者或受试者群体,或施用HDL治疗剂后,例如施用2,4,6,8,10,12,16,20或24小时后的受试者或受试者群体。在不同的实施方案中,在施用后2-10,2-12,4-6,4-8,4-24,4-16,6-8或6-10小时获得样品。受试者可以用作为单一疗法的HDL治疗剂治疗或作为联合治疗方案中的一个部分的HDL治疗剂治疗,所述联合治疗例如,与一个或多个控制脂质的药物如阿托伐他汀,依泽替米贝,烟酸,罗舒伐他汀,辛伐他汀,阿司匹林,氟伐他汀,洛伐他汀和普伐他汀联合。在一些实施方案中,确定合适的剂量是在健康个体中进行的,并且在其他实施方案中它是在具有状况的个体群体中进行。在多种实施方案中,合适的剂量是,与受试者的基线量和/或群体的平均值相比,使一种或多种HDL标志物的表达水平降低20%-80%,30%-70%,40%-60%,或50%的剂量。在其他实施方案中,合适的剂量是与受试者的基线量和/或群体的平均值相比,使一种或多种HDL标志物的表达水平降低不超过50%的剂量,并且在一些实施方案中降低不超过40%,不超过30%,不超过20%,或不超过10%的剂量。在其它实施方案中,剂量是与受试者的基线量和/或群体的平均值相比,不会使一种或多种HDL标志物的表达水平降低的剂量。
在另一个实施方案中,本文提供了用于本公开的伴随诊断测定中试剂盒。在一些实施方案中,所述试剂盒包括(a)至少一种HDL治疗剂和(b)至少一种诊断试剂,其用于定量HDL标志物的表达(例如,在核酸测定法的情况下,用于检测HDL标志物的引物和/或探针,和在蛋白质测定法的情况下,至少一种抗HDL标志物抗体(多克隆或单克隆))。在另一个实施方案中,HDL标志物是在用于从生物样品(例如血液或淋巴)分离细胞的细胞分选仪或FACS仪器的帮助下确定的。
另外本文提供了用HDL治疗剂治疗患家族性高α脂蛋白血症,例如,ABCA1缺陷的受试者的方法。优选地,治疗分为两个阶段,最初的,更加激烈的“诱导”阶段,随后,较不强烈的“维护”阶段。任选地,该治疗是根据使用本文描述的方法鉴定的给药日程表给出的。
本文还提供用HDL治疗剂治疗患LCAT缺失(纯合子或杂合子)的受试者的方法,任选地使用使用本文描述的方法鉴定的本文描述的方法鉴定的给药日程表。
本文还提供用HDL治疗剂治疗患ApoA-I缺失(纯合子或杂合子)的受试者的方法,任选地使用使用本文描述的方法鉴定的本文描述的方法鉴定的给药日程表。
本文还提供用HDL治疗剂治疗患低HDL水平(纯合子或杂合子)的受试者的方法(男性40mg/dl以下的HDL-chol或以下,女性50mg mg/dl以下的HDL-chol)用HDL治疗剂治疗的受试者,任选地使用本文描述的方法鉴定的给药日程表。。
在某些实施方案中,本公开提供了鉴定有效地使受试者中的胆固醇流通的HDL治疗剂剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者,(b)在施用所述第一剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第一剂量对所述表达水平的效应;和(c)(i)如果受试者的一种或多种HDL标志物的表达水平的降低超过截留量,施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量低于第一剂量;或(ii)如果受试者的一种或多种HDL标志物的表达水平的降低未超过截留量,用所述HDL治疗剂的第一剂量治疗受试者。
在某些实施方案中,本公开提供了用于监测HDL治疗剂在受试者中的功效的方法。在一些实施方案中,该方法包括:(a)根据第一给药日程表用HDL治疗剂治疗受试者,(b)测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一给药日程表对所述表达水平的效应;及(c)(i)如果受试者的一种或多种HDL标志物的表达水平的降低超过上截留量(upper cutoff amount),根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较低剂量,在一段较长的时间中将HDL治疗剂输注到受试者中,并且不太频繁地施用HDL治疗剂至受试者;(ii)如果受试者的一种或多种HDL标志物的表达水平的降低未超过下截留量(lower cutoff amount),根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较高剂量,在一段较短的时间中将HDL治疗剂输注到受试者中,并且较频繁地施用HDL治疗剂至受试者;或(iii)如果受试者的一种或多种HDL标志物的表达水平降低的量在上截留量和下截留量之间,根据第一给药日程表持续治疗受试者。
截留量可以是相对于在所述施用之前受试者的自身基线,或截留量可以是相对于对照量,如来自例如,健康受试者或具有与受试者相同疾病状况的群体或与受试者共享一个或多个疾病风险基因的群体的群体平均值。
在某些实施方案中,本公开提供了鉴定能有效地使胆固醇流通的剂量HDL治疗剂的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者群体,(b)在施用所述第一剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第一剂量对所述表达水平的效应;(c)施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量高于或低于第一剂量;(d)在施用所述第二个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第一剂量对所述表达水平的效应;(e)针对所述HDL治疗剂的一个或多个额外剂量任选地重复步骤(c)和(d);和(f)鉴定受试者的一种或多种HDL标志物的表达水平的降低不会超过截留量的最高剂量,从而鉴定能有效地使胆固醇流通的剂量HDL治疗剂。
在一些实施方案中,在施用所述第二个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第二剂量对所述表达水平的效应。如果受试者的一种或多种HDL标志物的表达水平的降低超过截留量,施用所述HDL治疗剂的第三剂量,其中所述HDL治疗剂的第三剂量低于第二剂量
在某些实施方案中,本公开提供了用于治疗需要HDL治疗剂的受试者的方法。在一些实施方案中,该方法包括施用至受试者以下的组合:(a)与受试者的基线量相比,使一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平的降低不超过20%或10%的剂量的脂蛋白复合物;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸,他汀类,贝特类,PCSK9抑制剂,依泽替米贝,和CETP抑制剂。
在某些实施方案中,本公开提供了用于治疗需要HDL治疗剂的受试者的方法。在一些实施方案中,该方法包括施用至受试者以下的组合:(a)与对照量相比,使一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平的降低不超过20%或10%的剂量的脂蛋白复合物;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸,他汀类,贝特类,PCSK9抑制剂,依泽替米贝,和CETP抑制剂。
对照量可以是群体平均值,如来自例如,健康受试者或具有与受试者相同疾病状况的群体或与受试者共享一个或多个疾病风险基因的群体的群体平均值。受试者可以是人或受试者群体是人类受试者群体。受试者可以是非人动物,例如,小鼠,或受试者群体可以是非人动物的群体。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是ABCA1。例如,对ABCA1 mRNA的表达水平或ABCA1蛋白表达水平进行了测量。在多种的实施方案中,ABCA1截留量为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。ABCA1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是ABCG1。例如,对ABCG1 mRNA的表达水平或ABCG1蛋白表达水平进行了测量。在多种的实施方案中,ABCG1截留量为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。ABCG1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是SREBP-1。例如,对SREBP-1 mRNA的表达水平或SREBP-1蛋白表达水平进行了测量。在多种的实施方案中,SREBP-1截留量为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。SREBP-1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在某些实施方案中,HDL治疗剂是脂蛋白复合物。脂蛋白复合物可以包括载脂蛋白例如ApoA-I,ApoA-II,ApoA-IV,ApoE或它们的组合。脂蛋白复合物可以包括载脂蛋白的肽模拟物诸如如ApoA-I,ApoA-II,ApoA-IV,ApoE肽模拟物或其组合。脂蛋白复合物可以是CER-001,CSL-111,CSL-112,CER-522,或ETC-216。
在某些实施方案中,HDL治疗剂是一种小分子,例如CETP抑制剂或泛酸衍生物。
在某些实施方案中,本文描述的方法进一步包括确定截留量。例如,所述截留量可以通过产生针对HDL治疗剂的剂量反应曲线来确定。截留量可以是在剂量反应曲线的拐点的HDL标志物的表达水平的25%,40%,50%,60%,或75%。在具体的实施方案中,截留量选自前述截留量中的任何两个限定的范围,例如,在剂量反应曲线的拐点的HDL标志物的表达水平的30%-70%,40%-60%,25%-50%,25%-75%。
在某些实施方案中,受试者或受试者群体具有ABCA1缺陷。受试者或受试者群体可以是纯合的ABCA1突变。受试者或受试者群体可以是杂合的ABCA1突变。
在其他实施方案中,受试者或受试者群体具有HDL缺陷(HDL deficiency),低α-脂蛋白血症或原发性家族性低α-脂蛋白血症。
在其他实施方案中,受试者或受试者群体具有LCAT缺失或鱼眼病。受试者或受试者群体可以是纯合的LCAT突变。受试者或受试者群体可以是杂合的LCAT突变。
在其他实施方案中,受试者或受试者群体具有ABCG1缺失。受试者或受试者群体可以是纯合的ABCG1突变。受试者或受试者群体可以是杂合的ABCG1突变。
在其他实施方案中,受试者或受试者群体具有ApoA-I缺失。受试者或受试者群体可以是纯合的ApoA-I突变。受试者或受试者群体可以是杂合的ApoA-I突变。
在其他实施方案中,受试者或受试者群体具有ABCG8缺失。受试者或受试者群体可以是纯合的ABCG8突变。受试者或受试者群体可以是杂合的ABCG8突变。
在其他实施方案中,受试者或受试者群体具有PLTP缺失。受试者或受试者群体可以是纯合的PLTP突变。受试者或受试者群体可以是杂合的PLTP突变。
患者可以具有在前述一个或多个基因中的遗传缺陷,即,具有混合的遗传缺陷。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定不会使所述一种或多种HDL标志物的表达水平降低超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定维持一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的基线表达水平或甚至增加该表达水平的剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。水平可以增加至少10%,至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,或在由上述值中的任意两个限定的范围中,例如,该水平可提高多达10%,多达20%,多达50%,10%-50%,20%-60%等。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定不会使所述一种或多种HDL标志物的表达水平在所述受试者中增加超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定维持一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的基线表达水平或甚至增加该表达水平的剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。水平可以增加至少10%,至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,或在由上述值中的任意两个限定的范围中,例如,该水平可提高多达10%,多达20%,多达50%,10%-50%,20%-60%等。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最高剂量。鉴定适合于疗法的HDL治疗剂的剂量的方法,可包括:(a)施用一个或多个剂量的HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的给药间隔的方法。在一些实施方案中,该方法包括:鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最频繁的给药日程表的最高剂量。鉴定适合于疗法的HDL治疗剂的给药间隔的方法,可包括:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不会使所述受试者中的胆固醇流出降低超过50%至100%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,一个或多个给药频率包括选自以下的一个或多个给药频率:(1)每2天以1-4小时输注施用;(b)每3天以1-4小时输注施用;(c)每周日以24小时输注施用;和(d)每两周以24小时输注施用。
胆固醇流出可在受试者或受试者群体单核细胞,巨噬细胞或单核细胞中测量。
在某些实施方案中,本公开提供了用于治疗具有ABCA1缺陷的受试者的方法。在一些实施方案中,该方法包括对受试者施用治疗有效量的HDL治疗剂如CER-001。受试者可以是杂合或纯合的ABCA1突变。
在某些实施方案中,本公开包括治疗患家族原发性低α-脂蛋白血症的受试者的方法。在一些实施方案中,该方法包括:(a)根据诱导方案对受试者施用HDL治疗剂;和,随后(b)根据维持方案对受试者施用HDL治疗剂。维持方案可意味着以较低剂量,较低频率或两者一起来施用HDL治疗剂。受试者可以是杂合或纯合的ABCA1突变。受试者可以是纯合或杂合的LCAT突变。受试者可以是纯合的或杂合的ApoA-I突变。受试者可以是纯合或杂合的ABCG1突变。受试者也可以用脂质控制药物如阿托伐他汀,依泽替米贝,烟酸,罗舒伐他汀,辛伐他汀,阿司匹林,氟伐他汀,洛伐他汀,普伐他汀或它们的组合来治疗。
HDL治疗剂可以是CER-001和/或诱导方案可以是4周的持续时间。诱导方案可包括每周施用HDL治疗剂两次,三次或四次。其中HDL治疗剂是脂蛋白复合物如CER-001,在诱导方案中施用剂量可以选自8-15mg/kg被选择(基于蛋白质重量)。在特别的实施方案中,诱导剂量是8mg/kg,12mg/kg或15mg/kg。维持方案可包括施用HDL治疗剂至少一个月,至少两个月,至少三个月,至少六个月,至少一年,至少18个月,至少两年,或无限期。维持方案可包括每周施用HDL治疗剂一次或两次。其中HDL治疗剂是脂蛋白复合物如CER-001,在维持方案中施用的剂量可以选自1-6mg/kg被选择(基于蛋白质重量)。在特别的实施方案中,维持剂量是1mg/kg,3mg/kg或6mg/kg。
在某些实施方案中,(a)诱导方案利用与受试者的基线量和/或群体平均值相比,使一种或多种HDL标志物的表达水平降低20%-80%或40%-60%的剂量;和/或(b)其中维持方案利用与受试者的基线量和/或群体平均值相比,使一种或多种HDL标志物的表达水平降低不超过20%或不超过10%的剂量。
应当指出的是,除非上下文另有明确说明,在本申请中使用的不定冠词“一”和“一个”和定冠词“该”,如在专利申请中常见的意味着一个或多个。此外,在本申请中使用的术语“或”,如在专利申请中是常见的,意味着分开的“或”或结合的“和。“
本公开的特征和优点从以下实施方案的详细描述中将变得更加明显。
5,附图简述
图1描述卡方(CHI SQUARE)研究设计;
图2A-2C描述在施用CER-001的第一次和第六次输注后ApoA-1,磷脂和总血浆浓度;
图3描述MHICC和SAHMRI之间的帧(frame)分布;
图4描述在TAV和PAV的LS平均改变-mITT群体;
图5描述在TAV和PAV的LS平均改变-mPP群体;
图6A-6B描述CER-001的倒U形剂量-效应曲线。
图7描述CER-001、HDL3或ApoA-I对J774巨噬细胞中ABCA1表达的效应;
图8描述CER-001、HDL3或ApoA-I对J774巨噬细胞中ABCG1表达的效应;
图9描述CER-001、HDL3或ApoA-I对J774巨噬细胞中SR-BI表达的效应;
图10描述CER-001、HDL3或ApoA-I对J774巨噬细胞中SREBP-1表达的效应;
图11描述CER-001、HDL3或ApoA-I对J774巨噬细胞中SREBP-2表达的效应;
图12描述CER-001、HDL3或ApoA-I对J774巨噬细胞中LXR表达的效应;
图13描述用CER-001、HDL3或ApoA-I剂量(μg/mL)处理的774巨噬细胞中ABCG1的表达
图14描述用CER-001、HDL3或ApoA-I剂量(μg/mL)处理的J774巨噬细胞中ABCG1的表达;
图15描述用CER-001、HDL3或ApoA-I剂量(μg/mL)处理的J774巨噬细胞中SREBP-1的表达;
图16描述用CER-001、HDL3或ApoA-I剂量(μg/mL)处理的J774巨噬细胞中SR-BI的表达;
图17描述用CER-001、HDL3或ApoA-I处理J774巨噬细胞中随着时间下降的ABCA1 mRNA水平;
图18描述在存在和不存在cAMP的情况下,J774巨噬细胞中ABCA1mRNA水平;
图19描述在存在和不存在cAMP的情况下,J774巨噬细胞中ABCG1mRNA水平;
图20描述CER-001和HDL3对J774巨噬细胞中ABCA1蛋白质水平的影响;
图21描述CER-001和HDL3对J774巨噬细胞中ABCA1蛋白质水平的影响;
图22描述在增加的CER-001的浓度的存在下,cAMP对J774巨噬细胞中ABCA1 mRNA水平的调节的设置为0的作用;
图23描述在增加浓度的CER-001的存在下,cAMP对J774巨噬细胞中ABCA1 mRNA水平的调节的设置为0的作用;
图24描述在增加浓度的CER-001的存在下,cAMP对J774巨噬细胞中ABCG1 mRNA水平的调节;
图25描述在增加浓度的CER-001的存在下,cAMP对J774巨噬细胞中ABCG1 mRNA水平的调节的设置为0的作用;
图26描述在增加浓度的CER-001的存在下,cAMP对J774巨噬细胞中ABCA1 mRNA水平调节的影响;
图27描述用CER-001、HDL3和ApoA-I处理之后,返回到ABCA1的基线量所必需的时间;
图28描述用CER-001、HDL3和ApoA-I处理之后,返回到ABCG1的基线量所必需的时间;
图29描述用CER-001、HDL3和ApoA-I处理之后,返回到SR-BI的基线量所必需的时间;
图30描述CER-001、HDL3和ApoA-I对HepG2肝细胞中ABCA1水平的影响。
图31描述CER-001、HDL3和ApoA-I对HepG2肝细胞中SR-BI水平的影响。
图32描述CER-001、HDL3和ApoA-I对Hepa 1.6肝细胞中ABCA1水平的影响。
图33描述CER-001、HDL3和ApoA-I对Hepa 1.6肝细胞中SR-BI水平的影响。
图34描述在通过CER-001和HDL3下调ABCA1后添加ApoA-1的影响;
图35描述在通过CER-001和HDL3下调ABCG1后添加ApoA-1的影响;
图36描述在通过CER-001和HDL3下调SR-BI后添加ApoA-1的影响;
图37描述HDL2对巨噬细胞J774中ABCA1 mRNA水平的影响;
图38描述HDL2对巨噬细胞J774中ABCG1 mRNA水平的影响;
图39描述HDL2对巨噬细胞J774中SR-BI mRNA水平的影响;
图40描述β环糊精对胆固醇流出的效应;
图41描述在β环糊精的存在下,在J774巨噬细胞中ABCA1 mRNA水平的剂量依赖性降低;
图42描述在β环糊精的存在下,在J774巨噬细胞中ABCG1 mRNA水平的剂量依赖性降低;
图44描述在β环糊精的存在下,在J774巨噬细胞中SR-BI mRNA水平的剂量依赖性降低;
图44描述β环糊精对J774巨噬细胞中的LXR mRNA水平的影响;
图45描述β环糊精对J774巨噬细胞中的SREBP1 mRNA水平的影响;
图46描述β环糊精对J774巨噬细胞中的SREBP2 mRNA水平的影响;
图47描述用CER-001和HDL3处理的小鼠的结扎的颈动脉中未酯化胆固醇含量;
图48描述用CER-001和HDL3处理的小鼠的结扎的颈动脉中总胆固醇含量;
图49描述CER-001输液后血浆总胆固醇水平;
图50描述HDL3输注后的血浆总胆固醇水平;
图51描述CER-001输注后血浆未酯化胆固醇水平;
图52描述HDL3输注后血浆未酯化胆固醇水平;
图53描述针对CER-001和HDL3的剂量后(post-dose)血浆总胆固醇水平;
图54描述针对CER-001和HDL3的剂量后(post-dose)血浆未酯化胆固醇水平;
图55描述在给药CER-001后血浆ApoA-I的水平;
图56描述在给药HDL3后血浆ApoA-I的水平;
图57描述在结扎的颈动脉中ABCA1表达的western印迹检测;
图58描述在CER-001的最后一次注射后24小时肝脏ABCA1水平;
图59描述在CER-001的最后一次注射后24小时肝脏中的SR-BI水平;
图60描述用CER-001和HDL3注射的小鼠粪便中测量的胆固醇含量;
图61描述HDL颗粒形成的概况;
图62描述逆脂质运输(RLT)途径的概述;
图63描述HDL成熟步骤的概述;
图64描述人类ApoA-I的氨基酸序列(SEQ ID NO:1);
图65A1-65A3和图65B分别描述人类ABCA1的核苷酸和多肽序列(分别是SEQ ID NO:2和3);
图66A1-66A2和图66B分别描述人类ABCG1的核苷酸和多肽序列(分别是SEQ ID NO:4和5);
图67A1-67A2和图67B分别描述人类SREBP1的核苷酸和多肽序列(分别是SEQ ID NO:6和7)。
图68A-68G描述在SAMBA临床试验的受试者中胆固醇酯化的时间过程;
图69A-69G描述在SAMBA临床试验的受试者中通过LCAT酯化装载的胆固醇;
图70描述在SAMBA临床试验一个月后在单个受试者中颈动脉血管壁的厚度变化;
图71描述在SAMBA临床试验一个月后在单个受试者中主动脉血管壁的厚度变化;和
图72描述在SAMBA受试者中1个月和6个月后平均血管壁的厚度变化。6.发明详述
6.1.定义
如本文所用,下列术语旨在具有下列含义:
一种或多种状况是指以下的一种,多种或全部:血脂异常(如高脂血症,高胆固醇血症,冠状动脉心脏病,冠状动脉疾病,血管和血管周围疾病,和心血管疾病如动脉粥样硬化)和与血脂异常有关的疾病(如冠状动脉心脏病,冠状动脉疾病,急性冠状动脉综合征,不稳定型心绞痛,心肌梗塞,中风,短暂性脑缺血发作(TIA),内皮功能障碍,血栓形成如动脉粥样硬化性血管疾病,炎性疾病如血管内皮炎症,心血管疾病,高血压,缺氧诱导的血管生成,内皮细胞凋亡,黄斑变性,I型糖尿病,II型糖尿病,局部缺血,再狭窄,血管或血管周围疾病,异常脂蛋白血症,高水平的低密度脂蛋白胆固醇,高水平的极低密度脂蛋白胆固醇,低水平的高密度脂蛋白,高水平的脂蛋白Lp(a)胆固醇,高水平的载脂蛋白B,动脉粥样硬化,例如动脉供血不足引起的间歇性跛行,加速的动脉粥样硬化,移植动脉粥样硬化,家族性高胆固醇血症(FH),家族性混合型高脂血症(FCH),脂蛋白脂肪酶缺失症,如高甘油三酯血症,低α-脂蛋白血症,和高胆固醇血症)。在一些实施方案中,脂质异常病症与家族原发性低α-脂蛋白血症(FPHA),如Tangier病,ABCA1缺陷,ApoA-I缺失,LCAT缺失或鱼眼病相关。
“IUSDEC”是指“倒U形的剂量-效应曲线”。IUSDEC是治疗剂的剂量和患者反应之间的非线性关系。增加给定治疗的剂量看起来使效应增加至最大值(剂量反应曲线具有正相性斜率的部分),在此之后(拐点),效应减少(剂量反应曲线具有负相性斜率的部分)。
“HDL治疗剂”是指用于治疗高胆固醇血症或高血脂症及相关疾病状况的治疗剂。HDL治疗剂的实例包括HDL模拟脂蛋白复合物(例如,CER-001,CSL-111,CSL-112,CER-522,ETC-216)和小分子(例如,他汀类类)。
“HDL标志物”是指分子标志物,其表达与响应于用HDL模拟物治疗的IUSDEC相关。示例性HDL标志物是ABCA1,ABCG1,ABCG5,ABCG8和SREBP1。HDL标志物可以在mRNA或蛋白质水平上进行测定,如按照第6.2节中所述进行测定。
6.2.伴随诊断方法
胆固醇逆向转运(RCT)是蓄积的胆固醇从血管壁运送到肝脏排出,从而防止动脉粥样硬化的路径。RCT的主要成分包括受体,如高密度脂蛋白(HDL)和载脂蛋白A-I(ApoA-1),以及酶如卵磷脂:胆固醇酰基转移酶(LCAT),磷脂转移蛋白(PLTP),肝脂肪酶(HL)和胆固醇酯转移蛋白(CETP)。RCT的关键部分是胆固醇流出,其中蓄积的胆固醇从巨噬细胞,例如在血管壁的内膜下层,通过ATP结合膜盒转运体A1(ABCA1)和G1(ABCG1)或通过其他机制,包括被动扩散,清道夫受体B1(SR-B1),小窝蛋白(caveolin)和甾醇27羟化酶除去,并通过HDL和ApoA-I收集。然后在HDL中的酯化胆固醇被递送到肝脏排出。固醇调节元件结合因子1基因(SREBP1)通过调节脂肪酸和胆固醇生物合成来影响RCT。
本公开部分地基于对用HDL治疗剂治疗的IUSDEC型响应的发现。本公开进一步部分地基于HDL治疗剂IUSDEC根本的作用机制的发现,即响应用HDL治疗剂治疗下调参与胆固醇流出的蛋白质(在本文中称为HDL标志物)(例如,ABCA1,ABCG1)表达或调节RCT途径(例如,SREBP1)。已经发现,这种蛋白质的下调与响应于用HDL治疗剂治疗的IUSDEC相关。
本公开部分涉及利用这种现象来诊断,预测和剂量优化HDL治疗剂以利用在剂量-反应曲线拐点附近的剂量,即,其中剂量-反应关系是最大化的。
本公开部分涉及利用这种现象来诊断,预测和剂量优化HDL治疗剂以利用在剂量-反应曲线拐点附近的剂量,即,其中剂量-反应关系是优化的同时不使用过量的HDL治疗剂。
在其它方面,本公开涉及鉴定对介导胆固醇流出,例如,从单核细胞,巨噬细胞或单核细胞流出的HDL标志物的表达和/或功能的影响最小化的治疗剂量和给药日程表。在一些方面中,选择不会使一种或多种HDL标志物的表达降低超过定义截留点(例如,10%,20%,30%,40%,50%,60%,70%或80%的HDL标志物的参考量)剂量。在某些实施方案中,截留量选自前述截留量的任意两个所限定的参考的任何范围,例如,20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等,可以为20%至80%。参考可以是受试者自身的基线或一些群体的平均值。该群体可以是年龄,性别和/或疾病的风险因子(例如,遗传或生活方式风险因子)相匹配的群体。群体平均值可以是正常群体或与受试者患相同或相似状况的群体。特定的HDL标志物和截留点,将取决于特定的HDL治疗剂,受试者的状况,以及受试者可以接受的其他疗法。
在一些方面中,特别是在涉及组合疗法时,选择使一种或多种HDL标志物的表达的减少不超过20%的剂量,在一些实施方案中,减少不超过10%,并且在其它实施方案中根本不会降低一种或多种HDL标志物的表达。
如本文所述的HDL标志物可用于优化第6.6节的治疗方法中的任一种。在某些实施方案中,本公开提供了鉴定有效地使受试者中的胆固醇流通的一剂HDL治疗剂的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者,(b)在施用所述第一剂量后,测量一种或多种HDL标志物在来自所述受试者的测试样品中,优选所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第一剂量对所述表达水平的效应;和(c)(i)如果受试者的一种或多种HDL标志物的表达水平的降低超过截留量,施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量低于第一剂量;或(ii)如果受试者的一种或多种HDL标志物的表达水平的降低未超过截留量,用所述HDL治疗剂的第一剂量治疗受试者。
在某些实施方案中,本公开提供了用于监测HDL治疗剂在受试者中的功效的方法。在一些实施方案中,该方法包括:(a)根据第一给药日程表用HDL治疗剂治疗受试者,(b)测量在来自所述受试者的测试样品中,优选所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一给药日程表对所述表达水平的效应;及(c)(i)如果受试者的一种或多种HDL标志物的表达水平的降低超过上截留量(upper cutoff amount),根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较低剂量,在一段较长的时间中将HDL治疗剂输注到受试者中,并且不太频繁地施用HDL治疗剂至受试者;(ii)如果受试者的一种或多种HDL标志物的表达水平的降低未超过下截留量(lower cutoff amount),根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较高剂量,在一段较短的时间中将HDL治疗剂输注到受试者中,并且较频繁地施用HDL治疗剂至受试者;或(iii)如果受试者的一种或多种HDL标志物的表达水平降低的量在上截留量和下截留量之间,根据第一给药日程表持续治疗受试者。
截留量可以是相对于在所述施用之前受试者的自身基线,或截留量可以是相对于对照量,如来自例如,健康受试者或具有与受试者相同疾病状况的群体的群体平均值。
在某些实施方案中,本公开提供了鉴定能有效地使胆固醇流通的HDL治疗剂剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者群体,(b)在施用所述第一剂量后,测量一种或多种HDL标志物在来自所述受试者的测试样品中,优选所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第一剂量对所述表达水平的效应;(c)施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量高于或低于第一剂量;(d)在施用所述第二个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平,以评估所述第二剂量对所述表达水平的效应;(e)针对所述HDL治疗剂的一个或多个额外剂量任选地重复步骤(c)和(d);和(f)鉴定受试者的一种或多种HDL标志物的表达水平的降低不会超过截留量的最高剂量,从而鉴定能有效地使胆固醇流通的剂量HDL治疗剂。
在一些实施方案中,在施用所述第二个剂量后,测量一种或多种HDL标志物在所述测试样品(例如循环单核细胞,巨噬细胞或单核细胞)中的表达水平,以评估所述第二剂量对所述表达水平的效应。如果受试者的一种或多种HDL标志物的表达水平的降低超过截留量,施用所述HDL治疗剂的第三剂量,其中所述HDL治疗剂的第三剂量低于第二剂量
在某些实施方案中,本公开提供了用于治疗需要HDL治疗剂的受试者的方法。在一些实施方案中,该方法包括施用至受试者以下的组合:(a)与受试者的基线量相比,使一种或多种HDL标志物在来自所述受试者的测试样品(例如,所述受试者的循环单核细胞,巨噬细胞或单核细胞)中的表达水平的降低不超过20%或10%的剂量的脂蛋白复合物;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸,他汀类,贝特类,PCSK9抑制剂,依泽替米贝,和CETP抑制剂。
在某些实施方案中,本公开提供了用于治疗需要HDL治疗剂的受试者的方法。在一些实施方案中,该方法包括施用至受试者以下的组合:(a)与对照量相比,使一种或多种HDL标志物在来自所述受试者的测试样品(例如,所述受试者的循环单核细胞,巨噬细胞或单核细胞)的表达水平的降低不超过20%或10%的剂量的脂蛋白复合物;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸,他汀类,贝特类,PCSK9抑制剂,依泽替米贝,和CETP抑制剂。
对照量可以是群体平均值,如来自例如,健康受试者或具有与受试者相同疾病状况的群体的群体平均值。受试者可以是人或受试者群体是人类受试者群体。受试者可以是非人动物,例如,小鼠,或受试者群体可以是非人动物的群体。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是ABCA1。例如,对ABCA1 mRNA的表达水平或ABCA1蛋白表达水平进行了测量。ABCA1截留量可以为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。ABCA1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是ABCG1。例如,对ABCG1 mRNA的表达水平或ABCG1蛋白表达水平进行了测量。ABCG1截留量可以为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。ABCG1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在本文中所描述的方法的某些实施方案中,至少一种HDL标志物是SREBP-1。例如,对SREBP-1mRNA的表达水平或SREBP-1蛋白表达水平进行了测量。SREBP-1截留量可以为10%,20%,30%,40%,50%,60%,70%或80%,或选自前述截留量中的任意两个所限定的任何量,例如20%-80%,30%-70%,40%-60%,10%-50%,10%-40%,20%-50%,等等。SREBP-1表达水平可以在施用2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时后进行测量。
在一些实施方案中,鉴定不改变或甚至增加一种或多种HDL标志物在受试者的循环单核细胞,巨噬细胞或单核细胞的表达水平的。的水平的剂量。水平可以增加至少10%,至少20%,至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,或由上述值中的任意两个限定的范围中,例如该水平可增加多达10%,多达20%,多达50%,10%-50%,20%-60%,等等。
在某些实施方案中,HDL治疗剂是脂蛋白复合物。脂蛋白复合物可以包括载脂蛋白例如ApoA-I,ApoA-II,ApoA-IV,ApoE或它们的组合。脂蛋白复合物可以包括载脂蛋白的肽模拟物诸如如ApoA-I,ApoA-II,ApoA-IV,ApoE肽模拟物或其组合。脂蛋白复合物可以是CER-001,CSL-111,CSL-112,CER-522,或ETC-216。在其他实施方案中,HDL治疗剂是脱脂或脂质差脂蛋白。
在某些实施方案中,HDL治疗剂是一种小分子,例如CETP抑制剂或泛酸衍生物。
在某些实施方案中,本文描述的方法进一步包括确定截留量。例如,所述截留量可以通过产生针对HDL治疗剂的剂量反应曲线来确定。截留量可以是在剂量反应曲线的拐点的HDL标志物的表达水平的25%,40%,50%,60%,或75%。在特定的实施方案中,截留量选自前述截留量中的任何两个限定的范围,例如,在剂量反应曲线的拐点的HDL标志物的表达水平的30%-70%,40%-60%,25%-50%,25%-75%等。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定不会使所述一种或多种HDL标志物的表达水平增加超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)在每个剂量后,测量一种或多种HDL标志物在所述受试者的循环单核细胞,巨噬细胞或单核细胞中的表达水平;和(c)鉴定不会使所述一种或多种HDL标志物的表达水平在所述受试者中增加超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的剂量的方法。在一些实施方案中,该方法包括:鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最高剂量。鉴定适合于疗法的HDL治疗剂的剂量的方法,可包括:(a)施用一个或多个剂量的HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
在某些实施方案中,本公开提供了鉴定适合于疗法的HDL治疗剂的给药间隔的方法。在一些实施方案中,该方法包括:鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最频繁的给药日程表的最高剂量。鉴定适合于疗法的HDL治疗剂的给药间隔的方法,可包括:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不会使所述受试者中的胆固醇流出降低超过50%至100%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
6.3.HDL疗法
本公开的HDL治疗剂包括脂蛋白复合物,去脂或脂质差脂蛋白,肽,融合蛋白和HDL模拟物。值得注意的是,“脂蛋白”和“载脂蛋白”在本文中可互换使用。
脂蛋白复合物包含蛋白质部分(例如载脂蛋白部分)和脂质部分(例如磷脂部分)。所述蛋白质部分包含一种或者多种当存在于脂蛋白复合物中时能够动员胆固醇的脂质-结合蛋白,诸如载脂蛋白、肽或者载脂蛋白肽类似物或者模拟物。所述载脂蛋白和载脂蛋白肽的非限制性实例包括ApoA-I,ApoA-II,ApoA-IV,ApoA-V和ApoE,优选它们的成熟形式。脂质结合蛋白还可以是前述载脂蛋白的活性多形形式(active polymorphic form),同种型,变体和突变体,以及截短形式,其中最常见的载脂蛋白是载脂蛋白A-I Milano(ApoA-IM),载脂蛋白A-I巴黎(ApoA-IP)的截短形式,和A-IZaragoza(ApoA-IZ)。含有半胱氨酸残基的载脂蛋白突变体也是已知的,并且也可以使用(参见,例如,美国公开号2003/0181372)。载脂蛋白可以是单体或二聚体的形式,所述二聚体可以是同二聚体或异二聚体。例如,ApoA-I的同二聚体和异源二聚体(在可行的情况)(Duverger et al.,1996,Arterioscler.Thromb.Vasc.Biol.16(12):1424-29),ApoA-IM(Franceschini et al.,1985,J.Biol.Chem.260:1632-35),ApoA-IP(Daum et al.,1999,J.Mol.Med.77:614-22),ApoA-II(Shelness et al.,1985,J.Biol.Chem.260(14):8637-46;Shelness et al.,1984,J.Biol.Chem.259(15):9929-35),ApoA-IV(Duverger et al.,1991,Euro.J.Biochem.201(2):373-83),ApoE(McLean et al.,1983,J.Biol.Chem.258(14):8993-9000),可以使用ApoJ和ApoH。
载脂蛋白可以包括与促进其分离的元件(比如His标记)或经设计用于其他目的其他元件相应的残基,只要当该载脂蛋白包括在复合物中时能够保留某些生物活性即可。在一个具体的实施方案中,所述载脂蛋白部分基本上由ApoA-I构成,最优选地为单一同等型。脂蛋白复合物中的ApoA-I可具有与相应于图64的ApoA-I脂蛋白(SEQ ID NO:1)的氨基酸25-267的蛋白至少90%或者至少95%的序列同一性。任选地,ApoA-I进一步包含在相应于SEQ ID NO:1的全长ApoA-I氨基酸25的位置(以及成熟蛋白的位置1)上的门冬氨酸。优选地,至少75%、至少80%、至少85%、至少90%或者至少95%的ApoA-I为经恰当工程化的成熟蛋白(即,缺失信号和前肽序列)且为未被氧化、被脱去酰胺和/或者被截短的。
可以使用适合作为载脂蛋白用于此处描述的荷电络合物及组合物中的、与载脂蛋白相应的肽和肽类似物以及模拟ApoA-I、ApoA-I、ApoA-II、ApoA-IV和Apo-E活性的激动剂。肽和肽模拟物的非限制性实例在以下文献中公开:美国专利号6,004,925、6,037,323和6,046,166(授予Dasseux等人);美国专利号5,840,688(授予Tso);美国公开号2004/0266671、2004/0254120、2003/0171277和2003/0045460(Fogelman的);以及美国公开号2003/0087819(Bielicki的)和PCT公开号WO2010/093918(Dasseux等人),通过引用将其全部公开内容并入本文。这些肽和肽类似物可以包括L-氨基酸或D-氨基酸或者包括L-氨基酸与D-氨基酸的混合物。所述肽和肽类似物还可以包括一种或多种非肽或酰胺键合,比如一种或多种公知的肽/酰胺等排物。可以使用本领域已知的任何肽合成技术来合成或制备此类“肽和/或肽模拟物”载脂蛋白,所述肽合成技术包括,如美国专利号6,004,925、6,037,323和6,046,166中描述的技术。
脂蛋白可以以脱脂的形式,或在除了蛋白质部分还含有脂质部分的脂蛋白复合物的形式用于HDL治疗剂。所述脂质部分通常包含一种或者多种磷脂,所述磷脂可为中性的、荷负电的、荷正电的或者它们的组合。所述磷脂上的脂肪酸链在长度上优选含有12-26或者16-26个碳且可在饱和程度上为饱和至单不饱和。示例性磷脂包括小烷基链磷脂、蛋磷脂酰胆碱、大豆磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二肉豆蔻酰磷脂酰胆碱、二硬脂酰磷脂酰胆碱、1-肉豆蔻酰-2-棕榈酰磷脂酰胆碱、1-棕榈酰-2-肉豆蔻酰磷脂酰胆碱、1-棕榈酰-2-硬脂酰磷脂酰胆碱、1-硬脂酰-2-棕榈酰磷脂酰胆碱、二油酰磷脂酰胆碱、二油酰磷脂酰乙醇胺、二月桂酰磷脂酰甘油磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰甘油、二磷脂酰甘油诸如二肉豆蔻酰磷脂酰甘油、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰甘油、二油酰磷脂酰甘油、二肉豆蔻酰磷脂酸、二棕榈酰磷脂酸、二肉豆蔻酰磷脂酰乙醇胺、二棕榈酰磷脂酰乙醇胺、二肉豆蔻酰磷脂酰丝氨酸、二棕榈酰磷脂酰丝氨酸、脑磷脂酰丝氨酸、脑鞘磷脂、蛋鞘磷脂、乳鞘磷脂、棕榈酰鞘磷脂、植物鞘磷脂、二棕榈酰鞘磷脂、二硬脂酰鞘磷脂、二棕榈酰磷脂酰甘油盐、磷脂酸、半乳糖脑苷脂、神经节苷酯、脑苷脂、二月桂基磷脂酰胆碱、(1,3)-D-甘露糖基-(1,3)甘油二酯、氨基苯基糖苷、3-胆固醇基-6'-(糖基硫基)己基醚糖脂以及胆固醇及其衍生物。包含SM和棕榈酰鞘磷脂的磷脂部分可任选地包含少量的任意类型的脂质,包括但不限于溶血磷脂质、除了棕榈酰鞘磷脂之外的鞘磷脂、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯以及胆固醇及其衍生物。
在某些而实施方案中,所述脂质部分含有至少一种中性磷脂以及任选地一种或者多种负电荷磷脂。在包含中性和负电荷磷脂的脂蛋白复合物中,所述中性和负电荷磷脂可含有具有相同或者不同数目的碳以及相同或者不同程度的饱和度的脂肪酸链。在一些情况下,所述中性和负电荷磷脂将具有相同的酰基末端,例如C16:0,或者棕榈酰、酰基链。在具体的实施方案中,特别其中将卵SM用作中性脂质的实施方案中,载脂蛋白部分:脂质部分为的重量比为约1:2.7至约1:3(例如,1:2.7)。
在生理学pH带有至少部分负电荷的任何磷脂可用作负电荷磷脂。非限制性实例包括荷负电的形式,例如磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰甘油和磷脂酸的盐。在一个具体的实施方案中,所述负电荷磷脂为1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]或者DPPG、磷脂酰甘油。优选的盐包括钾盐和钠盐。
在一些实施方案中,HDL治疗剂是在美国专利号8206750或WO WO 2012/109162(及其美国的对应物,US 2012/0232005),其各自的内容通过引用全部并入本文。在特定的实施方案中,脂蛋白复合物的蛋白质组分是如第6.1节所描述的,并且优选是WO 2012/109162的6.1.1节中所描述的(和US 2012/0232005),脂组分是如WO 2012/109162(和US 2012/0232005)的6.2节所描述的,其可任选地与WO 2012/109162(和US 2012/0232005)中描述的量组合。将这些章节的每一部分的内容通过引用并入本文。在某些方面,脂蛋白复合物中处于至少85%,至少90%,至少95%,至少97%,或至少99%均质的复合物群体中,如WO 2012/109162(和US2012/0232005)第6.4节中描述的,所述专利的内容在此通过引用并入本文。
在一个具体的实施方案中,脂蛋白复合物基本上由2-4 ApoA-I等同物,2分子带电磷脂,50-80分子卵磷脂和20-50分子SM组成。
在另一个具体的实施方案中,脂蛋白复合物基本上由2-4 ApoA-I等同物,2分子带电磷脂,50分子卵磷脂和50分子SM组成。
在另一个具体的实施方案中,脂蛋白复合物基本上由2-4 ApoA-I等同物,2分子带电磷脂,80分子卵磷脂和20分子SM组成。
在另一个具体的实施方案中,脂蛋白复合物基本上由2-4 ApoA-I等同物,2分子带电磷脂,70分子卵磷脂和30分子SM组成。
在另一个具体的实施方案中,脂蛋白复合物基本上由2-4 ApoA-I等同物,2分子带电磷脂,60分子卵磷脂和40分子SM组成。
在一个具体的实施方案中,脂蛋白复合物是三元复合物,其中脂质组分基本上由约90至99.8wt%SM和约0.2至10wt%的带负电荷的磷脂组成,例如约0.2-1wt%,0.2-2wt%,0.2-3wt%,0.2-4wt%,0.2-5wt%,0.2-6wt%,0.2-7wt%,0.2-8wt%,0.2-9wt%,或0.2-10wt%的总带负电荷的磷脂组成。在另一具体实施方案中,脂蛋白复合物是三元复合物,其中脂质部分基本上由约90至99.8wt%卵磷脂和约0.2至10wt%的带负电荷的磷脂,例如约0.2-1wt%,0.2-2wt%,0.2-3wt%,0.2-4wt%,0.2-5wt%,0.2-6wt%,0.2-7wt%,0.2-8wt%,0.2-9wt%或0.2-10wt%的总负电荷的磷脂组成。
在又一具体实施方案中,脂蛋白复合是四元复合物,其中脂质部分基本上由约9.8-90wt%的SM,约9.8至90wt%卵磷脂和约0.2-10wt%带负电荷的磷脂,例如,约0.2-1wt%,0.2-2wt%,0.2-3wt%,0.2-4wt%,0.2-5wt%,0.2-6wt%,0.2-7wt%,0.2-8wt%,0.2-9wt%,以0.2-10wt%的总负电荷的磷脂组成。
在另一具体实施方案中,脂蛋白复合物由33wt%proApoAI,65wt%鞘磷脂和2wt%磷脂酰甘油组成。
在另一具体实施方案中,脂蛋白复合物包含ApoA-I载脂蛋白和脂质部分,其中,所述脂质部分基本上由鞘磷脂和约3wt%的带负电荷的磷脂组成,其中,所述脂质部分与ApoA-载脂蛋白的摩尔比为约2:1至200:1,并且其中所述脂蛋白复合物是含有2-4 ApoA-I等同物的小型或大型圆盘状颗粒。
复合物可以包括单种类型的载脂蛋白,或者包括两种或多种不同的载脂蛋白的混合物,所述两种或多种不同的载脂蛋白可以源自相同或不同的物种。尽管不需要,但是该荷电的脂蛋白复合物仍优选地包括源自受治疗动物物种的氨基酸序列的载脂蛋白或与其相应的载脂蛋白,以避免产生对治疗免疫应答的诱导作用。因此,对于人类患者的治疗,人类来源的脂质结合蛋白优选第用于本公开的复合物。载脂蛋白肽模拟物的使用还可以诱导或避免产生免疫应答。
在优选的实施方案中,脂质组分包括两种类型的磷脂:鞘磷脂(SM)和带负电荷的磷脂。SM是“中性”磷脂,原因在于它在生理pH具有约为零的净电荷。因此,如本文所用,表述“SM”包括源自或获自天然来源的鞘磷脂,以及与天然形成的SM一样的、不受LCAT水解影响的天然形成的SM的类似物和衍生物。
事实上,SM可以源自任何来源。例如,SM可以由牛奶、蛋或脑获得。还可以使用SM类似物或衍生物。有用的SM类似物和衍生物的非限制性实例包括但不限于棕榈酰鞘磷脂、N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(一种形式的植物鞘磷脂)、棕榈酰鞘磷脂、硬脂酰鞘磷脂、D-赤藓糖-N-16:0-鞘磷脂及其二氢异构体、D-赤藓糖-N-16:0-二氢-鞘磷脂。可使用合成的SM诸如合成的棕榈酰鞘磷脂或者N-棕榈酰-4-羟基二氢鞘氨醇-1-磷酸胆碱(植物鞘磷脂),以产生更均质的复合物以及更少的污染物和/或者氧化产物(相比于动物来源的鞘脂)。
可以人工地使由天然来源分离的鞘磷脂富含一种特殊的饱和或不饱和酰基链。例如,乳鞘磷脂(Avanti Phospholipid,Alabaster,Ala.)的特征为具有饱和的长酰基链(即,具有20个或更多个碳原子的酰基链)。相反,蛋鞘磷脂的特征为具有饱和的短酰基链(即,具有少于20个碳原子的酰基链)。例如,虽然只有大约20%的乳鞘磷脂包括C16:0(16个碳,饱和的)酰基链,但是却有约80%的蛋鞘磷脂包括C16:0酰基链。可以通过使用溶剂萃取来使乳鞘磷脂的组成富含与蛋鞘磷脂具可比性的酰基链组分,反之亦然。
为使SM具有特定的酰基链,其可以是半合成的。例如,首先可将乳鞘磷脂从乳品纯化,然后可将一种特定的酰基链如C16:0酰基链裂解并替换为另一酰基链。SM也可以完全通过例如大规模合成来进行合成。参见,例如Dong et al.,美国专利5,220,043,标题为Synthesis of D-erythro-sphingomyelins,issued Jun.15,1993;Weis,1999,Chem.Phys.Lipids 102(1-2):3-12。
可以选择性地改变构成半合成或合成SM的酰基链的长度和饱和度。所述酰基链可以是饱和或不饱和的,并且可以含有约6至约24个碳原子。每条链可以含有相同数目的碳原子,或者可选地,每条链可以含有不同数目的碳原子。在一些实施方案中,半合成或合成的SM包含混合的酰基链,以使其中的一条链为饱和的而另一条链为不饱和的。在具有这样混合的酰基链的SM中,该链的长度可以相同或不同。在其它实施方案中,半合成或合成SM的酰基链可均为饱和或不饱和的。此外,该链可以含有相同或不同数目的碳原子。在一些实施方案中,构成半合成或合成SM的酰基链是相同的。在一个具体的实施方案中,该链与天然形成的脂肪酸的酰基链一致,所述天然形成的脂肪酸的例子如肉豆蔻酸、油酸、棕榈酸、硬脂酸、亚油酸、linonenic acid或花生四烯酸。在另外的实施方案中,使用具有饱和或者不饱和官能链的SM。在另一个具体的实施方案中,这两种酰基链均为饱和的并且均含有6至24个碳原子。
在优选的实施方案中,所述SM为棕榈酰SM诸如合成的棕榈酰SM,其具有C16:0酰基链,或者其为蛋SM,其包含作为主要成分的棕榈酰SM。
在一个具体的实施方案中,使用官能化的SM诸如植物鞘磷脂。
所述脂质部分优选包含负电荷磷脂,即在生理pH条件下具有负的净电荷的磷脂。所述负电荷磷脂可包含单一类型的负电荷磷脂,或者两种或者更多种不同的荷负电的磷脂的混合物。在一些实施方案中,所述荷电磷脂为荷负电的甘油磷脂。适当的负电荷磷脂的具体实例包括但不限于1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]、磷脂酰甘油、磷脂酰肌醇、磷脂酰丝氨酸和磷脂酸。在一些实施方案中,所述负电荷磷脂包含一种或者多种磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰甘油和/或者磷脂酸。在一个具体的实施方案中,所述负电荷磷脂由1,2-二棕榈酰-sn-甘油-3-[-磷酸-外消旋-(1-甘油)]或者DPPG构成。
与SM一样,负电荷磷脂可以由天然来源获得或者通过化学合成制备。如上文与SM相关的讨论一样,在采用合成的负电荷磷脂的实施方案中,可以选择性地改变酰基链的特性。在本申请描述的荷电脂蛋白复合物的一些实施方案中,该负电荷磷脂上的两种酰基链是相同的。在一些实施方案中,SM以及负电荷磷脂上的酰基链全部相同。在特定的实施方案中,所述一种或者多种负电荷磷脂和/或SM均具有C16:0或C16:1酰基链。在特定的实施方案中,所述SM的脂肪酸部分主要为C16:1棕榈酰。在一个特定的实施方案中,所述一种或者多种荷电的磷脂和/或SM的酰基链与棕榈酸的酰基链一致。
使用的磷脂优选为至少95%纯的和/或者具有降低水平的氧化剂。由天然来源获得的脂质优选具有较少的多不饱和脂肪酸部分和/或者不易于氧化的脂肪酸部分。样品的氧化水平可使用碘量法来确定,其提供了过氧化值,表示为每千克样品的分离的碘的毫当量数,缩写为meq O/kg。参见例如Gray,J.I.,Measurement of Lipid Oxidation:A Review,Journal of the American Oil Chemists Society,Vol.55,p.539-545(1978);Heaton,F.W.and Uri N.,Improved Iodometric Methods for the Determination of Lipid Peroxides,Journal of the Science of food and Agriculture,vol 9.P,781-786(1958)。优选地,所述氧化水平或者过氧化物水平是低的,例如小于5meq O/kg、小于4meq O/kg、小于3meq O/kg或者小于2meq O/kg。
包含SM和棕榈酰鞘磷脂的脂质部分可任选地包含少量的额外的脂质。实际上,可使用任何类型的脂质,包括但不限于溶血磷脂质、半乳糖脑苷脂、神经节苷酯、脑苷脂、甘油酯、甘油三酯和胆固醇及其衍生物。
当包括在内时,所述任选的脂质通常包含小于约15wt%的脂质部分,尽管在一些情况下可包含更任选的脂质。在一些实施方案中,任选的脂质为小于约10wt%、小于约5wt%或者小于约2wt%。在一些实施方案中,所述脂质部分不包含任选的脂质。
在一个具体的实施方案中,所述磷脂部分含有重量比(SM:负电荷磷脂)范围为90:10至99:1、更优选范围为95:5至98:2的蛋SM、棕榈酰SM或者植物鞘磷脂以及DPPG。在一个实施方案中,所述重量比为97:3。
脂蛋白复合物也可用作载体来递送疏水性、亲脂性或者非极性活性剂以用于各种治疗或者诊断应用。对于所述应用,所述脂质部分可进一步包含一种或者多种疏水性、亲脂性或者非极性活性剂,包括但不限于脂肪酸、药物、核酸、维生素和/或者营养素。适当的疏水性、亲脂性或者非极性活性剂并不限于治疗类别,且可为例如镇痛药、抗炎剂、驱虫药、抗心律不齐药、抗菌剂、抗病毒剂、抗凝血剂、抗抑郁药、抗糖尿病药、抗癫痫剂、抗真菌剂、抗痛风药、抗高血压剂、抗疟药、抗偏头痛药、抗毒蕈碱剂、抗肿瘤药、勃起机能障碍改善剂、免疫抑制剂、抗原虫剂、抗甲状腺剂、抗焦虑剂、镇静药、安眠药、神经镇静药、β-阻滞剂、心脏收缩药(cardiac inotropic agents)、皮质类固醇(corticosteroids)、利尿剂、抗帕金森综合征剂、胃肠药、组胺受体拮抗剂、角质层分离剂、脂质调节剂、抗心绞痛药、cox-2抑制剂、白三烯抑制剂、大环内酯类、肌肉松弛药(muscle relaxants)、营养剂、核酸(例如小干扰RNA)、阿片样物质镇痛药、蛋白酶抑制剂、性激素类、兴奋药、肌肉松弛药、抗骨质疏松药(anti-osteoporosis agents)、减肥药、认知增强药、抗尿失禁药、营养油、抗良性前列腺肥大药、必需脂肪酸、非必需脂肪酸以及它们的混合物。
脂蛋白复合物中脂质部分与蛋白部分的摩尔比可以改变,并且除了其它因素之外,该摩尔比取决于构成所述蛋白部分的载脂蛋白的特性、构成所述脂质部分的荷电磷脂的特性和数量以及荷电脂蛋白复合物的期望尺寸。由于认为载脂蛋白(诸如ApoA-I)的生物活性受构成载脂蛋白的两亲性螺旋介导,因此可方便地使用ApoA-I蛋白质当量来表示脂质:载脂蛋白摩尔比的载脂蛋白部分。一般公认ApoA-I含有6-10个两亲性螺旋,并且其取决于用来计算螺旋的方法。可以ApoA-I当量来表示其它的载脂蛋白,根据它们含有的两亲性螺旋数目。例如,可将通常以二硫桥键二聚体存在的ApoA-IM表示为2当量的ApoA-I,原因是每分子ApoA-IM含有的两亲性螺旋是每分子ApoA-I的两倍。相反,可将含有一个两亲性螺旋的肽载脂蛋白表示为1/10-1/6当量的ApoA-I,原因是其每分子含有的两亲性螺旋是每分子ApoA-I的1/10-1/6。一般而言,脂蛋白复合物(此处定义为“Ri”)中脂质:ApoA-I当量的摩尔比范围为约105:1至110:1。在一些实施方案中,Ri约为108:1。对于磷脂,使用约为650-800的MW可以获得重量比。
在一些实施方案中,脂质:ApoA-I等价物的摩尔比(“RSM”)的范围为约80:1至约110:1,例如约80:1至约100:1。在一个具体的实例中,脂蛋白复合物的RSM可为约82:1。
在优选的实施方案中,所述脂蛋白复合物为荷负电的脂蛋白复合物,其包含蛋白部分和脂质部分,所述蛋白部分优选为成熟的全长ApoA-I,且所述脂质部分包含中性磷脂、鞘磷脂(SM)和负电荷磷脂。
在一个具体的实施方案中,所述脂质组分含有重量比范围为90:10至99:1、更优选范围为95:5至98:2例如97:3(SM:负电荷磷脂)的蛋SM、棕榈酰SM或者植物SM以及DPPG。
在一些具体的实施方案中,ApoA-I蛋白部分与脂质部分的比的范围通常为约1:2.7至约1:3,其中1:2.7是优选的。这相应于ApoA-I蛋白与磷脂的摩尔比为约1:90至1:140。在一些实施方案中,所述蛋白与脂质的摩尔比为约1:90至约1:120、约1:100至约1:140或者约1:95至约1:125。
在特定的实施方案中,复合物是CER-001,CSL-111,CSL-112,CER-522或ETC-216。
CER-001包含ApoA-I,鞘磷脂(SM)和DPPG,其中脂蛋白重量:总磷脂重量比为1:2.7,SM:DPPG重量比是97:3。优选地,SM是蛋SM,尽管可以取代为合成SM或植物SM。在一些实施方案中,复合物是按WO 2012/109162的实施例4中描述的方法制备。
CSL-111是从血浆纯化的与大豆磷脂酰胆碱(SBPC)络合的重组人载脂蛋白ApoA-I(Tardif et al.,2007,JAMA 297:1675-1682)。
CSL-112是从血浆中纯化和重组,以形成HDL适于静脉输注的ApoA-I的制剂(Diditchenko et al.,2013,DOI 10.1161/ATVBAHA.113.301981)。
ETC-216(也称为MDCO-216)是HDL的脂质缺失形式,含有重组ApoA-IMilano-参见Nicholls et al.,2011,Expert Opin Biol Ther.11(3):387-94.doi:10.1517/14712598.2011.557061。
在另一个实施方案中,复合物是CER-522,其包含三种磷脂的组合和22个氨基酸的肽的脂蛋白复合物,CT80522:
CT80522
CER-522的磷脂成分由卵鞘磷脂,1,2-二棕榈酰-sn-甘油基-3-磷酸胆碱(二棕榈酰磷脂酰胆碱DPPC)和1,2-二棕榈酰-sn-甘油-3-[磷酸外消旋-(1-甘油)](Dipalmitoylphosphatidyl-甘油,DPPG)组成,重量比为48.5:48.5:3。在CER-522复合物中肽与总磷脂的比例为1:2.5(w/w)。
HDL治疗剂的其它实例包括,但不限于在以下美国专利中描述的脂蛋白复合物,脱脂载脂蛋白,肽,融合蛋白和HDL模拟物:美国专利号8,617,615;8,206,750;8,378,068;7,994,120;7,566,695;7,312,190;7,307,058;7,273,848;7,250,407;7,211,565;7,189,689;7,189,411;7,157,425;6,900,177;6,844,327;6,753,313;6,734,169;6,716,816;6,630,450;6,602,854;6,573,239;6,455,088;6,376,464;6,329,341;6,287,590;6,265,377;6,046,166;6,037,323;6,004,925;6,743,778;8,383,592;8,101,565;8,044,021;7,985,728;7,985,727;8,568,766;8,557,767;8,404,635;8,148,328;8,048,851;7,994,132;7,820,784;7,807,640;7,723,303;7,638,494;7,531,514;7,199,102;7,166,578;7,148,197;7,144,862;6,933,279;6,930,085;8,541,236;8,148,323;8,071,746;7,572,771;7,223,726;8,163,699;8,415,293;7,691,965;7,601,802;7,439,323;7,217,785;8,158,601;8,653,245;8,557,962;7,491,693;7,749,315;5,059,528;RE38,556;6,258,596;5,866,551;6,953,840;8,119,590;7,193,056,6,767,994;6,617,134;6,559,284;6,454,950;6,306,433;6,107,467;5,990,081;5,876,968;5,721,114;8,343,932;7,786,352;8,536,117;8,143,224;7,781,219;7,776,563;7,390,504;7,378,396;6,897,039;7,273,849;8,637,460;8,268,787;8,048,851;8,048,015;8,030,281;7,402,246;7,393,826;7,375,191;7,361,739;7,364,658;7,361,739;7,364,658;7,361,739;7,297,262;7,297,261;7,195,710;7,166,223;7,033,500;6,897,039;8,252,739;7,847,079;7,592,010;7,550,432;7,521,424;7,507,414;7,507,413;7,482,013;7,238,667;7,094,577;7,081,354;7,056,701;7,045,318;7,041,478;6,994,857;6,989,365;6,987,006;6,972,322;6,946,134;6,926,898;6,909,014;6,905,688和美国专利公开号20040266662。将所有这些专利都通过引用以其整体并入本文。
本公开的HDL治疗剂包括其施用导致增加的HDL水平的小分子。示例性的小分子包括CETP抑制剂,例如托彻普(torcetrapib),anacetrapib,evacetrapib,DEZ-001(以前的TA-8995)和dalcetrapib,和在以下美国专利中公开的那些小分子:美国专利号8,053,440;5,783,600;5,756,544;5,750,569;5,648,387;8,642,653;8,623,915;8,497,301;8,309,604;8,153,690;8,084,498;8,067,466;7,838,554;7,812,199;7,709,515;7,705,177;7,576,130;7,335,799;7,335,689;7,304,093;7,192,940;7,119,221;6,909,014;6,831,105;6,790,953;6,713,507;6,703,422;6,699,910;6,673,780;6,646,170;6,506,799;6,459,003;和6,410,802。将所有这些专利都通过引用以其整体并入本文。
本公开的小分子HDL治疗剂还包括CER-002和CER-209:
CER-002
CER-209
HDL治疗剂可以配制为药物组合物。本公开所涵盖的药物组合物包括作为活性成分的HDL治疗剂,该HDL治疗剂包含在药用的、适用于体内施用和递送的载体中。
可注射的组合物包括活性成分在水性或油性媒介物中的无菌混悬液、溶液或乳剂。该组合物还可包含多种配方成分,如助悬剂、稳定剂和/或分散剂。在一些实施方案中,其中该HDL治疗剂是HDL模拟物,该模拟物被配制成包含在磷酸盐缓冲盐水(10mM磷酸钠,80mg/mL蔗糖,pH 8.2)中的可注射的组合物。用于注射的组合物可以单位剂量形式存在,如,在安瓿中或在多剂量的容器中,并且可包括添加的防腐剂。对于输注,组合物可在输液袋中进行供应,该输液袋由与HDL治疗剂相容的材料制成,如乙烯乙酸乙烯酯或本领域已知的任何其它相容的材料。
作为脂蛋白复合物或去脂脂蛋白的HDL治疗剂的适当的剂型是包含最终浓度为约1mg/mL至约50mg/mL的脂蛋白,优选约5mg/mL至约15mg/mL的脂蛋白的HDL治疗剂。在一个具体的实施方案中,所述剂型包含最终浓度为约8mg/mL至约10mg/mL的载脂蛋白A-I、优选约8mg/mL的HDL治疗剂。
6.4.HDL标志物
本公开部分涉及HDL标志物的利用,所述HDL标志物通过增加HDL治疗剂给药下调(无论通过增加的频率,增加剂量,或两者)。HDL标志物直接或间接地参与了蓄积的胆固醇或胆固醇酯从单核细胞,巨噬细胞和单核细胞的去除,并且包括ATP结合膜盒转运体A1(ABCA1)和G1(ABCG1)和固醇调节元件结合因子1基因(SREBP1),其在脂肪酸和胆固醇的生物合成,以及在脂质代谢中起重要作用。在多种实施方案中,本公开的方法测定单一的HDL标志物。在其他实施方案中,本公开的方法测定多个(例如,两个或三个)HDL标志物。可以在本公开的方法进行检测的示例性的HDL标志物的组合包括ABCA1+ABCG1;ABCA1+SREBP1;ABCG1+SREBP1;和ABCA1+ABCG1+SREBP1,所述组合是单独或与其它标志物组合。测定HDL标志物的方法在本领域中是已知的并在下面举例说明。
6.4.1.ABCA1
在多种实施方案中,本公开的方法需要测定ABCAI的表达水平和表达水平的改变(例如,响应于用HDL治疗剂治疗)。ABCA1 mRNA序列的表达水平,可以测定为分配的登录号AB055982.1的表达水平,和ABCA1蛋白的表达水平可以测定为分配的登录号AAF86276的表达水平。这些序列分别显示于图65A1-65A3和65B中。
已经开发了几个RT-PCR和抗体检测系统,其可用于根据本发明的方法的ABCA1表达的测定,例如,如通过et al.,2005,Cardiovascular Research 66:141-149;et al.,2007,BMC Mol Biol.8:5;Genvigir et al.,2010,Pharmacogenomics 11(9):1235-46;Wang et al.,2007,Biochem Biophys Res Commun.353(3):650-4;Holven et al.,2013,PLOS ONE 8(11):e78241;and Rubic&Lorenz,2006,Cardiovascular Research 69:527-35描述的。
6.4.2 ABCG1
在多种实施方案中,本公开的方法需要测定ABCGI的表达水平和表达水平的改变(例如,响应于用HDL治疗剂治疗)。ABCGI mRNA序列的表达水平,可以测定为分配的登录号NM_207629.1的表达水平,和ABCG1蛋白的表达水平可以测定为分配的登录号P45844的表达水平。这些序列分别显示于图66A1-66A2和66B中。
已经开发了几个RT-PCR和抗体检测系统,其可用于根据本发明的方法的ABCA1表达的测定,例如,如通过et al.,2007,BMC Mol Biol.8:5;Genvigir et al.,2010,Pharmacogenomics 11(9):1235-46;Wang et al.,2007,Biochem Biophys Res Commun.353(3):650-4;Holven et al.,2013,PLOS ONE 8(11):e78241;和Rubic&Lorenz,2006,Cardiovascular Research 69:527-35描述的。
6.4.3 SREBP1
在多种实施方案中,本公开的方法需要测定SREBP1的表达水平和表达水平的改变(例如,响应于用HDL治疗剂治疗)。可以测定表达水平的SREBP1mRNA序列分配登录号BC063281.1,并且可以测定表达水平的SREBP1蛋白可以分配登录号P36956。这些序列分别显示于图67A1-67A2和67B中。
6.5.单核细胞
单核细胞在骨髓中产生,在血流中被释放,并且还可以在其他生物体液如脑脊液,或淋巴中释放,并且在离开循环后产生不同类型的组织巨噬细胞或树突状细胞。单核细胞,其后代和在骨髓中的即时前体(immediate precursor)也被命名为“单核吞噬细胞系统”(MPS)。它们来源于骨髓中的产生单核细胞和粒细胞的粒细胞/巨噬细胞集落形成单位(CFU-GM)前体。
新形成的单核细胞离开骨髓并迁移到外周血中。循环单核细胞能够粘附到毛细血管的内皮细胞,并能迁移到多种组织(van Furth et al.,1992,Production and Migration of Monocytes and Kinetics of Macrophages.In:van Furth R ed.Mononuclear Phagocytes.Dordrecht,The Netherlands:Kluwer Academic Publishers),在这里它们可以分化成巨噬细胞或树突状细胞。单核细胞,巨噬细胞和树突状细胞是在动脉粥样硬化的引发和进展中的关键细胞。在正常情况下与流动的血液接触的内皮单层细胞抵抗单核细胞的牢固粘附。然而,在暴露于促炎因子后,在内皮细胞中多种白细胞粘附分子的表达增加,这能使单核细胞粘附到内皮细胞膜上(Libby,2002,Nature 420:868-874)。一旦已经迁移,单核细胞成为组织-定居的巨噬细胞,在暴露于经修饰的脂蛋白后依次发展成脂质装载的泡沫细胞(Osterud and Bjorklid,2003,Physiol.Rev.83:1069-1112)。
本公开的诊断和剂量优化方法通常需要在用HDL治疗剂治疗之前,期间和/或之后测定单核细胞或巨噬细胞中HDL标志物的表达以鉴定在患者水平,群体水平,在动物模型或在体外细胞培养中的最佳给药。
分离外周血单核细胞的方法是本领域的常规方法。这样的方法包括密度梯度离心(其中细胞的比重差被用于分离),成分输血,单核细胞对塑料表面仪器,如聚苯乙烯烧瓶的附着,利用分子标志物的细胞分选方法。
单核细胞可以通过密度梯度离心法进行分离。
单核细胞可以通过它们粘附到塑料(聚苯乙烯)基质被分离,因为单核细胞具有比例如外周血发现的其他细胞,如淋巴细胞和自然杀伤(NK)细胞粘附到塑料的更大的倾向。污染细胞可以通过在基质的剧烈洗涤而除去。
单核细胞也可以使用淘析来分离,在该方法中细胞悬浮液在具有斜率的室中离心的,同时缓冲液以与离心相反的方向流动,以形成特定的细胞层。
单核细胞和巨噬细胞,优选通过使用细胞分选法分离(例如,荧光激活细胞分选(FACS),磁激活细胞分选(MACS)或流式细胞术)利用细胞表面标志物如CD14和CD16分离。示例性的细胞分选方法和标志物公开在Mittar et al.,August 2011 BD Biosciences的出版物中,标题为“Flow Cytometry and High-Content Imaging to Identify Markers of Monocyte-Macrophase Differentiation。
6.6.治疗方法
本公开提供了用于治疗或预防病症的方法。在一些实施方案中,该方法包括将有效量的HDL治疗剂施用到需要其的受试者。受试者优选是哺乳动物,最优选人。治疗方法可以利用的剂量(量和/或给药日程表和/或输注时间)是通过本文所述的方法鉴定和/或伴随如本文所述的利用HDL标志物的伴随诊断测定来监测治疗功效。
ABCA1缺陷导致在等位基因病症家族性低α-脂蛋白血症(FHA)或更严重的病症Tangier病(TD),其特征在于HDL-C胆固醇水平在血浆中大大降低,受损的胆固醇流出,并趋向于蓄积细胞内胆固醇酯。本公开提供了用于治疗这些病症的方法。
HDL治疗剂和本文所述的组合物可用于几乎每一种目的HDL模拟物,所述HDL模拟物已被证明可以用于,例如治疗或预防ABCA1相关疾病或缺失,治疗或预防ABCG1缺失有关的疾病,和治疗或预防HDL缺失症,载脂蛋白A-I缺失或LCAT缺失。HDL治疗剂可用于治疗或预防疾病,如黄斑变性,中风,动脉粥样硬化,急性冠脉综合征,内皮功能障碍,加速的动脉粥样硬化,移植的动脉粥样硬化,缺血和短暂性脑缺血发作。
本公开的HDL治疗剂和组合物特别用于治疗或者预防心血管疾病、障碍和/或者相关病症。治疗或者预防受试者中的心血管疾病、障碍和/或者相关病症的方法通常包括向所述受试者给予低(<15mg/kg)剂量或者量的本申请所述的HDL治疗剂或者药物组合物,其根据有效治疗或者预防具体适应症的治疗方案。
以足以或者有效提供治疗益处的量给予HDL治疗剂。在治疗心血管疾病、障碍和/或者相关病症的情境下,可推断出治疗益处,条件是出现以下的一种或者多种:相比于基线而言胆固醇流通的增加、动脉粥样硬化斑块体积的降低、增加了百分比斑块体积(通过IVUS获得的测量结果)(Nicholls et al.,2010,J Am Coll Cardiol 55:2399–407),通过超声成像技术(内膜中层厚度)或MRI(Duivenvoorden et al.,2009,Circ Cardiovasc Imaging.2:235-242.)测量的血管壁厚度的降低,相比于基线水平而言游离胆固醇的高密度脂蛋白(HDL)部分的增加,而没有平均血浆甘油三酯浓度的增加或者肝转氨酶(或者丙氨酸氨基转移酶)水平的正常范围之上的增加。尽管希望完全治愈,但是完全治愈不是存在治疗益处所必需。
在一些实施方案中,HDL治疗剂以每次注射约1mg/kg ApoA-I等价物至约15mg/kg ApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约1mg/kg,2mg/kg或3mg/kg ApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约6mg/kg ApoA-I等价物的剂量给予。在一些实施方案中,所述脂蛋白复合物以约8mg/kg,12mg/kg或15mg/kg ApoA-I等价物的剂量给予。
在一些实施方案中,治疗或预防本文所述的病症的方法包括监测HDL治疗剂的治疗功效的步骤,例如,根据本文描述的用于监测HDL治疗剂的功效的方法来监测。HDL治疗剂的剂量和/或给药日程表的功效可以通过在两个或多个时间点比较一种或多种HDL标志物的表达水平来监测,例如在施用HDL治疗剂的剂量之前和在施用HDL治疗剂的剂量之后。在一些实施方案中,所述表达水平在施用HDL治疗剂的剂量后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时进行测量。在另一个实施方案中,一种或多种HDL标志物的表达水平是在根据给药日程表,例如其中HDL治疗剂是每2天施用,每3天,每周日(every week day),或每两周施用的给药日程表的施用HDL治疗剂之前和之后测量的。
表达水平可以是蛋白质表达水平或mRNA表达水平。在一个实施方案中,所述表达水平是使用抗体检测系统,例如,如在第6.4节中描述的测定的蛋白质表达水平。在另一个实施方案中,表达水平是使用RT-PCR测定的mRNA表达水平。在一个实施方案中,测量了一种或多种HDL标志物在根据6.5节中描述的任意方法分离的循环单核细胞,巨噬细胞或单核细胞的表达水平。HDL治疗剂的剂量和/或给药日程表可以根据表达水平是否降低超过了6.2节中描述的一种或多种HDL标志物的截留量而被保持或修改。
待治疗的受试者为患有心血管疾病、障碍和/或者相关病症的个体。可使用本申请所述的HDL治疗剂和组合物治疗或者预防的所述心血管疾病、障碍和/或者相关病症的非限制性实例包括外周血管性疾病、再狭窄、动脉粥样硬化以及动脉粥样硬化的众多临床表现诸如中风、缺血性中风、短暂性缺血发作、心肌梗塞、急性冠脉综合征、心绞痛、间歇性跛行、严重肢体缺血、心瓣狭窄和房脉瓣硬化。受试者可为具有急性冠脉综合征诸如心肌梗塞(具有或者不具有ST升高)或者不稳定心绞痛的先前发病的个体。所治疗的受试者可为任意动物例如哺乳动物,具体为人类。
在一个实施方案中,该方法包括治疗或预防具有器官移植,如心脏移植(例如,移植物血管病(cardiac allograft vasculopathy)(CAV)),肾移植,或肝移植(Garcia-Garcia et al.,2010,European Heart Journal 3:2456–2469 at 2465,under“Cardiac Allograph Disease”)的受试者中心血管疾病,加速的动脉粥样硬化的方法。在一些实施方案中,该方法包括将本文中所描述的HDL治疗剂或组合物施用于受试者。
在某些方面,所述方法涵盖治疗或者预防心血管疾病的方法。在一些实施方案中,该方法包括向受试者施用某个量的本申请所述的HDL治疗剂或者组合物,以便(a)在施用后不改变患者的基线ApoA-I和/或(b)在施用约2小时后,获得比施用前基线(最初的)浓度高出约5mg/dL至100mg/dL的游离或复合的载脂蛋白血清浓度,和/或者在施用后约24小时后,获得比施用前基线(最初的)浓度高出约5mg/dL至20mg/dL的游离或复合的载脂蛋白血清浓度。
在另一个方面,该方法包括治疗或预防心血管疾病的方法。在一些实施方案中,该方法包括向受试者施用本申请所述的、有效量的HDL治疗剂或者组合物,以便在施用后至少一天内,获得比施用前最初的HDL-胆固醇成分高至少约10%的HDL-胆固醇成分的循环血浆浓度。
在另一个方面,该方法包括治疗或预防心血管疾病的方法。在一些实施方案中,该方法包括向受试者施用本申请所述的、有效量的HDL治疗剂或者组合物,以便在施用后的5分钟到1天之间,获得30至300mg/dL的HDL-胆固醇成分的循环血浆浓度。
在另一个方面中,该方法包括治疗或预防心血管疾病的方法。在一些实施方案中,该方法包括向受试者施用本申请所述的、有效量的脂蛋白复合物(例如荷电的复合物)或者组合物,以便在施用后的5分钟到1天之间,获得30至300mg/dL的胆固醇酯的循环血浆浓度。
在另一个方面中,该方法包括治疗或预防心血管疾病的方法。在一些实施方案中,该方法包括向受试者施用本申请所述的、有效量的HDL治疗剂或者组合物,以便在施用后至少一天内,获得比施用前的基线(最初的)浓度高至少约10%的增加的粪便胆固醇分泌。
本申请所述的HDL治疗剂或者组合物可以单独使用或与用于治疗或预防前述病症的其它药物进行联合治疗。这样的治疗包括但不限于所包括药物的同时或依序施用。例如,在血脂异常、高胆固醇血症诸如家族性高胆固醇血症(纯合或者杂合)或动脉粥样硬化的治疗中,HDL治疗剂可以与目前使用的任何一种或多种降低胆固醇的疗法一起施用;如胆汁酸树脂、烟酸、他汀类、胆固醇吸收抑制剂和/或贝特类。由于在胆固醇的合成和转运中,每种药物作用于不同的靶点,因而使得这样的联合方案可以产生特别有益的疗效,即,胆汁酸树脂影响胆固醇的再循环、乳糜微粒和LDL群;烟酸主要影响VLDL和LDL群;他汀类抑制胆固醇的合成,减少LDL群(并且也许增加LDL受体的表达);而本申请所述的HDL治疗剂影响RCT,增加HDL并促进胆固醇外流。
在另一个实施方案中,本申请所述的HDL治疗剂或者组合物可以结合贝特类使用以治疗或预防冠心病、冠状动脉疾病、心血管疾病、再狭窄、血管或外周血管疾病、动脉粥样硬化(包括治疗和预防动脉粥样硬化)。
本申请所述的HDL治疗剂或者组合物可以以增加小HDL成分的剂量施用,所述小HDL成分例如前-β、前-γ和前-β状HDL成分、αHDL成分、HDL3和/或HDL2成分。在一些实施方案中,该剂量可有效地实现如经由显像技术所测量的动脉粥样硬化斑块的减少,所述显像技术如磁共振成像(MRI)或血管内超声(IVUS)。IVUS追踪的参数包括但不限于粥样斑体积由基线改变的百分比以及粥样斑总体积的改变。MRI追踪的参数包括但不限于IVUS的那些参数以及斑块的脂质组成和钙化。
可以在最后的输注结束时,或在最后的输注后数周内,或在开始治疗后的3个月、6个月或1年内使用患者作为自身对照来测量斑块的消退(时间0比时间t)。
通过肠胃外的施用途径可实现最佳的施用,其包括静脉内注射(IV)、肌内注射(IM)、皮内注射、皮下注射(SC)以及腹膜内注射(IP)。在某些实施方案中,经由注样器、吸入器或导管进行施用。在一些实施方案中,HDL治疗剂以获得与通过肠胃外施用获得的循环血清浓度相等的循环血清浓度的量,通过注射、皮下植入泵或贮库制品进行施用。例如,该HDL治疗剂还可吸收在支架或其它的装置中。
可以通过多种不同的治疗方案来实现施用。例如,可以在一天内定期地施用几次静脉内注射,其中累积的注射总体积不能达到每日毒性剂量。所述方法包括以2、3、4、5、6、7、8、9、10、11或者12天的间隔施用HDL治疗剂。在一些实施方案中,HDL治疗剂以每周一次,每周2次,每周三次或更多的间隔施用。
所述方法可进一步包括以如上所述的任何间隔施用HDL治疗剂4、5、6、7、8、9、10、11、12次或更多次。在患家族原发性低α-脂蛋白血症的受试者中,HDL治疗剂可以持续几个月,几年或无限期地施用。
例如,在一个实施方案中,施用HDL治疗剂六次,在每次施用之间的间隔为1周。在一些实施方案中,施用可如下完成:施用一系列注射,然后停止注射达6个月至1年,然后再开始另外一系列的注射。然后可在每年或者每3-5年施用维持的系列注射。可历时一天(灌注以保持复合物的特定血浆水平)、若干天(例如历时8天的时间内四次注射)或者若干周(例如历时4周的时间内四次注射)完成所述系列注射,然后在六个月至一年后重新开始。对于慢性病症,可在发展基础上进行施用。任选地,所述方法可在诱导期后实施,当更频繁地施用HDL治疗剂时。
在另一个实施方案中,用HDL治疗剂治疗可以根据诱导给药日程表,随后是维持方案(其中剂量和/或给药频率降低)来启始。例如,诱导方案可是必需每周施用HDL治疗剂两次,三次或四次。其中HDL治疗剂是脂蛋白复合物如CER-001,诱导剂量可以基于蛋白质是在4-15mg/kg之间的范围内(例如,4,5,6,7,8,9,10,12或15mg/kg)。维持方案可以是必需施用HDL治疗剂每周一次,两次或每周三次。其中HDL治疗剂是脂蛋白复合物如CER-001,维持剂量可以基于蛋白质是在0.5-8mg/kg之间的范围内(例如,0.5%,1,2,3,4,5,6,7或8mg/kg)。诱导给药日程表特别适合于患家族性低α-脂蛋白血症的受试者。说明性的给药日程表在实施例4中描述。
在又一备选方案中,可以施用渐增的剂量,开始时以每次施用1-8mg/kg之间的剂量施用约1至5次,随后每次施用时重复4-15mg/kg之间的剂量。根据患者的需求,其可以通过持续时间超过1小时的缓慢输注进行施用,通过1小时或更少时间的快速输注进行施用,或者通过一次快速推注施用。该剂量可施用每周一次,两次,三次或更多次。
可以使用细胞培养中的标准药物规程或者使用确定LD50(群体50%的致死剂量)和ED50(群体50%的治疗有效剂量)的实验动物来确定多种HDL治疗剂的毒性和治疗效力。毒性与治疗作用之间的剂量比是治疗指标并且其可以表示为LD50/ED50比值。优选表现出更高治疗指数的HDL治疗剂。可跟踪的参数的非限制性实例包括肝功能转氨酶(不超过2×正常的基线水平)。其表明过多的胆固醇被运至肝并且不能同化如此大的量。由于胆固醇从红细胞的动员可使红细胞变脆或者影响红细胞的形状,因而还可监测对红细胞的作用。ABCA1,ABCG1或本文所描述的HDL标志物的下调也可以进行监测。
患者可以在采取医疗措施之前接受数天至数周的治疗(如,预防性治疗)、或在采取医疗措施之中或之后接受数天至数周的治疗。所述施用可以与另一种有创疗法相伴或同时进行,所述有创疗法如血管成形术、颈动脉消融术、rotoblader或器官移植(如,心脏、肾、肝等)。
在某些实施方案中,将HDL治疗剂施用于胆固醇合成受他汀类或胆固醇合成抑制剂(例如,但不限于PCSK9抑制剂)控制的患者。在其它实施方案中,将HDL治疗剂施用于接受结合树脂(例如,半合成树脂如消胆胺)或纤维(如植物纤维)治疗的患者,以捕获胆汁盐和胆固醇,从而增加胆汁酸的分泌并降低血胆固醇浓度。
7.实施例1:CER-001剂量反应分析
7.1卡方临床试验
CER-001是具有负电荷的工程化改造的重组人载脂蛋白A-I高密度脂蛋白(HDL),当由静脉内注射时模拟天然HDL的生物学性质。CER-001,在WO2012/109162(将其全部并入本文作为参考)的实施例3和4中描述为“式H”,是由重组人载脂蛋白A-I和磷脂组成,所述磷脂含有鞘磷脂(SPH)和二棕榈酰磷脂酰甘油(DPPG)。蛋白质对磷脂的比例是1:2.7,并含有97%的Sph和3%DPPG。
如WO2012/109162实施例8中所述的,在健康志愿者中以0.25,0.75,2,5,10,30和45mg/kg的单次IV剂量的CER-001的I期研究表明复合物是耐受良好的,并且随着剂量增加,胆固醇流通也增加,在大于15mg/kg的水平,观察到甘油三酯的瞬时增加。
基于I期研究,已启动标题为“HDL输注是否可以显著地加快动脉粥样硬化的消退?”(“卡方”)的II期临床研究。登记了呈现急性胸痛或其他相当的心绞痛症状(指示ST段抬高心肌梗死的诊断),非ST段抬高心肌梗死或不稳定型心绞痛的504个受试者。要符合资格,受试者必须具有冠状动脉疾病的血管造影证据,如通过血管造影目测的在三大天然冠状动脉中的任一种的至少有一个病灶的管腔直径具有>20%的减少所定义的,或经皮冠状动脉介入(“PCI”)的在先史。PCI的靶血管不是用于研究IVUS的靶冠状动脉,并且具有先前的PCI的任何血管不能用作靶冠状动脉。
在图1中显示了研究设计。主要端点是通过三维IVUS(血管内超声)评估的30mm段的靶冠状动脉中的总斑块体积的名义变化。关键的次要端点是靶30mm段中斑块体积的变化%和粥样斑体积的变化%,靶30mm段中总血管体积的变化,和最少并且最多患病5mm段中斑块,管腔和总血管体积从基线的变化。发病率和死亡率为探索端点(exploratory endpoint)。
7.2结果
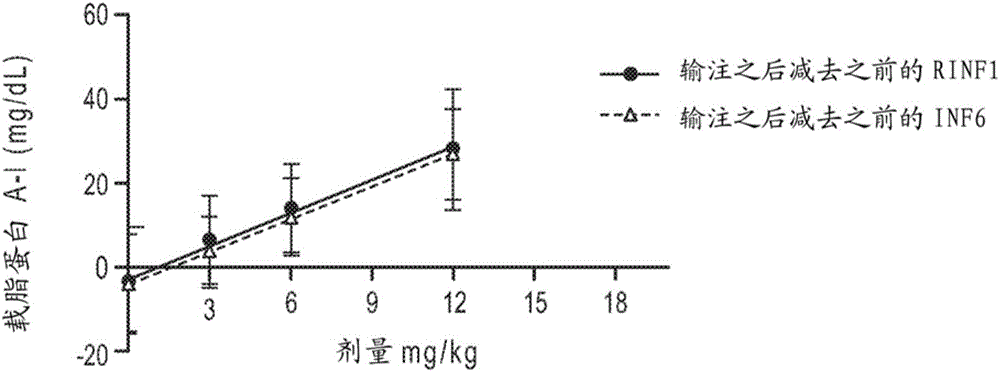
在IV CER-001施用后,载脂蛋白A-I以剂量依赖的方式(输注1)并以与从I期的预测相一致的幅度增加。在输注6保留了该效应,指示在随着时间没有效应的衰减。参见图2A。
磷脂以剂量依赖的方式(输注1)并以与从I期的预测相一致的幅度增加。在输注6保留了该效应,指示随着时间没有效应的衰减。参见图2B。磷脂和ApoA-I的剂量反应曲线的斜率比为2.8,这与在CER-001中磷脂与蛋白质的比例相一致。
血浆总胆固醇以剂量依赖的方式(输注1)并以与从I期的预测相一致的幅度增加。在输注6保留了该效应,指示随着时间没有效应的衰减。参见图2C。这些数据表明,3mg/kg CER-001的效力与15mg/kg ETC-216的效力相当。
CER-001在3,6,和12mg/kg的剂量整体耐受性良好,在实验室参数时没有明显的剂量相关毒性。
7.2.1.IVUS-第一种方法
在基线处的平均总粥样斑体积是155.24±67.99mm3。总粥样斑体积的变化的经调整的平均值对于安慰剂,CER-001 3mg/kg,CER-001 6mg/kg和CER-001 12mg/kg组,分别为-2.71,-3.13,-1.50和-3.05mm3(p=0.81,用于前指定12mg/kg主要分析比安慰剂)。与安慰剂相比,CER-001 6mg/kg(名义p=0.45)和3mg/kg(名义p=0.77)组没有差异。所有研究组的百分比粥样斑体积变化是相似的(安慰剂0.02,-0.02,0.01和0.19%,CER-001 3mg/kg(p=0.86),CER-001 6mg/kg(p=0.95)和CER-001 12mg/kg(p=0.53)组(名义p值比安慰剂)。
与下面要讨论的“随着步行(walk-along)”相反,单独选择帧对(frame pair)以用于最佳可读性。基于无回声(钙)和侧枝选择帧。选择30mm段的最多31帧,排除了拉回大于30mm长的好处。当可获得>31帧时,没有使用预先定义的标准来选择包括在分析组中的31帧。
约60%的成对图像集聚集在31帧中,并且约16%的成对的图像集聚集在16帧中。
“聚集”在16帧图像集中是提示,以小于1mm(即低至0.3mm)的时间间隔选择帧以使用于分析的图像集符合规格。
“聚集”在31帧图像集是提示<1mm的间隔也可能已经用于使图像对的数目最大化至31。
分析的更多细节在Tardif et al.,2014,Eur.Heart Journal,first published online April 29,2014 doi:10.1093/eurheartj/ehu171)中描述,通过引用将其整体并入本文。
根据这种方法,在126名患者/治疗组中,卡方不足以显示对心血管事件的显著性(需要约5000名患者/组)。
7.2.2.IVUS分析-第二种方法
通过南澳大利亚健康与医学研究院(South Australian Health&Medical Research Institute)(SAHMRI)进行IVUS数据的事后分析(post-hoc analysis)。
在这种情况下,基线和随访之间有相似的帧计数。所选帧的数目呈正态分布(图3)。
分析表明相比于先前的HDL模拟物,PAV和TAV相对于基线的统计学显著和可比级数的减少(图4)。尽管这项研究并没有达到mITT群体中主要端点,在改良后的Per Protocol(mPP)人群中,在TAV和PAV二者中3mg/kg剂量实现对安慰剂的名义统计学显著性(图5)。
如可在图6A-6B中看到的,SAHMRI分析的结果与CER-001在人类中的倒U形的剂量-效应曲线是一致的。
如在表1中所显示的,在基线PAV等于或大于30的患者中,剂量最低的3mg/kg在总动脉粥样硬化体积(TAV)的变化和所有患者(mITT)的PAV的变化中获得相对于安慰剂的统计学显著性。
在具有PAV≥30的患者亚群中的剂量反应在基线遵循着总群体相同的模式,但在3mg/kg的剂量处在TAV和PAV有甚至更显著的变化。
8.实施例2:在用CER-001或HDL3治疗后在逆脂质转运中牵涉的基因的调控
8.1.介绍
研究A-P的目标是确定在用CER-001,HDL3和ApoA-I治疗小鼠巨噬细胞(J774)之后,逆脂质转运(RLT)中牵涉的基因的调控。胆固醇逆向转运(RCT)是由外周细胞释放累积胆固醇至细胞外受体,如高密度脂蛋白(HDL),其然后介导胆固醇递送到肝脏进行排出,从而防止动脉粥样硬化的通路。研究胆固醇流出的一种方法是用[3H]-胆固醇氧化的LDL标记巨噬细胞,并测量在受体分子的存在下,来自这些细胞的胆固醇释放。ABCA1,ABCG1和SR-BI是胆固醇流出中牵涉的膜蛋白。
8.1.材料
用于这些研究的材料包括CER-001(带电荷的脂蛋白复合物,具有1:2.7的蛋白质对总脂质的比例,97%卵鞘磷脂/3%DPPG)和13.5mg/mL浓度的ApoA-1),纯化的人HDL3和纯化的ApoA-I。材料储存于约-20℃。
HDL3脂蛋白部分根据第8.3.1节中描述的方法从人血浆中制备。简言之,首先用KBr梯度(d<1.055)和连续超速离心(24小时3次100,000xg)取出VLDL,IDL和LDL部分。保存LDL部分以后续用于胆固醇流出实验。从KBr梯度(d=1.19)–100,000xg持续40h分离HDL3部分。在用于实验之前对磷酸缓冲盐水(PBS)充分透析脂蛋白部分。
8.3方案
8.3.1血浆脂蛋白的分离
接受血浆。测量新鲜血浆体积(不冷冻)。以最终浓度:EDTA:0.1%(w/v),NaN3:0.01%(w/v)添加添加剂。在20000rpm,4℃离心血浆20分钟。除去细胞碎片和可能的乳糜微粒,得到澄清的血浆。
脂蛋白分离。脂蛋白通过在KBr溶液中连续浮选超速离心获得(VLDL,d=1.006g/mL;LDL,1.006<d<1.063g/mL)。HDL2首先在d=1.125g/mL分离(110,000xg,40h),之后HDL3在d=1.19g/mL分离(110,000xg,40h)。使用前,对磷酸缓冲盐水充分透析脂蛋白。盐溶液的体积是血清体积-7%,对应于水合蛋白质的体积。
8.3.2RNA提取
步骤1-均浆化:在1mL TRI中均浆化组织样品(50mg)或培养的细胞(6孔板中的1个孔)。在室温下,在1.5mL的无RNA酶的管中温育匀浆5分钟。对于组织样品,在4℃下以12,000×g离心10分钟,且将上清液转移到新管中。注意:对于培养的细胞样品,没有必要。
步骤2-RNA提取:将100μl溴氯丙烷(BCP)添加至1ml匀浆物中并良好地混合(涡旋15秒)。在室温下温育5分钟。在4℃以12,000xg离心10分钟。将400μl含水的上层相转移到新的1.5mL的无RNA酶的试管中。
步骤3-最终RNA纯化:加入200μl 100%乙醇并立即混合(涡旋5秒)。通过以12,000×g离心30秒使样品通过过滤筒。用500μl洗涤液(12,000xg,30秒)清洗过滤器两次。离心30秒以上,以去除残留的洗涤液。将过滤筒转移至新的收集管。加50-100μl洗脱缓冲液至过滤柱,在室温温育2分钟,并在12,000×g下离心30秒,以从过滤器洗脱RNA。将回收的RNA储存在-80℃下。
步骤4–测定RNA浓度:RNA溶液的浓度是通过在NanoDrop分光光度计上测量1.5μl样品在260nm处的吸光度进行测定的。为了评估RNA的质量,可以如第8.3.3节所描述的用Agilent 2100生物分析仪进行分析。
8.3.3用Agilent生物分析仪进行RNA质量检测
允许所有的试剂在使用前在室温下平衡30分钟。而将染料浓缩物拿到室温中时使其避光。
步骤1-准备凝胶:将550μl AgilentRNA 6000 Nano凝胶基质放置到自旋过滤器中。在1500×g离心10分钟。将65μl过滤的凝胶等分到包括在试剂盒中的0.5mL无RNA酶的微量离心管中。在一个月内使用过滤凝胶。
步骤2-准备凝胶染料混合物:旋涡RNA 6000 Nano染料浓缩物10秒并旋下。添加1μl RNA 6000 Nano染料浓缩物到65μl过滤凝胶的等分试样中。盖住管帽,涡旋并目视检查凝胶和染料的适当混合。旋管,在室温下以13,000xg旋转管10分钟。在一天之内使用准备好的凝胶。每次使用前始终以13,000×g重新旋转凝胶染料混合物10分钟。
步骤3-装载凝胶染料混合物:装载凝胶染料混合物之前,确保芯片涂刷站(chip priming station)的底板在适当位置(C),并且可调节的夹被设置到顶部位置。在芯片涂刷站上换上新的RNA6000 Nano芯片。在围绕的G孔底部吸取9μl凝胶染料混合物。计时器设置为30秒,确保柱塞定位在1ml处,然后关闭该芯片涂刷站。当涂刷站正确地关闭时,门闩的锁将点击。按下注射器的柱塞直到它被夹子固定住。正好等待30秒,然后用夹子释放机构释放柱塞。等待5秒钟,然后慢慢将柱塞回拉至1ml的位置。缓慢打开芯片涂刷站。在两个G孔的每一个中吸取9μl凝胶染料混合物。
步骤4-装载AgilentRNA 6000 Nano标志物:吸取5μl RNA 6000 Nano标志物至标记有Ladder标记的孔和12样品孔中的每个中。
步骤5-装载Ladder和样品:使用前,解冻等分的Ladder和RNA样品,并保持它们在冰上。为了最小化二级结构,在样品装载在芯片上之前使其热变性(70℃,2分钟)。吸取1μl准备好的Ladder至标有Ladder标记的孔。吸取1μl每一样品到至12个样品孔的每一个中。吸取1μl RNA 600 Nano标志物至每个未使用的样品孔中。将芯片水平放置在IKA旋涡混合器的适配器中,以2400rpm涡旋1分钟。5分钟内在Agilent2100生物分析仪内运行芯片。
步骤6-启动芯片分析:在仪器背景中,从测定菜单选择合适的检测(例如:测定真核生物RNA),并选择COM端口1。接受当前的文件前缀或修改它。数据将被自动保存到使用这个前缀的名称的文件中。此时,文件存储位置和将要分析的样品数目可以是定制的。单击该窗口右上角的开始按钮以启动芯片的运行。输入样品信息,如样品名称和注释,选择以蓝色高亮显示的数据文件的链接或者进入分析文件(Assay context)并选择芯片摘要选项卡(Chip Summary tab)。完成样品名称表。芯片运行结束后,立即从容器取下芯片。
8.3.4反转录
在准备反应管前,使用高容量的RNA至cDNA试剂盒((Applied Biosystems cat.No.4387406)准备RT反应混合物。为了在冰上制备RT反应混合物(每反应20μl):(1)允许试剂盒组分在冰上解冻和(2)计算所需成分的体积以准备如表2中显示的所需数目的反应:
将20μl RT反应混合物分配至管中。密封管,并在230×g下离心它们1分钟。为进行RT反应,热循环仪的程序设置如下:37℃→60分钟;95℃→5分钟;12℃→∞。
8.3.5基因表达定量分析(实时PCR)
步骤1-准备cDNA样品:使用RibopureRNA分离试剂盒(Applied Biosystems AM 1924)提取总RNA,并通过NanoDrop分光光度计测定1.5μl样品中的RNA浓度(参见8.3.2节)。使用高容量RNA至cDNA试剂盒(Applied Biosystems PN 4387406)进行逆转录(RT)(见第8.3.4节)。如果不立即进行PCR,在-20℃存储cDNA样品。
步骤2-准备PCR反应混合物:对于所有样品,使用相同量的cDNA(20μl RT反应,对于0.5或1μg RNA使用4μl cDNA)。对于每一个样品(以一式三份运行),将以下作为样品放到无核酸酶的1.5mL离心管(对于2个样品,添加更多体积来计算PCR反应混合物的最终体积):2X基因表达主要混合物:10μl;20X基因表达测定:1μl;无核酸酶的H2O:5μl。盖住帽筒并倒转几次,以混合反应组分。短暂离心管。
步骤3-装载板:将4μlcDNA放入到96孔反应板的各孔中,对于两种沉积物(预见一个孔中用4μl H2O作为每个基因的空白对照),通过改变板的方向每孔转移16μl PCR反应混合物。用合适的覆盖物密封板。短暂离心板(230×g,1分钟)。将板装入StepOnePlus实时PCR系统。
步骤4-运行板:创建用于运行的实验/板文件。运行板。程序:(a)95℃→10分钟;(b)95℃→15秒;(c)60℃→1分钟;(b)和(c)运行40个循环。
8.3.6放射性胆固醇流出研究
第1天-细胞培养:从ATCC获得的J774巨噬细胞(N°TIB-67)在Dulbecco改良的Eagle培养基(DMEM,Invitrogen)中,在37℃,5%CO2下培养,所述培养基补充有10%FBS(胎牛血清,Invitrogen),100单位/ml青霉素G(Invitrogen)和100单位/ml链霉素(Invitrogen)。以40,000个细胞/孔将细胞接种到24-孔板(Falcon)中,并在2ml DMEM 10%FBS中生长32小时。LDL氧化:在Slide-A-IyzerTM Mini Dialysis Units 7000MWCO(Pierce)中,使1mL LDL对4L PBS透析(两次,每次12小时)。
第2天-LDL氧化:[1]在透析后,使用白蛋白(#23209,ThermoScientific)作为标准用Coomassie蛋白质测定法(#856209,ThermoScientific)定量蛋白质-LDL。在600nm处用Glomax多检测系统(Promega)读取吸光度。用CuSO4(5μΜ最终浓度)(C8027,Sigma Aldrich)在37℃下氧化对PBS-透析的LDL(2mg/mL)4小时。该反应通过加入EDTA(100μΜ最终浓度)(#20302.236,Prolablo)终止。使氧化的LDL对2x1L PBS透析0.5小时。透析后,蛋白质-LDL用与[1]相同的方法进行定量。细胞培养:氧化的LDL(50μl,12.5μg)与在DMEM 2.5%FBS中的[3H]胆固醇的(1μCi,Perkin Elmer)混合15分钟。将经放射性标记的LDL添加到450μl DMEM 2.5%FBS中的J744细胞中24小时。
第3天-细胞培养:除去放射性培养基,用1ml DMEM(无FBS)洗涤细胞三次,并在有或没有激动剂LXR(1μΜ)的情况下培养过夜。
第4天-胆固醇流出试验:流出通过在无FBS的250μl DMEM中加入不同受体诱导6小时(或1至24小时之间的不同时间)。放射性通过以下测量:加入培养基(0.25mL)到Super Mix(0.75ml)(1200-439Perkin-Elmer),在24孔柔性微孔板(1450-402Perkin-Elmer)混合,并用Trilux(计数时间2分钟)测量放射性。细胞内[3H]胆固醇通过0.2mL己烷-异丙醇(3:2)(温育0.5小时)萃取,并通过液体闪烁计数来测量。
8.3.7膜/胞质溶胶分离
膜/胞质溶胶分离,不需要超速离心:在200μl裂解缓冲液中重悬细胞沉淀(6孔板中的2-孔),或在1ml裂解缓冲液中重悬组织样品(50-100mg)。用匀浆组织样品或使用DigitalBRANSON以30%的振幅超声2×10s来匀浆细胞沉淀。在4℃以800×g离心5分钟。将上清液转移到新管中,并在4℃以13,000xg离心30分钟。保存上清液(胞质溶胶部分)。沉淀重悬在100-200μl裂解液(补充有1.2%的Triton X100)。15分钟内剧烈搅拌。以14,000xg离心5分钟,保存上清液(溶解的膜蛋白部分)。
用超速离心进行的膜/胞质溶胶分离:在1ml裂解缓冲液中重悬细胞沉淀(6孔板中的2-孔)或组织样品(50-100mg)。用匀浆组织样品或使用DigitalBRANSON以30%的振幅超声2×10s来匀浆细胞沉淀。在4℃以800×g离心5分钟。转移上清液至管中用于超速离心,在8℃下以100,000xg(38,500rpm)(转子Ti70)离心1小时,保存上清液(胞质溶胶部分)。沉淀重悬在100-200μl裂解缓冲液中(表3)(补充有1.2%的Triton X100)。15分钟内剧烈搅拌下。以14,000xg离心5分钟,保存上清液(溶解的膜蛋白部分)。
8.4基因调控研究A-P的结果
8.4.1研究A:通过CER-001,HDL3和ApoA-I调控J774 ABCA1基因-剂量反应(25,250和1000μg/mL)
在这项研究中,在胆固醇流出的条件下,针对不同浓度的CER-001,HDL3和ApoA-I,检查了小鼠巨噬细胞(J774)的ABCA1基因表达。J774接种在6×孔板(300,000细胞/孔)并用氧化性-LDL装载,而无需使用3H-胆固醇。将CER-001,HDL3(来自冷冻原液)和ApoA-I(25,250和1000μg/mL)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA(每种条件一个孔)。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案用Taqman探针Mm00442646.m1测定ABCA1基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)
6小时温育后,在实验中所用的剂量的ApoA-I没有改变ABCA1表达。所有的剂量的CER-001降低了ABCA1 mRNA;25μg/mL剂量的HDL3不影响ABCA1 mRNA的浓度(图7)。
8.4.2研究B:通过CER-001,HDL3和ApoA-I调控J774 ABCG1基因-剂量反应(25,250和1000μg/mL)
在这项研究中,在胆固醇流出的条件下,针对不同浓度的CER-001,HDL3和ApoA-I,检查了小鼠巨噬细胞(J774)的ABCG1基因表达。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载,而无需使用3H-胆固醇。将CER-001,HDL3(来自冷冻原液)和ApoA-I(25,250和1000μg/mL)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA(每种条件一个孔)。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案用Taqman探针Mm00437390.m1测定ABCG1基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)
在实验中所用的剂量的ApoA-I没有改变ABCG1表达。所有的剂量的CER-001降低了ABCG1 mRNA;25μg/mL剂量的HDL3不影响ABCG1 mRNA的浓度(图8)。
8.4.3研究C:通过CER-001,HDL3和ApoA-I调控J774SR-BI基因-剂量反应(25,250和1000μg/mL)
在这项研究中,在胆固醇流出的条件下,针对不同浓度的CER-001,HDL3和ApoA-I,检查了小鼠巨噬细胞(J774)的SR-BI基因表达。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载,而无需使用3H-胆固醇。将CER-001,HDL3(来自冷冻原液)和ApoA-I(25,250和浓度为1000μg/mL)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA(每种条件一个孔)。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案用Taqman探针Mm00450234.m1测定SR-BI基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)
在所有的剂量进行的不同的处理没有观察到SR-BI基因表达的显著变化(图9)。
8.4.4研究D:通过CER-001,HDL3和ApoA-I调控J774其他基因-剂量反应(25,250和1000μg/mL)
表达ABCA1,ABCG1和SR-BI的那些基因的mRNA调节是与核蛋白质,如LXR,SREBP1和SREBP2相关的。本研究在胆固醇流出的条件下,针对不同浓度的CER-001,HDL3和ApoA-I,检查了小鼠巨噬细胞(J774)LXR,SREBP1和SREBP2的mRNA水平。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载,而无需使用3H-胆固醇。将CER-001,HDL3和ApoA-I(25,250和浓度为1000μg/mL)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA(每种条件一个孔)。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案用Taqman探针(分别是Mm01138344.m1,Mm01306292.m1,Mm00443451.m1)测定SREBP-1,SREBP-2和LXR的基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
对于用ApoA-I的不同处理,没有观察到SREBP-1,SREBP-2和LXR的基因表达的显著变化。不同剂量的CER-001和HDL3仅影响SREBP-1的mRNA水平(图10),而SREBP-2和LXR未改变(分别为图11和图12)。
8.4.5研究E:用于调控J774小鼠巨噬细胞中ABCA1,ABCG1和SR-BI表达的CER-001和HDL3EC50的测定
本研究检查用于调控ABCA1,ABCG1和SR-BI基因表达所需要的ApoA-I,CER-001或HDL3ApoA-I的最低有效浓度。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载。将CER-001,HDL3和ApoA-I(0.25,2.5,7.5,25和250μg/mL)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定SR-BI基因(Taqman探针Mm00450234.m1),ABCG1(Taqman探针Mm00437390.m1),SREBP1(Taqman探针MM01 138344.mL)和ABCA1(Taqman探针Mm00442646.m1)。使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
ApoA-I没有改变所测试基因的mRNA水平(图13)。CER-001使ABCA1水平减少一半的剂量约7.5μg/mL,并HDL3是25μg/mL(图13)。对于ABCG1,剂量超过75μg/mL的CER-001和HDL3对于使mRNA水平减少一半是必要的(图14)。对于SREBP1,在浓度高于2.5μg/mL的CER-001和高于25μg/mL的HDL3下,我们观察减少和平稳状态(图15)。SR-BI水平未受到不同处理的影响(图16)。
8.4.6研究F:CER-001和HDL3调控J774小鼠巨噬细胞中ABCA1mRNA的动力学
本研究检查降低J774小鼠巨噬细胞中ABCA1 mRNA水平的动力学。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载。将CER-001,HDL3和ApoA-I(25和250μg/mL)在不同的时间点加入巨噬细胞,根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCA1(Taqman探针Mm00442646.m1)的表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
CER-001(25或250μg/mL)能够在4小时减少一半的ABCA1 mRNA水平。HDL3(250μg/mL)(已解冻/冷冻几次)的行为类似于CER-001,除了在25μg/mL的HDL3处未观察到下调。如之前报道的,浓度为25μg/mL或250μg/mL的ApoA-I没有降低ABCA1的mRNA水平。用ApoA-I处理(图17)在2小时和4小时观察到ABCA1 mRNA的增加。
8.4.7.研究G:在CER-001,HDL3和ApoA-I的存在下,Camp对调控ABCA1和ABCG1 mRNA水平的效应
本研究检查了用cAMP处理后,CER-001,HDL3或ApoA-I对J774巨噬细胞中ABCA1和ABCG1 mRNA水平的效应。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载。第二天,培养基被替换为DMEM+/-cAMP(300μΜ)。在存在/不存在cAMP下,过夜培养后,去除培养基,并替换为混合有CER-001,HDL3或ApoA-I(250μg/mL)的DMEM达6小时,并且根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCG1(Taqman探针Mm00437390.m1)和ABCA1(Taqman探针Mm00442646.m1)的表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
在cAMP的存在下,观察到了增加的ABCA1 mRNA水平(图18)。在CER-001或HDL3(250μg/mL)的存在下,ABCA1和ABCG1的mRNA水平降低,而没有改变ApoA-I。在cAMP的存在下,当细胞与CER-001或HDL3温育时,ABCA1和ABCG1的浓度恢复到RQ=1,但没有达到ABCA1刺激(RQ=5-6)(图18和图19)。在ApoA-I和cAMP的存在下,与单独的ApoA-I相比ABCA1的mRNA水平(RQ≈3)增加,但未达到针对DMEM+cAMP的相同的水平(RQ≈6)。
8.4.8.研究H:在CER-001和HDL3的存在下,调控J774巨噬细胞中ABCA1蛋白质水平的效应
本研究检查了CER-001和HDL3对J774巨噬细胞中ABCA1蛋白质水平的效应。J774巨噬细胞接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载。第二天,培养基被替换为DMEM。过夜平衡后,去除培养基,并替换为混合有CER-001和HDL3(250μg/mL)的DMEM达6小时。并且根据第8.3.7节的方法裂解细胞和分离膜。胞浆和膜蛋白在SDS-PAGE 10%上分离,并针对ABCA1(ab7360-稀释度1/1000)进行探测。使用软件对蛋白质水平进行定量。
观察到用CER-001和HDL3处理的巨噬细胞ABCA1蛋白水平显著减少(图20和图21)。ApoA-I未影响ABCA1的水平,并且添加cAMP大大增加了此水平。添加250μg/mL CER-001和HDL3到巨噬细胞J774中持续6小时,导致ABCA1的mRNA和蛋白质水平减少。
8.4.9研究I:在增加浓度的CER-001的存在下,cAMP对调节ABCA1和ABCG1 mRNA水平的效应
本研究检查了用cAMP处理,增加浓度的CER-001对ABCA1和ABCG1 mRNA水平的效应。J774接种在6孔板(300,000细胞/孔)并用氧化性-LDL装载。第二天,培养基被替换为DMEM+/-cAMP(300μΜ)。在存在/不存在cAMP下,过夜培养后,去除培养基,并替换为混合有不同浓度的CER-001(0,0.1,0.5,1,2,4,6,8,10,15和30μg/mL)的DMEM,达6小时,并且根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCG1(Taqman探针Mm00437390.m1)和ABCA1(Taqman探针Mm00442646.m1)的表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
在cAMP的存在下,观察到ABCA1和ABCG1 mRNA水平的增加(图22,图23,图24,图25,和图26)。在4-6μg/m剂量的剂量观察到ABCA1和ABCG1 mRNA水平的降低,最大约15μg/mL。cAMP激活并没有改变用于降低ABCA1的水平的CER-001的足够剂量,因为在存在或不存在cAMP的情况下,轮廓相似(图26)。
8.4.10研究J:用CER-001和HDL3处理后恢复到ABCA1和ABCG1 mRNA的正常量
本研究检查用CER-001和HDL3处理后恢复到ABCA1和ABCG1 mRNA的正常量所需要的时间。J774在DMEM 10%FCS中接种于6孔板(600,000细胞/孔)。第二天,培养基被替换为无血清的DMEM,并用CER-001,HDL3或ApoA-I(250μg/mL)处理24小时。除去培养基并用DMEM洗涤巨噬细胞。在去除CER-001,HDL3或ApoA-I后不同时间点(0,1,2,4,8和24小时),用RiboPureTM试剂盒按照制造商的方案提取细胞RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCG1(Taqman探针Mm00437390.m1),ABCA1(Taqman探针Mm00442646.m1)和SR-BI(Taqman探针Mm00450234.m1)的表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
CER-001和HDL3处理后观察到ABCA1和ABCG1 mRNA水平下降。ApoA-I并不影响那些mRNA水平,并且CER-001和HDL3不会改变SR-BI的mRNA水平(图27,图28,和图29)。在CER-001处理后,ABCA1的mRNA水平在超过8小时中恢复到基线,并且对于ABCG1,恢复更快,因为在8小时内到达基线。在HDL3处理后,ABCA1的mRNA水平在约8小时恢复到基线,并且对于BCG1,2-4小时是必需的。在CER-001和HDL3处理之间观察到的差异可能是由于在CER-001的存在下mRNA处于较低的水平。ApoA-I的除去引起在不同时间点(对于ABCA1为1小时,对于ABCG1为4小时)ABCA1和ABCG1 mRNA水平的增加。CT代表对照,即未添加CER-001,HDL3或ApoA-I的J774巨噬细胞的生长。
8.4.11研究K:通过CER-001和HDL3调控ABCA1和SR-BI mRNA的巨噬细胞特异性-对肝细胞(小鼠和人类)的效应
本研究检查了(25μg/mL)的CER-001和HDL3对小鼠和人肝细胞ABCA1和SR-BI的mRNA水平的影响。在DMEM 10%FCS的HepG2细胞(人肝细胞)和Hepa1-6(小鼠肝细胞)接种到6孔板(300,000细胞/孔)。三天后,将CER-001,HDL3和ApoA-I(在DMEM中0.25,25和250μg/mL)添加到肝细胞中6小时,用RiboPureTM试剂盒按照制造商的方案提取细胞RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCA1(Taqman探针Hs01059118.m1和Mm00442646.m1,分别用于HepG2和Hepa1-6)和SR-BI(Taqman探针Hs00969821.ml和Mm00450234.m1,分别用于HepG2和Hepa1-6)的表达。所使用的参考基因是针对Hepa1-6的HPRT1(Taqman探针:Mm00446968.m1)和针对HepG2细胞的GAPDH(Taqman探针:Hs03929097.g1)。
用CER-001,HDL3和ApoA-I处理后(图30和图31),在人肝细胞中没有观察到ABCA1和SR-BI mRNA水平的显著下降。用250μg CER-001和HDL3处理后,在小鼠肝细胞中观察到ABCA1 mRNA水平的两倍的降低(图32和图33)。用ApoA-I以250μg/mL处理在小鼠肝细胞中ABCA1 mRNA水平下降25%。
8.4.12研究L:在通过CER-001和HDL3下调ABCA1后添加ApoA-I的结果
本研究检查在通过CER-001和HDL3下调ABCA1后添加ApoA-I对基因表达的影响。在DMEM 2.5%FCS中的J774接种于6孔板(300,000细胞/孔)。平衡(DMEM)后,CER-001,HDL3和ApoA-I是在250μg/mL添加过夜。第二天,培养基替换为补充或未补充ApoA-I(25或250μg/mL)的新鲜的DMEM以起始ApoA-I胆固醇流出,持续2小时。该实验在不同时间点停止:1)添加ApoA-I前停止J774,2)J774+DMEM(被动流出,2小时),3)J774+ApoA-I(25μg/mL),持续2小时和4)J774+ApoA-I(250μg/mL),持续2小时。用RiboPureTM试剂盒按照制造商的方案提取细胞RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCA1(Taqman探针Mm00442646.m1),ABCG1(Taqman探针Mm00437390.m1),和SR-BI(Taqman探针Mm00450234.m1)的表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。
加入250μg/mL的ApoA-I在2小时后增加了ABCA1 mRNA水平(DMEM条件–第4组条(图34)。这种增加是短暂的,因为在6小时内水平回到基线(见实验F)。添加CER-001或HDL3强烈地降低了ABCA1 mRNA水平(黑条)。去除脂蛋白后两个小时,ABCA1 mRNA水平也相应增加到以前的结果(见实验I),并且这种增加通过添加250μg/mL的ApoA-I而加强。用250μg/mL ApoA-I预培养巨噬细胞并未改变ABCA1 mRNA水平。在用250μg/mL ApoA-I预温育在那些条件下也观察到了用DMEM+250μg ApoA-I记录的刺激。观察到在不同的条件下ABCG1 mRNA调节的类似的概貌(图35)。SR-BI mRNA在HDL3的存在下增加,但在其他条件下未增加(图36)。对于测试的不同条件,添加ApoA-I并未改变SR-BI mRNA水平。
8.4.13研究M:通过HDL2调节巨噬细胞J774中ABCA1,ABCG1和SR-BI的mRNA细胞水平
本研究检查HDL2对小鼠巨噬细胞中ABCA1,ABCG1和SR-BI mRNA水平的影响。HDL2是与HDL3相比更大且更成熟的脂蛋白,并且HDL2与ABCG1,以及HDL3与ABCA1相互作用。J774接种在6×孔板(300,000细胞/孔)并用氧化性-LDL装载。在巨噬细胞上加入HDL2(2.5至1000μg/mL)6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCA1(Taqman探针Mm00442646.m1),ABCG1(Taqman探针Mm00437390.m1)和SR-BI(Taqman探针Mm00450234.m1)的基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)。在实验中使用的HDL2刚刚针对PBS溶液透析。
观察到75μg/mL以上的HDL2处理导致小鼠巨噬细胞中ABCA1和ABCG1 mRNA水平的显著下降(图37和图38)。HDL2浓度高于75μg/mL时,SR-BI的mRNA水平开始增加(图39)。
8.4.14研究N:通过环糊精调控J774巨噬细胞中ABCA1,ABCG1和SR-BI mRNA的细胞水平-测定环糊精的存在下的胆固醇流出
本研究采用β环糊精来检查细胞内胆固醇浓度是否可以负责用CER-001和HDL3观察到的J774小鼠巨噬细胞中ABCA1和ABCG1的下调。β环糊精是环状寡糖,溶于水,具有对固醇极高的特异性并能够从细胞流出胆固醇。在DMEM 2.5%FCS中,J774接种在24孔板(60,000细胞/孔)并装载3H-胆固醇LDL。24小时平衡(DMEM)后,添加β环糊精(0.03,0.1,0.3,1,3,10和30mM),持续6小时。使用第8.3.6节的方案检测流出的百分比,并被确定为:培养基DPM/(培养基DPM+细胞DPM)*100。30mM的剂量不会在最终图上表示,因为剂量是细胞毒性的,杀死细胞群体的一半。
观察到胆固醇流出与β环糊精之间的剂量依赖性增加(图40)。
8.4.15研究O:通过环糊精调控J774巨噬细胞中ABCA1,ABCG1和SR-BI mRNA的细胞水平-测定基因表达
本研究采用β环糊精来检查细胞内胆固醇浓度是否负责用CER-001和HDL3观察到的J774小鼠巨噬细胞中ABCA1和ABCG1的下调。J774接种在6孔板(300,000细胞/孔)。将β环糊精(0.03,0.1,0.3,1,3,10和30mM)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案测定ABCA1(Taqman探针Mm00442646.m1),ABCG1(Taqman探针Mm00437390.m1)和SR-BI(Taqman探针Mm00450234.m1)的基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)
在β环糊精的存在下,观察到J774中ABCA1和ABCG1 mRNA水平的剂量依赖性减少(图41和图42)。与此相反,SR-BI显示随β环糊精(图44)的剂量依赖性增加。
8.4.16研究P:通过环糊精调控J774巨噬细胞中SREBP1,SREBP2和LXR mRNA的细胞水平-测定基因表达
本研究中使用β环糊精检查β环糊精对J774巨噬细胞中LXR,SREBP1和SREBP2 mRNA表达的影响。J774接种在6孔板(300,000细胞/孔)。将β环糊精(0.03,0.1,0.3,1,3,10和30mM)加入巨噬细胞6小时,根据制造商的方案使用RiboPureTM试剂盒提取RNA。使用在8.3.2节(RNA提取);8.3.4(逆转录)和8.3.5(qPCR)中描述的方案测定基因表达。根据制造商的方案用Taqman探针(分别为Mm01138344.m1,Mm01306292.m1,Mm00443451.m1)测定LXR,SREBP1和SREBP2的基因表达。所使用的参考基因是HPRT1(Taqman探针:Mm00446968.m1)
没有观察到LXR mRNA随β环糊精浓度增加的显著变化(图44)。在β环糊精的最低剂量下SREBP-2mRNA增加,并达到平台(图46)。观察到SREBP-1mRNA的剂量依赖性降低(图45),这类似于用CER-001和HDL3处理观察到的。
9实施例3:测量用CER-001处理的Apo-/-小鼠流动终止模型(Flow Cessation Model)中的斑块消退
9.1介绍
研究A-F的目标是测量不同CER-001浓度对来自用高脂饮食喂养的apoE-/-小鼠的结扎左侧颈动脉的斑块进展的效力。
9.2材料与方法
9.2.1概述
用于这些研究的材料包括CER-001(1109HDL03-2X240913批次,通过膜Vivaflow 30KDa盒浓缩)和纯化的人HDL3。在实验前,CER-001和HDL3制剂等分为至少8等分/脂蛋白浓度(每组注射使用1等分试样)。在注射之前,制剂的一个等分试样通过在约37℃水浴中温育5分钟并轻轻晃动解冻。该制剂不能震荡或剧烈搅拌,以避免起泡。如果溶液混浊,或者如果观察到可见颗粒物,将溶液在约37℃水浴中温育额外的半小时。
制备磷酸缓冲蔗糖稀释剂(10mM磷酸盐,4%的蔗糖和2%甘露醇,pH值=7.4)溶液,等分并储存在约-20℃。安慰剂溶液用于制备不同浓度的CER-001和HDL3。
9.2.2动物
在这些研究中所用的动物是C57Bl/6-B6.129P2-Apoetm1Unc/J品系小鼠。该品系来源于Jackson实验室,并且由Charles River分配。此物种和品系是用于胆固醇代谢研究的充分表征了的模型。纳入标准包括重量:21克(8周龄),23克(9周龄)和25克数(3个月龄);年龄:在开始饮食前8、9和12周,性别和数目:雄性,n=125(每组12只小鼠)。
动物饲养在Prolog Biotech的动物房中,按最大12只动物/笼的组。Prolog Biotech具有从法国兽医主管部门获得的协议编号A-31-254-01。在每个笼子中,为了动物的福利添加2个圆顶。动物在研究开始前5天进行驯化(从09/18到09/23)。动物接触到水和高胆固醇饮食(0.2%胆固醇,39.9%的脂肪,14.4%的蛋白质,45.7%的糖)。类似地管理所有的动物并根据Prolog Biotech的动物房的通常实践适当考虑它们的福利。这项研究计划已经被Prologue Biotech Ethical Committee(N℃EF-2011-CER-09)接受。
动物室条件如下:温度:21±1℃,相对湿度50±10%,和亮/暗循环:12小时/12小时(07H/19H)。每个月编辑动物室条件的报告。每周称重每只动物。动物通过在实验开始时插入耳环来鉴定。
9.2.3处理
将动物分成10组,每组12只动物,并如表4所示进行处理。
将制剂注入到用异氟烷麻醉的小鼠的眶后静脉(50μL/每只小鼠),每2天一次,注射8次。施用的剂量是基于在每个笼子中小鼠体重的平均值。所述化合物在每天上午10点注射。对于血液取样,以所指示的剂量对禁食过夜的小鼠采样:(1)通过框后抽取在前剂量时(上午9点):第一次注射/手术日前24小时;(2)通过框后抽取在前剂量(上午9点):最后一次注射后24小时;和(3)在第5次注射后在t=0(9AM)和指定的时间点通过尾部抽血。血液样品在采集后立即保持在约+4℃,以避免血液样品的改变。血样离心(在+4℃800×g下离心10分钟),并且保存血浆以用于未来分析。
9.2.4手术
对于器官采集,在最后一次注射后24小时,腹膜内注射氯胺酮(100mg/kg)和赛拉嗪(10mg/kg)的混合物麻醉小鼠,并且动物在2或3分钟后入睡。血液通过毛细作用(眶后静脉,大约200μl血液)抽取并转移到含有EDTA的管中。然后,进行腹胸切口。通过右心室进行第一次清洗,必要时通过左心室,然后对心脏灌注PBS。液体应当通过胸主动脉流动。
取出左和右颈动脉,肝,脾,和连接到心脏的主动脉并储存在-80℃。肝脏被收集在四个不同的等分试样中。剩下的生物标本在器官采集后丢弃。对于粪便收集,在每个组进行最后一次注射的当天,对笼更换新的稻草,并持续24小时(处死当天)收集粪便。
9.2.5测定血浆总胆固醇
实验程序:在每个管中添加胆固醇标准品(2g/L):0/0.625/1.25/1.875/2.5/3.75/5μl。在12,000xg离心血浆样品1分钟。根据物种,如表5所示添加样品至每个管中。添加0.5mL重构的缓冲液至每个管(标准品和样品),涡旋并在37℃下温育5分钟。从每个管转移150μl至96孔板中的2个不同的孔。在500nm读取吸光度。
9.2.6测定在血浆中的非酯化胆固醇
实验程序:在每个管中添加胆固醇标准品(2g/L):0/0.625/1.25/1.875/2.5/3.75/5μl。在12,000xg离心血浆样品1分钟。根据物种,如表6所示添加样品至每个管中。添加0.5mL重构的缓冲液至每个管(标准品和样品),涡旋并在37℃下温育5分钟。从每个管转移150μl至96孔板中的2个不同的孔。在500nm读取吸光度。
9.2.7通过RP C18HPLC测定胆固醇
设备:HPLC(Waters Binary HPLC pump 1525,Waters UV/Visible detector 2489,Waters Sample manager 2767,Masslynx软件(4.1),柱:RP C18 Zorbax 4.6mm×25厘米,粒度10μm(或相当的),乙腈HPLC级,无水乙醇,水(milliQ),标准胆固醇为无水乙醇中的0.1g/l。
层析参数:洗脱液A:86%乙腈,10%乙醇,4%水;洗脱液B:86%乙腈,14%乙醇。在使用前在超声波器水浴中超声处理洗脱液5分钟。流速:1.5mL/min;压力:1400PSI;检测:UV 214nm;运行时间:20分钟;注射:25至100μL;在表7显示梯度程序:
样品:样品是根据第9.2.8节的方法制备。添加50μl的乙醇提取物到微瓶中,注入40μl到HPLC。在214nm确定峰面积并计算在提取物中的浓度:[胆固醇样品(μg/μl)=峰面积/斜率/注射体积
9.2.8从肝脏提取胆固醇
步骤1:称量约50mg肝,将组织引入到玻璃管中。在3ml MeOH中均浆组织。
EDTA 5mM(2:1)。添加3mL氯仿和3mL H2O并涡旋五分钟。1,500xg离心10min,并收集下相。将溶液等体积(2×1.3mL)分配在2个玻璃管(小)中。
步骤2:如下处理溶液:
未酯化的胆固醇:干燥溶液。添加400μl EtOH以用于样品的增溶。
总胆固醇:干燥溶液。添加1ml 0.5M甲醇KOH溶液。在60℃温育至少1小时。通过添加1mL氯仿和1ml H2O到样品中,涡旋,在1,500xg离心10分钟并收集下层相来执行Bligh和Dyer脂质提取。干燥有机相。添加400μlEtOH以用于样品的增溶。
9.2.9从颈动脉或主动脉提取胆固醇
步骤1:取出手术带(只针对颈动脉)并将组织引入到玻璃管中。加1.8mL CHCl3/MeOH(2:1)(对于颈动脉)或3mL(对于主动脉)。在4℃混合过夜。
步骤2:去除,干燥,称重颈动脉或主动脉。将有机溶液(CHCl3/MeOH)等体积分配在2个玻璃管(小)中。如下处理溶液:
未酯化的胆固醇:干燥溶液。添加200μl EtOH以用于样品的增溶。
总胆固醇:干燥溶液。添加1ml 0.1M乙醇KOH溶液。在60℃温育至少1小时。通过添加1mL氯仿和1ml H2O到样品中,涡旋,在1,500xg离心10分钟并收集下层相来执行Bligh和Dyer脂质提取。干燥有机相。添加200μl EtOH以用于样品的增溶。
9.3体内斑块进展研究A-F的结果
9.3.1研究A:测定在结扎的左颈动脉中的动脉粥样硬化斑块
本研究检查CER-001施用对来自用高脂肪饮食喂养的apoE-/-小鼠的经结扎的颈动脉斑块进展的影响。对于每组小鼠,在脂质提取和HPLC分析后测试了颈动脉的胆固醇含量。结扎的颈动脉收集于处死的当天,并保存在-80℃。脂质用有机溶液萃取,通过HPLC测定胆固醇浓度。
经结扎的颈动脉是根据第9.2.9节的方法提取脂质的。从颈动脉(鲜重)中除去手术带,并将组织引入到玻璃管中。对这添加1.8mL CHCl3/MeOH(2:1)并在4℃混合过夜。然后取出颈动脉,干燥并称重,将有机溶液(CHCl3/MeOH)等体积分到两个玻璃管中。对于未酯化的胆固醇(UC),添加100μLβ谷甾醇(内标)并将溶液干燥。对这添加200μL EtOH,以用于样品的增溶,并通过HPLC分析样品UC。对于总胆固醇(TC),添加100μLβ谷甾醇(内标)并将溶液干燥。对这添加1mL 0.1M甲醇KOH溶液,并在60℃下温育该溶液至少30分钟。进行Bligh和Dyer方法以用于胆固醇萃取,其中添加1mL氯仿,随后是1mL H2O,并通过涡旋混合。当进行相分离时,收集下层相并干燥。对这添加200μL EtOH以用于样品的增溶并用HPLC分析TC。胆固醇浓度通过HPLC根据第9.2.7的方法测定。简言之,注射50μl至C18Zorbax:SB-C18 4,6X250mm(Agilent ref 880975-902)柱。流速为以60%的洗脱液A(ACN/ETOH/H2O 85/10/5)和40%的洗脱液B(ACN/ETOH 86/14)1.5mL/min。运行时间为55分钟,胆固醇的保留时间为22.85分钟,和β谷甾醇的保留时间为32.2分。系统:设定在214nm处的二元泵Waters 1525-UV检测器-软件:Massslynx 4.1。
在用CER-001或HDL3处理的小鼠中观察到了结扎颈动脉中的胆固醇含量的相似概貌(图47和图48)。对于2,5和10mg/kg浓度,观察到未酯化胆固醇降低25%,并观察到经结扎的颈动脉中总胆固醇含量降低50%。用20和50mg/kg剂量的CER-001或HDL3处理,斑块进展的抑制是约10%。
9.3.2研究B:测定CER-001输注后血浆胆固醇流通
这项研究检查了CER-001施用对用高脂肪饮食喂养的apoE-/-小鼠的脂蛋白概貌的影响。在第5次输注后的不同时间点收集和分析血液。还比较了剂量前血浆(第一次注射之前)和剂量后血浆(最后一次注射后24小时)。分析血浆的总胆固醇,未酯化的胆固醇和人ApoA-I含量。
根据章节9.2.5和9.2.6的方法分别测定总的和未酯化的胆固醇浓度。在从总胆固醇中减去未酯化的胆固醇后测定胆固醇酯浓度。在第5次施用(注射前1小时;注射后1小时,2小时,4小时和24小时)后,测定每组12只小鼠的胆固醇流通。动物禁食过夜。
在输注CER-001或HDL3后,未观察到总血浆胆固醇流通的显著变化(图49和图50)。在CER-001和HDL3输注后未观察到未酯化胆固醇流通的显著变化(图51和图52)。在输注后2和4小时,50mg/kg的CER-001似乎增加血浆未酯化的胆固醇浓度。
CER-001和HDL3的剂量后概貌是相似的,除了与HDL3处理的小鼠相比,在经CER-001处理的动物中总的和未酯化的胆固醇浓度高两倍(图53和图54)。与安慰剂相比,10mg/kg以上剂量的CER-001在8次注射后增加小鼠血浆中的胆固醇浓度。HDL3输注没有将胆固醇浓度增加得高于安慰剂。
9.3.3研究C:血浆人ApoA-I的测定
本研究通过测定输注CER-001后血浆中人ApoA-I的浓度来检查CER-001输注的动力学。根据制造商的说明书,通过ELISA(Assay Pro EA5201-1)测定血浆中的ApoA-I浓度。在ApoA-I测定之前,取决于注射到小鼠中的CER-001和HDL3浓度,将血浆稀释1/100,1/50或1/10。
使用CER-001观察到人ApoA-I血浆浓度的剂量依赖性增加。所有测试浓度均恢复了血浆中ApoA-I的预期剂量(图55)。对于HDL3,观察到人ApoA-I血浆浓度的剂量依赖性增加(图56)。然而,人血浆ApoA-I比预期剂量是小3倍浓缩的。
9.3.4研究D:Western印迹测定ABCA1在结扎的颈动脉中的表达
本研究检查ABCA1的表达是否可以与胆固醇含量的差异相关,因为在小鼠结扎的颈动脉中观察到胆固醇含量的降低(5mg/kg CER-001)和无影响(50mg/kg CER-001)。先前用氯仿:甲醇提取的经结扎的颈动脉溶解在NAOH 0.1N(100μL/颈动脉)中。将溶液短暂超声处理并在15,000×g离心10分钟。用Bradford测定法测定蛋白质浓度,并将40μg样品上样到SDS-PAGE上。使用软件定量ABCA1表达(ab7360-稀释度1/1000)。
对于50mg/kg剂量的CER-001和HDL3,观察到颈动脉ABCA1含量的减少(图57)。5mg/kg剂量的CER-001和HDL3不影响ABCA1表达。针对50mg/kg CER-001和HDL3剂量,经结扎颈动脉中的ABCA1表达下调。那些巨噬细胞的胆固醇排出可能已经受损,这可以解释在50mg/kg浓度下对斑块胆固醇含量没有影响的原因。
9.3.5研究E:在小鼠肝脏中SR-BI和ABCA1的测定
本研究检查了最后一次注射CER-001后24小时在肝脏中的SR-BI和ABCA1蛋白含量。通过短暂超声处理在PBS(500μL)中裂解肝脏块(50mg)。将样品离心(800×g,10分钟),弃去沉淀。将上清液在4℃以16,000xg离心30分钟,沉淀用PBS 1%Triton X100(200μL)溶解。将10μg溶解的沉淀物装载在SDS PAGE 10%上,并使用软件定量ABCA1表达(ab7360-稀释1/1000)或SR-BI表达(ab24603-稀释1/1000)。
与ABCA1颈动脉含量相反,随着CER-001浓度的增加,在小鼠肝脏中观察到ABCA1蛋白水平的增加(图58)。这种差异可以解释为:i)细胞群是不同的;在颈动脉中,细胞群由巨噬细胞和内皮细胞组成;在肝脏中,细胞群大多数是肝细胞,ii)CER-001的形式及其功能在两种情况下是不同的;对于颈动脉,在胆固醇中的CER-001是装载不足的,并且其功能是从细胞中排出胆固醇;对于肝脏,CER-001是胆固醇装载的,并且其功能将被肝脏消除。因为ABCA1表达受胆固醇含量的严格调控,我们假设在胆固醇不良环境(例如高胆固醇流出)中,ABCA1表达降低,并且在富含胆固醇的环境(胆固醇摄取)中,ABCA1表达增加。对于SR-BI,随着CER-001浓度的增加,没有观察到蛋白质水平的显著变化(图59)。
9.3.6研究F:小鼠粪便中胆固醇含量的测定
本研究分析了针对不同浓度的CER-001和HDL3,小鼠粪便中的胆固醇含量。粪便通过脂质提取并通过HPLC分析其胆固醇含量。粪便(200mg)溶解在甲醇:水(50:50)溶液中,并与混合1分钟。将溶液冷冻并冻干过夜。第二天,加入4mL氯仿/甲醇(2:1),将溶液在4℃下混合24小时。对这加入水(1.33mL),然后将溶液混合并在3700×g离心3分钟。保存有机相并干燥。将沉淀溶解在无水乙醇(2mL)中,并在筒AC 0.2μm上过滤。根据第9.2.7节的方法分析样品中的胆固醇浓度。
对于用CER-001和HDL3注射的小鼠,观察到粪便中胆固醇含量的剂量依赖性增加(图60)。在10mg/kg的浓度观察到最大胆固醇排出。
10.实施例4:CER-001在患有低α-脂蛋白血症的患者中的临床试验
10.1背景
Cerenis在由于遗传缺陷(包括Tangier病患者和两个ABCA1杂合子)导致的低-α-脂蛋白血症患者中完成了一些早期临床试验工作。
在“诱导期”期间,由于RLT途径中的终身缺乏而在全身血管壁中捕获的胆固醇的负荷应当随每一个重复的剂量逐渐减少,并且在其中LDL水平被充分控制的患者中动脉粥样硬化斑块应该退化。治疗将以减少的给药间隔(“维持期”)长期地持续,以维持适当的胆固醇稳态-即,通过内源性LDL-C进行的向组织的递送和通过输注的CER-001前-β-样HDL颗粒进行的除去之间的平衡。CER-001治疗可以是终生的,因为凭借遗传因果关系,HDL产生和RLT中的先天缺陷是永久性的。
下表8显示了试验(称为SAMBA试验)中所包括的患者的概貌。
患者最初在强烈的“诱导期”进行治疗,在4周内以8mg/kg的剂量接受9剂的CER-001。在该诱导期后,用脂蛋白概貌和MRI扫描重新评估研究的受试者。随后,研究的受试者继续在“维持期”基序每两周一次治疗持续6个月的总治疗。此时,重复脂蛋白谱和MRI扫描。
10.2结果
在图68A-68G和图69A-69G中按逐个受试者显示了CER-001对通过LCAT导致的胆固醇流通和胆固醇酯化的影响。
缺乏ApoA-I基因(纯合子,ApoA-I-/-)的受试者1在8mg/Kg的一剂CER-001后显示胆固醇流通,LCAT激活和粪便胆固醇消除。
没有ABCA1基因(纯合子ABCA1-/-)且患有Tangier病的受试者7在8mg/Kg的一剂CER-001后显示胆固醇流通和LCAT活化。在该患者中未测试粪便胆固醇消除。
图70和图71分别显示了在治疗一个月后逐个患者的平均颈动脉和主动脉血管壁厚度。颈动脉的平均血管壁厚度在诱导治疗一个月后下降了-6.4%,并且主动脉的平均血管壁厚度在诱导治疗一个月后下降了平均-4.6%。纯合的ApoA-I缺乏患者经历颈动脉平均血管壁厚度的-17%消退。图72显示6个月后的平均血管壁厚度。通过3Tesla MRI测定平均血管壁厚度。
该试验证明了在这些受试者中机制(即,CER-001执行RLT途径的所有步骤)的证据以及积极治疗效果的证据,特别是在一个月强化治疗后颈动脉内膜–中膜壁厚度减少,其在具有影响最重大的缺陷(纯合ABCA1缺陷)的受试者中,与他汀类未治疗的高胆固醇血受试者中治疗两年后看到的降低相当。重要的是,观察到的减少在标准护理(加强的个体化脂质管理)之上看到。重要的是,在另外5个月的维持治疗后,观察到持续的和累积的益处,这支持具有家族性低α-脂蛋白血症的患者终生需要长期ApoA-I替代疗法的治疗原理。在ABCA1缺陷中,在不存在ABCA1或不存在ABCA1功能的情况下,胆固醇仍然流出到CER-001,这可能是因为存在通过其他受体(如但不限于ABCG1)的排出途径的冗余。
具体实施方式
在以下编号段落中阐述的实施方案中描述了本公开的各个方面。
1.鉴定有效地使受试者中的胆固醇流通的HDL治疗剂剂量的方法,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者,(b)在施用所述第一剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应;并且(c)(i)如果将受试者的一种或多种HDL标志物的表达水平降低超过截留量,则施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量低于第一剂量;或(ii)如果没有将受试者的一种或多种HDL标志物的表达水平降低超过截留量,则用所述HDL治疗剂的第一剂量治疗受试者。
2.用于在受试者中监测HDL治疗剂的功效的方法,该方法包括:(a)根据第一给药日程表用HDL治疗剂治疗受试者,(b)测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一给药日程表对所述表达水平的效应;及(c)(i)如果将受试者的一种或多种HDL标志物的表达水平降低超过上截留量(upper cutoff amount),则根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较低剂量,在一段较长的时间中将HDL治疗剂输注到受试者中,并且不太频繁地施用HDL治疗剂至受试者;(ii)如果没有将受试者的一种或多种HDL标志物的表达水平降低超过下截留量(lower cutoff amount),则根据第二给药日程表用HDL治疗剂治疗受试者,其中所述第二给药日程表包含以下的一个或多个:施用HDL治疗剂的较高剂量,在一段较短的时间中将HDL治疗剂输注到受试者中,并且较频繁地施用HDL治疗剂至受试者;或(iii)如果将受试者的一种或多种HDL标志物的表达水平降低在上截留量和下截留量之间的量,则根据第一给药日程表持续治疗受试者。
3.实施方案1或实施方案2的方法,其中所述截留量是相对于在所述施用之前受试者的自身基线。
4.实施方案1或实施方案2的方法,其中所述截留量是相对于对照量。
5.实施方案4的方法,其中所述对照量是群体平均值。
6.实施方案5的方法,其中所述群体平均值来自健康受试者。
7.实施方案5的方法,其中所述群体平均值来自与受试者具有相同疾病状况的群体。
8.鉴定有效地使胆固醇流通的剂量HDL治疗剂的方法,该方法包括:(a)施用HDL治疗剂的第一剂量至受试者群体,(b)在施用所述第一剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应;(c)施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的第二剂量高于或低于第一剂量;(d)在施用所述第二剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量和/或第二剂量对所述表达水平的效应;(e)任选地,用所述HDL治疗剂的一个或多个额外剂量重复步骤(c)和(d);和(f)鉴定没有将一种或多种HDL标志物的表达水平降低超过截留量的最高剂量,从而鉴定有效地使胆固醇流通的HDL治疗剂剂量。
9.实施方案8的方法,其中所述步骤(d)包括在施用所述第二个剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应。
10.实施方案1-9中任一项的方法,进一步包括在施用所述第二剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第二剂量对所述表达水平的效应。
11.实施方案10的方法,其中如果将受试者的一种或多种HDL标志物的表达水平降低超过截留量,则施用所述HDL治疗剂的第三剂量,其中所述HDL治疗剂的第三剂量低于第二剂量。
12.用于治疗需要HDL治疗剂的受试者的方法,该方法包括对受试者施用以下的组合:(a)下述剂量的任选作为脂蛋白复合物的HDL治疗剂,与所述受试者的基线量相比,所述剂量没有将在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达降低超过20%或10%;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸(niacin),他汀类(statin),贝特类(fibrate),PCSK9抑制剂,依泽替米贝(ezetimibe),和CETP抑制剂。
13.实施方案12的方法,其中所述HDL治疗剂是脂蛋白复合物。
14.用于治疗需要HDL治疗剂的受试者的方法,该方法包括对受试者施用以下的组合:(a)下述剂量的任选作为脂蛋白复合物的HDL治疗剂,与对照量相比,所述剂量没有将在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达降低超过20%或10%;和(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸,他汀类,贝特类,PCSK9抑制剂,依泽替米贝,和CETP抑制剂。
15.实施方案14的方法,其中所述HDL治疗剂是脂蛋白复合物。
16.实施方案14或15的方法,其中所述对照量是群体平均值。
17.实施方案16的方法,其中所述群体平均值来自健康受试者。
18.实施方案16的方法,其中所述群体平均值来自与受试者具有相同疾病状况的群体。
19.实施方案1至18中任一项的方法,其中所述受试者是人或受试者群体是人类受试者群体。
20.实施方案1至18中任一项的方法,其中所述受试者是非人动物,或所述受试者群体是非人动物群体。
21.实施方案20的方法,其中所述非人动物是小鼠。
22.实施方案1至21中任一项的方法,其中所述至少一种HDL标志物是ABCA1。
23.实施方案22的方法,其中测量ABCA1 mRNA的表达水平。
24.实施方案22的方法,其中测量ABCA1蛋白的表达水平。
25.实施方案22至24中任一项的方法,其中所述ABCA1截留量为20%-80%。
26.实施方案25的方法,其中所述ABCA1截留量为30%-70%。
27.实施方案26的方法,其中所述ABCA1截留量为40%-60%。
28.实施方案27的方法,其中所述ABCA1截留量为50%。
29.实施方案22至28中任一项的方法,其中在施用所述第一剂量或所述第二剂量后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时测量ABCA1表达水平。
30.实施方案1至29中任一项的方法,其中所述至少一种HDL标志物是ABCG1。
31.实施方案30的方法,其中测量ABCG1 mRNA表达水平。
32.实施方案30的方法,其中测量ABCG1蛋白表达水平。
33.实施方案30至32中任一项的方法,其中所述ABCG1截留量为20%-80%。
34.实施方案33的方法,其中所述ABCG1截留量为30%-70%。
35.根据实施方案34所述的方法,其中所述ABCG1截留量为40%-60%。
36.实施方案35的方法,其中所述ABCA1截留量为50%。
37.实施方案30至36中任一项的方法,其中在施用后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时测量ABCG1表达水平。
38.实施方案1至37中任一项的方法,其中所述至少一种HDL标志物是SREBP-1。
39.实施方案38的方法,其中测量SREBP-1mRNA表达水平。
40.实施方案38的方法,其中测量SREBP-1蛋白表达水平。
41.实施方案38至40中任一项的方法,其中所述SREBP-1截留量为20%-80%。
42.实施方案41的方法,其中所述SREBP-1截留量为30%-70%。
43.实施方案42的方法,其中所述SREBP-1截留量为40%-60%。
44.实施方案43的方法,其中所述SREBP-1截留量为50%。
45.实施方案38至44中任一项的方法,其中测量施用后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时的SREBP-1表达水平。
46.实施方案1至45中任一项的方法,其中所述HDL治疗剂是脂蛋白复合物。
47.实施方案46的方法,其中所述脂蛋白复合物包含载脂蛋白。
48.实施方案47的方法,其中所述载脂蛋白是ApoA-I,ApoA-II,ApoA-IV,ApoE或其组合。
49.实施方案46的方法,其中所述脂蛋白复合物包含载脂蛋白肽模拟物。
50.实施方案49的方法,其中所述肽模拟物是ApoA-I,ApoA-II,ApoA-IV或ApoE肽模拟物或其组合。
51.实施方案46的方法,其中所述脂蛋白复合物是CER-001,CSL-111,CSL-112或ETC-216。
52.实施方案1至45中任一项的方法,其中所述HDL治疗剂是小分子。
53.实施方案52的方法,其中所述小分子是CETP抑制剂。
54.实施方案52的方法,其中所述小分子是泛酸衍生物。
55.实施方案1至46中任一项的方法,其还包括确定截留量。
56.实施方案55的方法,其中通过产生针对HDL治疗剂的剂量反应曲线来确定所述截留量。
57.实施方案56的方法,其中所述截留量为导致剂量反应曲线中的拐点的剂量的25%-75%。
58.实施方案57的方法,其中所述截留量为导致剂量反应曲线中的拐点的剂量的40%-60%。
59.实施方案1至58中任一项的方法,其中所述受试者或受试者群体具有ABCA1缺陷。
60.实施方案59的方法,其中所述受试者或受试者群体对于ABCA1突变是纯合的。
61.实施方案59的方法,其中所述受试者或受试者群体对于ABCA1突变是杂合的。
62.鉴定适合于疗法的HDL治疗剂的剂量的方法,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者,(b)在每个剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平;和(c)鉴定没有使所述一种或多种HDL标志物的表达水平降低超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
63.鉴定适合于疗法的HDL治疗剂的剂量的方法,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)在每个剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平;和(c)鉴定没有使所述一种或多种HDL标志物的表达水平在所述受试者中增加超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
64.鉴定适合于疗法的HDL治疗剂的剂量的方法,该方法包括:鉴定没有使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最高剂量。
65.实施方案64的方法,其包括:(a)施用一个或多个剂量的HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
66.鉴定适合于疗法的HDL治疗剂的给药间隔的方法,该方法包括:鉴定不会使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最频繁的给药日程表的最高剂量。
67.实施方案66的方法,其包括:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定没有使所述受试者中的胆固醇流出降低超过0%,超过10%或超过20%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
68.实施方案67的方法,其中一个或多个给药频率包括选自以下的一个或多个给药频率:(a)每2天以1-4小时输注施用;(b)每3天以1-4小时输注施用;(c)每周日以24小时输注施用;和(d)每两周以24小时输注施用。
69.实施方案65至68中任一项的方法,其中在来自所述受试者或受试者群体的单核细胞,巨噬细胞或单核细胞中测量所述胆固醇流出。
70.治疗具有ABCA1缺陷的受试者的方法,该方法包括对受试者施用治疗有效量的HDL治疗剂。
71.实施方案70的方法,其中所述HDL治疗剂是CER-001。
72.实施方案70或71的方法,其中所述受试者对于ABCA1突变是杂合的。
73.实施方案70或71的方法,其中所述受试者对于ABCA1突变是纯合的。
74.治疗患家族原发性低α-脂蛋白血症的受试者的方法,该方法包括:(a)根据诱导方案对受试者施用HDL治疗剂;和随后(b)根据维持方案对受试者施用HDL治疗剂。
75.实施方案74的方法,其中所述维持方案需要以较低剂量,较低频率或两者施用所述HDL治疗剂。
76.实施方案74或实施方案75的方法,其中所述受试者对于ABCA1突变是杂合的。
77.实施方案74或实施方案75的方法,其中所述受试者对于ABCA1突变是纯合的。
78.实施方案74至77中任一项的方法,其中所述受试者对于LCAT突变是纯合的或杂合的。
79.根据实施方案74至78中任一项所述的方法,其中所述受试者对于ApoA-I突变是纯合的或杂合的。
80.实施方案74至79中任一项的方法,其中所述受试者对于ABCG1突变是纯合的或杂合的。
81.实施方案74至80中任一项的方法,其中也用脂质控制药物治疗所述受试者。
82.实施方案81的方法,其中所述脂质控制药物是阿托伐他汀,依泽替米贝,烟酸,罗舒伐他汀,辛伐他汀,阿司匹林,氟伐他汀,洛伐他汀,普伐他汀或它们的组合。
83.实施方案74至82中任一项的方法,其中所述HDL治疗剂是CER-001。
84.实施方案83的方法,其中所述诱导方案的持续时间是4周。
85.实施方案83或实施方案84的方法,其中所述诱导方案包括每周施用CER-001三次。
86.实施方案83至85中任一项的方法,其中在诱导方案中施用的剂量为8-15mg/kg(基于蛋白质重量)。
87.实施方案86的方法,其中在诱导方案中施用的剂量是8mg/kg,12mg/kg或15mg/kg。
88.实施方案83至87中任一项的方法,其中所述维持方案包括施用HDL治疗剂至少一个月,至少两个月,至少三个月,至少六个月,至少一年,至少18个月,至少两年,或无限期。
89.实施方案83至88中任一项的方法,其中所述维持方案包括每周施用CER-001两次。
90.实施方案83至89中任一项的方法,其中在维持方案中施用的剂量为1-6mg/kg(基于蛋白质重量)。
91.实施方案90的方法,其中在维持方案中施用的剂量是1mg/kg,3mg/kg或6mg/kg。
92.实施方案74至91中任一项的方法,其中,(a)诱导方案利用与受试者的基线量和/或群体平均值相比,使一种或多种HDL标志物的表达水平降低20%-80%或40%-60%的剂量;和/或(b)其中维持方案利用与受试者的基线量和/或群体平均值相比没有使一种或多种HDL标志物的表达水平降低超过20%或超过10%的剂量。
93.实施方案92的方法,其中维持方案利用没有降低一种或多种HDL标志物的表达水平的剂量。
94.HDL治疗剂,其在用于鉴定有效使受试者中的胆固醇流通的所述HDL治疗剂的剂量的方法中的用途,该方法包括:
(a)施用所述HDL治疗剂的第一剂量至受试者,
(b)在施用所述第一剂量后,测量所述受试者的循环单核细胞,巨噬细胞或单核细胞中的一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应;并且
(c)(i)如果将所述受试者的一种或多种HDL标志物的表达水平降低超过截留量,则施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的所述第二剂量低于所述第一剂量;或
(ii)如果没有将所述受试者的一种或多种HDL标志物的表达水平降低超过所述截留量,则用所述HDL治疗剂的所述第一剂量治疗所述受试者。
95.HDL治疗剂,其在用于在受试者中监测所述HDL治疗剂的功效的方法中的用途,该方法包括:
(a)根据第一给药日程表用所述HDL治疗剂治疗受试者,
(b)测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一给药日程表对所述表达水平的效应;并且
(c)(i)如果将所述受试者的一种或多种HDL标志物的表达水平降低超过上截留量(upper cutoff amount),则根据第二给药日程表用所述HDL治疗剂治疗所述受试者,其中所述第二给药日程表包含以下的一个或多个:施用所述HDL治疗剂的较低剂量,在一段较长的时间中将所述HDL治疗剂输注到所述受试者中,并且不太频繁施用所述HDL治疗剂至所述受试者;
(ii)如果没有将所述受试者的一种或多种HDL标志物的表达水平降低超过下截留量(lower cutoff amount),则根据第二给药日程表用所述HDL治疗剂治疗所述受试者,其中所述第二给药日程表包含以下的一个或多个:施用所述HDL治疗剂的较高剂量,在一段较短的时间中将所述HDL治疗剂输注入所述受试者中,并且较频繁地施用所述HDL治疗剂至所述受试者;或
(iii)如果将所述受试者的一种或多种HDL标志物的表达水平降低介于上截留量和下截留量之间的量,则根据所述第一给药日程表持续治疗所述受试者。
96.用于实施方案94或实施方案95的用途的HDL治疗剂,其中所述截留量是相对于在所述施用之前所述受试者的自身基线。
97.用于实施方案94或实施方案95的用途的HDL治疗剂,其中所述截留量是相对于对照量。
98.用于实施方案97的用途的HDL治疗剂,其中所述对照量是群体平均值。
99.用于实施方案98的用途的HDL治疗剂,其中所述群体平均值来自健康受试者。
100.用于实施方案98的用途的HDL治疗剂,其中所述群体平均值来自与所述受试者具有相同疾病状况的群体。
101.HDL治疗剂,其在用于鉴定有效使胆固醇流通的HDL治疗剂剂量的方法中的用途,该方法包括:
(a)施用HDL治疗剂的第一剂量至受试者群体,
(b)在施用所述第一剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应;
(c)施用所述HDL治疗剂的第二剂量,其中所述HDL治疗剂的所述第二剂量高于或低于所述第一剂量;
(d)在施用所述第二剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量和/或第二剂量对所述表达水平的效应;
(e)任选地,用所述HDL治疗剂的一个或多个额外剂量重复步骤(c)和(d);并且
(f)鉴定没有将一种或多种HDL标志物的表达水平降低超过截留量的最高剂量,从而鉴定有效地使胆固醇流通的所述HDL治疗剂的剂量。
102.实施方案101的方法,其中所述步骤(d)包括在施用所述第二剂量后测量所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第一剂量对所述表达水平的效应。
103.用于实施方案94至101中任一项的用途的HDL治疗剂,所述方法还包括在施用所述第二剂量后测量所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平,以评估所述第二剂量对所述表达水平的效应。
104.用于实施方案102的用途的HDL治疗剂,其中如果将所述受试者的一种或多种HDL标志物的表达水平降低超过截留量,则施用所述HDL治疗剂的第三剂量,其中所述HDL治疗剂的所述第三剂量低于所述第二剂量。
105.HDL治疗剂,其任选是脂蛋白复合物,用于在用于治疗需要HDL治疗剂的受试者的方法中使用,该方法包括对所述受试者施用以下的组合:
(a)下述剂量的所述HDL治疗剂,与所述受试者的基线量或对照量相比,所述剂量没有将在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达降低超过20%或10%;和
(b)胆固醇降低疗法,任选地选自胆汁酸树脂,烟酸(niacin),他汀类(statin),贝特类(fibrate),PCSK9抑制剂,依泽替米贝(ezetimibe),和CETP抑制剂。
106.用于实施方案105的用途的HDL治疗剂,其是脂蛋白复合物。
107.用于实施方案105或106的用途的HDL治疗剂,其中比较量是所述受试者的基线量。
108.用于实施方案105或106的用途的HDL治疗剂,其中比较量是对照量,并且是群体平均值。
109.用于实施方案108的用途的HDL治疗剂,其中所述群体平均值来自健康受试者。
110.用于实施方案108的用途的HDL治疗剂,其中所述群体平均值来自与所述受试者具有相同疾病状况的群体。
111.用于实施方案94至110中任一项的用途的HDL治疗剂,其中所述受试者是人或所述受试者群体是人受试者群体。
112.用于实施方案94至110中任一项的用途的HDL治疗剂,其中所述受试者是非人动物,或所述受试者群体是非人动物群体。
113.用于实施方案112的用途的HDL治疗剂,其中所述非人动物是小鼠。
114.用于实施方案94至113中任一项的用途的HDL治疗剂,其中所述至少一种HDL标志物是ABCA1。
115.用于实施方案114的用途的HDL治疗剂,其中测量ABCA1 mRNA的表达水平。
116.用于实施方案114的用途的HDL治疗剂,其中测量ABCA1蛋白的表达水平。
117.用于实施方案114至116中任一项的用途的HDL治疗剂,其中所述ABCA1截留量为20%-80%。
118.用于实施方案117的用途的HDL治疗剂,其中所述ABCA1截留量为30%-70%。
119.用于实施方案118的用途的HDL治疗剂,其中所述ABCA1截留量为40%-60%。
120.用于实施方案119的用途的HDL治疗剂,其中所述ABCA1截留量为50%。
121.用于实施方案114至120中任一项的用途的HDL治疗剂,其中在施用所述第一剂量或所述第二剂量后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时测量ABCA1表达水平。
122.用于实施方案94至121中任一项的用途的HDL治疗剂,其中所述至少一种HDL标志物是ABCG1。
123.用于实施方案122的用途的HDL治疗剂,其中测量ABCG1 mRNA表达水平。
124.用于实施方案122的用途的HDL治疗剂,其中测量ABCG1蛋白表达水平。
125.用于实施方案122至124中任一项的用途的HDL治疗剂,其中所述ABCG1截留量为20%-80%。
126.用于实施方案125的用途的HDL治疗剂,其中所述ABCG1截留量为30%-70%。
127.用于实施方案126的用途的HDL治疗剂,其中所述ABCG1截留量为40%-60%。
128.用于实施方案127的用途的HDL治疗剂,其中所述ABCA1截留量为50%。
129.用于实施方案122至128中任一项的用途的HDL治疗剂,其中在施用后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时测量ABCG1表达水平。
130.用于实施方案94至129中任一项的用途的HDL治疗剂,其中至少一种HDL标志物是SREBP-1。
131.用于实施方案130的用途的HDL治疗剂,其中测量SREBP-1mRNA表达水平。
132.用于实施方案130的用途的HDL治疗剂,其中测量SREBP-1蛋白表达水平。
133.用于实施方案130至132中任一项的用途的HDL治疗剂,其中所述SREBP-1截留量为20%-80%。
134.用于实施方案133的用途的HDL治疗剂,其中所述SREBP-1截留量为30%-70%。
135.用于实施方案134的用途的HDL治疗剂,其中所述SREBP-1截留量为40%-60%。
136.用于实施方案135的用途的HDL治疗剂,其中所述SREBP-1截留量为50%。
137.用于实施方案130至136中任一项的用途的HDL治疗剂,其中在施用后2-12小时,4-10小时,2-8小时,2-6小时,4-6小时或4-8小时测量SREBP-1表达水平。
138.用于实施方案94至137中任一项的用途的HDL治疗剂,其中所述HDL治疗剂是脂蛋白复合物。
139.用于实施方案138的用途的HDL治疗剂,其中所述脂蛋白复合物包含载脂蛋白。
140.用于实施方案139的用途的HDL治疗剂,其中所述载脂蛋白是ApoA-I,ApoA-II,ApoA-IV,ApoE或其组合。
141.用于实施方案138的用途的HDL治疗剂,其中所述脂蛋白复合物包含载脂蛋白肽模拟物。
142.用于实施方案141的用途的HDL治疗剂,其中所述肽模拟物是ApoA-I,ApoA-II,ApoA-IV或ApoE肽模拟物或其组合。
143.用于实施方案138的用途的HDL治疗剂,其中所述脂蛋白复合物是CER-001,CSL-111,CSL-112或ETC-216。
144.用于实施方案94至137中任一项的用途的HDL治疗剂,其中所述HDL治疗剂是小分子。
145.用于实施方案144的用途的HDL治疗剂,其中所述小分子是CETP抑制剂。
146.用于实施方案144的用途的HDL治疗剂,其中所述小分子是泛酸衍生物。
147.用于实施方案94至138中任一项的用途的HDL治疗剂,其还包括确定截留量。
148.用于实施方案147的用途的HDL治疗剂,其中通过产生针对HDL治疗剂的剂量反应曲线来确定所述截留量。
149.用于实施方案148的用途的HDL治疗剂,其中所述截留量为导致所述剂量反应曲线中的拐点的剂量的25%-75%。
150.用于实施方案149的用途的HDL治疗剂,其中所述截留量为导致所述剂量反应曲线中的拐点的剂量的40%-60%。
151.用于实施方案94至150中任一项的用途的HDL治疗剂,其中所述受试者或受试者群体具有ABCA1缺陷。
152.用于实施方案151的用途的HDL治疗剂,其中所述受试者或受试者群体对于ABCA1突变是纯合的。
153.用于实施方案151的用途的HDL治疗剂,其中所述受试者或受试者群体对于ABCA1突变是杂合的。
154.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的剂量的方法中的用途,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者,(b)在每个剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平;和(c)鉴定不使所述一种或多种HDL标志物的表达水平降低超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
155.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的剂量的方法中的用途,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)在每个剂量后,测量在所述受试者的循环单核细胞,巨噬细胞或单核细胞中一种或多种HDL标志物的表达水平;和(c)鉴定不使所述一种或多种HDL标志物的表达水平在所述受试者中增加超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
156.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的剂量的方法中的用途,该方法包括:鉴定不使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最高剂量。
157.用于实施方案156的用途的HDL治疗剂,其包括:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定在所述受试者中不使胆固醇流出降低超过50%至100%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
158.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的给药间隔的方法中的用途,该方法包括:鉴定不使细胞胆固醇流出降低超过0%,超过10%或超过20%的HDL治疗剂的最频繁的给药日程表的最高剂量。
159.用于实施方案158的用途的HDL治疗剂,其包括:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定在所述受试者中不使细胞胆固醇流出降低超过50%至100%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
160.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的剂量的方法中的用途,该方法包括:(a)施用HDL治疗剂的一个或多个剂量至受试者群体,(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不使所述受试者中细胞胆固醇流出降低超过0%,超过10%或超过20%的最大剂量,从而鉴定适合于疗法的HDL治疗剂的剂量。
161.HDL治疗剂,其用于在鉴定适合于疗法的HDL治疗剂的给药间隔的方法中的用途,该方法包括通过以下步骤鉴定HDL治疗剂的最频繁的给药日程表的最高剂量:(a)根据一个或多个给药频率施用HDL治疗剂至受试者或受试者群体;(b)测量来自所述受试者或受试者群体的细胞中的胆固醇流出;和(c)鉴定不使所述受试者中的胆固醇流出降低超过0%,超过10%或超过20%的最大给药频率,从而鉴定适合于疗法的HDL治疗剂的剂量。
162.用于实施方案161的用途的HDL治疗剂,其中一个或多个给药频率包括选自以下的一个或多个给药频率:
(a)每2天以1-4小时输注施用;
(b)每3天以1-4小时输注施用;
(c)每周日(every week days)以24小时输注施用;和
(d)每两周以24小时输注施用。
163.用于实施方案156至162中任一项的用途的HDL治疗剂,其中在来自所述受试者或受试者群体的单核细胞,巨噬细胞或单核细胞中测量所述胆固醇流出。
164.HDL治疗剂,其用于在治疗具有ABCA1缺陷的受试者的方法中的用途,该方法包括对所述受试者施用治疗有效量的HDL治疗剂。
165.用于实施方案164的用途的HDL治疗剂,其中所述HDL治疗剂是CER-001。
166.用于实施方案164或165的用途的HDL治疗剂,其中所述受试者对于ABCA1突变是杂合的。
167.用于实施方案164或165的用途的HDL治疗剂,其中所述受试者对于ABCA1突变是纯合的。
168.HDL治疗剂,其用于在治疗患家族原发性低α-脂蛋白血症(familial primary hypoalphalipoproteinemia)的受试者的方法,该方法包括:
(a)根据诱导方案对所述受试者施用所述HDL治疗剂;和,随后
(b)根据维持方案对所述受试者施用所述HDL治疗剂。
169.用于实施方案168的用途的HDL治疗剂,其中所述维持方案需要以较低剂量,较低频率或两者施用所述HDL治疗剂。
170.用于实施方案168或实施方案169的用途的HDL治疗剂,其中所述受试者对于ABCA1突变是杂合的。
171.用于实施方案168或实施方案169的用途的HDL治疗剂,其中所述受试者对于ABCA1突变是纯合的。
172.用于实施方案168-171中任一项的用途的HDL治疗剂,其中所述受试者对于LCAT突变是纯合的或杂合的。
173.用于实施方案168-172中任一项的用途的HDL治疗剂,其中所述受试者对于ApoA-I突变是纯合的或杂合的。
174.用于实施方案168-173中任一项的用途的HDL治疗剂,其中所述受试者对于ABCG1突变是纯合的或杂合的。
175.用于实施方案168-174中任一项的用途的HDL治疗剂,其中也用脂质控制药物治疗所述受试者。
176.用于实施方案175的用途的HDL治疗剂,其中所述脂质控制药物是阿托伐他汀(atorvastatin),依泽替米贝,烟酸,罗舒伐他汀(rosuvastatin),辛伐他汀(simvatatin),阿司匹林,氟伐他汀(fluvastatin),洛伐他汀(lovastatin),普伐他汀(paravastatin)或它们的组合。
177.用于实施方案168-176中任一项的用途的HDL治疗剂,其中所述HDL治疗剂是CER-001。
178.用于实施方案177的用途的HDL治疗剂,其中所述诱导方案的持续时间是4周。
179.用于实施方案177或实施方案178的用途的HDL治疗剂,其中所述诱导方案包括一周施用CER-001三次。
180.用于实施方案177-179中任一项的用途的HDL治疗剂,其中在所述诱导方案中施用的剂量为8-15mg/kg(基于蛋白质重量)。
181.用于实施方案180的用途的HDL治疗剂,其中在所述诱导方案中施用的所述剂量是8mg/kg,12mg/kg或15mg/kg。
182.用于实施方案177-181中任一项的用途的HDL治疗剂,其中所述维持方案包括施用HDL治疗剂达至少一个月,至少两个月,至少三个月,至少六个月,至少一年,至少18个月,至少两年,或无限期。
183.用于实施方案177-182中任一项的用途的HDL治疗剂,其中所述维持方案包括一周施用CER-001两次。
184.用于实施方案177-183中任一项的用途的HDL治疗剂,其中在所述维持方案中施用的所述剂量为1-6mg/kg(基于蛋白质重量)。
185.用于实施方案184的用途的HDL治疗剂,其中在所述维持方案中施用的剂量是1mg/kg,3mg/kg或6mg/kg。
186.用于实施方案168-185中任一项的用途的HDL治疗剂,其中,
(a)所述诱导方案利用与所述受试者的基线量和/或群体平均值相比,使一种或多种HDL标志物的表达水平降低20%-80%或40%-60%的剂量;和/或
(b)所述维持方案利用与受试者的基线量和/或群体平均值相比,不使一种或多种HDL标志物的表达水平降低超过20%或超过10%的剂量。
187.用于实施方案186的用途的HDL治疗剂,其中所述维持方案利用不降低一种或多种HDL标志物的表达水平的剂量。
虽然已经解释和描述了各种具体实施例,但是应当理解,在不脱离本公开的精神和范围的情况下可以进行各种改变。
通过引用并入
在本申请中引用的所有出版物,专利,专利申请和其他文件通过引用整体并入本文以用于所有目的,并入的程度如同单独指示将每个单独的出版物,专利,专利申请或其他文献通过引用并入以用于所有目的。
已经包括在本说明书中的对文档,行为,材料,设备,文章等的任何讨论仅仅是为了提供本公开的上下文的目的。仅因为它们在本申请的优先权日之前的任何地方存在,而不应被视为承认任何或所有这些事项形成现有技术基础的一部分或者是与本公开相关的领域中的公知常识。
序列表
<110> 塞勒尼斯医疗控股公司
<120> HDL治疗标志物
<130> CRN-016WO
<140>
<141>
<150> 61/988,095
<151> 2014-05-02
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 267
<212> PRT
<213> 人类
<400> 1
Met Lys Ala Ala Val Leu Thr Leu Ala Val Leu Phe Leu Thr Gly Ser
1 5 10 15
Gln Ala Arg His Phe Trp Gln Gln Asp Glu Pro Pro Gln Ser Pro Trp
20 25 30
Asp Arg Val Lys Asp Leu Ala Thr Val Tyr Val Asp Val Leu Lys Asp
35 40 45
Ser Gly Arg Asp Tyr Val Ser Gln Phe Glu Gly Ser Ala Leu Gly Lys
50 55 60
Gln Leu Asn Leu Lys Leu Leu Asp Asn Trp Asp Ser Val Thr Ser Thr
65 70 75 80
Phe Ser Lys Leu Arg Glu Gln Leu Gly Pro Val Thr Gln Glu Phe Trp
85 90 95
Asp Asn Leu Glu Lys Glu Thr Glu Gly Leu Arg Gln Glu Met Ser Lys
100 105 110
Asp Leu Glu Glu Val Lys Ala Lys Val Gln Pro Tyr Leu Asp Asp Phe
115 120 125
Gln Lys Lys Trp Gln Glu Glu Met Glu Leu Tyr Arg Gln Lys Val Glu
130 135 140
Pro Leu Arg Ala Glu Leu Gln Glu Gly Ala Arg Gln Lys Leu His Glu
145 150 155 160
Leu Gln Glu Lys Leu Ser Pro Leu Gly Glu Glu Met Arg Asp Arg Ala
165 170 175
Arg Ala His Val Asp Ala Leu Arg Thr His Leu Ala Pro Tyr Ser Asp
180 185 190
Glu Leu Arg Gln Arg Leu Ala Ala Arg Leu Glu Ala Leu Lys Glu Asn
195 200 205
Gly Gly Ala Arg Leu Ala Glu Tyr His Ala Lys Ala Thr Glu His Leu
210 215 220
Ser Thr Leu Ser Glu Lys Ala Lys Pro Ala Leu Glu Asp Leu Arg Gln
225 230 235 240
Gly Leu Leu Pro Val Leu Glu Ser Phe Lys Val Ser Phe Leu Ser Ala
245 250 255
Leu Glu Glu Tyr Thr Lys Lys Leu Asn Thr Gln
260 265
<210> 2
<211> 6786
<212> DNA
<213> 人类
<400> 2
atggcttgtt ggcctcagct gaggttgctg ctgtggaaga acctcacttt cagaagaaga 60
caaacatgtc agctgctgct ggaagtggcc tggcctctat ttatcttcct gatcctgatc 120
tctgttcggc tgagctaccc accctatgaa caacatgaat gccattttcc aaataaagcc 180
atgccctctg caggaacact tccttgggtt caggggatta tctgtaatgc caacaacccc 240
tgtttccgtt acccgactcc tggggaggct cccggagttg ttggaaactt taacaaatcc 300
attgtggctc gcctgttctc agatgctcgg aggcttcttt tatacagcca gaaagacacc 360
agcatgaagg acatgcgcaa agttctgaga acattacagc agatcaagaa atccagctca 420
aacttgaagc ttcaagattt cctggtggac aatgaaacct tctctgggtt cctgtatcac 480
aacctctctc tcccaaagtc tactgtggac aagatgctga gggctgatgt cattctccac 540
aaggtatttt tgcaaggcta ccagttacat ttgacaagtc tgtgcaatgg atcaaaatca 600
gaagagatga ttcaacttgg tgaccaagaa gtttctgagc tttgtggcct accaagggag 660
aaactggctg cagcagagcg agtacttcgt tccaacatgg acatcctgaa gccaatcctg 720
agaacactaa actctacatc tcccttcccg agcaaggagc tggctgaagc cacaaaaaca 780
ttgctgcata gtcttgggac tctggcccag gagctgttca gcatgagaag ctggagtgac 840
atgcgacagg aggtgatgtt tctgaccaat gtgaacagct ccagctcctc cacccaaatc 900
taccaggctg tgtctcgtat tgtctgcggg catcccgagg gaggggggct gaagatcaag 960
tctctcaact ggtatgagga caacaactac aaagccctct ttggaggcaa tggcactgag 1020
gaagatgctg aaaccttcta tgacaactct acaactcctt actgcaatga tttgatgaag 1080
aatttggagt ctagtcctct ttcccgcatt atctggaaag ctctgaagcc gctgctcgtt 1140
gggaagatcc tgtatacacc tgacactcca gccacaaggc aggtcatggc tgaggtgaac 1200
aagaccttcc aggaactggc tgtgttccat gatctggaag gcatgtggga ggaactcagc 1260
cccaagatct ggaccttcat ggagaacagc caagaaatgg accttgtccg gatgctgttg 1320
gacagcaggg acaatgacca cttttgggaa cagcagttgg atggcttaga ttggacagcc 1380
caagacatcg tggcgttttt ggccaagcac ccagaggatg tccagtccag taatggttct 1440
gtgtacacct ggagagaagc tttcaacgag actaaccagg caatccggac catatctcgc 1500
ttcatggagt gtgtcaacct gaacaagcta gaacccatag caacagaagt ctggctcatc 1560
aacaagtcca tggagctgct ggatgagagg aagttctggg ctggtattgt gttcactgga 1620
attactccag gcagcattga gctgccccat catgtcaagt acaagatccg aatggacatt 1680
gacaatgtgg agaggacaaa taaaatcaag gatgggtact gggaccctgg tcctcgagct 1740
gacccctttg aggacatgcg gtacgtctgg gggggcttcg cctacttgca ggatgtggtg 1800
gagcaggcaa tcatcagggt gctgacgggc accgagaaga aaactggtgt ctatatgcaa 1860
cagatgccct atccctgtta cgttgatgac atctttctgc gggtgatgag ccggtcaatg 1920
cccctcttca tgacgctggc ctggatttac tcagtggctg tgatcatcaa gggcatcgtg 1980
tatgagaagg aggcacggct gaaagagacc atgcggatca tgggcctgga caacagcatc 2040
ctctggttta gctggttcat tagtagcctc attcctcttc ttgtgagcgc tggcctgcta 2100
gtggtcatcc tgaagttagg aaacctgctg ccctacagtg atcccagcgt ggtgtttgtc 2160
ttcctgtccg tgtttgctgt ggtgacaatc ctgcagtgct tcctgattag cacactcttc 2220
tccagagcca acctggcagc agcctgtggg ggcatcatct acttcacgct gtacctgccc 2280
tacgtcctgt gtgtggcatg gcaggactac gtgggcttca cactcaagat cttcgctagc 2340
ctgctgtctc ctgtggcttt tgggtttggc tgtgagtact ttgccctttt tgaggagcag 2400
ggcattggag tgcagtggga caacctgttt gagagtcctg tggaggaaga tggcttcaat 2460
ctcaccactt cggtctccat gatgctgttt gacaccttcc tctatggggt gatgacctgg 2520
tacattgagg ctgtctttcc aggccagtac ggaattccca ggccctggta ttttccttgc 2580
accaagtcct actggtttgg cgaggaaagt gatgagaaga gccaccctgg ttccaaccag 2640
aagagaatat cagaaatctg catggaggag gaacccaccc acttgaagct gggcgtgtcc 2700
attcagaacc tggtaaaagt ctaccgagat gggatgaagg tggctgtcga tggcctggca 2760
ctgaattttt atgagggcca gatcacctcc ttcctgggcc acaatggagc ggggaagacg 2820
accaccatgt caatcctgac cgggttgttc cccccgacct cgggcaccgc ctacatcctg 2880
ggaaaagaca ttcgctctga gatgagcacc atccggcaga acctgggggt ctgtccccag 2940
cataacgtgc tgtttgacat gctgactgtc gaagaacaca tctggttcta tgcccgcttg 3000
aaagggctct ctgagaagca cgtgaaggcg gagatggagc agatggccct ggatgttggt 3060
ttgccatcaa gcaagctgaa aagcaaaaca agccagctgt caggtggaat gcagagaaag 3120
ctatctgtgg ccttggcctt tgtcggggga tctaaggttg tcattctgga tgaacccaca 3180
gctggtgtgg acccttactc ccgcagggga atatgggagc tgctgctgaa ataccgacaa 3240
ggccgcacca ttattctctc tacacaccac atggatgaag cggacgtcct gggggacagg 3300
attgccatca tctcccatgg gaagctgtgc tgtgtgggct cctccctgtt tctgaagaac 3360
cagctgggaa caggctacta cctgaccttg gtcaagaaag atgtggaatc ctccctcagt 3420
tcctgcagaa acagtagtag cactgtgtca tacctgaaaa aggaggacag tgtttctcag 3480
agcagttctg atgctggcct gggcagcgac catgagagtg acacgctgac catcgatgtc 3540
tctgctatct ccaacctcat caggaagcat gtgtctgaag cccggctggt ggaagacata 3600
gggcatgagc tgacctatgt gctgccatat gaagctgcta aggagggagc ctttgtggaa 3660
ctctttcatg agattgatga ccggctctca gacctgggca tttctagtta tggcatctca 3720
gagacgaccc tggaagaaat attcctcaag gtggccgaag agagtggggt ggatgctgag 3780
acctcagatg gtaccttgcc agcaagacga aacaggcggg ccttcgggga caagcagagc 3840
tgtcttcgcc cgttcactga agatgatgct gctgatccaa atgattctga catagaccca 3900
gaatccagag agacagactt gctcagtggg atggatggca aagggtccta ccaggtgaaa 3960
ggctggaaac ttacacagca acagtttgtg gcccttttgt ggaagagact gctaattgcc 4020
agacggagtc ggaaaggatt ttttgctcag attgtcttgc cagctgtgtt tgtctgcatt 4080
gcccttgtgt tcagcctgat cgtgccaccc tttggcaagt accccagcct ggaacttcag 4140
ccctggatgt acaacgaaca gtacacattt gtcagcaatg atgctcctga ggacacggga 4200
accctggaac tcttaaacgc cctcaccaaa gaccctggct tcgggacccg ctgtatggaa 4260
ggaaacccaa tcccagacac gccctgccag gcaggggagg aagagtggac cactgcccca 4320
gttccccaga ccatcatgga cctcttccag aatgggaact ggacaatgca gaacccttca 4380
cctgcatgcc agtgtagcag cgacaaaatc aagaagatgc tgcctgtgtg tcccccaggg 4440
gcaggggggc tgcctcctcc acaaagaaaa caaaacactg cagatatcct tcaggacctg 4500
acaggaagaa acatttcgga ttatctggtg aagacgtatg tgcagatcat agccaaaagc 4560
ttaaagaaca agatctgggt gaatgagttt aggtatggcg gcttttccct gggtgtcagt 4620
aatactcaag cacttcctcc gagtcaagaa gttaatgatg ccatcaaaca aatgaagaaa 4680
cacctaaagc tggccaagga cagttctgca gatcgatttc tcaacagctt gggaagattt 4740
atgacaggac tggacaccaa aaataatgtc aaggtgtggt tcaataacaa gggctggcat 4800
gcaatcagct ctttcctgaa tgtcatcaac aatgccattc tccgggccaa cctgcaaaag 4860
ggagagaacc ctagccatta tggaattact gctttcaatc atcccctgaa tctcaccaag 4920
cagcagctct cagaggtggc tctgatgacc acatcagtgg atgtccttgt gtccatctgt 4980
gtcatctttg caatgtcctt cgtcccagcc agctttgtcg tattcctgat ccaggagcgg 5040
gtcagcaaag caaaacacct gcagttcatc agtggagtga agcctgtcat ctactggctc 5100
tctaattttg tctgggatat gtgcaattac gttgtccctg ccacactggt cattatcatc 5160
ttcatctgct tccagcagaa gtcctatgtg tcctccacca atctgcctgt gctagccctt 5220
ctacttttgc tgtatgggtg gtcaatcaca cctctcatgt acccagcctc ctttgtgttc 5280
aagatcccca gcacagccta tgtggtgctc accagcgtga acctcttcat tggcattaat 5340
ggcagcgtgg ccacctttgt gctggagctg ttcaccgaca ataagctgaa taatatcaat 5400
gatatcctga agtccgtgtt cttgatcttc ccacattttt gcctgggacg agggctcatc 5460
gacatggtga aaaaccaggc aatggctgat gccctggaaa ggtttgggga gaatcgcttt 5520
gtgtcaccat tatcttggga cttggtggga cgaaacctct tcgccatggc cgtggaaggg 5580
gtggtgttct tcctcattac tgttctgatc cagtacagat tcttcatcag gcccagacct 5640
gtaaatgcaa agctatctcc tctgaatgat gaagatgaag atgtgaggcg ggaaagacag 5700
agaattcttg atggtggagg ccagaatgac atcttagaaa tcaaggagtt gacgaagata 5760
tatagaagga agcggaagcc tgctgttgac aggatttgcg tgggcattcc tcctggtgag 5820
tgctttgggc tcctgggagt taatggggct ggaaaatcat caactttcaa gatgttaaca 5880
ggagatacca ctgttaccag aggagatgct ttccttaaca aaaatagtat cttatcaaac 5940
atccatgaag tacatcagaa catgggctac tgccctcagt ttgatgccat cacagagctg 6000
ttgactggga gagaacacgt ggagttcttt gcccttttga gaggagtccc agagaaagaa 6060
gttggcaagg ttggtgagtg ggcgattcgg aaactgggcc tcgtgaagta tggagaaaaa 6120
tatgctggta actatagtgg aggcaacaaa cgcaagctct ctacagccat ggctttgatc 6180
ggcgggcctc ctgtggtgtt tctggatgaa cccaccacag gcatggatcc caaagcccgg 6240
cggttcttgt ggaattgtgc cctaagtgtt gtcaaggagg ggagatcagt agtgcttaca 6300
tctcatagta tggaagagtg tgaagctctt tgcactagga tggcaatcat ggtcaatgga 6360
aggttcaggt gccttggcag tgtccagcat ctaaaaaata ggtttggaga tggttataca 6420
atagttgtac gaatagcagg gtccaacccg gacctgaagc ctgtccagga tttctttgga 6480
cttgcatttc ctggaagtgt tctaaaagag aaacaccgga acatgctaca ataccagctt 6540
ccatcttcat tatcttctct ggccaggata ttcagcatcc tctcccagag caaaaagcga 6600
ctccacatag aagactactc tgtttctcag acaacacttg accaagtatt tgtgaacttt 6660
gccaaggacc aaagtgatga tgaccactta aaagacctct cattacacaa aaaccagaca 6720
gtagtggacg ttgcagttct cacatctttt ctacaggatg agaaagtgaa agaaagctat 6780
gtatga 6786
<210> 3
<211> 2261
<212> PRT
<213> 人类
<220>
<221> MOD_RES
<222> (780)..(780)
<223> 任意氨基酸
<220>
<221> MOD_RES
<222> (1555)..(1555)
<223> 任意氨基酸
<220>
<221> MOD_RES
<222> (1648)..(1648)
<223> 任意氨基酸
<220>
<221> MOD_RES
<222> (1974)..(1974)
<223> 任意氨基酸
<220>
<221> MOD_RES
<222> (2168)..(2168)
<223> 任意氨基酸
<400> 3
Met Ala Cys Trp Pro Gln Leu Arg Leu Leu Leu Trp Lys Asn Leu Thr
1 5 10 15
Phe Arg Arg Arg Gln Thr Cys Gln Leu Leu Leu Glu Val Ala Trp Pro
20 25 30
Leu Phe Ile Phe Leu Ile Leu Ile Ser Val Arg Leu Ser Tyr Pro Pro
35 40 45
Tyr Glu Gln His Glu Cys His Phe Pro Asn Lys Ala Met Pro Ser Ala
50 55 60
Gly Thr Leu Pro Trp Val Gln Gly Ile Ile Cys Asn Ala Asn Asn Pro
65 70 75 80
Cys Phe Arg Tyr Pro Thr Pro Gly Glu Ala Pro Gly Val Val Gly Asn
85 90 95
Phe Asn Lys Ser Ile Val Ala Arg Leu Phe Ser Asp Ala Arg Arg Leu
100 105 110
Leu Leu Tyr Ser Gln Lys Asp Thr Ser Met Lys Asp Met Arg Lys Val
115 120 125
Leu Arg Thr Leu Gln Gln Ile Lys Lys Ser Ser Ser Asn Leu Lys Leu
130 135 140
Gln Asp Phe Leu Val Asp Asn Glu Thr Phe Ser Gly Phe Leu Tyr His
145 150 155 160
Asn Leu Ser Leu Pro Lys Ser Thr Val Asp Lys Met Leu Arg Ala Asp
165 170 175
Val Ile Leu His Lys Val Phe Leu Gln Gly Tyr Gln Leu His Leu Thr
180 185 190
Ser Leu Cys Asn Gly Ser Lys Ser Glu Glu Met Ile Gln Leu Gly Asp
195 200 205
Gln Glu Val Ser Glu Leu Cys Gly Leu Pro Arg Glu Lys Leu Ala Ala
210 215 220
Ala Glu Arg Val Leu Arg Ser Asn Met Asp Ile Leu Lys Pro Ile Leu
225 230 235 240
Arg Thr Leu Asn Ser Thr Ser Pro Phe Pro Ser Lys Glu Leu Ala Glu
245 250 255
Ala Thr Lys Thr Leu Leu His Ser Leu Gly Thr Leu Ala Gln Glu Leu
260 265 270
Phe Ser Met Arg Ser Trp Ser Asp Met Arg Gln Glu Val Met Phe Leu
275 280 285
Thr Asn Val Asn Ser Ser Ser Ser Ser Thr Gln Ile Tyr Gln Ala Val
290 295 300
Ser Arg Ile Val Cys Gly His Pro Glu Gly Gly Gly Leu Lys Ile Lys
305 310 315 320
Ser Leu Asn Trp Tyr Glu Asp Asn Asn Tyr Lys Ala Leu Phe Gly Gly
325 330 335
Asn Gly Thr Glu Glu Asp Ala Glu Thr Phe Tyr Asp Asn Ser Thr Thr
340 345 350
Pro Tyr Cys Asn Asp Leu Met Lys Asn Leu Glu Ser Ser Pro Leu Ser
355 360 365
Arg Ile Ile Trp Lys Ala Leu Lys Pro Leu Leu Val Gly Lys Ile Leu
370 375 380
Tyr Thr Pro Asp Thr Pro Ala Thr Arg Gln Val Met Ala Glu Val Asn
385 390 395 400
Lys Thr Phe Gln Glu Leu Ala Val Phe His Asp Leu Glu Gly Met Trp
405 410 415
Glu Glu Leu Ser Pro Lys Ile Trp Thr Phe Met Glu Asn Ser Gln Glu
420 425 430
Met Asp Leu Val Arg Met Leu Leu Asp Ser Arg Asp Asn Asp His Phe
435 440 445
Trp Glu Gln Gln Leu Asp Gly Leu Asp Trp Thr Ala Gln Asp Ile Val
450 455 460
Ala Phe Leu Ala Lys His Pro Glu Asp Val Gln Ser Ser Asn Gly Ser
465 470 475 480
Val Tyr Thr Trp Arg Glu Ala Phe Asn Glu Thr Asn Gln Ala Ile Arg
485 490 495
Thr Ile Ser Arg Phe Met Glu Cys Val Asn Leu Asn Lys Leu Glu Pro
500 505 510
Ile Ala Thr Glu Val Trp Leu Ile Asn Lys Ser Met Glu Leu Leu Asp
515 520 525
Glu Arg Lys Phe Trp Ala Gly Ile Val Phe Thr Gly Ile Thr Pro Gly
530 535 540
Ser Ile Glu Leu Pro His His Val Lys Tyr Lys Ile Arg Met Asp Ile
545 550 555 560
Asp Asn Val Glu Arg Thr Asn Lys Ile Lys Asp Gly Tyr Trp Asp Pro
565 570 575
Gly Pro Arg Ala Asp Pro Phe Glu Asp Met Arg Tyr Val Trp Gly Gly
580 585 590
Phe Ala Tyr Leu Gln Asp Val Val Glu Gln Ala Ile Ile Arg Val Leu
595 600 605
Thr Gly Thr Glu Lys Lys Thr Gly Val Tyr Met Gln Gln Met Pro Tyr
610 615 620
Pro Cys Tyr Val Asp Asp Ile Phe Leu Arg Val Met Ser Arg Ser Met
625 630 635 640
Pro Leu Phe Met Thr Leu Ala Trp Ile Tyr Ser Val Ala Val Ile Ile
645 650 655
Lys Gly Ile Val Tyr Glu Lys Glu Ala Arg Leu Lys Glu Thr Met Arg
660 665 670
Ile Met Gly Leu Asp Asn Ser Ile Leu Trp Phe Ser Trp Phe Ile Ser
675 680 685
Ser Leu Ile Pro Leu Leu Val Ser Ala Gly Leu Leu Val Val Ile Leu
690 695 700
Lys Leu Gly Asn Leu Leu Pro Tyr Ser Asp Pro Ser Val Val Phe Val
705 710 715 720
Phe Leu Ser Val Phe Ala Val Val Thr Ile Leu Gln Cys Phe Leu Ile
725 730 735
Ser Thr Leu Phe Ser Arg Ala Asn Leu Ala Ala Ala Cys Gly Gly Ile
740 745 750
Ile Tyr Phe Thr Leu Tyr Leu Pro Tyr Val Leu Cys Val Ala Trp Gln
755 760 765
Asp Tyr Val Gly Phe Thr Leu Lys Ile Phe Ala Xaa Leu Leu Ser Pro
770 775 780
Val Ala Phe Gly Phe Gly Cys Glu Tyr Phe Ala Leu Phe Glu Glu Gln
785 790 795 800
Gly Ile Gly Val Gln Trp Asp Asn Leu Phe Glu Ser Pro Val Glu Glu
805 810 815
Asp Gly Phe Asn Leu Thr Thr Ser Val Ser Met Met Leu Phe Asp Thr
820 825 830
Phe Leu Tyr Gly Val Met Thr Trp Tyr Ile Glu Ala Val Phe Pro Gly
835 840 845
Gln Tyr Gly Ile Pro Arg Pro Trp Tyr Phe Pro Cys Thr Lys Ser Tyr
850 855 860
Trp Phe Gly Glu Glu Ser Asp Glu Lys Ser His Pro Gly Ser Asn Gln
865 870 875 880
Lys Arg Ile Ser Glu Ile Cys Met Glu Glu Glu Pro Thr His Leu Lys
885 890 895
Leu Gly Val Ser Ile Gln Asn Leu Val Lys Val Tyr Arg Asp Gly Met
900 905 910
Lys Val Ala Val Asp Gly Leu Ala Leu Asn Phe Tyr Glu Gly Gln Ile
915 920 925
Thr Ser Phe Leu Gly His Asn Gly Ala Gly Lys Thr Thr Thr Met Ser
930 935 940
Ile Leu Thr Gly Leu Phe Pro Pro Thr Ser Gly Thr Ala Tyr Ile Leu
945 950 955 960
Gly Lys Asp Ile Arg Ser Glu Met Ser Thr Ile Arg Gln Asn Leu Gly
965 970 975
Val Cys Pro Gln His Asn Val Leu Phe Asp Met Leu Thr Val Glu Glu
980 985 990
His Ile Trp Phe Tyr Ala Arg Leu Lys Gly Leu Ser Glu Lys His Val
995 1000 1005
Lys Ala Glu Met Glu Gln Met Ala Leu Asp Val Gly Leu Pro Ser
1010 1015 1020
Ser Lys Leu Lys Ser Lys Thr Ser Gln Leu Ser Gly Gly Met Gln
1025 1030 1035
Arg Lys Leu Ser Val Ala Leu Ala Phe Val Gly Gly Ser Lys Val
1040 1045 1050
Val Ile Leu Asp Glu Pro Thr Ala Gly Val Asp Pro Tyr Ser Arg
1055 1060 1065
Arg Gly Ile Trp Glu Leu Leu Leu Lys Tyr Arg Gln Gly Arg Thr
1070 1075 1080
Ile Ile Leu Ser Thr His His Met Asp Glu Ala Asp Val Leu Gly
1085 1090 1095
Asp Arg Ile Ala Ile Ile Ser His Gly Lys Leu Cys Cys Val Gly
1100 1105 1110
Ser Ser Leu Phe Leu Lys Asn Gln Leu Gly Thr Gly Tyr Tyr Leu
1115 1120 1125
Thr Leu Val Lys Lys Asp Val Glu Ser Ser Leu Ser Ser Cys Arg
1130 1135 1140
Asn Ser Ser Ser Thr Val Ser Tyr Leu Lys Lys Glu Asp Ser Val
1145 1150 1155
Ser Gln Ser Ser Ser Asp Ala Gly Leu Gly Ser Asp His Glu Ser
1160 1165 1170
Asp Thr Leu Thr Ile Asp Val Ser Ala Ile Ser Asn Leu Ile Arg
1175 1180 1185
Lys His Val Ser Glu Ala Arg Leu Val Glu Asp Ile Gly His Glu
1190 1195 1200
Leu Thr Tyr Val Leu Pro Tyr Glu Ala Ala Lys Glu Gly Ala Phe
1205 1210 1215
Val Glu Leu Phe His Glu Ile Asp Asp Arg Leu Ser Asp Leu Gly
1220 1225 1230
Ile Ser Ser Tyr Gly Ile Ser Glu Thr Thr Leu Glu Glu Ile Phe
1235 1240 1245
Leu Lys Val Ala Glu Glu Ser Gly Val Asp Ala Glu Thr Ser Asp
1250 1255 1260
Gly Thr Leu Pro Ala Arg Arg Asn Arg Arg Ala Phe Gly Asp Lys
1265 1270 1275
Gln Ser Cys Leu Arg Pro Phe Thr Glu Asp Asp Ala Ala Asp Pro
1280 1285 1290
Asn Asp Ser Asp Ile Asp Pro Glu Ser Arg Glu Thr Asp Leu Leu
1295 1300 1305
Ser Gly Met Asp Gly Lys Gly Ser Tyr Gln Val Lys Gly Trp Lys
1310 1315 1320
Leu Thr Gln Gln Gln Phe Val Ala Leu Leu Trp Lys Arg Leu Leu
1325 1330 1335
Ile Ala Arg Arg Ser Arg Lys Gly Phe Phe Ala Gln Ile Val Leu
1340 1345 1350
Pro Ala Val Phe Val Cys Ile Ala Leu Val Phe Ser Leu Ile Val
1355 1360 1365
Pro Pro Phe Gly Lys Tyr Pro Ser Leu Glu Leu Gln Pro Trp Met
1370 1375 1380
Tyr Asn Glu Gln Tyr Thr Phe Val Ser Asn Asp Ala Pro Glu Asp
1385 1390 1395
Thr Gly Thr Leu Glu Leu Leu Asn Ala Leu Thr Lys Asp Pro Gly
1400 1405 1410
Phe Gly Thr Arg Cys Met Glu Gly Asn Pro Ile Pro Asp Thr Pro
1415 1420 1425
Cys Gln Ala Gly Glu Glu Glu Trp Thr Thr Ala Pro Val Pro Gln
1430 1435 1440
Thr Ile Met Asp Leu Phe Gln Asn Gly Asn Trp Thr Met Gln Asn
1445 1450 1455
Pro Ser Pro Ala Cys Gln Cys Ser Ser Asp Lys Ile Lys Lys Met
1460 1465 1470
Leu Pro Val Cys Pro Pro Gly Ala Gly Gly Leu Pro Pro Pro Gln
1475 1480 1485
Arg Lys Gln Asn Thr Ala Asp Ile Leu Gln Asp Leu Thr Gly Arg
1490 1495 1500
Asn Ile Ser Asp Tyr Leu Val Lys Thr Tyr Val Gln Ile Ile Ala
1505 1510 1515
Lys Ser Leu Lys Asn Lys Ile Trp Val Asn Glu Phe Arg Tyr Gly
1520 1525 1530
Gly Phe Ser Leu Gly Val Ser Asn Thr Gln Ala Leu Pro Pro Ser
1535 1540 1545
Gln Glu Val Asn Asp Ala Xaa Lys Gln Met Lys Lys His Leu Lys
1550 1555 1560
Leu Ala Lys Asp Ser Ser Ala Asp Arg Phe Leu Asn Ser Leu Gly
1565 1570 1575
Arg Phe Met Thr Gly Leu Asp Thr Arg Asn Asn Val Lys Val Trp
1580 1585 1590
Phe Asn Asn Lys Gly Trp His Ala Ile Ser Ser Phe Leu Asn Val
1595 1600 1605
Ile Asn Asn Ala Ile Leu Arg Ala Asn Leu Gln Lys Gly Glu Asn
1610 1615 1620
Pro Ser His Tyr Gly Ile Thr Ala Phe Asn His Pro Leu Asn Leu
1625 1630 1635
Thr Lys Gln Gln Leu Ser Glu Val Ala Xaa Met Thr Thr Ser Val
1640 1645 1650
Asp Val Leu Val Ser Ile Cys Val Ile Phe Ala Met Ser Phe Val
1655 1660 1665
Pro Ala Ser Phe Val Val Phe Leu Ile Gln Glu Arg Val Ser Lys
1670 1675 1680
Ala Lys His Leu Gln Phe Ile Ser Gly Val Lys Pro Val Ile Tyr
1685 1690 1695
Trp Leu Ser Asn Phe Val Trp Asp Met Cys Asn Tyr Val Val Pro
1700 1705 1710
Ala Thr Leu Val Ile Ile Ile Phe Ile Cys Phe Gln Gln Lys Ser
1715 1720 1725
Tyr Val Ser Ser Thr Asn Leu Pro Val Leu Ala Leu Leu Leu Leu
1730 1735 1740
Leu Tyr Gly Trp Ser Ile Thr Pro Leu Met Tyr Pro Ala Ser Phe
1745 1750 1755
Val Phe Lys Ile Pro Ser Thr Ala Tyr Val Val Leu Thr Ser Val
1760 1765 1770
Asn Leu Phe Ile Gly Ile Asn Gly Ser Val Ala Thr Phe Val Leu
1775 1780 1785
Glu Leu Phe Thr Asp Asn Lys Leu Asn Asn Ile Asn Asp Ile Leu
1790 1795 1800
Lys Ser Val Phe Leu Ile Phe Pro His Phe Cys Leu Gly Arg Gly
1805 1810 1815
Leu Ile Asp Met Val Lys Asn Gln Ala Met Ala Asp Ala Leu Glu
1820 1825 1830
Arg Phe Gly Glu Asn Arg Phe Val Ser Pro Leu Ser Trp Asp Leu
1835 1840 1845
Val Gly Arg Asn Leu Phe Ala Met Ala Val Glu Gly Val Val Phe
1850 1855 1860
Phe Leu Ile Thr Val Leu Ile Gln Tyr Arg Phe Phe Ile Arg Pro
1865 1870 1875
Arg Pro Val Asn Ala Lys Leu Ser Pro Leu Asn Asp Glu Asp Glu
1880 1885 1890
Asp Val Arg Arg Glu Arg Gln Arg Ile Leu Asp Gly Gly Gly Gln
1895 1900 1905
Asn Asp Ile Leu Glu Ile Lys Glu Leu Thr Lys Ile Tyr Arg Arg
1910 1915 1920
Lys Arg Lys Pro Ala Val Asp Arg Ile Cys Val Gly Ile Pro Pro
1925 1930 1935
Gly Glu Cys Phe Gly Leu Leu Gly Val Asn Gly Ala Gly Lys Ser
1940 1945 1950
Ser Thr Phe Lys Met Leu Thr Gly Asp Thr Thr Val Thr Arg Gly
1955 1960 1965
Asp Ala Phe Leu Asn Xaa Asn Ser Ile Leu Ser Asn Ile His Glu
1970 1975 1980
Val His Gln Asn Met Gly Tyr Cys Pro Gln Phe Asp Ala Ile Thr
1985 1990 1995
Glu Leu Leu Thr Gly Arg Glu His Val Glu Phe Phe Ala Leu Leu
2000 2005 2010
Arg Gly Val Pro Glu Lys Glu Val Gly Lys Val Gly Glu Trp Ala
2015 2020 2025
Ile Arg Lys Leu Gly Leu Val Lys Tyr Gly Glu Lys Tyr Ala Gly
2030 2035 2040
Asn Tyr Ser Gly Gly Asn Lys Arg Lys Leu Ser Thr Ala Met Ala
2045 2050 2055
Leu Ile Gly Gly Pro Pro Val Val Phe Leu Asp Glu Pro Thr Thr
2060 2065 2070
Gly Met Asp Pro Lys Ala Arg Arg Phe Leu Trp Asn Cys Ala Leu
2075 2080 2085
Ser Val Val Lys Glu Gly Arg Ser Val Val Leu Thr Ser His Ser
2090 2095 2100
Met Glu Glu Cys Glu Ala Leu Cys Thr Arg Met Ala Ile Met Val
2105 2110 2115
Asn Gly Arg Phe Arg Cys Leu Gly Ser Val Gln His Leu Lys Asn
2120 2125 2130
Arg Phe Gly Asp Gly Tyr Thr Ile Val Val Arg Ile Ala Gly Ser
2135 2140 2145
Asn Pro Asp Leu Lys Pro Val Gln Asp Phe Phe Gly Leu Ala Phe
2150 2155 2160
Pro Gly Ser Val Xaa Lys Glu Lys His Arg Asn Met Leu Gln Tyr
2165 2170 2175
Gln Leu Pro Ser Ser Leu Ser Ser Leu Ala Arg Ile Phe Ser Ile
2180 2185 2190
Leu Ser Gln Ser Lys Lys Arg Leu His Ile Glu Asp Tyr Ser Val
2195 2200 2205
Ser Gln Thr Thr Leu Asp Gln Val Phe Val Asn Phe Ala Lys Asp
2210 2215 2220
Gln Ser Asp Asp Asp His Leu Lys Asp Leu Ser Leu His Lys Asn
2225 2230 2235
Gln Thr Val Val Asp Val Ala Val Leu Thr Ser Phe Leu Gln Asp
2240 2245 2250
Glu Lys Val Lys Glu Ser Tyr Val
2255 2260
<210> 4
<211> 2946
<212> DNA
<213> 人类
<400> 4
gctttataaa ggggagtttc cctgcacaag ctctctctct tgtctgccgc catgtgagac 60
atgcctttca ccttccgcca tgatcatgag gcttccccag ccacatggaa ctaatgccag 120
cagttactct gcagagatga cggagcccaa gtcggtgtgt gtctcggtgg atgaggtggt 180
gtccagcaac atggaggcca ctgagacgga cctgctgaat ggacatctga aaaaagtaga 240
taataacctc acggaagccc agcgcttctc ctccttgcct cggagggcag ctgtgaacat 300
tgaattcagg gacctttcct attcggttcc tgaaggaccc tggtggagga agaaaggata 360
caagaccctc ctgaaaggaa tttccgggaa gttcaatagt ggtgagttgg tggccattat 420
gggtccttcc ggggccggga agtccacgct gatgaacatc ctggctggat acagggagac 480
gggcatgaag ggggccgtcc tcatcaacgg cctgccccgg gacctgcgct gcttccggaa 540
ggtgtcctgc tacatcatgc aggatgacat gctgctgccg catctcactg tgcaggaggc 600
catgatggtg tcggcacatc tgaagcttca ggagaaggat gaaggcagaa gggaaatggt 660
caaggagata ctgacagcgc tgggcttgct gtcttgcgcc aacacgcgga ccgggagcct 720
gtcaggtggt cagcgcaagc gcctggccat cgcgctggag ctggtgaaca accctccagt 780
catgttcttc gatgagccca ccagcggcct ggacagcgcc tcctgcttcc aggtggtctc 840
gctgatgaaa gggctcgctc aagggggtcg ctccatcatt tgcaccatcc accagcccag 900
cgccaaactc ttcgagctgt tcgaccagct ttacgtcctg agtcaaggac aatgtgtgta 960
ccggggaaaa gtctgcaatc ttgtgccata tttgagggat ttgggtctga actgcccaac 1020
ctaccacaac ccagcagatt ttgtcatgga ggttgcatcc ggcgagtacg gtgatcagaa 1080
cagtcggctg gtgagagcgg ttcgggaggg catgtgtgac tcagaccaca agagagacct 1140
cgggggtgat gccgaggtga acccttttct ttggcaccgg ccctctgaag aggactcctc 1200
gtccatggaa ggctgccaca gcttctctgc cagctgcctc acgcagttct gcatcctctt 1260
caagaggacc ttcctcagca tcatgaggga ctcggtcctg acacacctgc gcatcacctc 1320
gcacattggg atcggcctcc tcattggcct gctgtacttg gggatcggga acgaagccaa 1380
gaaggtcttg agcaactccg gcttcctctt cttctccatg ctgttcctca tgttcgcggc 1440
cctcatgcct actgttctga catttcccct ggagatggga gtctttcttc gggaacacct 1500
gaactactgg tacagcctga aggcctacta cctggccaag accatggcag acgtgccctt 1560
tcagatcatg ttcccagtgg cctactgcag catcgtgtac tggatgacgt cgcagccgtc 1620
cgacgccgtg cgctttgtgc tgtttgccgc gctgggcacc atgacctccc tggtggcaca 1680
gtccctgggc ctgctgatcg gagccgcctc cacgtccctg caggtggcca ctttcgtggg 1740
cccagtgaca gccatcccgg tgctcctgtt ctcggggttc ttcgtcagct tcgacaccat 1800
ccccacgtac ctacagtgga tgtcctacat ctcctatgtc aggtatgggt tcgaaggggt 1860
catcctctcc atctatggct tagaccggga agatctgcac tgtgacatcg acgagacgtg 1920
ccacttccag aagtcggagg ccatcctgcg ggagctggac gtggaaaatg ccaagctgta 1980
cctggacttc atcgtactcg ggattttctt catctccctc cgcctcattg cctattttgt 2040
cctcaggtac aaaatccggg cagagaggta aaacacctga atgccaggaa acaggaagat 2100
tagacactgt ggccgagggc acgtctagaa tcgaggaggc aagcctgtgc ccgaccgacg 2160
acacagagac tcttctgatc caacccctag aaccgcgttg ggtttgtggg tgtctcgtgc 2220
tcagccactc tgcccagctg ggttggatct tctctccatt cccctttcta gctttaacta 2280
ggaagatgta ggcagattgg tggttttttt ttttttaaca tacagaattt taaataccac 2340
aactggggca gaatttaaag ctgcaacaca gctggtgatg agaggcttcc tcagtccagt 2400
cgctccttag caccaggcac cgtgggtcct ggatggggaa ctgcaagcag cctctcagct 2460
gatggctgca cagtcagatg tctggtggca gagagtccga gcatggagcg attccatttt 2520
atgactgttg tttttcacat tttcatcttt ctaaggtgtg tctcttttcc aatgagaagt 2580
catttttgca agccaaaagt cgatcaatcg cattcatttt aagaaattat acctttttag 2640
tacttgctga agaatgattc agggtaaatc acatactttg tttagagagg cgaggggttt 2700
aaccgagtca cccagctggt ctcatacata gacagcactt gtgaaggatt gaatgcaggt 2760
tccaggtgga gggaagacgt ggacaccatc tccactgagc catgcagaca tttttaaaag 2820
ctatacaaaa aattgtgaga agacattggc caactctttc aaagtctttc tttttccacg 2880
tgcttcttat tttaagcgaa atatattgtt tgtttcttcc taaaaaaaaa aaaaaaaaaa 2940
aaaaaa 2946
<210> 5
<211> 678
<212> PRT
<213> 人类
<400> 5
Met Ala Cys Leu Met Ala Ala Phe Ser Val Gly Thr Ala Met Asn Ala
1 5 10 15
Ser Ser Tyr Ser Ala Glu Met Thr Glu Pro Lys Ser Val Cys Val Ser
20 25 30
Val Asp Glu Val Val Ser Ser Asn Met Glu Ala Thr Glu Thr Asp Leu
35 40 45
Leu Asn Gly His Leu Lys Lys Val Asp Asn Asn Leu Thr Glu Ala Gln
50 55 60
Arg Phe Ser Ser Leu Pro Arg Arg Ala Ala Val Asn Ile Glu Phe Arg
65 70 75 80
Asp Leu Ser Tyr Ser Val Pro Glu Gly Pro Trp Trp Arg Lys Lys Gly
85 90 95
Tyr Lys Thr Leu Leu Lys Gly Ile Ser Gly Lys Phe Asn Ser Gly Glu
100 105 110
Leu Val Ala Ile Met Gly Pro Ser Gly Ala Gly Lys Ser Thr Leu Met
115 120 125
Asn Ile Leu Ala Gly Tyr Arg Glu Thr Gly Met Lys Gly Ala Val Leu
130 135 140
Ile Asn Gly Leu Pro Arg Asp Leu Arg Cys Phe Arg Lys Val Ser Cys
145 150 155 160
Tyr Ile Met Gln Asp Asp Met Leu Leu Pro His Leu Thr Val Gln Glu
165 170 175
Ala Met Met Val Ser Ala His Leu Lys Leu Gln Glu Lys Asp Glu Gly
180 185 190
Arg Arg Glu Met Val Lys Glu Ile Leu Thr Ala Leu Gly Leu Leu Ser
195 200 205
Cys Ala Asn Thr Arg Thr Gly Ser Leu Ser Gly Gly Gln Arg Lys Arg
210 215 220
Leu Ala Ile Ala Leu Glu Leu Val Asn Asn Pro Pro Val Met Phe Phe
225 230 235 240
Asp Glu Pro Thr Ser Gly Leu Asp Ser Ala Ser Cys Phe Gln Val Val
245 250 255
Ser Leu Met Lys Gly Leu Ala Gln Gly Gly Arg Ser Ile Ile Cys Thr
260 265 270
Ile His Gln Pro Ser Ala Lys Leu Phe Glu Leu Phe Asp Gln Leu Tyr
275 280 285
Val Leu Ser Gln Gly Gln Cys Val Tyr Arg Gly Lys Val Cys Asn Leu
290 295 300
Val Pro Tyr Leu Arg Asp Leu Gly Leu Asn Cys Pro Thr Tyr His Asn
305 310 315 320
Pro Ala Asp Phe Val Met Glu Val Ala Ser Gly Glu Tyr Gly Asp Gln
325 330 335
Asn Ser Arg Leu Val Arg Ala Val Arg Glu Gly Met Cys Asp Ser Asp
340 345 350
His Lys Arg Asp Leu Gly Gly Asp Ala Glu Val Asn Pro Phe Leu Trp
355 360 365
His Arg Pro Ser Glu Glu Val Lys Gln Thr Lys Arg Leu Lys Gly Leu
370 375 380
Arg Lys Asp Ser Ser Ser Met Glu Gly Cys His Ser Phe Ser Ala Ser
385 390 395 400
Cys Leu Thr Gln Phe Cys Ile Leu Phe Lys Arg Thr Phe Leu Ser Ile
405 410 415
Met Arg Asp Ser Val Leu Thr His Leu Arg Ile Thr Ser His Ile Gly
420 425 430
Ile Gly Leu Leu Ile Gly Leu Leu Tyr Leu Gly Ile Gly Asn Glu Ala
435 440 445
Lys Lys Val Leu Ser Asn Ser Gly Phe Leu Phe Phe Ser Met Leu Phe
450 455 460
Leu Met Phe Ala Ala Leu Met Pro Thr Val Leu Thr Phe Pro Leu Glu
465 470 475 480
Met Gly Val Phe Leu Arg Glu His Leu Asn Tyr Trp Tyr Ser Leu Lys
485 490 495
Ala Tyr Tyr Leu Ala Lys Thr Met Ala Asp Val Pro Phe Gln Ile Met
500 505 510
Phe Pro Val Ala Tyr Cys Ser Ile Val Tyr Trp Met Thr Ser Gln Pro
515 520 525
Ser Asp Ala Val Arg Phe Val Leu Phe Ala Ala Leu Gly Thr Met Thr
530 535 540
Ser Leu Val Ala Gln Ser Leu Gly Leu Leu Ile Gly Ala Ala Ser Thr
545 550 555 560
Ser Leu Gln Val Ala Thr Phe Val Gly Pro Val Thr Ala Ile Pro Val
565 570 575
Leu Leu Phe Ser Gly Phe Phe Val Ser Phe Asp Thr Ile Pro Thr Tyr
580 585 590
Leu Gln Trp Met Ser Tyr Ile Ser Tyr Val Arg Tyr Gly Phe Glu Gly
595 600 605
Val Ile Leu Ser Ile Tyr Gly Leu Asp Arg Glu Asp Leu His Cys Asp
610 615 620
Ile Asp Glu Thr Cys His Phe Gln Lys Ser Glu Ala Ile Leu Arg Glu
625 630 635 640
Leu Asp Val Glu Asn Ala Lys Leu Tyr Leu Asp Phe Ile Val Leu Gly
645 650 655
Ile Phe Phe Ile Ser Leu Arg Leu Ile Ala Tyr Phe Val Leu Arg Tyr
660 665 670
Lys Ile Arg Ala Glu Arg
675
<210> 6
<211> 4262
<212> DNA
<213> 人类
<400> 6
agtttccgag gaacttttcg ccggcgccgg gccgcctctg aggccagggc aggacacgaa 60
cgcgcggagc ggcggcggcg actgagagcc ggggccgcgg cggcgctccc taggaagggc 120
cgtacgaggc ggcgggcccg gcgggcctcc cggaggaggc ggctgcgcca tggacgagcc 180
acccttcagc gaggcggctt tggagcaggc gctgggcgag ccgtgcgatc tggacgcggc 240
gctgctgacc gacatcgaag gtgaagtcgg cgcggggagg ggtagggcca acggcctgga 300
cgccccaagg gcgggcgcag atcgcggagc catggattgc actttcgaag acatgcttca 360
gcttatcaac aaccaagaca gtgacttccc tggcctattt gacccaccct atgctgggag 420
tggggcaggg ggcacagacc ctgccagccc cgataccagc tccccaggca gcttgtctcc 480
acctcctgcc acattgagct cctctcttga agccttcctg agcgggccgc aggcagcgcc 540
ctcacccctg tcccctcccc agcctgcacc cactccattg aagatgtacc cgtccatgcc 600
cgctttctcc cctgggcctg gtatcaagga agagtcagtg ccactgagca tcctgcagac 660
ccccacccca cagcccctgc caggggccct cctgccacag agcttcccag ccccagcccc 720
accgcagttc agctccaccc ctgtgttagg ctaccccagc cctccgggag gcttctctac 780
aggaagccct cccgggaaca cccagcagcc gctgcctggc ctgccactgg cttccccgcc 840
aggggtcccg cccgtctcct tgcacaccca ggtccagagt gtggtccccc agcagctact 900
gacagtcaca gctgccccca cggcagcccc tgtaacgacc actgtgacct cgcagatcca 960
gcaggtcccg gtcctgctgc agccccactt catcaaggca gactcgctgc ttctgacagc 1020
catgaagaca gacggagcca ctgtgaaggc ggcaggtctc agtcccctgg tctctggcac 1080
cactgtgcag acagggcctt tgccgaccct ggtgagtggc ggaaccatct tggcaacagt 1140
cccactggtc gtagatgcgg agaagctgcc tatcagccgg ctcgcagctg gcagcaaggc 1200
cccggcctct gcccagagcc gtggagagaa gcgcacagcc cacaacgcca ttgagaagcg 1260
ctaccgctcc tccatcaatg acaaaatcat tgagctcaag gatctggtgg tgggcactga 1320
ggcaaagctg aataaatctg ctgtcttgcg caaggccatc gactacattc gctttctgca 1380
acacagcaac cagaaactca agcaggagaa cctaagtctg cgcactgctg tccacaaaag 1440
caaatctctg aaggatctgg tgtcggcctg tggcagtgga gggaacacag acgtgctcat 1500
ggagggcgtg aagactgagg tggaggacac actgacccca cccccctcgg atgctggctc 1560
acctttccag agcagcccct tgtcccttgg cagcaggggc agtggcagcg gtggcagtgg 1620
cagtgactcg gagcctgaca gcccagtctt tgaggacagc aaggcaaagc cagagcagcg 1680
gccgtctctg cacagccggg gcatgctgga ccgctcccgc ctggccctgt gcacgctcgt 1740
cttcctctgc ctgtcctgca accccttggc ctccttgctg ggggcccggg ggcttcccag 1800
cccctcagat accaccagcg tctaccatag ccctgggcgc aacgtgctgg gcaccgagag 1860
cagagatggc cctggctggg cccagtggct gctgccccca gtggtctggc tgctcaatgg 1920
gctgttggtg ctcgtctcct tggtgcttct ctttgtctac ggtgagccag tcacacggcc 1980
ccactcaggc cccgccgtgt acttctggag gcatcgcaag caggctgacc tggacctggc 2040
ccggggagac tttgcccagg ctgcccagca gctgtggctg gccctgcggg cactgggccg 2100
gcccctgccc acctcccacc tggacctggc ttgtagcctc ctctggaacc tcatccgtca 2160
cctgctgcag cgtctctggg tgggccgctg gctggcaggc cgggcagggg gcctgcagca 2220
ggactgtgct ctgcgagtgg atgctagcgc cagcgcccga gacgcagccc tggtctacca 2280
taagctgcac cagctgcaca ccatggggaa gcacacaggc gggcacctca ctgccaccaa 2340
cctggcgctg agtgccctga acctggcaga gtgtgcaggg gatgccgtgt ctgtggcgac 2400
gctggccgag atctatgtgg cggctgcatt gagagtgaag accagtctcc cacgggcctt 2460
gcattttctg acacgcttct tcctgagcag tgcccgccag gcctgcctgg cacagagtgg 2520
ctcagtgcct cctgccatgc agtggctctg ccaccccgtg ggccaccgtt tcttcgtgga 2580
tggggactgg tccgtgctca gtaccccatg ggagagcctg tacagcttgg ccgggaaccc 2640
agtggacccc ctggcccagg tgactcagct attccgggaa catctcttag agcgagcact 2700
gaactgtgtg acccagccca accccagccc tgggtcagct gatggggaca aggaattctt 2760
ggatgccctc gggtacctgc agctgctgaa cagctgttct gatgctgcgg gggctcctgc 2820
ctacagcttc tccatcagtt ccagcatggc caccaccacc ggcgtagacc cggtggccaa 2880
gtggtgggcc tctctgacag ctgtggtgat ccactggctg cggcgggatg aggaggcggc 2940
tgagcggctg tgcccgctgg tggagcacct gccccgggtg ctgcaggagt ctgagagacc 3000
cctgcccagg gcagctctgc actccttcaa ggctgcccgg gccctgctgg gctgtgccaa 3060
ggcagagtct ggtccagcca gcctgaccat ctgtgagaag gccagtgggt acctgcagga 3120
cagcctggct accacaccag ccagcagctc cattgacaag gccgtgcagc tgttcctgtg 3180
tgacctgctt cttgtggtgc gcaccagcct gtggcggcag cagcagcccc cggccccggc 3240
cccagcagcc cagggcacca gcagcaggcc ccaggcttcc gcccttgagc tgcgtggctt 3300
ccaacgggac ctgagcagcc tgaggcggct ggcacagagc ttccggcccg ccatgcggag 3360
ggtgttccta catgaggcca cggcccggct gatggcgggg gccagcccca cacggacaca 3420
ccagctcctc gaccgcagtc tgaggcggcg ggcaggcccc ggtggcaaag gaggcgcggt 3480
ggcggagctg gagccgcggc ccacgcggcg ggagcacgcg gaggccttgc tgctggcctc 3540
ctgctacctg ccccccggct tcctgtcggc gcccgggcag cgcgtgggca tgctggctga 3600
ggcggcgcgc acactcgaga agcttggcga tcgccggctg ctgcacgact gtcagcagat 3660
gctcatgcgc ctgggcggtg ggaccactgt cacttccagc tagaccccgt gtccccggcc 3720
tcagcacccc tgtctctagc cactttggtc ccgtgcagct tctgtcctgc gtcgaagctt 3780
tgaaggccga aggcagtgca agagactctg gcctccacag ttcgacctgc ggctgctgtg 3840
tgccttcgcg gtggaaggcc cgaggggcgc gatcttgacc ctaagaccgg cggccatgat 3900
ggtgctgacc tctggtggcc gatcggggca ctgcaggggc cgagccattt tggggggccc 3960
ccctccttgc tctgcaggca ccttagtggc ttttttcctc ctgtgtacag ggaagagagg 4020
ggtacatttc cctgtgctga cggaagccaa cttggctttc ccggactgca agcagggctc 4080
tgccccagag gcctctctct ccgtcgtggg agagagacgt gtacatagtg taggtcagcg 4140
tgcttagcct cctgacctga ggctcctgtg ctactttgcc ttttgcaaac tttattttca 4200
tagattgaga agttttgtac agagaattaa aaatgaaatt atttataaaa aaaaaaaaaa 4260
aa 4262
<210> 7
<211> 1147
<212> PRT
<213> 人类
<400> 7
Met Asp Glu Pro Pro Phe Ser Glu Ala Ala Leu Glu Gln Ala Leu Gly
1 5 10 15
Glu Pro Cys Asp Leu Asp Ala Ala Leu Leu Thr Asp Ile Glu Asp Met
20 25 30
Leu Gln Leu Ile Asn Asn Gln Asp Ser Asp Phe Pro Gly Leu Phe Asp
35 40 45
Pro Pro Tyr Ala Gly Ser Gly Ala Gly Gly Thr Asp Pro Ala Ser Pro
50 55 60
Asp Thr Ser Ser Pro Gly Ser Leu Ser Pro Pro Pro Ala Thr Leu Ser
65 70 75 80
Ser Ser Leu Glu Ala Phe Leu Ser Gly Pro Gln Ala Ala Pro Ser Pro
85 90 95
Leu Ser Pro Pro Gln Pro Ala Pro Thr Pro Leu Lys Met Tyr Pro Ser
100 105 110
Met Pro Ala Phe Ser Pro Gly Pro Gly Ile Lys Glu Glu Ser Val Pro
115 120 125
Leu Ser Ile Leu Gln Thr Pro Thr Pro Gln Pro Leu Pro Gly Ala Leu
130 135 140
Leu Pro Gln Ser Phe Pro Ala Pro Ala Pro Pro Gln Phe Ser Ser Thr
145 150 155 160
Pro Val Leu Gly Tyr Pro Ser Pro Pro Gly Gly Phe Ser Thr Gly Ser
165 170 175
Pro Pro Gly Asn Thr Gln Gln Pro Leu Pro Gly Leu Pro Leu Ala Ser
180 185 190
Pro Pro Gly Val Pro Pro Val Ser Leu His Thr Gln Val Gln Ser Val
195 200 205
Val Pro Gln Gln Leu Leu Thr Val Thr Ala Ala Pro Thr Ala Ala Pro
210 215 220
Val Thr Thr Thr Val Thr Ser Gln Ile Gln Gln Val Pro Val Leu Leu
225 230 235 240
Gln Pro His Phe Ile Lys Ala Asp Ser Leu Leu Leu Thr Ala Met Lys
245 250 255
Thr Asp Gly Ala Thr Val Lys Ala Ala Gly Leu Ser Pro Leu Val Ser
260 265 270
Gly Thr Thr Val Gln Thr Gly Pro Leu Pro Thr Leu Val Ser Gly Gly
275 280 285
Thr Ile Leu Ala Thr Val Pro Leu Val Val Asp Ala Glu Lys Leu Pro
290 295 300
Ile Asn Arg Leu Ala Ala Gly Ser Lys Ala Pro Ala Ser Ala Gln Ser
305 310 315 320
Arg Gly Glu Lys Arg Thr Ala His Asn Ala Ile Glu Lys Arg Tyr Arg
325 330 335
Ser Ser Ile Asn Asp Lys Ile Ile Glu Leu Lys Asp Leu Val Val Gly
340 345 350
Thr Glu Ala Lys Leu Asn Lys Ser Ala Val Leu Arg Lys Ala Ile Asp
355 360 365
Tyr Ile Arg Phe Leu Gln His Ser Asn Gln Lys Leu Lys Gln Glu Asn
370 375 380
Leu Ser Leu Arg Thr Ala Val His Lys Ser Lys Ser Leu Lys Asp Leu
385 390 395 400
Val Ser Ala Cys Gly Ser Gly Gly Asn Thr Asp Val Leu Met Glu Gly
405 410 415
Val Lys Thr Glu Val Glu Asp Thr Leu Thr Pro Pro Pro Ser Asp Ala
420 425 430
Gly Ser Pro Phe Gln Ser Ser Pro Leu Ser Leu Gly Ser Arg Gly Ser
435 440 445
Gly Ser Gly Gly Ser Gly Ser Asp Ser Glu Pro Asp Ser Pro Val Phe
450 455 460
Glu Asp Ser Lys Ala Lys Pro Glu Gln Arg Pro Ser Leu His Ser Arg
465 470 475 480
Gly Met Leu Asp Arg Ser Arg Leu Ala Leu Cys Thr Leu Val Phe Leu
485 490 495
Cys Leu Ser Cys Asn Pro Leu Ala Ser Leu Leu Gly Ala Arg Gly Leu
500 505 510
Pro Ser Pro Ser Asp Thr Thr Ser Val Tyr His Ser Pro Gly Arg Asn
515 520 525
Val Leu Gly Thr Glu Ser Arg Asp Gly Pro Gly Trp Ala Gln Trp Leu
530 535 540
Leu Pro Pro Val Val Trp Leu Leu Asn Gly Leu Leu Val Leu Val Ser
545 550 555 560
Leu Val Leu Leu Phe Val Tyr Gly Glu Pro Val Thr Arg Pro His Ser
565 570 575
Gly Pro Ala Val Tyr Phe Trp Arg His Arg Lys Gln Ala Asp Leu Asp
580 585 590
Leu Ala Arg Gly Asp Phe Ala Gln Ala Ala Gln Gln Leu Trp Leu Ala
595 600 605
Leu Arg Ala Leu Gly Arg Pro Leu Pro Thr Ser His Leu Asp Leu Ala
610 615 620
Cys Ser Leu Leu Trp Asn Leu Ile Arg His Leu Leu Gln Arg Leu Trp
625 630 635 640
Val Gly Arg Trp Leu Ala Gly Arg Ala Gly Gly Leu Gln Gln Asp Cys
645 650 655
Ala Leu Arg Val Asp Ala Ser Ala Ser Ala Arg Asp Ala Ala Leu Val
660 665 670
Tyr His Lys Leu His Gln Leu His Thr Met Gly Lys His Thr Gly Gly
675 680 685
His Leu Thr Ala Thr Asn Leu Ala Leu Ser Ala Leu Asn Leu Ala Glu
690 695 700
Cys Ala Gly Asp Ala Val Ser Val Ala Thr Leu Ala Glu Ile Tyr Val
705 710 715 720
Ala Ala Ala Leu Arg Val Lys Thr Ser Leu Pro Arg Ala Leu His Phe
725 730 735
Leu Thr Arg Phe Phe Leu Ser Ser Ala Arg Gln Ala Cys Leu Ala Gln
740 745 750
Ser Gly Ser Val Pro Pro Ala Met Gln Trp Leu Cys His Pro Val Gly
755 760 765
His Arg Phe Phe Val Asp Gly Asp Trp Ser Val Leu Ser Thr Pro Trp
770 775 780
Glu Ser Leu Tyr Ser Leu Ala Gly Asn Pro Val Asp Pro Leu Ala Gln
785 790 795 800
Val Thr Gln Leu Phe Arg Glu His Leu Leu Glu Arg Ala Leu Asn Cys
805 810 815
Val Thr Gln Pro Asn Pro Ser Pro Gly Ser Ala Asp Gly Asp Lys Glu
820 825 830
Phe Ser Asp Ala Leu Gly Tyr Leu Gln Leu Leu Asn Ser Cys Ser Asp
835 840 845
Ala Ala Gly Ala Pro Ala Tyr Ser Phe Ser Ile Ser Ser Ser Met Ala
850 855 860
Thr Thr Thr Gly Val Asp Pro Val Ala Lys Trp Trp Ala Ser Leu Thr
865 870 875 880
Ala Val Val Ile His Trp Leu Arg Arg Asp Glu Glu Ala Ala Glu Arg
885 890 895
Leu Cys Pro Leu Val Glu His Leu Pro Arg Val Leu Gln Glu Ser Glu
900 905 910
Arg Pro Leu Pro Arg Ala Ala Leu His Ser Phe Lys Ala Ala Arg Ala
915 920 925
Leu Leu Gly Cys Ala Lys Ala Glu Ser Gly Pro Ala Ser Leu Thr Ile
930 935 940
Cys Glu Lys Ala Ser Gly Tyr Leu Gln Asp Ser Leu Ala Thr Thr Pro
945 950 955 960
Ala Ser Ser Ser Ile Asp Lys Ala Val Gln Leu Phe Leu Cys Asp Leu
965 970 975
Leu Leu Val Val Arg Thr Ser Leu Trp Arg Gln Gln Gln Pro Pro Ala
980 985 990
Pro Ala Pro Ala Ala Gln Gly Thr Ser Ser Arg Pro Gln Ala Ser Ala
995 1000 1005
Leu Glu Leu Arg Gly Phe Gln Arg Asp Leu Ser Ser Leu Arg Arg
1010 1015 1020
Leu Ala Gln Ser Phe Arg Pro Ala Met Arg Arg Val Phe Leu His
1025 1030 1035
Glu Ala Thr Ala Arg Leu Met Ala Gly Ala Ser Pro Thr Arg Thr
1040 1045 1050
His Gln Leu Leu Asp Arg Ser Leu Arg Arg Arg Ala Gly Pro Gly
1055 1060 1065
Gly Lys Gly Gly Ala Val Ala Glu Leu Glu Pro Arg Pro Thr Arg
1070 1075 1080
Arg Glu His Ala Glu Ala Leu Leu Leu Ala Ser Cys Tyr Leu Pro
1085 1090 1095
Pro Gly Phe Leu Ser Ala Pro Gly Gln Arg Val Gly Met Leu Ala
1100 1105 1110
Glu Ala Ala Arg Thr Leu Glu Lys Leu Gly Asp Arg Arg Leu Leu
1115 1120 1125
His Asp Cys Gln Gln Met Leu Met Arg Leu Gly Gly Gly Thr Thr
1130 1135 1140
Val Thr Ser Ser
1145
- 还没有人留言评论。精彩留言会获得点赞!