收集元件与具有该元件的样本处理套组的制作方法
本申请案主张在2014年7月2日提出申请的美国临时专利申请案第62/019,900号的权益,所述专利申请案的全部揭示内容以引用的方式并入本文中。
技术领域
本发明涉及一种样本分离与收集套组,且特别涉及一种可拆式收集元件与具有该元件的样本处理套组。
背景技术:
微流体技术被广泛应用于生物、医药以及生化领域之中,而离心微流体平台已普遍被用作研究工具。在离心微流体平台中,由于样本非连续流体输入的设计,使得离心微流体装置不适于处理大容量的样本,且无法作为商业销售或使用的测试平台或套组。此外,利用离心微流体平台所处理分离的样本常需要进一步抽取或收集以供后续其他检验或测试,亦需要有更佳收集样本的方法。
技术实现要素:
本发明提供一种样本处理套组,包括至少一离心微流碟片以及至少一收集元件。收集元件以可拆卸的方式嵌入离心微流碟片。藉由使用此样本处理套组,目标分子或细胞可利用密度梯度分离于离心微流碟片中分离开来且收集至收集元件中。而且,本发明的样本处理套组可应用于注入连续流体的自动工作站,因此可轻易处理大量样本。
本发明涉及一种样本处理套组,包括至少一离心微流元件以及至少一收集元件。离心微流元件包括用以载入生物样本的样本入口、分离槽、沉降槽以及用以紧密嵌入收集元件的嵌合部位。收集元件是以可拆卸的方式嵌入嵌合部位。分离槽连接样本入口以及沉降槽连接分离槽。在离心的过程中,生物样本经处理后分离成待收集的部分以及剩余的部分,待收集的部分会进入分离槽,剩余的部分则会进入沉降槽。收集元件包括芯片主体。芯片主体其上具有进入口且其内部具有收集槽。具有进入口的收集槽与用以接收生物样本的离心微流碟片的分离槽相连接。
在本发明亦提供一种收集元件,可应用于样本处理套组的离心微流碟片。收集元件包括芯片主体。芯片主体其上具有进入口且其内部具有收集槽。具有进入口的收集槽与离心微流碟片的分离槽相连接。生物样本自离心微流碟片的样本入口注入并且经过离心微流碟片的分离槽后分离,会收集于收集元件的收集槽。
为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合所附附图作详细说明如下。
附图说明
为了更理解本发明,所附附图并入并构成本说明书的一部分。附图参酌实施方式说明本发明的实施例,并且用以理解本发明的原理。
图1A是根据本发明实施例的样本处理套组的立体示意图。
图1B是根据图1A所示样本处理套组的收集元件的上视图。
图1C是根据图1A所示样本处理套组的收集元件的剖面示意图。
图1D是根据本发明另一实施例的样本处理套组的收集元件的上视图。
图1E是根据本发明另一实施例的样本处理套组的收集元件的剖面示意图。
图2是根据本发明另一实施例的样本处理套组的立体示意图。
图3A是根据本发明另一实施例的样本处理套组的立体示意图。
图3B是根据图3A所示样本处理套组的收集元件的上视图。
图3C是根据图3A所示样本处理套组的收集元件的剖面示意图。
图4A是根据本发明一实施例沿着位于样本处理套组中的离心微流碟片一部分的厚度方向剖面示意图。
图4B是根据本发明一实施例沿着位于样本处理套组中的收集元件一部分的厚度方向剖面示意图。
图5A是根据本发明一实施例的离心微流碟片的立体示意图。
图5B至图5E是根据图5A所示离心微流碟片的各种剖面示意图。
图6A是根据本发明另一实施例的离心微流碟片的立体示意图。
图6B至图6G是根据图6A所示离心微流碟片的不同剖面示意图。
图7是根据本发明实施例的自动工作站示意图。
图8是根据本发明实施例的样本处理套组的流速与细胞株MCF7的回收率的关系图。
图9示出不同种类的细胞株的回收率。
所有附图和详细实施方式使用相同的参考数字以指示相同的元件。本发明将通过结合所附附图及下列的详细实施方式而更加浅显易懂。
具体实施方式
本发明涉及一种可拆式收集元件以及一种样本处理套组。可拆式收集元件以可拆卸的方式嵌入离心微流碟片。样本处理套组包括可拆式收集元件以及离心微流碟片。样本处理套组可利用密度梯度来处理(即分离、收集和/或标记)载入离心微流碟片内的细胞或目标分子。此外,本发明的样本处理套组可经由一种自动工作站来操作离心微流碟片以及执行生物样本的处理。
本发明所揭示的样本处理套组可应用于处理不同种类的样本,包括所有的血液样本、血浆流体、尿液或者其他体液或生物流体。
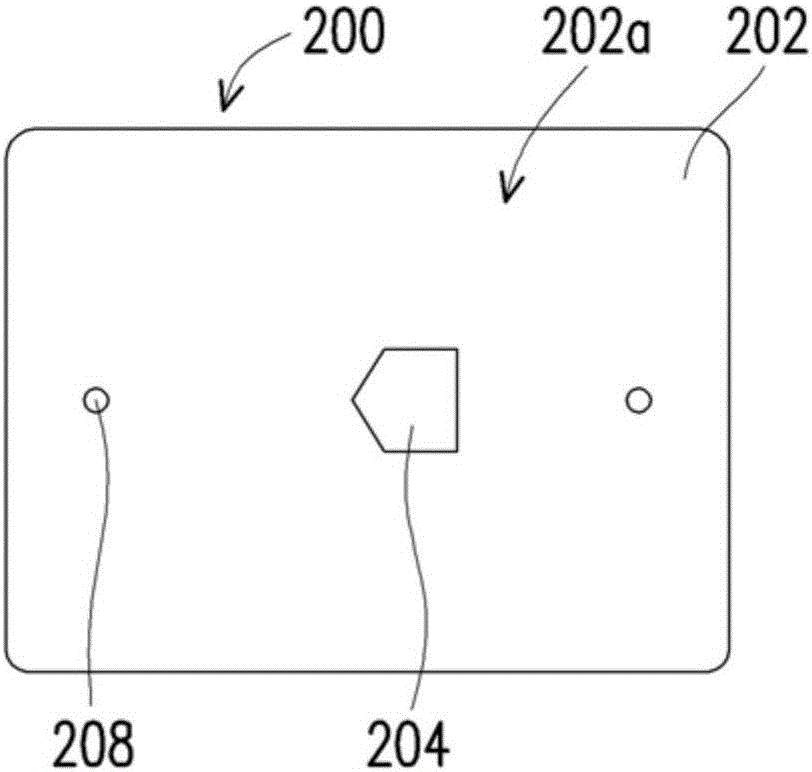
图1A是根据本发明实施例的样本处理套组的立体示意图。图1B是图1A所示样本处理套组的收集元件的上视图,而图1C是图1A所示样本处理套组的收集元件的剖面示意图。图1C的剖面是横切于图1A的收集元件的厚度方向。
请参照图1A,样本处理套组10至少包括离心微流碟片100以及收集元件200。收集元件200是可移动的及可拆卸的,并且能够嵌入或垂直插入离心微流碟片100的凹槽150中。已嵌入的收集元件200直立于微流碟片100。也就是说,在收集元件200嵌入碟片后,收集元件200的厚度方向X会实质上垂直于微流碟片100的厚度方向Y。离心微流碟片100可以是圆形或椭圆形碟片,且微流碟片100可以是由数个薄切片组装或彼此堆叠后制造而得。微流碟片100的材质可以是塑胶材料,例如聚甲基丙烯酸甲酯(PMMA)或其他热塑性塑料。微流碟片100的直径可以是在6与18公分之间,举例而言,微流碟片100的直径以12至14公分为较佳。微流碟片100包括多于一个的轴孔130,用以容纳旋转轴。尽管离心微流碟片称为“碟片”,但其事实上是离心微流处理元件,且用词“碟片”并非用以限制元件的形状或外形设计。
请参照图1A,微流碟片100至少包括样本入口102、分离槽104以及沉降槽106。样本入口102位于碟片100的中央部位,且样本可藉由样本入口102载入至碟片100。分离槽104藉由连结通道103与样本入口102连接。连结通道103与分离槽104共同设计成自中央的样本入口102向外盘旋的螺旋形。分离槽104具有弧形以及分离槽104的弧形部(弧形部实质上沿着碟片的圆周边缘)所具有的长约为2至20公分及宽约为0.1至2公分。
连结通道103(其连接样本入口至圆周部分)的长度尺寸大约为0.1至1公分。
沉降槽106配置环绕分离槽104,但与分离槽104两者之间存在间距且相互分离。沉降槽106藉由位于彼此之间的连接部107与分离槽104连接,以致导入流体可于分离槽104与沉降槽106之间流动。连结通道103的一端物理连接样本入口102,而分离槽104的一端104b物理连接汇流点122。微流碟片100还包括位于微流碟片100周围部分的凹槽150。凹槽150配置用以容纳可拆式收集元件200。也就是说,凹槽150的形状应设计成与收集元件200紧密嵌合。
原则上,凹槽可被视为嵌合部位,且收集元件藉由紧密嵌合的机制而嵌入嵌合部位。
如图1A所示,碟片100又包括化学物入口或试剂入口120,位于碟片100的中央位置,而反应试剂可以藉由试剂入口120载入至碟片100。试剂入口120与样本入口102皆为圆形开口,但试剂入口120与样本入口102为不同尺寸,并以同心圆(concentric)的方式配置于不同层。位于上层的试剂入口120具有大于位于下层的样本入口102的尺寸。试剂入口120藉由连通通道124连接汇流点122。分离的样本或试剂流经汇流点122后,更进一步藉由传送通道110流入嵌入凹槽150的收集元件200。传送通道110的端点其功能是作为分离的样本或试剂的出口。汇流点122垂直延伸而与位于上层的传送通道110及位于下层的分离槽104相通。分离的样本可藉由汇流点122与传送通道110自分离槽104的一端104b流入嵌入凹槽150的收集元件200内。由试剂(化学物)入口120载入的试剂的流径与由样本入口载入的样本的流径位于不同层且所流经的路线也不相同。收集元件200可于后续步骤中自碟片移除。
参照图1B至图1C,收集元件200包括芯片主体202,芯片主体202其上表面202a具有进入口204。进入口204通向位于芯片主体202内部的收集槽206。如图1C所示,收集槽206连接至少一个废料出口208(此处例示为2个),以使额外或不必要的流体或者操作缓冲溶液(running buffer)自废料出口208排出。进入口204其功能事实上是作为入口,用以接收来自分离槽104并经由汇流点122及传送通道110的样本流体。如图1A所示,当收集元件200插入微流碟片100时,得以接收分离的样本或其他流体。
在另一实施例中的收集元件,如图1D至图1E所示,收集元件200’包括芯片主体202,芯片主体202其上表面202a具有进入口204。此外,芯片主体202可进一步包括一或多个位于两侧的支臂部分203,以使芯片主体202易于嵌入凹槽150。然而,此部分设计是可选择的。在图1E中,收集槽206连接至少一个废料出口208(此处例示为2个)。
收集元件200/200’的尺寸可以为例如:长度或宽度为0.3至5公分且厚度为0.1至5公分。收集槽206装载的体积可例如为10微升至5毫升。收集元件200/200’可以是由数个薄切片组装或彼此堆叠后制造而得。收集元件200/200’的材质可以是塑胶材料,例如聚甲基丙烯酸甲酯(PMMA)或其他热塑性塑料。较佳地,收集元件200/200’可以是由2至4个切片彼此藉由防水黏着材料(water-proof adhesive materials)(例如PDMS)或者藉由超音波焊接(ultrasonic welding)或点胶(dispensing)或双面胶(double tape)固定后制造而得。收集元件200/200’可藉由移除一或多个收集元件的上层切片来开启而暴露出收集槽206以易于抽取样本。经由上述方式,当所需样本被收集至收集元件200/200’的收集槽206内时,其他切片会被移除且只有保留有样本的芯片主体(即包含收集槽的切片)会被保存下来进一步实验。
图2是根据本发明另一实施例的样本处理套组的立体示意图。样本处理套组20至少包括离心微流碟片100以及收集元件200A。微流碟片100的凹槽150A位于微流碟片100的边缘部分且凹槽150A侧向开放并直接朝向外部环境。凹槽150A同样配置用以容纳可拆式收集元件200A。也就是说,凹槽150A的形状应设计成与收集元件200A紧密嵌合。收集元件200A是可移动的及可拆卸的,并且能够侧向插入离心微流碟片100的凹槽150A中。在收集元件200A嵌入碟片后,收集元件200A的厚度方向X会实质上垂直于微流碟片100的厚度方向Y。在本实施例中的离心微流碟片100和收集元件200A与在先前实施例中的离心微流碟片100和收集元件200相似,差别在于凹槽的位置和嵌入的方式不同。因此,微流碟片和收集元件的细节在此可省略不再赘述。
图3A是根据本发明另一实施例的样本处理套组的立体示意图。样本处理套组30至少包括离心微流碟片100以及收集元件200B。与图1A中的离心微流碟片100的差异在于,图3A中的离心微流碟片100仅包括一个轴孔130,其位于样本入口102的中心用以容纳旋转轴。
如图3A所示,微流碟片100的凹槽150A位于微流碟片100的边缘部分且凹槽150A侧向开放并直接朝向外部环境。凹槽150A同样配置用以容纳可拆式收集元件200B。也就是说,凹槽150A的形状应设计成与收集元件200B紧密嵌合。收集元件200B是可移动的及可拆卸的,并且能够侧向插入离心微流碟片100的凹槽150A中。在收集元件200B嵌入碟片后,收集元件200B的厚度方向X会实质上垂直于微流碟片100的厚度方向Y。与先前的实施例相比,在本实施例中离心微流碟片100和收集元件200B的相似的部分或结构在此可省略不再赘述。图3B是图3A所示样本处理套组的收集元件的上视图,而图3C是图3A所示样本处理套组的收集元件的剖面示意图。图3C的剖面是横切于图3A的收集元件的厚度方向。
参照图3A至图3C,收集元件200B包括芯片主体202,芯片主体202其上表面202a具有进入口204。进入口204通向位于芯片主体202内部的收集槽206。如图3A及3C所示,收集槽206经由多个壁状结构206a被分成数个半连接的部分206b。收集槽206连接至少一个废料出口208(此处例示为1个),以使额外或不必要的流体或者运转溶液自废料出口208排出。进入口204其功能事实上是作为入口,用以接收来自分离槽104的样本流体或是经由汇流点122及传送通道110的试剂。如图3A至3B所示,进入口204位于上表面202a的周围部分,而不是位在如图1B中所示的中央位置。当收集元件200B插入微流碟片100时,进入口204面向凹槽150A的一侧以接收流体。
于肿瘤(tumor)转移的过程中,在初步位置的侵入性肿瘤细胞倾向于使细胞流泻至血流,转移至其他器官而生长成新肿瘤。然而,血流中的这些转移细胞(metastasized cells)是难以定位的,因为这些转移细胞与血液细胞(hematologic cells)相比是非常稀少的(大约每一亿个细胞中仅有一个肿瘤细胞)。值得注意的是,在血液内循环的这些转移细胞例如循环性癌细胞(CTCs),可有助于提供肿瘤转移和/或特殊疗法的疗效所相关的潜在预测资讯。为实验所需,这些稀罕细胞(rare cells)例如循环性癌细胞,可自血液样本分离或收集。
在以下实施例中,所有血液作为生物样本的范例,而自所有血液分离与收集的稀罕细胞可用于描述样本处理套组以及相关的自动工作站的运作。
图4A是根据本发明一实施例沿着位于样本处理套组中的离心微流碟片一部分的厚度方向剖面示意图。为了说明细胞或分子分离的原理,图4A着重于分离槽和沉降槽的部分。密度梯度溶液105在样本载入前,首先被载入至分离槽104以及沉降槽106。密度梯度溶液105例如是Ficoll-Paque溶液(Ficoll-paqueTM plus GE Healthcare,No.17-1440-02)。于碟片100旋转的期间,离心力驱动流体(流体样本以及缓冲液)自中央的样本入口102径向地向外流动,向外沿着连结通道103与分离槽104的螺旋形,接着朝向配置靠近于碟片100的圆周边缘且环绕分离槽104的沉降槽106向外流动。意即,流体样本例如血液样本,其包含了轻细胞(light cells)LC以及重细胞(heavy cell)HC,自样本入口载入并且流动至分离槽104(流向如箭头所示)。藉由离心力的作用以及密度梯度溶液105的筛选,轻细胞LC或小分子悬浮在分离槽104中,并自分离槽104进一步流动至收集槽(流向如箭头所示),而重细胞HC或大分子沉降并冲刷至沉降槽106。样本的流径起始于样本入口102,沿着连结通道103、分离槽104及沉降槽106,并且部分的样本(轻细胞LC或小分子)经由汇流点122和传送通道110流到嵌入至凹槽150的收集元件200内。
藉由调整流动条件和/或密度梯度溶液105的密度,目标细胞或分子可轻易地自生物样本分离开来,而被收集元件200收集。
当目标细胞或分子被收集在收集元件200内,可执行进一步的处理以加工目标细胞或分子。举例而言,在目标细胞移出收集元件200之前,目标细胞可在收集元件200内被进一步标记。在这种情况下,标记试剂可自试剂入口120而非样本入口102载入,并通过连通通道124、汇流点122、传送通道110而流入收集元件200(如图1A所示)。化学物或标记试剂的流径起始于试剂入口120(化学物入口),经由连通通道124、汇流点122、传送通道110而终止于收集元件200的收集槽206,并没有进入到分离槽或沉降槽内。化学物可包括选自一或多种的荧光染料(fluorescent dye)、抗体(antibodies)、免疫标示物(immuno-marker)、量子点(quantum dots)、磁珠(magnetic bead)、标记材料或样本制备材料。
图4B是根据本发明一实施例沿着位于样本处理套组中的收集元件一部分的厚度方向剖面示意图。为了说明细胞标记(cell labeling)的原理,图4B着重于收集槽的部分。如图4B的上半部所示,轻细胞LC被收集至收集元件200的收集槽206内(流向如箭头所示)。之后,试剂R(即化学物,例如荧光染料、抗体、免疫标示物、量子点、磁珠或其它标记或样本制备材料)被载入至收集元件200的收集槽206并与轻细胞LC(图4B的中段部所示)培养,接着在培养之后可得到标记的轻细胞LC’(图4B的下半部所示)。最后,注入清洗缓冲液(washing buffer)以冲洗出未反应的标记试剂。标记过程可以是任何有效的标记过程,例如免疫标记(immuno-labeling)、荧光标记(fluorescence labeling)或磁珠标记(magnetic bead labeling)。
在本实施例中,标记过程仅仅执行一次,但如有需要,收集于收集槽内的目标物可被执行数次标记[即复数标记(multiple labeling)或复合标示标记(multi-marker labeling)]。
图5A是根据本发明一实施例的离心微流碟片的立体示意图。图5B至图5E是图5A所示离心微流碟片的各种剖面说明示意图。图5B至图5E所示是图5A中的碟片由下层依序至上层的剖面。图5B至图5E的剖面是横切于图5A中的碟片的厚度方向。离心微流碟片500可以是圆形或椭圆形碟片,且图5A中的微流碟片500可以是由数个切片组装或彼此堆叠后制造而得。在图5A中,碟片500的堆叠切片显示为两个分离的部分(一为下方且较大的部分,另一为上方且较小的部分)以达到说明目的。微流碟片500的材质可以是塑胶材料,例如聚甲基丙烯酸甲酯(PMMA)或其他热塑性塑料。微流碟片500的直径可以是在6与18公分之间,举例而言,以12至14公分为较佳。
图5A中的离心微流碟片500事实上包括三个独立处理部分,处理部分A、处理部分B以及处理部分C,且每个处理部分可被当作离心微流元件,其功能类似于前述的微流碟片100。原则上,离心微流碟片500是将至少三个独立作用的微流元件整合成一个微流碟片。连同如上所述的三个分离的收集元件,三个独立的样本处理套组被整合成一个样本处理套组,以使这三个独立的样本处理套组(分别处理相同或不同的样本)的处理流程可以藉由一个单一的离心过程同时执行。这样的设计非常符合经济成本,并提供高效率和高收益。
如图5A至图5E中所示,离心微流碟片500的每个处理部分A/B/C包括样本入口502A/502B/502C、连结通道503A/503B/503C、分离槽504A/504B/504C以及沉降槽506A/506B/506C。样本入口502A/502B/502C位于碟片500的中央部位,且相同的样本或是不同的样本可藉由样本入口502A/502B/502C载入至碟片500的不同处理部分。分离槽504A/504B/504C藉由对应的连结通道503A/503B/503C与样本入口502A/502B/502C连接。样本入口502A/502B/502C为不同尺寸,并以同心的方式配置于不同层。沉降槽506A/506B/506C与分离槽504A/504B/504C连接,并且在离心过程中,在入射流体样本中待收集的目标物或细胞可流入分离槽504A/504B/504C,而流体样本中不收集的部分会流入沉降槽506A/506B/506C。藉由调整流动条件和/或密度梯度溶液的密度,目标物或细胞可轻易地自生物流体样本脱离,且流入收集元件。
分离槽504A/504B/504C的一端物理连接汇流点522A/522B/522C。待收集的目标物或细胞流经分离槽504A/504B/504C,经由汇流点522A/522B/522C,进一步流入与凹槽550A/550B/550C相连接的传送通道510A/510B/510C。汇流点522A/522B/522C垂直延伸(跨越两层)而与位于下层的分离槽504A/504B/504C及位于上层的传送通道510A/510B/510C相通。意即,自分离槽504A/504B/504C的一端分离的样本可藉由汇流点522A/522B/522C与传送通道510A/510B/510C接着流入横截的凹槽550A/550B/550C内(即由嵌入其中的收集元件来收集)。如前所述,收集元件200(如图1A所示)可在分离的样本于后续步骤收集完毕后自碟片的凹槽移除。
图6A是根据本发明另一实施例的离心微流碟片的立体示意图。图6B至图6G是图6A所示离心微流碟片的各种剖面说明示意图。图6B至图6G所示是图6A中的碟片由下层依序至上层的剖面。图6B至图6G的剖面是横切于图6A中的碟片的厚度方向。离心微流碟片600可以是圆形或椭圆形碟片,且微流碟片600可以是由数个切片组装或彼此堆叠后制造而得。在图6A中,碟片600的堆叠切片显示为两个分离的部分(一为下方且较大的部分,另一为上方且较小的部分)以达到说明目的。
图6A中的离心微流碟片600事实上被分为三个独立处理部分,处理部分A、处理部分B以及处理部分C,且每个处理部分的功能类似于前述的微流碟片100。相似而言,离心微流碟片600的设计是将至少三个独立作用的微流碟片整合成一个微流碟片,并且如上所述的三个收集元件可嵌入微流碟片600,以作为在单一的离心过程中三个独立的样本处理套组。离心微流碟片600的设计类似于离心微流碟片500的设计,除了用以载入试剂或染料的额外流径设计。
如图6A至图6G中所示,离心微流碟片600的每个处理部分A/B/C包括样本入口602A/602B/602C、连结通道603A/603B/603C、分离槽604A/604B/604C以及沉降槽606A/606B/606C。样本入口602A/602B/602C位于碟片600的中央部位,且相同的样本或是不同的样本可藉由样本入口602A/602B/602C载入至碟片600的不同处理部分。分离槽604A/604B/604C藉由对应的连结通道603A/603B/603C与样本入口602A/602B/602C连接。样本入口602A/602B/602C为不同尺寸,并以同心的方式配置于不同层。在图6B中,储存槽621A/621B/621C配置在各处理部分的连结通道603A/603B/603C的旁边,且试剂入口620A/620B/620C连接至储存槽621A/621B/621C。沉降槽606A/606B/606C与分离槽604A/604B/604C连接,并且在离心过程中,在入射流体样本中待收集的目标物或细胞可流入分离槽604A/604B/604C,而流体样本中不收集的部分会流入沉降槽604A/604B/604C。分离槽604A/604B/604C的一端物理连接汇流点622A/622B/622C。待收集的目标物或细胞流经分离槽604A/604B/604C,经由汇流点622A/622B/622C,进一步流入与凹槽650A/650B/650C相连接的传送通道610A/610B/610C。汇流点622A/622B/622C垂直延伸(跨越两层)而与位于下层的分离槽604A/604B/604C及位于上层的传送通道610A/610B/610C相通。意即,自分离槽604A/604B/604C的一端分离的样本可藉由汇流点622A/622B/622C与传送通道610A/610B/610C接着流入横截的凹槽650A/650B/650C内(即由嵌入其中的收集元件来收集)。如前所述,收集元件200(如图1A所示)可在分离的样本于后续步骤收集完毕后自碟片的凹槽移除。
在图6A和图6C中,除了试剂入口620A/620B/620C和与试剂入口620A/620B/620C相连的储存槽621A/621B/621C,碟片600的各个处理部分A/B/C还包括与储存槽621A/621B/621C和汇流点622A/622B/622C相连接的连通通道624A/624B/624C,且清洗通道623A/623B/623C连接到汇流点622A/622B/622C。清洗缓冲液从清洗入口625(位于上层)载入,经由清洗通道623A/623B/623C流入传送通道610A/610B/610C(经过汇流点622A/622B/622C)以稀释样本或洗去残留物。在图6F中,清洗入口625实质上是三角形的开口(具有三个端部625A/625B/625C),位于碟片600的第二最上层且藉由位在碟片600最上层的中央开口朝向外部环境而暴露出一部分(如图6G所示)。清洗入口625的端部625A/625B/625C藉由穿过不同层的接点626A/626B/626C而分别与位在较下层的清洗通道623A/623B/623C相连接。清洗入口625和样本入口602A/602B/602C是位在不同层且具有不同尺寸的开口,但其是以同心的方式配置。
相同的反应试剂或是不同的反应试剂可藉由试剂入口620A/620B/620C分别载入至碟片600的储存槽621A/621B/621C,且储存槽621A/621B/621C延伸跨越两层(如图6B至图6C中所示)以保留载入至其内的试剂。试剂入口620A/620B/620C延伸通过所有的上方层且开口朝向外部环境,使得试剂能够从碟片600的最上层载入。
样本的流径起始于样本入口602A/602B/602C,沿着连结通道603A/603B/603C、分离槽604A/604B/604C,并且部分的样本(待收集的目标物或细胞)终止于嵌入至凹槽650A/650B/650C的收集元件200的收集槽206。当目标物或细胞被收集在收集元件的收集槽206内,可藉由注入试剂至碟片600执行进一步的处理以加工目标物或细胞。举例而言,藉由自试剂入口620A/620B/620C载入标记试剂,通过连通通道624A/624B/624C、汇流点622A/622B/622C、传送通道610A/610B/610C而流入收集元件的收集槽,目标细胞可在收集槽内被进一步标记。试剂的流径起始于试剂入口620A/620B/620C,经由连通通道624A/624B/624C、汇流点622A/622B/622C、传送通道610A/610B/610C而终止于嵌入至凹槽650A/650B/650C的收集元件的收集槽,并无进入到分离槽内。
根据本发明实施例的样本处理套组可藉由将上述的微流碟片100、微流碟片500或微流碟片600与上述的收集元件200、收集元件200A或收集元件200B随意地组装而制得。根据本发明实施例的样本处理套组可使用自动工作站共同操作。图7是根据本发明实施例的自动工作站说明示意图。自动工作站400包括至少一个蠕动泵(peristaltic pump)410、旋转平台(rotation platform)420以及夹紧阀(pinch valve)V1至V6。外部的蠕动泵410可驱动流体或缓冲溶液,以提供血液样本稳定的流率。夹紧阀V1至V6允许快速的流体输送及关断(shut-off),以致整个工作站可以轻易地程式化。旋转平台420可由马达提供动力,以使样本处理套组(微流碟片以及收集元件)于高速下旋转而得到高生产率支配(throughput handing)。自动工作站400接受连续的流体输入,藉由蠕动泵持续推送流体样本(例如血液样本)与缓冲液,并在碟片运转期间持续注入血液样本。自动工作站400的流动机制(flow mechanism)如图7所示,而流向是由箭头所标记。举例而言,夹紧阀V1至V4分别控制了血液样本、第一缓冲液、试剂溶液以及第二缓冲液的载入。藉由泵410的驱动,夹紧阀V2和夹紧阀V5松开(unlocking)而使血液样本注入至内部的样本入口。又藉由泵410的驱动,夹紧阀V4和夹紧阀V6松开而使试剂溶液注入至外部的试剂入口。试剂溶液可包括一或多种荧光染料、抗体、免疫标示物或甚至标记磁珠(labeled magnetic beads)。
根据本实施例所揭示的自动离心系统,连续流动(continuous-flow)微流的运作可提供显著的优点,包括大量样本体积(上至20毫升)、简易施作以及降低污染。如先前所述,样本入口与试剂入口的相对位置可以同心或偏心(eccentric)的方式配置,而离心碟片可藉由位于碟片的中心部的旋转轴或不具有旋转主轴而旋转。
自动工作站的流体样本(例如包含轻细胞与重细胞的血液样本)的处理步骤可概括如下:引进血液样本至自动工作站内的微流碟片;藉由旋转平台旋转样本处理套组(微流碟片以及收集元件),以驱动血液样本径向地向外流动至分离槽,其中血液样本的轻细胞流动至收集元件的收集槽,而重细胞沉淀至微流碟片的沉降槽;以及藉由自微流碟片移除收集元件以进一步实验或观察,而由收集槽收集轻细胞。运作细节可如以下步骤举例说明:
(a)将血液样本、Ficoll-paqueTM plus溶液、缓冲液以及试剂溶液填入至贮藏管。
(b)样本处理套组(微流碟片100、微流碟片500或微流碟片600以及收集元件200、收集元件200’、收集元件200A、收集元件200B)于每分钟转速2000至4000转下旋转。
(c)旋转期间,以每分钟流速50至5000微升(μl)自样本入口载入并推送Ficoll-paqueTM plus溶液至碟片。
(d)以每分钟流速50至5000微升自清洗入口载入并推送PBS/缓冲液至碟片。
(e)以每分钟流速50至2000微升载入并推送血液样本(混合缓冲液)至碟片。
(f)以每分钟流速50至5000微升自清洗入口载入并推送推送PBS/缓冲液至碟片。
(g)自试剂入口,以每分钟流速50至3000微升载入并推送20至1000微升的试剂溶液至碟片。
(h)样本处理套组(微流碟片以及收集元件)于每分钟转速0至500转下旋转10至60分钟,用于培养。
(i)样本处理套组(微流碟片以及收集元件)于每分钟转速1000至5000转下旋转。
(j)以每分钟流速50至5000微升自清洗入口载入并推送PBS/缓冲液至碟片。
(k)停止旋转并自微流碟片取出收集元件以观察或进一步实验。收集槽内收集到的细胞可直接观察或是取出以进行其他测试或分析。
为具体描绘碟片平台(disk platform)的效能,在实验中使用少量的特定癌细胞株来代表目标细胞。所使用细胞株为乳癌细胞株MCF7与MDA-MB-231、摄护腺癌细胞株PC3、肝癌细胞株(hepatoma cell lines)HEP3B与PLC5以及结肠直肠癌细胞株(colorectal cancer cell line)Colo205。血液样本是从健康人体的自愿者所收集,大约100至200个癌细胞被混合至2毫升的血液中以模拟人体环境中稀罕细胞的存在情况。
为决定碟片平台的理想流速,以抗体anti-EpCAM-PE所标记的细胞株MCF7与1毫升的血液掺杂混合的样本来进行实验。图8示出在碟片平台使用微流碟片100来分离回收细胞株MCF7时,样本处理套组中微流碟片100的流速与细胞株MCF7的回收率(recovery ratio)之间的关系。结果指出本实验样本处理套组中微流碟片的理想流速为每分钟500微升,且细胞回收率(即收获量)大约为0.9(90%)。利用每分钟500微升的流速来进行进一步的实验,以针对了不同种类的癌细胞株进行测试。图9示出不同种类的细胞株的回收率。在碟片平台使用微流碟片100针对不同种类的癌细胞株的细胞回收率在60%至90%之间,通常是高于70%。在碟片平台使用微流碟片500或微流碟片600所观察到的比较结果中,对于细胞株MCF7的分离回收率约为70%。这些结果说明了本发明的样本处理套组(微流碟片以及收集元件)可自该些血液样本中有效地分离以及收集非常少量的细胞(亦即稀罕细胞)。具体而言,利用样本处理套组对于不同细胞株的细胞回收率分别是:对于摄护腺癌细胞株PC3达90%以上、对于肝癌细胞株HEP3B与PLC5约为80%、对于乳癌细胞株MCF7和结肠直肠癌细胞株Colo205约为70-80%以及对于乳癌细胞株MDA-MB-231约达60-70%。
此外,将标记试剂注入收集元件用以标记所收集到的细胞的标记效果也经过测试,发现使用微流碟片100、微流碟片500和微流碟片600所观察到的细胞株的标记效果均令人满意。
与先前可透过免疫亲合(immuno-affinity)分离法从血液中分离出特定细胞的微流装置相比,本发明的样本处理套组可有效的捕捉具有相对低的抗原表现(antigen expression)水准的细胞株(例如MDA-MB-231)。此表示在前面实施例中所揭示的使用密度梯度分离的样本处理套组,可有效地单独分离具有肿瘤细胞标记表现量(expression level)的目标细胞。
由于本发明的样本处理套组所包括的收集元件可在离心期间于原位(in situ)收集样本,并且可将收集到的样本保留在收集元件内部,而不需要从收集元件中取出或者移出作进一步处理,因此不必担心收集样本受到污染或是损耗。此可显著提升稀罕样本或是极少量样本的可加工性。
本发明的先进的样本处理套组可应用于生物实验、生化测试及医药检验的领域。本发明的样本处理套组与全自动样本制备相容,而且其可容纳的样本体积可视需求调整改变(范围变动弹性在0.1至20毫升之间)。本发明的样本处理套组可达到上至60%至90%稀少样本(scarce samples)的高回收率。进一步来说,本发明利用微流离心碟片的样本处理套组利用了连续密度梯度分离与复合标示标记的技术。
虽然本发明已以实施例揭示如上,然其并非用以限定本发明,任何所属技术领域中具有通常知识者,在不脱离本发明的精神和范围内,当可作些许的更动与润饰,故本发明的保护范围当视后附的申请专利范围所界定者为准。附图不必然依比例示出。由于制造的过程与公差,在本揭示中美术的重现与实际装置之间是有所区别的。本发明的其他实施例可能未被具体示出。因此,本说明书与附图应视为例示,而非用以限制本发明。可适应于本发明的标的、精神及范围的特定情况、材料、物质的组成、方法或过程进行修改。所有的修改都意图限定于所附的权利要求范围之内。虽然在此所公开的方法已参照在特定的顺序下执行特定的操作,将被理解的是,这些操作也可以组合、细分或重新排序,以在不脱离本发明的教示下形成等效的方法。
权利要求书(按照条约第19条的修改)
1.一种样本处理套组,包括至少一离心微流元件以及至少一收集元件,其中所述至少一离心微流元件包括:
样本入口,用以载入生物样本至所述离心微流元件中;
分离槽,连接所述样本入口;
沉降槽,其中所述沉降槽连接所述分离槽并且从所述分离槽径向地向外配置;以及
嵌合部位,用以容纳所述至少一收集元件,
其中所述至少一收集元件与所述至少一离心微流元件为分离的元件,并且当所述至少一收集元件以可拆卸的方式嵌入所述至少一离心微流元件的所述嵌合部位时,所述至少一收集元件的所述至少一收集元件与所述至少一离心微流元件的所述分离槽相连接,所述至少一收集元件其上具有进入口,用以接收经由所述至少一离心微流元件处理过的所述生物样本,并且在接收处理过的所述生物样本后,所述至少一收集元件会与所述至少一离心微流元件的所述嵌合部位分开。
2.根据权利要求1所述的样本处理套组,其中所述收集元件包括芯片主体,所述芯片主体其上具有所述进入口且其内部具有收集槽,且所述进入口通向所述收集槽,以使得经由所述至少一离心微流元件处理过的所述生物样本流入所述收集槽中。
3.根据权利要求2所述的样本处理套组,其中所述生物样本的流径起始于所述样本入口,实质上流经所述分离槽并且终止于所述至少一收集元件的所述收集槽中。
4.根据权利要求1所述的样本处理套组,其中所述至少一离心微流元件还包括试剂入口用以载入试剂,且所述试剂入口经由连结通道连接至所述至少一收集元件。
5.根据权利要求4所述的样本处理套组,其中所述试剂的流径起始于所述试剂入口,经由所述连结通道并且终止于所述至少一收集元件的所述收集槽中。
6.根据权利要求1所述的样本处理套组,其中所述样本处理套组包括多个离心微流元件以及多个收集元件分别嵌入所述离心微流元件的所述嵌合部位。
7.根据权利要求6所述的样本处理套组,其中所述至少一离心微流元件还包括试剂入口用以载入试剂;储存槽,用以接收来自所述试剂入口的所述试剂;以及连结通道,将所述储存槽连接至所述至少一收集元件。
8.根据权利要求7所述的样本处理套组,其中所述试剂的流径起始于所述试剂入口,经由所述储存槽和所述连结通道并且终止于所述至少一收集元件的所述收集槽中。
9.根据权利要求6所述的样本处理套组,其中所述至少一离心微流元件还包括清洗入口用以载入缓冲液,且所述清洗入口经由清洗通道连接至所述至少一收集元件,且所述清洗入口和所述样本入口位于所述至少一离心微流元件的不同层。
10.根据权利要求1所述的样本处理套组,其中所述嵌合部位位于自所述样本入口径向地向外且所述至少一离心微流元件的周围部分,并且所述至少一收集元件嵌入所述嵌合部位。
11.根据权利要求10所述的样本处理套组,其中嵌入所述嵌合部位的所述至少一收集元件的厚度方向实质上垂直于所述至少一离心微流元件的厚度方向。
12.根据权利要求1所述的样本处理套组,其中所述嵌合部位位于自所述样本入口径向地向外且所述至少一离心微流元件的边缘部分,并且所述至少一收集元件嵌入所述嵌合部位。
13.根据权利要求12所述的样本处理套组,其中嵌入所述嵌合部位的所述至少一收集元件的厚度方向实质上垂直于所述至少一离心微流元件的厚度方向。
14.根据权利要求1所述的样本处理套组,其中所述生物样本是生物流体,并且所述样本处理套组利用密度梯度分离以收集来自所述生物流体的细胞。
15.一种收集元件,可应用于样本处理套组的离心微流元件,所述收集元件包括芯片主体,所述芯片主体其上具有进入口且其内部具有收集槽,其中所述收集槽具有所述进入口以接收经由所述离心微流元件处理过的生物样本,所述收集元件以可拆卸的方式嵌入所述离心微流元件的嵌合部位,所述收集元件与所述离心微流元件为分离的元件,并且经由所述离心微流元件的分离槽处理过的所述生物样本会由所述收集元件的所述收集槽收集。
16.根据权利要求15所述的收集元件,其中所述收集槽接收化学物载入至所述离心微流元件,且所述化学物会与位于所述收集元件的所述收集槽中的经处理过的所述生物样本进行反应,且所述化学物包括选自一或多种的荧光染料、抗体、免疫标示物、量子点、磁珠、标记材料或样本制备材料。
17.根据权利要求15所述的收集元件,其中所述生物样本是生物流体,并且所述样本处理套组利用密度梯度分离以收集来自所述生物流体的细胞。
18.根据权利要求15所述的收集元件,其中所述芯片主体被开启而暴露所述收集槽以抽取样本。
19.根据权利要求15所述的收集元件,其中所述收集元件还包括至少一废料出口,且所述收集槽连接所述至少一废料出口以排放流体。
20.一种用于处理生物样本的样本处理套组,其中所述样本处理套组利用离心及密度梯度溶液将一或多种包含于血液样本中的生物成分分离,且所述血液样本会持续沿着流径流动,且所述样本处理套组的几何形状并非长圆柱管类的几何形状,而是实质上平面的几何形状,所述样本处理套组沿其平面并穿越其离心中心的最长长度实质上大于所述样本处理套组的厚度,且所述样本处理套组包括具有至少一样本入口的至少一离心微流元件和至少一样本收集元件,且所述至少一样本收集元件可物理性地拆卸并嵌入至所述至少一离心微流元件,且所述样本处理套组可在其内部不具有阀门的情况下于操作期间控制流体有顺序地流动。
- 还没有人留言评论。精彩留言会获得点赞!