用线粒体特化细胞治疗神经退行性疾病的医药组合物的制作方法
本非临时性申请依35U.S.C.§119(a)要求2014年9月11日递交的第62/049,030号美国专利申请的优先权,其通过引用被全部并入本申请。
技术领域
本发明有关于一种医药组合物,且特别有关于可有效地改善以及治疗神经退行性疾病,并增加活化细胞分化为类神经元细胞的比例的医药组合物。
背景技术:
由于经济发展与医疗卫生的进步,人类的平均寿命逐年攀升,人口结构的老化已是全球趋势。根据联合国统计数据显示,2012年全球人口达70.8亿,65岁以上人口占全球的7.9%,已是世界卫生组织(WHO)所定义的老龄化社会(Aging society)。伴随着老龄化人口的增加,神经退行性疾病的人数亦同样快速增长,目前全世界至少有400万人罹患这种疾病。然而,神经退行性疾病并非好发于老年人,约一半的患者在60岁以后发病,另一半则于60岁之前发病。神经退行性疾病是一种大脑和脊髓的细胞神经元细胞退化的疾病状态,由其神经元突触或其髓鞘的功能丧失导致,将导致功能障碍、行动不便或死亡。
帕金森氏病是一种较常在老年人中出现的神经性疾病,发病年龄以五十至七十九岁最常见。而其病理特征为中脑的黑质组织内的多巴胺细胞退化死亡,正常黑质组织内约含二十万个多巴胺神经细胞,多巴胺神经可分泌多巴胺,专司控制运动的协调。这些神经少许的退化并不会引起任何运动的不协调,但当退化超过50%时,便开始出现轻微症状,包括肢体颤抖、僵直及动作缓慢。神经退化愈多,则上述症状会愈严重,最终至完全需人照顾的病废状态;最后可能因呼吸道、泌尿道、褥疮的感染而死亡。
目前,在帕金森氏症的发病初期通过药物治疗供给多巴胺神经多巴胺药物,以便制造出更多的多巴胺来弥补退化的神经所减少的制造量。早期的帕金森氏症患者对于多巴药物的疗效反应皆相当不错。但由于帕金森氏症为进行性的疾病,多巴胺神经一直在死亡,以至多巴药物会愈服用愈多,然后药效愈来愈差,症状就愈来愈严重。许多患者在服用药物几年后,便会出现药物的副作用,包括幻觉、恶心、肠胃不适,甚至全身不自主的肢体舞蹈等。由于药物治疗于后期已无法控制严重患者的症状,因此需用外科手术来改善患者的生活质量。其中,手术治疗则可细分为以下三种形式:(1)烧灼切开术,也就是把脑部某些小区域加热至80℃,时间为80秒,使局部的神经细胞失去功能,这些区域包括苍白球、视丘以及视丘下核等;(2)埋入电极,与烧灼破坏效果类似,其原理为当电极通电后,局部的神经细胞就会失去功能;以及(3)干细胞治疗手术,其原理就是补充退化的多巴胺细胞,便会一直增长,使脑内多巴胺细胞增多,改善帕金森氏症的症状。
虽然,过去已有文献揭露可利用移植干细胞来治疗帕金森氏症,虽然可以改善帕金森氏症的症状,然而效果并没有到达治愈的程度。主要原因包括干细胞给予到体内之后因免疫反应而存活率不佳,以及干细胞给予到体内之后分化为多巴胺神经元的比例偏低(Cave等,2014)。
技术实现要素:
有鉴于上述先前技术所存在的问题,本发明提供一种医药组合物,该医药组合物包含线粒体特化细胞(MitoCell),其中该线粒体特化细胞为当归萃取物预先处理的脂肪干细胞,使脂肪干细胞于体外时就已趋向类神经元细胞的方向。线粒体特化细胞被给予到体内之后分化为类神经元细胞的比例增加。本发明医药组合物可有效提高于体内分化为类神经细胞的比例并降低所引起的免疫反应,并达到治疗帕金森氏症的目的。
本发明提供一种线粒体特化细胞的培养基,该培养基包含当归萃取物。
在本发明的一个实施例中,其中,当归萃取物包含丁烯基苯酞(butylidenephthalide)。
本发明提供一种线粒体特化细胞的制备方法,包含以当归萃取物对干细胞进行前处理。
本发明还提供一种线粒体特化细胞,该线粒体特化细胞为经当归萃取物处理的干细胞。
在本发明的一个实施例中,其中,线粒体特化细胞为干细胞。
在本发明的一个实施例中,其中,线粒体特化细胞为脂肪干细胞。
在本发明的一个实施例中,其中,根据JC-1荧光染色结果,线粒体特化细胞的线粒体膜电位的红/绿荧光比为6.5~2.7。
本发明另外提供一种增加类神经元的医药组合物,该医药组合物包含50%~90%的线粒体特化细胞。
本发明同时提供一种治疗神经退行性疾病的方法,该方法包括以下步骤:将线粒体特化细胞给予至个体的脑部中。
附图说明
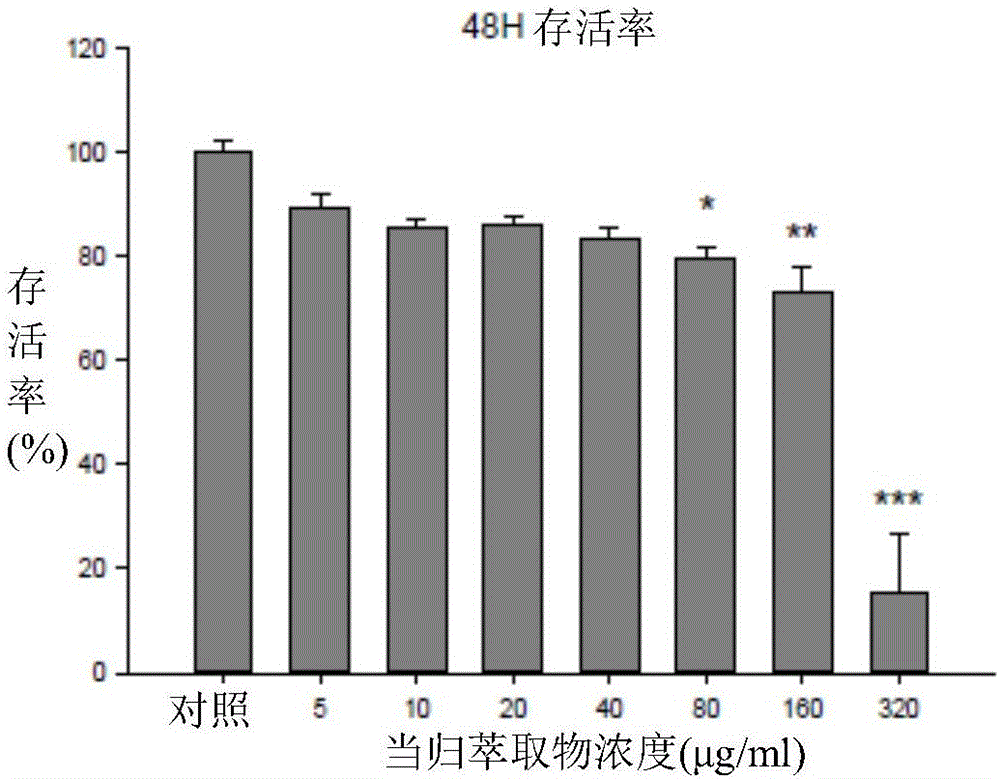
图1A-图1B显示脂肪干细胞在不同浓度的当归萃取物下的存活率。
图2显示脂肪干细胞在不同浓度的当归萃取物下的类神经元分泌的Nurr1、BDNF增高,代表脂肪干细胞呈现分化为神经细胞的命运走向;而SDF1上升则代表干细胞归巢(homing)能力增加,而IL-8基因表达下降则代表发炎反应降低。
图3A显示线粒体特化细胞的线粒体的蓝/绿荧光比降低,因此,线粒体特化细胞(MitoCell)的线粒体膜电位已与正常细胞的线粒体膜电位不相同,图3B呈现此线粒体特化细胞仍具有干细胞的必要特性(CD44/CD105)。
图4A-图4B显示平衡木测试结果。结果显示,在给予脂肪干细胞(第3组)或线粒体特化细胞(MitoCell)(第4组)后的小鼠明显增加平衡能力,第4组的效果比第3组的效果好。
图5显示旋转轮测试结果。结果显示,在给予脂肪干细胞(第3组)或线粒体特化细胞(MitoCell)(第4组)后的小鼠可恢复小鼠的平衡与协调能力,第4组的效果比第3组的效果好。
图6A-图6C显示八通道穿梭箱实验结果,结果显示,在给予脂肪干细胞(第3组)或线粒体特化细胞(MitoCell)(第4组)后的小鼠可以明显看到其行为能力的恢复,第4组的效果比第3组的效果好。
图7显示大脑切片H&E(Hematoxylin and Eosin)染色结果,结果显示将脂肪干细胞和线粒体特化细胞注射给予后,对神经细胞并无任何毒性及不会促进大脑的炎症反应。
具体实施方式
本发明关于一种创新的融合蛋白,其包含一生物活性分子以及部份的免疫球蛋白分子。本发明各方面涉及融合蛋白、包含其的组合物以及制造与使用所揭露的融合蛋白的方法。揭露的融合蛋白应用于延长生物分子在生物中的血清半衰期。
以下提供详细说明以协助本领域具通常知识者实施本发明。本领域具通常知识者可理解以下说明的实施例的调整或变化,在不偏离此处所包含的精神或范畴的情况下,被包含于本发明中。本发明说明中使用的术语仅是用于叙述特定的实施例而非意图用作本发明的限制。以下使用的段落标题是为了组织化的目的而非作为说明的内容的限制。
当归可通过冷冻干燥、喷雾干燥、蒸发或加热干燥等程序进行干燥。在本发明中,当归可为主根、侧根或纤维。当归可利用溶剂进行萃取,以获得当归萃取物。例如,可使用超临界流体萃取、水萃取或有机溶剂萃取方法。本发明的当归萃取物较佳含有丁烯基苯酞(butylidenephthalide)。
本发明所述的“干细胞”是指细胞在未分化或部分分化的状态下,具有自我更新的特性,并可具有分化成多种细胞类型的发育潜能,而没有关于发育潜能的特定暗示的意义。“干细胞”包括胚胎干细胞或成体干细胞。成体干细胞可分离自各种成体组织,包括血液、骨髓、脑、嗅上皮、皮肤、胰腺、骨骼肌和心脏肌肉。本发明的干细胞包括但不限于脂肪干细胞、神经干细胞、神经嵴干细胞、间质干细胞、造血干细胞、胰干细胞、皮肤干细胞、胚胎干细胞、内皮干细胞、肝脏干细胞、肠上皮干细胞及生殖干细胞,较佳为脂肪干细胞。
本发明提供了线粒体特化细胞。本发明的线粒体特化细胞通过如下的处理而获得:将干细胞用含有本发明的当归萃取物和/或丁烯基苯酞的培养基处理至少1小时、较佳为2、3、4、5、6、7、8、9、10、15、20或24小时以上、更佳为1、2、3、4、5、6、7、8、9或10天以上。
应注意的是,线粒体特化细胞在经当归萃取物处理后,仍具有干细胞的特征。此外,线粒体特化细胞在小鼠体内可分化为类神经元细胞。
当干细胞经当归萃取物处理时,细胞的线粒体活化,但所述干细胞仍具有干细胞的特性。例如,在处理前、后,在所有经处理的干细胞中均能检测到CD44+/CD105+表面标记。
本发明提供一种线粒体特化细胞的制备方法,包括于培养基中培养干细胞,其中,该培养基含有当归萃取物。
本发明另外提供一种线粒体特化细胞用于制备治疗退行性疾病的医药组合物的用途,其特征在于通过注射方式,使线粒体特化细胞进入个体脑部。
本发明另外提供一种治疗神经退行性疾病的医药组合物。本发明的医药组合物包含线粒体特化细胞,其中该医药组合物包含活性剂量为约50%~90%的线粒体特化细胞、最佳活性剂量为80%~90%的线粒体特化细胞。
本发明医药组合物可有效地促进脑部神经元细胞的数量及质量,以增加个体的平衡与协调能力。本发明所述的个体为人类或非人类动物(如,小鼠、狗、猫、羊、牛、马、猴子等),较佳为人类。
更重要的是,本发明的线粒体特化细胞不仅可显著地提高多巴胺神经元细胞的数量,更重要的是,还可降低给予线粒体特化细胞所产生的免疫反应。线粒体特化细胞优于未经处理的干细胞。
本发明的医药组合物可单独给药,或是与其它神经元退行性神经疾病的治疗方法或治疗药物组合。
综上所述,本发明的线粒体特化细胞可增加多巴胺神经元细胞(特别处于中脑黑质区),具有治疗老年神经退化相关疾病(例如帕金森氏症及阿尔茨海默症等)的作用。此外,将本发明的线粒体特化细胞给予至体内所产生的免疫排斥反应比将脂肪干细胞给予至体内所产生的免疫反应低。
本发明额外的特定实施例包括但不限于以下。
实施例1.线粒体特化细胞(MitoCell)的培养及前处理
线粒体特化细胞(MitoCell)是将脂肪干细胞培养于脂肪干细胞培养液中制备而得到的,其中,脂肪干细胞培养液包含Keratinocyte-SFM(1X)Liquid(Gibco)、牛垂体提取物(Gibco)、EGF(Gibco)、N-乙酰-L-半胱氨酸(Sigma)、L-抗坏血酸2-磷酸酯镁水合物(Sigma)、胎牛血清(HyClone)(10%),并含有0、5、10、20、40、80、160和320μg/ml的当归萃取物,其中包含所述的丁烯基苯酞。此外,以下所述的线粒体特化细胞均为经当归萃取物处理后的脂肪干细胞。
参照图1,在培养24小时后,当归萃取物浓度大于160μg/mL时,线粒体特化细胞的存活率下降。在培养48小时后,当归萃取物浓度大于80μg/mL时,线粒体特化细胞的存活率会下降。
另外,将脂肪干细胞分别培养于0、0.3125、0.625、1.25、2.5、5和20μg/mL的当归萃取物中。线粒体特化细胞中的Nurr1、BDNF、SDF1、IL-8基因的表达量被检测,用以找出最适合处理的剂量。
参照图2,在高浓度(20μg/mL)的当归萃取物下,Nurr1、BDNF与SDF1基因的表达量增加,但IL-8基因的表达会受到抑制。
参照图3,图3A显示线粒体特化细胞的线粒体的JC-1染色红/绿荧光比例改变。特化细胞的线粒体膜的电位能已有明显改变;图3B显示由流式细胞仪检测线粒体特化细胞。线粒体特化细胞具有CD44+/CD105+表达,显示线粒体特化细胞仍具干细胞特性。20μg/mL的当归萃取物被选择进行后续实验。
实施例2.诱导帕金森氏症小鼠模型的建立
以八周龄,体重约25克左右的C57BL/6雄性小鼠被购买作实验对象。小鼠分笼为四组后给予数天适应期,避免小鼠因紧迫、焦虑影响实验进行与结果。进行实验的前一天,先进行神经行为学观察分析。手术前10分钟给予小鼠4%水合氯醛(cholra hydrate),剂量是1mL/g/kg体重。小鼠体重大约都在25克,故每次都会给予0.25毫升的4%水合氯醛。此外,给予异氟醚(isoflurane)以麻醉小鼠,避免小鼠在手术期间苏醒。
将1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)用生理食盐水溶解以用于在小鼠中诱发帕金森氏症,经由换算,每只小鼠以腹腔注射(I.P.)的方式给予MPTP,一天注射4次,间隔2小时,剂量为20mg/kg。并以1x106个细胞/每只给予帕金森氏症的实验组别,如表1所示。
(1)第1组:对照组,不注射MPTP;
(2)第2组:阴性对照组,注射MPTP诱导帕金森氏症后向脑部给予生理盐水;
(3)第3组:实验组,注射MPTP诱导帕金森氏症后向脑部给予1x106个脂肪干细胞;
(4)第4组:实验组,注射MPTP诱导帕金森氏症后向脑部给予1x106个线粒体特化细胞。
实施例3.手术前/后神经行为学分析
3.1平衡木测试
平衡木测试(Beam walking analysis)用来测量小鼠的平衡能力,将小鼠放至于80cm的平衡木上,记录小鼠通过平衡木的时间以及后脚滑掉的次数,以分析小鼠的平衡和协调。测试时间为60秒,若超过60秒小鼠仍无法通过平衡木,仍以60秒计算。
参照图4A,小鼠注射MPTP以诱导帕金森氏症(第2组)后,无法完成平衡木测试。在给予脂肪干细胞或线粒体特化细胞后(第3组、第4组),明显增加小鼠的平衡能力。
参照图4B,小鼠注射MPTP以诱导帕金森氏症(第2组)后,其跌倒的次数增加。在给予脂肪干细胞或线粒体特化细胞后(第3组、第4组),明显降低小鼠跌倒的次数。
由实验结果发现,线粒体特化细胞(第3组)相较于脂肪干细胞(第4组)对予的小鼠具有较佳的治疗效果。
3.2旋转轮测试
旋转轮测试(Rotarod analysis)同样用来测量小鼠的平衡与协调能力,在测试的前一周,我们将把小鼠放至滚轮上训练,直至小鼠在滚轮上的时间能够超过三分钟,手术后,再利用旋转轮测试评估小鼠治疗之后恢复的平衡能力,滚轮的速度为5rpm。
参照图5A、图5B,小鼠在注射MPTP以诱导帕金森氏症(第2组)后,其平衡与协调能力明显下降。然而,在给予脂肪干细胞或线粒体特化细胞后(第3组、第4组),可恢复小鼠的平衡与协调能力,较佳为给予线粒体特化细胞的小鼠(第4组)。
3.3八通道穿梭箱实验(Locomotor activity box)
在进行监测前,先将小鼠放进采样箱等待10至20分钟使其适应。八通道穿梭箱连接计算机,经由感应显示并记录小鼠在30分钟期间的走动(水平位移)、抬头或攀爬(垂直位移)、以及整体总位移的数据,之后汇整数据进行统计分析。
参照图6A、图6B、图6C,小鼠在注射MPTP以诱导帕金森氏症(第2组)后,其平衡与协调能力明显下降。然而,在给予脂肪干细胞或线粒体特化细胞后(第3组、第4组),可恢复小鼠的垂直移动次数(图6A)、时间(图6B)和能力(图6C),较佳为给予线粒体特化细胞的小鼠(第4组)。
小鼠被采用过量麻醉的牺牲法(2至3倍的麻醉剂量),等待小鼠深度麻醉,开始利用盐水进行灌流,待血液皆冲出后,再用三聚甲醛(paraformaldehyde)灌流至四肢僵硬,进行脑部取出的动作。
将耳朵后面的皮肤用尖锐直剪刀剪开,再在头顶皮肤予以垂直剪开,以露出头骨,用剪刀在小鼠颈部上方剪开,使颈骨与小脑部分连接处断裂,小心将刀尖深入颅骨向鼻尖剪开,注意不要伤害到脑部。脑部底下掏空,取出整个脑,并且将鼠脑脱水,之后放置在切脑台上,在这之前切脑台可先放在冰上预凉以避免脑部损伤。
去除脑中的小脑与嗅球,将大脑左右两侧切成两部分,进行OCT(最佳切削温度;optimal cutting temperature)包埋,而后利用冷冻切片机得到鼠脑切片。
将取得鼠脑切片用H&E染色,观察注射脂肪干细胞和线粒体特化细胞的脑部细胞是否有受损或炎症反应,结果显示脑部细胞无受损及发炎反应发生(图7)。
- 还没有人留言评论。精彩留言会获得点赞!
- SeZn7MT3的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 纤维支架材料、其制备方法、及亚甲蓝负载量的调节方法与流程
- 大驳骨在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 花叶假杜鹃在制备预防和/或治疗神经退行性疾病的药物中的应用及药物的制造方法与工艺
- 大脑内稳态调节蛋白的组成、制备方法及其在防治阿尔茨海默症中的应用与流程
- 一种药物组合物及其制备方法和在制备防治神经退行性疾病的药物中的应用与流程
- 片层碳‑四氧化三铁复合体在抑制Aβ聚集中的应用的制造方法与工艺
- 一种干细胞球切割收集装置及干细胞球的切割分离传代方法与流程
- 一种具有改善记忆功效的多肽及其分离制备方法和应用与制造工艺
- 治疗或预防神经退行性病症的组合物和方法与制造工艺