培养的哺乳动物角膜缘干细胞、其产生方法和其用途与流程
本申请要求2014年6月27日提交的美国临时申请号62/018,396的权益,该美国临时申请以引用方式整体并入本文中。
在本申请中引用各种出版物。这些出版物的全部公开内容在此通过引用并入本申请中以更全面地描述本发明所属现有技术的状况。
本发明的领域涉及用于治疗眼科病症、疾病和损伤的方法和组合物。具体地说,本发明的领域涉及用于治疗角膜和眼部表面的病症、疾病、缺陷和损伤的方法、试剂盒和组合物。本公开涉及来源于角膜缘组织的培养的哺乳动物角膜缘干细胞的制剂。在优选的实施方案中,角膜缘干细胞系是自我更新的并且具有分化为角膜上皮组织的能力。还公开了用于培养角膜缘干细胞系的方法以及它们的使用的方法和组合物。
背景技术:
已知成体干细胞存在于眼的角巩膜缘中。这些细胞参与角膜表面的动态平衡并取代在眨眼期间蜕下并脱落的浅表上皮细胞。来自化学或热灼伤、接触透镜、若干微生物感染、多次手术程序、冷冻疗法或疾病如史蒂文-约翰逊综合征(steven-johnsonsyndrome)或眼部瘢痕类天疱疮对角膜缘干细胞的若干损伤可导致角膜缘干细胞的破坏和角膜缘干细胞缺乏,这可以导致异常的角膜表面、畏光和降低的视力(anderson等,(2001)br.j.opthalmol.85:567-575)。在不再次引入角膜缘干细胞来源的情况下,该损伤不能修复(tseng等,(1998)arch.opthalmol.116:431-41;tsai等,(2000)n.engl.j.med.343:86-93;henderson等,(2001)br.j.opthalmol.85:604-609)。因此,具有高增殖能力的角膜缘干细胞显然对于维持活力眼部表面至关重要,因为它们提供了维持角膜表面平衡所必需的角膜上皮细胞的连续供应(tseng,(1996)mol.biol.rep.23:47-58)。
已使用若干方法来尝试在角膜表面病损后恢复正常视力,然而这些方法通常不足以修复与角膜缘干细胞损失相关的损伤或由角膜缘干细胞损失所引起的损伤。一种常规的方法是通过将羊膜直接移植至受试者的眼的表面上来修复受损角膜表面。(anderson等,(2001)brj.opthalmol.85:567-575)。已发现羊膜移植促进上皮化,维持正常上皮表型,减少炎症,减少瘢痕形成,减少组织的粘附,并减少眼中的血管化。然而,羊膜移植具有并非总是成功的缺点,最终结局经常与患者的起始点区别不大(prabhasawat等,(1997)arch.ophthalmol115:1360-67)。hu等(wo00/73421)也公开了用于分离人羊膜上皮细胞并使它们分化为角膜表面上皮的方法。
治疗角膜损伤的另一方法涉及角膜移植。(lindstrom,(1986)n.engl.j.med.315:57-59)。治疗角膜缘干细胞缺乏的又一方法是将来自供体的眼的角膜缘移植片移植到接受者的眼中。
考虑到从活供体移出大角膜缘活检标本的缺点,已开发出用于治疗角膜缘干细胞缺乏的其它方法,所述方法依赖于从健康的眼仅取出角膜缘上皮的小活检标本(pellegrini等,(1997)lancet349:990-993),(koizumi等,(2000)invest.ophthalmol.vis.sci.41:2506-2513;koizumi等,(2000)cornea19:65-71;dua等,(2000)surv.ophthalmol.44:415-425;junshimazaki等,(2002)opthalmol.109:1285-1290)。利用羊膜的另一方法公开于美国公开号20030208266中,该美国公开描述了在特别处理的羊膜上离体培养的上皮干细胞的移植。
用于产生移植片的另一方法陈述于欧洲专利号0572364中,该欧洲专利公开了人眼表面上皮的活检标本的体外生长的方法,所述活检标本来源于眼的边缘区域和/或前缘(perlimbus)区域、或眼的forrinx区域和/或结膜区域。另一专利申请wo03/030959公开了用于治疗角膜病损的角膜修复装置,其使用具有用于培养角膜缘干细胞的改良表面的接触透镜。
相似地,美国公开号20020039788公开了用于治疗受损或患病角膜上皮表面的生物改造的复合移植片,其中所述复合移植片包含分化的上皮细胞的多层上皮。美国专利号6,610,538公开了从角膜缘干细胞培养物体外重建人上皮角膜层以用作用于患有眼部损伤的患者的移植片的方法。wo03/093457也公开了借助选择表达膜蛋白质标志物cd34或cd133的干细胞从角膜组织鉴别和分离干细胞的方法,这两种标志物均属于分化簇(cd)。
任何角膜缘细胞移植物的稳定性和成功均取决于其持续再生用于重新填充眼部表面的有活力的角膜缘干细胞的能力。目前用于治疗角膜缘干细胞缺乏的移植物或移植片通常含有高百分比的分化的角膜上皮细胞,而不是可能仅以有限量存在的角膜缘干细胞。由于角膜缘干细胞的供应有限,因此此类移植物或移植片中的供体上皮通常仅存活很短的时间。或者,移植物可产生明显的角膜上皮,但缺少足够的角膜缘干细胞导致异常上皮表面和愈合不良,导致无法修复眼部表面和改善视力。因此,这些意在向具有角膜缘干细胞缺乏的眼供应角膜缘干细胞的方法具有严重的局限性,这可能归因于存在于移植物或移植片中的有自我再生能力的未分化角膜缘干细胞的供应有限。因此,期望通过提供足够的具有再生和向眼持续供应角膜缘干细胞的能力的角膜缘干细胞群体来提供将更加成功地修复和重建眼部表面病损的移植物或移植片。
到目前为止,不存在能够完全改善角膜上皮损伤或诱导新角膜上皮细胞或角膜缘干细胞的生长和发育以替代受损或死亡细胞的治疗选择,这些措施中的任一种或全部都可以有助于患者恢复正常或接近正常的视力功能。因此,本发明的目标是向罹患眼科病症、疾病和损伤、特别是角膜病症、疾病和损伤的患者提供此类治疗选择。
技术实现要素:
本公开描述了来源于非胚胎组织、优选角膜缘组织的哺乳动物角膜缘干细胞(lsc)的培养。具体地说,本公开提供了培养的哺乳动物lsc,以及产生培养的哺乳动物lsc的方法,所述培养的哺乳动物lsc:(i)从角巩膜缘被分离,(ii)在体外培养中扩增,并且(iii)保持在体外培养中或在有需要的受试者的眼上治疗性地分化为谱系定型的角膜上皮细胞的潜力。
在某些实施方案中,lsc是在细胞外基质上的无饲养层的培养基中培养的培养细胞,所述培养基进一步补充有细胞培养基,所述细胞培养基至少包含最低必需培养基与任选的试剂如生长因子、血清和一种或多种可溶性因子。
本发明的角膜缘干细胞可从任何适合的哺乳动物分离。在一些实施方案中,本发明的角膜缘干细胞可从非接受者的供体分离。此类供体可以是与受试者生物相容的尸体或器官供体。在一些实施方案中,本发明的角膜缘干细胞可从也是接受者的供体分离,使得接受者和供体可以是相同的个体或受试者。
角膜缘干细胞的分离可在培养和扩增之前、培养和扩增期间或培养和扩增之后进行。在优选的实施方案中,解离的组织可用于分离本发明的lsc,然后将其扩增。
本发明的角膜缘干细胞可在支持角膜缘干细胞生长和扩增的培养基中培养。分离的lsc在用于大量传代的体外培养中保持基本上未分化。
在某些实施方案中,在适当的支持材料如细胞外基质或生物包覆的表面(例如细胞外基质载体或生物包覆的透镜)上培养本发明的角膜缘干细胞。表面材料可以是用如本文所述的一种或多种附着因子生物包覆的任何支持物。
本发明的角膜缘干细胞可以各种治疗方式利用,例如用于治疗有需要的患者的眼科病症、疾病或损伤的方法,所述方法包括向所述患者施用治疗有效量的包含分离的lsc细胞的一种或多种组合物。例如,本发明涵盖用于在有需要的患者或患有角膜缘干细胞缺陷的患者中刺激角膜上皮细胞增殖或再生的方法。
在本发明的一个实施方案中,向受试者提供适当的支持材料如细胞外基质或生物包覆的表面上的本发明的lsc细胞。所述支持材料可以是从头合成的或用于培养本发明的lsc的支持材料。例如,本发明的一个示例包括生物包覆的透镜套件上的培养的lsc。在替代实施方案中,从培养基分离本发明的lsc并且用细胞外基质、介质和其它材料将其提供给有需要的受试者。相似地,介质和其它因子可来源于培养基。在一个示例中,本发明的lsc可与其它试剂或治疗模式组合施用。在更具体的实施方案中,其它试剂是活性试剂。并且在最具体的实施方案中、活性剂包括生长因子、细胞因子、抑制剂、免疫抑制剂、类固醇、趋化因子、抗体、抗生素、抗真菌剂、抗病毒剂、丝裂霉素c或其它细胞类型。另一具体实施方案是其中其它治疗模式包括接触透镜、滴剂和用于递送lsc的其它眼科手段的实施方案。
本发明提供了lsc和用于制备角膜修复材料的材料,包括以下步骤:(1)从角膜缘干细胞悬浮物分离角膜缘干细胞;(2)上述步骤(1)包括从所述悬浮物获得角膜缘干细胞并接种在置于诱导培养基中的支架上以促进角膜缘干细胞分化为角膜上皮细胞。
在上述步骤(1)中,在一个实施方案中,角膜缘干细胞可通过以下方法获得:可对新鲜的角膜缘组织进行清洁,将其切成小片,并用0.2%胶原酶iv在37℃处理2-4小时以消化细胞团。角膜缘组织可在1-3%基质胶matrigel包覆的培养皿中在37℃进一步用0.25%胰蛋白酶和1mmedta以单细胞悬浮物的方式消化10到20分钟。
优选地,在另一实施方案中,胶原酶iv消化时间为3小时;0.25%胰蛋白酶和1mmedta消化时间为15分钟;matrigel浓度为2%。
此外,在再一实施方案中,在角膜缘干细胞悬浮物中,细胞浓度可以是约2×102~8×102/ul。
另外,在本发明的一个实施方案中,在步骤(2)中,支架可以是生物来源的材料或无细胞的透镜。
在又一实施方案中,在步骤(2)中,生物材料可以是细胞来源的胶原或matrigel羊膜。
另外,在一个实施方案中,在步骤(2)中,用于诱导的培养基是上皮细胞培养基cnt-30。
在另一实施方案中,在步骤(2)中,用于诱导培养的培养时间可以是约3到18天。优选地,在步骤(2)中,培养时间为约14~18天。
本发明还提供了用于制备用于角膜损伤的药物的角膜修复材料的上述处理。
从所附的说明书、实施例和权利要求来看,本发明的其它特征和优点将是显而易见的。本申请通篇引用的所有参考文献、待审专利申请和授权专利的内容在此以引用方式明确地并入。
附图说明
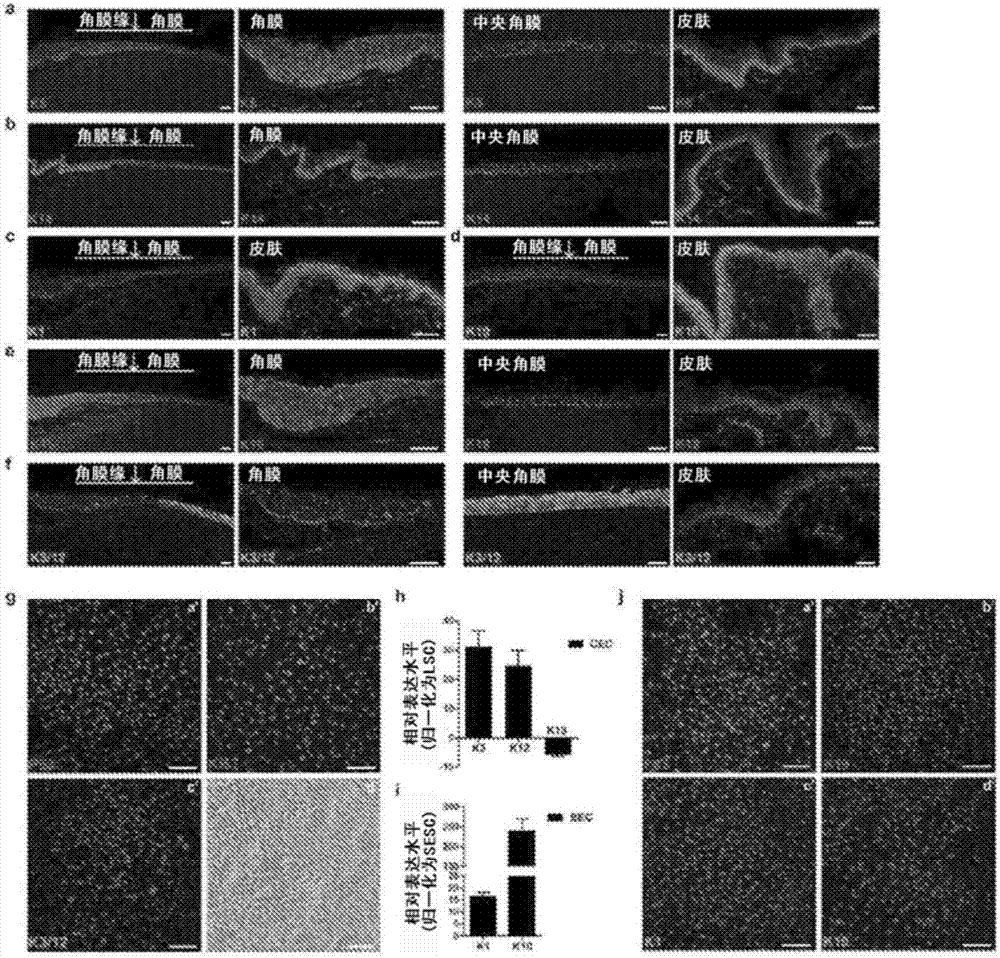
图1a-d.角膜上皮的正常变化和病理变化以及其与皮肤的比较。a,正常角膜-角膜缘连接处。通过k19和p63(也参见图2e)所鉴别的角膜缘以及通过k12所鉴别的角膜。b,通过基底层中的p63和k5/k14所鉴别的(参见图2a、图2b)且不存在k3/k12的正常皮肤表皮。c,通过k3/k12所标记的且不存在p63和k1/k10(也参见图2c、图2d、图2f)的正常中央角膜。d,具有异常表皮分化的角膜,其显示不存在k3/k12(a’)且存在皮肤上皮标志物p63(b’)和k5/k1/k10(c’-e’)。h&e染色,左图。比例尺:100μm。
图2a-j.lsc和sesc的角蛋白表达谱和细胞培养/3-d分化。a-f,人角膜缘、角膜和皮肤表皮中的角蛋白表达谱。a、b,外周角膜-角膜缘连接处和皮肤组织,其显示在角膜缘和皮肤的基底细胞层中的阳性k5(a)和k14(b)表达,并且它们在中央角膜上皮中不存在。c-d,皮肤表皮,其显示阳性k1(c)和k10(d)表达,并且它们在角膜和角膜缘中不存在。e-f,外周角膜-角膜缘连接处,其显示角膜缘中的阳性k19和中央角膜上皮和皮肤中的阴性k19(e),以及仅在角膜中的阳性k3/k12和角膜缘和皮肤中的阴性k3/k12(f)。g-j,在第12次传代具有干细胞/祖细胞和sesc特征的培养的lsc以及3-d分化系统的验证。g,lsc的免疫荧光染色,其显示p63(a’)和ki67(b’)的阳性干细胞信号以及阴性分化的cec信号k3/12(c’),相差照片(d’);(h)qpcr分析,其显示与lsc相比,来自3-d分化测定的cec中的k3/k12上调和k19下调;i,与sesc(c)相比,来自3-d分化测定的sec中的k1/k10上调,全部n=3,p<0.01。j,培养的sesc的免疫荧光染色,其显示阳性p63(a’)以及角膜缘干细胞标志物k19(b’)和成熟皮肤上皮标志物k1/k10(c’、d’)的阴性信号。比例尺,100μm。
图3a-f.角膜缘和角膜处wnt7a和pax6的排他性表达。a-d,培养的lsc和sesc以及3-d分化的cec和sec的免疫荧光染色。左图,相差照片;lsc(a)中的63、k19和ki67,sesc(c)中的p63、k5和ki67,3-d培养球中的cec(b)和sec(d)中的k3/12、k1、k5、k10和k14。e,描绘在lsc、cec和sesc之间进行比较的差异基因表达的热点图。*表示wnt7a和pax6。f,角膜缘、角膜和皮肤(a’-d’)处wnt7a和pax6的免疫荧光染色。培养的lsc(e’、g’)和3-dcec球(f’、h’)中wnt7a和pax6的表达。缩写:lsc:角膜缘干细胞/祖细胞,sesc,皮肤上皮干细胞,cec,角膜上皮细胞,sec,皮肤上皮细胞。比例尺,100μm。
图4a-i.基因表达分析。a-c,lsc、cec和sesc的全基因组基因表达微阵列。a,来自比较lsc/cec与sesc的前100个重要基因。b,用显示出强相关性的qpcr分析对微阵列数据的验证。c,与sesc相比,lsc和cec中wnt7a和pax6表达的qpcr分析,全部n=3,p<0.05。d,1岁婴儿的角膜和角膜缘中wnt7a和pax6的表达。h&e染色(a’)加框区域显示于具有wnt7a(b’)、pax6(c’)和k3/12(d’)的免疫荧光染色的连续切片(b’-d’)中。比例尺,100μm
图5a-c.wnt7a和pax6是维持角膜细胞命运所必需的。a,人角膜上皮鳞状化生。红框(一对中的左框;或a’中的单个大框)指示化生区域,蓝框(一对中的右框)指示相对正常的角膜的区域;顶图:显示在基底层处具有阳性p63的典型皮肤表皮形态的h&e染色(a’,箭头指示p63染色),wnt7a(b’)和pax6(c’)的缺失伴随角膜k3/k12(d’)的不存在。顶图中由红框和蓝框标记的区域的连续切片呈现于下图中。b,wnt7a或pax6敲低的3-d分化细胞的免疫荧光;k1和k5,左图;pax6和k10,中图;k3/12,右图;c,wnt7a或pax6敲低的3-d分化细胞中角膜或皮肤上皮标志物的基因表达变化的定量pcr分析(全部n=3,p<0.05)。数据显示为平均值±s.d。比例尺,100μm。
图6a-e.人角膜疾病中皮肤表皮标志物的出现与角膜标志物的缺失。患有史蒂文-约翰逊综合征(a、b)、眼类天疱疮(c)、创伤损伤(d)和碱性灼伤(e)的患者的角膜中皮肤表皮标志物p63、k5和k10的出现与角膜标志物k3/12、pax6和wnt7a的缺失。对于所有图像,对角膜上皮鳞状化生的病灶实施h&e染色(a’)。b'-f’,连续切片中的同一病灶区域,其显示基底上层中增加的p63(b’、d’)和k5(c’、d’)和k10(e’),在区域(f’)中不能检测到wnt7a(e’)、k3/12或pax6。比例尺,100μm。
图7a-f.wnt7a/fzd5对lsc中的pax6表达的作用。a-c,wnt7a敲低对lsc中的pax6表达的作用。a,相差照片,其显示wnt7a和pax6敲低(shwnt7a和shpax6)在lsc和它们的3-d分化球中的作用。b,lsc中的wnt7a和pax6的基因表达变化的qpcr分析。wnt7a敲低降低pax6表达(n=3,p<0.01);pax6敲低中的wnt7a表达没有显著变化。c,通过蛋白质印迹分析对lsc中wnt7a和pax6的敲低效率的验证。d-f,wnt7a和fzd5充当pax6表达的上游调节物。d,相差照片,其显示lsc和3-d分化球中fzd5(shfzd5)敲低的细胞形态。e,lsc中wnt7a和fzd5的共免疫沉淀。f,具有fzd5敲低的lsc的3-d分化细胞(3-dshfzd5lsc)中角膜和皮肤上皮标志物的基因表达变化的qpcr分析。fzd5敲低不影响wnt7a表达;所有其它,n=3,p<0.05。比例尺,100μm。
图8a-c.pax6转导在lsc中的作用。a,具有pax6转导(pax6+)的sesc和3-d分化球的相差照片。b,通过蛋白质印迹法分析对3-d分化球中的k12和pax6表达的验证。c,具有pax6转导的3-d分化sesc(3-dpax6+sesc)中的皮肤特异性角蛋白k1/k10的缺失。比例尺,100μm。
图9a-e.通过pax6转导将sesc转化为角膜上皮样细胞。a,被转染的sesc中的pax6和p63的双重免疫荧光染色,k19在pax6转导的(pax6+)sesc中为阳性。b,3-d分化条件下k3/12和pax6+sesc的免疫荧光染色。c,pax6+sesc中角蛋白的基因表达的qpcr分析(全部n=3,p<0.05)。数据显示为平均值±s.d。d,cec、具有pax6敲低的分化的lsc(3-dshpax6lsc)、sec和具有pax6转导的分化的sesc(3-dpax6+sesc)之间的层次聚类分析。e,显示lsc正常分化为cec(a’)和所提出在角膜表面上皮细胞疾病中的如下机制(b’)的示意图,其中lsc中的wnt7a/pax6的缺失导致异常皮肤表皮样分化。比例尺,100μm。
图10a-c.rna-seq数据的定量信息。a,rna-seq样品的统计分析:包括每个样品的原始读数、作图读数和作图率。b,重复生物样品的成对比较。c,sec和3-dpax6+sesc之间、cec和3-dshpax6lsc之间的差异,全部fdr<0.001。a,具有pax6转导的兔sesc(rbpax6+sesc)或具有pax6敲低的lsc(rbshpax6lsc)中的pax6表达的qpcr分析(全部n=3,p<0.05)。我们注意到热点图中的一些微小差异,这可能是由于一些实验变更所致或者归因于以下可能性:尽管pax6表达在基因表达和功能水平两者上在很大程度上都决定了从sesc到cec的细胞命运转变(如我们在当前研究中所证实的),但这种单一转录因子可能不足以产生与cec完全相同的细胞。
图11a-f.pax6和兔lsc缺乏模型的工程化表达。a-e,兔sesc和pax6敲低的lsc中pax6的工程化表达的定量和培养。a,pax6转导的兔sesc(rbpax6+sesc)或pax6敲低的lsc(rbshpax6lsc)中的pax6表达的qpcr分析(全部n=3,p<0.05)。b,具有p63的阳性染色和pax6的阴性染色的兔sesc。左图,相差照片。c,上行,pax6转导的兔sesc中pax6和p63的双重免疫荧光染色。左上图,相差照片。底行,兔pax6+sesc进一步被gfp标记用于移植。d,具有p63和pax6的阳性染色的兔lsc。左上图,相差照片。e,pax6敲低的经gfp标记的兔lsc的培养。f,a’,进行结膜环状切开术并去除2mm前角膜缘结膜的周边条状物。b’-d’,进行板层巩膜和角膜剖分以沿着前角膜间质平面完全去除lsc和角膜上皮。剖分帽示于(d’,箭头)。e’-f’,暴露的角膜间质床被人羊膜(e’)和缝线(f’)覆盖。(n=3)。比例尺,100μm。
图12a-d.通过移植的经gfp标记的pax6+sesc对兔lsc缺乏模型进行的角膜上皮再生和修复。a,角膜上皮缺陷修复的时间过程。移植后15天:通过角膜表面的荧光素染色证明的降低的角膜清澈性与整个角膜上皮缺陷;移植后30天,角膜上皮缺陷的改善的角膜清澈性和降低的荧光素染色;移植后45天和90天:角膜清澈性的恢复和维持。b-c,用gfp标记的pax6+sesc移植后90d,兔角膜上皮表面的再生和修复的其它两个示例,其显示角膜上皮缺陷的完全修复和再上皮化。a-c,左起各图:角膜上皮的白光显微照片、裂隙灯显微照片和荧光素染色(注:角膜表面上的亮点归因于照相机光反射,它们不是上皮缺陷)。(n=5)。d,用gfp标记的pax6+sesc移植后90d,三只单独的兔中的角膜上皮表面的再生和修复的h&e染色,其显示完整的角膜上皮组织结构。
图13a-c.兔lsc缺乏模型中通过移植的角膜上皮再生。a,用gfp标记的pax6+sesc移植后,对兔lsc缺乏模型的角膜上皮再生和修复的时间过程。上图,移植后3天。左,显示混浊角膜的光学显微照片;右,角膜缘区域处的gfp+供体细胞(箭头)。下图,移植后20天。左,显示具有部分清澈性的角膜的光学显微照片;右,共同定位于透明区域中的gfp+供体(箭头)。比例尺,1mm。我们观察到,只有来自角膜缘区域的移植细胞可存活、增殖并使角膜表面上皮再生,这表明角膜缘含有有利于干细胞存活和生长的干细胞小生境。b,用gfp标记的pax6+sesc移植后90天,来自兔接受者的眼的角膜缘区域的重编程的供体gfp标记的pax6+sesc上皮细胞的培养和再分离。上图,pax6和gfp的双重免疫荧光染色;下图,pax6转导的兔sesc中的p63和gfp的双重免疫荧光染色。比例尺,100μmc,用gfp标记的pax6+sesc移植的角膜上的重复角膜上皮损伤的修复和恢复。上图,我们在pax6+lsc的初始移植后3个月医源性地刮除并去除供体来源的角膜上皮细胞,并且制造大的角膜表面上皮缺陷(箭头)。下图:在72h内观察到完全修复和恢复与愈合的上皮缺陷(n=3)。左图,光学显微照片;中图,裂隙灯显微照片;右图,荧光素染色。
图14a-g.对兔角膜缘干细胞缺乏模型的细胞移植和角膜上皮修复。a,移植后2个月的兔角膜的免疫荧光染色。上图,用gfp标记的pax6+sesc移植的角膜,其显示角膜表面上的阳性gfp信号以及角膜上皮标志物k3和k12的表达。下图,用gfp标记的shpax6-lsc移植的角膜,其显示阳性gfp信号和皮肤表皮上皮标志物k10的表达。比例尺,100μm。b-f,细胞移植后2个月的兔角膜(左图,h&e染色;中间两图,白光显微照片和裂隙灯显微照片;右图,角膜上皮表面的荧光素染料染色)。比例尺,100μm。b,具有典型角膜上皮组织结构的正常角膜和没有上皮缺陷的完整角膜表面。c,仅用人羊膜覆盖的裸露角膜,其显示上皮化生和具有血管化的不透明角膜的组织结构(n=4)。d-e,用gfp标记的lsc(d,n=3)和gfp标记的pax6+sesc(e,n=5)移植的角膜,其显示没有上皮缺陷的角膜上皮组织结构,即愈合和完整的角膜表面。f,用gfp标记的、经shpax6处理的lsc移植的角膜,其显示具有上皮缺陷的上皮化生、不透明且血管化的角膜表面的组织结构(n=4)。g,用gfp标记的pax6+sesc移植后3个月的兔角膜:具有阳性gfp信号(第二图,比例尺,1mm)的光滑、透明角膜(顶图)。第二组中的加框区域被放大以显示gfp(中图)、pax6(第四图)以及gfp-pax6两者(下图)的表达。比例尺,100μm。
图15a-e.不同胚胎阶段的小鼠角膜的pax6和p63表达模式。a,小鼠角膜中处于e12.5时的阳性pax6。p63是不可检测的。更高的放大倍数(左图)显示用苏木精和伊红(h&e)染色的角膜-角膜缘-结膜连接区域(红框)。b,在e14.5时,pax6表达在眼部区域(结膜、角膜缘和角膜组织,白色箭头)中是显著的,而p63在眼睑皮肤、角膜缘和角膜中为阳性。左图显示h&e染色。c和d,e16.5(c)和e18.5(d)时的小鼠角膜中的pax6和p63表达。右上图,h&e染色(左图)中的红框中所描绘的区域的pax6和p63染色,其显示在所有眼部组织中的pax6表达以及在角膜组织中的p63表达;右下图,更高放大倍数的通过黄框加框的区域。e,处于p1和p60的rosamt/mg;pax6-gfpcre小鼠的角膜上皮中的pax6的谱系追踪,rosamt/mg充当对照。比例尺=100μm。
图16a-b.人角膜和皮肤上皮的表征。a,通过pax6和k3/12所鉴别的且不存在p63、k5、k1和k10的角膜。b,通过p63、k5、k1和k10所鉴别的且不存在pax6和k3/12的皮肤表皮。左上图,h&e染色。比例尺=100μm。
图17a-c.人角膜缘区域和培养的人lsc和lsc的免疫荧光染色。a,通过pax和p63所鉴别的人角膜缘区域。左上图,角膜-角膜缘连接处(箭头)的h&e染色。b,用pax6和p63染色的培养的lsc。左图,相差。c,用p63和k5染色的培养的sesc。左图,相差。比例尺=100μm。
图18a-b.pax6是维持角膜细胞命运所必需的。a,显示人lsc和它们分化的细胞中pax6敲低的细胞形态和ki67染色的相差。b,与分化的lsc相比,在分化的pax6shrnalsc(shpax6-lsc)中角膜或皮肤上皮标志物的基因表达变化的定量pcr分析(n=3,p<0.05)。数据显示为平均值±s.d。比例尺=100μm。
图19a-b.患有角膜-角膜缘皮样瘤的患者中皮肤表皮标志物的出现与角膜标志物的缺失。a,患有典型角膜缘皮样瘤的患者(图a)和h&e染色(图b)。b,显示基底层中增加的p63(图a)和k5(图b)和k10(图c)的连续切片。不能检测到k3/12或pax6(图d)。比例尺=100μm。
图20a-c.鉴别到的参与lsc和sesc的信号途径。a,比较lsc和sesc在wnt、notch和tgf-β途径中的基因表达数据的热点图。对于热点图中的每个基因,红色和蓝色分别表示相对于所有样品中的平均表达水平的高表达和低表达。b,属于wnt和notch途径的基因之间遗传相互作用的图示。两个独立的lsc和sesc制剂中的平均表达值之间的倍数差异用于单个地对每个基因进行颜色编码(红色,lsc中的更高表达;蓝色,在sesc中更高)。选择与notch和wnt途径相关的基因子集。
具体实施方式
定义
术语“培养基”、“细胞培养基”或“细胞介质”用于描述其中生长细胞(例如干细胞、祖细胞或分化的细胞)的细胞生长培养基。培养基是本领域众所周知的并且至少包含最低必需培养基与任选的试剂,如生长因子(例如,包括成纤维细胞生长因子,优选碱性成纤维细胞生长因子(bfgf),和表皮生长因子(egf))、细胞因子(例如,白血病抑制因子(lif))、激素(例如,包括糖皮质激素(如氢化可的松)和甲状腺激素(如3,3’,5-三碘-l-甲状腺原氨酸))、葡萄糖、非必需氨基酸、谷氨酰胺、胰岛素、转铁蛋白、β巯基乙醇、rock抑制剂、霍乱毒素和本领域众所周知的其它试剂。此类培养基包括市售培养基如dmem/f12(1:1),其可补充有以下中的任一种或多种:l-谷氨酰胺、敲低无血清替代物(ksr)、胎牛血清(fbs)、非必需氨基酸、白血病抑制因子(lif)、表皮生长因子(egf)、β-巯基乙醇、碱性成纤维细胞生长因子(bfgf)、氢化可的松、3,3’,5-三碘-l-甲状腺原氨酸、rock抑制剂、抗生素、b27培养基补充剂和/或其它培养基补充剂。可用于本发明的细胞培养基是市售的并且可补充有购自invitrogen公司(gibco)和以色列biologicalindustries,bethhaemek以及众多其它商业来源的市售组分。
“lsc培养基”或“lsc维持培养基”是经配制用于体外稳定增殖角膜缘干细胞或祖细胞(lsc)或lsc样细胞的培养基。
“分化培养基”是经配制用于使干细胞或祖细胞体外分化为特定细胞谱系的细胞的培养基或细胞培养基。例如,“lsc分化培养基”可以是经配制用于使角膜缘干细胞或祖细胞或lsc样细胞体外分化为角膜上皮细胞(cec)或cec样细胞的培养基。
“无饲养层的培养基”是指用于培养目标细胞即lsc或sec的培养基不需要饲养细胞以允许所述细胞稳定增殖的实事。例如,在“无饲养层的培养基”(其中在培养中不存在饲养细胞层)中培养的lsc细胞能够分裂并维持为lsc。
“无血清”是指没有血清,血清是从动物或人获得的澄清的血液产物。
“无血清”培养基是没有血清的培养基。它可含有例如血清代用品或血清替代物。
“化学成分确定的”培养基(medium)或“化学成分确定的”培养介质是组分是化学确定的培养基。因此,它没有血清,血清是化学成分不确定的组分。为了培养需要血清的细胞或组织,“化学成分确定的”培养基通常含有代替血清的血清代用品或血清替代物。如果“化学成分确定的”培养基不含动物来源的产物或不含动物来源的外来产物,则它是“无异源物的”。它也可不含人来源的产物。通常期望用重组产生的材料、化学合成的材料或酶合成的材料替代动物来源或人来源的产物,这些材料没有先前的动物接触或暴露。
“干细胞”是展现自我更新、产生祖细胞的细胞,所述祖细胞可增殖并分化为终末分化细胞,终末分化细胞为有丝分裂后细胞。例如,角膜缘干细胞可分裂而产生角膜缘干细胞以及祖细胞。祖细胞可针对经历向例如角膜上皮细胞(cec)的分化(通过例如在适当的条件下体外培养)。
“角膜缘干细胞或祖细胞”或“lsc”包括从例如角膜缘,即眼的角膜和结膜之间的区域获得的干细胞。lsc可增殖并分化以产生角膜上皮细胞(cec)。具体地说,lsc被认为位于角膜缘内的lsc小生境中。可从边缘区域分离lsc,所述边缘区域包含眼的角膜缘、角膜和结膜的边缘、角膜和巩膜的边界、角巩膜缘、角膜缘上皮的基底层的隐窝区域、包含栅间表皮突的区域或包含vogt栅状皱纹的区域。
如本文所定义的“分离”是指将材料从其原始环境移出且因此“通过人力”使其从其天然状态被改变。
“分离的角膜缘干细胞或祖细胞”包括从个体分离并且置于离体或体外培养的lsc。通常,组织活检中的分离的lsc可被解离以获得单细胞。
如本文所用的“富集的”意指通过从混合物消除不想要的材料、或选择并分离期望的材料(即,从异源细胞群体分离具有特定细胞标志物的细胞,其中并非所述群体中的所有细胞均表达所述标志物)而选择性地浓缩或增加一种或多种材料的量。
如本文所用的术语“全能细胞”应具有以下含义。在哺乳动物中,全能细胞具有成为成体中的任何细胞类型;胚外膜(例如,胎盘)的任何细胞类型的潜力。全能细胞包括受精卵以及通过其裂解而产生的大约前4个细胞。
如本文所用的术语“多能干细胞”应具有以下含义。多能干细胞是具有在体内产生任何分化细胞的潜力的真正干细胞,但不能有助于产生来源于滋养层的胚外膜的组分。羊膜由上胚层而不是滋养层发育而来。迄今为止,已确认了三种类型的多能干细胞;胚胎干(es)细胞(在灵长类动物中也可以是全能的)、胚胎生殖(eg)细胞和胚胎癌(ec)细胞。这些ec细胞可从畸胎癌分离,畸胎癌是偶尔发生在胎儿的生殖腺中的肿瘤。与其它两种不同,它们通常是非整倍性的。
如本文所用的术语“多能干细胞”是真正的干细胞,但仅可分化为有限数目的类型。例如,骨髓含有产生所有血液细胞但可能不能分化为其它细胞类型的多能干细胞。
术语“无动物”当指代本文所述的某些组合物、生长条件、培养基等时,意指在某些组合物的制备、生长、培养、扩增、储存或配制或方法未使用非人动物来源的材料如牛血清、蛋白质、脂质、碳水化合物、核酸、维生素等。“未使用非人动物来源的材料”意指所述材料从未处于非人动物体或物质中或与其接触,因此它们未被异源物污染。
如本文所用的术语“饲养细胞”意指作为辅助物起作用的另外的细胞,其用于调节例如用于待增殖或分化的靶多能干细胞的培养条件。例如,饲养细胞,特别是动物饲养细胞如小鼠来源的原代培养成纤维细胞负责提供用于细胞粘附的支架和供应干细胞所需的生长因子。因此,“无饲养”或“无”饲养细胞意指在某些组合物的制备、生长、培养、扩增、储存或配制或方法未使用饲养细胞。
术语“扩增的”在指代细胞组合物时,意指细胞群体构成了比使用先前方法所获得的显著更高浓度的细胞。例如,“扩增的”群体相对于先前方法在每克组织的细胞数目方面具有至少2倍且最高达10倍的改进。术语“扩增的”意在仅涵盖其中已人为干预来提高细胞数目的那些情况。
如本文所用的术语“传代”意指以下的细胞培养技术,其中将组织培养器皿中已达到汇合或接近汇合的培养生长的细胞从所述器皿移出,用新鲜培养基稀释(例如,稀释1:5)并置于新的组织培养容器中以允许它们的持续生长和活力。例如,从角膜缘分离的lsc被称为原代细胞。通过在本文所述的生长培养基中生长而使此类细胞在培养中扩增。当对此类原代细胞传代培养时,每轮传代培养被称为传代。如本文所用的“原代培养物”意指从受试者新鲜分离的细胞群体。
如本文所用的术语“分化”意指细胞渐进地变得更为特化的过程。当在本文用于描述多能干细胞时,术语“分化”意指导致多能干细胞丧失它们的分化多能性(即,分化为所有组织的潜在能力)并具有作为构成特定组织的细胞的特征的变化。
如本文所用的术语“生理水平”意指活系统中的物质被发现并且与生物化学过程和/或生物过程的适当运行相关的水平。
如本文所用的术语“集合的”意指已被合并而产生与非集合的组合物相比具有更恒定或一致特征的新组合物的多个组合物。
术语“治疗有效量”意指实现期望的生理效应(例如,修复或促进角膜愈合)所必需的治疗剂的量。
如本文所用的术语“溶解产物”是指当溶解细胞(例如lsc)并任选地去除细胞碎片(例如,细胞膜)时获得的组合物。这可通过机械手段,通过冷冻和解冻,通过声波处理,通过使用洗涤剂如edta,或通过使用例如以下酶进行酶消化来实现:胰蛋白酶、糜蛋白酶、胶原酶、弹性蛋白酶、玻璃酸酶、分散酶、蛋白酶和核酸酶,以及商业产品如stemproaccutase。在一些情况下,可能期望溶解细胞并保留细胞膜部分并丢弃溶解细胞的剩余部分。
如本文所用的术语“药学上可接受的”意指除了治疗剂以外的构成所述制剂的组分适于向根据本发明治疗的患者施用。
如本文所用的术语“组织”是指联合以执行特定功能的类似特化的细胞的聚集体。
如本文所用的术语“移植”是指向人或其它动物施用包含未分化、部分分化或完全分化形式的细胞的组合物,包括细胞悬浮物或并入基质或组织中的细胞。
如本文所用的术语“附加”是指共同地、加上、连同、结合等。
如本文所用的术语“共同施用”可包括同时或依序施用两种或更多种试剂。
术语“受试者”和“个体”可互换使用。如本文所用的,这两个术语均表示任何动物,如哺乳动物,包括人和/或非人。术语“患者”、“受试者”和“个体”可互换使用。所述术语均不应被解释为需要医学专业人员(例如,医生、护士、医生助理、护理员、临终关怀工作者)的监护。
如本文所用的术语“治疗”、“处理”或“治疗方法”包括预防性地或治疗性地缓解、减少和/或改善疾病和/或病况的症状、预防额外症状、改善和/或预防症状的潜在代谢病因、抑制疾病和/或病况,例如,阻滞疾病和/或病况发展、减轻疾病和/或病况、引起疾病和/或病况消退、减轻由疾病和/或病况而引起的病况和/或终止疾病和/或病况的症状。
关于如本文所用的制剂、组合物或成分,术语“眼科上可接受的”意指不具有对所治疗的眼或其功能或对所治疗的受试者的一般健康显著有害的持久效应。应认识到,瞬时效应如小刺激或“刺痛”感觉在药物的局部眼部施用中是常见的,并且此类瞬时效应的存在与如本文所界定为“眼科可接受的”所讨论的制剂、组合物或成分并不一致。然而,优选的制剂、组合物和成分是不引起显著有害作用、甚至具有瞬时性质的那些。
如本文所用的术语“基质”是指角膜缘干细胞和/或其祖细胞可粘附的,因此可取代饲养细胞的细胞附着功能或支持其粘附的任何物质,如附着因子。特别适用于本发明的是来源于基膜的细胞外基质组分或形成粘附分子受体-配体偶联的一部分的细胞外基质组分。可由本发明的该方面的方法使用的适合基质的非限制性示例包括哺乳动物羊膜(例如、人羊膜)、胶原(例如胶原iv)、纤维蛋白原、基底膜蛋白多糖、层粘连蛋白、纤连蛋白、蛋白聚糖、前胶原、透明质酸、巢蛋白、硫酸乙酰肝素、腱糖蛋白、聚-l-赖氨酸、明胶、聚-l-鸟氨酸等、或其任何组合。或者,细胞外基质是市售的。市售的细胞外基质的示例是细胞外基质蛋白质(fischer或lifetech)、纤维蛋白原和凝血酶片(reliancelife)和matrigeltm(bdbiosciences)和它们的等同物。在期望完全无动物培养条件的情况下,基质来源于人源或使用重组技术合成。此类基质包括例如人羊膜、人来源的纤连蛋白、重组纤连蛋白基质,其可以从sigma,st.louis,mo,usa获得或可使用已知的重组dna技术产生(参见例如美国专利号6,152,142和tseng等,(1997)am.j.ophthalmol.124:765-774,各自以引用方式并入本文)。
根据本发明,可采用本领域技术内的常规分子生物学、微生物学和重组dna技术。此类技术在文献中有充分说明。参见例如sambrook等人,2001,“molecularcloning:alaboratorymanual”;ausubel编辑,1994,“currentprotocolsinmolecularbiology”第i-iii卷;celis编辑,1994,“cellbiology:alaboratoryhandbook”第i-iii卷;coligan编辑,1994,“currentprotocolsinimmunology”第i-iii卷;gait编辑,1984,“oligonucleotidesynthesis”;hames和higgins编辑,1985,“nucleicacidhybridization”;hames和higgins编辑,1984,“transcriptionandtranslation”;freshney编辑,1986,“animalcellculture”;irlpress,1986,“immobilizedcellsandenzymes”;perbal,1984,“apracticalguidetomolecularcloning”`。
当提供值的范围时,应当理解,本发明内涵盖该范围的上限与下限之间的每个居中值(除非上下文另有明确规定,否则至下限单位的1/10)以及所述范围中任何其它所述值或居中值的范围。这些更小范围的上限和下限可独立地包括在更小范围中,也涵盖在本发明内,从属于所述范围中的任何明确排除的界限。当所述范围包括所述界限中的一个或两个时,排除那些被包括的界限中的一个或两个的范围也包括在本发明中。
当在数字名称(例如,温度、时间、量、浓度和此类其它名称,包括范围)前使用时,如本文所用的术语“约”指示可以变化(+)或(-)10%、5%或1%的近似值。
如本文所用的术语“基本上不含”包括不含给定物质或细胞类型或几乎不含该物质或细胞类型,例如,具有小于约1%的给定物质或细胞类型。
必须注意的是,除非上下文另有明确规定,否则如本文和所附权利要求书中所用的单数形式“一(a、an)”和“所述”包括复数个指示物。
如本文所用的术语“包括”或“包含”意在意指所述组合物和方法包括所列举的要素,但不排除其它要素。当用于定义组合物和方法时,“基本上由……组成”应当意指出于所述目的排除对该组合具有任何重要意义的其它元素。因此,基本上由如本文所定义的要素组成的组合物将不排除不实质影响本公开的基本和新颖特征的其它材料或步骤。“由……组成”应当意指排除超过痕量要素的其它成分和实质性方法步骤。由这些过渡术语中的每一个所限定的实施方案均在本公开的范围内。
除非另有定义,否则本文所用的所有技术和科学术语都与本发明所属领域技术人员通常所理解的含义相同。尽管类似或等同于本文所述的方法和材料的任何方法和材料也可用于实践或测试本发明,但本文现在描述优选的方法和材料。
本发明的组合物
本发明提供分离的角膜缘干细胞或祖细胞(lsc)群体或lsc样群体,其群体包含化学合成、重组或分离的编码pax6的核酸,所述核酸整合到染色体中,或者未整合而保持为染色体外遗传材料,其中所述分离的lsc群体基本上不含非lsc细胞,或其中所述lsc样群体基本上不含非lsc样细胞,或其中所述分离的lsc或lsc样群体基本上不含非lsc和非lsc样细胞。lsc群体或lsc样群体可来自哺乳动物如人。lsc群体或lsc样群体可经遗传改良。此外,lsc群体或lsc样群体可保持或可维持为lsc或lsc样细胞命运。
在本发明的一个实施方案中,化学合成、重组或分离的核酸可表达pax6或其片段。pax6或其片段可维持lsc状态或lsc样状态或可将干细胞或祖细胞引导至lsc状态或lsc样状态。此外,lsc状态或lsc样状态可将细胞群体限定为产生角膜上皮细胞(cec)的分化途径。在另一实施方案中,pax6或其片段维持lsc状态或lsc样状态或将干细胞或祖细胞引导至lsc状态或lsc样状态,并且lsc状态或lsc样状态进一步将细胞群体限定为产生角膜上皮细胞的分化途径。
在本发明的又一实施方案中,90-95%的lsc群体或lsc样群体表达p63、pax6、k19和ki67。在另一实施方案中,小于5%的lsc群体表达k5和k14。在再一实施方案中,大于95%的lsc群体表达wnt7a和fzd5。在又一实施方案中,小于5%的lsc样群体表达wnt7a。
在本发明的另一实施方案中,角膜上皮细胞表达pax6和角膜上皮标志物k3和k12。
在一个实施方案中,分离的lsc表达一组标志物,该组标志物包括wnt7a、fzd5、pax6、p63、角蛋白5(k5)、角蛋白14(k14)、角蛋白19(k19)和ki67。在另一实施方案中,90-95%的lsc表达p63、pax6、k19和ki67。在再一实施方案中,大于95%的lsc表达wnt7a和fzd5。在另一实施方案中,小于5%的lsc表达k5和k14。在又一实施方案中,90-95%的lsc表达p63、pax6、k19和ki67,大于95%的lsc表达wnt7a和fzd5,小于5%的lsc表达k5和k14。
例如,角膜缘干细胞或祖细胞样细胞或lsc样细胞是非lsc干细胞,例如皮肤上皮干细胞(sesc),其在pax6足量过表达时转变或采用“lsc样“状态。在一个实施方案中,转变为“lsc样”状态的干细胞具有诱导的k19表达,与细胞核中p63和pax6两者的表达一致。在另一实施方案中,当在lsc分化培养基存在下将“lsc样”细胞置于三维培养(包埋在减少生长因子的matrigel中)时,“lsc样”细胞分化为“cec样”细胞,其具有增加的角膜k3和k12表达并伴随降低的皮肤k1和k10表达。例如,由过表达pax6的sesc(其转化为lsc谱系,而非保持为定型的sesc)的3d分化所产生的cec样细胞中的角膜k3表达可以是经类似处理但不过表达pax6的sesc中的约9.4倍。
本发明进一步提供限定的细胞群体,其包含lsc群体或lsc样群体的多个细胞。所限定的细胞群体可以是同源的或异源的。所限定的细胞群体可以是克隆的或来源于单细胞。本发明进一步提供了致力于发育为角膜上皮细胞的lsc群体或lsc样群体的后代细胞。另外,本发明还提供了包含lsc群体或lsc样群体的细胞的组织。
本发明进一步提供了包含lsc群体或lsc样群体和适合载体的药物组合物。在本发明的一个实施方案中,lsc群体或lsc样群体可被培养至少17次传代而不分化为cec。另外,在本发明的另一实施方案中,在第3次传代时表达pax6和p63的细胞的百分比与第17次传代时的百分比相同。在本发明的又一实施方案中,在第3次传代时表达k19和ki67的细胞的百分比略大于第17次传代或第17次以后传代时的百分比。在本发明的又一实施方案中,本发明的lsc群体或lsc样群体包含可稳定繁殖40-60代而不分化为cec的细胞。此外,在本发明的一个实施方案中,lsc群体或lsc样群体可分化为角膜上皮细胞群体。
另外,本发明还提供了包含本发明的lsc群体或lsc样群体的细胞的组织。此外,本发明另外提供了形成受试者的组织的方法,其包括将足够量的本发明的lsc群体或lsc样群体的后代细胞引入受试者之中或之上以形成所述受试者的角膜上皮细胞。
本发明另外提供了分离的皮肤上皮干细胞(sesc)群体或sesc样群体,其包含化学合成、重组或分离的编码pax6的核酸,所述核酸整合到染色体中,或者未整合而保持为染色体外遗传材料,其中所述分离的sesc群体基本上不含非sesc细胞。此外,sesc样群体可基本上不含非sesc样细胞,或者分离的sesc群体或sesc样群体可基本上不含非sesc细胞和非sesc样细胞,或者分离的sesc群体或sesc样群体进一步还可基本上不含非sesc细胞、非sesc样细胞、非lsc细胞和非lsc样细胞。另外,在本发明的一个实施方案中,化学合成、重组或分离的核酸可表达pax6或其片段,所述pax6或其片段可维持lsc状态或lsc样状态或可将干细胞或祖细胞引导至lsc状态或lsc样状态,并且所述lsc状态或lsc样状态进而可将细胞群体限定为产生角膜上皮细胞的分化途径。在本发明的另一实施方案中,化学合成、重组或分离的核酸表达pax6或其片段,所述pax6或其片段将sesc细胞或sesc样细胞引导至lsc状态或lsc样状态,所述lsc状态或lsc样状态进而可将细胞群体限定为产生角膜上皮细胞的分化途径。sesc群体或sesc样群体可来自哺乳动物如人。sesc群体或sesc样群体可经遗传改良。此外,sesc群体或sesc样群体可从sesc或sesc样细胞命运转变为lsc或lsc样细胞命运。
在一个实施方案中,约90-95%的细胞群体表达p63、k5和ki67,同时保持为sesc或sesc样细胞命运。在另一实施方案中,在保持为sesc或sesc样细胞命运的细胞中未检测到约k3或k12表达。在又一实施方案中,wnt7a在保持为sesc或sesc样细胞命运的细胞中以lsc细胞中的水平的约1/5-1/4的水平表达。在再一实施方案中,pax6在保持为sesc或sesc样细胞命运的细胞中不表达或以小于lsc细胞中的水平的约1/8的水平表达。在另一实施方案中,wnt7a在超过70%的保持为sesc样命运的细胞中表达。在再另一实施方案中,所述群体中90-95%转变为lsc或lsc样细胞命运的细胞表达p63、pax6、k19和ki67。另外,在本发明的一个实施方案中,皮肤表皮细胞表达皮肤表皮分化标志物k1和k10。
另外,本发明进一步提供了包含sesc群体或sesc样群体和适合载体的药物组合物。在本发明的一个实施方案中,本发明的sesc群体或sesc样群体可被培养至少17次传代而不分化为皮肤表皮细胞或角膜上皮细胞。在一个实施方案中,sesc群体或sesc样群体可包含可稳定繁殖40-60代而不分化为皮肤表皮细胞或角膜上皮细胞的细胞。在又一实施方案中,sesc群体或sesc样群体可包含已将细胞命运转变为lsc或lsc样细胞命运的sesc细胞或sesc样细胞。此外,在一个实施方案中,sesc群体或sesc样群体已采用lsc或lsc样细胞命运,并且不存在sesc或sesc样细胞命运。sesc群体或sesc样群体可分化为角膜上皮细胞。在一个实施方案中,sesc群体或sesc样群体可分化为基本上不含皮肤表皮细胞的角膜上皮细胞。
本发明进一步提供限定的细胞群体,其包含sesc群体或sesc样群体的多个细胞。所限定的细胞群体可以是同源的或异源的。所限定的细胞群体可以是克隆的或来源于单细胞。本发明进一步提供了致力于发育为角膜上皮细胞的sesc群体或sesc样群体的后代细胞。
另外,本发明还提供了包含本发明的sesc群体或sesc样群体的细胞的组织。此外,本发明另外提供了形成受试者的组织的方法,其包括将足够量的本发明的sesc群体或sesc样群体的后代细胞引入受试者之中或之上以形成所述受试者的角膜上皮细胞。
本发明的方法
在本发明的一个实施方案中,本公开涉及哺乳动物角膜缘干细胞(lsc)的培养。角膜缘干细胞来源于来自人供体的角膜巩膜或角膜缘组织。具体地说,本公开是具有自再生性角膜缘干细胞的系统,并且可包含大的lsc群体,例如至少约70%、至少约80%或至少约90%的角膜缘干细胞。用于分离角膜缘组织的典型程序是从供体眼的角膜表面的上象限或颞象限手术移出由0.8-3mm2的角膜缘组织组成的小活检标本。例如通过板层角膜切除术从角膜缘获得此类活检标本的程序是本领域技术人员已知的。用于产生角膜缘干细胞的角膜缘组织活检标本的供体还可以是组织系统移植物、植入物或移植片(即自体组织系统)的接受者。或者,当角膜缘组织活检标本的供体不是接受者时,在一个示例中,供体是生物相容性供体,例如移植物或移植片的接受者的近亲,或者还可来自生物相容性(例如,组织相容性)尸体(即同种异体组织系统)。通常期望移植的细胞或组织与移植物的接受者在遗传学上相容或相同,以避免组织排斥的问题。
本公开的lsc是具有分化为角膜上皮细胞的潜力的未分化或基本上未分化的细胞。未分化细胞的形态学特征是本领域技术人员众所周知的。本领域技术人员理解,可用于本发明实施方案中的细胞,如角膜上皮的角膜缘干细胞,可通过许多互补因素来表征,如从中获得它们的体内位点和/或它们的形态或大小(例如平均直径),以及生物标志物的存在、不存在和/或表达水平,所述生物标志物如atp结合盒亚家族g成员2(abcg2)、转录因子p63、bmi-1、notch-1、阶段特异性胚胎抗原-4(ssea4)、阶段特异性胚胎抗原-3(ssea3)、n-钙粘素、cd73、cd105、cd54、cd117、oct-4、ki67、nanog、rex1、sox2、tra-1-60、tra-1-81、干细胞因子和细胞角蛋白(k),如k1、k3、k5、k10、k12、k14或k15、k19和细胞角蛋白-3(参见例如nakatsu等,investigativeophthalmology&visualscience2011;52:4734-4741;truong等,investophthalmolvissci.2011;52:6315-6320;dua等,survophthalmol.2000年3月-4月;44(5):415-25;watson等,curreyeres.2013年4月10日;meyer-blazejewska等,investophthalmolvissci.2010年2月;51(2):765-74;和rama等,nengljmed2010;363:147-55;thomson等,(science282:1145-1147,1998);reubinoff等(naturebiotech.18:399-403,2000))。在本发明的说明书性实施方案中,人角膜缘干细胞展现了通过检查以下中的一种或多种而表征的表达谱,atp结合盒亚家族g成员2(abcg2)、-转录因子p63α、阶段特异性胚胎抗原-4(ssea4)、n-钙粘素和细胞角蛋白(k)如k1、k3、k5、k10、k12、k14或k15。在本发明的实施方案中,还鉴别或表征了人角膜缘干细胞或饲养细胞的其它特征,例如细胞大小或形态。
例如,在从供体移出活检标本后,必须以如下方式对它进行护理:使得角膜缘组织活检标本的足够部分保持活力,以允许分离角膜缘干细胞。在一个实施方案中,将角膜缘组织活检标本在支持活检标本的活力的培养基中运输或储存。用于储存或运输活检标本的培养基的示例可包括达尔伯克改良伊格尔培养基(dmem)和ham'sf-12(比率1:1)、dmso(0.1-0.5%)、重组人表皮生长因子(rhegf;0.5-2ng/ml)、胰岛素(0.5-5μg/ml)、转铁蛋白(0.5-5μg/ml)、亚硒酸钠(0.1-0.5μg/ml)、氢化可的松(0.1-0.5μg/ml)、霍乱毒素a(0.01-0.1μmol/l)、庆大霉素(10-50μg/ml)和两性霉素b(0.5-1.25μg/ml)。或者,所述培养基可用功能等同的组分或用不同的抗生素取代。所述培养基可进一步补充有人脐带血血清(3-5%)。角膜缘细胞活检标本可在从供体手术移出后的48小时内被放置培养。
角膜缘干细胞可在运输之前或之后从组织活检标本直接纯化。角膜缘组织活检标本可作为完整的外植体培养,或者可在培养之前解离成单个(或减少的)细胞的悬浮物。例如,可针对具有增加的生物活性的某些群体来纯化所述组织。纯化可使用本领域已知的手段进行,或者可通过如本文所述的用于lsc标志物的阳性选择来实现。在本发明的一个实施方案中,将角膜缘干细胞以无菌方式机械降解并用酶处理以允许从收集的组织解离所述细胞。此类酶包括但不限于胰蛋白酶、糜蛋白酶、胶原酶、弹性蛋白酶透明质酸酶和/或商业产品如stemproaccutase(fischer)。随后对角膜缘干细胞的悬浮物进行洗涤,评估其活力,并且可将其直接用于本发明的实践或培养用于扩增。在一些情况下,将期望在用于通过条件培养基增代之前扩增细胞。可通过用如本文所述的特定因子离体培养来进行扩增。
在从供体取下活检用角膜缘组织之后,将其与培养基,且在一个实施方案中,与适当的支持基质,例如细胞外基质或生物包覆的表面,例如细胞外基质载体或生物包覆的培养皿放置培养。在一个实施方案中,支持基质的存在促进活检标本中的角膜缘干细胞与组织培养板或器皿的结合,从而促进角膜缘干细胞的生长。外植体可在放置培养之前被切成小片。
可通过借助冷冻-解冻、酶消化和机械刮除去除内源性羊膜上皮细胞,之后用生长因子、细胞外基质化合物和/或粘附增强分子处理表面来制备人羊膜,以增强角膜缘干细胞的生长。在一个实施方案中,将基膜或间质侧朝上的羊膜平滑地附着到用于培养lsc的培养板上。
能够在体外支持lsc的任何培养基均可用于培养lsc。可支持lsc生长的培养基制剂包括但不限于最低必需培养基伊格尔、adc-1、lpm(无牛血清白蛋白)、f10(ham)、f12(ham)、dccm1、dccm2、rpmi1640、bgj培养基(有和无fitton-jackson改良)、基础培养基伊格尔(bme—添加有厄尔(earle's)盐基质)、达尔伯克改良伊格尔培养基(dmem-无血清)、yamane、imem-20、格拉斯哥改良伊格尔培养基(gmem)、leibovitzl-15培养基、mccoy's5a培养基、培养基m199(m199e—具有厄尔盐基质)、培养基m199(m199h—有汉克(hank's)盐基质)、最低必需培养基伊格尔(mem-e—有厄尔盐基质)、最低必需培养基伊格尔(mem-h—具有汉克盐基质)和最低必需培养基伊格尔(具有非必需氨基酸的mem-naa)、α改良最低必需培养基(αmem)和罗斯韦尔公园纪念研究所培养基1640(rpmi培养基1640)、用于上皮细胞的
可用于本发明方法中的培养基的另外的非限制性示例可包括浓度为至少1%到约30%、至少约5%至15%(例如约10%)的胎牛血清、小牛血清或其它物种的血清。在某些实施方案中,可优选使用人血清。
在优选的实施方案中,用于本发明中的培养基是无饲养层、无血清和无异源物的培养基。例如,用于制备组织系统的培养基,包括用于运输角膜缘组织活检标本的培养基、用于培养活检标本的培养基、用于培养角膜缘干细胞的富集培养基和用于运输组织系统的培养基,不含有动物来源的任何血清或其它因子。这将有助于使组织系统被异种组分污染的任何风险最小化,从而使所述组织系统对于人类施用是安全的。在最优选的实施方案中,无饲养层、无血清和无异源物的培养基是化学成分确定的培养基,其中培养基中的所有组分都是化学成分确定的,并且不含有未确定的动物来源或人来源的产物。
对于可用于培养lsc的与细胞培养和培养干细胞相关的一般技术,从业者可参考标准教科书和综述,例如:e.j.robertson,“teratocarcinomasandembryonicstemcells:apracticalapproach”编辑,irlpress有限公司,1987;hu和aunins(1997),curr.opin.biotechnol.8:148-153;kitano(1991),biotechnology17:73-106;spier(1991),curr.opin.biotechnol.2:375-79;birch和arathoon(1990),bioprocesstechnol.10:251-70;xu等(2001),nat.biotechnol.19(10):971-4;和lebkowski等(2001)cancerj.7增刊2:s83-93,各自以引用方式并入本文。
根据本发明的方法的又一实施方案包括包含rock(rho相关蛋白质激酶)抑制剂的培养基。发现添加rock抑制剂可预防失巢凋亡,尤其是在培养干细胞时。rock抑制剂是本领域内已知,并且在一个示例中,选自r)-(+)-反式-4-(1-氨乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物(y-27632;sigma-aldrich)、5-(1,4-二氮杂环庚烷-1-基磺酰基)异喹啉(法舒地尔(fasudil)或ha1077;caymanchemical)、h-1152、h-1152p、(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]高哌嗪,2hcl、rock抑制剂、二甲基法舒地尔(dimf、h-1152p)、n-(4-吡啶基)-n′-(2,4,6-三氯苯基)脲、y-39983、wf-536、snj-1656和(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂
rock抑制剂还包括可减弱rock活性的rock活化负调节物,如小gtp结合蛋白质(例如gem、rhoe和rad)。在本公开的具体实施方案中,靶向rock1而不是rock2,例如,wo03/080610涉及作为激酶抑制剂的咪唑并吡啶衍生物,如rock抑制剂,以及用于抑制rock1和/或rock2的作用的方法。上文引用的申请的公开内容以引用方式并入本文。rho抑制剂还可通过与rock(rho-活化的激酶)的相互作用而于下游起作用,导致对rho的抑制。此类抑制剂描述于美国专利号6,642,263(其公开内容以引用方式整体并入本文)中。可使用的其它rho抑制剂描述于美国专利号6,642,263和6,451,825中。此类抑制剂可使用例如描述于美国专利号6,620,591中的常规细胞筛选测定(其全部以引用方式整体并入本文)来鉴别。
培养基还可包含在培养基中以适当浓度培养lsc所必需的生长因子、细胞因子和激素。可用于本发明方法中的培养基还可含有一种或多种目标化合物,包括但不限于可用于培养lsc的抗生素化合物、抗炎化合物、抗病毒化合物、促有丝分裂化合物或分化化合物。在一个非限制性实施方案中可使所述细胞在约27℃到40℃的温度,在另一非限制性实施方案中在约31℃到37℃,且在另一非限制性实施方案中在加湿培育箱中生长。二氧化碳含量可维持在约2%到10%,并且氧含量可维持在约1%到22%;然而,本发明决不应被解释为限于任何一种分离和培养lsc的方法。而是,分离和培养lsc的任何方法都应被解释为包括在本发明中。
所述培养基还可补充有生长因子。如本文所用的术语“生长因子”是指结合到细胞表面上的受体、具有活化细胞增殖和/或分化的主要结果的蛋白质。用于培养角膜缘组织的生长因子例如选自表皮生长因子(egf)、碱性成纤维细胞生长因子(bfgf)、白血病抑制因子(lif)、神经生长因子(ngf)、胰岛素生长因子(igf)、tgf-β、肝细胞生长因子、角质形成细胞生长因子、胰岛素、亚硒酸钠、人转铁蛋白或人白血病抑制因子(hlif)、牛垂体提取物等,以及其组合。然而,可使用本领域技术人员已知的任何适合的培养基。在某些实施方案中,用细胞因子或其它生长因子处理角膜缘细胞,所述细胞因子或其它生长因子使lsc优选在培养物中增殖。用于培养角膜缘细胞的其它因子可选自dmso和氢化可的松、葡萄糖、l-谷氨酰胺、叶酸、碳酸氢钠、腺嘌呤、cacl2、孕酮、乙醇胺、三碘甲腺原氨酸、磷酸乙醇胺等。
在某些实施方案中,抗生素是大环内酯(例如,妥布霉素
有用的抗炎剂包括但不限于非类固醇抗炎药物,如水杨酸、乙酰水杨酸、水杨酸甲酯、二氟尼柳、双水杨酯、奥色拉秦、柳氮磺胺吡啶、对乙酰氨基酚、吲哚美辛、舒林酸、依托度酸、甲芬那酸、甲氯灭酸钠、托美丁、酮咯酸、双氯芬酸、布洛芬、萘普生、萘普生钠、非诺洛芬、酮洛芬、氟比洛芬、奥沙普秦、吡罗昔康、美罗昔康、安吡昔康、屈恶昔康、匹伏昔康、替诺昔康、萘丁美酮、保泰松、羟布宗、安替比林、氨基比林、阿扎丙宗和尼美舒利;白三烯拮抗剂,包括但不限于齐留通、金硫葡糖、硫代苹果酸金钠和金诺芬;和其它抗炎剂,包括但不限于甲氨蝶呤、秋水仙碱、别嘌醇、丙磺舒、磺吡酮和苯溴马隆。
有用的抗病毒剂包括但不限于核苷类似物,如齐多夫定、阿昔洛韦、更昔洛韦、阿糖腺苷、碘苷、曲氟尿苷和利巴韦林,以及膦甲酸、金刚烷胺、金刚乙胺、沙奎那韦、茚地那韦、利托那韦和α-干扰素。
在一个实施方案中,lsc的分离群体在允许所述细胞扩增而基本上不分化的培养基中培养,例如在富集有从灭活的人胚胎成纤维细胞获得的条件培养基的培养基、富集有人白血病抑制因子的培养基、或补充有一种或多种可溶性因子的培养基中培养,所述可溶性因子选自由二甲基亚砜、重组人表皮生长因子、胰岛素、亚硒酸钠、转铁蛋白、孕酮、腐胺、亚硒酸盐、氢化可的松和碱性成纤维细胞生长因子组成的组。或者,lsc在允许所述细胞分化为例如角膜上皮细胞的培养基中培养,使用了例如特异性生长因子或培养基,例如角膜上皮培养基cnt-30(cellntec,zen-bio)或化学成分确定的无异源物的培养基reges(regea06/015、regea07/046和regea08/013;rajala等,2010,plosone5(4):e10246)。
培养角膜缘组织活检标本的示例性方法是在将外植体置于细胞外基质或生物包覆的组织培养板上之前或之后,使所述外植体经受几分钟干燥培育。然后将少量培养基添加到外植体中,使得其粘附到细胞外基质或生物包覆的组织培养物表面。几小时到一天后,轻轻添加另外的培养基,并将外植体在co2培育箱中在37℃培育几天,每隔一天更换培养基。优选地,在这样的示例中,在干细胞开始在培养物中增殖之后,从培养物移出原始角膜缘组织活检标本片。
在其它实施方案中,在扩增之前,角膜缘组织活检标本可用于产生单细胞悬浮物,所述单细胞悬浮物随后被培养以产生本文所公开的组织系统。例如,对角膜缘组织活检标本进行洗涤,然后例如用胰蛋白酶-edta(例如,约0.25%,保持20-30分钟)或分散酶(例如,在4℃过夜)进行酶处理,以产生包含lsc的单细胞悬浮物。酶处理允许分离上皮;因此,在单细胞悬浮物中可减少基质或间充质细胞或不存在基质或间充质细胞。
在将角膜缘组织培养几天,例如直到细胞变得汇合之后,可从培养物分离lsc。优选地、在该示例中、允许角膜缘组织培养物生长直到它至少约50%、60%、70%、80%、90%或95%汇合。在一个实施方案中,首先从细胞外基质或生物包覆的组织培养板解离角膜缘细胞,例如通过酶消化,例如使用胰蛋白酶-edta或分散酶溶液。还可使用本领域技术人员已知的各种方法从培养中的其它细胞分离lsc,例如免疫标记和荧光分选,例如固相吸附、荧光活化细胞分选(facs)、磁-亲和细胞分选(macs)等。在某些实施方案中,通过某些细胞表面标志物的分选(例如免疫荧光分选)来分离lsc。本领域技术人员熟知的两种优选的分选方法是macs和facs。
分选技术可涉及使用适当的干细胞标志物以将lsc与培养中的其它细胞分离。可使用一种或多种经标记的抗体或因子,通过一种或多种特异性表面标志物来鉴别lsc,所述经标记的抗体或因子与所述标志物特异性地相互作用,并且基于标记的存在对所述lsc进行分选,所述标记如在facs的情况下的荧光标记或在macs的情况下的顺磁性材料。可用于从培养的角膜缘细胞分离lsc的适当的干细胞特异性表面标志物包括但不限于abcg2、转录因子p63、ssea4、ssea3、n-钙粘素、cd73、cd105、cd54、cd117、oct-4、nanog、tdgf、utx-1、fgf-4、rex1、sox2、tra-1-60、tra-1-81、干细胞因子和kl、k3、k10、k12、k14或k15、k19。通过这种方式,由从角膜缘组织活检标本培养的混合细胞群体获得lsc的细胞表面标志物阳性的富集群体。或者,可通过选择未在lsc上发现的细胞表面标志物来分选细胞以去除不期望的细胞。在从角膜缘组织分离的lsc的情况下,lsc对于以下细胞表面标志物为阴性:cd34、cd45、cd14、cd133、cd106、cd11c、cd123和hla-dr。
通过分选获得的富集的角膜缘细胞培养物具有至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、98%或99%的lsc。在替代实施方案中,通过筛选某些基因标志物的表达,针对lsc的存在来筛选含有角膜缘细胞的混合细胞培养物。在混合角膜缘细胞培养物的情况下,lsc群体可通过例如以下的基因标志物的表达来鉴别:abcg2、转录因子p63、ssea4、ssea3、n-钙粘素、cd73、cd105、cd54、cd117、oct-4、nanog、tdgf、utx-1、fgf-4、rex1、sox2、tra-1-60、tra-1-81、干细胞因子和k1、k3、k10、k12、k14或k15、k19、以及未分化细胞的其它基因标志物、或其组合。
在使用上述方法之一分离富集lsc的角膜缘细胞群体之后,优选将分离的细胞在一定条件下在培养基中培养,所述培养基支持lsc的生长和组织系统的发育,以用于移植、植入或嫁接到受损或患病的眼上。优选地,在这些条件下培养的组织系统将包含至少约30%、40%、50%、60%、70%、80%、90%或95%的lsc。在一个实施方案中,在富集培养基存在下,在组织基底上培养分离的lsc,以供用lsc发育出组织系统。可在生长或扩增的不同阶段添加不同的因子。例如,可在几次扩增传代后添加rock抑制剂。组织基底可具有接近天然眼部表面的特征,例如诸如为透明的、薄的、弹性的、生物相容性的、非血管性的和非抗原性的特征,并且还可支持lsc的生长,以及在移植、植入或嫁接后的正常分化。
在适当的培养基中对包括lsc的角膜缘细胞进行培养或传代以允许lsc保持为基本上未分化的状态。尽管群体内lsc的集落可与分化的邻接细胞相邻,但是当在适当的条件下对所述群体进行培养或传代并且单个lsc构成所述细胞群体的相当大比例时,lsc的培养物将仍然保持基本上未分化。基本上未分化的未分化干细胞培养物含有至少约20%未分化的lsc,并且可含有至少约40%、60%、80%或90%的lsc。例如,必须将培养中的lsc保持在约104/cm2的适当细胞密度,并传代培养,同时频繁地更换培养基以防止它们分化。在长期培养中,当以约70-90%汇合对细胞进行传代时,它们可分散为小簇或单细胞悬浮物。通常,获得细胞的单细胞悬浮物,然后将其接种到另一组织培养级塑料皿上,以达到传代后约15-20%汇合。
所述培养物可被连续传代至少10次、20次、40次、60次、80次、100次或更多次代,而lsc基本上不分化。包含lsc的角膜缘细胞培养物可经冷冻保存以供进一步在不同时间点使用而不损失分化潜力,优选地,在这种情况下,在冷冻培养基中冷冻保存,所述冷冻培养基包括具有从人脐带血收集的约10-90%热灭活的血清和约5-10%dmso的培养基。或者,预期冷冻培养基可以是化学成分确定的,其为无血清的、无异源物的且无饲养层的。角膜缘细胞培养物可包含例如通过冷冻保存在每次传代后保存的lsc,使得可从单个角膜缘组织活检标本产生另外的或多个组织系统。这些冷冻保存的培养物还将充当未分化的、自我再生的且有活力的角膜缘干细胞库,以供将来在任何给定时间点使用。例如,这些冷冻保存的培养物可用于产生另外的组织系统,以供在接受者中的组织系统由于免疫抑制、来自先前手术的并发症、感染等而失效的情况下自体使用。这些冷冻保存的培养物还可用于产生用于生物相容性患者的另外的组织系统。这些保存的培养物的可用性还将避免在组织系统失效的情况下从供体移出另外的角膜缘组织的需要,从而防止将来耗尽自体角膜缘干细胞来源的风险。
在产生本文所公开的组织系统之后,可将其运输到接受者的位置以供移植、植入或嫁接。用于运输组织系统的手段可充分维持组织系统的活力,使得其在运输后仍然可用作移植物、植入物或移植片。组织系统在容纳运输介质的容器中运输,所述运输介质可以是用于培养包含lsc的组织系统的富集培养基或足以在运输期间缓冲组织系统而不含生长因子的替代培养基。或者,可将接受者带到保持本文所公开的组织系统的设施,避免了对运输介质的需要。
本文所公开的包含lsc的组织系统可用于治疗应用,例如作为移植物、植入物或移植片用于患有角膜缘干细胞缺乏的受试者的一只眼或两只眼中。本公开的组织系统可用于治疗需要治疗的任何受试者,包括但不限于人、灵长类动物以及家养动物、农场动物、宠物动物或运动动物,如狗、马、猫、羊、猪、牛、大鼠、小鼠等。如本文所用的术语“治疗性”、“治疗性地”、“治疗”、“处理”或“疗法”是指治疗性治疗和预防性措施两者。治疗性治疗包括但不限于减少或消除特定疾病、病况、损伤或病症的症状,或减缓或减弱现有疾病或病症的进展,或治愈现有疾病或病症。需要此类治疗的受试者将通过治疗有效量的组织系统被治疗以使功能恢复或再生。如本文所用,组织系统的“治疗有效量”是足以阻抑或改善受试者中由角膜缘干细胞的损失、损伤、机能障碍或退化引起的生理效应的量。所使用的细胞或组织的治疗有效量将取决于受试者的需要、受试者的年龄、生理条件和健康、所期望的治疗效果、待靶向治疗的组织区域的大小、植入部位、病理程度、所选的递送途径和治疗策略。优选以允许组织系统嫁接到预定部位并重建或再生功能缺陷区域的方式向患者施用所述组织系统。
在优选的实施方案中,本公开的组织系统用于治疗性治疗患有眼部损伤或疾病、特别是眼部表面病损的受试者。或者,所公开的组织系统可用于治疗其它疾病或损伤,例如用于修复灼伤的皮肤区域,所述其它疾病或损伤将治疗性地受益于来源于角膜缘组织的未分化干细胞来源。所公开的组织系统特别适合于治疗患有以下疾病的受试者:原发性角膜缘干细胞缺乏,其可由遗传病况如无虹膜、多发性内分泌缺陷相关性角膜炎、limbitis和特发病引起;或继发性角膜缘干细胞损失,其可发生于后天病况,如史蒂文斯—约翰逊综合征、感染(如严重微生物性角膜炎)、眼部表面肿瘤、由化学或热损伤或暴露于紫外辐射、多次手术或冷冻疗法引起的角膜缘干细胞的外伤性破坏、角膜上皮内瘤形成、外周溃疡性或炎性角膜炎、缺血性角膜炎、角膜病变、由接触透镜或透镜洗涤液诱导的毒性效应、免疫性病况、眼部瘢痕类天疱疮、翼状胬肉、假性翳状胬肉等。在某些实施方案中,组织系统被移植、植入或嫁接到受试者,并且能够修复受试者的眼部损伤或疾病,例如通过向受试者的受损或患病的眼中提供稳定的角膜缘干细胞群体来实现。在某些实施方案中,组织系统的移植、植入或嫁接在眼中促进上皮化,维持正常的上皮表型,减少炎症,减少瘢痕形成,减少组织粘附,减少血管化,并改善视力。
例如,组织系统可被移植、植入或嫁接以修复受损的角膜。尽管许多此类方法是本领域技术人员众所周知的,但一种此类方法涉及在角膜缘进行环状切开术,之后将周围的角膜缘周结膜下瘢痕和发炎的组织去除到裸露的巩膜。角膜的纤维血管组织可通过板层角膜切除术移出。可根据接受者眼的大小来缩放组织系统,并将组织系统移植或嫁接到相应的接受者角膜缘区域。或者,组织系统可以用作整个板层角膜组织,并作为板层角膜移植术移植或嫁接以覆盖整个区域。然后例如用缝线或本领域技术人员已知的任何其它手段将移植、植入或嫁接的组织系统固定到受损部位。
本发明进一步提供了使受试者的组织再生或修复的方法,其包括将足够量的本发明的lsc群体或lsc样群体或sesc群体或sesc样群体的细胞引入受试者之中或之上,以使组织再生或修复。
在一个实施方案中,再生或修复的组织包括角膜上皮细胞谱系的组织,其包含角膜缘干细胞或祖细胞(lsc)和角膜上皮细胞。
本发明另外提供了用于从受试者的皮肤上皮干细胞(sesc)获得角膜缘干细胞或祖细胞(lsc)样细胞的方法。在本发明的一个实施方案中,所述方法包括在sesc中引入pax6基因或上调pax6基因表达,以便将sesc中的pax6蛋白质增加到足以将sesc转化为lsc样细胞的水平,从而从受试者的sesc获得lsc样细胞。在一个实施方案中,在sesc中引入pax6基因或上调pax6基因表达用于从受试者的皮肤上皮干细胞(sesc)获得角膜缘干细胞或祖细胞(lsc)样细胞包括以下步骤:(a)从所述受试者获得sesc;(b)在无饲养层的细胞培养基中体外或离体培养所述sesc;(c)在所述sesc中引入至少一种pax6基因或上调pax6基因表达,以将sesc中的pax6蛋白质增加到足以将sesc转化为角膜缘干细胞或祖细胞(lsc)样细胞的水平,,从而从来自受试者的皮肤上皮干细胞(sesc)获得哺乳动物角膜缘干细胞或祖细胞(lsc)样细胞。
根据本发明的实践,所述方法可以是体外方法、离体方法或原位或直接应用于受试者上。
在一个实施方案中,用引入编码pax6蛋白质的核酸、上调pax6基因表达或增加pax6活性的试剂治疗受试者。所述试剂的适合示例包括但不限于基因治疗载体、病毒粒子、慢病毒、腺病毒、腺相关病毒、重组核酸、重组蛋白质、pax6蛋白质、pax6表达的小分子调节物、pax6表达的负调节物的抑制剂、pax活性的负调节物的小分子抑制剂、pax6活性的小分子增强剂或其组合。
pax6基因的示例包括但不限于pax6a基因、pax6b基因、工程化的pax6a基因、工程化的paxb基因、pax6基因家族的任何成员、编码整个或部分pax6a蛋白质的核酸、编码整个或部分pax6b蛋白质的核酸和编码具有pax6或pax6样活性的蛋白质的任何核酸。在本发明的一个实施方案中,pax6蛋白质是pax6a蛋白质、pax6b蛋白质、pax6蛋白质家族的任何成员和具有pax6或pax6样活性的任何蛋白质中的任一种。在本发明的一个实施方案中,pax6或pax6样活性可涉及可引起内源性k19表达增加的任何蛋白质,其中k19上调的secs可分化为k3和k12基因的表达增加以及k1和k10基因的表达降低的角膜上皮细胞(cec)或cec样细胞。
在一个实施方案中,本发明提供了用于从如上所述的本发明的lsc样细胞获得角膜上皮细胞(cec)样细胞的方法,并且进一步包括在无饲养层的lsc分化培养基中分化(c)的细胞,以将lsc样细胞转化为cec样细胞。
在本发明的一个实施方案中,无饲养层的lsc分化培养基可以是化学成分确定的。在本发明的另一实施方案中,所述培养基无异源物或无除来源于与培养细胞相同的物种的组分之外的组分。在再一实施方案中,所述培养基可以是无血清的。在又一实施方案中,所述培养基可没有任何动物或人产物。
例如,无异源物的的培养基或无异源物的的培养介质是其中所述培养基不含有外来动物来源的产物或材料的培养基。具体地说,在外来动物细胞或接触的外来动物细胞中不产生培养基中的产物或材料。如果用于培养人细胞或除牛细胞以外的任何动物细胞,则包含胎牛血清的培养基将不被认为是无异源物的,因为血清将来源于奶牛;而包含不存在任何动物来源的产物或材料的人血清的培养基,如果培养人细胞,则将被认为是无异源物的。例如,无异源物的培养基可含有由微生物如细菌或酵母菌产生或获得的产物或材料。无异源物的培养基也可被认为是“无动物”培养基。在该示例中,无异源物是指不存在外来动物来源的产物或材料。
本发明进一步提供用于从皮肤上皮干细胞(sesc)获得角膜缘干细胞或祖细胞(lsc)样细胞的方法。所述方法可包括以下步骤:(a)从受试者获得sesc;(b)在无饲养层的细胞培养基中体外培养所述sesc;(c)使所述sesc与试剂接触以上调所述sesc中的pax6基因表达,以将sesc中的pax6蛋白质增加到足以将sesc转化为角膜缘干细胞或祖细胞(lsc)样细胞的水平,从而从来自受试者的皮肤上皮干细胞(sesc)获得哺乳动物角膜缘干细胞或祖细胞(lsc)样细胞。
适合的试剂的示例包括但不限于包含pax6基因的核酸、基因治疗载体、病毒粒子、慢病毒、腺病毒、腺相关病毒、重组蛋白质、pax6蛋白质、pax6表达的小分子调节物、pax6表达的负调节物的抑制剂、pax活性的负调节物的小分子抑制剂、pax6活性的小分子增强剂和其组合。
适合的pax6基因的示例包括但不限于pax6a基因、pax6b基因、工程化的pax6a基因、工程化的paxb基因、pax6基因家族的任何成员、编码整个或部分pax6a蛋白质的核酸、编码整个或部分pax6b蛋白质的核酸和编码具有pax6或pax6样活性的蛋白质的任何核酸。
根据本发明的实践,pax6蛋白质可以是pax6a蛋白质、pax6b蛋白质、pax6蛋白质家族的任何成员或具有pax6或pax6样活性的任何蛋白质中的任一种和其片段。
本发明进一步提供用于从受试者获得哺乳动物lsc的体外方法。在一个实施方案中,所述方法包括以下步骤:(a)从来自受试者的眼的边缘区域获得组织样品;(b)将所述组织解离以获得单细胞;和(c)在无饲养层的细胞培养基中培养(b)单细胞以允许lsc增殖,其中所述增殖的lsc具有分化为角膜上皮细胞(cec)的潜力,从而在体外从受试者获得哺乳动物lsc。在一个实施方案中,边缘区域包括眼的角膜缘。在本发明的一个实施方案中,在(b)中解离组织的步骤包括通过设备或工具(例如激光)进行机械或物理解离以将组织机械地解离为更小的团块和/或单细胞。在另一实施方案中,解离涉及使用一种或或多种试剂,如酶、蛋白酶、化学品、金属螯合剂或其组合。解离组织的其它方法可用于获得单个lsc,如本领域内所已知的。
在本发明的一个实施方案中,无饲养层的细胞培养基进一步包含rho相关蛋白质激酶(rock)抑制剂或白血病抑制因子(lif)或两者。rock抑制剂的一个示例是y-27632(4-[(1r)-1-氨乙基]-n-4-吡啶基-反式-环己烷甲酰胺二盐酸盐)。
在本发明的另一实施方案中,所述方法进一步包括通过在基质或细胞外基质上培养而将lsc细胞或lsc样细胞转化为cec样细胞的步骤。
本发明进一步提供了在无饲养层的lsc培养基中在体外从受试者获得和/或扩增哺乳动物角膜缘干细胞或祖细胞(lsc)的方法。在一个实施方案中,所述方法包括:(a)从来自受试者的眼的边缘区域获得组织样品;(b)将所述组织解离以获得单细胞;和(c)在无饲养层的细胞培养基中培养(b)单细胞以允许lsc增殖,其中所述增殖的lsc具有分化为角膜上皮细胞(cec)的潜力,从而在体外从受试者获得并扩增哺乳动物角膜缘干细胞。在本发明的一个实施方案中,在所述方法的步骤(c)中,在基质或细胞外基质上培养单细胞。
根据本发明的实践,基质或细胞外基质可以是以下中的任一种:
在另一实施方案中,所述方法进一步包括步骤(d),其中所述增殖的lsc细胞或lsc样细胞在传代前约70-90%汇合时以及在传代后约15-20%汇合时被传代。在又一实施方案中,增殖的lsc细胞或lsc样细胞可作为lsc细胞或lsc样细胞稳定传代的次数是约17次或更多次传代。在另一实施方案中,lsc可以约16-20小时的世代时间增殖。此外,lsc细胞或lsc样细胞可稳定繁殖约40-60代而不分化为cec。在本发明的一个实施方案,可每隔一天更换无饲养层的lsc培养基。
根据本发明的实践,边缘区域可包含眼的角膜缘、角膜和结膜之间的边缘、角膜和巩膜之间的边界、角巩膜缘、包含栅间表皮突的区域或包含vogt栅状皱纹的区域。
在步骤b中,在一个实施方案中,所述方法进一步提供通过用一种或多种解离剂处理或接触组织来解离所述组织的步骤,其中所述一种或多种解离剂是酶、蛋白酶、化学品、金属螯合剂或其组合。在另一实施方案中,通过经由设备或工具进行机械或物理破坏来实现解离,以将组织机械解离为更小的团块和单细胞。
在一个实施方案中,蛋白酶可包括胰蛋白酶、胶原酶iv或其组合。此外,金属螯合剂可包括edta、egta或其组合。
在本发明的一个实施方案中,无饲养层的细胞培养基可包含最低必需培养基、生长因子、激素和可溶性因子。在又一实施方案中,无饲养层的细胞培养基可进一步包含血清,优选来自获得和扩增lsc的物种的血清,或血清代用品。在又一实施方案中,无饲养层的细胞培养基还可进一步包含rho相关蛋白质激酶(rock)抑制剂。在又一实施方案中,无饲养层的细胞培养基另外包含白血病抑制因子(lif)。
rock抑制剂的适合的示例包括但不限于(r)-(+)-反式-4-(1-氨乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物(y-27632)、5-(1,4-二氮杂环庚烷-1-基磺酰基)异喹啉(法舒地尔或ha1077)、h-1152、h-1152p、(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]高哌嗪二盐酸盐、二甲基法舒地尔(dimf;h-1152p)、n-(4-吡啶基)-n′-(2,4,6-三氯苯基)脲、y-39983、wf-536、snj-1656和(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂
在本发明的一个实施方案中,在从受试者分离lsc后,在lsc约第四(4)次传代后,将rock抑制剂添加到无饲养层的细胞培养基中。
在一个实施方案中,在从受试者分离lsc后,在lsc约第四(4)次传代后,将lif添加到无饲养层的细胞培养基中。
在本发明的一个具体实施方案中,无饲养层的细胞培养基包含dmem/f12培养基、dmem、青霉素-链霉素、血清、egf、胰岛素、氢化可的松、霍乱毒素、3,3',5-三碘-l-甲状腺原氨酸或其组合。血清可以是胎牛血清,但优选来自与所培养的lsc相同的物种的血清,或血清代用品。无饲养层的细胞培养基可进一步包含rock抑制剂y-27632。在约4次细胞传代后,可将rock抑制剂y-27632添加到无饲养层的细胞培养基中。无饲养层的细胞培养基进一步包含白血病抑制因子(lif)。可在从受试者分离lsc后,在lsc约第四(4)次传代后,将lif添加到无饲养层的细胞培养基中。
在本发明的一个实施方案中,这样获得和/或扩增的lsc可表达一组标志物,该组标志物包括wnt7a、fzd5、pax6、p63、角蛋白5(k5)、角蛋白14(k14)、角蛋白19(k19)和ki67。在另一实施方案中,约90-95%这样获得和/或扩增的lsc表达p63、pax6、k19和ki67。在再一实施方案中,小于约5%的lsc表达k5和k14。在又一实施方案中,大于约95%的lsc表达wnt7a和fzd5。在另一实施方案中,cec表达一组标志物,该组标志物包括wnt7a、fzd5、pax6、角蛋白3(k3)和角蛋白12(k12),其相对于lsc,具有统计学上显著更高的k3和k12表达,并且相对于lsc,具有统计学上显著更低的k19表达。在另一实施方案中,cec不表达p63或相比于lsc表达显著更低水平的p63,并且不表达角蛋白1(k1)和角蛋白10(k10)或相比于皮肤或表皮细胞表达显著更低水平的角蛋白1(k1)和角蛋白10(k10)。
本发明还提供了用于将分离的lsc在体外分化为角膜上皮细胞(cec)的方法。所述方法可包括:(a)获得最初来源于受试者的先前培养的lsc,其优选被解离为单细胞状态;(b)将分离的lsc置于基质或细胞外基质之中和/或之上以形成或允许形成适于分化的三维细胞培养物;和(c)在lsc分化培养基中培养lsc以允许分离的lsc体外分化为cec,从而将分离的lsc体外分化为角膜上皮细胞。
根据本发明的实践,基质或细胞外基质可以是以下中的任一种:
在一个实施方案中,所述基质或细胞外基质包括减少生长因子的
在又一实施方案中,cec因此表达一组标志物,该组标志物包括wnt7a、fzd5、pax6、角蛋白3(k3)和角蛋白12(k12),其相对于lsc,具有统计学上显著更高的k3和k12表达,并且相对于lsc,具有统计学上显著更低的k19表达。
在又一实施方案中,这样产生、获得或扩增的cec不表达p63或相比于lsc表达显著更低水平的p63,并且不表达角蛋白1(k1)和角蛋白10(k10)或相比于皮肤或表皮细胞表达显著更低水平的角蛋白1(k1)和角蛋白10(k10)。
在本发明方法的一个实施方案中,每隔一天更换lsc分化培养基。
本发明还提供了用于在无饲养层的细胞培养基中体外获得和扩增sesc的方法,其包括在本发明的权利要求的无饲养层的细胞培养基中培养分离的sesc皮肤。在一个实施方案中,可从滤泡间表皮分离sesc。在另一实施方案中,从人或动物中携带sesc的任何sesc小生境分离sesc。
本发明另外提供用于从角膜缘干细胞(lsc)获得上皮干细胞(sesc)或sesc样细胞的方法,其包括:(a)敲低wnt7a或pax6基因或蛋白质的表达或活性以足够使细胞命运从lsc改变为sesc命运,从而从lsc细胞获得sesc细胞或sesc样细胞。在一个实施方案中,lsc可与针对wnt7a或pax6的shrna接触,或者,lsc表达所引入的基因,所述基因产生针对wnt7a或pax6基因的shrna、rnai或反义rna,以充分降低wnt7a或pax6的表达,以将lsc转化为sesc细胞或sesc样细胞。
本发明还提供用于在无饲养层的细胞培养基中从受试者体外获得并扩增皮肤上皮干细胞(sesc)的方法。在一个实施方案中,所述方法包括:(a)从受试者的滤泡间表皮或携带ses的任何sesc干细胞小生境获得组织样品;(b)将所述组织解离以获得单细胞;和(c)在无饲养层的细胞培养基中培养(b)单细胞以允许sesc增殖,其中所述增殖的sesc具有分化为皮肤表皮细胞的潜力,从而从受试者体外获得并体外扩增皮肤上皮干细胞。在另一实施方案中,可在本发明的无饲养层的细胞培养基中体外培养sesc。
本发明进一步提供用于从sesc细胞或sesc样细胞体外获得皮肤表皮细胞或皮肤表皮样细胞的方法,其包括在化学成分确定的分化培养基中培养分离的sesc细胞或sesc样细胞,所述培养基支持sesc细胞或sesc样细胞分化为皮肤表皮细胞或皮肤表皮样细胞,从而从sesc细胞或sesc样细胞体外获得皮肤表皮细胞或皮肤表皮样细胞。在一个实施方案中,化学成分确定的分化培养基可以是cnt-02(cellntec)或等同培养基。
本发明仍进一步提供用于治疗需要新皮肤的受试者的方法,其中所述方法包括向所述受试者施用通过本发明的方法获得或通过本发明的任何方法获得并扩增的sesc细胞、sesc样细胞、皮肤表皮细胞或皮肤表皮样细胞,以再次填充所述受试者的sesc细胞群体或皮肤表皮细胞群体,并向所述受试者提供新的皮肤,从而治疗需要新皮肤的受试者。
在一个实施方案中,需要皮肤的受试者可能遭受皮肤营养不良、皮肤疾病、皮肤感染、烧伤、皮肤溃疡、擦伤、黑色素瘤、癌、伤口、衰老、皮肤的遗传病症、皮肤活检、手术、整容缺陷或影响皮肤的重建手术。或者,需要皮肤的受试者可以是需要皮肤替代物或经历整容手术或影响皮肤的重建手术的受试者。
本发明另外提供将角膜缘干细胞或祖细胞(lsc)和/或其后代改变为sesc细胞或sesc样细胞的方法。所述方法包括在lsc中下调wnt7a或pax6基因的表达以足够使lsc和/或其后代改变为sesc细胞或sesc样细胞,从而将lsc和/或其后代改变为sesc细胞或sesc样细胞。
本发明还提供将lsc样细胞和/或其后代改变为sesc细胞或sesc样细胞的方法。所述方法包括在lsc样细胞中下调wnt7a或pax6基因的表达以足够使lsc样细胞和/或其后代改变为sesc细胞或sesc样细胞,从而将lsc样细胞和/或其后代改变为sesc细胞或sesc样细胞。
本发明提供将皮肤上皮干细胞(sesc)和/或其后代改变为lsc细胞或lsc样细胞的方法。所述方法包括在sesc中上调pax6或wnt7a或过表达pax6或wnt7a以足够使sesc细胞和/或其后代改变为lsc细胞或lsc样细胞,从而将sesc和/或其后代改变为lsc细胞或lsc样细胞。
另外,本发明提供将sesc样细胞和/或其后代改变为lsc细胞或lsc样细胞的方法。所述方法包括在sesc样细胞中上调pax6或wnt7a或过表达pax6或wnt7a以足够使sesc样细胞和/或其后代改变为lsc细胞或lsc样细胞,从而将sesc样细胞和/或其后代改变为lsc细胞或lsc样细胞。
本发明提供由本发明的任何方法获得或产生的分离的角膜缘干细胞(lsc)或lsc样细胞的群体。在一个实施方案中,所述lsc表达一组标志物,该组标志物包括wnt7a、fzd5、pax6、p63、角蛋白5(k5)、角蛋白14(k14)、角蛋白19(k19)和ki67。
本发明进一步提供由本发明的任何方法获得的分离的角膜上皮细胞(cec)的群体。在一个实施方案中,所述cec表达(i)一组标志物,该组标志物包括wnt7a、fzd5、pax6、角蛋白3(k3)和角蛋白12(k12),其相比于lsc,具有统计学上显著更高的k3和k12表达,并且相比于lsc,具有统计学上显著更低的k19表达,并且(ii)不表达p63或相比于lsc表达显著更低水平的p63,并且不表达角蛋白1(k1)和角蛋白10(k10)或相比于皮肤或表皮细胞表达显著更低水平的角蛋白1(k1)和角蛋白10(k10)。
本发明进一步提供用于角膜组织修复的试剂盒,其包含通过本发明的任何方法产生的lsc、lsc样细胞或cec、或所述细胞的组合、填充材料和使用说明书。在一个实施方案中,所述试剂盒进一步包含药学上可接受的载体。药学上可接受的载体可以是接触透镜或其等同物,其用于支持细胞在曲部如人眼或动物眼的曲部中附着或生长。在另一实施方案中,所述试剂盒进一步包含人羊膜或动物羊膜。
本发明另外提供药物组合物,其包含有效量的通过本发明的任何方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞、或其所述细胞的组合和适合的药物载体。
本发明还提供用于生长和维持本发明的lsc群体或lsc样群体、或本发明的sesc群体或sesc样群体的试剂盒,其包含用于维持lsc群体的细胞培养基,其中所述培养基基本上不含饲养层。在一个实施方案中,所述试剂盒的组分基本上不含异源物。在再一实施方案中,所述试剂盒进一步包含用于将lsc群体或lsc样群体分化为cec群体或cec样群体的lsc分化培养基。在又一实施方案中,所述试剂盒的组分基本上不含血清。在又一实施方案中,所述组分基本上不含动物产物,如基本上不含人产物。在另一实施方案中,所述试剂盒的组分是化学成分确定的。
还提供了用于角膜组织修复的试剂盒,其包含通过本发明的任何方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞、或所述细胞的组合、填充材料和使用说明书。所述试剂盒可进一步包含药学上可接受的载体。药学上可接受的载体是接触透镜或其等同物,其用于支持细胞在曲部如人眼或动物眼的曲部中附着或生长。另外,所述试剂盒可进一步包含人羊膜或动物羊膜。
治疗性用途
本发明提供了用于治疗患有与机能障碍性角膜缘干细胞或角膜上皮细胞相关的疾病的受试者的方法。在一个实施方案中,所述方法包括:(a)向受试者受影响的眼移植本发明的或通过本发明方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞,其中所移植的细胞填充所述受试者受影响的眼的角膜或角膜缘并恢复正常角膜清澈性和透明性,从而治疗患有与机能障碍性角膜缘干细胞或祖细胞或角膜上皮细胞相关的疾病的受试者。
疾病或病况的示例包括但不限于角膜缘干细胞或祖细胞缺乏、角膜上皮细胞缺乏、对角膜缘的损伤、对眼角膜的损伤、对角膜缘干细胞的损伤、对角膜上皮细胞的损伤、影响角膜发育或功能的先天缺陷、影响角膜发育或功能的获得性缺陷、影响角膜谱系向皮肤谱系转变的细胞命运决定的先天缺陷、影响角膜谱系向皮肤谱系转变的细胞命运决定的获得性缺陷、异常表皮分化、史蒂文斯—约翰逊综合征、无虹膜、复发性翼状胬肉、角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤、化学灼伤、碱性灼伤、部分失明或完全失明。
在一个实施方案中,疾病或病况是部分失明、完全失明、角膜表面疾病、角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤或碱性灼伤。
本发明进一步提供用于恢复患有部分失明、完全失明、角膜表面疾病、角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤或碱性灼伤的受试者的正常角膜清澈性和透明性的方法。在一个实施方案中,所述方法包括(a)向受试者受影响的眼移植本发明的或通过本发明方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞,其中所移植的细胞填充所述受试者受影响的眼的角膜或角膜缘并恢复正常角膜清澈性和透明性,从而恢复患有部分失明、完全失明、角膜表面疾病、角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤或碱性灼伤的受试者的正常角膜清澈性和透明性。
本发明还提供了使受试者的角膜组织再生或修复的方法,其包括将足够量的本发明的或通过本发明的任何方法产生的分离的lsc细胞群体、lsc样细胞群体、cec细胞群体或cec样细胞群体引入所述受试者中,以使角膜组织再生或修复。
在一个实施方案中,所述细胞来自除受试者以外的个体。在另一实施方案中,所述细胞来自用通过所述方法产生的细胞治疗的受试者。
在一个实施方案中,所述受试者是哺乳动物。哺乳动物的示例包括但不限于人、大鼠、狗、猫、猪、马、兔、奶牛、猴或小鼠。
本发明进一步提供了确定患有眼部化生的患者是否可受益于用pax6基因或基因产物治疗的方法。在一个实施方案中,所述方法包括评估化生区域中wnt7a、pax6、k3和/或k12的基因表达或蛋白质水平,化生区域中不存在wnt7a、pax6、k3和/或k12指示患有眼部化生的患者可受益于用本发明的pax6基因或基因产物或细胞治疗。
另外,本发明进一步提供了确定患有眼部化生的患者是否可受益于用wnt7a基因或基因产物治疗的方法。在本发明的一个实施方案中,所述方法包括评估化生区域中wnt7a、pax6、k3和/或k12的基因表达或蛋白质水平,化生区域中不存在wnt7a、pax6、k3和/或k12指示患有眼部化生的患者可受益于用wnt7a基因或基因产物治疗。
此外,本发明进一步提供了确定患有眼部化生的患者是否可受益于用wnt7a和pax6两者的基因或基因产物治疗的方法。在一个实施方案中,所述方法包括评估化生区域中wnt7a、pax6、k3和/或k12的基因表达或蛋白质水平,化生区域中不存在wnt7a、pax6、k3和/或k12指示患有眼部化生的患者可受益于用wnt7a和pax6两者的基因或基因产物治疗。
此外,本发明提供了确定患有眼部化生的患者是否可受益于用通过本发明的任何方法产生的pax6基因或基因产物或细胞治疗的方法,其中所述方法包括评估化生区域中wnt7a、pax6、k3和/或k12的基因表达或蛋白质水平,化生区域中不存在wnt7a、pax6、k3和/或k12指示患有眼部化生的患者可受益于用通过本发明的任何方法产生的pax6基因或基因产物或细胞治疗。
本发明还提供了使受试者的角膜组织再生或修复的方法,其包括将足够量的本发明的分离的lsc群体引入所述受试者中,以使角膜组织再生或修复。所述受试者可以是哺乳动物受试者。示例包括但不限于人、大鼠、狗、猫、猪、马、兔、奶牛、猴或小鼠。
此外,本发明另外提供了用于治疗眼病的方法,其包括向受试者施用足够量的本发明的分离的lsc群体或lsc样群体、或本发明的sesc群体或sesc样群体,使得本发明的分离的lsc群体或lsc样群体产生或过表达足够量的pax6,以产生或维持允许分化为cec细胞或cec样细胞的lsc状态或lsc样状态,从而治疗所述眼病。在一个实施方案中,所述眼病是人角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤和碱性灼伤。根据本发明的实践,所述眼病可以是人眼病。
另外提供了使受试者的角膜组织再生或修复的方法,其包括使受试者的眼的角膜组织、角膜组织的假定位置或角膜组织的前表面与足够量的pax6接触,以使角膜组织再生或修复。
另外提供了使受试者的角膜组织再生或修复的方法,其包括在眼的角膜或眼的前表面上施用足够量的通过本发明的任何方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞、或其所述细胞的组合,以使角膜组织再生或修复。
进一步提供了使受试者的角膜组织再生或修复的方法,其包括向眼的角膜组织、角膜组织的假定位置或角膜组织的前表面上施用足够量的pax6蛋白质,以使角膜组织再生或修复。
还提供了用于评估受试者发生影响角膜或角膜功能的眼病的风险的方法。在一个实施方案中,所述方法包括(a)评估wntz7a、fzd5和pax6或其组合在lsc或角膜上皮细胞中的活性,其中wntz7a、fzd5和pax6或其组合的较低活性或无活性指示受试者发生影响角膜或角膜功能的眼病的风险较高,从而评估受试者发生影响角膜或角膜功能的眼病的风险。
本发明进一步提供了用于鉴别患者群体的方法,所述患者群体适于用通过本发明的任何方法产生的lsc细胞、lsc样细胞、cec细胞或cec样细胞、或其所述细胞的组合进行细胞移植,或用pax6蛋白质或编码pax6的核酸治疗,其中所述患者群体具有角膜中的异常皮肤表皮样细胞以及相关角化和损失、或wntz7a、fzd5和pax6基因或基因组合的降低表达。
本发明还提供了用于在患有角膜缘干细胞缺乏的受试者中用lsc细胞或lsc样细胞再次填充角膜缘的方法。在一个实施方案中,所述方法包括向受试者的眼的前表面施用通过本发明的任何方法产生的lsc细胞或lsc样细胞并允许所述细胞迁移到lsc小生境,从而在所述受试者中用lsc细胞或lsc样细胞再次填充角膜缘。在另一实施方案中,所述方法包括施用lsc细胞或lsc样细胞,包括将一个或多个lsc细胞或lsc样细胞片嫁接到受试者的眼表面上,或者施用包含lsc细胞或lsc样细胞的细胞或组织悬浮物。在又一实施方案中,在向受试者的眼中施用lsc细胞或lsc样细胞之后,可用羊膜、优选人羊膜覆盖lsc细胞或lsc样细胞。
本发明另外提供了用于在患有角膜缘干细胞缺乏的受试者中用lsc细胞或lsc样细胞再次填充角膜缘的方法,其包括向受试者的结膜、假定角膜位置、眼或眼睑的区域施用增加pax6活性或表达的试剂,以将所述结膜、假定角膜位置、眼或眼睑中的皮肤上皮干细胞(sesc)转化为lsc细胞或lsc样细胞,所述lsc细胞或lsc样细胞在迁移到角膜缘后用lsc细胞或lsc样细胞再次填充所述受试者中的角膜缘,从而在受试者中用lsc细胞或lsc样细胞再次填充所述角膜缘。
因此,在一个方面,本发明涉及供应本发明的角膜缘干细胞用于治疗例如视力系统和其它器官损伤或疾病。可使用本发明的治疗组合物治疗的示例性的视力系统损伤或疾病如下:用于患有角膜缘干细胞缺乏的患者的眼部表面的重建(tseng等,1998);通常用于治疗视力系统年龄相关性疾病;用于重建患有角膜持续性上皮缺陷的患者的眼部表面(tseng等,1998);用于在屈光性角膜切除术后角膜上皮愈合以及避免角膜间质重塑和雾状浑浊形成(woo等,2001);作为可促进并支持与史蒂文斯—约翰逊综合征和ocp相关的眼部表面损伤后的愈合过程的物质(tsubota等,1996);用于其它眼前表面疾病中的愈合支持和治疗性方法,所述疾病包括干眼、干燥综合症、热和化学灼伤以及急性和慢性炎症;和作为可治疗总体和部分上皮干细胞缺乏的病因的挥发性化合物。示例性的总体上皮干细胞缺乏包括但不限于化学和热损伤、史蒂文斯—约翰逊综合征、角膜缘区域中的多次手术影响、接触透镜过度佩戴和严重微生物感染。示例性的部分上皮干细胞缺乏包括但不限于神经营养性角膜炎、缺血性角膜炎、外周溃疡和炎性角膜炎、limbitis、无虹膜、翼状胬肉、假性翼状胬肉和多发性内分泌缺乏(tseng等,1998;uchida等,2000)。
根据本发明的组合物的其它示例性用途是作为用于皮肤营养不良、烧伤和皮肤溃疡的治疗(trelford等,1979);作为用于化疗性口炎的疗法;作为自身免疫疾病中的免疫调节物;增加在自体移植物、异体移植物和异源移植物的治疗中的耐受性;作为用于引导骨再生的骨诱导性质的物质(gomes等,2001);作为可并入目前用于体外或体内细菌和其它简单生物体培养的实际硬件中的物质;作为可并入目前使用的专用于细胞培养的装置中的物质,如细胞培养皿、三维基质或凝胶(uchida等,2000);作为用于人细胞的储存介质或培养基;作为将有效的化合物从可及部位运输到需要的部位的整合式递送系统的一部分,用于羊膜的所有有益效果的远程释放;作为骨和组织抗炎药物;作为用于神经变性或炎性疾病的因子和受体的来源;以及作为介导葡萄糖运输的受体的来源。
在所述方法的另一实施方案中,所述眼部手术程序改变角膜的形状或者是屈光手术。在一个具体的实施方案中,所述眼部手术程序是屈光性角膜切除术(prk)、激光辅助的上皮下角膜切除术(lasek)或激光辅助的原位角膜磨削术(lasik)。在另一具体的实施方案中,所述眼部手术程序是自动化板层角膜移植术(alk)、激光热角膜移植术(ltk)或传导性角膜移植术(ck)。
d.靶向的疾病和病症
本发明涵盖治疗患有眼部疾病或病况的受试者的方法,其包括向所述受试者施用在适于递送到所述受试者的治疗制剂中包含治疗量的如本文所述的角膜缘干细胞的组合物。角膜损伤可以是涉及在病理生理学中起作用的任何损伤、病症或疾病。非限制性示例如下所述。
1.眼部损伤
角膜伤口是对眼部表面的损伤,并且可以是热伤口(即烧伤)、化学伤口(即酸)、物理伤口(即擦伤)或手术伤口(即角膜移植)或其组合。本发明的组合物和方法可有效治疗角膜伤口。
a.异物
所有眼部损伤中约25%涉及角膜表面上的异物。如果损伤仅影响角膜上皮,则不会发生瘢痕形成;但如果它还影响鲍曼区,则瘢痕形成是可能的。在去除异物后,用磺酰胺或抗生素治疗眼,并且如果存在睫状充血和畏光,或如果难以去除异物,则用睫状肌麻痹剂如约5%的后马托品治疗。在一些情况下,本发明的治疗组合物被设计成加速由异物引起的损伤的愈合并预防感染,并且改善临床结果。
b.化学灼伤
通过首先通过用流体冲洗眼来稀释化学品,然后通过使用局部抗生素预防感染来治疗化学灼伤。
可通过施加噻吗洛尔、肾上腺素、乙酰唑胺或其它类似试剂来降低眼内压。如果在一周后角膜的上皮形成不完全,除了感染的风险之外,还存在间质坏死的危险。因此,至关重要的是加速愈合以减少这些风险。
严重瘢痕形成是化学灼伤的另一常见结果。本发明的治疗组合物被设计成加速由化学灼伤引起的角膜糜烂的愈合,防止眼的间质坏死和感染,以及减少角膜瘢痕形成,从而恢复/保持角膜透明性。
出乎意料地,本发明的组合物能够预防或减少瘢痕形成,而同时增强眼部愈合、伤口修复并维持角膜透明性。尽管不希望受限于任何特定的作用机制,但似乎由于所述组合物的抗炎作用而可获得这些有益效果。在一些情况下,由于本发明组合物的抗炎和抗凋亡作用的组合而可获得有益效果。
c.撕裂
角膜撕裂之后是封闭损伤的虹膜的脱垂。如在所有眼损伤中,存在感染的风险。撕裂还可延伸到巩膜,这是严重得多的损伤。在这种情况下,需要手术以从受伤区域去除脱垂的葡萄膜组织,并用缝线封闭巩膜。本发明的治疗组合物被设计成加速撕裂的愈合并预防感染。
炎性病况
角膜炎是指角膜的炎症。原因包括但不限于变形虫感染、细菌感染、真菌感染或病毒感染、光照性角膜炎、暴露(眼睑功能障碍)、化学损伤、创伤、手术(lasik、prk、白内障、角膜移植、翼状胬肉手术)或先天性原因,如圆锥形角膜、福克斯营养不良或干燥性角结膜炎。眼的其它炎症介导的病况包括但不限于葡萄膜炎、黄斑水肿、年龄相关性黄斑变性、视网膜脱离、眼部肿瘤、多灶性脉络膜炎、糖尿病性葡萄膜炎、增生性玻璃体视网膜病变(pvr)、交感性眼炎、福格特-小柳-原田(vkh)综合征、组织胞浆菌病和葡萄膜扩散。
当角膜的表面以某种方式被损伤或损坏时,形成角膜溃疡。溃疡可以是无菌的或受感染的,并且决定治疗的过程。细菌感染性溃疡往往极为疼痛,并且通常与上皮(角膜的最外层)中的破裂相关。某些类型的细菌,如假单胞菌(pseudomonas),是极具侵袭性的,并且如果不予处理,可在24-48小时内引起严重的损伤,甚至失明。无菌溃疡引起很少(如果有)的疼痛。它们经常在角膜的外周边缘附近被发现,并且不一定伴随角膜的上皮层中的破裂。角膜溃疡有许多原因。如果接触透镜佩戴者不勤于对他们的透镜和镜盒进行清洁、处置和消毒,则他们处于角膜溃疡的风险增加。细菌感染性溃疡还与损坏角膜表面的疾病相关,所述角膜表面为生物体感染角膜创造了机会窗口。患有严重干眼、眨眼有困难或不能照顾自己的患者也有风险。溃疡的其它原因包括单纯疱疹病毒感染、炎性疾病、角膜擦伤或损伤以及其它全身性疾病。本发明的组合物和方法可有效治疗角膜溃疡。
本发明的组合物和方法可有效治疗角膜炎症。微球的悬浮物可用作眼的抗炎疗法,尤其用于治疗眼附属器、睑结膜或球结膜、角膜和眼球前段的炎性病况。微球的抗炎悬浮物的常见治疗应用包括病毒性结膜炎、变应性结膜炎、红斑痤疮、虹膜炎和虹膜睫状体炎。微球也还用于改善与由于化学或热灼伤或异物穿透所致的角膜损伤相关的炎症。此类病况可能由对眼睛的手术、损伤、变应性或感染引起,并且可引起严重的不适。
值得注意的是,与nsai试剂和皮质类固醇的普遍局部眼部使用相比,微球在减少炎性反应方面具有相当大的治疗优势。局部类固醇的使用与许多并发症相关,包括后囊下白内障形成、眼内压升高、继发性眼部感染、角膜伤口愈合延迟、葡萄膜炎、瞳孔散大、暂时性眼部不适和眼睑下垂。众多全身性并发症也可由局部眼部应用皮质类固醇而引起。这些并发症包括肾上腺功能不全、库兴氏综合征、消化性溃疡、骨质疏松症、高血压、mlscle虚弱或萎缩、生长抑制、糖尿病、感染活化、情绪变化和延迟的伤口愈合。
3.眼部手术应用
根据本发明的微球的组合物还可用于改善与眼部手术相关的炎症,并且在本上下文中特别可用于预防模式以及用于促进愈合和减少瘢痕形成,如上文已详述的。
特别适合的是本发明的组合物用于:屈光性角膜切除术(prk)、激光辅助的上皮下角膜切除术(lasek)、激光辅助的原位角膜磨削术(lasik)、自动化板层角膜移植术(alk)、激光热角膜移植术(ltk)、传导性角膜移植术(ck)、小梁切除术后(滤过手术);翼状胬肉手术后;眼附属器创伤和手术后;眼内手术后,且特别是:晶状体切除术后、玻璃体切除术后、视网膜脱离手术后、以及视网膜外和视网膜下膜剥离后。
可治疗的其它角膜病状包括治疗性光角膜切除术(又名光性治疗性角膜切除术(ptk)),其包括由于以下所致的并发症:reis-bueckler营养不良、groenouw再发、角膜白斑、治疗后角膜炎、翼状胬肉、角膜异物、几种角膜病变、小结角膜移植术后、角膜糜烂、碱灼伤、放射状角膜移植术和prk后,以及在以下的治疗中的并发症:与延伸超出上皮层的角膜瘢痕、不透明性或营养不良相关的视力障碍或刺激症状(例如,来自前部间质板营养不良的持续性上皮缺陷)、复发性角膜糜烂、浅表性角膜营养不良、上皮膜营养不良、角膜融合、角膜溃疡和由于salzmann结节性变性或圆锥角膜结节引起的不规则角膜表面。
本领域技术人员应当了解,这些意在用作可使用本发明的组合物和方法的普遍手术程序的非限制性示例。
4.其它前眼部病况
前眼部病况是影响或涉及前(即眼前部)眼部区域或部位(如眼周mlscle、眼睑或位于晶状体囊或睫状体mlscle的后壁之前的眼球组织或流体)的疾病、病痛或病况。因此,前眼部病况主要影响或涉及结膜、角膜、前房、虹膜、后房(在虹膜之后但在晶状体囊的后壁之面)、晶状体或晶状体囊以及血管化或神经支配前眼部区域或部位的血管和神经。
因此,前眼部病况可包括疾病、病痛或病况,如例如无晶状体;假晶状体;散光;眼睑痉挛;白内障;结膜疾病;结膜炎,包括但不限于特应性角结膜炎;角膜损伤,包括但不限于对角膜间质区域的损伤;角膜疾病;角膜溃疡;干眼综合征;眼睑疾病;泪器疾病;泪管阻塞;近视;老视;瞳孔病症;屈光病症和斜视。青光眼也可被认为是前眼部病况,因为青光眼治疗的临床目标可以是降低眼前房中的房水的高血压(即降低眼内压)。
可根据本发明治疗的其它眼部疾病或病症包括但不限于眼部瘢痕性类天疱疮(ocp)、史蒂文斯—约翰逊综合征和白内障。
干眼综合征是眼科医生治疗的最常见问题之一。它通常由润滑眼的泪膜的质量问题引起。泪液包含三层。粘液层包覆角膜,形成基础,使得泪膜可粘附到眼,中间水层向角膜提供湿气并供应氧和其它重要营养素,且外脂质层是密封眼上的泪膜并有助于防止蒸发的油性膜。泪液由眼周围的几个腺体形成。水层在位于上睑下方的泪腺中产生,并且眼睑中的几个较小的腺体产生油层和粘液层。每次眨眼时,眼睑将泪液散布在眼上。过量的泪液通过鼻流入眼角中的两个微小的引流管道中。这些管道产生连接到鼻道的微小的小管。干眼综合征有许多原因。干燥的最常见的原因之一是正常的衰老过程。许多其它因素,如热、干燥或多风的气候、高海拔、空调和香烟烟雾也会引起干眼。许多人还发现,当他们在电脑上阅读或工作时,他们的眼睛变得刺痛。接触透镜佩戴者也可能遭受干燥,因为触点吸收泪膜,导致透镜表面上形成蛋白质。某些药物、甲状腺病况、维生素a缺乏、绝经以及诸如帕金森病和斯耶格伦综合征的疾病也可引起干燥。本发明的组合物和方法可有效治疗干眼综合征。
配制、给药和施用
可向受试者施用包含角膜缘干细胞的组合物以提供各种细胞或组织功能,例如治疗由创伤、手术、遗传、疾病等所致的眼科病症。如本文所用的“受试者”可意指人或非人动物。
此类组合物可使用一种或多种生理学上可接受的载体(任选包括赋形剂和助剂)以任何常规方式配制。适当的制剂依赖于所用的施用途径。所述组合物可包装有关于它们在治疗眼科疾病或恢复治疗上重要的代谢功能方面的用途的书面说明。所述组合物还可在一种或多种生理上可接受的载体中被施用给接受者。
治疗试剂盒-本发明还提供了包含包装材料和含于所述包装材料内的本发明的药物组合物的制造物品,其中所述药物组合物包含单独的lsc或与载体组合的lsc。包装材料包括标签或包装插页,其指示lsc可用于治疗眼科病症,例如角膜病症/疾病/损伤。
在一个实施方案中,本发明提供了载体,如接触透镜产品,其包括装载有本发明lsc的软性一次性接触透镜。在一个实施方案中,接触透镜可以是生物相容性网格。如本文所用的术语“生物相容性网格”意在指可促进形成为有助于组织发育的三维结构的衬底。因此,例如,可将细胞培养或接种到此类生物相容性网格上,如包含细胞外基质材料或经生物包覆以支持lsc生长或粘附的网格。网格可被模制成期望的形状,用于促进组织类型的发育。此外,至少在细胞培养的早期阶段,培养基和/或衬底补充有促进适当的组织类型和结构发育的因子(例如,生长因子、细胞因子、细胞外基质材料等)。lsc可在运输到接受者之前在透镜上扩增或放置在透镜上。
用于使用本发明的方法形成软性接触透镜的适合材料包括但不限于硅酮弹性体、含硅酮的大分子单体(包括但不限于以引用方式整体并入本文的美国专利号5,371,147、5,314,960和5,057,578中所公开的那些)、水凝胶、含硅酮的水凝胶等和其组合。更优选地,透镜由含有硅氧烷官能团的材料制成,所述材料包括但不限于聚二甲基硅氧烷大分子单体、甲基丙烯酰氧基丙基聚烷基硅氧烷和其混合物、硅酮水凝胶或由含有羟基、羧基或两者的单体制成的水凝胶和其组合。用于制备软性接触透镜的材料是众所周知的且市售的。例如,透镜材料是acquafilcon、etafilcon、genfilcon、lenefilcon、balafilcon、lotrafilcon或galyfilcon。透镜可通过在包装溶液中使用添加剂而进一步增强。此类添加剂的一个示例是聚乙烯吡咯烷酮。适合的透镜材料是聚甲基丙烯酸甲酯。然而,还可使用其它材料,如透气性材料(包括硅酮、聚甲基丙烯酸甲酯和硅酮的组合以及乙酸丁酸纤维素)。
本公开的接触透镜可以是透明的(即,具有至少约20%的可见光透射率)、不透明的或两者的组合。例如,在某些实施方案中,本公开的接触透镜可以是透明的,在这种情况下,接触透镜可为一只或两只眼提供或不提供视力矫正。
本公开的接触透镜可包含软柔性材料,或可包含刚性的透气性材料。软柔性材料的示例可使用一种或多种聚合物形成,如聚合物的组合,如硅酮、硅酮水凝胶或其它水凝胶材料(例如,含有两种或更多种水凝胶单体的均聚物或共聚物的材料,所述水凝胶单体如甲基丙烯酸2-羟基乙酯、1-乙烯基-2-吡咯烷酮、甲基丙烯酸等)。刚性材料的示例包括硅酮丙烯酸酯(s/a)共聚物、氟硅酮丙烯酸酯(f-s/a)共聚物和聚(甲基丙烯酸甲酯)(pmma)。
透镜可具有曲率,以匹配角膜的自然曲率并提供标准配合。在软性接触透镜的情况下,这可以是一个大小。例如,接触透镜可在标准角膜曲率范围(例如,基础曲度范围为8mm到10mm,以及其它值)被提供,并且可具有直径范围(例如,直径范围为8mm到18mm,以及其它值),以为患者提供舒适且安全的配合。软接触透镜的理想大小可以是8.8mm的基础曲度和14mm的直径以及其它值。
本公开的另外其它方面涉及可用于治疗患者的试剂盒。试剂盒可包括根据本公开可用于治疗患者的所有组分的全部或子集。试剂盒可包括例如:(a)根据本公开的一个或多个接触透镜,(b)治疗量的本发明的培养的lsc,(c)制剂中的细胞外基质,用以支持本发明的lsc的生长,所述基质可以或可以不被生物包覆在接触透镜上,(d)任选地,在运输期间维持本发明的lsc的生长或缓冲lsc的培养基,(e)关于将本发明组合物施用于患者的眼和/或关于配合接触透镜的说明书,以及(f)监管细胞治疗产品、药物和/或医疗装置的政府监管机构所要求的包装和信息。另外,本发明的试剂盒可包括适合的液体载体(例如注射用无菌水、生理盐水、磷酸盐缓冲液、磷酸盐缓冲盐水等)的一个或多个容器,以从本发明的透镜洗涤过量的培养基。
在某些实施方案中,试剂盒的组分被提供于单一无菌包装中,以供健康护理专业人员方便使用。
在优选的实施方案中,所述基质选自哺乳动物羊膜、matrigeltm和其等同物、层粘连蛋白、腱糖蛋白、巢蛋白、透明质酸酶、纤维蛋白原、凝血酶、胶原-iv、胶原-iv片、聚-l-赖氨酸、明胶、聚-l-鸟氨酸、纤连蛋白、凝血酶片(纤维蛋白封闭剂,relisealtm,reliancelifesciences)等或其组合。
用于产生本文所公开的组织系统的组织基底的一个示例是人羊膜,其可以使用本领域技术人员熟知的方法制备。人羊膜可带有上皮层完整使用,或将上皮细胞剥去使用。用于制备人羊膜的优选方法公开于下文的实施例中。在其它实施方案中,用另外的支持材料(例如促进lsc结合到组织基底上的材料)生物包覆组织基底。可采用的另外的支持材料可选自纤维蛋白原、层粘连蛋白、胶原iv、腱糖蛋白、纤连蛋白、胶原、牛垂体提取物、egf、肝细胞生长因子、角质形成细胞生长因子、氢化可的松或其组合。
或者,在一个非限制性实施方案中,本发明的组合物可被局部施用于眼,如例如以滴眼剂的形式。在又一非限制性实施方案中,滴眼剂包含本发明的lsc,其可被施用于角膜以治疗角膜疾病或病症。
在各种实施方案中,本发明的组合物可包含在溶液、悬浮物或两者中包含本发明的ilsc的液体。如本文所用的液体组合物包含凝胶。
在其它实施方案中,组织基底是胶原凝胶或纤维蛋白凝胶,并且所述凝胶可进一步包含用于产生组织系统的其它期望的细胞类型,包括但不限于成纤维细胞,如角膜间质成纤维细胞,间充质组织的衍生物,和上皮细胞,如角膜上皮细胞。在其它实施方案中,组织基底是水凝胶,例如合成水凝胶、软性水凝胶接触透镜或聚hema基质。在某些实施方案中,在移植、植入或嫁接组织系统后,组织基底将在体内逐渐被吸收。另外,组织基底示例性地是非抗原性的,并且促进上皮化而没有显著的纤维血管生长。
本文中的术语“悬浮物”包括液体组合物,其中本发明的lsc与细胞外基质和培养基组合存在于溶液中。本发明还可以分离本发明的不同组分,其中提供了具有培养基的悬浮物中的lsc和分开地具有细胞外基质的第二溶液,其中悬浮物和溶液两者在处理时被合并,分开或组合引入(例如,在递送之前预混合)。
在优选的实施方案中,所述基质选自哺乳动物羊膜、matrigeltm和其等同物、层粘连蛋白、腱糖蛋白、巢蛋白、透明质酸酶、纤维蛋白原、凝血酶、胶原-iv、胶原-iv片、聚-l-赖氨酸、明胶、聚-l-鸟氨酸、纤连蛋白、血小板源生长因子(pdgf)、凝血酶片(纤维蛋白封闭剂,relisealtm,reliancelifesciences)等或其组合。
用于产生本文所公开的组织系统的组织基底的一个示例是人羊膜,其可以使用本领域技术人员熟知的方法制备。人羊膜可带有上皮表面完整使用,或将上皮细胞剥去使用。用于制备人羊膜的示例性方法公开于下文的实施例中。在其它实施方案中,用另外的支持材料(例如促进lsc结合到组织基底上的材料)生物包覆组织基底。可采用的另外的支持材料优选选自纤维蛋白原、层粘连蛋白、胶原iv、腱糖蛋白、纤连蛋白、胶原、牛垂体提取物、egf、肝细胞生长因子、角质形成细胞生长因子、氢化可的松或其组合。
优选地,液体组合物是水性的。或者,所述组合物可以呈软膏的形式。在优选的实施方案中,所述组合物是原位可胶凝的水性组合物,例如作为原位可胶凝的水溶液。此类组合物可包含在与眼或眼外部中的泪液接触时有效促进胶凝的浓度的胶凝剂。
本发明的水性组合物具有眼科相容性ph和渗透压。这些组合物可结合抑制微生物生长的手段,例如通过在无菌条件下制备并包装和/或通过包含抗微生物有效量的眼科上可接受的防腐剂。适合的防腐剂非限制性地包括含汞物质,如苯基汞盐(例如,乙酸苯汞、硼酸苯汞和硝酸苯汞)和硫柳汞;稳定化二氧化氯;季铵化合物,如苯扎氯铵、十六烷基三甲基溴化铵和西吡氯铵;咪唑烷基脲;对羟基苯甲酸酯,如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯和对羟基苯甲酸丁酯和其盐;苯氧基乙醇;氯苯氧基乙醇;苯氧基丙醇;氯丁醇;氯甲酚;苯乙醇;edta二钠;以及山梨酸和其盐。
适合的胶凝剂非限制性地包括热固性聚合物,如环氧乙烷和环氧丙烷的四取代的乙二胺嵌段共聚物(例如泊洛沙胺1307);聚卡波非和多糖,如结冷胶、角叉菜胶(例如κ-角叉菜胶和ι-角叉菜胶)、壳聚糖和藻酸盐胶。短语“原位可胶凝的”不仅包括可在与眼接触或与眼外部中的泪液接触时形成凝胶的低粘度的液体,而且还包括在施用于眼或眼周围区域时展示显著增加的粘度或凝胶硬度的更粘的液体,如半流体和触变凝胶。
本领域技术人员可容易地确定用于特定目的的本发明lsc的适当浓度或剂量。本领域技术人员将认识到优选的剂量是在有需要的患者中产生治疗效果如角膜伤口愈合的剂量。当然,lsc的适当剂量可能需要在使用时基于几个变量的经验确定,所述变量包括但不限于所治疗的疾病、损伤、病症或病况的严重性和类型;患者的年龄、体重、性别、健康状况;向患者施用的其它药物和治疗;等。提供了大量的lsc以确保适当的治疗。本领域技术人员还将认识到,待施用的剂量数目(给药方案)也需要基于例如所治疗的疾病、损伤、病症或病况的严重性和类型来经验地确定。在一个实施方案中,一个剂量是足够的。其它实施方案涵盖2个、3个、4个或更多个剂量。在其它实施方案中,本发明组合物可被涂覆到接触透镜的内表面上,然后被置于眼上,从而允许lsc直接递送到眼部表面。用于涂覆接触透镜的lsc可被配制在液体、凝胶或其它适合的眼科相容的媒介物中。
本发明的培养基
本发明还提供了用于lsc细胞、lsc样细胞、sesc细胞或sesc样细胞的短期体外培养的无饲养层的细胞培养基,其包含最低必需培养基、生长因子、激素、可溶性因子和血清或血清代用品。在一个实施方案中,较短期体外培养被用于传代约第0至约第4次传代的lsc细胞、lsc样细胞、sesc细胞或sesc样细胞。
在本发明的一个实施方案中,所述培养基包含dmem/f12培养基、dmem、青霉素-链霉素、胎牛血清、egf、胰岛素、氢化可的松、霍乱毒素和3,3’,5-三碘-l-甲状腺原氨酸,其中所述胎牛血清可用人血清或血清代用品取代,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素,并且其中所述组分中的每一种均可用功能等同的组分替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec细胞或皮肤表皮细胞即可。
在另一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有约10-20%范围的胎牛血清或约10-20%范围的针对血清的血清代用品、10-20ng/ml范围的egf、5-10μg/ml范围的胰岛素、0.2-0.8μg/ml范围的氢化可的松、5×10-11m到5×10-10m范围的霍乱毒素和10-9m到4×10-9m范围的3,3′,5-三碘-l-甲状腺原氨酸,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素,并且其中所述组分中每一种均可用功能等同的组分替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec细胞或皮肤表皮细胞即可。
在又一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有100u/ml青霉素、100μg/ml链霉素、10%胎牛血清、10ng/mlegf、5μg/ml胰岛素、0.4μg/ml氢化可的松、10-10m霍乱毒素和2×10-9m3,3′,5-三碘-l-甲状腺原氨酸,其中所述胎牛血清可用人血清或血清代用品取代,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素,并且其中所述组分中每一种均可用功能等同的组分替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec细胞或皮肤表皮细胞即可。
本发明还提供了用于lsc细胞、lsc样细胞、sesc细胞或sesc样细胞的长期体外培养的无饲养层的细胞培养基,其包含最低必需培养基、生长因子、激素、可溶性因子、血清或血清代用品和rho-相关蛋白质激酶(rock)抑制剂。在本发明的一个实施方案中,长期体外培养被用于传代约17次或更多次传代的lsc细胞、lsc样细胞,sesc细胞或sesc样细胞。
在一个实施方案中,所述培养基包含dmem/f12培养基、dmem、青霉素-链霉素、胎牛血清、egf、胰岛素、氢化可的松、霍乱毒素和3,3’,5-三碘-l-甲状腺原氨酸和y-27632,其中所述胎牛血清可用人血清或血清代用品取代,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素,其中y-27632可用另一rock抑制剂替代,并且其中所述组分中的每一种均可用功能等同的组分替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec细胞或皮肤表皮细胞即可。
在另一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有约10-20%范围的胎牛血清或约10-20%范围的针对血清的血清代用品、约10-20ng/ml范围的egf、约5-10μg/ml范围的胰岛素、约0.2-0.8μg/ml范围的氢化可的松、约5×10-11m到5×10-10m范围的霍乱毒素、约10-9m到4×10-9m范围的3,3′,5-三碘-l-甲状腺原氨酸和约1-10μm范围的y-27632,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素,其中y-27632可用另一rock抑制剂替代,并且其中所述组分中每一种均可用功能等同物替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec或皮肤表皮细胞即可。
在再一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有约100u/ml青霉素、约100μg/ml链霉素、约10%胎牛血清、约10ng/mlegf、约5μg/ml胰岛素、约0.4μg/ml氢化可的松、约10-10m霍乱毒素、约2×10-9m3,3′,5-三碘-l-甲状腺原氨酸和约1μmy-27632,其中所述胎牛血清可用人血清或血清代用品取代,其中egf和胰岛素可以分别是重组egf和/或重组胰岛素,优选重组人egf和重组人胰岛素。y-27632可用另一rock抑制剂替代。此外,每一组分均可用功能等同物替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec细胞或皮肤表皮细胞即可。
本发明另外提供了用于lsc细胞或lsc样细胞的长期体外培养的无饲养层的细胞培养基,其包含最低必需培养基、生长因子、激素、可溶性因子、血清或血清代用品、rho-相关蛋白质激酶(rock)抑制剂和白血病抑制因子(lif)。长期体外培养可被用于传代约17次或更多次传代的lsc细胞或lsc样细胞。
在一个实施方案中,所述培养基包含dmem/f12培养基、dmem、青霉素-链霉素、胎牛血清、egf、胰岛素、氢化可的松、霍乱毒素和3,3’,5-三碘-l-甲状腺原氨酸、y-27632和lif,其中所述胎牛血清可用人血清或血清代用品取代,其中egf、胰岛素和lif可以分别是重组egf、重组胰岛素和/或重组lif,优选重组人egf、重组人胰岛素和重组人lif,其中y-27632可用另一rock抑制剂替代,并且其中所述组分中的每一种均可用功能等同的组分替代,只要lsc细胞或lsc样细胞增殖且不分化为cec即可。
在另一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有约10-20%范围的胎牛血清或约10-20%范围的针对血清的血清代用品、约10-20ng/ml范围的egf、约5-10μg/ml范围的胰岛素、约0.2-0.8μg/ml范围的氢化可的松、约5×10-11m到5×10-10m范围的霍乱毒素、约10-9m到4×10-9m范围的3,3′,5-三碘-l-甲状腺原氨酸、约1-10μm范围的y-27632和约5-20ng/mllif。此外,egf、胰岛素和lif可以分别是重组egf、重组胰岛素和/或重组lif。优选使用重组人egf、重组人胰岛素和重组人lif。此外,y-27632可用另一rock抑制剂替代。此外,每一组分均可用功能等同物替代,只要lsc细胞、lsc样细胞、sesc细胞或sesc样细胞增殖且不分化为cec即可。
在再一实施方案中,所述培养基包含dmem/f12和dmem(1:1),其具有约100u/ml青霉素、100μg/ml链霉素、10%胎牛血清、10ng/mlegf、5μg/ml胰岛素、0.4μg/ml氢化可的松、10-10m霍乱毒素、2×10-9m3,3′,5-三碘-l-甲状腺原氨酸、1μmy-27632和10ng/mllif。胎牛血清可用人血清或血清代用品取代;egf、胰岛素和lif可以分别是重组egf、重组胰岛素和/或重组lif,优选重组人egf、重组人胰岛素和重组人lif。y-27632可用另一rock抑制剂替代。另外,在其它实施方案中,每一组分均可用功能等同物替代,只要lsc细胞或lsc样细胞增殖且不分化为cec即可。
适合的rock抑制剂的示例包括但不限于(r)-(+)-反式-4-(1-氨乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐一水合物(y-27632;sigma-aldrich)、5-(1,4-二氮杂环庚烷-1-基磺酰基)异喹啉(法舒地尔或ha1077;caymanchemical)、h-1152、h-1152p、(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]高哌嗪二盐酸盐、二甲基法舒地尔(dimf;h-1152p)、n-(4-吡啶基)-n′-(2,4,6-三氯苯基)脲、y-39983、wf-536、snj-1656和(s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂
根据本发明的实践,胎牛血清可用人血清或另一血清代用品(取决于这样获得和/或扩增的干细胞的哺乳动物来源)取代。例如,干细胞可来自哺乳动物如人、大鼠、狗、猫、猪、马、兔、奶牛、猴或小鼠。
在一个实施方案中,egf、胰岛素或lif分别为重组egf、重组胰岛素或重组lif。例如,egf可以是重组人egf。仅举例来说,胰岛素可以是重组人胰岛素。在另一示例中,lif可以是重组人类lif。
在一个实施方案中,本发明提供了本发明的培养基,其具有上述任何实施方案的组分,但没有糖原合酶激酶3(gsk3)抑制剂和/或转化生长因子β(tgf-β)抑制剂。
在另一实施方案中,本发明提供了基本上由上述任何实施方案的组分组成的本发明的培养基。
在再一实施方案中,用于本发明中的激素包括糖皮质激素、氢化可的松、糖皮质激素受体激动剂、甲状腺激素、3,3',5-三碘-l-甲状腺原氨酸或t3、甲状腺受体激动剂和胰岛素。激素可被合成以反映在自然界中发现的激素的结构,或者可以是未在自然界中发现但能够调节特定激素受体(如糖皮质激素受体、甲状腺受体或胰岛素)的活性的合成/人工激素受体。
包括以下实施例以证实本公开的优选实施方案。本领域技术人员应当了解,以下实施例中所公开的技术代表了本发明人发现的在本发明的实施中良好地发挥作用的技术,因此可被视为构成其优选实施模式。然而,本领域技术人员根据本公开应当了解,可在不脱离本发明精神和范围的情况下对所公开的具体实施方案作出许多改变,并且仍然获得相同或类似的结果。
实施例
提出以下实施例以向本领域普通技术人员提供如何制备和使用本发明的方法和组合物的完全公开和描述,并且不意在限制本发明人所认为的其发明的范围。已经做出努力以确保关于所使用的数字(例如,量、温度等)的精确性,但应当考虑一些实验误差和偏差。除非另有说明,否则份数是重量份,分子量是平均分子量,温度是摄氏度,并且压力是大气压或接近大气压。
实施例1
材料和方法
人类病理学样品
获得角膜上皮鳞状化生和所有其它组织作为去识别化的手术标本,固定在5%福尔马林中,包埋到石蜡中,切片并染色,用于免疫荧光研究。
角膜缘干细胞和皮肤表皮干细胞的分离和培养
从眼库获得死后人眼球,取出边缘区域并将其在具有100iu青霉素和100μg/ml链霉素的冷pbs中洗涤,并且切成小片。通过在37℃用0.2%胶原酶iv消化2小时来获得细胞簇,通过在37℃用0.25%胰蛋白酶-edta进一步消化15min来获得单细胞。将原代细胞接种在用2%减少生长因子的matrigel(354230,bdbiosciences公司)包覆的塑料板上。使用与人lsc相同的方法分离来自gfp标记的大鼠和兔的角膜缘干细胞,并培养。
从眼睑的供体皮肤活检标本获得人表皮,并在显微镜下移出毛囊。使用与对人角膜缘干细胞所述相同的方法从滤泡间表皮分离原代人和兔表皮干细胞。培养基如下:dmem/f12和dmem(1:1),其具有1/100pen-strep、10%胎牛血清、10ng/mlegf、5μg/ml胰岛素、0.4μg/ml氢化可的松、10-10m霍乱毒素和2×10-9m3,3′,5-三碘-l-甲状腺原氨酸。
本实施例1中所用的所有细胞均来自我们实验室制备的原代培养细胞。常规进行支原体污染测试,并且为阴性。
体外三维(3-d)分化方案
在24孔板或8孔室上进行3-d分化。简单地说,将解离的单个干细胞以2×104个细胞/50μl凝胶包埋在
免疫荧光和激光共焦显微镜检查
为了检测培养细胞中蛋白质的定位,将细胞用4%多聚甲醛固定20min,然后用0.3%tritonx-100-pbs渗透5min两次,并在含有5%牛血清白蛋白和0.3%tritonx-100的pbs溶液中封闭,之后在4℃下在一级抗体中培育过夜。在pbs中洗涤3次后,将细胞与二级抗体培育。用dapi将细胞核复染。对于石蜡包埋的组织切片的免疫荧光,进行脱石蜡化,之后进行上述相同的免疫荧光方案。
使用以下抗体:小鼠抗p63单克隆抗体、兔抗k5单克隆抗体、小鼠抗k10单克隆抗体、用生物素标记的小鼠抗k14单克隆抗体、小鼠抗k19单克隆抗体(ma1-21871、rm2106s0、ms611p0、ms115b0、ms1902p0,thermofisherscientific公司)、兔抗pax6多克隆抗体(prb-278p,covance公司)、小鼠抗k1单克隆抗体(sc-376224,santacruz公司)、兔抗wnt7a多克隆抗体、小鼠抗k3/12单克隆抗体、兔抗k12单克隆抗体(ab100792、ab68260、ab124975,abcam公司)、小鼠抗ki67单克隆抗体(550609,bdscience公司)、抗gfp兔单克隆抗体和抗gfp小鼠单克隆抗体(g10362、a11120,invitrogen公司)。以1:500的稀释度使用二级抗体alexafluor488或568缀合的抗小鼠或兔免疫球蛋白g(igg)(invitrogen公司)。使用olympusfv1000共焦显微镜获得图像。
实时pcr(q-pcr)
使用rneasy试剂盒(qiagen公司)分离rna,并经受柱上dnase消化。使用superscriptiii逆转录酶试剂盒根据制造商说明书(invitrogen公司)进行cdna合成。使用基因特异性引物(表1)和powersybrgreenpcrmastermix在7500实时pcr系统(appliedbiosystems公司)上通过40个循环扩增进行定量pcr。以一式三份进行测量并将其归一化为内源性gapdh水平。使用δδct方法计算表达的相对倍数变化(ct值<30)。基于三次重复,数据显示为平均值±sd。
表1.引物序列
全基因组的基因表达微阵列和数据分析
从来自3-d分化测定的lsc、sesc和分化的cec分离总rna。使用illumina人类基因组微阵列系统对每个样品以生物学重复进行基因表达微阵列分析(n=2/组;humanht-12v4expressionbeadchip;illumina,sandiego,ca)。原始数据以保藏号gse32145保藏在geo数据库中。表达水平数据通过illuminabeadstudio3.4.0版生成并使用四分位数归一化进行归一化。在至少一个样品中表达水平超过阈值64的探针被认为被检测到。通过检查log2表达水平的分布图发现阈值。检测到的探针根据它们的q值进行分选,q值是探针被称为显著的最小错误发现率(fdr)。使用微阵列的显著性分析和其在官方统计软件包sam中的实施来评价fdr19。为了避免由于假的小差异所致的假阳性调用,将用于正则化t统计中的可交换性因子s0的标准偏差值的百分位数设定为50。我们将lesc和cec样品合并成一组四个样品,并寻找该组与sesc样品之间的差异表达基因。该比较中的前100个显著的基因呈现于图4中。该图中的所有基因在0.01或更小的fdr水平下都是显著的。使用内部层次聚类软件创建热点图,并且颜色定性地对应于倍数变化。
rna-seq和层次聚类分析
通过picropurerna分离试剂盒(lifetechnology)纯化总rna。如先前所述进行rna-seq20。简单地说,首先通过superscriptiii第一链合成试剂盒用引物biotin-b-t将600ng总rna转化为cdna。通过nucleospingel和pcrclean-upkit柱(clontech)去除游离引物和酶来纯化cdna。然后,施加末端转移酶(neb)以封闭cdna3'端的末端。进一步施加抗生蛋白链菌素包覆的磁珠(lifetechnology)以分离cdna。在用氢氧化钠降解rna后,通过用引物a-n8随机引发来合成第二链cdna。通过热变性从珠粒洗脱第二链cdna。然后将cdna用作模板,以通过用条码引物和引物pb扩增来构建文库。在hiseq2000系统上进行测序。
用聚类和javatreeview进行层次聚类分析21。首先使用由cluster程序提供的默认参数过滤原始数据,通过对数变换进一步调节过滤的数据,用中值将基因和阵列中心化,然后用欧几里德和平均连锁对基因和阵列进行层次聚类。通过javatreeview显现并产生层次树和基因矩阵。
慢病毒rnai和pax6转导
靶向pax6、wnt7a和fzd5基因的慢病毒shrna被克隆到plko.1质粒中的agei和ecori之间或直接购自sigma。用于基因特异性敲低的shrna靶向序列如下:pax6,cgtccatctttgcttgggaaa和agtttgagagaacccattatc;wnt7a,cgtgctcaaggacaagtacaa和gcgttcacctacgccatcatt;fzd5,cgcgagcccttcgtgcccatt和tcctaaggttggcgttgtaat。我们使用编码shrna的慢病毒plko.1-puronon-targetshrna对照质粒(sigma公司)作为所有基因敲低实验中的阴性对照,该对照质粒不靶向来自任何物种的任何已知基因。
根据先前所述的方案22制备慢病毒shrna颗粒。简单地说,通过shrna构建体与包装混合物(9:1比率的pcmv-dr8.2和pcmv-vsvg)的共转染,将无复制能力的慢病毒粒子包装在293t细胞中。在转染后48hr和72hr收获病毒两次。
对于转导,从购自thermoscientific的cdna(mhs6278-202756612)对pax6aorf进行pcr扩增,并将其插入plenticmv-gfppuro载体的bamhi和bsrg1之间。通过pcr介导的点突变策略用引物pax6inf和pax6inr(表1)产生pax6b。对于gfp-标记,使用购自addgene的plenticmv-gfphygro(656-4)。通过与包装质粒pspax2和pmd2.g共转染来包装慢病毒粒子。
对于慢病毒感染,用含有单个病毒和聚凝胺的新鲜培养基将细胞感染16-20hr,最终浓度为8μg/ml。通过2μg/ml嘌呤霉素持续48hr或200μg/ml潮霉素持续72hr来进一步选择受感染的细胞。
蛋白质印迹和共免疫沉淀(co-ip)
对于蛋白质印迹法,用pbs将细胞洗涤一次,然后收集于细胞溶解缓冲液(50mmtris-hcl,ph6.8;2%sds;10%甘油;100mmdtt)中。通过nanodrop对蛋白质浓度进行定量,并添加溴酚蓝至最终浓度为0.1%,然后在4-12%nupage凝胶(lifetechnology公司)上分级分离25μg总裂解物。将蛋白质在100v下转移至硝酸纤维素膜并持续1小时。用5%牛乳封闭膜并用相关抗体和小鼠抗β-肌动蛋白单克隆抗体(a5316,sigma公司)检测。
为了检测fzd5和wnt7a之间的相互作用,收集10cm皿的90%汇合时的角膜缘干细胞;将细胞沉淀物重悬于700μlco-ip缓冲液(10mmtris-hcl,ph7.4,100mmnacl,2.5mmmgcl2,0.5%np-40,1×蛋白酶抑制剂)中并在冰上培育20分钟,然后在4℃以13,000rpm离心20分钟。将600μl上清液等分到两个预冷的微量离心管中,向每个管中添加5μg兔抗fzd5单克隆抗体(编号5266,cellsignaling公司)或wnt7a抗体,并在4℃培育过夜。向每个管中添加50μl蛋白a/g磁珠(thermofisher公司),并在4℃培育2小时,用co-ip缓冲液洗涤,并在70℃在1xsds样品缓冲液(lifetechnology公司)中洗脱。将输入物和洗脱物在4-12%nupage凝胶上分级分离,并用fzd5和wnt7a抗体印迹。
细胞移植
所有动物研究均完全根据在眼科和视力研究中使用动物的arvo声明进行,并且获得了公共机构动物护理委员会的批准。
在研究中使用新西兰白兔(2.0kg-2.5kg,雄性)。通过肌内注射盐酸赛拉嗪(2.5mg/ml)和盐酸氯胺酮(37.5mg/ml)将兔麻醉。为了创建角膜缘干细胞缺乏模型(图11f),通过360度结膜环状切开术和板层剖分去除从角膜缘后2mm到角膜中心的前巩膜组织和角膜间质组织,来去除角膜和角膜缘上皮。这种剖分确保了去除lsc和整个角膜上皮。将5×105个兔gfp标记的lsc细胞、pax6+sesc细胞或shpax6lsc细胞与纤维蛋白(25mg/ml)和凝血酶(25u/ml)混合并且接种到接受者角膜和角膜缘区域的暴露间质床上;然后通过用10.0vicryl缝线(ethicon,usa)固定的人羊膜(bio-tissue公司,usa)将所述表面覆盖(表2)。
表2.兔移植结果汇总
作为阴性对照,仅将羊膜施加于裸露的角膜。在细胞移植程序后立即将抗生素(左氧氟沙星)和类固醇(倍他米松)施加于两只眼,并且每天施用三次,持续2周。将动物随机分配到每个实验组中。进行细胞移植的研究人员对所使用的细胞的身份不知情。另一研究人员用于评估兔的角膜上皮修复的效果,并且对移植中所用的细胞的身份不知情。对于分析,我们只排除死于术后并发症如感染的动物,因为它们没有达到用于评估细胞移植效果的终点;该准则是预先建立的。
结果和讨论
角膜上皮和皮肤上皮共有许多相似性,包括分层上皮的典型形态以及在角膜缘和表皮中的角蛋白5/角蛋白14+(k5/k14)基底细胞层中p63对它们的干细胞的维持4-8(图1a、图1b、图2a和图2b)。`然而,它们之间有明显的差异。皮肤上皮干细胞(sesc)在分化期间从深层垂直向上移动到基底上层9,10,其中k5和k14被皮肤特异性k1/k10替代(参照11;图2c和图2d)。相比之下,lsc(由角膜缘处的k19限定12,参见图1a和图2e)向心地迁移几毫米到中央角膜,在此期间,它经历分化并且k5/k14被角膜特异性k3和k12替代(参照13、14;图1c和图2f)。
由cec维持的清澈、透明的角膜是视力所必需的。cec向皮肤样上皮细胞的病理转化(如形态变化和角蛋白表达的转变(例如,基底层处皮肤特异性k1/k10连同k5阳性细胞对角膜特异性k3/k12的替代,参见图1d)所指示的)导致角膜的透明性损失,并导致全世界数百万人遭受部分或完全失明3,但潜在机制仍然在很大程度上是未知的。
为了阐明潜在的疾病机制,我们成功地开发了无饲养层的细胞培养方案,以扩增来自人类供体的lsc,使我们能够产生均一的细胞群体,以描绘出参与控制lsc细胞命运决定和cec分化的关键因素。增殖的lsc的特征在于阳性p63和k19与高百分比的有丝分裂标志物ki67(图2g和图3a)。我们接下来建立了3-dlsc分化方案,以在14-18天内从单个lsc建立3-dcec球结构,如通过cec特异性标志物k3/k12的强表达所证明的(图3b)。3-d分化球进一步的特征在于lsc和cec之间的基因表达的关键差异,后者显示k3(↑31.2倍)和k12(↑24.7倍)的增加表达,以及k19的伴随降低表达(↓6.2x,全部p<0.01;参见图2h)。我们采取了类似的策略来扩增sesc,并且观察到培养的sesc中典型的sesc标志物p63和k5的强表达(图3c)。如所预期的,我们检测到与sesc相比,3-d分化的皮肤上皮细胞(sec)中表皮分化标志物k1(↑16.6倍)和k10(↑225.8倍)的增加表达(图2i、图2j和图3d)。
为了鉴别在lsc、cec和sesc中独特表达的另外的基因,我们进行了全基因组基因表达分析(图3e、图4a和图4b)。在差异表达的基因中,我们集中于信号传导分子和转录因子,因为它们在细胞命运决定和分化中具有中心作用。我们鉴别出与sesc相比时在lsc和cec中高度表达的wnt7a和pax6(pax6,在lsc中为↑8.8倍,且在cec中为↑12.3倍,p<0.001;wnt7a,在lsc中为↑4.5倍,在cec中为↑6.0倍,p<0.001)(图3e和图4c)。我们观察到wnt7a表达精确地反映了pax6在体外lsc和cec培养物中以及在婴儿到成年的角膜和角膜缘的体内上皮层中的表达模式,而这两个基因在皮肤表皮中是不可检测的(图3f和图4d)。
为了确定lsc和cec中的wnt7a和pax6表达的临床相关性,我们检查了几种类型的人角膜疾病、角膜上皮鳞状化生、炎性角膜病变、创伤和碱性灼伤。我们观察到p63和k5在基底层的局部表达(图5a和图6)以及k10在基底上层中的表达(图1d和图6)。我们还发现在化生区域中明显不存在wnt7a/pax6和k3/12表达,而它们在周围角膜上皮中是阳性的(图5a和图6)。这些结果表明角膜上皮细胞在患有这些疾病状况的患者组织中转变为皮肤样上皮细胞。
wnt分子是在控制细胞命运决定和组织特化中起关键作用的分泌的信号传导蛋白质15。pax6也是眼睛发育和疾病的众所周知的控制基因16。然而,仍然不清楚pax6的缺失是眼部表面疾病中异常皮肤表皮分化的原因还是结果。
为了证实wnt7a和pax6是lsc和cec细胞命运决定和分化所必需的,我们使用慢病毒shrna以在lsc中特异性地敲低它们。尽管具有wnt7a或pax6敲低的lsc未改变增殖和形态性质(图7a),但这些处理显著降低了在3-d分化条件下的角膜k3/k12的表达(wnt7a敲低:k3为↓24.7倍,k12为↓22.6倍;pax6敲低:k3为↓20.8倍,k12为↓21.4倍;全部p<0.05),并且同时,皮肤特异性k1/k10的表达变得更加突出(wnt7a敲低:k1为↑3.9倍且k10为↑5.7倍;pax6敲低:k1为↑3.1倍且k10为↑6.1倍;全部p<0.05),指示更多的皮肤样分化(图5b和图5c)。此外,wnt7a的敲低降低了lsc中的pax6表达(↓1.8倍,p<0.001);这种抑制作用在分化的cec中甚至更强(↓8.0倍,p<0.01)。相比之下,当pax6在lsc或cec中被敲低时,wnt7a表达没有显著差异(图5c、图7b和图7c)。这些结果表明wnt7a在cec分化期间在pax6的上游起作用。
为了进一步研究wnt信号途径在角膜命运决定和分化中的作用,我们研究了frizzled受体(fzd)的功能要求,已基于共免疫沉淀证明其与wnt7a相互作用并转导wnt7a信号转导17。我们发现wnt7a与lsc中的fzd5强烈相互作用(图7d和图7e),并且如所预测的,lsc中fzd5的敲低也导致降低的pax6表达(在lsc中为↓1.7倍,且在分化的cec中为↓3.0倍(p<0.001))(图7f)。总之,这些数据证实wnt7a或pax6的缺失导致角膜上皮细胞转变为皮肤样表皮细胞并且wnt7a/fzd5充当角膜分化中pax6表达的上游调节物。
鉴于pax6在眼发育中的中心作用16,我们接下来测试了pax6的工程化表达可能能够将sesc转化为lsc样细胞的可能性(图8a)。实际上,我们发现sesc中的pax6a或pax6b的表达足以将它们转化为lsc样细胞,如通过表面上诱导的k19表达所证明的,这与细胞核中p63和pax6两者的表达一致(图9a)。当置于3-d培养时,pax6转导的sesc显示角膜k3/k12表达的显著增加(↑9.4倍和↑72.7倍,全部p<0.05),以及皮肤k1/k10表达的伴随降低(↓20.8倍和↓20.0倍,全部p<0.01)(图8b、图8c、图9b和图9c)。为了获得成功的细胞命运转化的全面证据,我们通过rnaseq18对敲低pax6后的cec、sec和lsc以及在3d分化后用pax6转导的sesc进行了基因表达谱分析。我们从每个生物样品中产生了3到7百万个读数,这些读数被唯一地映射到refseq数据库(图10a)。成对比较证实,数据在同一组样品内是非常可再现的(图10b),相比之下,当在具有不同命运的细胞之间比较时,数据证实基于fdr<0.001的统计截止值的显著差异(图10c)。我们展示了记录多个细胞类型中>10,000个基因的表达的整个数据集(图9d),证实诱导的基因(红色)和受阻抑基因(绿色)在cec和pax6+sesc之间以及在shpax6处理的lsc和sec之间是明确共分离的。因此,这些数据提供了wnt7a/pax6轴在sesc到cec的细胞命运转化中的作用的全面证据。总之,这些数据表明wnt7a/pax6轴中的缺陷可能造成人角膜疾病中角膜细胞向皮肤表皮样细胞的化生转化(图解说明于图9e中),尽管需要进行进一步的研究以确定wnt7和pax6轴在角膜上皮分化中的重要性。
最后,我们测试了具有pax6的工程化表达的sesc(图11a、图11b和图11c)可用于治疗和修复兔lsc缺乏模型(图11f)上的角膜上皮缺陷的潜力,该模型模拟了人的常见角膜疾病状况。我们证明具有pax6转导的兔sesc形成具有角膜特异性k3/12阳性染色的连续上皮细胞片(图14a),并成功地修复了整个角膜表面的上皮缺损,从而恢复并维持正常的角膜清澈性和透明性达3个多月(图14b-14g和图12)。通过使用gfp标记的pax6+sesc遵循角膜上皮表面修复的时间过程,我们观察到这些pax6重编程的sesc最初仅位于角膜缘区域,然后渐进地朝向具有恢复的角膜清澈性的相应区域的中央角膜移动(图13a)。重要的是,这些移植的细胞确实能够再次填充角膜缘,如通过来自角膜缘区域的pax6+sesc的培养和再次分离所证明的(图13b)。引人注目的是,这些重编程的sesc能够修复重复的角膜上皮刮除后的大的角膜上皮缺陷(图13c)。形成鲜明对比的是,将具有pax6敲低的兔lsc(图11a、图11d和图11e)移植到裸露的角膜表面上导致具有不透明性和血管化的k10阳性皮肤样上皮(图14f)。总之,这些数据证实具有pax6表达的sesc能够转分化为角膜样上皮并修复角膜表面缺陷。
总之,本研究确定了在无饲养层的条件下扩增lsc的可行性和其治疗潜力,并证实wnt7a和pax6在角膜谱系特化中的关键作用。重要的是,通过pax6表达转化为角膜命运的sesc细胞或其它细胞类型可充当角膜表面修复和再生的潜在来源,特别是在具有总lsc缺乏的患者中。这将克服使用专利自己的lsc用于移植的主要可行性问题,因此指向用于治疗人类的许多常见角膜疾病的潜在治疗策略。
参考文献
1davanger,m.和evensen,a.roleofthepericornealpapillarystructureinrenewalofcornealepithelium.nature229,560-561(1971).
2cotsarelis,g.,cheng,s.z.,dong,g.,sun,t.t.和lavker,r.m.existenceofslow-cyclinglimbalepithelialbasalcellsthatcanbepreferentiallystimulatedtoproliferate:implicationsonepithelialstemcells.cell57,201-209(1989).
3li,w.等,down-regulationofpax6isassociatedwithabnormaldifferentiationofcornealepithelialcellsinsevereocularsurfacediseases.thejournalofpathology214,114-122,doi:10.1002/path.2256(2008).
4pellegrini,g.等,p63identifieskeratinocytestemcells.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica98,3156-3161,doi:10.1073/pnas.061032098(2001).
5mills,a.a.等,p63isap53homologuerequiredforlimbandepidermalmorphogenesis.nature398,708-713,doi:10.1038/19531(1999).
6yang,a.等,p63isessentialforregenerativeproliferationinlimb,craniofacialandepithelialdevelopment.nature398,714-718,doi:10.1038/19539(1999).
7koster,m.i.,kim,s.,mills,a.a.,demayo,f.j.和roop,d.r.p63isthemolecularswitchforinitiationofanepithelialstratificationprogram.genes&development18,126-131,doi:10.1101/gad.1165104(2004).
8rama,p.等,limbalstem-celltherapyandlong-termcornealregeneration.thenewenglandjournalofmedicine363,147-155,doi:10.1056/nejmoa0905955(2010).
9blanpain,c.和fuchs,e.epidermalhomeostasis:abalancingactofstemcellsintheskin.naturereviews.molecularcellbiology10,207-217,doi:10.1038/nrm2636(2009).
10arwert,e.n.,hoste,e.和watt,f.m.epithelialstemcells,woundhealingandcancer.naturereviews.cancer12,170-180,doi:10.1038/nrc3217(2012).
11kopan,r.和fuchs,e.anewlookintoanoldproblem:keratinsastoolstoinvestigatedetermination,morphogenesis,anddifferentiationinskin.genes&development3,1-15(1989).
12lauweryns,b.,vandenoord,j.j.和missotten,l.thetransitionalzonebetweenlimbusandperipheralcornea.animmunohistochemicalstudy.investigativeophthalmology&visualscience34,1991-1999(1993).
13eichner,r.,bonitz,p.和sun,t.t.classificationofepidermalkeratinsaccordingtotheirimmunoreactivity,isoelectricpoint,andmodeofexpression.thejournalofcellbiology98,1388-1396(1984).
14schlotzer-schrehardt,u.和kruse,f.e.identificationandcharacterizationoflimbalstemcells.experimentaleyeresearch81,247-264,doi:10.1016/j.exer.2005.02.016(2005).
15dorsky,r.i.,moon,r.t.和raible,d.w.controlofneuralcrestcellfatebythewntsignallingpathway.nature396,370-373,doi:10.1038/24620(1998).
16eiraku,m.等,self-organizingoptic-cupmorphogenesisinthree-dimensionalculture.nature472,51-56,doi:10.1038/nature09941(2011).
17vonmaltzahn,j.,bentzinger,c.f.和rudnicki,m.a.wnt7a-fzd7signallingdirectlyactivatestheakt/mtoranabolicgrowthpathwayinskeletalmuscle.naturecellbiology14,186-191,doi:10.1038/ncb2404(2012).
18yu,f-x,zhao,b.,panupinthu,n.,jewell,j.l.,lian,i.,wang,l.h.,zhao,j.,yuan,h.,tumaneng,k.,li,h.,fu,x-d,mills,g.b.,guan,k-l(2012).regulationofthehippo-yappathwaybyg-protein-coupledreceptorsignaling.cell,150:780--791.
19tusher,v.g.,tibshirani,r.和chu,g.significanceanalysisofmicroarraysappliedtotheionizingradiationresponse.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica98,5116-5121,doi:10.1073/pnas.091062498(2001).
20fox-walsh,k.,davis-turak,j.,zhou,y.,li,h.和fu,x.d.amultiplexrna-seqstrategytoprofilepoly(a+)rna:applicationtoanalysisoftranscriptionresponseand3'endformation.genomics98,266-271,doi:s0888-7543(11)00083-8[pii]10.1016/j.ygeno.2011.04.003.
21eisen,m.b.,spellman,p.t.,brown,p.o.和botstein,d.clusteranalysisanddisplayofgenome-wideexpressionpatterns.procnatlacadsciusa95,14863-14868(1998).
22xue,y.等,directconversionoffibroblaststoneuronsbyreprogrammingptb-regulatedmicrornacircuits.cell152,82-96,doi:s0092-8674(12)01433-x[pii]10.1016/j.cell.2012.11.045.
实施例2
材料和方法
动物
rosamt/mg小鼠先前被描述(pmid:17868096;28)并维持为纯合子。将在pax6p0增强子控制下表达egfp-cre重组酶融合蛋白质的p0-3.9-gfpcre小鼠维持在fvb背景上,并如所述(29)进行pcr基因分型。
谱系追踪
通过使纯合gfp报告小鼠(rosamt/mg)与晶状体特异性cre转基因小鼠(p0-3.9-gfpcre)杂交进行谱系追踪实验,其中cre表达处于小鼠pax6外胚层增强子的控制之下。在出生后(p)第1天和p60剖分眼睛,并将其在4%甲醛中固定过夜。然后将组织在10%蔗糖中培育,并包埋在用于冷冻切片的最佳切割温度培养基中。将冷冻的切片在pbs中洗涤并在zeissaxio成像仪荧光显微镜上成像。
人类lsc和皮肤表皮干细胞(sesc)的分离和培养
从眼库获得死后人眼球;从眼睑的供体皮肤活检获得人表皮。切离角膜缘区域并将其在具有100iu/ml青霉素和100μg/ml链霉素的冷pbs中洗涤。将边缘区域切成小片后,通过在37℃用0.2%胶原酶iv消化2h来获得细胞簇。之后用0.25%胰蛋白酶/edta在37℃进一步消化15min以获得单细胞。将原代细胞接种在用2%减少生长因子的
用于角膜缘干细胞(lsc)和皮肤表皮干细胞(sesc)两者的培养基均含有dmem/营养素混合物f-12和dmem(1:1),其具有100iu/ml青霉素、100μg/ml链霉素、10%胎牛血清、10ng/ml表皮生长因子(egf)、5μg/ml胰岛素、0.4μg/ml氢化可的松、10-10m霍乱毒素和2×10-9m3,3'5-三碘-l-甲状腺原氨酸。为了分化lsc,将细胞在cnt-30(cellntec公司)中培养8-12天。
实时定量pcr(qpcr)
使用rneasy试剂盒(qiagen公司)来分离rna。进行柱上dnase消化。根据制造商说明书,将superscriptiii逆转录酶试剂盒(invitrogen公司)用于cdna合成。使用实时pcr系统(appliedbiosystems公司)进行定量pcr。使用基因特异性引物(表3)和powersybrgreenpcrmastermix实施40个循环的扩增。以一式三份进行测量并将其归一化为内源性gapdh水平。使用δδct方法计算表达的相对倍数变化(ct值<30)。数据显示为基于三次重复的平均值±s.d。
表3.用于实时pcr的引物
慢病毒rnai
使用克隆到plko.1质粒中agei和ecori之间的慢病毒shrna靶向pax6基因。用于基因特异性敲低的shrna靶向序列为5’-cgtccatctttgcttgggaaa-3’和5’-agtttgagagaacccattatc-3’。在所有基因敲低实验中,我们使用编码shrna的慢病毒plko.1-puronon-targetshrna对照质粒(sigma公司)作为阴性对照,该对照质粒不靶向来自任何物种的任何已知基因。为了制备慢病毒shrna粒子,通过shrna构建体与包装混合物(9:1比例的pcmv-dr8.2和pcmv-vsvg)的共转染,将无复制能力的慢病毒粒子包装在293t细胞中。在转染后48h和72h收获病毒两次。用含有单个病毒和聚凝胺的新鲜培养基,用慢病毒将细胞感染16-20hr,最终浓度为8μg/ml。用2μg/ml嘌呤霉素持续48hr来进一步选择受感染的细胞。
免疫荧光和共焦显微镜检查
将细胞用4%多聚甲醛在室温下固定15min,用含有0.3%tritonx-100的磷酸盐缓冲盐水(pbs)透化10min,并在含有5%牛血清白蛋白和0.3%tritonx-100的pbs中封闭。将细胞与一级抗体在4℃培育18hr,在pbs中洗涤三次,并与二级抗体培育1hr。用dapi将细胞核复染。通过标准脱石蜡化、之后与上述相同的免疫荧光方案来完成石蜡包埋的组织切片的免疫荧光。
使用以下抗体:小鼠抗p63单克隆抗体、兔抗k5单克隆抗体和小鼠抗k10单克隆抗体(ma1-21871、rm2106s0和ms611p0,thermofisherscientific公司);兔抗pax6多克隆抗体(prb-278p,covance公司);小鼠抗k1单克隆抗体(sc-376224,santacruzbiotechnology公司);和小鼠抗k3/12单克隆抗体和兔抗k12单克隆抗体(ab68260和ab124975,abcam公司)。以1:500的稀释度使用二级抗体alexafluor488或568缀合的抗小鼠或兔免疫球蛋白g(igg)(invitrogen公司)。使用olympusfv1000共焦显微镜获得图像。
微阵列数据分析
如我们先前的研究(15),从lsc和sesc分离总rna。原始数据以保藏号gse32145保藏在geneexpressionomnibus(geo)数据库中。将本研究中产生的基于微阵列的基因表达数据在样品之间归一化,并使用cluster3.0/treeview软件包(16)进行平均连锁层次聚类。基于先前的研究进行属于wnt和notch途径的基因的选择。使用用于cytoscape3(18)的reactomefunctionalinteraction(fi)插件,将表达值覆盖在使用用于reactome网络(17)的geneset分析工具产生的网络上。
结果
小鼠眼部发育期间的pax6和p63表达
为了阐明pax6和p63在角膜发育期间的功能,我们首先研究了它们在小鼠胚胎中从胚胎(e)第12.5天到e18.5的表达谱。在e12.5时,在眼区,特别是在早期角膜上皮中检测到强烈的pax6表达,而p63表达为阴性(图15a)。相比之下,在眼睑的发育和融合之后,在e14.5时,p63阳性细胞出现在眼部表面,并且随后扩展到角膜缘和角膜(图15b)。pax6表达在眼部发育期间局限于眼区(图15a-d)。另外,我们使用驱使gfp报告子的pax6启动子进行了谱系追踪实验。我们在p1和p60时的rosamt/mg;pax6-gfpcre小鼠的角膜上皮中观察到强烈的gfp表达(图15e)。这些结果表明从早期发育阶段到成年期pax6在角膜缘干细胞和角膜上皮中的中心作用。
人角膜上皮和皮肤上皮中的pax6和p63表达
我们观察到,p63(鳞状上皮细胞发育的主调节物)主要在角膜缘和皮肤表皮两者的基底层中表达,表明这两种上皮细胞类型的相似性。然而,尽管pax6在角膜的上皮层中高度表达,但在成人的皮肤表皮中是不可检测的(图16)。为了进一步表征皮肤表皮上皮和角膜上皮,我们进行了用于组织特异性角蛋白的免疫染色。lsc在分化时迁移到中央角膜,k3和k12作为角膜特异性标志物(图16a),而皮肤表皮特异性角蛋白k1和k10在基底上表皮层中表达(图16b),并且pax6和p63共定位在角膜缘中(图17a)。我们进一步在体外分离并培养了lsc和皮肤表皮干细胞(sesc)。lsc可通过pax6和p63表达扩增并鉴别(图17b),sesc可通过p63和k5表达来鉴别(图17c)。
pax6是角膜细胞命运决定中所必需的
为了研究pax6在确定角膜细胞命运中的作用,我们在人lsc中使用了慢病毒介导的pax6敲低。我们通过嘌呤霉素选择纯化了pax6shrnalsc。从干细胞和分化细胞两者提取rna;通过定量pcr比较相关基因的表达水平。使用了两种不同的pax6shrna并显示相似的结果。尽管lsc中pax6的4.5倍敲低不产生具有活性ki67表达的增殖缺陷(图18a),但角膜特异性标志物k3和k12在分化后显著下调17.7倍和14.5倍(p<0.05)。相比之下,皮肤特异性k1和k10表达分别上调了4.1倍和4.4倍(p<0.05)(图18b)。这些结果表明,lsc中pax6的缺失导致皮肤样分化。
人先天性角膜缘皮样瘤组织中pax6的缺失
为了确定pax6表达在lsc和角膜上皮细胞(cec)中的临床相关性,我们研究了人角膜缘皮样瘤,其展示出具有血管化的皮肤表皮病理和基质中的无组织细胞(图19a)。我们发现pax6表达在角膜皮样瘤区域中完全不存在(图19b)。此外,我们观察到p63和k5在基底层中(图19b)以及皮肤特异性角蛋白k1和k10在基底上层中(图19b)的局部表达。这些结果表明在患者组织中角膜上皮细胞在发育期间转化为皮肤样上皮细胞并且强烈支持pax6在角膜上皮细胞命运决定中的重要作用。
lsc命运决定中的信号传导途径
为了进一步确定控制角膜细胞命运定型的功能特征,我们寻求鉴别可能在lsc和sesc中差异活化的信号传导途径。我们使用微阵列对lsc和sesc进行了rna表达分析,之后使用david进行了基因本体论和途径分析(19、20)。我们鉴别了显示lsc和sesc之间至少2倍表达差异基因子集,从而产生总共1185个基因。该分析鉴别了影响许多细胞和代谢过程的众多go项和信号传导途径。然而,特别地,notch、wnt和tgf-β途径作为来自该分析的重要途径出现,与它们在来自包括上皮在内的多种组织的干细胞的自我更新和谱系定型中的关键作用一致(21-23)。在图20中提供了这些途径的不同成员的表达变化的图示。
讨论
通过lsc的自我更新和它们向cec的分化来维持清澈、透明的角膜(24、25)。这两个过程必须高度组织化以维持角膜上皮的完整性和稳态。lsc的病理变化可导致角膜透明性的损失,并导致部分或完全失明(2、15)。在本研究中,我们发现pax6是维持lsc特征和它们进一步定型为cec谱系所必需的。值得注意的是,尽管p63被充分证明为用于常见鳞状上皮(如角膜、表皮和前列腺中的鳞状上皮)的自我更新和分化的主基因(4-6),但我们观察到p63在pax6后表达,这暗示pax6表达为角膜细胞命运控制中的中心事件。
培养中的pax6缺陷lsc展现出皮肤样上皮细胞命运,如分化时角蛋白表达的转变,特别是皮肤特异性k1/k10对角膜特异性k3/k12的替代所指示的。此外,角膜皮样瘤组织中不存在pax6,角膜皮样瘤组织是将角膜转变到皮肤谱系的先天性畸胎瘤。这与异常表皮分化中的pax6下调的最近发现是一致的,所述异常表皮分化如史蒂文斯—约翰逊综合征、化学灼伤、无虹膜和复发性翼状胬肉中所见的(2)。
已证明wnt和notch信号传导对于胚胎发生中的上皮细胞和来自各种组织的干细胞的自我更新和谱系定型是至关重要的(21-23)。两种信号传导途径都是复杂的,具有不同的受体、配体、共活化剂和抑制性蛋白质。例如,notch1有助于在受损小鼠角膜的修复期间维持角膜上皮细胞命运(26)。wnt信号传导对眼部表面发育的影响也已被广泛报道。wnt4在人胎儿角膜和成人基底lsc中表达(27)。dkk2(经典wnt信号传导的拮抗剂)是通过调节wnt/β-连环蛋白活性而实现小鼠的眼部表面上皮的精确发育所必需的(14)。此外,我们先前的工作已表明wnt7a-pax6轴在角膜上皮细胞命运决定中的中心作用,其中sesc可通过pax6的过表达而转化为lsc样细胞(15)。在当前的研究中,我们通过比较lsc和sesc之间的基因表达谱提供了关于wnt和notch信号传导途径的重要性的进一步证据。确定这些基因在角膜上皮细胞特化中的功能的进一步研究可使我们更好地理解并操控角膜疾病。
总之,我们的数据表明pax6在lsc和角膜上皮细胞命运决定中的关键作用。此外,我们鉴别了pax6在角膜上皮表型的确定中的关键作用。理解pax6如何控制角膜细胞命运将提供关于角膜稳态和疾病的重要见解,并有助于开发用于治疗常见角膜疾病的新治疗策略。
参考文献
1.masse,k.,bhamra,s.,eason,r.,dale,n.和jones,e.a.(2007).purine-mediatedsignallingtriggerseyedevelopment.nature449,1058-1062.
2.li,w.,chen,y.t.,hayashida,y.,blanco,g.,kheirkah,a.,he,h.,chen,s.y.,liu,c.y.和tseng,s.c.(2008).down-regulationofpax6isassociatedwithabnormaldifferentiationofcornealepithelialcellsinsevereocularsurfacediseases.j.pathol.214,114-122.
3.zhao,b.,allinson,s.l.,ma,a.,bentley,a.j.,martin,f.l.和fullwood,n.j.(2008).targetedcornealimbalstem/progenitorcelltransfectioninanorganculturemodel.invest.ophthalmol.vis.sci.49,3395-3401.
4.koster,m.i.,kim,s.,mills,a.a.,demayo,f.j.和roop,d.r.(2004).p63isthemolecularswitchforinitiationofanepithelialstratificationprogram.genesdev.18,126-131.
5.pellegrini,g.,dellambra,e.,golisano,o.,martinelli,e.,fantozzi,i.,bondanza,s.,ponzin,d.,mckeon,f.和deluca,m.(2001).p63identifieskeratinocytestemcells.proc.natl.acad.sci.u.s.a.98,3156-3161.
6.mills,a.a.,zheng,b.,wang,x.j.,vogel,h.,roop,d.r.和bradley,a.(1999).p63isap53homologuerequiredforlimbandepidermalmorphogenesis.nature398,708-713.
7.yang,a.,schweitzer,r.,sun,d.,kaghad,m.,walker,n.,bronson,r.t.,tabin,c.,sharpe,a.,caput,d.,crum,c.和mckeon,f.(1999).p63isessentialforregenerativeproliferationinlimb,craniofacialandepithelialdevelopment.nature398,714-718.
8.arwert,e.n.,hoste,e.和watt,f.m.(2012).epithelialstemcells,woundhealingandcancer.nat.rev.cancer12,170-180.
9.blanpain,c.和fuchs,e.(2009).epidermalhomeostasis:abalancingactofstemcellsintheskin.nat.rev.mol.cellbiol.10,207-217.
10.kopan,r.和fuchs,e.(1989).anewlookintoanoldproblem:keratinsastoolstoinvestigatedetermination,morphogenesis,anddifferentiationinskin.genesdev.3,1-15.
11.schlotzer-schrehardt,u.和kruse,f.e.(2005).identificationandcharacterizationoflimbalstemcells.exp.eyeres.81,247-264.
12.eichner,r.,bonitz,p.和sun,t.t.(1984).classificationofepidermalkeratinsaccordingtotheirimmunoreactivity,isoelectricpoint,andmodeofexpression.j.cellbiol.98,1388-1396.
13.ramaesh,t.,collinson,j.m.,ramaesh,k.,kaufman,m.h.,west,j.d.和dhillon,b.(2003).cornealabnormalitiesinpax6+/-smalleyemicemimichumananiridia-relatedkeratopathy.invest.ophthalmol.vis.sci.44,1871-1878.
14.mukhopadhyay,m.,gorivodsky,m.,shtrom,s.,grinberg,a.,niehrs,c.,morasso,m.i.和westphal,h.(2006).dkk2playsanessentialroleinthecornealfateoftheocularsurfaceepithelium.development133,2149-2154.
15.ouyang,h.,xue,y.,lin,y.,zhang,x.,xi,l.,patel,s.,cai,h.,luo,j.,zhang,m.,zhang,m.,yang,y.,li,g.,li,h.,jiang,w.,yeh,e.,lin,j.,pei,m.,zhu,j.,cao,g.,zhang,l.,yu,b.,chen,s.,fu,x.d.,liu,y.和zhang,k.(2014).wnt7aandpax6definecornealepitheliumhomeostasisandpathogenesis.nature511,358-361.
16.dehoon,m.j.,imoto,s.,nolan,j.和miyano,s.(2004).opensourceclusteringsoftware.bioinformatics20,1453-1454.
17.wu,g.,feng,x.和stein,l.(2010).ahumanfunctionalproteininteractionnetworkanditsapplicationtocancerdataanalysis.genomebiol.11,r53.
18.shannon,p.,markiel,a.,ozier,o.,baliga,n.s.,wang,j.t.,ramage,d.,amin,n.,schwikowski,b.和ideker,t.(2003).cytoscape:asoftwareenvironmentforintegratedmodelsofbiomolecularinteractionnetworks.genomeres.13,2498-2504.
19.huangda,w.,sherman,b.t.和lempicki,r.a.(2009).systematicandintegrativeanalysisoflargegenelistsusingdavidbioinformaticsresources.nat.protoc.4,44-57.
20.huangda,w.,sherman,b.t.和lempicki,r.a.(2009).bioinformaticsenrichmenttools:pathstowardthecomprehensivefunctionalanalysisoflargegenelists.nucleicacidsres.37,1-13.
21.lien,w.h.和fuchs,e.(2014).wntsomelosesome:transcriptionalgovernanceofstemcellsbywnt/-cateninsignaling.genesdev.28,1517-1532.
22.collu,g.m.,hidalgo-sastre,a.和brennan,k.(2014).wnt-notchsignallingcrosstalkindevelopmentanddisease.cell.mol.lifesci.71,3553-3567.
23.kopan,r.和ilagan,m.x.(2009).thecanonicalnotchsignalingpathway:unfoldingtheactivationmechanism.cell137,216-233.
24.cotsarelis,g.,cheng,s.z.,dong,g.,sun,t.t.和lavker,r.m.(1989).existenceofslow-cyclinglimbalepithelialbasalcellsthatcanbepreferentiallystimulatedtoproliferate:implicationsonepithelialstemcells.cell57,201-209.
25.davanger,m.和evensen,a.(1971).roleofthepericornealpapillarystructureinrenewalofcornealepithelium.nature229,560-561.
26.figueira,e.c.,digirolamo,n.,coroneo,m.t.和wakefield,d.(2007).thephenotypeoflimbalepithelialstemcells.invest.ophthalmol.vis.sci.48,144-156.
27.vauclair,s.,majo,f.,durham,a.d.,ghyselinck,n.b.,barrandon,y.和radtke,f.(2007).cornealepithelialcellfateismaintainedduringrepairbynotch1signalingviatheregulationofvitaminametabolism.dev.cell13,242-253.
28.muzumdar,m.d.,tasic,b.miyamichi,k.,li,l.和luo,l.(2007)aglobaldouble-fluorescentcrereportermouse.genesis45,593-605.
29.rowan,s.,conley,k.w.,le,t.t.,donner,a.l.,maas,r.l.和brown,n.l.(2008).notchsignalingregulatesgrowthanddifferentiationinthemammalianlens.dev.biol.321,111-122.
实施例3
用于制备供体角膜修复材料的方法
1.材料
角膜缘干细胞培养基或角膜缘干细胞维持培养基:补充有以下物质的dmem/营养素混合物f-12(体积:体积比率为3:1的dmem:f-12)基础培养基:10%胎牛血清、0.4μg/ml氢化可的松、10-10μm霍乱毒素、5μg/ml转铁蛋白、2×10-9m3,3’,5-三碘-l-甲状腺原氨酸、5μg/ml胰岛素、10ng/ml表皮生长因子(egf)、100u/ml青霉素和100μg/ml链霉素。在第4次细胞传代后,将rock抑制剂添加到角膜缘干细胞培养基中,以将lsc维持在增殖状态,如通过添加1μmy-27632。上述组分dmem、f12培养基和胎牛血清购自
角膜缘干细胞分化培养基:cnt-30或等同物(cellntecadvancedcellsystemsag,bern,switzerland)。可用于代替cnt-30的其它角膜缘干细胞分化培养基是cnt-02、cnt-02-3dp5、reges(regea06/015、regea07/046和regea08/013;rajala等,2010,plosone5(4):e10246)。
眼球:来自供体。
2.方法
角膜缘干细胞分离和扩增:从眼球分离角膜缘的样本,将其用pbs中的100iu/ml青霉素和100μg/ml链霉素洗涤,切成小片(约2×2mm2组织大小),并在37℃用0.2%胶原酶iv消化1小时。然后,通过用0.25%胰蛋白酶和1mm乙二胺四乙酸(edta)在37℃进一步处理15分钟来获得单细胞。将原代细胞接种在用2%减少生长因子(gfr)的
用于移植的角膜修复材料:将2×104个细胞的第3次传代(p3)世代的培养的角膜缘干细胞(也称为人角膜干细胞)的悬浮物与
实施例4
用于制备供体角膜修复材料的方法
1.材料
与实施例3中相同。
2.方法
角膜缘干细胞分离和扩增:从眼球分离角膜缘的样本,将其用pbs中的100iu/ml青霉素和100μg/ml链霉素洗涤,切成小片(约2×2mm2组织大小),并在37℃用0.2%胶原酶iv消化2小时。然后,通过用0.25%胰蛋白酶和1mmedta在37℃进一步处理15分钟来获得单细胞。将原代细胞接种在用2%减少生长因子的
用于移植的细胞来源的制备:将4×104个细胞的第3次传代(p3)世代的培养的人lsc的悬浮物与
实施例5
用于制备供体角膜修复材料的方法
1.材料
与实施例3中相同。
2.方法
角膜缘干细胞分离和扩增:从眼球剖分角膜缘组织,并将其用pbs中的100iu/ml青霉素和100μg/ml链霉素洗涤。将角膜缘组织切割成2mm×2mm的片,并且在37℃用0.2%胶原酶iv培育并消化2.5小时,然后在37℃用0.25%胰蛋白酶和1mmedta处理20分钟,以获得单细胞悬浮物。然后将这些消化的原代细胞接种在
用于移植的细胞来源的制备:将1×104个第三次传代培养的人角膜干细胞的悬浮物与胶原在cnt-30培养基(cellntecadvancedcellsystemsag,伯尔尼,瑞士)(最终体积为50μl)中混合,并且将胶原包埋的角膜干细胞在分化诱导培养基cnt-30(cellntecadvancedcellsystemsag,伯尔尼,瑞士)中培育18天,以获得供体角膜修复材料。
实施例6
用于制备供体角膜修复材料的方法
1.材料
与实施例3中相同。
2.方法
角膜缘干细胞分离和扩增:从眼球分离角膜缘的样本,将其用pbs中的100iu/ml青霉素和100μg/ml链霉素洗涤,切成组织小片(约2mm×2mm),并在37℃用0.2%胶原酶iv消化3.5小时。然后,在37℃将细胞和细胞团用0.25%胰蛋白酶和1mmedta进一步处理10分钟,以获得单细胞悬浮物。然后将单个原代细胞在用2%减少生长因子的
用于移植的细胞来源的制备:将3×104个第三次传代培养的人角膜干细胞的悬浮物与羊膜在cnt-30培养基(cellntecadvancedcellsystemsag,伯尔尼,瑞士)中混合,最终体积为50μl。将羊膜膜处理的人角膜干细胞混合物置于分化诱导培养基cnt-30培养基中培养14天,以获得供体角膜修复材料。
尽管在实施例3-6中使用了第三次传代(p3)的lsc,但还可使用其它lsc传代物。对于在第4次传代后获得的lsc,这些lsc应已被维持在补充有rock抑制剂(例如以1μmy-27632的浓度使用的y-27632)的lsc培养基或维持培养基中。
培养的lsc的3-d分化。
在接种lsc细胞之前,通过在37℃用2%减少生长因子的
在不脱离本发明的精神或本质属性的情况下,本发明可以其它特定形式体现。任何等同的实施方案均意在属于本发明的范围内。实际上,除了本文所示和所述的那些之外的本发明的各种修改对于本领域技术人员来说从前面的描述也将变得显而易见。此类修改也意在落入所附权利要求的范围内。
在整个说明书中,已提到了各种出版物。意在每个出版物均以引用方式整体并入本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!