发芽处理植物种子的制造方法、发芽诱导用原料种子的制造方法、发芽处理植物种子的萃取组合物以及筛选方法与流程
本发明涉及发芽处理植物种子的制造方法、发芽诱导用原料种子的制造方法、发芽处理植物种子的萃取组合物以及筛选方法。
背景技术:
已知植物在代谢时,会生成能够用于医药品或健康食品的植物化学成分等有用的化合物。此外,因为植物的代谢依赖于植物的生长环境,所以能够想到通过改变与植物的生长有关的环境因素,由植物代谢产生的化合物的种类或量会变化。于是,从以往就进行如下的研究:改变与植物的生长有关的环境因素,使植物产生植物化学成分等有用的化合物。
作为植物化学成分,已知有例如多酚,在专利文献1中,公开有如下的发芽处理植物种子的制造方法:通过将植物种子保持在2000ppm以上的二氧化碳浓度以及/或者18体积%以下的氧浓度的气氛条件下,并且保持在发芽温度内的条件下,水溶性多酚的量会增加。
现有技术文献
专利文献
专利文献1:日本国特开2008-125515号公报
技术实现要素:
发明要解决的技术问题
然而,虽然已知植物抗毒素是通常的植物不会产生的二次代谢产物,对于生物功能具有有效性,但是根据专利文献1的发芽处理植物种子的制造方法,仅能增加水溶性的多酚,难以制造足量的植物抗毒素。
本发明鉴于以上的实际情况而提出,目的在于提供适于产生大量的植物抗毒素的新的发芽处理植物种子的制造方法、用于制造这样的发芽处理植物种子的发芽诱导用原料种子的制造方法、发芽处理植物种子的萃取组合物以及用于产生目标物质的候补植物种子的筛选方法。
用于解决上述技术问题的手段
本发明人发现对植物种子进行控制发芽环境的前处理,并且之后通过将微生物即病原体接种在植物种子上,发芽处理植物种子能够大量地产生植物抗毒素,从而完成了本发明。更具体而言,本发明提供以下内容。
(1)一种发芽诱导用原料种子的制造方法,具有前处理工序,所述前处理工序在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,将植物种子连续地保持5小时以上。
(2)如(1)所述的发芽诱导用原料种子的制造方法,所述保持5小时以上并非是通过对所述植物种子进行浸泡来保持。
(3)如(1)或(2)所述的发芽诱导用原料种子的制造方法,所述前处理工序进行2次以上的所述保持5小时以上以及结束该保持的组合。
(4)一种发芽诱导用原料种子的制造方法,具有前处理工序,前处理工序对植物种子进行处理,使前处理工序后的植物种子中的植物化学成分的质量变为前处理工序前的植物种子的植物化学成分的质量的2倍以上100倍以下。
(5)如(4)所述的发芽诱导用原料种子的制造方法,所述前处理工序对植物种子进行处理,使前处理工序后的植物种子中的植物化学成分整体的质量变为前处理工序前的植物种子的植物化学成分整体的质量的2倍以上100倍以下。
(6)如(1)~(5)中的任一项所述的发芽诱导用原料种子的制造方法,进行所述前处理工序,使所述前处理工序后的所述植物种子中的谷氨酸的质量变为所述前处理工序前的所述植物种子的谷氨酸的质量的2.5倍以上。
(7)一种发芽诱导用原料种子的制造方法,具有前处理工序,前处理工序对植物种子进行处理,使前处理工序后的植物种子中的植物化学成分的质量变为前处理工序前的植物种子的植物化学成分的质量的2倍以上,
进行所述前处理工序,使所述前处理工序后的所述植物种子中的谷氨酸的质量变为所述前处理工序前的所述植物种子的谷氨酸的质量的2.5倍以上。
(8)如(1)~(7)中的任一项所述的发芽诱导用原料种子的制造方法,前处理工序前的所述植物种子的植物化学成分的含量为0.1mg/g以上。
(9)如(8)所述的发芽诱导用原料种子的制造方法,所述植物种子为葡萄科、豆科、茄科、唇形科或者十字花科的植物种子。
(10)一种发芽处理植物种子的制造方法,具有发芽诱导工序,将微生物即病原体接种在如(1)~(9)中的任一项所述的发芽诱导用原料种子上,将所述发芽诱导用原料种子放置在能够诱导发芽且所述病原体能够生长的环境下。
(11)如(10)所述的发芽处理植物种子的制造方法,所述病原体为食用微生物。
(12)一种发芽处理植物种子的萃取组合物,由(10)或(11)所述的方法制造。
(13)一种筛选方法,筛选用于产生目标物质的候补植物种子,具有:
前处理工序,在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,将被试验植物种子连续地保持5小时以上;
发芽诱导工序,在所述前处理工序后,将微生物即病原体接种在所述被试验植物种子上,将所述被试验植物种子放置在能够诱导发芽且所述病原体能够生长的环境下;
检测工序,对所述发芽诱导工序后的所述被试验植物种子中的目标物质进行检测;
选择工序,基于所述检测结果,选择用于产生目标物质的候补植物种子。
(14)如(13)所述的筛选方法,所述保持5小时以上并非是通过对所述被试验植物种子进行浸泡来保持。
(15)如(13)或(14)所述的筛选方法,所述前处理工序进行2次以上的所述保持5小时以上以及结束该保持的组合。
(16)一种筛选方法,筛选用于产生目标物质的候补植物种子,具有:
前处理工序,前处理工序对被试验植物种子进行处理,使前处理工序后的被试验植物种子中的植物化学成分的质量变为前处理工序前的被试验植物种子的植物化学成分的质量的2倍以上100倍以下;
发芽诱导工序,在所述前处理工序后,将微生物即病原体接种在所述被试验植物种子上,将所述被试验植物种子放置在能够诱导发芽且所述病原体能够生长的环境下;
检测工序,对所述发芽诱导工序后的所述被试验植物种子中的目标物质进行检测;
选择工序,基于所述检测结果,选择用于产生目标物质的候补植物种子。
(17)如(16)所述的筛选方法,所述前处理工序对被试验植物种子进行处理,使前处理工序后的被试验植物种子中的植物化学成分整体的质量变为前处理工序前的被试验植物种子的植物化学成分整体的质量的2倍以上100倍以下。
(18)如(13)~(17)中的任一项所述的筛选方法,进行所述前处理工序,使所述前处理工序后的所述被试验植物种子中的谷氨酸的质量变为所述前处理工序前的所述被试验植物种子的谷氨酸的质量的2.5倍以上。
(19)一种筛选方法,筛选用于产生目标物质的候补植物种子,具有:
前处理工序,前处理工序对被试验植物种子进行处理,使前处理工序后的被试验植物种子中的植物化学成分的质量变为前处理工序前的被试验植物种子的植物化学成分的质量的2倍以上;
发芽诱导工序,在所述前处理工序后,将微生物即病原体接种在所述被试验植物种子上,将所述被试验植物种子放置在能够诱导发芽且所述病原体能够生长的环境下;
检测工序,对所述发芽诱导工序后的所述被试验植物种子中的目标物质进行检测;
选择工序,基于所述检测结果,选择用于产生目标物质的候补植物种子,
进行所述前处理工序,使所述前处理工序后的所述被试验植物种子中的谷氨酸的质量变为所述前处理工序前的所述被试验植物种子的谷氨酸的质量的2.5倍以上。
发明效果
根据本发明,能够提供适于产生大量的植物抗毒素的新的发芽处理植物种子的制造方法、用于制造这样的发芽处理植物种子的发芽诱导用原料种子的制造方法、发芽处理植物种子的萃取组合物以及用于产生目标物质的候补植物种子的筛选方法。
附图说明
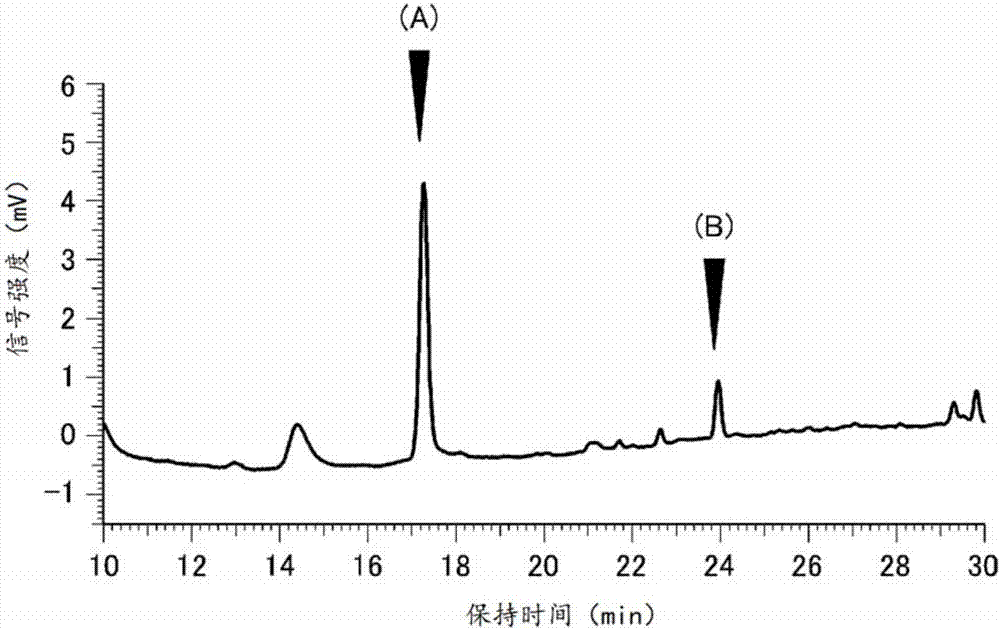
图1a是示出根据高效液相色谱法对比较例1的葡萄种子的萃取组合物的分析结果的图,图1b是示出根据高效液相色谱法对实施例1的发芽处理植物种子的萃取组合物的分析结果的图。
图2a是示出根据高效液相色谱法对比较例2的红车轴草种子的萃取组合物的分析结果的图,图2b是示出根据高效液相色谱法对实施例2的发芽处理植物种子的萃取组合物的分析结果的图,图2c是示出根据高效液相色谱法对实施例3的发芽处理植物种子的萃取组合物的分析结果的图。
图3a是示出根据高效液相色谱法对比较例3的番茄种子的萃取组合物的分析结果的图,图3b是示出根据高效液相色谱法对实施例4的发芽诱导用原料种子的萃取组合物的分析结果的图。
图4是示出实施例5~7的发芽诱导用原料种子、比较例4~9的大豆萃取组合物中的植物化学成分即异黄酮的量的图表的图。
图5a是示出比较例4~6的大豆萃取组合物中的植物化学成分即各种异黄酮的量的图表的图。图5b是示出比较例7~9的大豆萃取组合物中的植物化学成分即各种异黄酮的量的图表的图。图5c是示出实施例5~7的发芽诱导用原料种子的萃取组合物中的植物化学成分即各种异黄酮的量的图表的图。
图6是示出实施例8~10的发芽处理植物种子、比较例10的种子的萃取组合物中的植物抗毒素即大豆抗毒素的量的图表的图。
图7是示出实施例9的发芽处理植物种子,从接种曲霉菌后时间经过(0~4天)与大豆抗毒素i~v的增加比例之间的关系的图表的图。
图8是示出实施例11的发芽诱导用原料种子、比较例11、12的种子的萃取组合物中的氨基酸的量的图表的图。
具体实施方式
以下,虽然对本发明的具体实施方式进行详细地说明,但是本发明并不受以下任何实施方式的限定,在本发明目的的范围内,能够增加适当变更实施。
<发芽诱导用原料种子的制造方法>
本发明的发芽诱导用原料种子的制造方法,具有将植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上的前处理工序,或者具有使前处理工序后的植物种子中的植物化学成分的质量,变为前处理工序前的植物种子的植物化学成分的质量的2倍以上的、对植物种子进行处理的前处理工序。
(前处理工序)
本发明的发芽诱导用原料种子的制造方法中的前处理工序是:将植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上;或者,对植物种子进行处理,使前处理工序后的植物种子中的植物化学成分的质量,变为前处理工序前的植物种子的植物化学成分的质量的2倍以上。在本发明中,“发芽诱导用原料种子”是指主要作为后述的发芽处理植物种子的制造原料而使用的种子,植物化学成分的量通过前处理工序而增加了的种子。
在本发明中,“前处理”是指,在后述的发芽处理植物种子的制造方法中的发芽诱导工序的前阶段进行的处理,是进行使种子中的植物化学成分的量增加的处理的工序。像这样地,通过植物化学成分的量增加,制造的发芽诱导用原料种子,通过后述的发芽诱导用原料种子的制造方法中的发芽诱导工序,能够大量地产生植物抗毒素。另外,虽然是在后述的发芽处理植物种子的制造方法中进行发芽诱导,但是也可以在本发明的“前处理”中进行发芽诱导。
此外,通过本发明中的前处理工序,也能够增加植物种子的氨基酸或糖等的产生量。推测其理由是,植物种子在发芽不久后异养,需要用于成长为能够进行光合作用的自养体的营养素,植物种子将为了成长为自养体而储藏在种子内的蛋白质分解为氨基酸作为氮源,将储藏的淀粉分解为糖作为碳源。由此,通过在植物种子内较多地产生氨基酸或糖,在后述的发芽处理植物种子的制造方法中,植物抗毒素的产生量会变多。
前处理能够通过以下方法来进行,在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,将植物种子连续地保持5小时以上。虽然在上述的专利文献1的方法中,也对二氧化碳浓度以及/或者氧浓度进行控制,但是保持是间歇性的,连续的保持时间较短,因此仅水溶性多酚的量会增加。而在本发明中,通过使植物种子在上述环境下的保持时间长达5小时以上,能够显著地增加种子中的植物化学成分的量。
二氧化碳浓度以及/或者氧浓度的连续保持时间,只要是5小时以上就没有特别地限定,但是从种子中的植物化学成分的产生量容易增加的方面考虑,优选是6小时以上,更优选是6.5小时以上,进一步优选是7小时以上,进而优选是8小时以上,更为优选的是10小时以上,最优选是12小时以上。另一方面,若保持时间过长,则植物化学成分的量变得过多,在后述的发芽处理植物种子的制造方法中,微生物即病原体变得难以对抗植物化学成分,结果是植物抗毒素的产生量变少。因此,保持时间优选是72小时以下,更优选是48小时以下,进一步优选是36小时以下。
虽然没有特别地限定二氧化碳浓度,但是从种子中的植物化学成分的产生量容易增加的方面考虑,优选是2000ppm以上,更优选是5000ppm以上,进一步优选是10000ppm以上,最优选是20000ppm以上。此外,虽然没有特别地限定二氧化碳浓度的上限,但是若二氧化碳浓度变得过高,结果是氧浓度变少,植物种子会厌氧呼吸,种子的植物化学成分的产生量会变少,因此优选是100000ppm以下,更优选是75000ppm以下,进一步优选是50000ppm以下,最优选35000ppm以下。
虽然没有特别地限定氧浓度,但是从种子中的植物化学成分的产生量容易增加的方面考虑,优选是18体积%以下,更优选是15%以下,进一步优选是12体积%以下,最优选是9体积%以下。此外,虽然没有特别地限定氧的下限,但是若氧浓度过低,植物种子会厌氧呼吸,种子的植物化学成分的产生量会变少,因此优选是3体积%以上,更优选是4体积%以上,进一步优选是6体积%以上,最优选7体积%以上。
虽然没有特别地限定二氧化碳浓度、氧浓度的保持,但是例如通过将植物种子堆积在密闭或者一部分密闭的容器内,能够使种子周围的氧浓度减少,二氧化碳浓度上升。因此,通过保持这样的状态,能够将二氧化碳浓度、氧浓度保持在期望的气氛条件下。为了结束该保持,例如可以通过打开密闭状态进行,或者也能够通过喷水进行。此外,能够通过容器的密闭程度或种子的堆积程度,调整保持的二氧化碳浓度、氧浓度。
在本发明中,暂时结束上述保持之后,也可以再次将植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上。在本发明中,虽然没有特别地限定进行保持与结束保持的次数,例如可以是1次以上(2次以上、3次以上、4次以上、5次以上、6次以上、8次以上、9次以上等),也可以是10次以下(9次以下、8次以下、7次以下、6次以下、5次以下、4次以下、3次以下、2次以下等),但优选是进行1~10次,更优选是进行2~8次,进一步优选是进行4~6次。
在本发明中,二氧化碳浓度、氧浓度是在gastec检测管/指示精度:cv=5%(cv:变动系数=σ:标准偏差÷平均值×100)的条件下测量的。
本发明中的植物种子,优选是使用能够发芽的种子。能够发芽的种子是指非休眠状态的种子。但是,在使用休眠状态的种子的情况下,在前处理工序之前,使休眠状态的种子经加热、水等解除休眠状态之后变为能够发芽的状态,从而能够在前处理工序中使用该种子。
在本发明中,使种子中的植物化学成分量增加的前处理工序,虽然能够通过将植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上来进行,但是前处理并不限定于此,只要是对植物种子进行处理,使前处理工序后的植物种子中的植物化学成分的质量变为前处理工序前的植物种子的植物化学成分的质量的例如2倍以上的方法,就可以是任何方法。另外,可以进行至少使1种以上的植物化学成分的质量变为2倍以上的处理,也可以进行植物化学成分整体的质量变为2倍以上的处理。
对使植物化学成分的质量变为2倍以上的植物处理,虽然没有特别地限定,但是除了调整并保持上述的二氧化碳浓度以及/或者氧浓度的气氛条件的方法之外,也能够通过单独地或者组合地控制种子周围的温度、水、光、植物激素、种子中的ph、离子浓度、微生物、微生物信号等的、与种子发芽有关的环境因素来进行植物处理。此外,也能够通过组合对这些环境因素的控制与对二氧化碳浓度以及/或者氧浓度的控制来进行。
温度虽然没有特别地限定,但是例如能够在10~45℃下进行。但是从种子中的植物化学成分的量容易增加的方面考虑,优选是15~40℃,更优选是20~35℃,进一步优选是25~35℃。此外,虽然能够通过以往已知的任何方法来进行温度的调整,但是也能够通过例如能够调节温度的恒温箱、能够调整室温的栽培室、加热器、冷却装置、空气控制装置、喷水等进行温度的调整。虽然没有特别地限定在期望的条件下保持温度的时间,但是能够根据例如二氧化碳浓度等的其他环境因素适当地设定该时间。
对水的控制例如能够通过喷水进行。虽然在本发明中没有特别地限定,但是能够通过例如将水吹出至种子上,或在种子上加水这样的不对植物种子进行浸泡来进行喷水的操作,此外也能够通过将种子浸泡在水中来进行。此外,在本发明中,通过对水的控制,能够调整种子周围的湿度、温度、二氧化碳浓度、氧等,由此能够使种子中的植物化学成分量增加。对水的控制能够根据湿度、温度、二氧化碳浓度、氧等,适当地设定其保持时间或喷水等的次数。
虽然水中可以含有例如10ppm以上的杀菌剂,但是在前处理中使用微生物的情况下,因在后述的发芽处理植物种子的制造方法中,可能会妨碍菌的生长,所以优选是不过多地使用杀菌剂。在该情况下,杀菌剂的浓度优选是9ppm以下,更优选是小于8ppm,进一步优选是小于5ppm。能够使用以往的公知的杀菌剂,例如能够列举次氯酸钠等。
虽然没有特别地限定,但是能够通过例如照射光强度为5~1000μmol/m2/天的光进行光的控制。此外,光的照射时间虽然没有特别地限定,但是优选是0.5~24小时/天,更优选是6~12小时/天。光的照射能够使用荧光灯等的以往的公知手段。
虽然没有特别地限定,但是能够通过例如乙烯气体(c2h4)、赤霉素等进行对植物激素的控制。控制的植物激素能够列举例如生长素、赤霉素、细胞分裂素、脱落酸、乙烯、油菜素甾醇、茉莉酸类、促花素、独脚金内酯等。
虽然没有特别地限定,但是能够通过例如将ph控制为2.3~9.0进行ph的控制。控制ph的方法,能够使用以往的公知手段。
虽然没有特别地限定,但是能够通过例如将喷在种子上的水中的离子(例如k+、mg2+、ca2+、na+等)调整为0.001ppm~100ppm进行对离子浓度的控制。
虽然没有特别地限定,但是能够通过控制例如曲霉菌等的微生物,或者β葡聚糖等的微生物信号,来进行对微生物或者微生物信号的控制。
通过前处理而增加的植物化学成分的量,大多是在后述的发芽处理植物种子的制造方法中,通过与病原体的相互作用,容易产生大量的植物抗毒素。因此,优选是对植物种子进行处理以使前处理工序后的植物种子中的植物化学成分的质量变为前处理工序前的植物种子的植物化学成分的质量的5倍以上;更优选变为10倍以上;进一步优选变为20倍以上。另一方面,若植物化学成分过多,则在后述的发芽处理植物种子的制造方法中,病原体容易死亡,难以大量地产生植物化学成分。因此,优选是对植物种子进行处理以使前处理工序后的植物种子中的植物化学成分的质量变为前处理工序前的植物种子的植物化学成分的质量的100倍以下;更优选变为80倍以下;进一步优选变为60倍以下。
在本发明中,使用的植物种子的种类没有特别地限定,例如能够列举葡萄科(赤霞珠、黑皮诺等)、豆科(大豆、红车轴草等)、茄科(番茄(红洋梨等)等)、菊科、十字花科、唇形科、枳科、蔷薇科、银杏科、禾木科、桑科、蓼科、山茶科、木犀科、冬青科、葫芦科、石榴科的种子等,更具体地能够列举葡萄、向日葵、赤霞珠、车轴草、芸苔、芝麻、白苏、胡麻、紫苏、花生、米、荞麦、玉米、小麦、野生稻、大麦、粟、稗草、葫芦巴、迷迭香、百里香、鼠尾草、薄荷、美国红樱桃、杏、杏仁、葡萄柚、柑橘、李子、金丝桃、番茄、草莓、胡萝卜、青椒、山竹、芒果、枇杷、牛蒡、可可等。植物种子的植物化学成分含量较多,在后述的发芽处理植物种子的制造方法中,植物抗毒素的产生量会变多,所以优选是使用植物化学成分含量较多的植物种子。按照该观点,作为前处理前的植物种子优选是使用植物化学成分含量为1mg/g以上的植物种子,更优选是使用植物化学成分含量为2mg/g以上的植物种子,进一步优选是使用植物化学成分含量为4mg/g以上的植物种子,最优选是使用植物化学成分含量为8mg/g以上的植物种子。更具体地,作为植物种子,因为其中的葡萄科、豆科、茄科、唇形科、十字花科的种子,种子粒较大,植物化学成分的含量较高,所以优选,此外,从能够比较便宜地获得的观点来看,也优选。特别是因为能够使用葡萄、番茄的种子在制造葡萄酒或番茄汁等时产生的残渣,所以从有效利用未利用资源的观点来看,也优选。
本发明中的“植物化学成分”是指,至少1种以上的植物化学成分。作为植物化学成分,只要是以往公知的植物化学成分即可,没有特别地限定,例如能够列举异黄酮等的多酚、番茄红素等的萜类、辣椒素等的长链烷基苯酚衍生物、皂苷等的与糖相关的化合物、萝卜硫素等的有机硫化合物。因为在发芽处理植物种子的制造方法中,植物抗毒素的产生量变多,所以优选是在这些植物化学成分之中,通过本发明的前处理,增加异黄酮的量。另外,本发明中的“异黄酮”是指,以异黄酮为基本骨架的黄酮类化合物中的异黄酮类。此外,在本发明中,植物化学成分也能够是植物抗毒素。
在本发明中,种子中的植物化学成分的质量通过高效液相色谱法来测量。
通过本发明中的前处理工序,种子能够产生氨基酸或糖等的后述的微生物即病原体的营养素。通过较多地生成该氨基酸或糖,能够在后述的发芽处理植物种子的制造方法中,大量地产生营养素。氨基酸没有特别地限定,只要是植物的营养素就没有特别地限定。特别是在氨基酸之中,谷氨酸的量通过前处理工序,优选是在前处理后质量比增加2.5倍以上(3倍以上、3.5倍以上等)。此外,糖的量优选是相对于前处理前增加2.5倍以上。由此,通过使氨基酸或糖的含量增加,在后述的发芽处理植物种子的制造方法中,微生物即病原体难以死亡,因此通过前处理能够更大量地增加植物化学成分。例如,在氨基酸即谷氨酸的量相对于前处理前变为2.5倍以上的含量的情况下,能够使植物化学成分的含量相对于前处理前增加到30倍以下(25倍以下、20倍以下等)。
在本发明中,通过uhplc测量氨基酸。此外,通过hplc测量糖。
<发芽处理植物种子的制造方法>
本发明的发芽处理植物种子的制造方法,具有发芽诱导工序,将微生物即病原体接种在上述发芽诱导用原料种子上,将发芽诱导用原料种子放置在能够诱导发芽且病原体能够生长的环境下。
(发芽诱导工序)
本发明的发芽处理植物种子的制造方法中的发芽诱导工序是将发芽诱导用原料种子放置在能够诱导发芽且病原体能够生长的环境下的工序。本发明通过该工序,能够制造发芽处理植物种子,所述发芽处理植物种子能够产生大量的植物抗毒素。
虽然以往已知有通过使用病原体制作发芽处理植物种子,产生异黄酮类等的植物抗毒素的方法(参考simonsr,vinckenjp,roidosn,boveetf,vanierselm,verbruggenma,gruppenh.通过真菌同时发芽和刺激来增加大豆异黄酮的含量与多样性以调节雌激素.j.agric.foodchem.,2011,59(12)第6748-6758页),但是根据以往的方法,因为与病原体接种之后的期间长达9天,所以存在费用或细菌管理等的问题,并不实用。但是根据本发明,接种微生物后,经较短期间(例如,1~5天)而无需9天的时间,就能够产生大量的植物抗毒素。
实施了本发明中的前处理的上述发芽诱导用原料种子,植物化学成分的量较多,该植物化学成分变为植物抗毒素的原料。因为该植物化学成分较多,所以即便接种微生物即病原体,也难以腐烂,结果是能够长时间地产生植物抗毒素,因此能够产生大量的植物抗毒素。
如上所述,通过本发明中的前处理能够在种子中大量地产生营养素即氨基酸或糖。病原体通过该营养素,能够对抗植物化学成分,因此在接种病原体后,病原体在植物化学成分的量较多的状态下,能够较长地生长。而且,推测在那时将前处理后的发芽诱导用原料种子放置在能够发芽的条件下,由此在病原体与前处理后的发芽诱导用原料种子间产生相互刺激,结果是能够有效地在种子中产生植物抗毒素。
接种病原体后,放置在上述环境下的时间,没有特别地限定,虽然例如也可以是6小时~7天等,但是放置时间过长,则植物可能会容易腐烂,因此放置时间优选是5天以下,更优选是4天以下。但是,如上所述,因为在种子中的氨基酸或糖的量变多的情况下,病原体能够更久地生长,所以接种病原体后,能够将发芽诱导用原料种子更长时间地放置在上述环境下。接种病原体后,也可以根据接种前的种子中的植物抗毒素的量增加多少程度为基准决定放置在上述环境下的时间,例如也可以放置在上述环境下,直至接种前的种子中的植物抗毒素的质量变为1mg/g以上(5mg/g以上、10mg/g以上、15mg/g以上、20mg/g以上、25mg/g以上、30mg/g以上等)。另外,在该情况下,也可以放置在上述环境下,以使至少1种以上的植物抗毒素的质量变为1mg/g以上等,也可以放置在上述环境下,以使植物抗毒素整体的质量变为1mg/g以上等。
在本发明中,通过四级杆质量分析器lc/ms/ms测量种子中的植物抗毒素的质量。
lc的条件如下。
色谱柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保护柱(1.7μm,2.1mm.×5mm)。
本发明中的植物抗毒素是指,至少1种以上的植物抗毒素。能够产生的植物抗毒素因种子的种类而不同,例如在使用葡萄种子的情况下,能够产生白藜芦醇苷或白藜芦醇等的二苯乙烯,在使用大豆的情况下,能够产生各种的大豆抗毒素(大豆抗毒素i、大豆抗毒素ii、大豆抗毒素iii、大豆抗毒素iv等)。
在本发明中,“病原体”是指一般被称为植物的病原体,在本发明中,为了用于在种子中产生植物抗毒素。本发明中的病原体,只要是微生物就没有特别地限定,本领域的技术人员能够根据植物种子的种类选择适当的病原体。其中,病原体优选是食用微生物。食用微生物没有特别地限定,能够列举例如坦培杆菌(根霉属菌、tempebacillus)、曲霉菌、纳豆菌、酵母菌、乳酸菌、蕈菌等。其中优选是坦培杆菌、曲霉菌、纳豆菌、酵母菌、乳酸菌,更优选是坦培杆菌、曲霉菌、酵母菌、乳酸菌。
在本发明中,能够通过以往公知的方法进行病原体的接种。
在本发明中,使发芽诱导用原料种子能够诱导发芽且能够使病原体生长的环境下,没有特别地限定,能够根据种子或病原体适当设定。
例如,虽然也可以是在与上述的前处理工序中相同的条件下,但是需要在这样的条件之中,选择能够诱导发芽且病原体能够生长的条件。能够诱导发芽的环境是指,虽然能够列举例如二氧化碳浓度300~120000ppm,氧浓度为5~20体积%,温度为10~45℃等的环境,但是在这样的环境之中,考虑病原体所需二氧化碳浓度、氧浓度、温度而设定环境。例如,在病原体为厌氧性微生物的情况下,优选氧浓度较低,在病原体为需氧性微生物的情况下,优选氧浓度较高。
<萃取组合物>
本发明的萃取组合物是上述发芽诱导用原料种子的萃取组合物。
本发明中的萃取组合物的调配没有特别地限定,能够使用以往公知的方法,例如在将发芽诱导用原料放入容器的状态下,通过加入水或有机溶剂(乙醇等)并粉碎来进行。此外,也可以具有进一步提纯、分离植物抗毒素那样的有用物质的工序。
本发明中的萃取组合物的用途没有特别地限定,因为在本发明的萃取组合物中含有植物抗毒素等的有用的化合物,所以在这样的情况下,优选是将萃取组合物制剂化,用于健康食品、医药品等。
<筛选方法>
本发明的筛选方法是用于产生目标物质的候补植物种子的筛选方法,具有:前处理工序,将被试验植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上,或者对被试验植物种子进行处理,使前处理工序后的被试验植物种子中的植物化学成分的质量,变为前处理工序前的被试验植物种子的植物化学成分的质量的2倍以上;发芽诱导工序,在前处理工序后,将微生物即病原体接种在被试验植物种子上,将发芽诱导用原料种子放置在能够诱导发芽且能够使病原体生长的环境下;检测工序,对发芽诱导工序后的被试验植物种子中的目标物质进行检测;选择工序,在能够检测的情况下,基于该检测结果,选择用于产生目标物质的候补植物种子。
虽然根据上述的发芽诱导用原料种子的制造方法以及发芽处理植物种子的制造方法,能够获得大量的植物抗毒素,但是得到的植物抗毒素因植物的种类而各式各样。因此,在希望获得特定种类的植物抗毒素等的有用的化合物的情况下,某植物种子能否生成期望的化合物,能够通过利用上述的发芽诱导用原料种子的制造方法以及发芽处理植物种子的制造方法来确定。即,通过利用上述的发芽诱导用原料种子的制造方法以及发芽处理植物种子的制造方法,能够筛选出能够用于产生目标物质的候补植物种子。
在本发明中,没有特别地限定目标物质,例如在本发明的筛选方法中,适于将植物抗毒素等的二次代谢产物作为目标物质。植物抗毒素的种类也没有特别地限定,也可以是以往已知的任何种类的植物抗毒素。
(前处理工序)
本发明的筛选方法中的前处理工序,是将被试验植物种子在400ppm以上的二氧化碳浓度以及/或者19体积%以下的氧浓度的气氛条件下,连续地保持5小时以上的前处理工序,或者对被试验植物种子进行处理,使前处理工序后的被试验植物种子中的植物化学成分的质量变为前处理工序前的被试验植物种子的植物化学成分的质量的2倍以上的前处理工序。所述前处理工序,能够使用与上述的发芽诱导用原料种子的制造方法中的前处理工序相同的工序。
被试验植物种子没有特别地限定,能够根据目的适当选择,能够使用以往公知的植物种子,特别地优选能够发芽的种子等。
如上所述,种子通过本发明中的前处理工序,能够生产氨基酸或糖等的微生物即病原体的营养素。因此,在前处理工序后,能够大量地生成氨基酸或糖等的被试验植物种子,适于在之后的发芽诱导工序中,产生植物抗毒素等的有用的化合物。因此,也可以在本发明的筛选方法中,具有在前处理工序后对被试验植物种子中的氨基酸或糖的量进行测量、确认的工序。特别是优选在氨基酸之中,谷氨酸的量,通过前处理工序,在前处理后质量比增加为2.5倍以上(3倍以上、3.5倍以上等)。
(发芽诱导工序)
本发明的筛选方法中的发芽诱导工序,能够使用与上述的发芽处理植物种子的制造方法中的发芽诱导工序相同的工序。
(检测工序)
本发明的筛选方法中的检测工序,是对发芽诱导工序后的被试验植物种子中的目标物质进行检测的工序。
检测能够使用以往公知的手段。例如,也可以压碎被试验植物种子而调配萃取组合物,通过高效液相色谱法进行检测。
(选择工序)
选择工序是在上述的检测工序后,在能够检测的情况下,基于该检测结果,选择用于产生目标物质的候补植物种子。
选择方法没有特别地限定,只要是通过以往公知的选择方法对候补物质进行选择即可。例如,也可以根据上述的检测结果,确认产生了作为目标的目标物质,由此将被试验植物种子选为候补植物种子。或者,也可以通过与其他的植物种子中的目标物质的量比较,来进行选择。作为比较对象的具体例,可以是例如进行前处理工序以及发芽诱导工序前的同种的植物种子,也可以是实施了前处理工序、未实施发芽诱导工序的同种的植物种子,或者可以是已知产生目标物质的其他种类的植物种子,也可以是不产生目标物质的阴性对照的植物种子。
实施例
<使用葡萄种子的试验>
(实施例1)
使用葡萄种子(品种:赤霞珠)制造发芽处理植物种子。首先,作为前处理,将葡萄种子(300g)容纳在大致密闭的容器中,每8小时进行喷水(1分钟注水后/1分钟排水),持续6小时地保持平均氧浓度为12体积%、二氧化碳浓度为20000ppm的气氛。合计进行21次喷水,合计进行7天的前处理工序。另外,水温以及室温的条件为28℃,喷水后的气氛化是氧浓度为20体积%,二氧化碳浓度为300~390ppm。通过该前处理,制造实施例1的发芽诱导用原料种子。
将酵母菌(种名:saccharomycescerevisiae)接种在实施例1的前处理后的发芽诱导用原料种子上,之后进行发芽诱导。接种由加州葡萄酒酵母菌rp15启动接种。接种后,一边在氧浓度8体积%、二氧化碳浓度20000ppm、24℃的环境下进行发芽诱导,一边使酵母菌生长6天。由此,进行实施例1的发芽处理植物种子的制造。
进行实施例1的发芽处理植物种子中的植物抗毒素即白藜芦醇以及白藜芦醇苷(piceid)的定量。首先,相对于实施例1的发芽处理植物种子的质量加入乙醇以及水,进行10倍稀释,粉碎1秒钟,并粉碎为0.5mm以下。量取15ml含有粉碎后的葡萄种子的溶液于离心管中,进行20分钟的超音波处理,制作萃取组合物。之后,使用该萃取组合物,进行组合物中的化合物的分析。分析在以下的条件下进行。
色谱柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保护柱(1.7μm,2.1mm.×5mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-10min15%,10-55min100%,55-60min100%,60-70min15%。
(比较例1)
准备与进行实施例1中的前处理以及发芽处理前的葡萄种子相同的种子,使用该种子,与实施例1同样地制作萃取组合物,对组合物中的化合物进行分析。
(分析结果1)
图1示出实施例1、比较例1各自的分析结果。图1的(a)箭头所示的峰示出白藜芦醇苷,图1的(b)箭头所示的峰示出白藜芦醇。如图1所示,与比较例1的葡萄种子相比,能够确认实施例1的发芽处理植物种子的白藜芦醇苷、白藜芦醇明显较多。此外,比较例1的葡萄种子(前处理前的葡萄种子)中的植物化学成分量为10mg/g,而实施例1的发芽诱导用原料种子(前处理后的发芽诱导用原料种子)中的植物化学成分量为25mg/g。此外,实施例1的发芽处理植物种子中产生的植物抗毒素的量为10mg/g。
<使用红车轴草种子的试验>
(实施例2)
除了使用红车轴草种子作为植物种子、进行2天的前处理以外,在与实施例1相同的条件下,制造发芽诱导用原料种子。
将曲霉菌(种名:aspergillusoryzae)接种在实施例2的前处理后的发芽诱导用原料种子上后,进行发芽诱导。通过种曲(秋田今野社)进行接种。接种后,一边在氧浓度8体积%、二氧化碳浓度20000ppm、24℃的环境下进行诱导发芽,一边使曲霉菌生长5天。由此,进行实施例2的发芽处理植物种子的制造。
对实施例2的发芽处理植物种子中的植物抗毒素即各种异黄酮进行分析。以与实施例1相同的顺序进行萃取组合物的制备。分析在以下的条件下进行。
色谱柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保护柱(1.7μm,2.1mm.×5mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(实施例3)
除了进行4天的前处理以外,在与实施例2完全相同的条件下进行发芽诱导用原料种子的制造、发芽处理植物种子的制造以及异黄酮的定量。另外,前处理前的红车轴草种子中的植物化学成分量为5mg/g,而前处理后的发芽诱导用原料种子中的植物化学成分的量为40mg/g。
(比较例2)
准备与进行实施例2中的前处理以及发芽处理前的红车轴草种子相同的种子(比较例2的种子),使用该种子,与实施例2同样地制备萃取组合物,对组合物中的化合物进行分析。
(分析结果2)
图2示出实施例2、3、比较例3各自的分析结果。图2中的(a)箭头所示的峰示出三叶豆紫檀苷(trifolirhizin),图2中的(b)箭头所示的峰示出芒柄花黄素(formononetinglucosidemalonate),图2中的(c)箭头所示的峰示出鹰嘴豆芽素a(biochaninaglucosidemalonate)。此外,在下述表1中示出图2中的三叶豆紫檀苷、芒柄花黄素以及鹰嘴豆芽素a各峰区域的面积比。
[表1]
如图2、表1所示,能够确认相对于未进行任何处理的比较例2的种子,在实施例2以及实施例3的发芽处理植物种子中,三叶豆紫檀苷、芒柄花黄素的量增加了。特别是能够确认,在进行了4天的前处理的实施例3的发芽处理植物种子中,相对于比较例2的种子,三叶豆紫檀苷增加了11.80倍,芒柄花黄素增加了15.46倍,鹰嘴豆芽素a增加了35.90倍。另外,比较例2的红车轴草种子(前处理前的红车轴草种子)中的植物化学成分量为5mg/g,而实施例2的发芽诱导用原料种子(前处理后的发芽诱导用原料种子)中的植物化学成分量为20mg/g。此外,实施例3的发芽诱导用原料种子(前处理后的发芽诱导用原料种子)中的植物化学成分量为如上所述的40mg/g,实施例3的发芽处理植物种子中产生的植物抗毒素的量为30mg/g。
<使用番茄种子的试验>
(实施例4)
除了使用番茄(品种:红洋梨)种子作为植物种子以外,在与实施例1相同的条件下,制造发芽诱导用原料种子。
调配实施例4的发芽处理植物种子的萃取组合物,对植物化学成分进行分析。分析在以下的条件下进行。
分析仪器:日立高效液相色谱仪(hplc)/检测器:uv检测器/色谱柱:glsciencesods(6.0mml.d.×150mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-10min15%,10-55min100%,55-60min100%,60-7min15%。
(比较例3)
准备与进行实施例4中的前处理前的番茄种子相同的种子,使用该种子,与实施例4同样地制备萃取组合物,在与实施例4相同的条件下进行组合物中的植物化学成分的分析。
(分析结果3)
图3示出实施例4、比较例3各自的分析结果。如图3所示,能够确认植物化学成分发生了变化。具体而言,能够确认在植物化学成分之中,特别是柚皮苷查尔酮增加了。在图3中,(a)箭头的峰示出柚皮苷查尔酮。此外,比较例3的番茄种子(前处理前的番茄种子)中的植物化学成分量为4mg/g,而实施例4的发芽诱导用原料种子中的植物化学成分量为16mg/g。
<使用大豆的试验>
(实施例5)
除了使用大豆(品种:白大豆)种子作为植物种子,此外,营造保持时的氧浓度为10体积%,二氧化碳浓度为40000pm的气氛,进行1天的前处理以外,在与实施例1相同的条件下进行前处理工序,制造发芽诱导用原料种子。
压碎实施例5的发芽诱导用原料种子,调配萃取组合物,对植物化学成分异黄酮进行分析。分析在以下的条件下进行。
分析仪器:岛津高效液相色谱仪(uhplc)/检测器:光电二极管阵列检测器/色谱柱:shim-packxr-odsiii(2.0mml.d.×150mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(实施例6)
除了使用秋田绿大豆作为大豆的品种以外,在与实施例5相同的条件下,制造发芽诱导用原料种子。
压碎实施例6的发芽诱导用原料种子,调配萃取组合物,在与实施例5相同的条件下进行植物化学成分异黄酮的分析。
(实施例7)
除了使用黑千石大豆作为大豆的品种以外,在与实施例5相同的条件下,制造发芽诱导用原料种子。
压碎实施例7的发芽诱导用原料种子,调配萃取组合物,在与实施例5相同的条件下进行植物化学成分异黄酮的分析。
(比较例4)
准备与进行实施例5中的前处理前的大豆(品种:白大豆)相同的种子,使用该种子,与实施例5同样地制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(比较例5)
准备与进行实施例6的前处理前的大豆(品种:秋田绿大豆)相同的种子,使用该种子,与实施例6同样地制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(比较例6)
准备与进行实施例7中的前处理前的大豆(品种:黑千石大豆)相同的种子,使用该种子,与实施例7同样地制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(比较例7)
除了将实施例5中保持时的氧浓度设为20体积%,二氧化碳浓度设为390ppm以外,通过与实施例5相同的条件,制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(比较例8)
除了将实施例6中保持时的氧浓度设为20体积%,二氧化碳浓度设为390ppm以外,通过与实施例6相同的条件,制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(比较例9)
除了将实施例7中保持时的氧浓度设为20体积%,二氧化碳浓度设为390ppm以外,通过与实施例7相同的条件,制备萃取组合物,在与实施例5相同的条件下进行组合物中的植物化学成分异黄酮的分析。
(分析结果4)
图4示出实施例5~7、比较例4~9的植物化学成分异黄酮的量。图4中“发芽前”示出未进行任何的诱导发芽处理的种子(比较例4~6的大豆),“发芽/有氧条件”示出在有氧条件下进行了诱导发芽处理的种子(比较例7~9的大豆),“发芽/微缺氧条件”示出在厌氧条件下进行了诱导发芽的前处理的种子(实施例5~7的发芽诱导用原料种子)。如图4所示,能够确认相对于未进行任何处理的比较例4~6的大豆或在氧容量为20%的有氧气氛条件下处理的比较例7~9的大豆,实施例5~7的发芽诱导用原料种子中的植物化学成分异黄酮高出了2.8~3.0倍。从该结果也能够确认,通过本发明中的前处理,植物种子中的植物化学成分量上升。
此外,在图5中示出实施例5~7的发芽诱导用原料种子、比较例4~9的大豆中所含的植物化学成分各种异黄酮的量。图5a示出比较例4~6的大豆的萃取组合物中的植物化学成分各种异黄酮的量,图5b示出比较例7~9的大豆的萃取组合物中的植物化学成分各种异黄酮的量,图5c示出实施例5~7的发芽诱导用原料种子的萃取组合物中的植物化学成分各种异黄酮的量。如图5所示,与比较例4~9的大豆相比,实施例5~7的发芽诱导用原料种子,特别是丙二酰染料木苷(malonyl-genistin),丙二酰大豆苷(malonyl-daidzin)的量显著变多。
(实施例8)
除了通过与实施例5相同的条件,使用大豆(品种:白大豆)作为植物种子,此外,营造保持时的氧浓度为10体积%,二氧化碳平均浓度为40000ppm的气氛以外,在与实施例1相同的条件下进行前处理工序,制造发芽诱导用原料种子。
使用实施例8的发芽诱导用原料种子,使用坦培杆菌(根霉属菌)(菌种:rhizopussp.)作为病原体以外,通过与实施例1相同的顺序进行实施例8的发芽处理植物种子的制造。
对实施例8的发芽处理植物种子中的大豆抗毒素进行分析。以与实施例1相同的顺序进行萃取组合物的制备。分析条件如下所述。
分析仪器:岛津高效液相色谱仪(uhplc)/检测器:光电二极管阵列检测器/色谱柱:aqcuityuplcbehshieldrp18柱(1.7μm,2.1mm.×150mm),aqcuityuplcbehshieldrp18vanguard保护柱(1.7μm,2.1mm.×5mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-2min15-20%,2-5min25%,5-6min30%,6-8min40%,8-9min45%,9-10min45%,10-12min50%,12-22min100%,22-24min100%,24-25min15%,25-27min15%。
(实施例9)
除了使用曲霉菌(菌种:aspergillussp.)作为病原体以外,在与实施例8相同的条件下,进行发芽诱导用原料种子的制造、发芽处理植物种子的制造、萃取组合物的调配以及大豆抗毒素的分析。
(实施例10)
除了使用乳酸菌(lactobacillussp.)作为病原体以外,在与实施例8相同的条件下,进行发芽诱导用原料种子的制造、发芽处理植物种子的制造、萃取组合物的调配以及大豆抗毒素的分析。
(比较例10)
除了不使用病原体以外,在与实施例8~10完全相同的条件下,进行发芽诱导用原料种子的制造、发芽处理植物种子的制造、萃取组合物的调配以及大豆抗毒素的分析。
(分析结果5)
图6示出实施例8~10、比较例10的大豆抗毒素的量。如图6所示,能够确认相对于不接种病原体的比较例10,在实施例8~10的发芽处理用原料种子中,大豆抗毒素的量显著地变多。另外,实施例8的发芽处理植物种子中产生的植物抗毒素的量为25mg/g。实施例9的发芽处理植物种子中产生的植物抗毒素的量为25mg/g。实施例10的发芽处理植物种子中产生的植物抗毒素的量为25mg/g。
此外,调查实施例9的发芽处理植物种子在接种曲霉菌后随着时间的推移(0~4天),大豆抗毒素i~v有多少程度的增加。在图7中示出其结果。图7中“i”~“v”分别示出“大豆抗毒素i~v”。另外图7中将质量最多的示为100%。如图7所示,能够确认大豆抗毒素之中,大豆抗毒素iii与大豆抗毒素iv显著地增加。特别是已知大豆抗毒素iii对乳腺癌的抑制、美肌效果的有效性。因此示出,通过使用大豆作为植物种子,利用本发明的方法制造发芽处理植物种子,不仅大豆抗毒素的量增加,有用的大豆抗毒素iii的比例也增加。
(实施例11)
除了使用大豆(品种:白大豆)作为植物种子以外,在与实施例1相同的条件下,制造发芽诱导用原料种子。
压碎实施例11的发芽诱导用原料种子,调配萃取组合物,对氨基酸进行分析。分析条件如下所述。
岛津高效液相色谱仪(uhplc)/检测器:荧光检测器/色谱柱:ymctriartc181.9mm(50mml.d.×3.0mm)/色谱柱温度:35℃/水(0.1%醋酸)、acn(0.1%醋酸):0-1.5min9.5%,1.5-4.5min18.5%,4.5-6.5min25%,6.5-8.5min45%,8.5-12min85%。
(比较例11)
准备与进行实施例11中的前处理前的大豆相同的种子,使用该种子,与实施例11同样地制作萃取组合物,在与实施例11相同的条件下进行组合物中的氨基酸的分析。
(比较例12)
除了不进行实施例11中的前处理,代替地进行通常的发芽处理(条件:氧浓度20体积%、二氧化碳浓度300ppm的气氛、温度26℃的条件下)以外,与实施例11同样地制作萃取组合物,在与实施例11相同的条件下进行组合物中的氨基酸的分析。
(分析结果6)
图8示出实施例11、比较例11、比较例12各自的分析结果。根据图8能够确认,实施例11的发芽诱导用原料种子,与未进行任何处理的比较例11的大豆、进行了通常的发芽处理的比较例12的大豆相比较,氨基酸的量增加了。特别是能够确认谷氨酸的量显著地增加。
因为通过本发明中的前处理,植物化学成分增加,所以即便接种了病原体也难以生长。但是,像这样地通过前处理使在种子中病原体的营养素即氨基酸大量地增加,所以病原体能够对抗植物化学成分。因此,推测在接种微生物即病原体的实施例中,在植物化学成分的量较多的状态下病原体能够生长,此时因为病原体与前处理后的发芽诱导用原料种子之间产生相互地刺激,所以结果是能够在种子中生成大量的植物抗毒素。
- 还没有人留言评论。精彩留言会获得点赞!