哺乳动物卵丘卵母细胞复合体的体外成熟的制作方法
发明领域
本发明一般性涉及用于哺乳动物辅助生殖技术的组合物和方法。具体地,本发明涉及用于哺乳动物卵丘卵母细胞复合体的体外成熟的组合物和方法。
发明背景
在人类不育实践中,传统的体外受精(ivf)或胞质内精子注射(icsi)技术在用昂贵的激素疗法进行超排卵后仍然使用,以获得大卵泡(即直径至少17mm)。激素的成本、其与急性和长期并发症相关的风险以及反复的医院就诊监测卵泡生长的不便,都会激励人们为正常/高卵泡储备的不育夫妇开发一种成本更低、耐受性更好的治疗方法。
卵母细胞体外成熟(ivm)是一种技术,其可以使得封闭在牢固凝聚的冠状卵丘层中生发泡(gv)期卵母细胞(卵母细胞复合物(coc))成熟。可以在通过施用人绒毛膜促性腺激素(hcg)或hcg施用之后的早期触发排卵之前通过超声引导的针穿刺获得这些卵母细胞。因此,卵母细胞ivm有可能简化生育治疗或降低与正常卵巢卵泡储备或高卵巢卵泡储备患者激素(hcg)刺激相关的风险和成本。这种卵泡储备通常通过测量抗苗勒激素水平和通过月经周期的第3天超声引导的卵泡计数来确定。
对于使用超声引导针穿刺的卵母细胞ivm,可以在最小刺激或未刺激的卵巢中从小(<10mm)卵泡中收集卵母细胞,并且体外成熟。然而,在发育的早期阶段干扰卵母细胞的正常发育(例如当卵泡仅达到10mm或更小的直径时)不仅产生较少的成熟卵母细胞,而且降低随后的胚胎发育和植入。特别是ivm后每个胚胎的成功植入率通常低于10%,只有常规ivf或icsi程序的成功率的一半。早期流产的发生率似乎是可变的,但通常大于ivf/icsi后的发生率。对于人类患者,目前降低的减数分裂成熟率(50%)与观察到成熟卵母细胞胚胎发育的缺陷一起是当前ivm技术的主要瓶颈(devosetal.,fertil.steril.2011;96(4)860-864;guzmanetal.,fertil.steril.2012;98(2):503-507)。因此,在该方法可以广泛接受之前,需要解决ivm胚胎发育潜力和植入率的降低。
ivm培养的基石是为获得发育能力提供适当的环境。这主要需要激素干预和激活必要的信号传导途径,通过使用允许卵母细胞内核细胞和细胞质成熟过程同步的化学化合物。体外延长卵母细胞成熟期的原理是促进未成熟卵母细胞与充分调节的卵丘细胞之间更长的相互作用。
负责减数分裂阻滞的卵泡细胞和卵母细胞之间的信号传导途径已被广泛研究。通过产生高水平的环腺苷酸(camp)来维持减数分裂阻滞。通过降解camp的磷酸二酯酶(pde)酶的活性调节卵母细胞内的camp浓度。最近的研究表明,cgmp在激活鸟苷酸-环化酶偶联的利尿钠肽2型受体(npr2)后在卵丘细胞中产生。npr2活性由其配体利尿钠肽前体c(nppc)诱导,主要由壁颗粒细胞合成并切割成c型利尿钠肽(cnp)。然后将cgmp转移到卵母细胞中,其中它通过磷酸二酯酶pde3a抑制camp的水解。这种抑制保持高浓度的camp,从而阻止减数分裂进展。(tsafririetal.dev.biol.1996,178(2):393-402;contietal.,mol.cell.endocrinol.1998,145(1-2):9-14;contietal.,mol.cell.endocrinol.2002,187(1-2):153-159)。
以前,为了促进卵母细胞减数分裂阻滞并允许获取卵母细胞能力,已经尝试了衍生自不同物种如小鼠、牛、人的体外成熟卵母细胞中camp水平的药理学干扰(nogueiraetal.biol.reprod.2003,69(6):2045-2052;thomasetal.biol.reprod.2004,71(4):1142-1149;shuetal.hum.reprod.2008,23(3):504-513;vanhoutteetal.hum.reprod.2009,24(3):658-669)。然而,在胚胎发育潜力水平方面没有报道重大改善。
最近,cnp/npr2信号传导途径已被证明是在中等大小和完全生长的卵泡中维持卵母细胞减数分裂阻滞的重要调节机制(zhangetal.j.cell.physiol.2015,230(1):71-81;satoetal.mol.endocrinol.2012,26:1158-1166,franciosietal.biol.reprod.2014,91(3):61,santiquetetal.biol.reprod.2014,91(1):16)。然而,上述研究中的主要问题是coc只能在减数分裂阻滞状态保持较短时间,因此,只有中等大小至答的卵泡的体外成熟才能成功,小的早期窦卵泡的成熟失败了。因此,延缓启动小的早期窦卵泡的减数分裂恢复以及为了改善ivm过程是目前的一个重大挑战。特别地,这样的操作方案不应影响进一步的体外成熟。对于这种小的早期窦卵泡,这种挑战甚至更高,因为它们需要获得或保持完成核成熟的能力(即从非包围核仁(nsn)变成包围核仁(sn)期),然后进入下一步骤潜在发育,甚至保持卵母细胞和卵丘之间的互连,允许从卵丘中转移营养物质(例如rna货物)。
发明概述
本发明涉及用于哺乳动物辅助生殖技术的组合物和方法。特别地,本发明提供了用于未成熟卵丘卵母细胞复合体(coc)的体外成熟的组合物和方法,从而增强胚胎学结果。
在本发明的背景中,无需在先的hcg刺激或在hcg刺激之后,收集未成熟的哺乳动物coc。在优选的实施方案中,在体内收集coc之前避免任何触发剂,包括高剂量的fsh、lhrh及其激动剂,重组lh或lh类似物。
在第一方面,本发明提供用于哺乳动物卵丘卵母细胞复合体(coc)的体外成熟的获能培养基,所述培养基包含0.1至50nmc型利尿钠肽(cnp),雌二醇和fsh。在具体实施方案中,获能培养基包含10至25nmcnp,甚至更特别是25nmcnp。
在具体实施方案中,获能培养基包含1至1000nm雌二醇,最优选10nm雌二醇。在另一实施方案中,获能培养基包含0.1至10miu/mlfsh,特别是1至5miu/ml的fsh,甚至更特别是2.5miu/ml的fsh或1miu/ml的fsh。在又一实施方案中,获能培养基包含25nmcnp,10nm雌二醇和2.5或1miu/mlfsh。在又一方面,获能培养基包括等量剂量的重组fsh、fsh类似物或fsh模拟分子。
在又一实施方案中,获能培养基包含0.1至10ng/ml胰岛素,特别是5ng/ml胰岛素。在另一方面,获能培养基包含等量剂量的胰岛素类似物或胰岛素模拟分子。
在进一步的实施方案中,获能培养基包含卵母细胞分泌因子。本文所用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合;特别是在获能培养基中的浓度各自分别为10至100ng/ml。在具体实施方案中,卵母细胞分泌因子是重组蛋白。在又一方面,卵母细胞分泌因子是异二聚体蛋白。
在又一个另外的实施方案中,获能培养基包含0.1至50nmcnp,最优选25nmcnp;1至1000nm雌二醇,最优选10nm雌二醇;0.1至10miu/mlfsh,最优选2.5miu/mlfsh或1miu/mlfsh;0.1至10ng/ml胰岛素,最优选5ng/ml胰岛素;和选自gdf-9、bmp-15、fgf-8或其任何等同物或组合的卵母细胞分泌因子。
本发明还提供了用于未成熟哺乳动物coc的体外成熟方法。
在第一方面,该方法包括在收集培养基中收集未成熟的coc,使哺乳动物coc与包含0.1至50nmcnp、雌二醇和fsh的获能培养基接触,并进一步使哺乳动物coc与成熟培养基接触。在所述方法中,未成熟的coc通常与收集培养基接触最少30分钟至最多2小时。同样在所述方法中,并且在与收集培养基接触后,使哺乳动物coc与维持减数分裂阻滞的获能培养基接触。特别地,coc与获能培养基接触足以达到晚期发育阶段的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型,如gv期观察到的那样所证明的。在此期间,在用于减数分裂恢复的刺激之后,卵母细胞将能够经历生发泡破裂(gvbd)。甚至更特别地,使哺乳动物coc与获能培养基接触最少2小时和最多96小时。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。更具体地,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。对于直径>5至10mm的卵泡,优选coc在获能培养基中保持至少24小时,直径大于10mm的卵泡优选在获能培养基中保持至少2小时。在另一实施方案中,使哺乳动物coc与成熟培养基接触以允许卵母细胞的进一步减数分裂成熟。
在具体实施方案中,在根据本发明的体外方法中,获能培养基包含1至1000nm雌二醇,更特别是10nm雌二醇。在另一实施方案中,在根据本发明的体外方法中,获能培养基包含0.1至10miu/mlfsh,更特别是2.5miu/mlfsh或1miu/mlfsh。在另一方面,获能培养基包括等量剂量的重组fsh、fsh类似物或fsh模拟分子。
在另一实施方案中,在根据本发明的方法中,获能培养基包含0.1至10ng/ml胰岛素,更特别是5ng/ml胰岛素。在另一方面,获能培养基包括等量剂量的胰岛素类似物或胰岛素模拟分子。
在另一实施方案中,在根据本发明的体外方法中,获能培养基包含卵母细胞分泌因子。本文所用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合;特别是在获能培养基中的浓度各自分别为10至100ng/ml。在具体实施方案中,卵母细胞分泌因子是重组蛋白。在另一实施方案中,卵母细胞分泌因子是异二聚体蛋白。
在另一实施方案中,在根据本发明的体外方法中,使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。这个时间足以达到晚期发育阶段,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。更具体地,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。获能期使得卵母细胞获得恢复减数分裂的能力,这仅在减数分裂刺激被触发后才进行评估。在另一实施方案中,使哺乳动物coc与成熟培养基(减数分裂刺激)接触以允许卵母细胞的进一步减数分裂成熟,这在倒置显微镜下通过生发泡破裂(gvbd)和第一极体(pb)的排出证明。
在具体实施方案中,在根据本发明的体外方法中,哺乳动物coc与非贴壁或贴壁培养板中、特别是非贴壁培养板中的获能培养基接触。
在另一实施方案中,在根据本发明的体外方法中,将未成熟的coc与收集培养基接触最少30分钟至最多2小时。
在另一实施方案中,根据本发明的体外方法是辅助生殖技术的一部分。在具体实施方案中,所述辅助生殖技术包括体外受精或icsi。
在本发明的一个具体实施方案中,哺乳动物coc是人类coc。
在另一方面,本发明提供了用于未成熟哺乳动物coc的体外成熟的试剂盒。所述试剂盒包含如本文所述的获能培养基。在具体实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至50nmcnp、雌二醇和fsh。在更具体的实施方案中,在根据本发明的试剂盒中,获能培养基包含10至25nmcnp,优选25nmcnp。在具体实施方案中,试剂盒中的获能培养基包含1至1000nm雌二醇,优选10nm雌二醇。在另一实施方案中,试剂盒中的获能培养基包含0.1至10miu/mlfsh,更特别是2.5miu/mlfsh或1miu/mlfsh。在另一方面,获能培养基包括等量剂量的重组fsh、fsh类似物或fsh模拟分子。在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至10ng/ml胰岛素,更特别是5ng/ml胰岛素。在另一方面,获能培养基包括等量剂量的胰岛素类似物或胰岛素模拟分子。在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至50nmcnp,优选25nmcnp;1至1000nm雌二醇,优选10nm雌二醇;0.1至10miu/mlfsh,优选2.5miu/mlfsh或1miu/mlfsh;和0.1至10ng/ml胰岛素,优选5ng/ml胰岛素。
在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含卵母细胞分泌因子。本文使用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合。特别是在获能培养基中的浓度各自分别为10至100ng/ml。在具体实施方案中,本文使用的卵母细胞分泌因子是重组蛋白或异二聚体蛋白。
在另一实施方案中,用于未成熟哺乳动物coc的体外成熟的试剂盒包含(a)收集培养基,其包含抑制天然存在的磷酸二酯酶的天然或人造化学化合物或卵母细胞减数分裂的天然抑制剂;(b)如本文所述的获能培养基;(c)成熟培养基;(d)贴壁和/或非贴壁培养板;和(e)使用该试剂盒的说明。
另一方面,本发明提供了用于未成熟哺乳动物coc的体外成熟的获能培养基的用途。如本文所述,所述获能培养基包含0.1至50nmcnp、雌二醇和fsh。在具体实施方案中,所述获能培养基包含1至1000nm雌二醇。在另一实施方案中,获能培养基包含0.1至10miu/mlfsh,优选2.5miu/mlfsh或1miu/mlfsh。在另一方面,获能培养基包括等量剂量的重组fsh、fsh类似物或fsh模拟分子。在另一实施方案中,获能培养基包含0.1至10ng/ml胰岛素,优选5ng/ml胰岛素。另一方面,获能培养基包括等量剂量的胰岛素类似物或胰岛素模拟分子。在另一实施方案中,在根据本发明的获能培养基的用途中,获能培养基包含卵母细胞分泌因子。本文所用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合。在具体实施方案中,卵母细胞分泌因子是重组蛋白。在另一方面,卵母细胞分泌因子是异二聚体蛋白。
在具体实施方案中,在根据本发明的获能培养基的用途中,使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。更具体地,在获能培养基的用途中,使哺乳动物coc与获能培养基接触以维持卵母细胞减数分裂阻滞并允许获得细胞质成熟。特别地,使coc与获能培养基接触足以达到晚期发育的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。更具体地,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,优选的是直径大于10mm的卵泡在获能培养基中保持至少2小时。在荧光显微镜下评估评估在核水平的卵母细胞成熟,即卵母细胞内的染色质重塑。
在具体实施方案中,在根据本发明的获能培养基的用途中,使哺乳动物coc与非贴壁或贴壁培养板中、特别是非贴壁培养板中的获能培养基接触。
在另一实施方案中,所述获能培养基的用途,用于使哺乳动物coc的卵母细胞维持在减数分裂阻滞状态。基于维持卵母细胞在减数分裂阻滞中而不影响其进一步成熟的能力,当与当前使用的ivm方法相比时,使用本发明的获能培养基创建了灵活的ivm方法。由于体外培养的扩展可能具有灵活性,即获能间隔-所有重要的技术工作(如微注射卵母细胞)现在都可以在正常工作时间内。显然,这是对当前ivm操作步骤的重要实践改进。
在进一步的实施方案中,根据本发明的获能培养基的用途是辅助再现技术的一部分。在具体实施方案中,所述辅助生殖技术包括体外受精或icsi。
基于使用本发明的获能培养基的其它应用在于比通常使用的从较小卵泡获得的coc的ivm性能的提高。
通过能够使较小的卵泡成熟,人们;
-有可能低温保存从小窦卵泡发育良好的成熟卵母细胞;
-有可能从小窦卵泡培养coc(在癌症治疗的情况下对于生育力保存领域是重要的),其中coc将从比通过超声引导的阴道前检查穿刺的更小的卵泡解剖获得。
本发明的另一方面是基于包含哺乳动物coc体外成熟的获能培养基的试剂盒的用途。所述试剂盒包含如本文所述的获能培养基。在具体实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至50nmcnp、雌二醇和fsh。在具体实施方案中,试剂盒中的获能培养基包含1至1000nm雌二醇。在另一实施方案中,试剂盒中的获能培养基包含0.1至10miu/mlfsh。在又一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至10ng/ml胰岛素。在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至50nmcnp,优选25nmcnp;1至1000nm雌二醇,优选10nm雌二醇;和0.1至10miu/mlfsh,优选2.5miu/mlfsh或1miu/mlfsh。在另一方面,获能培养基包含等量剂量的重组fsh、fsh类似物或fsh模拟分子。
在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至10ng/ml胰岛素,更特别是5ng/ml胰岛素。在另一方面,获能培养基包含等量剂量的胰岛素类似物或胰岛素模拟分子。
在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含卵母细胞分泌因子。本文使用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合。在具体实施方案中,本文所用的卵母细胞分泌因子是重组蛋白或异二聚体蛋白。
在另一实施方案中,包含用于未成熟哺乳动物coc的体外成熟的获能培养基的试剂盒的用途包括使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。更具体地,在包含获能培养基的试剂盒的用途中,使哺乳动物coc与获能培养基接触以诱导减数分裂阻滞并允许成熟。特别地,使coc与获能培养基接触足以达到晚期发育的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。更特别地,通过超声成像在coc取出时确定卵泡大小。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。在荧光显微镜下评估核水平的卵母细胞成熟,即卵母细胞内的染色质重塑。
本发明的另一方面是基于试剂盒的用途,试剂盒包含(a)收集培养基,其包含抑制天然存在的磷酸二酯酶的天然或人造化合物或天然的卵母细胞减数分裂抑制剂;(b)如本文所述的获能培养基;(c)成熟培养基;(d)贴壁和/或非贴壁培养板;和(e)使用该试剂盒的说明。
在本发明的特定方面,用于未成熟哺乳动物coc的体外成熟的试剂盒的用途包括使coc与收集培养基接触至少30分钟至最多2小时。在另一方面,在根据本发明的试剂盒的用途中,使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。更具体地,在包含收集培养基,获能培养基,成熟培养基,贴壁和/或非贴壁培养板和使用说明的试剂盒的用途中,使哺乳动物coc与获能培养基接触以诱导减数分裂阻滞并允许成熟。特别地,使coc与获能培养基接触足以达到晚期发育的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。更具体地,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。
获能期使得卵母细胞获得恢复减数分裂的能力,这仅在减数分裂刺激被触发后才进行评估。在另一实施方案中,使哺乳动物coc与成熟培养基(减数分裂刺激)接触以允许卵母细胞的进一步减数分裂成熟,这在倒置显微镜下通过生发泡破裂(gvbd)和第一极体(pb)的排出证明。
在具体实施方案中,在根据本发明的试剂盒的用途中,使哺乳动物coc与非贴壁或贴壁培养板中的获能培养基接触。
在另一实施方案中,在根据本发明的试剂盒的用途中,获能培养基使哺乳动物coc的卵母细胞维持在减数分裂阻滞状态。
在进一步的实施方案中,根据本发明的试剂盒的用途诱导哺乳动物coc的成熟。
在另一实施方案中,根据本发明的试剂盒的用途是辅助生殖技术的一部分。在具体实施方案中,所述辅助生殖技术包括体外受精或icsi。
本发明的编号实施方案如下:
1.用于未成熟哺乳动物卵丘卵母细胞复合体的体外成熟的获能培养基,所述培养基包含0.1至50nmc型利尿钠肽(cnp)、雌二醇和卵泡刺激素(fsh);特别是包含10至50nmc型利尿钠肽(cnp);更特别是25nmcnp。
2.根据权利要求1所述的获能培养基,其中所述培养基包含1至1000nm雌二醇。
3.根据权利要求1所述的获能培养基,其中所述培养基包含0.1至10miu/ml卵泡刺激素(fsh)。
4.根据前述权利要求中任一项所述的获能培养基,其中所述培养基还包含0.1至10ng/ml胰岛素。
5.根据前述权利要求中任一项所述的获能培养基,其中所述培养基包含卵母细胞分泌因子。
6.根据权利要求5所述的获能培养基,其中所述卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8,它们的类似物或其任何组合;特别是在获能培养基中每个所述因子的浓度分别为10至100ng/ml。
7.用于未成熟哺乳动物卵丘卵母细胞复合体的体外成熟的方法,所述方法包括将未成熟的卵丘卵母细胞复合体收集在收集培养基中,使哺乳动物卵丘卵母细胞复合体与包含0.1至50nmcnp(特别是10至50nmcnp)、雌二醇和fsh的获能培养基接触,并进一步使哺乳动物卵丘卵母细胞复合体与成熟培养基接触。
8.根据权利要求7所述的方法,其中所述获能培养基包含1至1000nm雌二醇。
9.根据权利要求7所述的方法,其中所述获能培养基包含0.1至10miu/mlfsh。
10.根据权利要求7至9中任一项所述的方法,其中所述获能培养基还包含0.1至10ng/ml胰岛素。
11.根据权利要求7至10中任一项所述的方法,其中所述获能培养基包含卵母细胞分泌因子。
12.根据权利要求11所述的方法,其中所述卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8,它们的类似物或其任何组合;特别是在获能培养基中每个所述因子的浓度分别为10至100ng/ml。
13.根据权利要求7至12中任一项所述的方法,其中所述哺乳动物卵丘卵母细胞复合体是人卵丘卵母细胞复合体。
14.根据权利要求7至13中任一项所述的方法,其中所述哺乳动物卵丘卵母细胞复合体与所述获能培养基接触至少2小时至最多96小时的时间段。
15.根据权利要求7至14中任一项所述的方法,其中所述哺乳动物卵丘卵母细胞复合体在非贴壁或贴壁培养板、特别是非贴壁培养板中与所述获能培养基接触。
16.根据权利要求7所述的方法,其中所述未成熟卵丘卵母细胞复合体与收集培养基接触最少30分钟至最多2小时。
17.根据权利要求7至16中任一项所述的方法,其中所述方法是辅助生殖技术的一部分。
18.根据权利要求17所述的方法,其中所述辅助生殖技术包括体外受精或icsi或生育力保存。
19.用于未成熟哺乳动物卵丘卵母细胞复合体的体外成熟的试剂盒,所述试剂盒包含根据权利要求1至6中任一项所述的获能培养基。
20.用于未成熟哺乳动物卵丘卵母细胞复合体的体外成熟的试剂盒,所述试剂盒包含:
(a)收集培养基,其包含抑制天然存在的磷酸二酯酶的天然或人造化学化合物或卵母细胞减数分裂的天然抑制剂;
(b)根据权利要求1至6中任一项所述的获能培养基;
(c)成熟培养基;
(d)非贴壁和/或贴壁培养板;和
(e)使用该试剂盒的说明。
21.根据权利要求1至6中任一项所述的获能培养基用于哺乳动物卵丘卵母细胞复合体的体外成熟的用途。
22.根据权利要求1至6中任一项所述的获能培养基的用途,其中所述哺乳动物卵丘卵母细胞复合体与所述获能培养基接触至少2小时至最多96小时的时间段。
23.根据权利要求1至6中任一项所述的获能培养基的用途,其中所述哺乳动物卵丘卵母细胞复合体在非贴壁或贴壁培养板中与所述获能培养基接触;特别是用非贴壁培养板。
24.根据权利要求1至6中任一项所述的获能培养基的用途,所述用途用于使哺乳动物卵丘卵母细胞复合体中的卵母细胞维持在减数分裂阻滞状态。
25.根据权利要求1至6中任一项所述的获能培养基作为辅助生殖技术的一部分的用途。
26.根据权利要求25所述的获能培养基的用途,其中所述辅助生殖技术包括体外受精或icsi。
27.根据权利要求1至6中任一项所述的获能培养基在生育力保存方法中的用途,例如在癌症治疗的情况下或在卵母细胞储备入库的情况下(后者,特别是年龄储备者(35-40岁))。
28.根据权利要求27所述的用途,其中所述生育力保存方法包括来自小窦卵泡的低温保存。
29.根据权利要求28所述的用途,其中所述获能培养基用于所述低温保存的小窦卵泡的体外成熟。
30.根据权利要求1至6中任一项所述的获能培养基在癌症治疗的生育力保存中的用途。
31.根据权利要求1至6中任一项所述的获能培养基在卵母细胞储备入库的生育力保存中的用途。
32.根据权利要求19或20的试剂盒用于哺乳动物卵丘卵母细胞复合体的体外成熟的用途。
33.根据权利要求20所述的试剂盒的用途,其中所述未成熟的卵丘卵母细胞复合体与收集培养基接触最少30分钟至最多2小时。
34.根据权利要求19或20所述的试剂盒的用途,其中所述哺乳动物卵丘卵母细胞复合体与所述获能培养基接触至少2小时至最多96小时的时间段。
35.根据权利要求19或20所述的试剂盒的用途,其中所述哺乳动物卵丘卵母细胞复合体在非贴壁或贴壁培养板中与所述获能培养基接触;特别是用非贴壁培养板。
36.根据权利要求19或20的试剂盒的用途,所述用途用于使哺乳动物卵丘卵母细胞复合体中的卵母细胞维持在减数分裂阻滞状态。
37.根据权利要求19或20的试剂盒的用途,所述用途用于诱导哺乳动物卵丘卵母细胞复合体成熟。
38.根据权利要求19或20的试剂盒作为辅助生殖技术的一部分的用途。
39.根据权利要求38的试剂盒的用途,其中辅助生殖技术包括体外受精或icsi。
40.根据权利要求19或20所述的试剂盒作为生育力保存方法的一部分的用途;特别是在癌症治疗的情况下的生育力保存。
附图的简要说明
现在具体参考附图,要强调的是,所示出的细节是通过举例的方式并且仅用于说明性讨论本发明的不同实施方案的目的。提供它们是为了提供被认为是对本发明的原理和概念方面最有用和容易理解的描述。在这方面,没有试图去示出比基本上理解本发明所需的结构细节更详细的本发明的结构细节。就附图进行的描述是用来指导本领域技术人员实践中如何可以实施本发明的若干形式。
图1:cnp-22对减数分裂成熟进展的剂量依赖性影响
在0(对照)、1、10、100nmcnp-22(a)以及与4ng/mlegf组合(b)的存在下,使排卵前coc体外成熟18小时。成熟期后,评估卵母细胞核成熟。每个条表示从三个重复获得的实验数据的平均值±sd(至少33个卵母细胞/处理)。不同字母表示差异显著(p<0.05)。
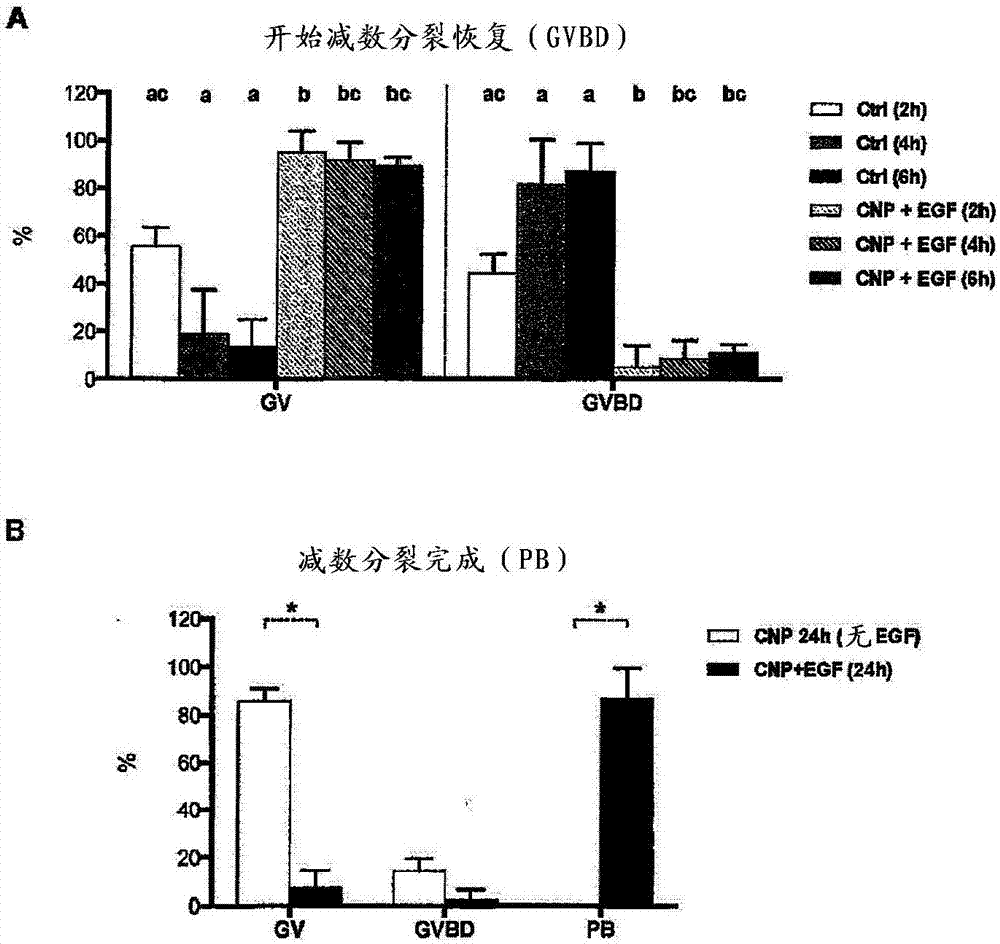
图2:cnp-22延缓egfr依赖性减数分裂重新启动
(a)在0(对照)或25nmcnp-22+4ng/mlegf的存在下,将排卵前coc置于培养物中,在收集后2、4和6小时评估早期减数分裂恢复。(b)在25nmcnp-22或25nmcnp-22+4ng/mlegf的存在下,将排卵前coc置于培养物中,24小时后评估减数分裂成熟(减数分裂完成直至pb排出)。每个条表示从三个重复获得的数据的平均值±sd(至少41个卵母细胞/处理)。不同字母或*表示显著性差异(p<0.05)。
图3:e2、fsh剂量和gdf9补充对卵母细胞减数分裂阻滞的影响
在25nmcnp-22单独存在或与10nme2一起存在下,将未成熟的coc置于培养物中。评估了在48小时培养期间单独加入2.5miu/ml或5miu/mlfsh或与50ng/mlgdf9组合对维持减数分裂阻滞的潜在影响。每个条表示从三个重复获得的实验数据的平均值±sd(至少38个卵母细胞/处理)。不同字母表示差异显著(p<0.05)。
图4:48小时培养期(预ivm)对gv卵母细胞染色质构型和直径的影响
在25nmcnp-22+10nme2的存在下,将未成熟的coc置于培养物中。评估了2.5miu/mlfsh或2.5miu/mlfsh+50ng/mlgdf9对卵母细胞的染色质构型(a)或卵母细胞直径(b)的潜在补充作用。如材料和方法所述评估染色质构型,并评分为nsn、nsn/sn(过渡)和nsn。此外,还在分离后、培养前(0h)立即评估卵母细胞直径。在(a)中,每个条代表从三个重复获得的实验数据的平均值±sd(至少46个卵母细胞/处理)。在(b)中,测量了至少31个gv卵母细胞/处理。不同字母表示差异显著(p<0.05)。
图5:在预ivm+ivm之后评估卵母细胞和胚胎质量
在48小时预ivm期和18小时ivm期之后,卵母细胞体外受精,胚胎培养至多5天。评估参数为2-细胞率(受精)(a)、第5天的胚泡形成(第5天胚泡/2-细胞)(b)。(a)和(b)中的每个条表示从四个重复获得的实验数据(至少64个卵母细胞/处理);结果显示为平均值±sd。
(c)显示两个参考对照的2-细胞率和第5天的胚泡率(第5天胚泡/2-细胞)。从20日龄小鼠的小窦卵泡获得未成熟的coc,并在100ng/mlereg[20do(ivm))的存在下体外成熟18小时。类似地,在48小时ecg激发(priming)接着14小时hcg之后,从25-27日龄小鼠获得金标准、体内生长的卵母细胞(对照)。这些对照的数据来自2个重复(至少56个卵母细胞/处理)(p<0.05)。
图6:cnp对体外培养的卵母细胞连接的影响
在pde3抑制剂或cnp存在下培养48小时后,小鼠coc中的跨区域凸出物(transzonalprojection,tzp)。左图是在存在pdp3抑制剂的情况下,右图是在存在cnp的情况下。围绕卵母细胞的透明带被描绘并用箭头指示。在pde3抑制剂的存在下,透明带是黑色的,表示几乎没有任何跨区域凸出物。超出预期的是,在cnp的存在下,透明带充满了跨区域凸出物,充分表明卵丘卵母细胞连接。
图7:体外培养的卵丘卵母细胞连接透明带中的肌动蛋白丝染色
暴露于cnp或pde3抑制剂的coc透明带上的平均像素强度。在(a)中,org9935用作pde3的抑制剂,肌动蛋白丝用结合德克萨斯红的鬼笔环肽证实;而在(b)中,环己喹酰胺用作pde3的抑制剂,肌动蛋白丝用actingreentm证实。(n=分析的coc数)。使用mannwhitney检验统计比较cnp和pde3i组,其中a图的p值为0.0082,而b图的p值<0.0001。
图8:在获能培养过程中cnp和pde3i的存在对卵丘封闭卵母细胞从早期窦卵泡小鼠发育能力的差异化作用
获能培养接着ivm之后受精率(a)和胚泡形成(b)。在两种情况下,包括来自两个参考对照的数据:1)无预先获能培养的ivm对照&2)标准体内对照(完全生长成熟的卵母细胞)。
图9:18小时后减数分裂恢复。cnp-22对减数分裂成熟进展的剂量依赖性影响。在cnp剂量范围为0.1nm至1μm的情况下培养排卵前coc。包括对照条件(不含cnp的基础培养基)。每个条表示从三次重复获得的实验数据的平均值±sd(平均为54个卵母细胞/处理)。星号表示相对于不含cnp的对照条件有显著性差异(p<0.01)。图a提供了具有完整生发泡(gv)的卵母细胞的百分比率(%),其中完整的gv的存在指示减数分裂阻滞。图b提供在生发泡破裂(gvbd)期卵母细胞的百分比,在减数分裂阻滞的情况下预期为低,并且图c提供排出第一极体(pb)的卵母细胞的百分比,再次在分裂阻滞的情况下预期为低。
图10:18小时后减数分裂恢复。cnp-53对减数分裂成熟进展的剂量依赖性影响。在cnp剂量范围为0.1nm至1μm的情况下培养排卵前coc。包括对照条件(不含cnp的基础培养基和含有25nmcnp-22的阳性对照)。每个条表示从三次重复获得的实验数据的平均值±sd(平均为54个卵母细胞/处理)。星号表示相对于不含cnp的对照条件有显著性差异(p<0.01)。图a提供具有完整生发泡(gv)的卵母细胞的百分比率。图b提供在生发泡破裂(gvbd)期卵母细胞的百分比。图c提供排出第一极体(pb)的卵母细胞的百分比。
图11:以每受精卵数(2pn)或每个初始coc数(coc)表示的优质胚胎(gqe)的成熟率、受精率和数量。黑条(n=374名患者):来自“常规ivf(icsi)领域的结果:反映欧洲当前的icsi实践。这些数据是从最常用的刺激疗法(gnrh拮抗剂+hp-hmg)获得的:来自公布的“megaset”数据的胚胎学数据:ferringpharmaceuticals的欧洲多中心多国研究,其中将所有胚胎培养至胚泡期。灰条(n=413名患者):当从非-hcg触发周期获得卵母细胞时,用常规ivm(origiokit)获得的结果。白条(n=15):对来自15名患者(其也给出用于获能培养的coc)的卵母细胞使用“新获能培养”步骤的结果。条纹白条(n=15名患者):这些结果来自15名患者的一部分卵母细胞的常规ivm(
图12:以每受精卵数(2pn)表示、每mii卵母细胞或每个初始coc数(coc)表达表示的第5天-第6天胚泡形成。黑条(n=374名患者)来自“常规ivf(icsi)领域的结果:反映欧洲当前的icsi实践。这些数据是从最常用的刺激疗法(gnrh拮抗剂+hp-hmg)获得的:来自公布的“megaset”数据的胚胎学数据:ferringpharmaceuticals的欧洲多中心多国研究,其中将所有胚胎培养至胚泡期。灰条(n=98名患者):是来自98名患者的亚组的结果,如果有4个或更多的良好第3天胚胎,其胚胎只能进一步培养至胚泡培养基。白条(n=15):对来自15名患者(其也给出用于获能培养的coc)的卵母细胞使用“新获能培养”步骤的结果。条纹白条(n=5名患者):是5名患者的亚组的结果,如果他们有4个或更多的“优质”第3天胚胎,那么胚胎才能进一步培养成胚泡培养基。注意:这是常规ivm最倾向的“偏见”。点状白条(n=7):来自“新获能培养”步骤的7名同胞患者的亚组的结果;在它们具有4个或更多“优质”第3天胚胎的情况下,胚胎仅在胚泡培养基中才考虑它们的发育。注意:进行这个亚组分析,以便对在常规ivm(条纹白条)中胚泡培养的策略进行理想的比较。
发明详述
本发明涉及用于哺乳动物辅助生殖技术的组合物和方法。具体地,本发明涉及用于哺乳动物卵丘卵母细胞复合体(coc)的体外成熟的组合物和方法。本发明基于以下发现:低剂量的cnp、雌二醇和fsh的组合成功地允许早期窦卵泡、特别是直径低于9mm的小的早期窦卵泡的体外成熟。
本文所用的术语“卵泡”是指卵巢卵泡,其是雌性生殖生物学的基本单位,并且由在卵巢中发现的细胞的大致球形聚集体组成。卵泡含有单个卵母细胞。卵泡定期开始生长和发育,最终排卵通常是单个感受态卵母细胞。卵巢卵泡的细胞是卵母细胞、颗粒细胞和内外膜(theca)层的细胞。
本文所用的术语“卵母细胞”包括单独的卵母细胞或者与一种或多种其它细胞关联的卵母细胞,例如作为卵母细胞复合物(coc)的一部分的卵母细胞。卵母细胞核被称为生发泡。
本文所用的术语“卵丘细胞”是指发育中的卵巢卵泡中的细胞,其直接靠近或非常接近卵母细胞。卵丘细胞参与提供卵母细胞在受精时产生可用胚胎所必需的一些营养、能量和/或其它要求。
本文所用的术语“卵丘卵母细胞复合体”是指彼此物理结合的至少一个卵母细胞和至少一个卵丘细胞。通常,卵母细胞被紧密堆积的卵丘细胞层包围,从而形成卵丘卵母细胞复合体。
本文所用的辅助生殖技术或art包括处理雌性配子(卵母细胞)和雄性配子(精子)的所有生育治疗(fertilitytreatment)。体外受精(ivf)是用于帮助不育夫妇妊娠的几种辅助生殖技术之一。ivf是指从雌性卵巢中取出卵母细胞并在实验室程序中与精子受精的过程。
在常规art中,促性腺激素用于刺激卵巢在体内产生许多具有成熟卵母细胞的大卵泡,而ivm主要旨在通过从来自未刺激或最小刺激的卵巢的小卵泡(直径<12mm)取出(retrieve)未成熟卵母细胞来避免卵巢刺激的副作用。然而,与常规art相比,ivm后,卵母细胞的内在发育能力降低。
卵母细胞的核成熟包括过程在前期i恢复减数分裂阻滞,并刺激减数分裂过程进行到中期ii(mii期),在该期通常发生受精。阻滞在前期i中的卵母细胞表现出所谓的生发泡(gv-期),其中核膜和核仁通过显微镜可见。当卵母细胞经历所谓的gv破裂(gvbd期),进入mii期并排出第一极体(pb)时,核成熟变得明显。细胞质成熟是指准备卵母细胞进行活化,形成原核的过程以及直到植入完成之前进行的发育路径。经历gv期卵母细胞核和细胞质成熟的能力通常以逐步方式获得。
卵母细胞体外成熟(ivm)是一种技术,其可以使得封闭在牢固凝聚的冠状卵丘细胞层中gv期卵母细胞(如coc)成熟。通过施用人绒毛膜促性腺激素(hcg)触发排卵之前或之后,可以通过超声引导针穿刺获得这些卵母细胞。卵母细胞ivm有可能简化生育治疗或降低与正常卵巢卵泡储备或高卵巢卵泡储备患者激素(hcg)刺激相关的风险和成本。这种卵泡储备通常通过测量抗苗勒激素(amh)水平和通过月经周期的第3天超声引导的卵泡计数来确定。
art和ivm的成功在很大程度上取决于受精前卵母细胞的成熟度。从放置在培养物中时,从窦性细胞卵泡收获的卵母细胞经历自发恢复减数分裂,即进行核成熟。这种核成熟可能常常发生在卵母细胞已经经历了完整的细胞质成熟之前。这被认为最终影响了受精的成功以及可能随后的胚胎发育和植入。因此,ivm的主要挑战是卵母细胞内核细胞和细胞质成熟过程的同步。延长的卵母细胞成熟期将促进未成熟卵母细胞与充分调节的卵丘细胞之间的更长的相互作用。此外,小卵泡的ivm似乎更具挑战性。从文献中已知小的人卵泡不能表达足够量的lh受体和/或egf和egf样因子的受体系统。因此,诱导成熟的egf样因子的主要级联不能被激活。
在本发明中,不经过在先hcg刺激或仅在hcg刺激后收集未成熟的哺乳动物coc。在优选的实施方案中,在coc收集之前没有发生hcg刺激。在甚至更优选的实施方案中,在体内收集coc之前必须避免任何触发剂,包括高剂量的fsh、lhrh、重组lh或lh类似物。
本发明基于以下发现:特定范围的“低”剂量的c型利尿钠肽(cnp)与雌二醇和fsh组合显著地改善了哺乳动物coc的ivm过程,特别是来自直径小于9mm的小早期窦卵泡的那些coc。从下文的实例中可以进一步看出,与应用pde3抑制剂使coc维持在减数分裂阻滞状态明显不同,cnp具有钟形剂量曲线。出乎意料的是,不仅非常低的剂量如0.1nm,而且非常高的剂量如1μm,均证明在将卵母细胞维持阻滞在gv期中不是最佳剂量。剂量曲线的这种差异意味着不同的内在机制,使cnp治疗不仅仅是延缓小的早期窦卵泡中减数分裂恢复的开始,如下文进一步详述。
因此,本发明的第一方面是提供用于哺乳动物coc的体外成熟的获能培养基。获能培养基包含0.1至50nmc型利尿钠肽(cnp)、雌二醇和fsh。在具体实施方案中,获能培养基包含1至1000nm雌二醇。在另一实施方案中,获能培养基包含0.1-10miu/ml的fsh。在又一方面,获能培养基包含等量剂量的重组fsh、fsh类似物或fsh模拟分子。在又一实施方案中,获能培养基包含0.1-10ng/ml胰岛素。在另一方面,获能培养基包括等量剂量的胰岛素类似物或胰岛素模拟分子。在又一实施方案中,获能培养基包含0.1至50nmcnp,优选10-50nmcnp,最优选10-25nmcnp,甚至更优选25nmcnp;1至1000nm雌二醇,最优选10nm雌二醇;0.1至10miu/mlfsh,最优选2.5或1miu/mlfsh;和0.1至10ng/ml胰岛素,最优选5ng/ml胰岛素。此外,在本发明的一些实施方案中,获能培养基包含卵母细胞分泌因子或卵母细胞分泌因子的组合。本文所用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合。在具体实施方案中,卵母细胞分泌因子是重组蛋白。在又一方面,卵母细胞分泌因子是异二聚体蛋白。在又一另外的实施方案中,获能培养基优选包含0.1至50nmcnp,优选10-50nmcnp,最优选10至25nmcnp,甚至更优选25nmcnp;1至1000nm雌二醇,甚至更优选10nm雌二醇;0.1至10miu/mlfsh,甚至更优选2.5或1miu/mlfsh;0.1至10ng/ml胰岛素,甚至更优选5ng/ml胰岛素;和选自gdf-9、bmp-15、fgf-8或其任何等同物或组合的卵母细胞分泌因子。
心房利尿钠肽(anp)、脑利尿钠肽(bnp)和c型利尿钠肽是利尿钠肽家族中研究最多的成员。cnp由利尿钠肽前体c(nppc)基因编码,其在不同的细胞类型中表达,其中前体nppc蛋白被切割成22个氨基酸的肽cnp。cnp激活其同源受体鸟苷酸环化酶b(gc-b),也称为利尿钠肽受体b(nprb),而anp和bnp刺激鸟苷酸环化酶a(gc-a),也称为利尿钠肽受体a(npra)。gc-a和gc-b是通过生产第二信使cgmp发出信号的膜锚定鸟苷酸环化酶。cnp以自分泌/旁分泌方式起作用以诱导血管松弛和血管重塑,并调节骨生长。
cnp长度为22个氨基酸残基(cnp-22),并且还描述了具有53个氨基酸残基的n-末端伸长形式(cnp-53)。anp、bnp和cnp以通过分子内二硫键形成的17-残基环结构高度同源。nppc基因的遗传序列可以在genbank、基因座nm_024409获得。anp和bnp主要作为主要由心房和心室产生的心脏激素。cnp被认为主要在脑中表达。然而,其他研究表明由培养的内皮细胞和体内血管产生cnp,通过各种细胞因子和生长因子增加cnp的产生。研究报道了nppc和nprb的卵巢表达及其由促性腺激素调节。最近的研究表明nppcmrna在颗粒细胞中的表达以及cnp刺激卵丘细胞cgmp产生的能力。cgmp然后通过间隙连接从卵丘细胞扩散到卵母细胞,并防止3型磷酸二酯酶(pde3)依赖性camp降解,因此维持卵母细胞减数分裂阻滞。
从以下实例将会变得明显,低剂量的cnp与雌二醇和fsh的组合对于延长cnp诱导的减数分裂阻滞是至关重要的。cnp在coc中有效地维持减数分裂阻滞至少24小时,但仅cnp不足以维持减数分裂阻滞48小时。因此,单独的cnp不允许小的早期窦卵泡的ivm,长期体外培养期对于成功成熟是至关重要的。然而,低剂量的cnp与雌二醇的组合允许coc长期维持减数分裂阻滞,但是ivf后卵母细胞的最终胚胎质量不足。此外,除了cnp和雌二醇之外,向获能培养基补充fsh也能使coc长期维持在减数分裂阻滞状态。另外,补充fsh改善减数分裂恢复,增加卵母细胞直径,并提高ivf过程后的胚胎质量。
fsh是由垂体前叶促性腺激素细胞合成和分泌的一种激素。fsh调节人体的发育、生长、青春期成熟和生殖过程。fsh和促黄体激素(lh)在生殖中协同作用。在卵巢中,fsh刺激未成熟卵泡生长成熟。随着卵泡生长,它释放阻断fsh生产的抑制素。fsh是二聚糖蛋白。lh、fsh、tsh和hcg的α亚单位是相同的,并含有92个氨基酸。fsh具有118个氨基酸的β亚单位,其赋予其特异性生物学作用并且负责与fsh受体的相互作用。
对于临床使用,可以使用各种制剂。它通常用于不孕症治疗以刺激卵泡发育。fsh可以例如pergonal或menopur(其是尿纯化的促性腺激素)以及作为重组fsh(例如gonalf、puregon)的纯形式并且作为例如gonal-f、gonal-frff、gonal-frffpen与lh或hcg。fsh的类似物也是临床有用的,并且包括所有生物活性突变体形式(例如其中一个、两个、三个或更多氨基酸从天然形式改变),聚乙二醇化fsh,单链双功能突变体,fsh-ctp等。还开发了长效fsh疗法,包括fsh-ctp(corifollitropinalfa,其中fsh的β亚单位通过hcg的c末端肽(ctp)部分连接)如elonva。
胰岛素是在调节体内碳水化合物和脂肪代谢中发挥重要作用的激素。在靶细胞中,胰岛素通过激活具有酪氨酸激酶活性的膜受体起始信号转导。该信号转导导致葡萄糖摄取和储存增加。同样在卵母细胞中,胰岛素信号传导级联是有活性的。胰岛素与fsh协同促进颗粒细胞分化和功能。对于临床用途,重组胰岛素也是可用的。胰岛素作为人工血清替代品(syntheticserumreplacement,ssr)的一部分用于诊所中。ssr是广泛用于胚胎培养的不同培养基的培养基成分。
卵母细胞分泌因子是卵母细胞分泌的旁分泌因子,是正常粒细胞和膜细胞功能所必需的。本文所用的术语“卵母细胞分泌因子”应被理解为是指由卵母细胞分泌的作用于颗粒细胞以调节颗粒细胞中的关键功能如增殖、分化、葡萄糖代谢和胆固醇生物合成的因子。卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何等同物。gdf-9是转化生长因子β超家族的成员。卵母细胞的gdf-9表达从初级卵泡期开始,并通过排卵持续。本文所用的“gdf-9”是指gdf-9蛋白、其单个亚单位、其单个亚单位的多聚体、gdf-9的功能片段或部分、gdf-9的功能等同物和/或类似物。本文所定义的“gdf-9”的功能等同物或片段包括经修饰的gdf-9蛋白,使得所得gdf-9产物具有类似于gdf-9的活性。
bmp-15是转化生长因子β(tgf-β)超家族的成员。它被作为前原肽(prepropeptide)合成、切割,然后加工成二聚体蛋白质。bmp-15可形成同二聚体,也可与gdf-9形成异二聚体。本文所用的“bmp-15”是指bmp-15蛋白、其单个亚单位、其单个亚单位的多聚体、bmp-15的功能片段或部分、以及bmp-15的功能等同物和/或类似物。本文所定义的“bmp-15”的功能等同物或片段包括经修饰的bmp-15蛋白,使得所得bmp-15产物具有类似于bmp-15的活性。
fgf-8是成纤维细胞生长因子(fgf)家族的成员。在成人卵巢中,fgf-8在卵母细胞中表达,并且在颗粒细胞中报道了fgf受体的表达。在卵母细胞成熟期间,fgf-8与其他卵母细胞分泌因子一起促进卵丘细胞中的糖酵解。本文所用的“fgf-8”是指fgf-8蛋白、其单个亚单位、其单个亚单位的多聚体、fgf-8的功能片段或部分、以及fgf-8的功能等同物和/或类似物。本文所定义的“fgf-8”的功能等同物或片段包括经修饰的fgf-8蛋白,使得所得fgf-8产物具有类似于fgf-8的活性。
在另一实施方案中,获能培养基包含与选自gdf-9、bmp-15、fgf-8的卵母细胞分泌因子或组合的卵母细胞分泌因子组合的cnp、雌二醇和fsh或其任何组合。如下文所述的实施例所证明的,生长因子和激素的这种组合显著改善了来自小窦卵泡的卵母细胞的发育能力和最终胚胎质量。特别地,将gdf-9添加到获能培养基中促进了卵母细胞染色质构型重塑进入凝聚期、卵母细胞直径和卵母细胞以及胚胎质量。
本发明的另一方面是如上文所述的用于未成熟哺乳动物coc的体外成熟的获能培养基的用途。所述用途包括使哺乳动物coc与获能培养基接触最少2小时至最多96小时的时间段。特别地,coc与获能培养基接触足以达到晚期发育的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。在另一具体实施方案中,哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间段。
在未成熟的哺乳动物coc中使用包含cnp、雌二醇和fsh的获能培养基诱导减数分裂阻滞。本发明典型地,并且从下文的实施例可以看出,使用包含cnp、雌二醇和fsh的获能培养基可使卵母细胞能够进行最多96小时的延长的“获能”培养。结果,这种延长的减数分裂阻滞期允许来自小卵泡的卵母细胞存活、生长并进入进一步的晚期发育阶段,目的是获得更高的生殖能力。到目前为止,这些小卵泡的体外成熟一直是具有挑战性的,因为卵母细胞在减数分裂阻滞下能够存活的培养条件和时间太短而不能获得充分的核和发育能力。如实施例中进一步所示,在没有cnp的情况下,自发地恢复减数分裂的卵泡卵母细胞最少。相比之下,当用1nm、10nm、25nm或50nmcnp处理时,几乎100%的卵母细胞可以维持在减数分裂阻滞状态。
本发明的获能培养基不仅可以延长卵母细胞的培养,而且cnp的存在同样维持卵丘-卵母细胞连接,对卵母细胞的发育能力有显著的改善,特别是当与本发明使用的pde3抑制剂使coc维持在减数分裂阻滞状态时相比较。
在使用如本文所述的获能培养基之后,卵母细胞将能够达到晚期发育阶段。通过用hoechst染色并在荧光显微镜下分析,在gv卵母细胞中评价卵母细胞的染色质构型。根据核仁周围染色质聚集的模式,染色质构型分为非包围核仁(nsn)、包围核仁(sn)或过渡(nsn/sn)期。还记录在用hoechst染色之前卵母细胞的直径。此外,在获能期后,可以诱导并通过在倒置显微镜下评估核成熟期来分析减数分裂能力。卵母细胞的核成熟评分为gv(生发泡)期、gvbd(生发泡破裂)期和mii(中期)-或pb(极体)。随着卵母细胞生长,它们获得重新开始减数分裂的能力,这一过程也称为减数分裂恢复。在该期,卵母细胞经历生发泡膜的破裂和染色体彼此分开。
在本发明中,coc与获能培养基接触足以达到晚期发育阶段的时间,例如通过将卵母细胞的染色质重组进入凝聚期或sn构型来证明。此外,哺乳动物coc与获能培养基接触一段由卵泡大小决定的时间段。卵泡大小在coc取出时、例如通过超声成像确定。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。
在另一实施方案中,使用获能培养基是辅助生殖技术、特别是体外受精和icsi的一部分。
本发明还提供了用于未成熟哺乳动物coc的体外成熟方法。在所述方法中,将未成熟的coc收集在收集培养基中并与收集培养基接触最少30分钟至最多2小时。同样在所述方法中,并且在与收集培养基接触之后,哺乳动物coc与如上所述的获能培养基接触以维持减数分裂阻滞并促进卵丘-卵母细胞相互作用。最后,使哺乳动物coc与成熟培养基进一步接触以使卵母细胞减数分裂成熟。
在具体实施方案中,在根据本发明的方法中,将未成熟的coc与收集培养基接触最少30分钟至最多2小时。
所述收集培养基包含抑制天然存在的磷酸二酯酶的天然或人造药物化合物,或包含通常称为减数分裂阻滞剂(arrester)的卵母细胞减数分裂恢复天然抑制剂。所述天然抑制剂可以选自cnp、次黄嘌呤或其类似物。使用这种收集培养基允许从非常小的窦卵泡取出coc,而不必在发情或月经周期的任何时刻强制需要卵巢刺激。在收集培养基中存在减数分裂阻滞剂的目的是阻止camp从收集的coc中的减少,特别是防止在具有这种能力的那些中重新开始减数分裂,即那些核成熟-并且保持卵母细胞和卵丘之间的互连条件“正确”。所述收集培养基在coc收集期间使用,作为穿刺coc从穿刺针转移入的培养基。在该收集培养基中,新鲜分离的coc优选保持最少30分钟至最多2小时。该收集培养基的主要目的是使coc在与卵泡液和其它污染细胞分开的同时保持最佳的功能状态。coc作为分开的实体被分离以被转移到“获能培养基”。
在根据本发明的体外方法的另一实施方案中,使哺乳动物coc与如上所述的获能培养基接触。在所述方法中,使哺乳动物coc与包含cnp、雌二醇和fsh的获能培养基接触最少2小时至最多96小时的时间段。特别地,在体外成熟方法中,使coc与获能培养基接触足以达到晚期发育阶段的时间,例如通过将卵母细胞的染色质重组进入凝聚期或所谓的包围核仁(sn)构型所证明的。更特别地,在体外成熟方法中,通过在倒置显微镜下评估核成熟期来分析减数分裂重新开始。卵母细胞的核成熟被评分为gv(生发泡)期、gvbd(生发泡破裂)期和mii(中期)期或pb(极体)期。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。如本文已经描述的,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。
在具体实施方案中,使哺乳动物coc与非贴壁或贴壁培养板中的获能培养基接触。从以下实施例将会变得明显,低剂量的cnp与雌二醇和fsh的组合对于延长cnp介导的减数分裂阻滞是至关重要的。cnp在coc中有效地维持减数分裂阻滞至少24小时,但单独的cnp不足以维持减数分裂阻滞48小时。然而,低剂量的cnp与雌二醇的组合允许coc长期维持减数分裂阻滞,但是ivf后卵母细胞的最终胚胎质量不是足够高。除了cnp和雌二醇之外,向获能培养基补充fsh也使coc长期维持在减数分裂阻滞状态,但也增加了卵母细胞直径,并提高了ivf过程后的胚胎质量。
在另一实施方案中,在根据本发明的体外方法中,将卵母细胞分泌因子如gdf-9、bmp-15、fgf-8或其任何组合加入到包含cnp、雌二醇和fsh的获能培养基。类似于fsh,这些卵母细胞分泌因子改善了小窦卵泡卵母细胞的发育能力及其最终的胚胎质量。
如前所述,在本发明的体外方法中,使coc进一步与成熟培养基接触。在该期并给予使用根据本发明的获能培养基的情况下,可以在补充有精选的生长因子的具有任意基础组成的成熟培养基中成熟获能的卵丘封闭的gv期卵母细胞。这些生长因子选自但不限于egf样因子,例如双调蛋白或上皮调节蛋白、fsh、lh、camp调节剂或其组合。因此,在另一实施方案中,本发明的体外成熟方法包括使coc与本文所述的获能培养基接触,并使coc与成熟培养基接触,其特征在于成熟培养基由补充如本文所述精选的生长因子。
本发明的另一个目的是提供一种用于未成熟哺乳动物coc的体外成熟的试剂盒。所述试剂盒包含如本文所述的获能培养基,其包含0.1-50nmcnp、雌二醇和fsh。在具体实施方案中,根据本发明的试剂盒包括包含1至1000nm雌二醇的获能培养基。在另一实施方案中,试剂盒包含0.1至10miu/mlfsh。在又一方面,获能培养基包括等量剂量的重组fsh、fsh类似物或fsh模拟分子。在又一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至10ng/ml胰岛素。在另一方面,获能培养基包括等量剂量的胰岛素类似物或胰岛素模拟分子。在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含0.1至50nmcnp,优选10至25nmcnp,甚至更优选25nmcnp;1至1000nm雌二醇,优选10nm雌二醇;0.1至10miu/mlfsh,优选2.5或1miu/mlfsh;和0.1至10ng/ml胰岛素。
在另一实施方案中,在根据本发明的试剂盒中,获能培养基包含卵母细胞分泌因子。本文使用的卵母细胞分泌因子选自gdf-9、bmp-15、fgf-8或其任何组合。在具体实施方案中,本文使用的卵母细胞分泌因子是重组蛋白或异二聚体蛋白。在另一实施方案中,用于未成熟哺乳动物coc的体外成熟的试剂盒包含(a)收集培养基,其包含抑制天然存在的磷酸二酯酶的天然或人造化学化合物或卵母细胞减数分裂的天然抑制剂,(b)如上所述的获能培养基,(c)成熟培养基,(d)贴壁和非贴壁培养板,和(e)使用该试剂盒的说明。如本文所述,试剂盒可用于执行本文所述的方法以及包含在试剂盒中的用于实施方法的说明。
本发明的另一方面公开了如上所述的用于哺乳动物coc的体外成熟的试剂盒的用途。在具体实施方案中,公开了如上所述包含获能培养基的试剂盒的用途。该用途包括使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。更特别地,在包含获能培养基的试剂盒的用途中,使哺乳动物coc与获能培养基接触以维持减数分裂阻滞并允许核和细胞质成熟。特别地,使coc与获能培养基接触足以达到晚期发育的时间,例如通过染色质重塑成包围核仁(sn)所证明的。在另一具体实施方案中,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。如本文已经描述的,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。
获能期使得卵母细胞能够获得恢复减数分裂的能力,这仅在减数分裂刺激被触发(例如与成熟培养基接触)之后评估。在倒置显微镜下进行卵母细胞核成熟的评估,并且由生发泡破裂(gvbd)和第一极体(pb)的进一步排出而证明。
在另一实施方案中,公开了包含以下内容的试剂盒的用途:(a)收集培养基,其包含抑制天然存在的磷酸二酯酶的天然或人造化学化合物或卵母细胞减数分裂的天然抑制剂,(b)如上所述的获能培养基,(c)成熟培养基,(d)贴壁和/或非贴壁培养板,以及(e)使用试剂盒的说明。典型的是,用于未成熟哺乳动物coc的体外成熟的试剂盒的用途包括使coc与收集培养基接触至少30分钟至最多2小时。在另一方面,在根据本发明的试剂盒的用途中,使哺乳动物coc与获能培养基接触至少2小时至最多96小时的时间段。更特别地,在包含收集培养基、获能培养、成熟培养基、贴壁和/或非贴壁培养板和使用说明的试剂盒的用途中,使哺乳动物coc与获能培养基接触以维持减数分裂阻滞并允许成熟。特别地,使coc与获能培养基接触足以达到gvbd期并重新开始减数分裂的时间,从而达到晚期发育阶段,例如通过包围核仁(sn)所证明的。此外,使哺乳动物coc与获能培养基接触一段由卵泡大小确定的时间。如本文已经描述的,在coc取出时确定卵泡大小,例如通过超声成像。直径为1至5mm的卵泡优选在获能培养基中保持至少48h。直径>5至10mm的卵泡优选在获能培养基中保持至少24小时,并且直径大于10mm的卵泡优选在获能培养基中保持至少2小时。
获能期使卵母细胞能够获得恢复减数分裂的能力,这仅在减数分裂刺激被触发(例如与成熟培养基接触)之后评估。在倒置显微镜下进行卵母细胞核成熟的评估,并且由生发泡破裂(gvbd)和第一极体(pb)的进一步排出而证明。
在本发明的不同实施方案中,哺乳动物coc是人类coc。
本发明的其它方面是本领域众所周知的。例如,从受试者获得卵母细胞的方法,用于操作卵母细胞的工具和设备,低温保存方法,ivf方法,体外胚胎培养以及将胚胎置于患者生殖道中的方法是本领域众所周知的,并且本领域已知的任意此类合适的方法可以与本发明的方法和组合物结合使用。
可以通过以下非限制性实施例进一步说明本发明。
实施例
实施例1
材料和方法
动物模型
用于本研究的动物是cbab6f1(c57bl/6jxcba/ca的f1杂交种)。这些动物遵循国家法规进行圈养和饲喂并得到了布鲁塞尔自由大学(vrijeuniversiteitbrussel)伦理委员会的同意(项目编号:09-216-1)。
来自小窦卵泡的未成熟卵丘卵母细胞复合体(coc)的收集和来自大窦卵泡的排卵前coc
为了收集未成熟的coc,在没有预先的促性腺激素给药的情况下,从青春期前小鼠(19-21日龄)的小窦卵泡收集第一波卵泡发育波的致密的coc。为了收集排卵前的coc(对照),在用2.5iu马绒毛膜促性腺激素(ecg,folligon,intervet,oss,thenetherlands)激发48小时后,通过穿刺青春期前雌性小鼠(25-27日龄)的大窦卵泡收集致密的coc。收集培养基由leibovitzl-15组成,含有10%热灭活的胎牛血清(fbs)、100iu/ml青霉素、100μg/ml链霉素(均来自lifetechnologies,gent,belgium)并补充200μm3-异丁基-1-甲基黄嘌呤(ibmx;sigma,schnelldorf,germany),以在收集和预培养处理期间防止减数分裂重新启动。
coc培养
用于培养coc(预ivm和ivm期)的基础培养基由α-mem、2.5%fbs(二者均来自lifetechnologies,gent,belgium)和5ng/ml胰岛素、5ug/mlapo-转铁蛋白、5ng/ml亚硒酸钠(均来自sigma,schnelldorf,germany)。
对于预ivm实验,cnp-22得自phoenixeurope(karlsruhe,germany),17-β-雌二醇得自sigma(schnelldorf,germany)并且生长和分化因子9(gdf9)得自r&dsystemseurope(oxon,unitedkingdom)。
对于涉及ivm的实验,使用重组表皮生长因子(r-egf)(roche;mannheim,germany)和重组小鼠上皮调节蛋白(ereg)(r&dsystemseurope;oxon,unitedkingdom)作为排卵刺激物,并且培养持续18小时。
其中所提及的将重组卵泡刺激素(fsh)(merck-serono,geneva,switzerland)加入到预ivm和ivm培养基中。
评估减数分裂重新启动
在规定的时间点,通过使用细孔玻璃移液管控制的口从致密或扩展的卵丘细胞中机械游离卵母细胞。通过在装备有hoffman调制对比度系统(nikon,tokyo,japan)的倒置显微镜下评估核成熟期分析减数分裂重新启动。核成熟评分为gv(生发泡期)、gvbd(当gv不可见时)、pb(在卵周隙中观察到的第一极体)或deg(当卵母细胞退化时)。
评估卵母细胞的染色质构型
在预ivm培养前后,在生发泡卵母细胞中评价卵母细胞的染色质构型。简而言之,在评估减数分裂重新启动后,将gv卵母细胞用10μg/mlhoechst33258(sigma;schnelldorf,germany)染色5分钟。在荧光显微镜(ix70;olympus)下分析核仁染色质构型。根据核仁周围染色质聚集的模式,染色质构型分为非包围核仁(nsn)、包围核仁(sn)或过渡(nsn/sn)期[27-29]。在用hoechst染色之前记录这些卵母细胞中一些卵母细胞的直径。
体外受精程序(ivf)
在评估卵母细胞发育能力的最终测试中,在预ivm+ivm培养期后,进行体外受精(ivf),然后进行胚胎培养至胚泡期。对于该实验,使用100ng/mlereg作为减数分裂恢复的触发剂。
用于ivf的培养基由m16培养基、3%牛血清白蛋白级分v(bsa)(二者均来自sigma,schnelldorf,germany)和非必需氨基酸(lifetechnologies,gent,belgium)组成。胚胎培养基由m16培养基和必需和非必需氨基酸(lifetechnologies,gent,belgium)组成。
从不同条件收集卵丘卵母细胞复合体,并在ivf培养基中洗涤一次。使用获自雄性cbab6f1的获能精子(2×106个精子/ml的最终稀释度)在ivf培养基中进行体外受精。在37℃、5%co2、5%o2和100%湿度下共孵育3.5小时后,推测的合子被剥离,洗涤两次,并在20μl铺了油的胚胎培养基中的10-15个受精卵组中在37℃、5%co2、5%o2和100%湿度下培养以进行胚胎培养(irvinescientific,alere;sintdenijswestrem,belgium)。ivf后24小时对分裂(2-细胞)率进行评分。在第5天,记录胚泡发育和孵化。
还评估了20日龄小鼠的小窦卵泡未成熟的coc的能力,其经历了用100ng/mlereg的18小时ivm。
从用2.5iu的马绒毛膜促性腺激素(ecg,
统计分析
除非另有说明,否则结果显示为平均值±sd。在不同体外条件下ivf后卵母细胞减数分裂恢复率(每个减数分裂期)、染色质构型和胚胎发育的差异通过anova之后通过tukey多重比较检验进行评估,p<0.05。当比较2个条件时,使用非配对t检验比较减数分裂恢复率。在进行统计分析之前,转换(反正弦)成百分比数据。
结果
cnp有效维持减数分裂阻滞并延缓egfr依赖性减数分裂恢复
在存在0(对照)、1、10、100nmcnp-22并结合4ng/mlegf的情况下,将从促性腺激素激发的小鼠(26-27日龄)取出的排卵前coc置于培养中18小时。
cnp-22对减数分裂阻滞的维持具有剂量依赖性作用。在100和10nm的剂量下,培养结束时的gv率显著高于1nm和对照(96%、93%、48%和0%)(图1a)
在egf存在下,观察到cnp-22对pb率的剂量依赖性作用。在10和100nmcnp-22的剂量下,许多卵母细胞保持在gvbd期,因此与对照组和1nmcnp-22(分别为98%和92%)相比,pb率保持显著更低(分别为35%和15%)(图1b)。由于用10和100nmcnp处理观察到的gvbd卵母细胞的比例更高,进行了追踪实验,以探索减数分裂恢复过程更慢的可能性。
将从促性腺激素激发的小鼠取出的排卵前coc在不存在(对照)或存在25nmcnp-22+4ng/mlegf的情况下置于培养中,并在2、4和6小时评估减数分裂成熟。在对照组中减数分裂恢复增加了2至6小时,但在相同时间段内,cnp-22+egf处理组诱导的gvbd较少(≤11%)(图2a)。此外,置于cnp-22+egf培养基中24小时的coc具有高发生的pb卵母细胞(93%),这个数字比仅就cnp-22培养相同时间段的coc明显更高(图2b)。
总而言之,这些数据表明,cnp-22能够维持减数分裂阻滞至少24小时,egfr信号传导能够诱导由cnp保持减数分裂阻滞的coc的减数分裂恢复,但速度较慢(vs对照6小时延缓)。
延长cnp诱导的未成熟的coc的减数分裂阻滞依赖于培养环境中雌二醇的存在
与上述研究类似;进行了未成熟的coc的重复研究(高减数分裂/发育不足)。从小窦卵泡取出这样的coc(如材料和方法中所述)并置于培养中48小时。结果表明,cnp-22可以维持减数分裂阻滞24小时但不能维持48小时(数据未显示),因此设计了一种通过补充有e2、fsh和gdf9的培养基对cnp-22的反应性的研究。
从19-20日龄的雌性小鼠的小窦卵泡中取出未成熟的coc,并在存在25nmcnp-22和存在或不存在10nm17-β-雌二醇的情况下置于培养中48小时;另外评估进一步加入2.5或5miu/mlfsh和/或50ng/mlgdf9的效果。
在25nmcnp(单独)存在下培养的coc的卵母细胞主要不能维持减数分裂阻滞,因此在培养48小时后,gv率仅占coc总数的26%。相比之下,在25nmcnp-22加10nm17-β-雌二醇(e2)的存在下培养的coc的大多数卵母细胞有效维持在gv期(≥89%;图3)中,而不管用fsh或gdf9补充。
fsh和gdf9补充对卵母细胞染色质凝聚状态、卵母细胞直径和coc对egfr排卵信号传导的反应性的影响
在25nmcnp-22和10nm17-β-雌二醇的存在下,从雌性小鼠(19-20日龄)的小窦卵泡取出未成熟的coc,并置于培养中48小时(预ivm条件)并加入2.5miu/mlfsh或2.5miu/mlfsh+50ng/mlgdf9。这些预处理之后是含有egf的培养基的18小时的排卵刺激(ivm条件)。
预ivm处理前后卵母细胞的染色质凝聚分析显示培养48小时期间,卵母细胞的染色质从主要的非包围核仁(nsn)分散构型转变成包围核仁(sn)凝聚构型。事实上,在预ivm之前,34%的卵母细胞具有过渡nsn/sn构型(66%nsn),而在预ivm前,≥68%的卵母细胞在每种条件下显示sn模式(图4a)。在2.5miu/mlfsh+50ng/mlgdf9存在下培养的卵母细胞中观察到sn模式无统计学意义但绝对数量较高(86%)。
此外,在含有fsh的培养基(w/ogdf9)中预ivm培养之后获得的卵母细胞的平均直径比在没有fsh的培养基中培养的卵母细胞显著更大。因此,紧接从卵泡分离后(预ivm前),卵母细胞直径为71.9±2.1μm,而培养48小时后,卵母细胞直径如下:cnp+e2、cnp+e2+fsh和cnp+e2+fsh+gdf9分别为72.1±1.7μm;73.5±1.7μm和73.3±1.4μm(图4b)。
在预ivm之后,用egf刺激一些coc减数分裂恢复,18小时后评估其pb率。由于在ivm培养基中在cnp存在下延缓减数分裂重新启动(见前面的实验:cnp有效维持减数分裂阻滞并延缓egfr依赖性减数分裂恢复);出于实际原因,在该实验中,从ivm培养基中省略了cnp。来自3个培养条件的卵母细胞表现出较高的减数分裂恢复率:cnp+e2、cnp+e2+fsh和cnp+e2+fsh+gdf9的pb率分别为79%、78%和82%。
在cnp、fsh和gdf9存在下预ivm改善卵母细胞和胚胎质量
研究了经历预ivm接着ivm培养期的卵母细胞的发育能力。卵母细胞进行体外受精,并且胚胎培养直至第5天。
对于该实验,在ivm期期间使用ereg作为减数分裂触发剂,并且仅将cnp和gdf9添加到预ivm培养基中并从ivm培养基中省略。
在预ivm和ivm培养期之后,来自所有处理的卵丘细胞表现出响应于ereg的大量扩展和粘液化。
不同处理方式2-细胞(受精)率没有差异(cnp+e2、cnp+e2+fsh和cnp+e2+fsh+gdf9分别为60%、54%和56%)。与cnp+e2条件相比,在含有fsh或fsh+gdf9的培养基中培养的卵母细胞的第5天胚泡/2-细胞的比率较高;后者显著(图5)。
作为参考,1)经历ivm(没有预ivm培养)的未成熟的coc和2)用ecg接着hcg卵巢过度刺激之后体内生长的卵母细胞的能力显示在图5c中。
实施例2
上述实验表明,根据本发明的获能培养基的用途不仅使卵母细胞维持在减数分裂阻滞下,而且是在不影响这些coc进行ivm的能力的情况下这样做的。然而,cnp的作用不能仅仅视为经作用于磷酸二酯酶(pde,负责减数分裂恢复期间卵母细胞内camp降解的酶)而具有该作用;因为获能培养期间卵母细胞发育能力大大提高。因此,假设在“低”剂量下,通过保持卵母细胞和卵丘细胞之间良好的通讯,cnp(特别是浓度范围为1nm至50nmcnp)具有进一步的(另外的)改善卵母细胞发育能力的作用。
在存在camp调节剂(特别是在使用pde3抑制剂的预成熟培养中)的情况下,在培养coc时,已经清楚地报道了长期培养中卵丘-冠和卵母细胞之间断开的问题是pde抑制剂方法的局限性(nogueiraetal.,2003,nogueiraetal.,2006,vanhoutteetal.,2009a)。
为了证明包含cnp的获能培养基实际上维持卵母细胞连接,将来自cbab6f1小鼠早期窦卵泡的卵母细胞复合物(coc)(同上)置于用于培养coc的基础培养基中并暴露于cnp和作为比较物的两种众所周知的磷酸二酯酶抑制剂pde3-i(org9935和环己喹酰胺)。
材料和方法
动物模型
用于本研究的动物是cbab6f1(c57bl/6jxcba/ca的f1杂交种)。这些动物遵循国家法规进行圈养和饲喂并得到了布鲁塞尔自由大学(vrijeuniversiteitbrussel)伦理委员会的同意(项目编号:14-216-1)。
coc培养
用于培养coc(预ivm和ivm期)的基础培养基由α-mem、2.5%fbs(二者均来自lifetechnologies,gent,belgium)和5ng/ml胰岛素、5ug/mlapo-转铁蛋白、5ng/ml亚硒酸钠(均来自sigma,schnelldorf,germany)。获能培养基由补充有与10nme217-β-雌二醇组合的25nmcnp或1μmorg9935或1μm环己喹酰胺的基础培养基组成。cnp获自phoenixeurope(karlsruhe,germany),而环己喹酰胺获自enzolifesciences(antwerpen,belgium)。由于实验的目的是为了明白cnp和pde3抑制剂之间存在的潜在差异,避免fsh的潜在干扰是至关重要的,因此后者从获能培养基中省略。在fsh存在的情况下进行测试时,后者掩盖了cnp对卵母细胞和周围卵丘细胞层之间连接的影响,其自身对所述连接有贡献,甚至在存在pde3抑制剂时也是明显的(数据未示出)。
染色和图像分析
通过用德克萨斯红-鬼笔环肽或actingreentm荧光标记f-肌动蛋白,证明了跨区域凸出物(tzp,与卵母细胞连接的颗粒细胞的膜性延伸),并且显示为穿过透明带的细丝(箭头)。
结果
虽然三种化合物能够维持卵母细胞减数分裂阻滞,但是出乎意料地显示cnp是能够保持卵母细胞和周围卵丘细胞层之间双向通讯所必需的跨区域凸出物的因子(图6和图7)。在图7中,使用平均像素强度作为量化穿过透明带的阳性肌动蛋白染色(tzp)的工具。使用imagej进行图像分析,并且包括计算在卵母细胞和卵丘细胞之间概括的感兴趣区域(roi)上的平均像素强度,透明带位于该区域。根据图像分析,观察到暴露于cnp的coc通过跨区域凸出物(tzp)保持更好的卵母细胞和卵丘细胞之间的连通性。在图7(a)中,使用org9935作为pde3的抑制剂,用结合德克萨斯-红的鬼笔环肽证实肌动蛋白丝;而在图7(b)中,使用环己喹酰胺作为pde3的抑制剂,用actingreentm证实肌动蛋白丝。使用mannwhitney检验统计比较cnp和pde3i组,其中图a的p值为0.0082,图b的p值<0.0001。
实施例3
如果上述结果表明cnp增强了coc中卵母细胞和卵丘细胞之间的连通性,以下结果旨在确定这是否会对早期窦卵泡培养的此类coc的发育能力产生影响。在本研究中,评估了在获能培养过程中cnp和pde3i对来自早期窦卵泡的小鼠卵丘封闭卵母细胞发育能力的差异作用。由于实验的目的是为了明白cnp和pde3抑制剂之间存在的潜在差异,避免fsh的潜在干扰是至关重要的;因此,在该实验中,后者从获能培养基中省略。
设置:
类似于实施例2;从早期窦卵泡(未刺激的19-20日龄小鼠)分离未成熟的卵丘卵母细胞复合体。在cnp或环己喹酰胺(pde3抑制剂)存在下,使coc置于基础培养基中48小时。
包括两个参考对照:
1)对照条件,其在ivm之前不进行获能培养,
2)标准体内对照,来自26-27日龄小鼠的完全生长成熟的卵母细胞。这些coc通过给予23-24日龄的小鼠48小时pmsg接着hcg获得(ivf操作方案)。
在获能培养之后,coc在表皮生长因子(egf)和体外受精的存在下成熟。评估受精后胚胎发育。
通过其成熟、受精(2-细胞率)和生产优质胚泡(通过第5天胚胎培养)的能力来评估在每种条件下卵母细胞能力的获取。
统计分析
通过卡方检验评估cnp和环己喹酰胺组之间的受精率和胚泡形成率差异。
结果
虽然在两种处理的受精率上没有观察到差异(参见图8(a)),但在cnp存在下获能培养后,每个受精卵形成的胚泡数量显著更高(见图8(b))。
实施例2和3的结论
观察到这两项比较pde抑制剂和cnp的补充(complimentary)研究中关于卵母细胞和胚胎质量的出乎意料差异可归因于cnp。这些结果表明,cnp具有超过那些经3型磷酸二酯酶调节介导的作用。除了抑制pde3的作用外,cnp增加了卵母细胞和卵丘细胞之间的物理连通性,从而增强了完成卵母细胞最终发育(细胞质成熟)所必需的因子的获取。
实施例4
在实施例1中,已证实cnp-22对减数分裂阻滞的维持具有剂量依赖性作用。在以下研究中,进行了包括更广泛的cnp范围的额外实验。
设置:
在本进一步实施例中使用的材料和方法相应地与实施例1中使用的材料和方法相同。从在48h马绒毛膜促性腺激素(ecg,folligon,intervet,oss,thenetherlands)刺激后体内生长的窦卵泡中分离24-26日龄小鼠的卵丘卵母细胞复合体。当小鼠为22-24日龄大时,注射2.5iuecg。在下列剂量的cnp存在下,将具有至少2层卵丘细胞的完整coc置于培养中18小时的时间段:
-对照(无cnp)*
-0.1nm**
-1nm
-10nm
-50nm**
-100nm
-1μm**
*对照条件,其中培养基中不存在cnp。
**0.1nm、50nm和1μm新测试剂量(包括在权利要求书中)。
根据实施例1中提供的小鼠的先前剂量实验收集和培养coc。
统计分析
通过anova之后通过tukey多重比较检验评估(每个减数分裂期)卵母细胞减数分裂恢复率的差异,p<0.01。在进行统计分析之前,转换(反正弦)成百分比数据。
结果:
总之,本发明的补充实验证实,cnp-22对减数分裂阻滞的维持具有剂量依赖性作用。通过在倒置显微镜下存在完整的生发泡(gv)证实卵母细胞减数分裂阻滞。
图9a显示1nm、10nm、50nm和100nm的剂量以≥80%(分别为80%、98%、94%和87%)的比率维持卵母细胞减数分裂阻滞。然而,与不含cnp的对照条件相比,仅10nm和50nm的剂量显著更高(分别为98%、94%vs50%,p<0.01)。
在生发泡破裂(gvbd)期的卵母细胞百分比没有记录到显著差异(图9b)。
cnp剂量为1nm、10nm、50nm和100nm时,排出第一极体的卵母细胞比例低或缺乏排出第一极体的卵母细胞(pb率,图9c)(与不含cnp的对照条件相比,后三个剂量显著不同,p<0.001),这匹配以下发现:在这些剂量cnp显示更有效的维持卵母细胞减数分裂阻滞的效果。
出乎意料的是,不仅非常低的剂量如0.1nm,而且非常高的剂量如1μm,被证明在维持卵母细胞阻滞在gv期中不是最佳剂量。
结论:
总而言之,这些数据表明,cnp-22能够以1nm至100nm的剂量间隔以高于80%的比率在排卵前卵母细胞中维持减数分裂阻滞,并且与要求保护的优选用于为了维持卵母细胞阻滞在gv期中的cnp剂量一致,其优选为10-50nm,更优选为10-25nm的剂量。因此,这种行为与pde3抑制剂的用途不同,其中增加剂量确实使卵母细胞持续阻滞。
实施例5
为了支持上述cnp效果不限于cnp-22本身,进行了另外的实验以测试这些效果是否可以由cnp类似物再现。进行另外的实验以测试cnp类似物:cnp-53的作用。与cnp-22类似,cnp-53是含有53个氨基酸的序列的c型利尿钠肽的主要内源形式之一。
设置:
除了替代性使用cnp-53外,在本进一步实施例中使用的材料和方法相应地与实施例4中使用的材料和方法相同。从在48小时ecg刺激后体内生长的窦卵泡中分离24-25日龄小鼠的卵丘卵母细胞复合体。当小鼠为22-23日龄大时,注射2.5iuecg。在下列剂量的cnp-53存在下,将完整的coc置于培养中18小时的时间段:
-对照(无cnp)*
-0.1nm
-1nm
-10nm
-50nm
-100nm
-1μm
-对照25nmcnp-22*
*包括两个对照条件:1)25nmcnp-22(标准剂量已知并用于之前的实验中以维持减数分裂阻滞),2)对照条件,其中培养基中不存在cnp。
统计分析
通过anova之后通过tukey多重比较检验评估(每个减数分裂期)卵母细胞减数分裂恢复率的差异,p<0.001。在进行统计分析之前,转换(反正弦)成百分比数据。
结果:
与使用cnp-22的补充实验中发现的结果相似,cnp-53证实对维持卵母细胞减数分裂阻滞具有出乎意料的(最大)剂量依赖性作用。
图10a显示,与不含cnp的对照条件相比,1nm、10nm、50nm和100nm的cnp-53剂量以显著更高的比率维持卵母细胞的减数分裂阻滞(分别为66%、98%、72%和69%vs.18%,p<0.001),与cnp-22对照相当(75%,p<0.01)。
在生发泡破裂(gvbd)期的卵母细胞百分比中没有记录到显著差异(图10b)。
与不含cnp的对照条件相比,剂量为1nm、10nm、50nm和100nm时,排出第一极体(pb期)的卵母细胞的比例显著不同(p<0.001),并且这匹配以下发现:这些特定剂量cnp-53在维持卵母细胞减数分裂阻滞中显示出更有效的效果(图10c)。
出乎意料的是,不仅非常低的剂量如0.1nm,而且非常高的剂量如1μm,被证明在维持卵母细胞阻滞在gv期中不是最佳剂量。
结论:
总体来说,这些数据表明,与cnp-22相当,cnp-53能够以高比率在排卵前卵母细胞中维持减数分裂阻滞。此外,cnp-53有效的剂量类似于cnp-22的剂量:1nm、10nm、50nm和100nm,在1nm至100nmcnp范围内不同的表达;在10nm至50nm的剂量范围内具有在排卵前卵母细胞中维持减数分裂阻滞的最佳效果。
实施例6
从临床前实验的结果来看,本发明的获能培养基对来自小卵泡的卵母细胞的成熟确实具有出乎意料的影响。在本研究中,已经评估了使用本申请的获能培养基的ivm方法对卵母细胞发育潜能是否会有影响,是否产生可受精的卵母细胞以及它们的胚泡形成潜力是否增加。
患者群体:
参与本研究的患者进行ivm治疗(n=15)同意捐赠一部分卵母细胞用于产生研究胚胎,并且具有以下特征:年龄<37岁;根据鹿特丹标准(rotterdameshre/asrm-sponsoredpcosconsensusworkshopgroup,2004)的多囊卵巢综合征(pco或pcos)的临床病史。
在卵母细胞取出之前、在最后一次超声扫描中患者具有30个或更多个卵泡的情况下,其中一部分(通常5-10名)被分配到新的ivm方法;其余的被分配到常规临床ivm操作方案作为患者治疗的一部分。
所有患者都接受了一项个性化刺激操作方案,其由累积剂量为600iu的hp-hmg(来自ferringpharmaceuticalssa的高度纯化的人绝经促性腺激素)组成。
一旦患者在超声扫描中显示平均直径在10-12mm范围内的至少1个优势卵泡,则在最后一次hp-hmg注射后42小时计划活体采卵(ovumpickup,opu)。
这项原理循证研究招募了15个同胞病例:
实验治疗=coc获能(使用根据本发明的获能培养基)+ivm
常规临床臂=常规ivm(
未成熟卵母细胞取出,获能培养,ivm和icsi
卵丘卵母细胞复合体(coc)采用17号单内腔针取自2-10mm卵泡,抽吸压力为70mmhg,并收集到含有补充有25iu/ml肝素(heparinleo,leopharma,belgium)的50μmibmx(sigma)的“收集培养基”中。
将收集的卵泡抽吸物在收集培养基(每管3ml预填充收集培养基)中立即稀释。从污染血细胞过滤收集管的内容物(falcon细胞过滤器;筛孔径70mm),并从培养皿中收集coc并保持在收集培养基中最长时间为1小时。然后将coc洗涤并在37℃、6%co2的空气中培养,在4孔ivf培养皿(nunc;thermofisherscientific;denmark)中每孔最多10个coc分组,每个孔含有500μl具有25nmcnp的“新获能培养基”(即根据本发明的获能培养基)。
经过22-26小时的获能培养后,将coc彻底洗涤并转移到含有100ng/ml人重组双调蛋白(rhareg)和100miu/ml重组fsh(gonal-f)的ivm培养基中,并在相同的允许体外减数分裂成熟发生的培养条件中孵育30小时。
在ivm培养30小时后,通过使用透明质酸酶(cookmedical),在立体显微镜下从卵丘层机械和酶学地游离卵母细胞,并在倒置显微镜下评估卵母细胞成熟。
研究臂中涉及的成熟卵母细胞(排出pb的)用普通供体的精子进行显微注射,并且在icsi后至第5天(最终第6天)评估胚胎发育。
在标准评估时间点记录受精和胚胎发育。具有良好形态并被认为是可转移的第3天的胚胎[根据卵裂球数量(至少5个细胞)、碎片率(最大20%),没有证据表明卵裂球多成核和/或早期致密化]被归类为“优质胚胎”(gqe)。
结果:
图11和12将“新获能培养+ivm”结果与对同胞卵母细胞的“常规ivm”进行比较,面对欧洲icsi数据(来自正常刺激的周期),并在uzbrussel(2014-2015)常规应用ivm。
第一数据集(常规icsi(megaset))在374名用hp-hmg超排卵的患者中发布常规icsi结果,并从大卵泡中收集了卵母细胞(
第二数据集(常规ivm(origio))是来自413名使用
最终和第三数据集(coc获能+ivm)是与其用
在人ivm之前应用获能培养法(即根据本发明的获能培养基)对未成熟的coc的培养显示出重要的益处:更高的核成熟率和更高的优质第3天胚胎和胚泡产量。
图11中的箭头(1)显示,与常规ivm相比,卵母细胞成熟率得到很大提高。图11中的箭头(2)显示受精率与常规icsi周期或常规ivm相等。图11中的箭头(3)显示,与从大卵泡icsi周期成熟卵母细胞获得的优质胚胎的比率相当,每个初始coc数的第3天的优质胚胎(第3天gqe)的产量几乎是常规ivm的两倍。
图12中的箭头(4)是指以每受精卵数量(2pn)或每个mii卵母细胞表示的培养的第5天或第6天的优质胚泡的产量。“获能培养”的结果略高于常规ivm。然而,常规ivm胚泡只有在第3天胚胎学有利(第3天4个或更多的优质胚胎)的情况下才能进一步生长的事实会积极地影响这些结果。因此,当将相同的方法应用于cnp(点状白条)时,结果远优于任何其他组。
图12中的箭头(5)是指在cnp组中以每个初始coc数表示的培养的第5天或第6天的优质胚泡的产量高于常规ivm(尽管该组具有阳性选择偏倚)和与常规icsi周期更相当。再次,在第3天应用于cnp组的≥4gqe的策略在所有组中产生最好的结果。
结论
作为ivm治疗的一部分,“新获能培养”培养步骤的应用增强了卵泡从小卵泡的成熟至类似于体内生长的卵母细胞(从刺激后的大卵泡获得)的程度。在早期胚胎发生过程中,这种更高成熟的效果是持久的,与传统的ivm相比,导致两倍量的优质胚胎。在早期胚胎发生过程中取得如此持久的效果超出预期,与目前使用的ivm方法相比,创造出灵活的ivm方法。
- 还没有人留言评论。精彩留言会获得点赞!