包含结合至5T4和CD3的三个结合结构域的融合蛋白的制作方法
本发明涉及包含三个结合结构域(bindingdomain)的双特异性结合分子,其中第一和/或第二结合结构域能够结合至细胞外5t4抗原并且剩余的结合结构域能够结合至t细胞上的cd3受体复合物(receptorcomplex)。
背景技术:
由单克隆抗体5t4定义的细胞表面抗原是由早在9周发育期间的所有类型滋养层表达的72-kd糖蛋白。在成人组织中,5t4表达限于少数专门的上皮细胞类型,但在成年肝、肺、支气管、心脏、睾丸、卵巢、脑或肌肉中未检测到。抗原由多种肿瘤细胞系选择性表达,包括发育起源的肿瘤细胞系。分子特征、某些肿瘤细胞类型的相对受限的正常组织分布和表达使得该抗原值得用作恶性肿瘤的诊断标志物(hole&stern,brjcancer.(1988)57(3),239-46)。
有明确证据表明5t4参与了癌症和癌症进展。癌细胞表面上高水平的5t4表达已经显示为卵巢癌(wrigleye,mcgownat,rennisonj,etal.5t4oncofetalantigenexpressioninovariancarcinoma.intjgynecolcancer.1995;5:269-274)、结肠癌(starzynskat,marshpj,schofieldpf,robertssa,myerska,sternpl.prognosticsignificanceof5t4oncofetalantigenexpressionincolorectalcarcinoma.brjcancer.1994;69:899-902)、子宫颈癌(jonesh,robertsg,holen,mcdickeniw,sternp.investigationofexpressionof5t4antigenincervicalcancer.brjcancer.1990;6:69-100)、胃癌(starzynskat,rahiv,sternpl.theexpressionof5t4antigenincolorectalandgastriccarcinoma.brjcancer.1992;66:867-869以及以上)和肺癌(forsbergg,ohlssonl,brodint,etal.therapyofhumannon-small-celllungcarcinomausingantibodytargetingofmodifiedsuperantigen.brjcancer.2001;85:129-136.)。还证明了与疾病进展的关联,即转移(mulderwm,sternpl,stukartmj,etal.lowintercellularadhesionmolecule1andhigh5t4expressionontumorcellscorrelatewithreduceddisease-freesurvivalincolorectalcarcinomapatients.clincancer.1997;3:1923-1930和starzynskat,wiechowska-kozlowskaa,marliczk,etal.5t4oncofetalantigeningastriccarcinomaanditsclinicalsignificance.eurjgastroenterolhepatol.1998;10:479-484以及naganumah,konok,moriy,etal.oncofetalantigen5t4expressionasaprognosticfactorinpatientswithgastriccancer.anticancerres.2002;22:1033-1038)。因为与癌性病变相比,正常组织中5t4的表达受到限制(ana,langdonj,sternpl,partidgem.thepatternofexpressionof5t4oncofoetalantigenonnormal,dysplasticandmalignantoralmucosa.oraloncol.2001;37:57-64),所以已经提出5t4作为靶向癌症治疗的合适的靶抗原(woodsam,wangww,shawdm,etal.characterizationofthemurine5t4oncofoetalantigen:atargetforimmunotherapyincancer.biochemj.2002;366:353-365和holen,sternpl.isolationandcharacterizationof5t4,atumor-associatedantigen.intjcancer.1990;45:179-184)。
基于抗体的癌症治疗需要靶抗原与癌细胞表面牢固结合才能活化。通过结合至表面靶,抗体可以直接或间接地向癌细胞递送致命的信号。根据理想治疗方案的要求,靶抗原5t4在特定癌细胞上是大量存在且可及的,而在正常细胞中不存在、被屏蔽或不那么丰富。然而,尽管5t4抗原在20多年前就被认为是肿瘤学靶点,但是尚无抗5t4免疫治疗被批准用于治疗癌症。因此,明确需要一种针对该抗原的有效治疗方法。
在本领域中已知的是提供双特异性分子形式的基于抗体的治疗,其以一个结构域与细胞毒性细胞(即细胞毒性t细胞)结合,并且以第二结合结构域结合至肿瘤细胞表面上的5t4。更具体地,在wo2013041687中描述了一种双特异性分子,其包含第一和第二结合结构域,(a)其中第一结合结构域能够结合至5t4的表位簇4;并且(b)其中第二结合结构域能够结合至t细胞上的cd3受体复合物。
两种相同或不同的蛋白质或肽与抗体的抗原结合臂的每个链(称为fab)融合的融合蛋白或其衍生物是已知的。在其最传统的意义上,fab是包含vh和ch1抗体结构域的fd链与包含vl和cl抗体结构域的l链之间的异源二聚体。可变结构域vh和vl可以衍生自不同物种或抗体亚类。而且,恒定结构域ch1和cl也可以衍生自不同的物种和亚类。融合蛋白利用ch1:cl异源二聚体相互作用使fab融合蛋白异源二聚化。wo9937791(多用途抗体衍生物)教导使用传统构象的fab。vh-ch1:vl-cl异源二聚体以第二和第三功能或甚至具有第四和第五功能扩展c末端和/或n末端。在肽、蛋白质或蛋白质部分或衍生物中编码扩增功能。wo9937791教导了使用与vh重链可变结构域的融合,再与ch1重链恒定结构域-1的融合,以形成与vl可变轻抗体结构域融合再与cl恒定轻抗体结构域融合的异源二聚体。vh-ch1:vl-cl(或写为vhch1:vlcl)异源二聚体可以扩展多达四个肽或蛋白质融合。
技术实现要素:
本发明涉及一种双特异性结合分子(进一步称为:‘融合蛋白’或“三体融合蛋白(tribodyfusionprotein)”或“tb-5t4融合蛋白”),其包含三个结合结构域,其中第一和/或第二结合结构域能够结合至细胞外5t4抗原并且剩余的结合结构域能够结合至t细胞上的cd3受体复合物。另外,本发明涉及一种编码融合蛋白的核酸序列、包含所述核酸序列的载体以及使用所述载体转化或转染的宿主细胞。此外,本发明涉及一种用于生产本发明的融合蛋白的方法、所述融合蛋白的医学用途和包含所述融合蛋白的试剂盒。
具体实施方式
贯穿本公开,各种出版物、专利和已公开的专利说明书通过标识引用来引用。这些出版物、专利和公开的专利说明书的公开内容通过引用并入本公开,以更充分地描述本发明所属领域的状态。
必须注意的是,如本文所使用的,单数形式“一个”、“一种”和“该”包括复数引用,除非上下文另有明确说明。因此,例如,提及“一种试剂”包括一种或多种这样的不同试剂,并且提及“该方法”包含提及本领域普通技术人员已知的可以修改或替代本文描述的方法的等效步骤和方法。
除非另有说明,否则在一系列元素前面的术语“至少”应理解为指该系列中的每个元素。本领域技术人员将认识到或使用不超过常规实验能够确定本文所述的本发明的具体实施方式的许多等同物。本发明旨在涵盖这样的等同物。
本文中无论何处使用的术语“和/或”包括“和”、“或”以及“由所述术语连接的元素的全部或任何其他组合”的含义。
本文所用的术语“约”或“近似”是指在给定值或范围的20%以内,优选在10%以内,更优选在5%以内。
在本说明书和所附权利要求书中,除非上下文另有要求,单词“包含”及变形诸如“包括”和“含有”将被理解为暗示包含所指定的整数或步骤或一组整数或步骤,但不排除任何其他整数或步骤或一组整数或步骤。当在本文中使用时,术语“包含”可以用术语“含”或“包括”代替,或者在本文中使用时,有时用术语“具有”代替。
当本文中使用时,“由…组成”不包括在权利要求元素中未指定的任何元素、步骤或成分。当本文中使用时,“基本上由…组成”不排除不会重大影响权利要求的基本和新颖特性的材料或步骤。
在本文中的每种情况下,术语“包含”、“基本上由…组成”和“由…组成”中的任何可以其它两个术语之一来替换。
与本发明有关的术语“结合结构域”表示与给定靶表位特异性结合/相互作用的多肽的结构域(能够结合至给定的靶表位/与给定的靶表位相互作用)。“表位”是抗原性的,因此术语表位在本文中有时也称为“抗原结构”或“抗原决定簇”。因此,结合结构域是“抗原相互作用位点”。术语根据本发明的术语“抗原相互作用位点”定义多肽的基序,其能够与特异性抗原或特异性抗原组(例如,不同物种中的相同抗原)特异性相互作用。所述结合/相互作用也被理解为定义“特异性识别”。在一个实例中,与给定靶表位特异性结合/相互作用的所述多肽是抗体,并且所述结构域是抗体的vh和/或vl区或结构域。
术语“表位”是指抗原上的位点,结合结构域(例如抗体、或免疫球蛋白、或免疫球蛋白的抗体的衍生物)特异性结合至该位点。可以通过蛋白质的三级折叠并入的连续氨基酸或非连续氨基酸形成表位。“线性表位”是其中氨基酸一级序列包含所识别的表位的表位。线性表位通常在唯一序列中包含至少3个、更通常至少5个(例如约8个至约10个)氨基酸。
与线性表位相比,“构象表位”是其中包含该表位的氨基酸的一级序列包含不是所识别的表位的唯一定义组分的表位(例如,其中氨基酸的一级序列不一定被定义表位的抗体识别的表位)。通常,构象表位包含相对于线性表位增加数量的氨基酸。关于构象表位的识别,结合结构域识别抗原的3维结构,优选肽或蛋白质或它们的片段(在本发明的上下文中,抗原针对5t4蛋白质的结合结构域中的一个)。例如,当蛋白质分子折叠以形成三维结构时,形成构象表位的某些氨基酸和/或多肽主链变得并列,使抗体能够识别表位。确定表位构象的方法包括但不限于例如x射线晶体学二维核磁共振光谱和定点自旋标记以及电子顺磁共振光谱。
术语“特异性结合/相互作用”、“特异性识别”、“针对/指向(directedto)”和“与...反应”根据本发明是指结合结构域能够与表位的至少两个、优选至少三个、更优选至少四个氨基酸特异性相互作用和/或与它们结合。这种结合可以通过的“锁和钥匙-原则”的特异性来例示。如本文所用,术语“特异性相互作用”、“特异性结合的”或“特异性结合”是指结合结构域对特定蛋白质或抗原表现出明显的亲和力,并且通常不表现出与其它蛋白质或抗原的显著交叉反应性。“明显的”或优选的结合包括具有10-6m(kd)或更高的亲和力的结合。优选地,当结合亲和力为约10-11至10-8m时,该结合被认为是特异的,优选约10-11至10-9m。如果需要,可以通过改变结合条件以减少非特异性结合,而不会本质上影响特异性结合。尤其通过将所述结合结构域之一和靶蛋白或抗原的反应与所述结合结构域和其它蛋白质或抗原的反应进行比较,可容易地测试结合域是否与靶特异性反应或结合。
认为特异性结合受结合结构域的氨基酸序列中的特定基序和抗原的影响。因此,作为其一级、二级或三级结构的结果以及所述结构的二次修饰的结果,实现了结合。抗原相互作用位点与其特异性抗原的特异性相互作用也可能导致所述位点与抗原的简单结合。此外,抗原相互作用位点与其特异抗原的特异性相互作用可以替代地导致信号的启动,例如,由于抗原构象的变化的诱导、抗原的寡聚化等。在一个例子中,结合结构域是抗体。
术语“基本上不结合”是指本发明的融合蛋白的结合结构域不结合另一种蛋白质,即显示出与另一蛋白质的交叉反应性小于30%,优选20%,更优选10%,特别是优选小于9、8、7、6或5%。
本文所用的术语“跨物种特异性”、“跨物种识别”和“种间特异性”表示结合结构域在人和非人物种中,优选在灵长类物种中,结合相同靶分子的能力。因此,“跨物种特异性”或“种间特异性”描述了对在不同物种中表达的相同分子x(例如,5t4或cd3)的种间反应性,但不是对除了x(例如5t4或cd3)以外的分子。
蛋白质(包括其片段,优选生物活性片段和通常具有少于30个氨基酸的肽)包含通过共价肽键彼此偶联的一个或多个氨基酸(产生氨基酸链)。本文所用的术语“多肽”描述了一组由多于30个氨基酸组成或包含多于30个氨基酸的分子。多肽可以进一步形成多聚体,例如二聚体、三聚体和更高级寡聚体,即由多于一个多肽分子组成或包含多于一个多肽分子。形成这种二聚体、三聚体等的多肽分子可以相同或不相同。因此,这种多聚体的相应较高级结构被称为同源二聚体或异源二聚体、同源三聚体或异源三聚体等。一个异源多聚体的一个例子是抗体分子,其天然存在形式由两个相同的轻多肽链和两个相同的重多肽链组成或包含两个相同的轻多肽链和两个相同的重多肽链。术语“多肽”和“蛋白质”也指天然修饰的多肽/蛋白质,其中修饰例如是通过如糖基化、乙酰化、磷酸化等的翻译后修饰实现的。这样的修饰在本领域是公知的。
如上所述,在一个方面,融合蛋白的第一和/或第二结合结构域能够结合至人类和普通狨、绒顶柽柳猴或松鼠猴5t4,和/或剩余的结合结构域能够结合至人类和普通狨、绒顶柽柳猴或松鼠猴cd3ε(epsilon)。根据该实施方式,本发明的融合蛋白的所有三个结合结构域对哺乳动物顺序的灵长类动物的成员具有特异性。在一个实施方式中,第一或第二或第三结合结构域衍生自抗体。在另一个实施方式中,所有结合结构域衍生自抗体。术语“抗体”的定义包括实施方式例如单克隆、嵌合、单链、人源化和人抗体,以及抗体片段,特别是fab片段。抗体片段或衍生物进一步包含f(ab')2、fv、scfv片段或单结构域抗体(如结构域抗体或纳米抗体)、单可变结构域抗体或仅包含一个可变结构域的免疫球蛋白单可变结构域,该可变结合结构域可以是vhh、vh或vl,该免疫球蛋白单可变结构域特异性结合抗原或表位而与其他v区域或结构域无关;参见例如harlow和lane(1988)及(1999),同前文献(loc.cit);kontermann和dubel,antibodyengineering,springer,第2版,2010以及little,recombinantantibodiesforimmunotherapy,cambridgeuniversitypress2009。这样的免疫球蛋白单可变结构域不仅包括分离的抗体单可变结构域多肽,还包括包含抗体单可变结构域多肽序列的一个或多个单体的较大多肽。
各种程序是本领域已知的并且可以用于生产这样的抗体和/或片段。因此,可通过模拟肽来产生(抗体)衍生物。另外,为生产单链抗体描述的技术(尤其参见美国专利4,946,778,kontermann和dubel(2010),同前文献以及little(2009),同前文献)可以经改编以生产对所选多肽特异的单链抗体。此外,转基因动物可以用于表达对本发明的多肽和融合蛋白特异的人源化抗体。为了制备单克隆抗体,可以使用提供由连续细胞系培养产生的抗体的任何技术。这些技术的实例包括杂交瘤技术(kohler和milstein,nature256(1975),495-497)、三瘤技术、人b细胞杂交瘤技术(kozbor,immunologytoday4(1983),72)和用于生产人类单克隆抗体的ebv杂交瘤技术(coleetal.,monoclonalantibodiesandcancertherapy,alanr.liss,inc.(1985),77-96)。bia核系统中使用的表面等离子体共振可用于提高结合至靶多肽表位(例如cd3ε)的噬菌体抗体的效率(schier,humanantibodieshybridomas7(1996),97-105;malmborg,j.immunol.methods183(1995),7-13)。在本发明的上下文中也设想到,术语“抗体”包括抗体构建体,其可以在如下文所述的宿主中表达,例如,可尤其通过病毒或质粒载体转染和/或转导的抗体构建体。
另外,本发明中使用的术语“抗体”还涉及本文所述的抗体的衍生物或变体,其显示出与所述抗体相同或相似的特异性。相似特异性是为所述变体或衍生物来源的初始/对照抗体的特异性的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少105%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%的特异性。“抗体变体”的实例包括非人抗体的人源化变体、“亲和力成熟”抗体(参见例如hawkinsetal.j.mol.biol.254,889-896(1992)和lowmanetal.,biochemistry30,10832-10837(1991))以及具有改变的作用或功能的抗体突变体(参见例如美国专利5,648,260,kontermann和dubel(2010),同前文献以及little(2009),同前文献)。
术语“抗原结合结构域”、“抗原结合片段”、“抗体结合结构域”和“抗体结合区”在本文中使用时,是指抗体分子的一部分,其包含负责抗体和抗原之间的特异性结合的氨基酸。被抗体特异性识别并结合的抗原部分被称为如上所述的“表位”。如上所述,抗原结合结构域通常可以包含抗体轻链可变区(vl)和抗体重链可变区(vh);然而,它不一定包含两者。例如,fd片段具有两个vh区,并且经常保留了完整抗原结合结构域的一些抗原结合功能。抗体的抗原结合片段的实例包括(1)fab片段,一种具有vl、vh、cl和ch1结构域的一价片段;(2)f(ab')2片段,一种具有通过在铰链区上的二硫键连接的两个fab片段的二价片段;(3)具有两个vh和ch1结构域的fd片段;(4)具有抗体单臂的vl和vh结构域的fv片段;(5)dab片段(wardetal.,(1989)nature341:544-546),其具有vh结构域;(6)分离的互补决定区(cdr),和(7)单链fv(scfv)。尽管fv片段的两个结构域,vl和vh通过单独的基因编码,但是它们可以通过合成接头使用重组方法连接,使得它们能够被制成单个的蛋白质链,其中vl和vh区对形成单价分子(称为单链fv(scfv);参见例如hustonetal.(1988)proc.natl.acad.sciusa85:5879-5883)。使用本领域技术人员已知的常规技术获得这些抗体片段,并以与完整抗体相同的方式评估片段的功能。本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即构成所述群体的单个抗体是相同的,但是可以存在的少量可能的天然存在的突变和/或翻译后修饰(例如,异构化,酰胺化)。针对单个抗原位点,单克隆抗体是高度特异性的。此外,与通常包括针对不同决定簇(表位)的不同抗体的常规(多克隆)抗体制剂相反,每个单克隆抗体针对抗原上的单一决定簇。除了它们的特异性之外,单克隆抗体的优点在于它们通过杂交瘤培养物合成,未受其他免疫球蛋白的污染。修饰语“单克隆”表示抗体的特征是从基本上均匀的抗体群获得,并且不应被解释为需要通过任何特定方法产生抗体。例如,可以通过首先由kohleretal.,nature,256:495(1975)描述的杂交瘤方法制备根据本发明使用的单克隆抗体,或者可以通过重组dna方法来制备(参见例如美国专利号4,816,567)。例如,还可以使用clacksonetal.,nature,352:624-628(1991)和marksetal.,j.mol.biol.,222:581-597(1991)中描述的技术,从噬菌体抗体文库中分离出“单克隆抗体”。
本文中的单克隆抗体具体包括“嵌合”抗体(免疫球蛋白)以及该抗体的片段,在所述抗体中,重链和/或轻链的一部分与衍生自特定物种或属于特定抗体类或亚类的抗体中的相应序列相同或同源,而链的其余部分与衍生自另一物种或属于另一种抗体类或亚类的抗体中的相应序列相同或同源,只要它们表现出所需的生物活性(美国专利号4,816,567;morrisonetal.,proc.natl.acad.sci.usa,81:6851-6855(1984))。本文的目标嵌合抗体包括包含衍生自非人灵长类动物(例如旧大陆猴,猿等)的可变结构域抗原结合序列和人类恒定区序列的“原始(primitized)”抗体。
非人(例如,鼠)抗体的“人源化”形式是主要是人序列的嵌合免疫球蛋白、免疫球蛋白链或其片段(诸如fv、fab、fab'、f(ab')2或抗体的其他抗原结合子序列),其含有来自非人免疫球蛋白的最小序列。在大多数情况下,人源化抗体是人免疫球蛋白(接受者抗体),其中来自接受者的高变区(也是cdr)的残基被来自非人物种(例如具有期望的特异性、亲和力和能力的小鼠、大鼠或兔)(供体抗体)的高变区的残基替代。在一些情况下,人免疫球蛋白的fv构架区(fr)残基被相应的非人残基代替。此外,本文所用的“人源化抗体”还可以包含在接受者抗体和供体抗体中都未发现的残基。进行这些修饰以进一步改进和优化抗体性能。人源化抗体最优还将包含免疫球蛋白恒定区(fc)的至少一部分,通常为人免疫球蛋白的恒定区。详情请见jonesetal.,nature,321:522-525(1986);reichmannetal.,nature,332:323-329(1988);和presta,curr.op.struct.biol.,2:593-596(1992)。
术语“人抗体”包括具有可变区和恒定区的抗体,其基本上与本领域已知的人种系免疫球蛋白序列相对应,包括例如kabatetal.(seekabat,etal.(1991),同前文献)描述的那些。本发明的人抗体可以包括未被人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变引入的突变或通过体内体细胞突变引入的突变),例如在cdr中,且特别是在cdr3中。人抗体可以具有至少一个、两个、三个、四个、五个或更多个位置被未被人种系免疫球蛋白序列编码的氨基酸残基替换。
如本文所用,“体外产生的抗体”是指其中全部或部分可变区(例如,至少一个cdr)是在非免疫细胞选择中产生的抗体(例如,体外噬菌体展示、蛋白质芯片或其中可以测试候选序列与抗原结合的能力的任何其它方法)。因此,该术语优选地排除由免疫细胞中的基因组重排产生的序列。“双特异性”或“功能性抗体”是具有两个不同重/轻链对和两个不同结合位点的人工混合抗体。双特异性抗体可以通过多种方法产生,包括杂交瘤的融合或fab'片段的连接。参见例如songsivilai&lachmann,clin.exp.immunol.79:315-321(1990)。本领域技术人员已知的许多方法可用于获得抗体或其抗原结合片段。例如,可以使用重组dna方法产生抗体(美国专利4,816,567)。也可以通过根据已知方法产生杂交瘤来产生单克隆抗体(参见例如kohler和milstein(1975)nature,256:495-499)。然后使用标准方法筛选以这种方式形成的杂交瘤,诸如酶联免疫吸附测定(elisa)和表面等离子体共振(biacoretm)分析,以鉴定产生与指定抗原特异性结合的抗体的一种或多种杂交瘤。任何形式的指定抗原均可以用作免疫原,例如重组抗原、其天然存在形式、其任何变体或片段、以及其抗原肽。
制备抗体的一个示例性方法包括筛选蛋白质表达文库,例如噬菌体或核糖体展示文库。例如,噬菌体展示被描述在ladneretal.,美国专利号5,223,409;smith(1985)science228:1315-1317;clacksonetal.(1991)nature,352:624-628中。
人源化抗体或其片段可以通过将不直接参与抗原结合的fv可变结构域的序列替换为来自人fv可变结构域的等同序列来产生。morrison(1985)science229:1202-1207;oietal.(1986)biotechniques4:214;和us5,585,089;us5,693,761;us5,693,762;us5,859,205;以及us6,407,213提供了用于产生人源化抗体或其片段的示例性方法。那些方法包括分离、操纵和表达编码来自重链或轻链中的至少一个的全部或部分免疫球蛋白fv可变结构域的核酸序列。这样的核酸可以从产生针对预定靶(如上所述)的抗体的杂交瘤获得,以及来自其它来源。然后将编码人源化抗体分子的重组dna克隆到合适的表达载体中。
可以通过引入保守取代、共有序列取代、种系取代和/或反向突变来优化人源化抗体。这种改变的免疫球蛋白分子可以通过本领域已知的几种技术中的任何一种制备(例如tengetal.,proc.natl.acad.sci.u.s.a.,80:7308-7312,1983;kozboretal,immunologytoday,4:7279,1983;olssonetal.,meth.enzymol.,92:3-16,1982,并且可以根据ep239400的教导来制备)。还可以通过wo98/52976和wo00/34317中公开的方法,通过人t细胞表位的特异性缺失或“去免疫”来修饰抗体或其片段。简而言之,可以分析抗体的重链和轻链可变结构域与mhcii类结合的肽;这些肽代表潜在的t细胞表位(如wo98/52976和wo00/34317中的定义)。为了检测潜在的t细胞表位,可以应用称为“肽线程”的计算机建模方法,此外,可以搜索人类mhcii类结合肽的数据库,以查找在vh和vl序列中存在的基序,如wo98/52976和wo00/34317中所述的。这些基序与18种主要的mhcii类dr同种异型结合,并因此构成潜在的t细胞表位。检测到的潜在的t细胞表位,可以通过在可变结构域中取代少量的氨基酸残基来消除,或优选通过单个氨基酸取代来消除。在这种情况下,少的意思是一个、二个、三个、四个、五个或六个氨基酸残基。通常,进行保守取代。通常但不排他地,可以使用与人种系抗体序列中的位置常见的氨基酸。人种系序列例如描述于tomlinson,etal.(1992)j.mol.biol.227:776-798;j.mol.biol.227:776-798;cook,g.p.etal.(1995)immunol.todayvol.16(5):237-242;和tomlinsonetal.(1995)emboj.14:14:4628-4638中。vbase目录提供了人免疫球蛋白可变区序列的综合目录(由tomlinson,la.etal.汇编,mrccentreforproteinengineering,cambridge,uk)。这些序列可以用作人类序列的来源,例如用于框架区和cdr。也可以使用共有人框架区,例如在美国专利号6,300,064中的描述。
vh和vl的配对一起形成单个抗原结合位点,以下称为“结合的vh/vl结合结构域”。最接近vh的ch结构域被指定为ch1。每个l链通过一个共价二硫键与h链连接,而两个h链通过一个或多个二硫键彼此连接,这取决于h链同种型。vh和vl结构域由称为框架区的相对保守序列的四个区域组成(fr1、fr2、fr3和fr4),其形成高变序列(互补决定区,cdr)的三个区域的支架。cdr含有负责抗体与抗原的特异性相互作用的大多数残基。cdr被称为cdr1、cdr2和cdr3。因此,重链上的cdr成分称为h1、h2和h3,而轻链上的cdr成分称为l1、l2和l3。
术语“可变”是指免疫球蛋白结构域在其序列中表现出可变性并涉及确定特定抗体的特异性和结合亲和力的部分(即“可变结构域”)。变异性不均匀分布在抗体的整个可变结构域中;它集中在每个重链和轻链可变区的子结构域中。这些子结构域称为“高变区”或“互补决定区”(cdr)。可变结构域的更保守(即非高变)部分称为“框架”区(frm)。天然存在的重链和轻链的可变结构域各自包含四个frm区,主要采用由三个高变区连接的β-片构型,其形成环连接,并且在某些情况下形成β-片结构的一部分。每个链中的高变区通过frm紧密地保持在一起,并且来自另一个链的高变区有助于形成抗原结合位点(参见kabatetal.,同前文献)。恒定结构域不直接参与抗原结合,但表现出各种效应子功能,例如抗体依赖性、细胞介导的细胞毒性和补体激活。
术语“氨基酸”或“氨基酸残基”通常指具有本领域公认定义的氨基酸,例如选自以下的氨基酸:丙氨酸(ala或a);精氨酸(arg或r);天门冬酰胺(asn或n);天冬氨酸(asp或d);半胱氨酸(cys或c);谷氨酰胺(gin或q);谷氨酸(glu或e);甘氨酸(gly或g);组氨酸(his或h);异白氨酸(he或i);亮氨酸(leu或l);赖氨酸(lys或k);蛋氨酸(met或m);苯丙氨酸(phe或f);脯氨酸(pro或p);丝氨酸(ser或s);苏氨酸(thr或t);色氨酸(trp或w);酪氨酸(tyr或y);和缬氨酸(val或v),但是可以根据需要使用修饰的、合成的或稀有的氨基酸。通常,氨基酸可以分组为具有非极性侧链(例如ala,cys,he,leu,met,phe,pro,val);带负电的侧链(例如asp、glu);带正电的侧链(例如arg、his、lys);或不带极性的侧链(例如asn、cys、gin、gly、his、met、phe、ser、thr、trp和tyr)。
当在本文中使用时,术语“高变区”(也称为“互补决定区”或cdr)是指免疫球蛋白的v区结构域内(通常为极端序列变异性的三个或四个短区)的抗体的氨基酸残基,其形成抗原结合位点并且是抗原特异性的主要决定簇。至少有两种鉴定cdr残基的方法:(1)基于跨物种序列变异性的方法(即kabatetal.,同前文献);和(2)基于抗原-抗体复合物晶体学研究的方法(chothia,c.etal.,j.mol.biol.196:901-917(1987))。然而,在两个残基识别技术限定重叠但不相同区域的区域的情况下,它们可以组合以定义杂交cdr。然而,通常,cdr残基优选根据所谓的kabat(编号)系统鉴定。
本发明包含fab(vhch1:vlcl)或交叉-fab(vhcl:vlch1)或结构域-fab(v1ch1:v2cl)的用途。我们将提及fab衍生的异源二聚体包含vhch1:vlcl;vhcl:vlch1和v1ch1:v2cl基结构。在本发明中,仅对fab衍生的和ch1:cl驱动的异源二聚体进行两个扩展。在优选的构型中,包含链的每个ch1和cl具有基于肽键的扩展。在最优选的构型中,这些扩展处于包含ch1和包含cl的链的c末端。在这个位置上,它们不会影响fab分子的结合能力,从而产生完全功能的三官能、三价、二价双特异性或三特异性分子。惊人地,本发明的c末端融合还增加了最终融合蛋白的稳定性和总体熔解温度,如图6a,6b所示。
本发明的融合蛋白进一步扩展有结合或效应子分子以包含针对肿瘤抗原和单一免疫激活功能的双重结合功能。
本发明的融合蛋白结合了针对与肿瘤相关的抗原(taa)5t4的二价结合,具有t细胞活化功能。在tb-5t4三体族的实例中,与5t4的二价结合将与cd3的单价结合相组合。二价5t4结合增加了对过表达5t4抗原的肿瘤细胞的特异性。二价结合还降低了靶向复合物的脱离速率,从而及时稳定了结合。与t细胞cd3的单价结合避免了由二价cd3结合分子激活t细胞,如用okt3和okt3衍生的(fab')2所看到的(结合cd3的二价结合fab片段)。这些分子已知用于t细胞活化,随后是活化诱导的细胞死亡或使t细胞无能,并被发现可用于避免移植器官的排斥。因此,本发明的融合蛋白由形成ch1:cl驱动的异源二聚体的两个融合链组成。在另一个实施方式中,融合蛋白包含两个不同链,其中(i)一条链包含两个vh抗体结合结构域、一个vl抗体结合结构域和一个ch1或cl抗体结构域,并且(ii)另一条链包含两个vl抗体结合结构域、一个vh抗体结合结构域和一个cl或ch1抗体结构域,前提是融合蛋白在一条链的ch1抗体结构域和另一条链的cl抗体结构域之间含有一个异源二聚体相互作用,其特征在于(a)在链内形成的一个或两个结合的vh/vl结合结构域能够结合细胞外5t4抗原;并且(b)在链内形成的剩余的一个或两个结合的vh/vl结合结构域能够结合至t细胞上的cd3受体复合物。
本发明的融合蛋白可以是以下的形式或也可以如下定义:
vh(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)
结合
vl(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)cl-l1-vl(5t4)-l2-vh(5t4)。
或以下的形式:
vh(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vl(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)cl-l1-vl(cd3)-l2-vh(cd3)。
或以下的形式:
vh(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vl(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)cl-l1-vl(5t4)-l2-vh(5t4)。
或以下的形式:
vl(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vh(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)cl-l1-vl(5t4)-l2-vh(5t4)。
或其于以下形式的交叉-fab(vhcl:vlch1):
vl(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)
结合
vh(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)cl-l1-vl(5t4)-l2-vh(5t4)。
或:
vl(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vh(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)cl-l1-vl(cd3)-l2-vh(cd3)。
所有这些融合蛋白均已在图1b和1c中示出。
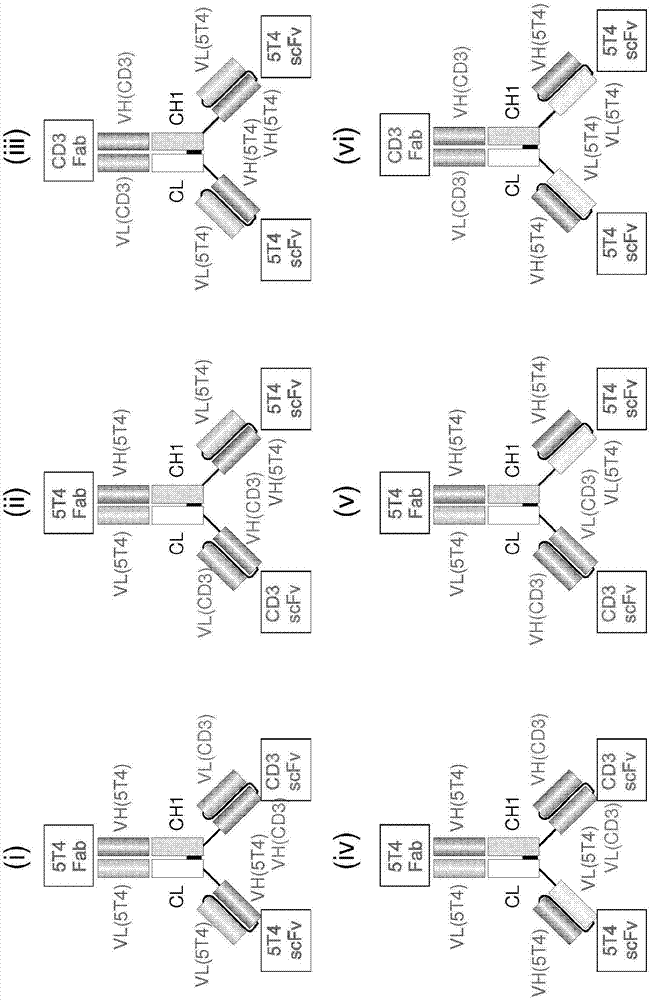
其他包含的tb-5t4融合蛋白是其中结构基于与ch1和cl异源二聚体(dfab)的单结构域结合物融合的那些(也参见图1d):
v1(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
v1(5t4)cl-l1-vl(5t4)-l2-vh(5t4)
其中v1是与5t4具有特异性的单结构域结合物
结合
v2-ch1-l1-vh(cd3)-l2-vl(cd3)或
v2-ch1-l1-vl(cd3)-l2-vh(cd3)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如图1d的(xiii)和(xvi)中的2种可能组合所示。
或不同形式组织的
v2-ch1-l1-vh(5t4)-l2-vl(5t4)或
v2-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
v1(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
v1(5t4)cl-l1-vl(cd3)-l2-vh(cd3)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如图1d的(xiv)和(xvii)中的2种可能组合所示。
或不同形式组织的
v1(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
v1(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
v2-cl-l1-vh(5t4)-l2-vl(5t4)或
v2-cl-l1-vl(5t4)-l2-vh(5t4)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如图1d的(xv)和(xviii)中的2种可能组合所示。
在图1d所示的所有组合中,scfv也可以是二硫键稳定的单链可变片段(dsfv)。
因此,在优选的实施方式中,在本发明包含的融合蛋白优选如上所定义。该融合蛋白包含两个不同的链:
a)第一链:vh(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)结合
第二链:vl(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)cl-l1-vl(5t4)-l2-vh(5t4),
b)第一链:vh(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:vl(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)cl-l1-vl(cd3)-l2-vh(cd3),
c)第一链:vh(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:vl(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)cl-l1-vl(5t4)-l2-vh(5t4),
d)第一链:vl(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:vh(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)cl-l1-vl(5t4)-l2-vh(5t4),
e)第一链:vl(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)结合
第二链:vh(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)cl-l1-vl(5t4)-l2-vh(5t4),
f)第一链:vl(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:vh(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)cl-l1-vl(cd3)-l2-vh(cd3),
g)第一链:v1(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
v1(5t4)cl-l1-vl(5t4)-l2-vh(5t4)结合
第二链:v2-ch1-l1-vh(cd3)-l2-vl(cd3)或
v2-ch1-l1-vl(cd3)-l2-vh(cd3),
h)第一链:v2-ch1-l1-vh(5t4)-l2-vl(5t4)或
v2-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:v1(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
v1(5t4)cl-l1-vl(cd3)-l2-vh(cd3),
i)第一链:v1(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
v1(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)结合
第二链:v2-cl-l1-vh(5t4)-l2-vl(5t4)或
v2-cl-l1-vl(5t4)-l2-vh(5t4),
其中vh、vl是抗体结合结构域,ch1和cl是抗体结构域,并且其中融合蛋白是这样的:(a)在链内形成的一个或两个结合的vh/vl结合结构域能够结合至细胞外5t4抗原;并且(b)在链内形成的剩余的一个或两个结合的vh/vl结合结构域能够结合至t细胞上的cd3受体复合物。
在一个实施方式中,也称为融合蛋白的tb-5t4融合蛋白包含融合蛋白,其中包含ch1:cl的部分结合5t4抗原,并且每个含ch1且含cl的链在与c末端扩展有另一结合分子。在包含ch1:cl的部分提供一种5t4结合功能的情况下,另外的融合结合物将包含至少一种其它5t4结合分子和另一种其它cd3结合分子。
本发明的融合蛋白可以从正常抗体中观察到的v结构域的组合衍生得到。它们可以被格式化为单链可变片段(scfv)。scfv可以是vh-接头-vl或vl-接头-vh的格式(format)。两种格式在结合性和稳定性方面都有差异。本领域技术人员可以对这两种格式进行比较,而不会造成不必要的负担。wo8801649(单个多肽结合分子)和us5455030(使用单链多肽结合分子的免疫治疗)设想了scfv的用途。
scfv分子包含本领域已经描述的接头分子。本领域包含其中接头序列可以被优选用于某些vh和vl对的实例。优选的接头跨越第一v结构域的c末端与第二v结构域的n末端之间的距离。优选的接头也足够柔性,不会干扰可变区的折叠。优选的接头不包含任何抗原抗体表位和免疫原性t细胞表位。在scfv中连接两个v结构域的优选接头的实例是含有许多甘氨酸(柔性的非免疫原性的氨基酸)和丝氨酸(具有较高溶解度的柔性低免疫原性氨基酸)的15至18个氨基酸长的肽。本领域中已知的最优选的接头的例子是ggggsggggsggggs或书写为(ggggs)3。
可变结构域通常不具有稳定的相互作用,并且vh:vl解离常数可以高达10mm。因此,v-结构域二聚体经常解离。融合两个结构域的接头增加了重新关联的机会。
另一技术是本领域已知的:wo9429350(制备具有结合特异性的重组二硫化物稳定的多肽片段的方法)教导了在vh和vl之间的特异性位点工程化以设计人造二硫化桥。以这种方式,可以获得共价稳定的二聚体。在本发明中,可变结合片段将优选作为单链多肽。由于需要两种融合蛋白如tb-5t4三体,单链格式避免了v结构域的配对错配,从而避免产品变异和产生非功能性衍生物。然而,vh-vl对的频繁解离和重新结合在特别情况下可导致与另一种融合蛋白如tb-5t4的二聚体形成。这些产物将具有可能的二价抗cd3结合,并因此即使在肿瘤靶细胞上未累积时也可能激活t细胞。
由于许多基于scfv分子的双特异性t细胞衔接器(engager)以炎性细胞因子产生的形式诱导脱靶毒性。诱导的典型细胞因子是il-2、ifn-γ和tnf-α。当刺激较高和/或细胞因子扰动不是临床控制时,其可能导致器官衰竭并变得危及生命。
本发明可以使用或使用如wo8801649中所述的单链可变结构域技术和如wo9429350中所述的v片段的二硫键稳定化的组合,以产生二硫化物稳定的单链可变结构域(dsfv)。
为了组装本发明的融合蛋白,必须选择形成功能性结合分子的可变结构域。与正常组织中具有未描述的交叉反应性的5t4taa结合的合适的抗体被称为小鼠单克隆5t4.h8。5t4.h8的可变结构域在seqid01和seqid16中给出或包含在seqid01和seqid16中或由seqid01和seqid16组成。这些序列的结构上更稳定的衍生物在seqid02和seqid17中给出或包含在seqid02和seqid17中或由seqid02和seqid17组成。鼠可变结构域框架区可以使用本领域已知的各种方法进行人源化。人源化的可变结构域的例子,对于vh结构域,在seqid3至15(seqid3;4;5;6;7;8;9;10;11;12;13;14;15)中给出或包含在seqid3至15中或由seqid3至15组成,并且对于vl结构域在seqid18至25(seqid18;19;20;21;22;23;24;25)中给出或包含在seqid18至25中或由seqid18至25组成。人源化框架残基是优选的,因为通常认为它们具有较低的抗原性和/或免疫原性。因此,优选的融合蛋白如本发明的tb-5t4将具有seqid3-15的vh序列与seq-id18-25的vl序列的组合。因此,一个实施方式涉及一种融合蛋白,诸如本发明的tb-5t4,其具有vh序列与vl序列的组合,该vh序列包含与seqid3-15之一具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列之一或由该序列之一组成,该vl序列包含与seq-id18-25之一具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列之一或由该序列之一组成。然后,可以将功能组合格式化到vh-接头-vl或vl-接头-vh格式的二硫化物稳定的单链可变结构域(dsfv)中,或接枝到ch1和cl结构域上,以产生vhch1:vlclfab或vhcl:vlch1交叉-fab上。
可以类似的方式组装与cd3复合物的适合结合物。许多活化的cd-ε结合物的t细胞是本领域已知的。okt3是一种用于预防移植排斥反应的小鼠单克隆抗体。us6750325(cd3特异性重组抗体)和wo2008079713(使用具有降低毒性的免疫抑制性单克隆抗体治疗lada和其他成人发病的自身免疫性糖尿病的方法)教导了okt3序列(seqid26和seqid34或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)的用途。us7635475(新型双抗体型双特异性抗体)和wo2005040220(多特异性去免疫化cd3结合物)中公开了人源化形式的okt3可变序列。seqidno27;28;29(或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)中给出了人源化okt3源的vh结构域序列。seqidno35;36;37(或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)中给出了人源化okt3源的vl结构域序列。基于okt3可变结构域以产生scfv、dsfvfab或交叉-fab组合的cd3结合部分,可以由seqidno27-29(包含这些序列的序列或与这些序列之一具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)与seqidno35-37(包含这些序列的序列或与这些序列之一具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)制得。
与cd3结合的其它结合物因us7728114(抗cd3抗体及其使用方法)(seqidno30和38或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列);wo9404679(人源化抗体及其制备方法)(seqidno32和40或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)、us7381803(针对cd3的人源化抗体)(seqidno33和40或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)、或如lietal(2005)."constructionandcharacterizationofahumanizedanti-humancd3monoclonalantibody12f6witheffectiveimmunoregulationfunctions."immunology116(4):487-498的描述(seqidno31和39或包含这些序列的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列)而在本领域中已知。wo2008119567(跨物种特异性结合结构域)中描述了还结合至其它物种cd3分子的适合的抗cd3结合物的其它适合例子,以及wo2010037835教导了它们在创造双特异性t细胞衔接器中的用途。
在本发明的一个实施方式中,所选择的vh和vl的组合随后可被格式化为单链可变片段。这可以是取向vh-l2-vl或vl-l2-vh,其中l2是连接第一可变结构域的c末端氨基酸与第二可变结构域的n末端的接头序列。优选的接头长度为15-30个氨基酸,具有高度的柔性,同时具有最小的疏水性和免疫原性或抗原性。优选的接头的一个例子是(ggggs)3接头,可能扩展有稍更多的(2-4)个小氨基酸。这种扩展的(gggs)3接头的例子是序列asggggsggggsggggsag。替代接头是本领域已知的并且已被优化以最小化对抗体片段的结构阻碍,以增加稳定性或溶解度。可以评估本领域已知的接头以获得更优的scfv分子。可以通过与选择系统结合的随机化来获得l2接头的进一步优化。tangetal.1996“selectionoflinkersforacatalyticsingle-chainantibodyusingphagedisplaytechnology”,thejournalofbiologicalchemistry,271,15682-15686给出了此种优化的一个例子。
本发明的scfv可以通过引入二硫化物稳定形式的scfv进一步稳定化。wo9429350解释了哪些位置适合在vh的c末端半部与vl结构域之间进行工程化非天然二硫键。schiedletal,2000“expressionofabispecificdsfv–dsfv′antibodyfragmentinescherichiacoli”proteineng.(2000)13(10):725-734描述了其它例子。不同于这些出版物的教导,令人惊奇的是,本发明的优选分子使用单个肽分子,其是通过在适当的vh和vl之间的工程改造的二硫键进一步稳定的单链可变片段。这防止了由于cd3结合物的多聚化导致形成的高活化复合物。令人惊讶的是,即使在融合蛋白中存在的两种不同scfv中的域间二硫键进行工程化,也没有形成错配对。同样令人惊讶的是,本发明的融合蛋白中完全不存在二硫化物错配,考虑到融合蛋白已经含有8个域内和1个链间二硫键,并且现在引入了另外两个域间二硫键。还令人惊讶的是,本发明融合蛋白具有整个分子的更高稳定性。一个例子是当ds稳定新型人源化形式的cd3结合scfv(okt3)(dshuokt3-31)时t细胞活化效力令人惊讶的增加。对于5t4结合物,组合的vh/vl结合结构域(即也称为组合的vh/vl)的序列在seqidno42(scfv5t4);seqidno43(scfvhu5t4);seqidno44(dsfvhu5t4)中给出。其中结合基于okt3的用于组合的vh/vl结合结构域与cd3结合的序列是seqidno45(scfvokt3);seqidno46(scfvhuokt3v32)和seqidno47(dsfvhuokt3v32)。在本发明的另一实施方式中,融合蛋白含有基于seqidno48中的ucht1的人源化二硫化物稳定的cd3结合物(dsfvhuucht1-24)。显然,基于seqid1-41中的序列表(即也称为融合蛋白的人工序列部分),本领域技术人员可以制备其它功能组合。本发明还涵盖了包含这些序列(即seqidno:42、43、44、45、46、47、48)的序列或与这些序列具有至少60%、70%、80%、90%、95%、97%、98%、99%同一性的序列。本领域还已知将负责抗原结合的区域移植到不同的框架上。抗原结合位点由6个不同的互补决定区(cdr)组成,由“游标”区中的结构性疏水核支持。cdr和必要支持序列的接枝在us8399625的教导中,并且经常用于将来自不同物种的抗原结合位点与人框架残基组合,如例如wo9109967;us5225539;us5693761或us5821337中所公开的。取决于抗体,不是cdr环中的所有序列都是必需的,并且必需位置可以通过丙氨酸扫描诱变来确定。此处,cdr环中的每个氨基酸被改变为ala并进行结合评价。wo2012038609“super-humanizedantibodies”和pelatetal(2011)“engineeringthevariableregionoftherapeuticiggantibodies”mabs3(3):243–252中描述了确定最小残基以保护抗原结合位点的技术的更新的和优选的变型。本领域技术人员可以容易地将本发明的融合蛋白中包含的抗原结合位点改变为如seqid1-41所列的不同框架。
一旦鉴定了所需的v结构域,则需要选择匹配对以接枝到fab恒定域ch1和cl上。该技术产生含有v结构域(vh和vl)和c-结构域(ch1和cl)的非天然组合的“嵌合”fab分子。可以通过与天然fab序列的同源性来引导取代,以便不破坏可影响结合和稳定性的fab折叠。fab嵌合化在本领域中有充分描述(参见例如,us20030095964,生产人源化嵌合体抗体的方法“。甚至在vhcl:vlch1配置中创建交叉-fab链也被充分地描述,并允许v结构域的成功接枝(参见例如fennetal.(2013)."crystalstructureofananti-ang2crossfabdemonstratescompletestructuralandfunctionalintegrityofthevariabledomain."plosone8(4):e61953)。
在本发明的一个实施方式中,fab衍生链(一方面是含ch1的链和另一方面是含cl的链)的c末端氨基酸将以所选择的接头序列l1连接到所选择的scfv或dsfv或单个结构域结合物或效应子分子(衍生自抗体或非抗体)。l1可以与单个氨基酸一样短,只要在功能上是需要的。优选地,l1应该在两个scfv衍生的结构单元和fab衍生的部分之间引入一些空间。还优选地,l1应当具有一些接头的柔性。可以优化l1的长度以适应表位和cd3的位置之间的最佳距离。在hombachetal.(2007)."tcellactivationbyantibody-likeimmunoreceptors:thepositionofthebindingepitopewithinthetargetmoleculedeterminestheefficiencyofactivationofredirectedtcells."jimmunol178(7):4650-4657;和guestetal.(2005)."theroleofextracellularspacerregionsintheoptimaldesignofchimericimmunereceptors:evaluationoffourdifferentscfvsandantigens."jimmunother28(3):203-211中可以找到此种例子。接头序列的组成可以优化刚性、蛋白酶抗性或含有附加功能。
在优选的实施方式中,对于基于鼠5t4结合物(tb535c)的融合蛋白,本发明的融合蛋白包含序列seqidno49(含ch1的链)和seqidno50(含cl的链),并且对于基于人源化5t4结合物(tb535h)的本发明的融合蛋白,其含有seqidno51(含ch1的链)和seqidno52(含cl的链)。
在优选的实施方式中,对于基于鼠5t4结合物(tb535c)的融合蛋白,本发明的融合蛋白包含与seqidno49具有至少90%、95%、96%、97%、98%、99%或100%同一性的序列(含ch1的链)和与seqidno50具有至少90%、95%、96%、97%、98%、99%或100%同一性的序列(含cl的链)。在另一优选的实施方式中,对于基于人源化5t4结合物(tb535h)的本发明的融合蛋白,本发明的融合蛋白包含与seqidno51具有至少90%、95%、96%、97%、98%、99%或100%同一性的序列(含ch1的链)和与seqidno52具有至少90%、95%、96%、97%、98%、99%或100%同一性的序列(含cl的链)。
在优选的实施方式中,对于基于鼠5t4结合物(tb535c)的融合蛋白,本发明的融合蛋白包含序列seqidno49(含ch1的链)和seqidno50(含cl的链)或由它们组成。在另一优选的实施方式中,对于基于人源化5t4结合物(tb535h)的本发明的融合蛋白,本发明的融合蛋白包含序列seqidno51(含ch1的链)和seqidno52(含cl的链)或由它们组成。
使用tb535h获得了最佳效果:令人惊讶的是,它具有紧凑的构型(图5a)。因此,可以认为它是相当稳定的(图6ad),并且它更容易生产(图7d中获得最佳产率)。此外,令人惊讶地发现,这种融合蛋白具有大的分布体积和缓慢的清除(图10)。最后,该融合蛋白的活性对于不同的肿瘤类型是最佳的(图9、11a、11b)。
在一个实施方式中,本发明的融合蛋白包含一个或两个vh结合结构域,其由seqidno:1至15中的任一个组成、或包含seqidno:1至15中的任一个、或与seqidno:1至15中的任一个具有至少90%的同一性。优选的vh由seqidno:6组成的序列、或包含seqidno:6的序列、或与seqidno:6具有至少90%同一性的序列表示。在另一实施方式中,本发明的融合蛋白包含一个或两个vl结合结构域,该vl结合结构域由seqidno:16至25中的任何一个组成、或包含seqidno:16至25中的任何一个、或与seqidno:16至25中的任何一个具有至少90%的同一性。由seqidno:19组成的序列、或包含seqidno:19的序列、或与seqidno:19具有至少90%同一性的序列代表了优选的vl。优选地,本发明的融合蛋白包含seqidno:1至15中的任何一个与seqidno:16至25中的任何一个的组合。更优选的本发明的融合蛋白包含由seqidno:6组成的序列、包含seqidno:6的序列或与seqidno:6具有至少90%同一性的序列表示的vh与由seqidno:19组成的序列、包含seqidno:19的序列或与seqidno:19具有至少90%同一性的序列表示的vl的组合。
在本发明的另一实施方式中,融合蛋白i)包含一个或多个vh结合结构域,该vh结合结构域由seqidno:26至33中的任何一个组成、或包含seqidno:26至33中的任何一个、或与seqidno:26至33中的任何一个具有至少90%的同一性,或ii)包含一个或两个vl结合结构域,该vl结合结构域由seqidno:34至41中的任何一个组成、或包含seqidno:34至41中的任何一个、或与seqidno:34至41中的任何一个具有至少90%的同一性。在优选的实施方式中,本发明的融合蛋白包含seqidno:26至33中的任何一个与seqidno:34至41中的任何一个的组合。更优选地,融合蛋白i)包含一个或两个vh结合结构域,该vh结合结构域由seqidno:29组成、或包含seqidno:29、或与seqidno:29具有至少90%的同一性,或ii)包含一个或两个vl结合结构域,该vl结合结构域由seqidno:37组成、或包含seqidno:37、或与seqidno:37具有至少90%的同一性。
在优选的实施方式中,本发明的融合蛋白包含一个或两个组合的vh/vl结合结构域,该组合的vh/vl结合结构域由seqidno:42至44中的任何一个或seqidno:45至48中的任何一个组成、或包含seqidno:42至44中的任何一个或seqidno:45至48中的任何一个、或与seqidno:42至44中的任何一个或seqidno:45至48中的任何一个具有至少90%的同一性,更特别地,其中一个或两个组合的vh/vl结合结构域由seqidno:42至44中的任何一个组成、或包含seqidno:42至44中的任何一个、或与seqidno:42至44中的任何一个具有至少90%的同一性,并且剩余的一个或两个组合的vh/vl结合结构域由seqidno:45至48中的任何一个组成、或包含seqidno:45至48中的任何一个、或与seqidno:45至48中的任何一个具有至少90%的同一性。在更优选的实施方式中,本发明的融合蛋白的一条链包含seqidno:49,而另一条链包含seqidno:50,或其中一条链包含seqidno:51且另一条链包含seqidno:52。
本发明还包括编码本文所述的本发明的融合蛋白的核酸序列,以及包含该核酸序列的载体、或用该核酸序列或该载体转化或转染的宿主细胞。
本发明还由一种用于生产本发明的融合蛋白的方法构成或包含该方法,其中所述方法包含在允许表达本发明的融合蛋白的条件下培养如上定义的宿主细胞,以及从培养物中回收所产生的融合蛋白。
在优选的实施方式中,本发明是一种药物组合物,其包含本发明的融合蛋白,或根据上述方法制备的,其用作药物,更具体地说,其用于预防、治疗或改善选自增殖性疾病、肿瘤疾病或免疫学障碍的疾病。本发明还提供了包含本发明的融合蛋白、如上所述的核酸分子、如上所述的载体或如上所述的宿主细胞的试剂盒。
本发明的融合蛋白优选为“分离的”融合蛋白。用于描述本文公开的融合蛋白的“分离”是指已经从其生产环境的组分中鉴定、分离和/或回收的融合蛋白。优选地,分离的融合蛋白与其生产环境中的所有其它组分无关。其生产环境的污染成分(例如由重组转染细胞产生的污染成分)是通常会干扰多肽的诊断或治疗用途的材料,并且可以包括酶、激素和其它蛋白质或非蛋白质溶质。在优选的实施方式中,融合蛋白将被纯化(1)至足以通过使用旋转杯式测序仪获得至少15个n末端或内部氨基酸序列残基的程度,或(2)使用考马斯兰或优选银染,在非还原或还原条件下通过sds-page的均一性。然而,通常通过至少一个纯化步骤制备分离的抗体。本领域技术人员将理解,本发明的融合蛋白本质上不会原样发生。其是通过重组分子生物学技术生产的。
在本发明的上下文中,蛋白质由氨基酸序列表示。在本发明的上下文中,优选的蛋白质是本文鉴定的融合蛋白或其链。
在本发明的上下文中,作为编码这种蛋白质或融合蛋白或其链的核酸分子的核酸分子由核酸或核苷酸序列表示。核酸分子可以包含调节区。
应当理解,在本文中通过给定的序列同一性(seqidno)鉴定的每种蛋白质不限于所公开的该特定序列,而且还包括表现出与本文之前定义的相似活性的蛋白质变体或其衍生物。对于由给定的seqidno:x(例如)鉴定并编码这种蛋白质的每个核酸分子也是如此:本发明还涵盖编码与由seqidno:x最初编码的蛋白质之一具有相似活性的蛋白质的核酸分子变体或衍生物。在本文中,活性可以是融合蛋白与5t4的结合和/或诱导的5t4表达细胞(优选肿瘤细胞)的致死。更优选地,所述结合和/或致死的评估如在图8所示的实验中进行。
在本申请中,每次韧提及编码给定蛋白质或融合蛋白或其链的特定核苷酸序列seqidno(以seqidno:x为例),可以将其替换为:
i.包含与seqidno:x具有至少60%序列同一性或相似性的核苷酸序列的核苷酸序列;
ii.核苷酸序列,其互补链与(i)的序列的核酸分子杂交;
iii.由于遗传密码的简并性,序列与(i)或(ii)的核酸分子的序列不同的核苷酸序列;或,
iv.编码与由核苷酸序列seqidno:x编码的氨基酸序列具有至少60%氨基酸同一性或相似性的氨基酸序列的核苷酸序列。
在本申请中,每次提及具体的氨基酸序列seqidno(以seqidno:y为例)时,可以将其替换为:蛋白质或融合蛋白或其链,其包含与氨基酸序列seqidno:y具有至少60%的序列同一性或相似性的氨基酸序列。
本文所述的每个核苷酸序列或氨基酸序列由于其分别与给定核苷酸序列或氨基酸序列的同一性或类似性百分比(60%),在进一步优选的实施方式中,其分别与给定的核苷酸序列或氨基酸序列具有至少65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或更高的同一性或类似性。在优选的实施方式中,通过比较本文鉴定的序列的整个长度来确定序列同一性或相似性。除非本文另有说明,否则与给定seqidno的同一性或相似性是指基于所述序列的全长(即在其整个长度或整体上)的同一性或相似性。
“序列同一性”在本文中定义为两个或更多个氨基酸(多肽或蛋白)序列或两个或多个核酸(多核苷酸)序列之间的关系,如通过比较序列确定。在优选的实施方式中,基于两个给定seqidno或其部分的全长来计算序列同一性。其部分是指两个seqidno的至少10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在本领域中,“同一性”还指通过这种序列的串之间的匹配确定的氨基酸或核酸序列之间的序列相关性程度(视情况而定)。
通过将一个多肽的氨基酸序列及其保守氨基酸替代物与第二多肽的序列进行比较来确定两个氨基酸序列之间的“相似性”。“同一性”和“相似性”可容易地通过已知方法计算,所述方法包括但不限于(computationalmolecularbiology,lesk,a.m.,ed.,oxforduniversitypress,newyork,1988;biocomputing:informaticsandgenomeprojects,smith,d.w.,ed.,academicpress,newyork,1993;computeranalysisofsequencedata,parti,griffin,a.m.,andgriffin,h.g.,eds.,humanapress,newjersey,1994;sequenceanalysisinmolecularbiology,vonheine,g.,academicpress,1987;和sequenceanalysisprimer,gribskov,m.anddevereux,j.,eds.,mstocktonpress,newyork,1991;以及carillo,h.,andlipman,d.,siamj.appliedmath.,48:1073(1988)中描述的那些。
设计确定同一性的优选方法是为了给出所测序列之间的最大匹配。确定同一性和相似性的方法在公共可用的计算机程序中编纂。确定两个序列之间的同一性和相似性的优选计算机程序方法包括例如gcg程度包(devereux,j.,etal.,nucleicacidsresearch12(1):387(1984))、bestfit、blastp、blastn和fasta(altschul,s.f.etal.,j.mol.biol.215:403-410(1990)。blastx程序可从ncbi和其他来源公开获取(blastmanual,altschul,s.,etal.,ncbinlmnihbethesda,md20894;altschul,s.,etal.,j.mol.biol.215:403-410(1990)。众所周知的smithwaterman算法也可以用来确定同一性。
多肽序列比较的优选参数包括:算法:needlemanandwunsch,j.mol.biol.48:443-453(1970);比较矩阵:blossum62,来自hentikoffandhentikoff,proc.natl.acad.sci.usa.89:10915-10919(1992);空位罚分:12;和空位长度罚分:4。与这些参数有用的程序可以从位于wi麦迪逊的遗传学计算机集团(geneticscomputergroup)作为“ogap”程序公开获得。上述参数是氨基酸比较的默认参数(连同终点空位没有罚分)。
核酸比较的优选参数包括:算法:needlemanandwunsch,j.mol.biol.48:443-453(1970);比较矩阵:匹配=+10,错配=0;空位罚分:50;空位长度罚分:3。从位于wis麦迪逊的遗传计算机集团作为gap程序获得。以上是核酸比较的默认参数。
任选地,在确定氨基酸相似性程度时,本领域技术人员还可以考虑所谓的“保守”氨基酸取代,这对本领域技术人员将是清楚的。保守氨基酸取代是指具有相似侧链的残基的互换性。例如,具有脂肪族侧链的一组氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;一组具有脂肪族-羟基侧链的氨基酸是丝氨酸和苏氨酸;一组含酰胺侧链的氨基酸是天门冬酰胺和谷氨酰胺;具有芳族侧链的一组氨基酸是苯丙氨酸、酪氨酸和色氨酸;一组具有碱性侧链的氨基酸是赖氨酸、精氨酸和组氨酸;和一组具有含硫侧链的氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代基是:缬氨酸-亮氨酸-异亮氨酸,苯丙氨酸-酪氨酸,赖氨酸-精氨酸,丙氨酸-缬氨酸和天冬酰胺-谷氨酰胺。本文公开的氨基酸序列的替代变体是其中所公开序列中的至少一个残基已经被去除并且在其位置插入了不同残基的那些。优选地,氨基酸变化是保守的。每种天然存在的氨基酸的优选保守取代如下:ala至ser;arg至lys;asn至gln或his;asp至glu;cys至ser或ala;gln至asn;glu至asp;gly至pro;his至asn或gln;ile至leu或val;leu至ile或val;lys至arg;gln或glu;met至leu或ile;phe至met,leu或tyr;ser至thr;thr至ser;trp至tyr;tyr至trp或phe;以及val至ile或leu。
包含的几种类型的融合蛋白变体如下所述。预期了本文所述的融合蛋白的氨基酸序列修饰。例如,可能需要改善抗体的结合亲和力和/或其他生物学性质。通过将适当的核苷酸变化引入融合蛋白核酸或通过肽合成来制备融合蛋白的氨基酸序列变体。
这样的修饰包括,例如,融合蛋白的氨基酸序列内的残基的缺失、和/或插入和/或取代。进行缺失、插入和取代的任何组合以获得最终构建体,只要最终构建体具有所需的特征即可。氨基酸变化也可以改变融合蛋白的翻译后过程,例如改变糖基化位点的数目或位置。优选地,在cdr中可以取代1、2、3、4、5、6、7、8、9或10个氨基酸,而在fr中可以取代1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25个氨基酸。取代优选如本文所述的保守取代。附加地或替代地,可以在每个cdr中插入或缺失1、2、3、4、5或6个氨基酸(当然,取决于它们的长度),而在每个fr中可以插入或缺失1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或25个氨基酸。
用于鉴定作为诱变优选位置的融合蛋白的某些残基或区域的有用方法称为“丙氨酸扫描诱变”,如cunningham和wells在科学(science),244:1081-1085(1989)中所描述的。此处,鉴定了融合蛋白内的残基或一组靶残基(例如,诸如arg、asp、his、lys和glu等带电残基),并且由中性或带负电荷的氨基酸(最优选丙氨酸或聚丙氨酸)替换以影响氨基酸与表位的相互作用。
然后,通过在或为取代位点引入进一步的或其他的变体,来改进显示出对取代的功能敏感性的那些氨基酸位置。因此,当氨基酸序列变异的引入部位是预先确定的时,突变本身的性质不需要预先确定。例如,为了分析在给定位点处的突变的性能,在靶密码子或区域进行ala扫描或随机诱变,并对所表达的融合蛋白变体筛选所需的活性。
优选地,氨基酸序列插入包括长度从一个、二个、三个、四个、五个、六个、七个、八个、九个或十个残基到含有一百或更多个残基的多肽的氨基和/或羧基末端融合,以及单个或多个氨基酸残基的序列内插入。融合蛋白的插入变体包括与抗体或酶的n-或c-末端融合或与多肽的融合,这增加抗体的血清半衰期。
另一种类型的变体是氨基酸取代变体。这些变体优选在融合蛋白中有至少一个、二个、三个、四个、五个、六个、七个、八个、九个或十个氨基酸残基被不同残基取代。取代诱变最令人感兴趣的位点包括重链和/或轻链的cdr,特别是高变区,但也设想了重链和/或轻链中的fr改变。
例如,如果cdr序列包含6个氨基酸,则设想了这些氨基酸中的一个、两个或三个被取代。类似地,如果cdr序列包含15个氨基酸,则设想这些氨基酸中的一个、二个、三个、四个、五个或六个被取代。
通常,如果氨基酸在重链和/或轻链的一个或多个或全部cdr中被取代,则优选地,所获得的“取代的”序列与本文先前描述的“原始”cdr序列具有至少60%、更优选65%、甚至更优选70%、特别优选75%、更特别优选80%的同一性。这意味着与“取代的”序列同一程度取决于cdr的长度。例如,具有5个氨基酸的cdr优选与其取代的序列80%同一,以具有至少一个氨基酸取代。因此,融合蛋白的cdr可以与其取代的序列具有不同程度的同一性,例如cdrl1可以具有80%,而cdrl3可以具有90%。优选的取代(或替代)是保守取代。然而,设想了任何取代(包括非保守取代),只要融合蛋白保留了其通过第一结合结构域结合5t4以及通过第二结合结构域结合cd3的能力和/或其cdr具有与如此取代的序列具有同一性(与“原始”cdr序列具有至少60%,更优选65%,甚至更优选70%,特别优选75%,更特别优选80%的同一性)。
本文考虑了融合蛋白的其它修饰。例如,融合蛋白可以连接到多种非蛋白质聚合物之一,例如聚乙二醇、聚丙二醇、聚氧化烯、或聚乙二醇和聚丙二醇的共聚物。融合蛋白也可以被俘获在例如通过凝聚技术或界面聚合制备的微胶囊中(例如,分别为羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)、在胶体药物递送系统中(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊);或在宏乳液中。remington的药物科学(pharmaceuticalsciences),第16版,oslo,a.,ed.,(1980)中公开了此类技术。本文公开的融合蛋白还可以配制成免疫脂质体。“脂质体”是由各种类型的脂质、磷脂和/或表面活性剂组成的小囊泡,其可用于向哺乳动物递送药物。脂质体的组分通常排列成双层形式,类似于生物膜的脂质排列。含有抗体的脂质体通过本领域已知的方法制备,诸如epsteinetal.,proc.natl.acad.sci.usa,82:3688(1985);hwangetal.,proc.natlacad.sci.usa,77:4030(1980);美国专利号4,485,045和4,544,545;以及1997年10月23日公开的w097/38731中的描述。美国专利号5,013,556中公开了具有增强循环时间的脂质体。特别有用的脂质体可以通过反相蒸发法,使用包含磷脂酰胆碱、胆固醇和peg衍生的磷脂酰乙醇胺(peg-pe)的脂质组合物产生。将脂质体通过规定孔径的过滤器挤出以产生具有所需直径的脂质体。可将本发明抗体的fab'片段通过二硫化物交换反应与脂质体缀合,如martinetal.j.biol.chem.257:286-288(1982)所述。化学治疗剂任选地被包含在脂质体内,参见gabizonetal.j.nationalcancerinst.81(19)1484(1989)。
当使用重组技术时,融合蛋白可以在细胞内产生、在周质空间中产生、或直接分泌到培养基中。如果在细胞内产生融合蛋白,则作为第一步,除去颗粒碎片、宿主细胞或裂解的片段,例如通过离心或超滤。carteretal.,bio/technology10:163-167(1992)描述了用于分离分泌到大肠杆菌周质空间的抗体的程序。
从细胞制备的融合蛋白组合物,可以使用例如羟基磷灰石层析、凝胶电泳、透析和亲和层析纯化,亲和层析是优选的纯化技术。
另一方面,本发明涉及编码本发明融合蛋白的核酸序列。所述核酸分子优选包含在载体中,该载体优选包含在宿主细胞中。所述宿主细胞例如在用本发明的核酸序列转化或转染后能够表达融合蛋白。为此,核酸分子与控制序列可操作地连接。
如本文所用,术语“宿主细胞”旨在表示通过转化、转染等引入了编码本发明的融合蛋白的核酸的细胞。应当理解的是,这样的术语不仅指特定的受试者细胞,而且指这种细胞的后代或潜在后代。由于突变或环境影响,后代可能发生某些改变,所以这种后代实际上可能不与亲本细胞相同,但仍包含在本文所用术语的范围内。
如本文所用的术语“表达”包括在本发明的融合蛋白的生产中涉及的任何步骤,包括但不限于转录、转录后修饰、翻译、翻译后修饰和分泌。术语“控制序列”是指在特定宿主生物中表达可操作地连接的编码序列所必需的dna序列。适用于原核生物的控制序列例如包括启动子、任选的操纵子序列和核糖体结合位点。已知真核细胞利用启动子、聚腺苷酸化信号和增强子。
当核酸与另一种核酸序列置于功能关系时,该核酸是“可操作地连接的”。例如,如果前序列或分泌前导序列的dna被表达为参与多肽分泌的前蛋白,则该前序列或分泌前导序列的dna可操作地连接到多肽的dna;如果启动子或增强子影响序列的转录,则其与编码序列可操作地连接;或者核糖体结合位点如果被定位以有利于翻译,则其与编码序列可操作地连接。通常,“可操作地连接”是指被连接的dna序列是连续的,并且在分泌前导序列的情况下,其是连续的且在读取阶段。然而,增强子不必是连续的。通过在方便的限制位点连接来实现连接。如果这些位点不存在,则按照常规实践使用合成的寡核苷酸衔接子或接头。合适的宿主细胞包括原核生物和真核宿主细胞,包括酵母、真菌、昆虫细胞和哺乳动物细胞。本发明的融合蛋白可以在细菌中生产。
表达后,本发明的融合蛋白,优选融合蛋白从可溶性级分中的大肠杆菌细胞糊中分离,并可以通过例如亲和层析和/或尺寸排阻来纯化。最终纯化可以类似于用于纯化例如在cho细胞中表达的抗体的方法进行。除了原核生物之外,真核微生物如丝状真菌或酵母是本发明的融合蛋白的合适的克隆或表达宿主。酿酒酵母(saccharomycescerevisiae)或普通面包酵母是最常用于低等真核宿主微生物。然而,许多其他属、物种和菌株在本文中通常是可获得且有用的,例如粟酒裂殖酵母;克鲁维链霉菌宿主,诸如乳酸克鲁维酵母、脆壁克鲁维酵母(atcc12424)、保加利亚克鲁维酵母(atcc16045),k.wickeramii(atcc24178)、k.waltii(atcc56500)、果蝇克鲁维酵母(atcc36906)、耐热克鲁维酵母和马克斯克鲁维酵母;耶氏酵母(ep402226);巴斯德毕赤酵母(ep183070);念珠菌属;里氏木霉(ep244234);粗糙链孢霉;许旺酵母诸如西方许旺酵母;和丝状真菌如例如脉孢菌属、青霉菌属、弯颈霉属和曲霉菌宿主诸如构巢曲霉和黑曲霉。
用于表达本发明的糖基化融合蛋白的合适的宿主细胞,优选抗体衍生的融合蛋白衍生自多细胞生物体。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定了许多杆状病毒菌株和变体以及来自诸如草地贪夜蛾(毛虫)、埃及伊蚊(蚊子)、白纹伊蚊(蚊子)、黑腹果蝇(果蝇)和家蚕等宿主的相应的许可昆虫宿主细胞。用于转染的各种病毒株可公开获得,例如,苜蓿尺蠖(autographacalifornica)npv的l-1变体和家蚕npv的bm-5菌株,并且这些病毒可以用作根据本发明的病毒,特别是用于转染草地贪夜蛾细胞。
棉花、玉米、马铃薯、大豆、矮牵牛、番茄、拟南芥和烟草的植物细胞培养物也可用作宿主。有用于在植物细胞培养物中生产蛋白质的克隆和表达载体是本领域技术人员已知的。参见例如hiattetal.,nature(1989)342:76-78,owenetal.(1992)bio/technology10:790-794,artsaenkoetal.(1995)theplantj8:745-750,和feckeretal.(1996)plantmolbiol32:979-986。
然而,对脊椎动物细胞的兴趣最大,并且脊椎动物细胞在培养(组织培养)中的繁殖已成为常规程序。有用的哺乳动物宿主细胞系的实例是由sv40转化的猴肾cv1系(cos-7,atcccrl1651);人类胚胎肾细胞系(亚克隆以用于在悬浮培养物中生长的293或293细胞,grahametal.,j.genvirol.36:59(1977));小仓鼠肾细胞(bhk,atccccl10);中国仓鼠卵巢细胞/-dhfr(cho,urlaubetal.,proc.natl.acad.sci.usa77:4216(1980));小鼠sertoli细胞(tm4,mather,biol.reprod.23:243-251(1980));猴肾细胞(cviatccccl70);非洲绿猴肾细胞(vero-76,atcccrl1587);人宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);水牛大鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,14138065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(matheretal.,annalsn.yacad.sci.383:44-68(1982));mrc5细胞;fs4细胞;和人肝癌细胞系(hepg2)。当使用重组技术时,本发明的融合蛋白可以在细胞内产生、在周质空间中产生或直接分泌到培养基中。如果在细胞内产生融合蛋白,则作为第一步,除去颗粒碎片、宿主细胞或裂解的片段,例如通过离心或超滤。carteretal.,bio/technology10:163-167(1992)描述了一种用于分离分泌到大肠杆菌的周质空间的抗体的程序。简言之,在乙酸钠(ph3.5)、edta和苯甲基磺酰氟(pmsf)的存在下,将细胞糊解冻约30分钟。细胞碎片可以通过离心去除。当抗体分泌到培养基中时,通常首先使用市售的蛋白质浓缩过滤器(例如amicon或milliporepellicon超滤单元),浓缩来自这种表达系统的上清液。蛋白酶抑制剂如pmsf可以包括在任何前述步骤中以抑制蛋白水解,并且可以包括抗生素以防止外来污染物的生长。
从宿主细胞制备的本发明的融合蛋白可以使用例如羟基磷灰石层析、凝胶电泳、透析和亲和层析纯化,亲和层析是优选的纯化技术。亲和配体所附接的基质通常是琼脂糖,但其他基质是可用的。机械稳定的基质如可控孔隙玻璃或聚(苯乙烯二乙烯基)苯允许比琼脂糖实现更快的流速和更短的处理时间。当本发明的融合蛋白包含ch3结构域时,bakerbondabxmresin(j.t.baker,phillipsburg,nj)有用于纯化。取决于待回收的抗体,也可以使用用于蛋白质纯化的其它技术,例如离子交换柱上的分级、乙醇沉淀、反相hplc、二氧化硅色谱法、在肝素sepharosetm上进行的色谱法、在阴离子或阳离子交换树脂(例如聚天冬氨酸柱)上进行的色谱法、色谱聚焦、sds-page和硫酸铵沉淀。在另一方面,提供了用于产生本发明的融合蛋白的方法,所述方法包括在允许融合蛋白表达的条件下培养本文定义的宿主细胞和从培养物中回收产生的融合蛋白。在替代实施方式中,提供了包含本发明的融合蛋白的组合物或根据本发明的方法制备的组合物。优选地,所述组合物是药物组合物。
如本文所用,术语“药物组合物”涉及用于向患者优选人类患者给药的组合物。本发明的特别优选的药物组合物包含本发明的融合蛋白。优选地,药物组合物包含载体、稳定剂和/或赋形剂的合适配方。在优选的实施方式中,药物组合物包含用于胃肠外、透皮、管腔内、动脉内、鞘内和/或鼻内给药或通过直接注射到组织中的组合物。特别设想了通过输注或注射将所述组合物给药于患者。合适的组合物的给药可以通过不同的方式进行,例如通过静脉内、腹膜内、皮下、肌内、局部或皮内给药。特别地,本发明提供了不间断地给药合适的组合物。作为非限制性实例,不间断即连续给药,可以由患者佩戴的小型泵系统实现,其用于计量流入患者体内的治疗剂。可以通过使用所述泵系统来给药包含本发明的融合蛋白的药物组合物。这种泵系统在本领域中通常是已知的,并且通常依赖于周期性地更换含有待注入的治疗剂的药筒。当更换在这种泵系统中的药筒时,可能会暂时中断治疗剂进入患者体内的本来不间断的流动。在这种情况下,药筒更换之前的给药阶段和药筒更换后的给药阶段仍将被认为处于本发明的药物装置和方法的含义范围内,共同构成了这种治疗剂的“不间断给药”。
本发明的这些融合蛋白的连续或不间断给药,可以是通过流体递送装置或小型泵系统进行静脉内或皮下注射,所述流体输送装置或小型泵系统包括用于将流体驱出储存器的流体驱动机构和用于致动驱动机构的致动机构。用于皮下给药的泵系统可以包括用于穿透患者皮肤的针或套管,并将合适的组合物输送到患者体内。所述泵系统可以独立于静脉、动脉或血管而直接固定或附接到患者的皮肤,从而允许泵系统和患者皮肤之间的直接接触。泵系统可以附接到患者的皮肤24小时至几天。泵系统可以是小尺寸的,具有用于小体积的储存器。作为非限制性实例,用于等给药的合适药物组合物的储存器的体积可以在0.1至50ml之间。
连续给药可以通过穿在皮肤上的贴剂透皮,并间隔更换。本领域技术人员知道适合于此目的的用于药物递送的贴剂系统。值得注意的是,透皮给药特别适合于不间断的给药,因为第一个耗尽的贴剂的更换可以有利地与新的第二贴剂的放置同时进行,例如在与第一个耗尽的贴片紧邻的皮肤表面上并且在去除第一个耗尽的贴片之前进行。不会出现流量中断或电池故障的问题。
本发明的组合物还可以包含药学上可接受的载体。合适的药物载体的实例是本领域公知的,包括溶液,例如磷酸盐缓冲盐水溶液、水、乳液如油/水乳液、各种类型的润湿剂、无菌溶液、脂质体等。包含这种载体的组合物可以通过公知的常规方法进行配制。配方可以包含碳水化合物、缓冲溶液、氨基酸和/或表面活性剂。碳水化合物可以是非还原糖,优选海藻糖、蔗糖、八硫酸盐、山梨糖醇或木糖醇。通常,如本文所用的“药学上可接受的载体”是指与药物给药相容的任何和所有溶剂、分散介质、包衣、抗菌和抗真菌剂、等渗剂和吸收延迟剂。这种介质和试剂用于药物活性物质的用途是本领域公知的。可接受的载体、赋形剂或稳定剂在使用的剂量和浓度下对接受者无毒,包括:额外的缓冲剂;防腐剂;共溶剂;抗氧化剂,包括抗坏血酸和甲硫氨酸;螯合剂如edta;金属络合物(例如zn-蛋白复合物);可生物降解聚合物,如聚酯;盐形成抗衡离子,如钠、多元糖醇;氨基酸,如丙氨酸、甘氨酸、天冬酰胺、2-苯丙氨酸和苏氨酸;糖或糖醇,例如海藻糖、蔗糖、八硫酸盐、山梨糖醇或木糖醇、水苏糖、甘露糖、山梨糖、木糖、核糖、肌糖蛋白(myoinisitose)、半乳糖、乳糖醇、核糖醇、肌醇六糖、半乳糖醇、甘油、环醇(例如肌醇)、聚乙二醇;含硫还原剂,如谷胱甘肽、硫辛酸、巯基乙酸钠、硫代甘油、α-单硫代甘油、和硫代硫酸钠;低分子量蛋白质,例如人血清白蛋白、牛血清白蛋白、明胶或其他免疫球蛋白;和亲水性聚合物,如聚乙烯吡咯烷酮。这样的配方可以用于连续给药,其可以是在有或没有泵系统的条件下的静脉内或皮下给药。氨基酸可以是带电氨基酸,优选赖氨酸、乙酸赖氨酸、精氨酸、谷氨酸和/或组氨酸。表面活性剂可以是洗涤剂(优选分子量为>1.2kd)和/或聚醚,优选分子量>3kd。优选洗涤剂的非限制性实例是吐温20、吐温40、吐温60、吐温80或吐温85。优选聚醚的非限制性实例是peg3000、peg3350、peg4000或peg5000。用于本发明的缓冲体系可以具有5-9的优选ph,并且可以包含柠檬酸盐、琥珀酸盐、磷酸盐、组氨酸和乙酸盐。
本发明的组合物可以以适当的剂量施用于受试者,所述适当的剂量例如可以通过剂量递增研究来确定,其通过向非黑猩猩灵长类动物(例如猕猴)施用增加剂量的表现出本文所述的跨物种特异性的本发明多肽。如上所述,表现出本文所述的跨物种特异性的本发明的多肽,在非黑猩猩灵长类动物的临床前测试中可以有利地以相同形式使用以及在人类中作为药物使用。这些组合物也可以与其它蛋白质和非蛋白质药物组合施用。这些药物可以与包含本文定义的本发明的多肽的组合物同时施用,或以及时定义的间隔和剂量在施用所述多肽之前或之后分开施用。剂量方案由主治医师和临床因素决定。如医学领域中众所周知的,任何一位患者的剂量取决于许多因素,包括患者的体型、体表面积、年龄、要给药的具体化合物、性别、给药时间和途径、一般健康状况和同时施用的其他药物。
肠胃外给药的制剂包括无菌水性或非水性溶液、悬浮液和乳液。非水溶剂的实例是丙二醇、聚乙二醇、植物油如橄榄油、以及可注射的有机酯如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外赋形药包括氯化钠溶液、林格氏右旋糖、右旋糖和氯化钠、乳酸林格氏或固定油。静脉内赋形药包括流体和营养补充剂、电解质补充剂(例如基于林格氏右旋糖的那些)等。还可以存在防腐剂和其它添加剂,例如抗微生物剂、抗氧化剂、螯合剂、惰性气体等。此外,本发明的组合物可以包含蛋白质载体,例如血清白蛋白或免疫球蛋白,优选人源的。除了本文定义的本发明的多肽之外,设想了本发明的组合物还可以包含另外的生物活性剂,这取决于组合物的预期用途。此种药剂可以是作用于胃肠系统的药物,作为细胞静息(cytostatica)的药物、预防高尿酸血症的药物、抑制免疫反应的药物(例如皮质类固醇)、调节炎症反应的药物、作用于循环系统的药物和/或本领域中已知的药剂如细胞因子。还设想了将本发明的融合蛋白应用于联合疗法中,即与另一种抗癌药物组合使用。
本文定义的药物组合物的生物活性可以例如通过细胞毒性测定来确定,如以下实施例所述、wo99/54440中的描述或schlerethetal.(cancerimmunol.immunother.20(2005),1-12)的描述。本文所用的“功效”或“体内功效”是指通过本发明的药物组合物治疗的响应,例如使用标准化nci响应标准。使用本发明的药物组合物的治疗的成功或体内功效是指组合物用于其预期目的的有效性,即组合物引起其预期效果的能力,即病理细胞(例如肿瘤细胞)的消耗。可以通过针对各种疾病实体的已建立的标准方法监测体内功效,包括但不限于白细胞计数、微分、荧光活化细胞分选、骨髓抽吸。此外,可以使用各种疾病特异性临床化学参数和其他已建立的标准方法。此外,可以使用计算机辅助断层扫描、x射线、核磁共振断层扫描(例如,用于国家癌症研究所-基于标准的响应评估[chesonbd,horningsj,coiffierb,shippma,fisherrl,connorsjm,listerta,vosej,grillo-lopeza,hagenbeeka,cabanillasf,klippenstend,hiddemannw,castellinor,harrisnl,armitagejo,carterw,hopper,canellosgp.reportofaninternationalworkshoptostandardizeresponsecriteriafornon-hodgkin'slymphomas.ncisponsoredinternationalworkinggroup.jclinoncol.1999apr;17(4):1244])、正电子发射断层扫描、白细胞计数、微分、荧光活化细胞分选、骨髓抽吸、淋巴结活组织检查/组织学和各种淋巴瘤特异性临床化学参数(例如乳酸脱氢酶)和其他已建立的标准方法。
开发诸如本发明的药物组合物等药物的另一个主要挑战是药代动力学性质的可预测的调节。为此,可以建立药物候选物的药代动力学概况,即影响特定药物治疗给定病症的能力的药代动力学参数的概况。影响药物治疗某种疾病实体的能力的药物药代动力学参数包括但不限于:半衰期、分布体积、肝脏首过代谢和血清结合程度。给定药物的功效可以受到上述每个参数的影响。
“tmax”是达到药物最大血液浓度的时间,“cmax”是给定药物获得的最大量血液浓度。达到生物效应所需药物的血液或组织浓度的时间受到所有参数的影响。显示跨物种特异性的双特异性单链抗体的药代动力学参数,其可以如上所述在非黑猩猩灵长类动物的临床前动物测试中确定,也描述于例如schlerethetal.的出版物(cancerimmunol.immunother.20(2005),1-12)中。
本文所用的术语“毒性”是指在不良事件或严重不良事件中表现出的药物的毒性作用。这些副作用可能是指一般缺乏药物的耐受性和/或给药后缺乏局部耐受性。毒性还可能包括由药物引起的致畸或致癌作用。
本文所用的术语“安全性”、“体内安全性”或“耐受性”定义了药物的给药,而在给药后不直接诱导严重的不良事件(局部耐受),并且在施用药物的较长时间内也不诱导严重的不良事件。例如,可以在治疗和随访期间定期评估“安全性”、“体内安全性”或“耐受性”。测量包括临床评价,例如器官表现、筛查实验室异常。可以进行临床评估,并根据nci-ctc和/或meddra标准记录/编码与正常发现的偏差。器官表现可以包括诸如过敏/免疫学、血液/骨髓、心律失常、凝血等标准,例如在不良事件v3.0(ctcae)的常用术语标准中所阐述的。可以测试的实验室参数包括例如血液学、临床化学、凝血分布和尿液分析以及其他体液(如血清、血浆、淋巴或脊髓液、液体(liquor))的检查。因此,可以通过身体检查、成像技术(即超声、x线、ct扫描、磁共振成像(mri)、使用技术装置(例如心电图)的其他措施、生命体征、通过测量实验室参数和记录不良事件来评估安全性。例如,可以通过组织病理学和/或组织化学方法,检查根据本发明所述的用途和方法中的非黑猩猩灵长类动物的不良事件。
术语“有效剂量(effectivedose)”或“有效剂量(effectivedosage)”定义为足以实现或至少部分实现期望效果的量。术语“治疗有效剂量”定义为足以治愈或至少部分抑制已患有疾病的患者中该疾病及其并发症的量。对这种用途有效的量将取决于感染的严重程度和受试者自身免疫系统的一般状态。术语“患者”包括接受预防性或治疗性治疗的人和其他哺乳动物受试者。
本文所用的术语“有效和无毒剂量”是指本发明的融合蛋白的可耐受剂量,其足够高以引起病理细胞的消耗、肿瘤消除、肿瘤缩小或疾病的稳定而没有或基本上没有主要的毒性作用。这种有效和无毒的剂量可以例如通过本领域描述的剂量递增研究来确定,并且应该低于诱导严重不良事件的剂量(剂量限制性毒性,dlt)。
上述术语也例如在生物技术衍生的药物s6的临床前安全性评估;ich协调三方指南;1997年7月16日举行的ich指导委员会会议中被提及。
本发明的融合蛋白的合适剂量或治疗有效量将取决于待治疗的病症、病症的严重程度、先前的治疗以及患者的临床病史和对治疗剂的响应。适当的剂量可以根据主治医师的判断进行调整,使其可以一次给药或一系列给药给予患者。所述药物组合物可以作为唯一治疗剂或在需要时与其它疗法如抗癌治疗组合施用。
本发明的药物组合物特别地可用于肠胃外给药,即皮下、肌肉内、静脉内、关节内和/或滑膜内。肠胃外给药可以通过推注或连续输注进行。如果药物组合物已被冻干,则首先在施用之前将冻干的物质在合适的液体中重构。冻干材料可以在例如抑菌注射用水(bwfi)、生理盐水、磷酸盐缓冲盐水(pbs)中重构或在冻干之前蛋白质所处的配方相同的配方中重构。
优选地,本发明的融合蛋白或通过本发明的方法产生的融合蛋白被用于预防、治疗或改善选自增殖性疾病、肿瘤疾病或免疫学障碍中的疾病。本发明的替代实施方式提供了一种用于治疗或改善选自于增殖性疾病、肿瘤疾病或免疫性障碍中的疾病的方法,所述方法包括以下步骤:向有需求的患者给药本发明的融合蛋白或通过本发明的方法生产的融合蛋白。肿瘤可以由癌症代替。优选的癌症是其中细胞外抗原5t4被表达在肿瘤细胞中的癌症。可以使用facs分析来评估5t4的表达。更优选的癌症是间皮瘤、乳腺癌、卵巢癌、结肠直肠癌、子宫颈癌、胃癌、肺癌或结肠癌。优选的乳腺癌是所谓的三阴性乳腺癌。优选的结肠癌是kras突变的结肠癌。
本文描述的配方作为在有需要的患者中治疗和/或预防本文所述的病理性医学病症的药物组合物是有用的。术语“治疗”是指治疗性治疗和预防性或预防性措施。治疗包括将配方施用或给药于患有疾病/病症、疾病/病症的症状或对疾病/病症有倾向的患者的身体、分离的组织或细胞,目的是治愈、愈合、减轻、缓解、改变、补救、改善、改进或影响疾病、疾病症状或对疾病的倾向。
那些“需要治疗”的人包括那些已经患有这种疾病的人以及需要预防疾病的那些。术语“疾病”是可受益于用本文所述的蛋白质配方治疗的任何病症。这包括慢性和急性疾病或疾病,包括使哺乳动物倾向于所述疾病的那些病理病症。本文要治疗的疾病/病症的非限制性实例包括增殖性疾病、肿瘤疾病或免疫学障碍。在另一方面,提供了包含本发明的融合蛋白、本发明的核酸分子、本发明的载体或本发明的宿主细胞的试剂盒。该试剂盒可以包含一个或多个含有融合蛋白的小瓶和使用说明书。试剂盒还可以含有用于施用本发明的融合蛋白质的装置,例如注射器、泵、输注器等。在又另一方面,本发明涉及所述试剂盒的用途。
应当理解,本文的发明不限于特定的方法、方案或试剂,因为它们可以变化。本文提供的讨论和示例仅用于描述特定实施方式的目的,并不意图限制本发明的范围,所述范围仅由权利要求书限定。本说明书全文引用的所有出版物和专利(包括所有专利、专利申请、科学出版物、制造商的说明书、指导书等),无论是在前还是在后,均通过引用整体并入本文。本文中的任何内容都不应被解释为承认本发明由于先前的发明而无权提前公开。在通过引用并入的材料与本说明书相矛盾或不一致的情况下,本说明书将取代任何此类材料。
附图说明
图1a代表了制备本发明融合蛋白(也称为“三体融合蛋白”)的优选原理。
a:分离了5t4和t细胞活化cd3表位的最小结合区,例如其衍生自抗体的v结构域或衍生自其它结合分子。这些最小结合结构域被格式化为既用作ch1:cl异源二聚结构域上的n末端延伸,和/或被格式化为单链可变结构域并延伸到本发明的融合蛋白的n末端。
b:fabl(包含vl和cl结构域)和fabfd(包含vh和ch1链)的基因结构的示意图,其在相同细胞中共表达时形成fab异源二聚体。
c:本发明的融合蛋白形式的基因结构的示意图,其中单链可变结构域(scfv)形式的额外结合结构域通过编码基因的基因融合在mrna水平上融合到cl和ch1结构域的c末端。在该实施例中,基因结构基于无内含子连续编码序列。
d:本发明的融合蛋白在色带和空间填充表现度中的分子模型。
e:在本发明的融合蛋白的分子模型中,在ch1及其延伸的c-末端结合物和cl及其延伸的c-末端结合物之间含有10-氨基酸接头序列。分子模拟使用基于sgggsgggss接头序列的最大柔性。表现度在空间填充中,较暗的结合域是融合蛋白,并且银色结构域是抗原结合(对所有3个结合部分,模型中相同的抗原)。
图1b示出了融合蛋白中结合结构的组织中的一些不同变化,其中结构基于fab-链异源二聚体(vh-ch1:vlcl):
vh(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)
结合
vl(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)cl-l1-vl(5t4)-l2-vh(5t4),
如模型(i)和(iv)中2种可能的组合所示的。
或,不同形式组织的
vh(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)
组合
vl(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)cl-l1-vl(cd3)-l2-vh(cd3)
如模型(ii)和(v)中2种可能组合所示的。
或不同形式组织的
vh(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vl(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)cl-l1-vl(5t4)-l2-vh(5t4)
如模型(iii)和(vi)中2种可能组合所示的。
在所有组合中,scfv还可以是二硫化稳定单链可变片段(dsfv)。
图1c示出了tb-5t4融合蛋白中结合结构的组织的一些不同变化,其中结构基于交叉-fab-链(cfab)异源二聚体(vhcl:vlch1):
vl(5t4)-ch1-l1-vh(cd3)-l2-vl(cd3)或
vl(5t4)-ch1-l1-vl(cd3)-l2-vh(cd3)
结合
vh(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(5t4)cl-l1-vl(5t4)-l2-vh(5t4)
如(vii)和(x)中2种可能组合所示的。
或不同形式组织的
vl(5t4)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(5t4)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vh(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
vh(5t4)cl-l1-vl(cd3)-l2-vh(cd3)
如(viii)和(xi)中2种可能组合所示的。
或不同形式组织的
vl(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
vl(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
vh(cd3)cl-l1-vh(5t4)-l2-vl(5t4)或
vh(cd3)cl-l1-vl(5t4)-l2-vh(5t4)
如模型(ix)和(xii)中2种可能组合所示的。
在所有组合中,scfv还可以是二硫化物稳定的单链可变片段(dsfv)。
图1d示出了tb-5t4融合蛋白中结合结构的组织中的一些不同变化,其中结构基于至ch1和cl异源二聚体的单结构域结合物融合(dfab):
v1(5t4)cl-l1-vh(5t4)-l2-vl(5t4)或
v1(5t4)cl-l1-vl(5t4)-l2-vh(5t4)
其中v1是对5t4具有特异性的单结构域结合物
结合
v2-ch1-l1-vh(cd3)-l2-vl(cd3)或
v2-ch1-l1-vl(cd3)-l2-vh(cd3)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如(xiii)和(xvi)中2种可能组合所示的。
或不同形式组织的
v2-ch1-l1-vh(5t4)-l2-vl(5t4)或
v2-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
v1(5t4)cl-l1-vh(cd3)-l2-vl(cd3)或
v1(5t4)cl-l1-vl(cd3)-l2-vh(cd3)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如(xiv)和(xvii)中2种可能组合所示的。
或不同形式组织的
v1(cd3)-ch1-l1-vh(5t4)-l2-vl(5t4)或
v1(cd3)-ch1-l1-vl(5t4)-l2-vh(5t4)
结合
v2-cl-l1-vh(5t4)-l2-vl(5t4)或
v2-cl-l1-vl(5t4)-l2-vh(5t4)
其中v2是具有不同于对5t4或cd3的特异性的单结构域结合物
如(xv)和(xviii)中2种可能组合所示的。
在所有组合中,scfv还可以是二硫化物稳定的单链可变片段(dsfv)。
图2
a:forsberg1997(j.biol.chem272:12430-12436)公开的鼠5t4.h8vh和vl序列(seqid2和16)与人源化序列(seqid6和19)的比较显示框架和预测的cdr区域的差异(加框的)。
b:包含seqid2和16中的鼠v(5t4)序列的tb535c和包含如seqid6和19中所示的人源化v(5t4)的tb535h-1120的示意图.
c:显示了人类分数的显著增加,其表达为鼠和人源化vh和vl的平均值(z-评分)的偏差。
d:包含不同人源化形式的vh(5t4)和vl(5t4)并且在含ch1的链(hhhhhh)的c末端延伸有his-标签的两个三体融合物在imac(固定化金属亲和色谱法)或sec(尺寸排阻色谱法)之后的生产产率。
图3
a:人源化融合蛋白tb535h(seqid51和52)的示意图。
b:与dsfv格式、fab格式、igg格式或bite格式(scfv(5t4)-scfv(cd3)融合)的人源化vh(5t4)seqid6和vl(5t4)seqid19相比,tb535h和tb535c(seqid49和50)的kd平衡解离常数的比较。
c:与部分fab(5t4)和dsfv(5t4)相比,tb535h的5t4的重组细胞外结构域上的elisa结合曲线的图形表示。
d:在msto-211h5t4阳性间皮瘤细胞系上,在tb535h及其部分fab(5t4)和dsfv(5t4)的饱和条件下的facs装饰(decoration,修饰)。
e:tb535h在msto-211h5t4阳性间皮瘤细胞系上的结合的滴定以及50%结合浓度(kd)与elisa方法的比较。
f:滴定tb535h在3种不同供体的外周血单核细胞上的结合的滴定。kd值是重现性约25nm。
图4a
a:tb535h的示意图,指示了存在于蛋白质中的所有二硫键。
b:tb535h中所有天然和工程化二硫键的列表。
c:tb535h的序列上所有二硫键的指示。
d:工程化二硫键的形成的比较,令人惊奇地,其中tb535h中比在tb535c(非还原性boltsds-page)中更好。还原凝胶显示了预期分子量的链。在中间显示了分子量校准曲线。
图4b
a:比较并入到tb-5t4中的cd3结合物vh(cd3)seqid29和vl(cd3)seqid37的人源化和稳定化影响的活性滴定曲线。
b:非二硫化物稳定的tb-5t4上的诱导应力对多聚体形成的影响。该图显示了在20℃或37℃下孵育3天后的分析性凝胶过滤洗脱液的叠加曲线。指示了单体(1)和多聚体(2-4)。
c:在37℃下3天后,二硫化物稳定的tb-5t4上的诱导应力对多聚体形成的影响。与起始情况相比,多聚体形成没有变化。
图5tb535融合蛋白的分析
a:比较tb535c和tb535h的分析凝胶过滤的洗脱曲线。示出了使用150kda、100kda、50kda和25kdaigg-来源的分子的校准。该表显示了从校准线导出的tb535h和tb535c的预测尺寸。令人惊讶的是,tb535h显示出更紧凑的构型。
b:tb535h的质谱分析显示正确的分子量并识别mw同种型。
c:tb535h的分析阳离子交换分析识别有限数量的电荷异构体。
d:等电聚焦将tb535c、tb535h与igg形式进行比较。
图6a基于蛋白质的融熔曲线的tb535的稳定性
a:tb535h的示意图。
b:通过thermofluor测定法通过熔解温度比较tb535c和tb535h之间的稳定性。
c:通过thermofluor测定法,比较tb535h与其单个组分(fab(5t4);dsfv(5t4),dsfv(cd3))的熔解曲线。还显示了组分的理论总和。令人惊讶的是,tb535h不是组分的总和,并且融合蛋白更稳定。
d:通过thermofluor测定法,比较tb535h与bite(dsfv(5t4)-dsfv(cd3)融合物)以及基于相同的v-结构域序列的igg1(5t4)格式的熔解曲线。令人惊讶的是,tb535h比igg和scfv-融合物(bite)更稳定。
图6b在37℃温育72小时后的tb535的稳定性
a:将tb535h和tb535c形式在37℃下在pbs中温育72小时,并且在此之前和之后通过分析尺寸排阻色谱进行分析。温育后未观察到多聚体形成。
b:将tb535h和tb535c形式在37℃下在人血清中温育72小时,并且之后在细胞杀伤测定(msto-211h5t4-阳性间皮瘤细胞系与人pbmce:t5:1,48h测定)中通过活性滴定进行分析。在温育之后未观察到活性的差异。
图7本发明的融合蛋白(fab-(scfv)2和bite(scfv-scfv)格式的比较
a:使用两种融合蛋白格式的单体和二聚体的典型形成。bite格式往往具有较高比例形成的二聚体。
b:摩尔比较的相对产量,其中将本发明格式的融合蛋白设置为100%,并与具有相同序列的bite格式进行比较。本发明的融合蛋白的格式通常具有较高的产量。
c:融合蛋白(tb535h-1120)纯化后的产量与基于相同序列的bite格式的产量的比较。
d:融合蛋白格式的活性滴定(在混合培养中通过人pbmc诱导杀死5t4阳性肿瘤细胞)与bite格式的比较显示,ec50值在相同的范围内,但是使用本发明的融合蛋白格式杀死了更高百分比的肿瘤细胞,形成t细胞衔接器。
图8tb535c和tb535h的结合和活性的比较
a:5t4抗原的重组细胞外结构域上的elisa结合。
b:人t-细胞系(jurkat)上的elisa结合。
c:msto-211h5t4-阳性间皮瘤肿瘤细胞的混合培养物中的细胞毒性滴定。
d:tb535c和tb535h的结合和活性的表格比较。
图9tb535h在一系列不同的肿瘤类型中是活跃的
a:使用代表不同形式的间皮瘤、三阴性乳腺癌和kras突变结肠癌的细胞系活性滴定(在混合培养中通过人pbmc诱导杀死5t4阳性肿瘤细胞)tb535。以皮摩尔浓度给出ec50值。
b:通过facs装饰确定的5t4膜表达水平与在细胞杀伤测定中获得的ec50值进行比较。
图10
a:在小鼠c57bl/6中注射后的平衡和消除期的半衰期估计。从处死的动物中回收血液,并使用细胞毒性诱导活性测定法测量功能性tb535的浓度。估计显示出大量的分布和缓慢的清除。
b:通过用抗flag标记蛋白质印迹分析探测全血蛋白,不能看到tb535的降解。
图11atb535在用人pbmc重建的间皮瘤异种移植的nod/scid老鼠中的有效性
a:皮下生长的间皮瘤肿瘤图片。
b:在1:1的效应子:靶比例和各种浓度的tb535h下,肿瘤生长的皮下模型和演变。
c:在2:1的效应子:靶比例和各种浓度的tb535h下,肿瘤生长的皮下模型和演变。
d:间皮衬里原位生长的中间皮瘤肿瘤的图片。
e:在用人pbmc重建并用tb535h处理的nod/scid小鼠中原位诱导的间皮瘤完全阻止了肿瘤的形成和死亡(人性化的终点牺牲)。
图11b在指示的天ip注射10e7人pbmc和tb535后治疗已建立的皮下肿瘤。使用卡尺测量肿瘤体积。
图12a通过tb535h在肿瘤细胞与pbmc的混合培养物中诱导th1细胞因子。特别是il-2、干扰素-γ和tnf-α被上调。
阳性对照是okt3-igg(莫罗单抗-cd3)(+)并且无添加物(-)。
图12b没有细胞因子诱导,使用来自3个人类供体的pbmc温育tb535h,直到tb535h浓度为1mm(毫摩尔)。
阳性对照是okt3-igg(莫罗单抗-cd3)(+)并且无添加物(-)。
图12c在不存在5t4阳性肿瘤细胞的情况下,在pbmc上不存在t细胞活化标志物诱导(cd69和cd25),直到1mm(毫摩尔)的浓度(开口符号)。闭合符号是混合肿瘤细胞/pbmc共培养物中的对照,其中从低10000倍的浓度下开始诱导活化标志物。
图13人pbmc中主效应子细胞的分析。将完整的pbmc与纯化的cd4阳性t细胞级分、cd8阳性t细胞级分、两者的组合以及cd56阳性nk细胞级分进行比较。
图14a在使用化学定义的培养基和饲料的补料分批生物反应器方法中,从稳定cho克隆产生高达1g/l的tb535。
图14b使用捕获(a)、纯化(b)和精炼(polishing)(c)步骤从废培养基中分离tb535。凝胶过滤分析(d)和用考马斯亮蓝染色的sds-page。
已经包括以下实施例来说明本发明的实施方式。以下实施例的某些方面由本共同发明人发现或预期的在本发明的实践中工作良好的技术和程序来描述。这些实施例说明了共同发明人的标准实验室实践。鉴于本公开和本领域的一般技术水平,本领域技术人员将理解,以下实施例仅旨在是示例性的。
实施例1表达
在hek293细胞中的瞬时表达
根据制造商的方案,将具有序列验证的核苷酸序列的表达质粒的克隆用于在freestyle-293表达系统(invitrogengmbh,德国卡尔斯鲁厄)中的转染和蛋白质表达。获得含有表达的蛋白质的上清液,通过离心除去细胞,将上清液保存在-20c下。在基因水平上构建根据位置不同排列的5t4和cd3结合物(例如图1b:i-iii))和/或用于scfv分子的vh-vl或vl-vh组合的用途(例如图1biv-vi),或在fab中具有交叉的v-结构域(例如图1cvii-xii),或与结构域结合物组合(例如图1dxiii-xviii),并且克隆在组合了cmv启动子和kozak翻译起始位点等特征的pes33载体中。所有的构建体均在c末端融合有his-标记(hhhhhh)并且在n末端融合有flag-标记(dykddddk)。在imac捕获的tca沉淀后分析消耗的培养基,随后是sds-page并且用抗-his抗体、抗flag抗体、抗人fab或抗人κ血清探测蛋白质印迹分析。使用imac捕获、离子交换纯化和在凝胶过滤上的精炼步骤的组合来纯化蛋白质,以确保分离严格的单体级分。以三体(即fab-(scfv)2)或bite(即scfv-scfv)格式比较了各种形式的5t4xcd3双特异性抗体,并评估了产生的单体蛋白的相对产量和相对分数。发现三体形式一般产生了更多的双特异性蛋白质以及更高分数的单体蛋白(参见图7a、7b和7c)。
cho细胞中的稳定表达
将具有序列验证的核苷酸序列的表达质粒的克隆转染到dhfr缺陷型cho细胞中以进行构建体的真核表达。如kaufmanr.j.(1990)methodsenzymol.185,537-566的描述进行dhfr缺陷型cho细胞中的真核蛋白表达。通过将甲氨蝶呤(mtx)的浓度增加至20nmmtx的终浓度,以诱导构建体的基因扩增。在两代静止培养后,收获之前,使用细胞在无核苷的hyqpfcho液体大豆培养基(具有4.0mml-谷氨酰胺,0.1%pluronicf-68;hyclone)的滚瓶中生长7天。通过离心去除细胞,将含有表达的蛋白质的上清液储存在-20c下。
使用不含血清/动物成分的悬浮液适应的cho细胞,创建稳定的tb535表达细胞系。将三体的fd和l基因克隆到载体中并共转染到cho细胞中。质粒含有可选择的标记物,其具有用以产生高水平表达的元件。从表达池中进行有限稀释克隆,以选择最高产量的最稳定的克隆。在使用化学定义的培养基和饲料的补料分批生物反应器方法中,从稳定克隆生产高达1g/l的tb535。图14a示出了典型的tb535生物反应器方法的细胞生长和tb535滴度。
通过深度过滤除去细胞,收获生物反应器。使用色谱步骤(例如亲和力、离子交换和尺寸排阻)的组合,从澄清的废培养基相中回收和纯化tb535(图14b),随后是最终浓缩/渗滤到制剂缓冲液中用于储存。该纯化方法产生大约400mg/l纯化的稳定配制的tb535三体。如图14b-d/e所示,由包括分析尺寸排除和非还原性sdspage的多种分析方法确定,由这一方法生产的tb535纯度>98%。
重组形式的可溶性人5t4的表达
将人5t4的编码序列(基因库,登录号nm_006670)用于构建人工cdna序列,其编码仅包含5t4的细胞外结构域的人5t4的可溶性蛋白。
对于与人白蛋白的融合,经修饰的cdna片段被设计为首先包含用于构建体的真核表达的kozak位点,随后是包含对应于信号肽和细胞外结构域的氨基酸1至355的人5t4蛋白的编码序列,框架中的前面是标记标签(flagtag)的编码序列,框架中的随后是经修饰的组氨酸标签(sghhhhhh)的编码序列和终止密码子。
上述程序均按照标准方案进行(sambrook,molecularcloning;alaboratorymanual,第3版,coldspringharbourlaboratorypress,coldspringharbour,newyork(2001))。
实施例2人源化
使用衍生自鼠h8抗体序列和人抗体序列的序列制备嵌合和人源化抗5t4抗体。图2中示于了本发明的代表性抗体的一些序列。
构建了具有鼠h8重链和轻链可变区序列(例如sedid01或seqid02与seqid16或seqid17组合)以及和人恒定区序列ch1和cl-κ的嵌合h8抗体。用于制备嵌合和人源化h8抗体的代表性人恒定区包括人igg1、人κ和人igg4。为了克隆编码igg恒定区的序列,可以任选地缺失内含子序列。还制备了其中一抗体链包含鼠h8可变区(如在嵌合抗体中那样)并且另一抗体链包含人源化h8可变区的抗体,即半人源化抗体。
人源化h8可变区被构建成包括移植到人或基本上人框架区上的鼠h8的cdr。使用abm定义鉴定鼠h8抗体的cdr,该abm定义基于序列变异性以及结构环区的位置。选择了人受体框架,依据是它们基本上类似于鼠h8抗体的框架区域,或者与可变区亚家族的共有序列最相似,参见图2。还考虑到人类中框架基因座的代表性,因此广泛代表的序列优于更为稀少的序列。进行了人框架受体序列的其他突变,例如以恢复被认为涉及抗原接触的鼠残基和/或涉及抗原结合位点的结构完整性的残基。也针对cho细胞的密码子偏好优化氨基酸序列,并去除限制酶位点。使用肽结构预测程序分析人源化可变重和轻区序列,以鉴定和避免由人性化设计引入的翻译后蛋白质修饰位点。使用这一策略,构建了三个版本的人源化h8可变区域。版本1在被认为对抗体完整性和抗原结合至关重要的框架序列内的位置保留了鼠h8残基。版本2仅在cdr中保留了鼠残基。版本3与版本2相似,不同之处在于使用共有可变区序列作为重链受体框架。版本3抗体的轻链可变区与版本2抗体的相同。
为了构建人源化h8轻链可变区,将dpk24种系序列vl-iv/基因座b3用作受体框架。dpk24序列与鼠h8轻链可变区具有68%的同一性,并且当与鼠h8轻链框架序列相比时,其含有18个氨基酸取代。还使用种系克隆亚组vκiii和vκi的轻链可变区的框架区构建人源化抗体。特别地,包括轻链vκiii亚组框架区和所公开的人源化h8抗体版本1的抗体均高度表达且稳定。
为了构建人源化h8重链可变区,将dp75种系序列vh-1/基因座1-02用作受体序列。dp75序列与鼠h8重链可变区具有65%的同一性,并且当与鼠h8重链框架序列相比时含有28个氨基酸取代。人源化h8重链可变区版本1维持鼠h8残基k38和s40(k38和s40对于与重链和轻链可变区的抗原接触是重要的)以及i48,i48对于与可变区和cdr2的抗原接触是重要的。或者,使用重链可变区亚组共有序列制备人源化h8重链。当与鼠h8重链框架序列相比时,共有序列含有25个氨基酸取代。
通过将重叠寡核苷酸一起退火并连接到含有人抗体恒定区的puc57克隆载体中,以构建人源化h8重链和轻链可变区。也可以使用pcr诱变或定点诱变来构建人源化重链和轻链可变区。寡核苷酸的设计包括用于cho细胞表达的密码子的优化和限制酶位点的去除。
通过用最接近的同源种系序列替代vhcdr1、vhcdr2、vlcdr1或vlcrd2进行进一步的优化。根据产量和结合活性对变体进行排序。vhcdr1取代是特别有意义的,因为它具有在scfv中有效形成稳定二硫键的意外增强的分子数量,如ep0703926所描述的(参见图4a和图4b-a、b和c)。
图5显示基于凝胶过滤、maldi-toff和分析离子交换的分析,其显示了人源化形式与基于小鼠的抗体的预期行为和可比性(图5b、c、d)。与tb535c(嵌合:含有小鼠v-结构域)相比,分析性凝胶过滤再次指示了稍微更紧凑形式的tb535h(人源化)。
图8显示了与基于鼠可变结构域(seqid02和seqid17)的三体相比,tb535h(基于seqid06和seqid19)与5t4以及cd3的可比结合性和tb535h的可比活性。
实施例3结合检测
facs分析:装饰、滴定、pbmc结合
采集需要测试的细胞系(肿瘤细胞系,pbmc)(1x10<6>细胞/样品),在pbs中洗涤并且在冰上使用在pbs/10%fbs中的1μg结合分子(例如抗体/三体)孵育1小时。为了表征由肿瘤细胞系对5t4的表达,使用了商用抗-5t4抗体(目录号:mab49751,r&d系统)。
为了获得抗-5t4分子(scfv、fab和三体格式)与人5t4结构域的结合,遵循制造商的说明,通过来自innovabiosciences的lightning-
然后使用pbs将细胞洗涤两次,并且使用bdfacsalibur装置通过流式细胞计评估与细胞表面的结合。
基于jurkat细胞的elisa
为了获得所述结构与人cd3结构域的结合,使用基于细胞的elisat细胞淋巴瘤(cd3+)细胞系。收集jurkat细胞,洗涤并分装到圆底elisa板的每个孔中。在pbs中制备三体和单链稀释液,并加入到细胞中。洗涤步骤后,将检测抗体加入到样品中(碱性磷酸酶缀合的单克隆抗-flag,目录号:a9469,sigma)。通过在加入p-npp(目录号:n7653,sigma)后发展出比色反应来检测二次抗体,并且在微孔板读数器上定量吸光度,并使用图形padprism软件通过非线性回归进行处理。
根据标准方案进行基于细胞或蛋白质的elisa(sambrook,molecularcloning;alaboratorymanual,第3版,coldspringharbourlaboratorypress,coldspringharbour,newyork(2001))。
对于与人cd3结构域的亲和力,使用具有t细胞淋巴瘤(cd3+)细胞系jurkat的基于细胞的elisa。收集jurkat细胞,洗涤并等分到圆底96孔微量培养板的每个孔中。在pbs中制备三体/样品稀释液,加入到细胞中并且孵育。在洗涤步骤之后,将检测抗体加入到样品中(抗人κ轻链ap;例如sigma,目录号k4377)。通过在加入p-npp(目录号:n7653,sigma)后发展出的比色反应来测量结合的检测抗体,在微孔板读数器上定量吸光度,并使用图形padprism软件通过非线性回归进行处理。
对于与5t4靶抗原的亲和力,使用具有5t4抗原的elisa。内部生产的靶抗原(5t4细胞外结构域)覆盖聚苯乙烯平底96孔微孔板并封闭。在具有0.2%w/v奶粉的tbs中制备三体/样品稀释液,加入到板中并孵育。在洗涤步骤之后,将检测抗体加入样品(抗人κ轻链ap;例如,sigma,目录号k4377)。结合的检测抗体通过加入p-npp(目录号:n7653,sigma)发展的比色反应来测量,在微孔板读数器上定量吸光度,并使用图形padprism软件通过非线性回归进行处理。
表1:各种格式结合5t4重组蛋白的亲和力
如表1所示,与单价格式例如可比较的bite(scfv-scfv格式)相比,二价结合tb535具有2-3倍更高的亲和力。使用三体格式,获得了接近igg格式的5t4的亲和力(参见图3a、b和c)。图3c和d显示了相对于单价形式如scfv和fab,三体的结合具有明显优点。
通过结合jurkat细胞以及不同供体的pbmc证实,tb535构型中的抗cd3结合仍然是有效的(图3f)。
实施例4活性检测
靶细胞标记
为了分析流式细胞术测定中的细胞裂解,用荧光膜染料dioci8(dio)(分子探针目录号:v22886)将人或猕猴5t4转染的cho细胞或表达5t4的人细胞标记为靶细胞,并且将它们与效应细胞区分开。简言之,收获细胞,用pbs洗涤一次,并在含有2%(v/v)fbs和膜染料dio(5μl/10<6>个细胞)的pbs中调节至10<6>个细胞/ml。在37℃下孵育3分钟后,将细胞在完整的rpmi培养基中洗涤两次并且将细胞数调整至1.25x10<5>个细胞/ml。使用0.5%(v/v)等渗eosing溶液(roth目录号:45380)确定细胞的活力。
用人pbmc进行基于facs的细胞毒性测定
通过ficoll密度梯度离心从富集淋巴细胞制剂(血沉棕黄层)制备人外周血单核细胞(pbmc),富集淋巴细胞制剂(血沉棕黄层)是血库收集输血血液的副产品。血沉棕黄层由当地血库供应并且pbmc分别在采血当天准备。在ficoll密度离心并用dulbecco'spbs(gibco)进行广泛洗涤之后,通过与红细胞裂解缓冲液(155mmnh4cl,10mmkhc03,100mmedta)一起孵育以从pbmc中除去剩余的红细胞。以100xg离心pbmc后,通过上清液除去血小板。剩余的淋巴细胞主要包括b和t淋巴细胞、nk细胞和单核细胞。将pbmc保持在具有10%fcs(gibco)的rpmi培养基(gibco)中在37℃/5%c02下的培养物中。
使用下列不同肿瘤细胞系作为靶细胞,通过基于facs的体外细胞毒性测定来分析三体的生物活性:mda-mb468(atcchtb-132)、msto-211h(atcccrl-2081)、nci-h2052(atcccrl-5915)、nci-h2452(atcccrl-5946)、nci-h28(atcccrl-5820)、mda-mb231(atcchtb-26)、hs-578t(atcchtb-126)、bt-549(atcchtb-122)、sw-620atccccl-227)、hct-116(atccccl-247)、hct-15(atccccl-225)。在cd3/cd28/il-2刺激后,将人pbmc用作效应细胞。为了刺激,在37℃下,使用在7.5mlpbs1x中的5μg/ml的αcd3(免疫工具目录号:21620030)将t片(75cm3)涂覆2小时。使用pbs冲洗烧瓶,然后将全部的pbmc加入到补充有10%fbs(paa目录号:a15-151)、5μg/mlαcd28(免疫工具目录号:21330280)和30u/ml人重组il-2(免疫工具目录号:11340023)的rpmi-1640(sigma目录号:r8758)中。在37℃和5%co2下刺激3天后,将pbmc转移到未覆盖的t烧瓶中并且在具有10%fbs和30u/mlil-2的rpmi-1640中再孵育24小时,以使内化的t细胞受体重新传递到细胞表面。根据制造商的说明书,用pkh67染料(sigma目录号:mini67-1kt)标记靶细胞,并孵育过夜以进行细胞粘附。以5:1的效应物:靶比例加入人pbmc(tebu目录号:192pmbc),并且制备浓度为1000至0.001ng/ml的三体,一式两份。靶标、效应细胞和三体在37℃和5%co2下孵育48小时。孵育后,收获细胞并重悬于含有碘化丙啶(sigma目录号:p4864)的pbs中,但不含三体的细胞除外。将特异性细胞毒性确定为以完整活体靶细胞(pkh67+细胞)相对于死细胞(pi+)的函数。
使用bdfacsalibur装置并使用细胞探索软件通过流式细胞术来访问细胞。为了测定发生的靶细胞的半最大裂解的估计三体浓度(ec50),将特异性细胞毒性值相对于三体浓度作图,并使用graph-padprism软件通过非线性回归进行处理。
tb5355t4xcd3三体的活性总是处于在代表几种癌症适应症的一系列细胞系中测量的低皮摩尔范围内(例如图9a和b)。令人惊奇的是,即使在饱和结合条件下体外测量时(参见图7d),5t4xcd3三体仍显示出比bitescfv-scfv格式更高的细胞杀伤百分比。
t细胞活化标志物的检测
在存在和不存在靶msto-211h细胞的情况下将pbmc健康供体(tebu-bio)与tb535h一起孵育,一式两份。将pbmc解冻,并在37℃和5%co2下在rpmi中孵育24小时。将msto-211h细胞以8x104个细胞/孔接种在24孔板中,孵育过夜以进行细胞粘附。在一定范围的三体浓度下,以10:1(未活化)的效应物:靶标加入pbmc。
在存在和不存在msto-211h细胞系的情况下孵育hpbmc和三体24小时后,在1μg抗体/百万细胞的浓度下,通过离心(300xg,5分钟,室温)收获pbmc(供应商:tebu-bio)并且使用apc-标记的抗-cd69(免疫工具目录号:21270564)和fitc偶联的抗-cd3(免疫工具目录号:21620033)染色。为了测定另外的t细胞活化标记物cd25,在48小时孵育后收获细胞,用apc-抗-cd25(免疫工具目录号:21270256)和ftic抗cd3染色。将抗体在黑暗中在4℃下孵育1小时。将细胞在pbs中洗涤3次,并在facscalibur装置中通过流式细胞术获得结果。
图12c显示,肿瘤细胞与pbmc的体外共培养诱导tb535浓度依赖性t细胞活化标志物表达,而即使在高达1μm的浓度下在不存在靶细胞的条件下这也不存在。
cd4+、cd8+和nk亚群的细胞毒性检测
购买了市售的cd4+、cd8+和cd56+富集细胞(供应商:tebu-bio),以评估cd4+t辅助细胞、cd8+效应物t细胞和nk细胞的细胞毒活性。
通过基于facs的体外细胞毒性测定评估tb535h的生物活性,其中对效应细胞的制备有改变。与pbmc相同,这些细胞群也被解冻并在用于细胞毒性测定之前培养过夜。然而,代替如对pbmc的使用10:1的固定e:t比例,效应细胞的量被改编适用于每个细胞亚群。通常,cd4+t辅助细胞、cd8+效应物t细胞和nk细胞占pbmc全部群体的50%、25%和10%。使用这个假设,这种细胞毒性测定中使用的e:t比例对于cd4+t辅助细胞为5:1,对cd8+效应t细胞为2,5:1,且对于nk细胞为1:1。作为对照,还以10:1的e:t的pbmc完整群体进行测定。此外,还测试了cd4+和cd8+细胞的混合物。
以100.000pm的tb535的孵育测定这些细胞群的细胞毒活性。将特异的细胞毒性确定为完整活体靶细胞(pkh67+细胞)相对于死细胞(pi+)的函数。
如图13所示,cd8+t细胞是主效应细胞,并且通过包含cd4+细胞增强其有效性。不刺激nk细胞以通过tb535杀死靶细胞。
实施例5稳定性
thermofluor分析
将scfv-po3和scfv-sp34样品在pbsph7.4中稀释至终浓度为0.1mg/ml。向55μl稀释样品中加入5μl200x稀释的宝石红(syprored)凝胶染色(目录号:s-6653,invitrogen)。将每个制备的样品20μl加载到毛细管中并离心,700g持续5s。为了检测,将热循环仪(rochelightcycler1.5)设定为640nm,并程序化为在37℃的第一步进行10秒,随后以0.5℃/秒连续上升至95℃,连续数据采集。
分析尺寸排除(凝胶过滤)
在biosec-5,5um,300a,7,8x300mm柱(agilent)上,在ultimate3000hplc(dionex)上通过在280nm下的uv检测,以1mlmin-1的磷酸钠/naclph7.0缓冲液进行分析,以定量三体并且确定相对于更高分子量可溶性聚集形式(例如二聚体、三聚体等)和更小分子量片段化形式(例如游离轻链)的单体的纯度和比例。使用针对使用纯化标准产生的校准曲线的auc进行定量。
发现三体形式-特别是当含有二硫键稳定的单链时-比可比较的scfv-scfv(bite)形式更稳定,并且令人惊奇地,甚至比含有相同v-结构域序列的igg格式更稳定(图6a-d)。
通过在37℃下在pbs或人血清中孵育3天来进一步说明tb535的显著稳定性。单体可溶性级分没有变化(图6b-a),并且没有活性损失(图6b-b)。
实施例6分析
在mabpacscx-103μm,4x50mm,柱(thermofisher)上,在ultimate3000hplc(dionex)上,通过在280nm下的uv检测,以0.5mlmin-1的mesph5.6缓冲液,使用盐梯度洗脱,进行分析性阳离子交换分析以表征和确定带电异构体的比例。
使用在具有bio-radpowerpachv的xcellsurelockmini-cell(invitrogen)中运行的ief3-10预制凝胶(serva),使用非平衡ph凝胶电泳,进行等电聚焦并且使用simplybluesafestain(invitrogen)染色。
在具有bio-radpowerpachv,mop缓冲液的xcellsurelocktmmini-cell(invitrogen)中运行的nupagenovexbis-tris4-12%凝胶(invitrogen)上进行sdspage,并且使用simplybluetmsafestain(invitrogen)染色。为了分析,用加载缓冲液nupagelds(invitrogen)稀释样品,并且为了还原sdspage,额外地用dtt还原。
对于蛋白质印迹,首先通过非还原sdspage,在具有bio-radpowerpachv,mop缓冲液的xcellsurelockmini-cell(invitrogen)中运行的nupagenovexbis-tris4-12%凝胶(invitrogen)分离样品,转移到pvdf膜上并且使用抗人κ轻链ap(例如sigma,目录号.k4377)检测。使用ap共轭试剂盒,目录号170-6432,biorad发展结合的检测抗体。
实施例7小鼠模型中的药代动力学和药效学
通过细胞毒性测定法测定半衰期
将30只小鼠(foxp3-gfp;混合性别;每个时间点2只雄性和1只雌性)注射10mg/kgtb535并且在注射后的不同时间点以3只小鼠一组处死:5和30分钟、1、2、3、4、6、8、12和16小时。通过基于facs的体外细胞毒性测定法评估血清样品中tb535h的生物活性,如前所述。简言之,根据制造商的说明书,用pkh67染料(sigma-aldrich)标记靶细胞(msto-211h),并孵育过夜以进行细胞粘附。用cd3/cd28/il2活化商业人类外周血单核细胞(pbmc),并且将其用作效应细胞,效应细胞与靶标比例为5:1。对于每个血清样品,制备2至3个稀释液,加入到靶细胞中,并在37℃和5%co2下孵育72小时。作为对照,还包括具有已知浓度的tb535h样品以建立校准曲线,其将三体浓度与该特定pbmc供体的细胞毒性值相关联。孵育后,收获细胞,并通过流式细胞术使用bdfacscalibur装置和使用细胞探索软件评估,将特异性细胞毒性确定为完整活体靶细胞(pkh67+细胞)相对于死细胞(pi+)的函数。为了通过该方法确定估计的tb535h浓度和半衰期,将特异性细胞毒性值相对于时间作图,并考虑α和β相通过线性回归进行处理。
图10示出了显示大体积分布和相对缓慢清除的半衰期确定的示例。
有效性的确定:早期治疗
为了测试三体(10;1;0.1;0.01mg/kg)对早期肿瘤模型的疗效,向nod/scid小鼠皮下注射混合有2.5x106或5x106个人类pbmc的2.5x106个间皮瘤肿瘤细胞。在肿瘤注射后的第0、2、4、7、9和11天静脉注射三体。用卡尺测量肿瘤生长。
为了模拟,向原位间皮瘤模型中胸膜内注射2.5.106个间皮瘤肿瘤细胞。定期检查动物的面包屑困难,并且将>20%的失重确定为当地道德委员会批准的人道终点。
图11a-abc显示了tb535在用人pbmc重建的皮下异种移植的nod/scid小鼠的治疗中的有效性,并且图11a-d和e示出了原位(胸膜内注射)间皮瘤肿瘤模型中的活性。
有效性测定:晚期治疗
使用nsg小鼠(nod-scidil2rγ<空>,杰克逊实验室(thejacksonlaboratory))中的异种移植物研究证实了已建立的肿瘤的治疗,皮下植入5.106个癌细胞7天后,通过ip每六天向小鼠注射三次10.106个活化的pbmc。对于所有研究,初次pbmc输注后两天,每隔一天以七个剂量的tb535或盐水静脉内治疗小鼠。每周两次用卡尺测量肿瘤,通过w×l×h计算肿瘤体积。
图11b显示tb535对于已建立的肿瘤也是有效的。
实施例8离体细胞毒性
细胞因子释放试验
在存在和不存在靶标msto-211h细胞的情况下用tb535h孵育来自4名健康供体的pbmc。将pbmc解冻,并在37℃和5%co2下在rpmi中孵育24小时。将msto-211h细胞以8×104个细胞/孔接种在24孔板中,孵育过夜以进行细胞粘附。在一定范围的三体浓度下,以10:1(未活化)的效应物:靶标加入pbmc。在37℃和5%co2下孵育24或48小时后,收获细胞并离心(300×g,5分钟,室温),并且将上清液收集到新的管中并且测定细胞因子释放。
根据制造商的说明书,使用以下试剂盒通过elisa评估释放到培养基中的细胞因子:il-2,mabtech3445-1h-6;ifn-γmabtech3420-1h-6;tnf-αmabtech3510-1h-6;tgf-β1r&ddy240-05;il-4r&ddy204-05和il-6r&ddy206。必须稀释一些样品,以使结果符合标准曲线,即对于tgf1-β(1:7稀释),il-6(1:10稀释)和ifn-γ(对于10ng/ml或更高的tb535h浓度,在noel靶标样品中1:40稀释)。孵育24h后,测量样品以定量il-2、ifn-γ、tnf-α和il-6。培养48h后,从培养基中量化il-4和tgf-β1。
图12a显示了具有i型应答的pbmc的肿瘤细胞的离体共培养中的细胞因子诱导,并且图12b显示在不存在靶细胞的情况下(仅pbmc+tb535)缺乏显著的细胞因子诱导。
表1:氨基酸序列
序列表
<110>生物技术有限公司
<120>包含结合至5t4和cd3的三个结合结构域的融合蛋白
<130>p6059494pct
<150>ep14199493
<151>2014-12-19
<160>52
<170>patentin3.3版
<210>1
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>1
gluvalglnleuglnglnserglyproaspleuvallysproglyala
151015
servallysilesercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserhisglylysserleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysalaileleuthrvalasplysserserthrthralatyr
65707580
metgluleuargserleuthrsergluaspseralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglyval
100105110
thrthrservalthrvalserser
115120
<210>2
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>2
gluvalglnleuglnglnserglyproaspleuvallysproglyala
151015
servallysilesercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglylysglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysalathrleuthrvalasplysserserthrthralatyr
65707580
metgluleuargserleuthrsergluaspseralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrservalthrvalserser
115120
<210>3
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>3
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglyglnglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>4
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>4
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>5
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>5
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrilethrargaspthrserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>6
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>6
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrsertyr
202530
tyrmethistrpvallysglnserproglyglnglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>7
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>7
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglyglnglyleuglutrpile
354045
glytrpileasnproasnserglyglythrasntyralaglnlysphe
505560
glnglyargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>8
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>8
glnvalglnleuvalglnserglysergluleulyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysphevalpheserleuaspthrservalserthralatyr
65707580
leuglnilecysserleulysalagluaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>9
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>9
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysvalserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglylysglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrmetthrgluaspthrserthraspthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alathrserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>10
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>10
glnmetglnleuvalglnserglyprogluvallyslysproglythr
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaargglyglnargleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrilethrargaspmetserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaalaserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>11
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>11
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnargleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrilethrargaspthrseralaserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>12
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>12
glnvalglnleuvalglnserglyalagluvallyslysproglyser
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrilethralaasplysserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>13
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>13
glnvalglnleuvalglnserglysergluleulyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrilethralaasplysserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>14
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>14
glnvallysleuglnglnserglyproglyleuvalthrprosergln
151015
serleuserilethrcysthrvalserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnserproglyglnglyleuglutrpleu
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplyslysserileserlysaspasnserlysserglnvalphe
65707580
leulysmetasnserleuglnalaaspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrthrvalthrvalserser
115120
<210>15
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>15
glnvalglnleuglngluserglyproglyleuvallysprosergln
151015
thrleuserleuthrcysthrvalserglytyrserphethrglytyr
202530
tyrmethistrpvalargglnproproglylysglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysvalthrileservalaspthrserlysasnglnpheser
65707580
leulysleuserservalthralaalaaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserser
115120
<210>16
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>16
aspilevalmetthrglnthrprothrpheleuleuvalseralacys
151015
aspargvalthrilethrcyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnserprothrleuleuile
354045
sertyrthrserserargtyralaglyvalproaspargpheilegly
505560
serglytyrglythraspphethrphethrileserthrleuglnala
65707580
gluaspleualavaltyrphecysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>17
<211>108
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>17
alaserilevalmetthrglnthrprothrserleuleuvalserala
151015
glyaspargvalthrilethrcyslysalaserglnservalserasn
202530
aspvalalatrptyrglnglnlysproglyglnserprolysleuleu
354045
ilesertyrthrserserargtyralaglyvalproaspargpheser
505560
glyserglytyrglythraspphethrleuthrileserservalgln
65707580
alagluaspalaalavaltyrphecysglnglnasptyrasnserpro
859095
prothrpheglyglyglythrlysleugluilelys
100105
<210>18
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>18
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnserprolysleuleuile
354045
sertyrthrserserargtyralaglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrphecysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>19
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>19
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyrtyrthrserserargtyralaglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>20
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>20
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncysargalaserglnglyileargasnasp
202530
leuglytrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyrtyrthrserserargtyralaglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>21
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>21
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyralaalaserserleuglnserglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>22
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>22
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglylysalaprolysargleuile
354045
tyrtyrthrserserargtyralaglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>23
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>23
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyrtyrthrserserargtyralaglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelys
100105
<210>24
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>24
gluilevalmetthrglnserproserthrleuseralaservalgly
151015
aspargvalileilethrcyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtyrthrserserargtyralaglyvalproserargphesergly
505560
serglyserglyalagluphethrleuthrileserserleuglnpro
65707580
aspaspphealathrtyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglnglythrlysleuthrvalleu
100105
<210>25
<211>105
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>25
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnalaproargleuleuile
354045
tyraspalaserasnargalathrglyileproalaargphesergly
505560
serglyproglythraspphethrleuthrileserserleuglupro
65707580
gluaspphealavaltyrtyrcysglnglnargserasntrphisphe
859095
glyglnglythrlysvalgluilelys
100105
<210>26
<211>119
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>26
glnvalglnleuvalglnserglyglyglyvalvalglnproglyarg
151015
serleuargleusercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglylysglyleuglutrpile
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysval
505560
lysaspargphethrileserargaspasnserlysasnthralaphe
65707580
leuglnmetaspserleuargprogluaspthrglyvaltyrphecys
859095
alaargtyrtyraspasphistyrcysleuasptyrtrpglyglngly
100105110
thrprovalthrvalserser
115
<210>27
<211>119
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>27
glnvalglnleuvalglnserglyglyglyvalvalglnproglyarg
151015
serleuargleusercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglylysglyleuglutrpile
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysval
505560
lysaspargphethrileserargaspasnserlysasnthralaphe
65707580
leuglnmetaspserleuargprogluaspthrglyvaltyrphecys
859095
alaargtyrtyraspasphistyrserleuasptyrtrpglyglngly
100105110
thrprovalthrvalserser
115
<210>28
<211>119
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>28
aspvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglyglnglyleuglutrpile
354045
glytyrileasnproserargglytyrthrasntyralaaspserval
505560
lysglyargphethrilethrthrasplysserthrserthralatyr
65707580
metgluleuserserleuargsergluaspthralathrtyrtyrcys
859095
alaargtyrtyraspasphistyrcysleuasptyrtrpglyglngly
100105110
thrthrvalthrvalserser
115
<210>29
<211>119
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>29
glnvalglnleuvalglnserglyalagluleulyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglyglncysleuglutrpmet
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysphe
505560
lysasplysalathrleuthralaasplysserthrserthralatyr
65707580
metgluleuargserleuargseraspaspthralavaltyrtyrcys
859095
alaargtyrtyraspasphistyrserleuasptyrtrpglyglngly
100105110
thrleuvalthrvalserser
115
<210>30
<211>118
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>30
glnvalglnleuvalgluserglyglyglyvalvalglnproglyarg
151015
serleuargleusercysalaalaserglyphelyspheserglytyr
202530
glymethistrpvalargglnalaproglylysglyleuglutrpval
354045
alavaliletrptyraspglyserlyslystyrtyrvalaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargglnmetglytyrtrphispheaspleutrpglyargglythr
100105110
leuvalthrvalserser
115
<210>31
<211>114
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>31
glnvalglnleuglnglnserglyalagluleualaargproglyala
151015
servallysmetsercyslysalaserglytyrthrphethrsertyr
202530
thrmethistrpvallysglnargproglyglnglyleuglutrpile
354045
glytyrileasnproserserglytyrthrlystyrasnglnlysphe
505560
lysasplysalathrleuthralaasplysserserserthralatyr
65707580
hisglnleuserserleuthrsergluaspseralavaltyrtyrcys
859095
alaargtrpglnasptyraspvaltyrpheasptyrtrpglyglngly
100105110
thrthr
<210>32
<211>122
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>32
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrserphethrglytyr
202530
thrmetasntrpvalargglnalaproglylysglyleuglutrpval
354045
alaleuileasnprotyrlysglyvalthrthrtyralaaspserval
505560
lysglyargphethrileservalasplysserlysasnthralatyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserglytyrtyrglyaspserasptrptyrpheaspvaltrp
100105110
glyglnglythrleuvalthrvalserser
115120
<210>33
<211>120
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>33
glnvalglnleuglnglnserglyalagluleualaargproglyala
151015
servallysmetsercyslysalaserglytyrthrpheilesertyr
202530
thrmethistrpvallysglnargproglyglnglyleuglutrpile
354045
glytyrileasnproargserglytyrthrhistyrasnglnlysleu
505560
lysasplysalathrleuthralaasplysserserserseralatyr
65707580
metglnleuserserleuthrsergluaspseralavaltyrtyrcys
859095
alaargseralatyrtyrasptyraspglyphealatyrtrpglygln
100105110
glythrleuvalthrvalserala
115120
<210>34
<211>106
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>34
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysseralaserserservalsertyrmet
202530
asntrptyrglnglnthrproglylysalaprolysargtrpiletyr
354045
aspthrserlysleualaserglyvalproserargpheserglyser
505560
glyserglythrasptyrthrphethrileserserleuglnproglu
65707580
aspilealathrtyrtyrcysglnglntrpserserasnprophethr
859095
pheglyglnglythrlysleuglnilethr
100105
<210>35
<211>106
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>35
glnilevalleuthrglnserproalailemetseralaserprogly
151015
glulysvalthrmetthrcysseralaserserservalsertyrmet
202530
asntrptyrglnglnlysserglythrserprolysargtrpiletyr
354045
aspthrserlysleualaserglyvalproalahispheargglyser
505560
glyserglythrsertyrserleuthrileserglymetglualaglu
65707580
aspalaalathrtyrtyrcysglnglntrpserserasnprophethr
859095
pheglyserglythrlysleugluileasn
100105
<210>36
<211>106
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>36
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnservalsertyrmet
202530
asntrptyrglnglnlysproglylysalaprolysargtrpiletyr
354045
aspthrserlysvalalaserglyvalproalaargpheserglyser
505560
glyserglythrasptyrserleuthrileasnserleuglualaglu
65707580
aspalaalathrtyrtyrcysglnglntrpserserasnproleuthr
859095
pheglyglyglythrlysvalgluilelys
100105
<210>37
<211>108
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>37
aspileglnleuthrglnserproserileleuseralaservalgly
151015
aspargvalthrilethrcysargalaserserservalsertyrmet
202530
asntrptyrglnglnlysproglylysalaprolysargtrpiletyr
354045
aspthrserlysvalalaserglyvalprotyrargpheserglyser
505560
glyserglythrglutyrthrleuthrilesersermetglnproglu
65707580
aspphealathrtyrtyrcysglnglntrpserserasnproleuthr
859095
pheglycysglythrlysvalgluilelysargthr
100105
<210>38
<211>108
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>38
gluilevalleuthrglnserproalathrleuserleuserprogly
151015
gluargalathrleusercysargalaserglnservalsersertyr
202530
leualatrptyrglnglnlysproglyglnalaproargleuleuile
354045
tyraspalaserasnargalathrglyileproalaargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglupro
65707580
gluaspphealavaltyrtyrcysglnglnargserasntrppropro
859095
leuthrpheglyglyglythrlysvalgluilelys
100105
<210>39
<211>104
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>39
glnilevalleuserglnserproalaleuleuseralaserprogly
151015
glulysvalthrmetthrcysargalasersersertyrmethistrp
202530
tyrglnglnlysproglyserserprolysprotrpiletyralathr
354045
serasnleualaserglyvalproalaargpheserglyserglyser
505560
glythrsertyrserleuthrileserargvalglualagluaspala
65707580
alathrtyrtyrcysglnglntrpserserasnproprothrphegly
859095
glyglythrlysleugluthrlys
100
<210>40
<211>107
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>40
aspileglnmetthrglnserproserserleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnaspileargasntyr
202530
leuasntrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrtyrthrserargleugluserglyvalproserargphesergly
505560
serglyserglythrasptyrthrleuthrileserserleuglnpro
65707580
gluaspphealathrtyrtyrcysglnglnglyasnthrleuprotrp
859095
thrpheglyglnglythrlysvalgluilelys
100105
<210>41
<211>106
<212>prt
<213>人工
<220>
<223>融合蛋白的人工序列部分
<400>41
glnilevalleuthrglnserproalailemetseralaserprogly
151015
glulysvalthrmetthrcysseralaserserservalsertyrmet
202530
asntrptyrlysglnlysserglythrserprolysargtrpthrtyr
354045
aspthrserlysleualaserglyvalproalaargpheserglyser
505560
glyserglythrsertyrserleuthrilesersermetglualaglu
65707580
aspalaalathrtyrtyrcysglnglntrpserserasnproprothr
859095
pheglyserglythrlysleugluilelys
100105
<210>42
<211>247
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>42
gluvalglnleuglnglnserglyproaspleuvallysproglyala
151015
servallysilesercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglylysglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysalathrleuthrvalasplysserserthrthralatyr
65707580
metgluleuargserleuthrsergluaspseralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrservalthrvalserseralaserglyglyglyglysergly
115120125
glyglyglyserglyglyglyglyseralaglyalaserilevalmet
130135140
thrglnthrprothrserleuleuvalseralaglyaspargvalthr
145150155160
ilethrcyslysalaserglnservalserasnaspvalalatrptyr
165170175
glnglnlysproglyglnserprolysleuleuilesertyrthrser
180185190
serargtyralaglyvalproaspargpheserglyserglytyrgly
195200205
thraspphethrleuthrileserservalglnalagluaspalaala
210215220
valtyrphecysglnglnasptyrasnserproprothrpheglygly
225230235240
glythrlysleugluilelys
245
<210>43
<211>246
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>43
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglyglnglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserseralaserglyglyglyglysergly
115120125
glyglyglyserglyglyglyglyseralaglyaspilevalmetthr
130135140
glnserproaspserleualavalserleuglygluargalathrile
145150155160
asncyslysalaserglnservalserasnaspvalalatrptyrgln
165170175
glnlysproglyglnproprolysleuleuiletyrtyrthrserser
180185190
argtyralaglyvalproaspargpheserglyserglyserglythr
195200205
aspphethrleuthrileserserleuglnalagluaspvalalaval
210215220
tyrtyrcysglnglnasptyrasnserproprothrpheglyglygly
225230235240
thrlysleugluilelys
245
<210>44
<211>246
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>44
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrsertyr
202530
tyrmethistrpvallysglnserproglyglncysleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserseralaserglyglyglyglysergly
115120125
glyglyglyserglyglyglyglyseralaglyaspilevalmetthr
130135140
glnserproaspserleualavalserleuglygluargalathrile
145150155160
asncyslysalaserglnservalserasnaspvalalatrptyrgln
165170175
glnlysproglyglnproprolysleuleuiletyrtyrthrserser
180185190
argtyralaglyvalproaspargpheserglyserglyserglythr
195200205
aspphethrleuthrileserserleuglnalagluaspvalalaval
210215220
tyrtyrcysglnglnasptyrasnserproprothrpheglycysgly
225230235240
thrlysleugluilelys
245
<210>45
<211>244
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>45
glnvalglnleuglnglnserglyalagluleualaargproglyala
151015
servallysmetsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvallysglnargproglyglnglyleuglutrpile
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysphe
505560
lysasplysalathrleuthrthrasplysserserserthralatyr
65707580
metglnleuserserleuthrsergluaspseralavaltyrtyrcys
859095
alaargtyrtyraspasphistyrcysleuasptyrtrpglyglngly
100105110
thrthrleuthrvalserseralaserglyglyglyglyserglygly
115120125
glyglyserglyglyglyglyseralaglyglnilevalleuthrgln
130135140
serproalailemetseralaserproglyglulysvalthrmetthr
145150155160
cysseralaserserservalsertyrmetasntrptyrglnglnlys
165170175
serglythrserprolysargtrpiletyraspthrserlysleuala
180185190
serglyvalproalahispheargglyserglyserglythrsertyr
195200205
serleuthrileserglymetglualagluaspalaalathrtyrtyr
210215220
cysglnglntrpserserasnprophethrpheglyserglythrlys
225230235240
leugluileasn
<210>46
<211>244
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>46
glnvalglnleuvalglnserglyalagluleulyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglyglnglyleuglutrpmet
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysphe
505560
lysasplysalathrleuthralaasplysserthrserthralatyr
65707580
metgluleuargserleuargseraspaspthralavaltyrtyrcys
859095
alaargtyrtyraspasphistyrserleuasptyrtrpglyglngly
100105110
thrleuvalthrvalserseralaserglyglyglyglyserglygly
115120125
glyglyserglyglyglyglyseralaglyaspileglnleuthrgln
130135140
serproserileleuseralaservalglyaspargvalthrilethr
145150155160
cysargalaserserservalsertyrmetasntrptyrglnglnlys
165170175
proglylysalaprolysargtrpiletyraspthrserlysvalala
180185190
serglyvalprotyrargpheserglyserglyserglythrglutyr
195200205
thrleuthrilesersermetglnprogluaspphealathrtyrtyr
210215220
cysglnglntrpserserasnproleuthrpheglyglyglythrlys
225230235240
valgluilelys
<210>47
<211>244
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>47
glnvalglnleuvalglnserglyalagluleulyslysproglyala
151015
servallysvalsercyslysalaserglytyrthrphethrargtyr
202530
thrmethistrpvalargglnalaproglyglncysleuglutrpmet
354045
glytyrileasnproserargglytyrthrasntyrasnglnlysphe
505560
lysasplysalathrleuthralaasplysserthrserthralatyr
65707580
metgluleuargserleuargseraspaspthralavaltyrtyrcys
859095
alaargtyrtyraspasphistyrserleuasptyrtrpglyglngly
100105110
thrleuvalthrvalserseralaserglyglyglyglyserglygly
115120125
glyglyserglyglyglyglyseralaglyaspileglnleuthrgln
130135140
serproserileleuseralaservalglyaspargvalthrilethr
145150155160
cysargalaserserservalsertyrmetasntrptyrglnglnlys
165170175
proglylysalaprolysargtrpiletyraspthrserlysvalala
180185190
serglyvalprotyrargpheserglyserglyserglythrglutyr
195200205
thrleuthrilesersermetglnprogluaspphealathrtyrtyr
210215220
cysglnglntrpserserasnproleuthrpheglycysglythrlys
225230235240
valgluilelys
<210>48
<211>248
<212>prt
<213>人工
<220>
<223>组合的vh/vl
<400>48
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglytyrserphethrglytyr
202530
thrmetasntrpvalargglnalaproglylyscysleuglutrpval
354045
alaleuileasnprotyrlysglyvalthrthrtyralaaspserval
505560
lysglyargphethrileservalasplysserlysasnthralatyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alaargserglytyrtyrglyaspserasptrptyrpheaspvaltrp
100105110
glyglnglythrleuvalthrvalserseralaserglyglyglygly
115120125
serglyglyglyglyserglyglyglyglyseralaglyaspilegln
130135140
metthrglnserproserserleuseralaservalglyaspargval
145150155160
thrilethrcysargalaserglnaspileargasntyrleuasntrp
165170175
tyrglnglnlysproglylysalaprolysleuleuiletyrtyrthr
180185190
serargleugluserglyvalproserargpheserglyserglyser
195200205
glythrasptyrthrleuthrileserserleuglnprogluaspphe
210215220
alathrtyrtyrcysglnglnglyasnthrleuprotrpthrphegly
225230235240
cysglythrlysvalgluilelys
245
<210>49
<211>480
<212>prt
<213>人工
<220>
<223>含有tb535c的链的ch1
<400>49
gluvalglnleuglnglnserglyproaspleuvallysproglyala
151015
servallysilesercyslysalaserglytyrserphethrglytyr
202530
tyrmethistrpvallysglnserproglylysglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysasplysalathrleuthrvalasplysserserthrthralatyr
65707580
metgluleuargserleuthrsergluaspseralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrservalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaproserserlysserthrserglyglythralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrglnthrtyrilecysasnvalasnhislys
195200205
proserasnthrlysvalasplyslysvalgluprolyssercysasp
210215220
lysthrhisthrglyproglyglyglyserproglyglnvalglnleu
225230235240
valglnserglyalagluleulyslysproglyalaservallysval
245250255
sercyslysalaserglytyrthrphethrargtyrthrmethistrp
260265270
valargglnalaproglyglncysleuglutrpmetglytyrileasn
275280285
proserargglytyrthrasntyrasnglnlysphelysasplysala
290295300
thrleuthralaasplysserthrserthralatyrmetgluleuarg
305310315320
serleuargseraspaspthralavaltyrtyrcysalaargtyrtyr
325330335
aspasphistyrserleuasptyrtrpglyglnglythrleuvalthr
340345350
valserseralaserglyglyglyglyserglyglyglyglysergly
355360365
glyglyglyseralaglyaspileglnleuthrglnserproserile
370375380
leuseralaservalglyaspargvalthrilethrcysargalaser
385390395400
serservalsertyrmetasntrptyrglnglnlysproglylysala
405410415
prolysargtrpiletyraspthrserlysvalalaserglyvalpro
420425430
tyrargpheserglyserglyserglythrglutyrthrleuthrile
435440445
sersermetglnprogluaspphealathrtyrtyrcysglnglntrp
450455460
serserasnproleuthrpheglycysglythrlysvalgluilelys
465470475480
<210>50
<211>470
<212>prt
<213>人工
<220>
<223>含有tb535c的链的cl
<400>50
serilevalmetthrglnthrprothrserleuleuvalseralagly
151015
aspargvalthrilethrcyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnserprolysleuleuile
354045
sertyrthrserserargtyralaglyvalproaspargphesergly
505560
serglytyrglythraspphethrleuthrileserservalglnala
65707580
gluaspalaalavaltyrphecysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelysargthrvalalaala
100105110
proservalpheilepheproproseraspgluglnleulyssergly
115120125
thralaservalvalcysleuleuasnasnphetyrproarggluala
130135140
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
145150155160
gluservalthrgluglnaspserlysaspserthrtyrserleuser
165170175
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
180185190
alacysgluvalthrhisglnglyleuserserprovalthrlysser
195200205
pheasnargglyglucysglyproglyglyglyserproglygluval
210215220
glnleuvalglnserglyproaspaspvallysproglyglyserval
225230235240
lysilesercyslysalaserglytyrserphethrglytyrtyrmet
245250255
histrpvallysglnserproglylyscysleuglutrpileglyarg
260265270
ileasnproasnasnglyvalthrleutyrasnglnlysphelysasp
275280285
lysalathrleuthrvalasplysserserthrthralatyrmetglu
290295300
leuargserleuthrsergluaspseralavaltyrtyrcysalaarg
305310315320
serthrmetilethrasntyrvalmetasptyrtrpglyglnglythr
325330335
leuvalthrvalserseralaserglyglyglyglyserglyglygly
340345350
glyserglyglyglyglyseralaglyaspilevalmetthrglnthr
355360365
prothrserleuleuvalseralaglyaspargvalthrilethrcys
370375380
lysalaserglnservalserasnaspvalalatrptyrglnglnlys
385390395400
proglyglnserprolysleuleuilesertyrthrserserargtyr
405410415
alaglyvalproaspargpheserglyserglytyrglythraspphe
420425430
thrleuthrileserservalglnalagluaspalaalavaltyrphe
435440445
cysglnglnasptyrasnserproprothrpheglycysglythrlys
450455460
leugluilelyssergly
465470
<210>51
<211>482
<212>prt
<213>人工
<220>
<223>含有tb535h的链的ch1
<400>51
glnvalglnleuvalglnserglyalagluvallyslysproglyala
151015
servallysvalsercyslysalaserglytyrserphethrsertyr
202530
tyrmethistrpvallysglnserproglyglnglyleuglutrpile
354045
glyargileasnproasnasnglyvalthrleutyrasnglnlysphe
505560
lysaspargvalthrmetthrargaspthrserileserthralatyr
65707580
metgluleuserargleuargseraspaspthralavaltyrtyrcys
859095
alaargserthrmetilethrasntyrvalmetasptyrtrpglygln
100105110
glythrleuvalthrvalserseralaserthrlysglyproserval
115120125
pheproleualaproserserlysserthrserglyglythralaala
130135140
leuglycysleuvallysasptyrpheprogluprovalthrvalser
145150155160
trpasnserglyalaleuthrserglyvalhisthrpheproalaval
165170175
leuglnserserglyleutyrserleuserservalvalthrvalpro
180185190
serserserleuglythrglnthrtyrilecysasnvalasnhislys
195200205
proserasnthrlysvalasplyslysvalgluprolyssercysasp
210215220
lysthrhisthrglyproglyglyglyserproglyglnvalglnleu
225230235240
valglnserglyalagluleulyslysproglyalaservallysval
245250255
sercyslysalaserglytyrthrphethrargtyrthrmethistrp
260265270
valargglnalaproglyglncysleuglutrpmetglytyrileasn
275280285
proserargglytyrthrasntyrasnglnlysphelysasplysala
290295300
thrleuthralaasplysserthrserthralatyrmetgluleuarg
305310315320
serleuargseraspaspthralavaltyrtyrcysalaargtyrtyr
325330335
aspasphistyrserleuasptyrtrpglyglnglythrleuvalthr
340345350
valserseralaserglyglyglyglyserglyglyglyglysergly
355360365
glyglyglyseralaglyaspileglnleuthrglnserproserile
370375380
leuseralaservalglyaspargvalthrilethrcysargalaser
385390395400
serservalsertyrmetasntrptyrglnglnlysproglylysala
405410415
prolysargtrpiletyraspthrserlysvalalaserglyvalpro
420425430
tyrargpheserglyserglyserglythrglutyrthrleuthrile
435440445
sersermetglnprogluaspphealathrtyrtyrcysglnglntrp
450455460
serserasnproleuthrpheglycysglythrlysvalgluilelys
465470475480
sergly
<210>52
<211>470
<212>prt
<213>人工
<220>
<223>含有tb535h的链的cl
<400>52
aspilevalmetthrglnserproaspserleualavalserleugly
151015
gluargalathrileasncyslysalaserglnservalserasnasp
202530
valalatrptyrglnglnlysproglyglnproprolysleuleuile
354045
tyrtyrthrserserargtyralaglyvalproaspargphesergly
505560
serglyserglythraspphethrleuthrileserserleuglnala
65707580
gluaspvalalavaltyrtyrcysglnglnasptyrasnserpropro
859095
thrpheglyglyglythrlysleugluilelysargthrvalalaala
100105110
proservalpheilepheproproseraspgluglnleulyssergly
115120125
thralaservalvalcysleuleuasnasnphetyrproarggluala
130135140
lysvalglntrplysvalaspasnalaleuglnserglyasnsergln
145150155160
gluservalthrgluglnaspserlysaspserthrtyrserleuser
165170175
serthrleuthrleuserlysalaasptyrglulyshislysvaltyr
180185190
alacysgluvalthrhisglnglyleuserserprovalthrlysser
195200205
pheasnargglyglucysglyproglyglyglyserproglyglnval
210215220
glnleuvalglnserglyalagluvallyslysproglyalaserval
225230235240
lysvalsercyslysalaserglytyrserphethrsertyrtyrmet
245250255
histrpvallysglnserproglyglncysleuglutrpileglyarg
260265270
ileasnproasnasnglyvalthrleutyrasnglnlysphelysasp
275280285
argvalthrmetthrargaspthrserileserthralatyrmetglu
290295300
leuserargleuargseraspaspthralavaltyrtyrcysalaarg
305310315320
serthrmetilethrasntyrvalmetasptyrtrpglyglnglythr
325330335
leuvalthrvalserseralaserglyglyglyglyserglyglygly
340345350
glyserglyglyglyglyseralaglyaspilevalmetthrglnser
355360365
proaspserleualavalserleuglygluargalathrileasncys
370375380
lysalaserglnservalserasnaspvalalatrptyrglnglnlys
385390395400
proglyglnproprolysleuleuiletyrtyrthrserserargtyr
405410415
alaglyvalproaspargpheserglyserglyserglythraspphe
420425430
thrleuthrileserserleuglnalagluaspvalalavaltyrtyr
435440445
cysglnglnasptyrasnserproprothrpheglycysglythrlys
450455460
leugluilelyssergly
465470
- 还没有人留言评论。精彩留言会获得点赞!