博来霉素衍生物6’-脱羟基-BLMS的高产菌株的制作方法
本发明属于生物医药
技术领域:
,具体涉及通过对产生新型活性博来霉素衍生物6’-脱羟基-BLMS(天赐博星)的原始菌种SB9026(保藏号CCTCCM2011292)进行基于紫外和核糖体工程诱变的菌种进化,最终筛选获得6’-脱羟基-BLMS(天赐博星)的高产菌株。
背景技术:
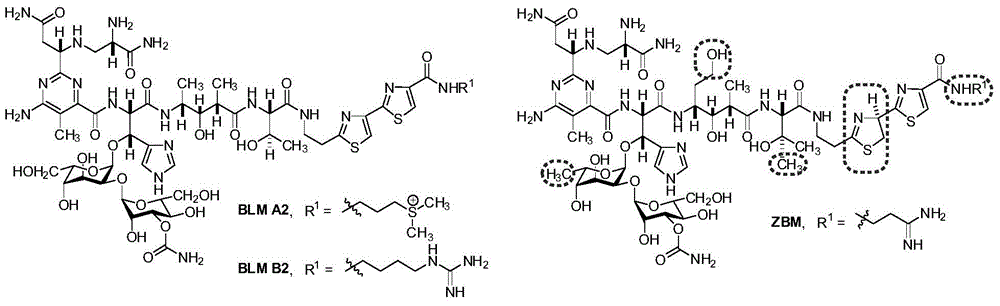
:博来霉素(Bleomycin,英文简字BLM)是20世纪60年代从轮枝链霉菌(Streptomycesverticillus)的发酵产物中分离发现的一类糖肽类抗肿瘤抗生素。目前已有十余种博来霉素天然组分被发现,它们的结构仅在末端胺基上存在差异,其中主要成分为博来霉素A2(55%~70%)和博来霉素B2(25%~32%)。佐伯霉素(Zorbamycin,英文简字ZBM)是由黄绿链霉菌(Streptomycesflavoviridis)合成的博来霉素族抗生素,其分子结构与博来霉素极为相似,主要差别在于佐伯霉素中的末端胺基支链不同,第一个噻唑啉/噻唑的氧化程度不同,多肽骨架中存在β-羟基化-L-缬氨酸和L-高丝氨酸结构部分,糖基部分为2-O-(3-O-氨基甲酰-甘露糖基)-6-脱氧-L-古洛糖(如图1所示)。相应的,在佐伯霉素生物合成基因簇(zbm)的40个开放阅读框(ORF)中,仅有22个显示出与对应博来霉素生物合成基因簇(blm)开放阅读框的同源性,其它开放阅读框的不同很可能导致了上述两种化合物的结构差异。博来霉素有独特的分子结构和生物活性,能够介导激活氧分子,并选择性地引起单链和双链DNA的断裂从而抑制肿瘤细胞DNA合成和复制。此外,博来霉素还可以选择性地裂解RNA从而抑制蛋白质的合成。博来霉素的活性机理决定了其不会抑制骨髓造血系统和免疫系统,因此对人体白细胞,机体免疫功能和造血系统等的副作用较为轻微。博来霉素属于细胞周期非特异性药物,从上世纪80年代起被开发成为一种重要的有效抗肿瘤药物,在临床上广泛应用。以BLMA2和B2为主要成分的商品药就被用于治疗睾丸癌,同时还广泛应用于霍奇金淋巴瘤、鳞状上皮细胞癌、生殖细胞瘤和其他肿瘤的治疗。但是博来霉素能增加活性氧分子从而导致细胞的氧化压力,并诱导肺中的上皮和非上皮细胞的衰老和凋亡最终导致肺纤维化。因此博来霉素导致的剂量依赖性肺纤维化以及一些肿瘤细胞逐渐形成的耐药性极大地限制了其临床应用和推广。获得新型的高效低毒的博来霉素族衍生物一直都是开发博来霉素类抗肿瘤药物的重点。博来霉素复杂的分子结构使得通过传统的化学全合成方法来获取其相关衍生物的过程及其繁琐且效率低下,无法满足临床研究的需要和工业化生产的应用,并且合成的博来霉素衍生物也并未展示出更好的活性或更低的毒性。新兴的组合生物合成方法通过遗传操纵次代谢产物生物合成基因来获取目标天然产物衍生物,是一种非常有应用前景的高新技术。专利授权号201110276318.9,从佐伯霉素的原始高产菌株黄绿链霉菌SB9001出发,应用基因重组技术将黄绿链霉菌SB9001中的zbmVIII基因完全失活后得到不生产佐伯霉素的黄绿链霉菌突变株,然后以该突变株作为异源宿主,将包含完整博来霉素生物合成基因簇(blm基因簇)的人造细菌染色体质粒blm1-6E转入其中获得黄绿链霉菌重组工程菌SB9026(保藏号CCTCCM2011292)。从该重组工程菌的发酵培养产物中我们成功得到一种新型博来霉素衍生物6’-脱羟基-BLMS(天赐博星),并且初步生物活性测试表明6’-脱羟基-BLMS的DNA裂解活性至少是BLMA2的10倍以上。这说明在更少用量的条件下,6’-脱羟基-BLMS比目前临床使用的任何一种博来霉素类抗癌药物的毒性都要低,因此作为迄今为止发现的最有效的博来霉素衍生物,6’-脱羟基-BLMS很有希望成为博来霉素族化合物中的新型抗癌药物。但是,6’-脱羟基-BLMS在黄绿链霉菌重组工程菌SB9026中的发酵产率极低,并且还有伴随的副产物BLMS产生,两者产量相当,总产量仅为10mg/L左右,其中6’-脱羟基-BLMS为5mg/L左右。专利申请号2013100594560,通过单一菌落分离和菌种选育筛选出稳定高产的SB9026发酵用菌株,并采取单因素和多元响应面等方法来优化发酵制备时所需的种子培养基和发酵培养基。在此基础上,在15L发酵罐中通过对温度、转速、pH值控制及原料补充控制等调控手段来调试和建立放大规模的6’-脱羟基-BLMS的微生物发酵制备工艺,其发酵产率最终可达30mg/L左右,虽有所提高但仍无法满足应用研究的需要。要推动6’-脱羟基-BLMS后继的抗癌活性分析、作用机理等临床前期以及新药开发研究,就必需获得足量的6’-脱羟基-BLMS。因此,进一步获得稳定的6’-脱羟基-BLMS高产菌株无论是从现阶段研究的需要,还是将来工业化应用的需求,都迫在眉睫。技术实现要素:针对以上现有技术的不足,本发明提供了一种新型活性博来霉素衍生物6’-脱羟基-BLMS的高产菌株G-4F12,该菌株已于2015年12月11日在武汉的中国典型培养物保藏中心保藏,保藏号为CCTCCM2015738,分类命名为StreptomycesflavoviridisG-4F12。该菌株是通过对产生活性博来霉素衍生物6’-脱羟基-BLMS(天赐博星)的原始菌种SB9026(保藏号CCTCCM2011292)进行基于紫外诱变和核糖体工程的菌种进化,最终筛选而得的菌株。制备上述菌株的具体步骤如下:1)黄绿链霉菌SB9026(保藏号CCTCCM2011292)的紫外诱变;2)黄绿链霉菌SB9026的核糖体工程诱变;3)黄绿链霉菌SB9026的生物活性高通量筛选;4)黄绿链霉菌SB9026的紫外/核糖体工程双重诱变及筛选。本发明通过紫外和核糖体工程双重诱变及高通量生物活性筛选获得稳定的6’-脱羟基-BLMS高产菌株,提高了6’-脱羟基-BLMS的发酵产率,发酵产率与原始产量相比提高了2倍以上。附图说明图1为博来霉素(BLM)和佐伯霉素(ZBM)的化学结构,虚线圈标示为两者结构差异之处;图2为黄绿链霉菌SB9026的生物活性高通量筛选。具体实施方式下面结合实施例进一步解释和说明本发明,以下所有百分含量均指质量百分含量。实施例1:黄绿链霉菌SB9026的紫外诱变将黄绿链霉菌SB9026接种至固体生长培养基(所述固体生长培养基为:10g/L可溶性淀粉、1g/LMgSO4·7H2O、1g/LK2HPO4、4g/LMgCl2、2g/L(NH4)2SO4、2g/LCaCO3、1g/L胰蛋白胨、0.5g/L酵母粉、0.001g/LMnCl2·7H2O、0.001g/LFeSO4·7H2O、20g/L琼脂,pH=7.0)斜面上,在30℃恒温条件下培养10天左右,用无菌的20%甘油收集孢子。收集的混合液体经振荡打散后用无菌的砂芯漏斗过滤,并通过平板稀疏涂布进行孢子计数,最终制成均一的、浓度为108个/mL的孢子悬浮液。将孢子悬浮液稀释到浓度为106个/mL,取5mL加入到直径为60mm的无菌玻璃培养皿中,将紫外灯调节至距离培养皿12cm处,在UV254nm波长条件下边搅拌边照射不同时间间隔(3分钟至8分钟不等,每30秒递增)。将经紫外照射后的孢子悬浮液按100μL/块接种至固体平板培养基(直径90mm)上,每个不同的照射时间分别接种3块平行平板,在30℃暗室条件下培养5天后计数,计算紫外照射致死率,最终确定UV254nm,距离12cm条件下,紫外致死率99.99%的照射时间为6分钟,并以此为黄绿链霉菌SB9026的紫外诱变条件。实施例2:黄绿链霉菌SB9026的核糖体工程诱变分别配制浓度为100mg/mL的链霉素(SS)、利福霉素(Rif)和庆大霉素(Gen)母液,其中SS和Gen用去离子超纯水溶解,Rif用二甲基亚砜(DMFO)溶解,并用0.22μm的无菌针头过滤器进行过滤除菌。分别配置含不同浓度抗生素的固体生长培养基平板(表1),每种浓度各3块平行。然后将SB9026的孢子悬浮液稀释至106个/mL,按100μL/块接种至相应的抗生素平板上,在30℃恒温条件下培养5-7天后计数,分别确定不同抗生素的最小抑菌浓度(MIC)。最终确定Gen的MIC为30mg/L,SS的MIC为50mg/L,Rif的MIC为10mg/L。表1.不同浓度的抗生素确定MICGen5mg/L10mg/L30mg/L50mg/L100mg/LSS5mg/L10mg/L30mg/L50mg/L100mg/LRif5mg/L10mg/L30mg/L50mg/L100mg/L实施例3:黄绿链霉菌SB9026的生物活性高通量筛选如图2所示,将挑选的黄绿链霉菌SB9026或相关突变菌株的单菌落分别平行接种至96孔板固体生长培养基和96孔板固体发酵培养基中,300μL培养基/孔,固体发酵培养基为:15g/L可溶性淀粉、15g/L葡萄糖、20g/L黄豆饼粉、2.5g/LNaCl、0.05g/LMnCl2、3g/LCaCO3、5g/L酵母粉、0.05g/LCuSO4·5H2O、0.5g/LZnSO4·7H2O、10g/L琼脂,pH=7.0。将接种的96孔板于30℃恒温培养10天后,挑选对应单菌落的琼脂块,放置于打孔的LB平板(直径90mm)上,以耻垢分枝杆菌(MycobacteriumSmegmatis)ATCC607为生物活性测试指示菌,将1mLOD600为1.0左右的ATCC607菌液与5mLLB软琼脂培养基(标准LB培养基,琼脂用量由20g/L降为8g/L)混合均匀后倾倒在置有待筛选单菌落琼脂块的LB平板上,待其凝固后于37℃恒温培养过夜,以原始菌株为参照,通过测量对应单菌落琼脂块的抑菌圈大小来快速筛选潜在的6’-脱羟基-BLMS高产菌株,并对获得的高产菌株进行摇瓶发酵培养和HPLC代谢产物分析,进一步确认其6’-脱羟基-BLMS的发酵产率。实施例4:黄绿链霉菌SB9026的紫外/核糖体工程双重诱变及筛选针对每一种抗生素的紫外/核糖体工程双重诱变,将5mLSB9026孢子悬浮稀释液(106个/mL)加入到60mm培养皿中,在UV254nm距离12cm条件下边搅拌边照射6分钟,随后将紫外诱变后的孢子悬浮液按100μL/块分别接种至相应浓度(0.5倍MIC和2倍MIC)的抗生素平板上,每种抗生素浓度平行接种20块平板,同时还接种至10块不含抗生素的平板作为参照,每一组抗生素筛选对象共计50块平板。将三组抗生素筛选对象在30℃恒温条件下暗室培养7-8天后挑选所有存活单菌落。如表2所示,所有参照组(仅发生紫外诱变)中共挑选192个单菌落,其中具有生物活性的27株,抑菌圈大于原始菌SB9026的5株。Gen组在0.5倍MIC(15mg/L)浓度下共挑选381个单菌落,其中具有生物活性的210株,抑菌圈大于原始菌SB9026的17株;2倍MIC(60mg/L)浓度下仅有1个存活单菌落且无生物活性。SS组在2种不同浓度下均未发现存活菌落;Rif组仅在2倍MIC(20mg/L)浓度下发现2个存活单菌落且无生物活性。将获得的共计22株潜在高产菌株进行摇瓶发酵验证,通过对发酵液中代谢产物的HPLC分析挑选出包括G-2E2、G-2G5、G-3A1、G-3B2和G-4F12在内的5株突变菌,其6’-脱羟基-BLMS产量相对于原始菌SB9026有明显提高,其中G-4F12的6’-脱羟基-BLMS摇瓶发酵产量达到52.2mg/L,与原始菌株SB9026相比产量提高了近2.3倍(表3)。表2.SB9026的紫外/核糖体工程诱变及生物活性高通量筛选结果汇总表3.潜在的高产突变株与原始菌株SB9026的天赐博星产量对比菌种编号天赐博星产量mg/L菌种编号天赐博星产量mg/LSB902622.3G-2E244.1G-2G528.9G-3A139.4G-3B233.1G-3F118.7G-4F1252.2当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1