一种生物酶法合成(R)-2-羟酸的方法与流程
本发明涉及一种(R)-2-羟酸的制备方法,特别涉及一种利用单菌双质粒三酶共表达串联氧化还原级联体系催化外消旋2-羟酸生产(R)-2-羟酸的方法。
(二)
背景技术:
2-羟基羧酸类化合物(2-hydroxy acids)是一类具有相似结构的化合物,它们的结构特点是其羧基侧C1位有一个羟基。2-羟基羧酸由于其同时具有酮基和羟基两个官能团,性质十分活跃。光学纯2-羟酸类手性模块是重要的精细化工中间体和手性药物前体,2-羟基酸对映体还是重要的手性拆分剂和手性催化剂,以α-羟基酸为催化剂,可以将脂肪族和芳香族醛不对称转化为相应的手性醇。具有光学活性的2-羟基酸已成为研究的热点,如代表性的苹果酸、扁桃酸、邻氯扁桃酸、对氯扁桃酸、苯基乳酸等都是合成重要医药的关键中间体。2-羟酸其R型和S型的结构式如下:
光学活性的2-羟酸是一种极为重要的药物中间体:如R-(-)-扁桃酸广泛地应用于多种药物的合成,如头孢菌素,青霉素,抗肿瘤制剂,抗肥胖药物、光学纯的氨基酸、血管紧张肽转化酶抑制剂、辅酶A、氯吡格雷等。研究表明,单一构型的扁桃酸所合成的药物与外消旋的扁桃酸或其衍生物合成的药物相比,不仅药效更高,更关键的是副作用下降了,因此在许多药物合成方面应用必须要求是单一型化合物;光学活性的扁桃酸还可以用作手性溶剂,用于多种不对称合成反应;光学活性的扁桃酸由于具有很好的生物分解性,是目前最受瞩目的酸性光学拆分剂,可使多数外消旋胺类和氨基酸类以非对映体异构盐形成进行光学拆分,如治咳药甲吗南的中间体八氢异喳琳衍生物可由R-扁桃酸拆分,对醇胺类药物也具有很好的拆分效果,以其为拆分剂的药物盐酸舍曲林在国际上就有30亿美金的市场。以(R)-邻氯扁桃酸为中间体的抗血小板聚集药物氯吡格雷居全球最畅销药品排行榜第二位;(R)-间氯扁桃酸是制备吗啡琳药物的衍生物;(R)-对氯扁桃酸是新型卵菌纲病害杀菌剂双炔酰菌胺的原料物质;(R)-2,4-二氟扁桃酸是控制体重的苯乙醇胺类药物的重要中间体。苯基乳酸是一些重要的化学合成物前体,并广泛应用于医药、化工、生物合成等领域。近几年来,它作为一种新型的抑菌剂又受到食品行业的广泛关注。(R)-2-羟基-4-苯基丁酸是抗高血压首选药-普利类药物合成的重要原料。
据不完全统计,目前国际市场上光学活性的2-羟酸需求约以年均10%以上的速度增长,已成为国际热点的重大化工产品;光学活性的2-羟酸作为一种高附加值的物质,其应用非常广泛、且市场需求量大,其制备越来越受到重视。
手性化合物在人们生活中具有重要作用,由于两个対映体在药理、毒理及功能作用等各方面均有所不同,因此,制备光学纯的手性化合物在医药、农业、材料和环保等领域都具有广泛的价值。目前,光学活性2-羟酸的获取主要采用化学拆分法和生物催化法两种。
化学拆分法主要包括非对映体盐结晶拆分法、色谱拆分法、手性萃取拆分法,毛细管电泳拆分法。
①非对映体盐结晶拆分法,面临的共同的问题就是价格昂贵,且有一定的毒性,在一定程度上造成了资源浪费和环境污染,目前我国规模化生产的R-扁桃酸均采用该方法生产。
②色谱拆分法,该法设备费用太高,消耗大,成本太高,处理量小,因此仅限于检测以及实验室制备,无法用于商业生产。
③手性萃取拆分法,手性萃取分离法是近几年才提出的手性分离方法,离商业化生产还有很大的距离。
④毛细管电泳拆分法,因具有高效、快速、经济等特点,广泛应用于各种药物对映体的分离,该方法就有成本高等缺点。
生物催化法被认为是手性化合物生产取得突破的关键技术,因此利用生物催化制备光学纯扁桃酸及其衍生物已成为国内外研究的热点。生物催化法又分为酶法拆分,不对称还原法,氧化还原法。
①酶法拆分,酶法拆分是动力学拆分方法的一种,最常用的就是通过降解外消旋体中一种对映体,而留下另一种构型,来达到拆分目的,由于该方法通过选择性降解其中一种构型而得到所需的对映体,因此转化率受到限制,无法超越50%,具有一定的局限性。另外,还有利用脂肪酶拆分邻氯扁桃酸酯得到单一构型的酯化物,然后通过水解方法获得光学纯的邻氯扁桃酸,但是该方法步骤繁琐,不适用于工业化应用。
②不对称还原法,利用微生物体内具有的立体选择性酶通过不对称还原法将潜手性的化合物还原成光学纯的单一对映体。该法的优点是理论产率高,操作简单等,缺点是该反应过程一般需要添加辅酶,辅酶价格昂贵,大大增加生产成本,不利于工业化应用。
③氧化还原法,以外消2-羟酸作为原料,利用具对映体选择性的脱氢酶氧化,羰基还原酶还原制备单一构型的扁桃酸及其衍生物。该法节约时间,省去中产物的提取或纯化,还有可能降低可逆反映向底物方向进行。是最具有价值的手性2-羟酸获取方法。
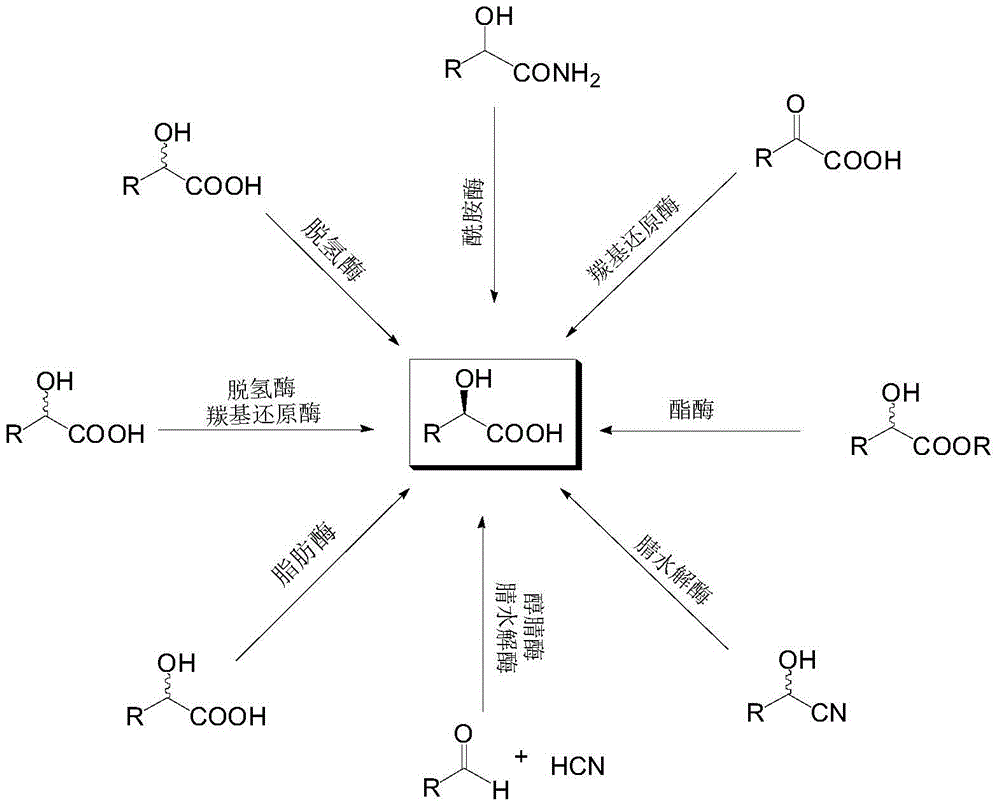
目前通过生物催化法获取2-羟酸的途径如图1所示。
(三)
技术实现要素:
本发明目的是提供一种单菌双质粒三酶串联氧化还原级联体系催化外消旋2-羟酸生产手性2-羟酸的方法,采用生物催化法去消旋2-羟酸中的氧化还原法,实现把外消旋2-羟酸转化为(R)-2-羟酸的途径,该方法不仅避免多菌体的培养,降低菌体总浓度,简化反应过程,而且还明显提高了催化效率,更适合级联催化体系的工业应用。
本发明采用的技术方案是:
本发明提供一种生物酶法合成(R)-2-羟酸的方法,所述方法以重组基因工程菌经发酵培养获得的湿菌体为催化剂,以式(Ⅰ)所示外消旋2-羟酸为底物,以葡萄糖为辅助底物,以pH6.0~9.0缓冲液为反应介质构成反应体系(即三酶共表达系统),在20~50℃(优选35℃)、150rpm条件下进行转化反应,反应完全后,将反应液分离纯化,获得(R)-2-羟酸;所述重组基因工程菌为含2-羟酸脱氢酶HADH基因、羰基还原酶KAR基因和葡萄糖脱氢酶GDH基因的重组大肠杆菌;所述2-羟酸脱氢酶HADH基因编码氨基酸序列为SEQ ID NO.2、SEQ ID NO.4、SEQ ID NO.6、SEQ ID NO.8或SEQ ID NO.10之一所示;优选SEQ ID NO.4和SEQ ID NO.8之一所示;
式(Ⅰ)中:m(R)表示m个R基团,R为羟基、卤素或C1~C4烷基,m为0~2正整数;n为0~5个CH2;优选m为0时,R为H,n为0,1或2;m为1时,R为2-F、4-F、2-Cl、3-Cl、4-Cl、2-Br、3-Br、4-Br、4-CH3、4-CF3、3-OH、4-OH、4-OCH3或3-OCH3-4-OH,n为0;m为2时,R为2,4-F或3,5-F,n为0。
进一步,所述2-羟酸脱氢酶HADH基因的核苷酸序列为SEQ ID NO.1、SEQ ID NO.3、SEQ ID NO.5、SEQ ID NO.7或SEQ ID NO.9之一所示。
进一步,所述羰基还原酶KAR基因的核苷酸序列为SEQ ID NO.11所示。
进一步,所述葡萄糖脱氢酶GDH基因的核苷酸序列为SEQ ID NO.13所示。
进一步,所述反应体系中,催化剂的用量以湿菌体重量计为20-60g/L(优选40g/L),底物终浓度为10-30mM(优选20mM),辅助底物终浓度为10-50mM(优选30mM)。
进一步,所述重组基因工程菌按如下方法制备:将2-羟酸脱氢酶HADH基因连到表达载体pET28b构建质粒pET28b-HADH,再将羰基还原酶KAR基因和葡萄糖脱氢酶GDH基因与表达载体pETDuet-1连接构建质粒pCDFDuet-KAR-GDH;然后将质粒pET28b-HADH和质粒pCDFDuet-KAR-GDH转入大肠杆菌,筛选阳性克隆,获得含2-羟酸脱氢酶HADH基因、羰基还原酶KAR基因和葡萄糖脱氢酶GDH基因的重组大肠杆菌。
进一步,所述重组基因工程菌发酵培养方法为:将含2-羟酸脱氢酶HADH基因、羰基还原酶KAR基因和葡萄糖脱氢酶GDH基因的重组大肠杆菌接种到含50μg/mL链霉素和50μg/mL卡那霉素的LB液体培养基中,于37℃、150转/分条件下振荡培养8~10h,获得种子液;将种子液按体积浓度2%接种量接入含50μg/mL链霉素和50μg/mL卡那霉素的LB液体培养基中,37℃、150转/分条件下振荡培养至OD600达到0.4~0.6时,加入IPTG至终浓度0.1mM,于28℃、150转/分条件下振荡培养10~12h,将发酵液离心,取沉淀用生理盐水洗涤两次,离心,收集湿菌体。
本发明以价格低廉的外消旋2-羟酸为底物,利用具有S-2-羟酸脱氢酶进行不对称氧化,得到(R)-2-羟酸和2-酮酸的混合物,再利用具有R-立体选择性羰基还原酶将其中的2-酮酸还原,最终使外消旋的2-羟酸去消旋化,得到(R)-2-羟酸,涉及手性羟酸合成原理反应式如图2所示,反应式中列出了有代表性的19种2-羟酸,本发明三酶共表达系统催化的2-羟酸底物包括但不限于这19种2-羟酸。
本发明所述反应体系为单菌双质粒三酶串联氧化还原级联体系,构建方法包括以下步骤:
(1)构建E.coll BL21(DE3)/pET28b-HADH菌株
设计引物对P1-F:GGAATTCCATATGATGATCATTTCCGCTTCCACC,P1-R:CCCAAGCTT TCAGGCGCCCAGTTCGCGGACCA
以Pseudomonas aeruginosa CCTCCM 2011394中基因组的DNA为PCR模板,进行PCR扩增,扩增产物为2-羟酸脱氢酶2-HADH基因序列(记为HADH1,核苷酸序列为SEQ ID NO.1所示,氨基酸序列为SEQ ID NO.2所示),与表达载体pET28b连接并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH1菌株。
以Pseudomonas aeruginosa CCTCC M 2011394中的2-HADH基因(即HADH1)为模板,通过基因挖掘筛选到与模板氨基酸序列同源性相差(32.67-35.15%)四条2-HADH序列HADH2、HADH3、HADH4、HADH5,分别来源于:Burkholderia xenovorans LB400(ABE35802.1),Pseudomonas putida(AAC15503.1),Pseudomonas aeruginosa strain NUST(AGM49308.1),Pseudomonas fluorescens strain EBC191(AAW79575.1)。
连接Burkholderia xenovorans LB400(ABE35802.1)中的2-羟酸脱氢酶2-HADH基因序列(记为HADH2,核苷酸序列为SEQ ID NO.3所示,氨基酸序列为SEQ ID NO.4所示)到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH2菌株。
连接Pseudomonas putida中的2-羟酸脱氢酶2-HADH基因序列(记为HADH3,核苷酸序列为SEQ ID NO.5所示,氨基酸序列为SEQ ID NO.6所示)到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH3菌株。
连接Pseudomonas aeruginosa strain NUST中的2-羟酸脱氢酶2-HADH基因序列(记为HADH4,核苷酸序列为SEQ ID NO.7所示,氨基酸序列为SEQ ID NO.8所示)到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH4菌株。
连接Pseudomonas fluorescens strain EBC191中的2-羟酸脱氢酶2-HADH基因序列(记为HADH5,核苷酸序列为SEQ ID NO.9所示,氨基酸序列为SEQ ID NO.10所示)到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH5菌株。
(2)构建E.coli BL21(DE3)/pCDFDuet-KAR-GDH菌株
设计引物对P2-F:AGGCCATGGGTAAAATCGCAATTGCCG,P2-R:AATCTCGAGGATCTCGAAGTTCTCTTGC
以Leuconostoc mesenteroides CCTCC M 2016063(肠膜明串珠菌(Leuconostoc mesenteroides)ZJB161保藏于中国典型培养物保藏中心,保藏日期为2016年1月25日,保藏编号为CCTCC M 2016063,保藏地址为中国武汉武汉大学,邮编430072)中基因组的DNA为PCR模板,进行PCR扩增,扩增产物为羰基还原酶KAR基因序列Seq-KAR(核苷酸序列为SEQ ID NO.11所示,氨基酸序列为SEQ ID NO.12所示)。
设计引物对P3-F:AGGCATATGTATAATTCTCTGAAAGGG,P3-R:AGGCTCGAGTCAACCACGGCCAGCCTG
以Exiguobacterium sibiricum中基因组的DNA为PCR模板,进行PCR扩增,扩增产物为葡萄糖脱氢酶基因序列Seq-GDH(核苷酸序列为SEQ ID NO.13所示,氨基酸序列为SEQ ID NO.14所示)。
将Seq-KAR、Seq-GDH先后与表达载体pETDuet-1连接,构建重组质粒pCDFDuet-KAR-GDH,并转入E.coli BL21(DE3),构建E.coli BL21(DE3)/pCDFDuet-KAR-GDH菌株。
(3)构建E.coli BL21(DE3)/pET28b-HADH/pCDFDuet-KAR-GDH菌株
通过一菌双质粒的方法构建三酶表达系统,分别从菌株E.coli BL21(DE3)/pET28b-HADH1、菌株E.coli BL21(DE3)/pET28b-HADH2、菌株E.coli BL21(DE3)/pET28b-HADH3、菌株E.coli BL21(DE3)/pET28b-HADH4、菌株E.coli BL21(DE3)/pET28b-HADH5和菌株E.coli BL21(DE3)/pCDFDuet-KAR-GDH中提取质粒pET28b-HADH1、pET28b-HADH2、pET28b-HADH3、pET28b-HADH4、pET28b-HADH5和pCDFDuet-KAR-GDH,将质粒pET28b-HADH1、pET28b-HADH2、pET28b-HADH3、pET28b-HADH4、pET28b-HADH5分别与pCDFDuet-KAR-GDH按浓度比1:1混匀后,转入E.coli BL21(DE3).,分别涂布到含50μg/mL链霉素和50μg/mL卡那霉素的双抗LB平板中,筛选到含2-羟酸脱氢酶HADH基因、羰基还原酶KAR基因和葡萄糖脱氢酶GDH基因的重组大肠杆菌,分别为菌株E.coli BL21(DE3)/pET28b-HADH1/pCDFDuet-KAR-GDH、菌株E.coli BL21(DE3)/pET28b-HADH2/pCDFDuet-KAR-GDH、菌株E.coli BL21(DE3)/pET28b-HADH3/pCDFDuet-KAR-GDH、菌株E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH和菌株E.coli BL21(DE3)/pET28b-HADH5/pCDFDuet-KAR-GDH。
本发明的积极有益效果:
(1)本发明通过一菌双质粒三酶共表达系统将廉价易得的外消旋2-羟酸生物催化为有重要应用价值的R-2-羟酸,这一级联反应使得S-2-羟酸理论上完全转化为其光学对映体,成本低,绿色环保,工艺简化,适于工业化生产。
(2)本发明方法的理论转化率可达到100%,是一种环境友好、经济的R-2-羟酸单一光学对映体制备方法,其中S-2-羟酸脱氢酶、羰基还原酶及葡萄糖脱氢酶基因是分离于生物体的天然序列,或经过改造后能够在相应宿主内获得活性表达。反应体系以NADH为辅因子,葡萄糖脱氢酶可以氧化葡萄糖且产生适量NADH,维持催化反应顺序进行。
(3)本发明一菌双质粒三酶共表达系统,创新的成功实现外消旋的2-羟酸通过一个工程菌转化为单一构型的(R)-2-羟酸,避免多菌体的培养,降低菌体总浓度,简化反应过程,减少了中间产物的提取步骤,而且还明显提高了催化效率,更适合级联催化体系的工业应用。
(四)附图说明
图1为生物催化法获取2-羟酸的途径示意图。
图2为手性羟酸合成原理反应式。
图3表示(S)-2-羟酸脱氢酶基因HADH4体pET28b的连接;
图4表示羰基还原酶基因KAR和葡萄糖脱氢酶基因GDH与pETDuet-1的连接。
图5表示三酶共表达系统催化外消旋2-羟酸转化为(R)-2羟酸示意图
图6重组工程菌E.coli BL21(DE3)/pCDFDuet-KAR-GDH and E.coli BL21(DE3)/pET28b-GDH酶蛋白表达电泳分析;1.E.coli BL21(DE3)/pCDFDuet-KAR-GDH with 0.1mM IPTG;2.E.coli BL21(DE3)/pCDFDuet-KAR-GDH with 0mM IPTG;3.E.coli BL21(DE3)/pET28b-GDH with 0.1mM IPTG;4.E.coli BL21(DE3)/pET28b-GDH with 0mM IPTG;5.Empty plasmid of pET28b with 0mM IPTG.The upper arrow in lane 1 indicated KAR(~32kDa)and the lower arrow in lane 1represented GDH(~28kDa).The prominent protein band in lane 3indicated GDH(~28kDa)。
图7 E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH表达HADH4,KAR and GDH电泳分析;1.Protein molecular weight markers;2.E.coli BL21(DE3)/pET28b-HADH/pCDFDuet-KAR-GDH.with 0mM IPTG.3.E.coli BL21(DE3)/pET28b-HADH/pCDFDuet-KAR-GDH.with 0.1mM IPTG.The upper arrow indicated HADH(~42kDa),the middle arrow indicated KAR(~32kDa)and the lower arrow represented GDH(~28kDa).。
图8去消旋扁桃酸反应进程。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
构建重组菌株E.coli BL21(DE3)/pET28b-HADH1/pCDFDuet-KAR-GDH
(1)设计引物对P1-F:GGAATTCCATATGATGATCATTTCCGCTTCCACC,P1-R:CCCAAGCTT TCAGGCGCCCAGTTCGCGGACCA。以Pseudomonas aeruginosa CCTCCM 2011394中基因组的DNA为PCR模板,进行PCR扩增,PCR反应进程:95℃ 5min,95℃ 1min,57℃ 1min,72℃ 1min(30cycles);72℃ 10min,4℃ for ever。
反应体系如下:
扩增产物为2-羟酸脱氢酶2-HADH基因序列,记为HADH1(核苷酸序列为SEQ ID NO.1所示,氨基酸序列为SEQ ID NO.2所示)。PCR产物经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA回收试剂盒回收目标条带。双酶切后与表达载体pET28b连接并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH1菌株。
(2)设计引物对P2-F:AGGCCATGGGTAAAATCGCAATTGCCG,P2-R:AATCTCGAGGATCTCGAAGTTCTCTTGC。以Leuconostoc mesenteroides CCTCC M 2016063中基因组的DNA为PCR模板,进行PCR扩增,PCR反应进程:95℃ 5min,95℃ 1min,65℃ 1min,72℃ 1min(30cycles);72℃ 10min,4℃ for ever。
反应体系如下:
扩增产物为羰基还原酶KAR基因序列Seq-KAR(核苷酸序列为SEQ ID NO.11所示,氨基酸序列为SEQ ID NO.12所示)。PCR产物经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA回收试剂盒回收目标条带。
(3)设计引物对P3-F:AGGCATATGTATAATTCTCTGAAAGGG,P3-R:AGGCTCGAGTCAACCACGGCCAGCCTG。以Exiguobacterium sibiricum中基因组的DNA为PCR模板,进行PCR扩增,PCR反应进程:95℃ 5min,94℃ 50s,50℃ 1.5min,72℃ 1min(30cycles),72℃ 10min,4℃ for ever。
扩增产物为葡萄糖脱氢酶基因序列Seq-GDH(核苷酸序列为SEQ ID NO.13所示,氨基酸序列为SEQ ID NO.14所示)。PCR产物经琼脂糖凝胶电泳纯化,利用琼脂糖凝胶DNA回收试剂盒回收目标条带。
将Seq-KAR、Seq-GDH经过双酶切后先后与表达载体pETDuet-1连接,构建重组质粒pCDFDuet-KAR-GDH,参考图4。
通过一菌双质粒的方法构建三酶表达系统,将质粒pET28b-HADH1和pCDFDuet-KAR-GDH,按1:1混匀后,通过常规热激法或电击法,转入E.coli BL21(DE3)感受态中,涂布到含50μg/mL链霉素和50μg/mL卡那霉素的双抗LB平板中,筛选到E.coli BL21(DE3)/pET28b-HADH1/pCDFDuet-KAR-GDH菌株。
实施例2:
构建重组菌株E.coli BL21(DE3)/pET28b-HADH2/pCDFDuet-KAR-GDH
合成Burkholderia xenovorans LB400(ABE35802.1)中的2-羟酸脱氢酶2-HADH基因序列,记为HADH2(核苷酸序列为SEQ ID NO.3所示,氨基酸序列为SEQ ID NO.4所示),连接到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH2菌株。
重组质粒pCDFDuet-KAR-GDH的构建同实施例1,参考图2。
通过一菌双质粒的方法构建三酶表达系统,将质粒pET28b-HADH2和pCDFDuet-KAR-GDH,按1:1混匀后,通过常规热激法或电击法,转入E.coli BL21(DE3)感受态中,涂布到含链霉素和卡那霉素的双抗平板中,筛选到E.coli BL21(DE3)/pET28b-HADH2/pCDFDuet-KAR-GDH菌株,操作同实施例1。
实施例3:
构建重组菌株E.coli BL21(DE3)/pET28b-HADH3/pCDFDuet-KAR-GDH
合成Pseudomonas putida中的2-羟酸脱氢酶2-HADH基因序列,记为HADH3(核苷酸序列为SEQ ID NO.5所示,氨基酸序列为SEQ ID NO.6所示),连接到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH3菌株。
重组质粒pCDFDuet-KAR-GDH的构建同实施例1,参考图2。
通过一菌双质粒的方法构建三酶表达系统,将质粒pET28b-HADH3和pCDFDuet-KAR-GDH,按1:1混匀后,通过常规热激法或电击法,转入E.coli BL21(DE3)感受态中,涂布到含链霉素和卡那霉素的双抗平板中,筛选到E.coli BL21(DE3)/pET28b-HADH3/pCDFDuet-KAR-GDH菌株,操作同实施例1。
实施例4:
构建重组菌株E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH
合成Pseudomonas aeruginosa strain NUST中的2-羟酸脱氢酶2-HADH基因序列,记为HADH4(核苷酸序列为SEQ ID NO.7所示,氨基酸序列为SEQ ID NO.8所示),连接到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-HADH4菌株。
重组质粒pCDFDuet-KAR-GDH的构建同实施例1,参考图2。
通过一菌双质粒的方法构建三酶表达系统,将质粒pET28b-HADH4和pCDFDuet-KAR-GDH,按1:1混匀后,通过常规热激法或电击法,转入E.coli BL21(DE3)感受态中,涂布到含链霉素和卡那霉素的双抗平板中,筛选到E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH菌株,操作同实施例1。
实施例5:
构建重组菌株E.coli BL21(DE3)/pET28b-HADH5/pCDFDuet-KAR-GDH
合成Pseudomonas fluorescens strain EBC191中的2-羟酸脱氢酶2-HADH基因序列,记为HADH5(核苷酸序列为SEQ ID NO.9所示,氨基酸序列为SEQ ID NO.10所示),连接到pET28b并且转入到E.coli BL21(DE3),构建E.coll BL21(DE3)/pET28b-H ADH5菌株。
重组质粒pCDFDuet-KAR-GDH的构建同实施例1,参考图2。
通过一菌双质粒的方法构建三酶表达系统,将质粒pET28b-HADH5和pCDFDuet-KAR-GDH,按1:1混匀后,通过常规热激法或电击法,转入E.coli BL21(DE3)感受态中,涂布到含链霉素和卡那霉素的双抗平板中,筛选到E.coli BL21(DE3)/pET28b-HADH5/pCDFDuet-KAR-GDH菌株,操作同实施例1。
实施例6:静息细胞的制备
将实施例1-5构建的重组双质粒工程菌分别接种到含50μg/mL链霉素和50μg/mL卡那霉素的LB液体培养基中,于37℃摇床,转速150转/分,振荡培养8~10h作为种子液,按体积浓度2%接种量分别接入含50μg/mL链霉素和50μg/mL卡那霉素的LB液体培养基中,37℃摇床,转速150转/分,振荡培养至OD600达到0.4~0.6时,加入IPTG至终浓度0.1mM,于28℃摇床,转速150转/分,振荡培养10~12h。结束后发酵液离心,取沉淀并用生理盐水洗涤两次,离心后收集湿菌体细胞备用。
实施例7:利用5个重组工程菌去消旋外消旋扁桃酸
以外消旋扁桃酸作为基准底物,检测实施例1-5中5个重组工程菌去消旋外消旋扁桃酸的催化效率。通过实施例6的方法,获得实施例1重组工程菌E.coli BL21(DE3)/pET28b-HADH1/pCDFDuet-KAR-GDH,实施例2重组工程菌E.coli BL21(DE3)/pET28b-HADH2/pCDFDuet-KAR-GDH,实施例3重组工程菌E.coli BL21(DE3)/pET28b-HADH3/pCDFDuet-KAR-GDH,实施例4重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH和实施例5重组工程菌E.coli BL21(DE3)/pET28b-HADH5/pCDFDuet-KAR-GDH的湿菌体,以及对照只含空载质粒pET28b和pCDFDuet的菌体E.coli BL21(DE3)/pET28b/pCDFDuet的湿菌体,分别称取0.4克于50mL三角形转化瓶中,在反应体系中加入溶有底物外消旋扁桃酸20mM,辅助底物葡萄糖30mM的pH7.5的100mM的磷酸盐缓冲液10ml,氧化反应和还原反应同时进行,于35℃,150rpm水浴摇床中转化2h。
反应两个小时结束后,转化液离心去除菌体,上清液进行液相检测分析。经过检测分析,对照组中没有发生催化反应,(S)-扁桃酸没有转化为(R)-扁桃酸。实施例1重组工程菌,实施例2重组工程菌,实施例3重组工程菌,实施例4重组工程菌和实施例5重组工程菌(R)-扁桃酸的收率分别为60.2%,90.5%,73.0%,95.2%和60.4%。(R)-扁桃酸的收率均大于50%,表明工程菌构建成功。选取转化效率最高的实施例4重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH作为研究对象,去消旋19种外消旋2-羟酸酸(1a-1s)。
底物的对映体过量值(e.e.)和转化率及产物酮酸的检测采用高效液相法分析检测,具体如下:反相手性柱(型号ChirobioticTM R250×4.6mm,Sigma,USA),流动相为0.5%AcOH:CH3CN(20∶80,v/v),检测波长为215nm,进样量3μL。
e.e值的计算方法:ee(%)=(R-S)/(R+S)×100%;(R)-2-羟酸收率的计算方法:Y(%)=R/C×100%。式中R表示反应结束后(R)-2-羟酸的浓度;S表示反应结束后(S)-2-羟酸的浓度;C表示起始反应时外消旋2-羟酸的浓度。
实施例8:不同反应条件去消旋外消旋扁桃酸生产(R)-扁桃酸
通过实施例6的方法,获得实施例4重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH的湿菌体,研究菌体浓度20g/L、40g/L、60g/L,底物外消旋扁桃酸浓度10mM、20mM、30mM和辅助底物葡萄糖浓度10mM、30mM、50mM去消旋基准底物外消旋扁桃酸。反应在50mL三角瓶中进行,反应体系10mL,使用pH7.5的100mM的磷酸盐缓冲液,氧化反应和还原反应同时进行,于35℃,150rpm水浴摇床中转化2h。
反应结束后,转化液离心去除菌体,上清液采用实施例7中的检测方法进行检测分析。检测分析如下表:
实施例9:去消旋19种外消旋2-羟酸酸(1a-1s)生产(R)-2-羟酸
通过实施例6的方法,获得实施例4重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH的湿菌体,分别称取0.4克于19个50mL三角形转化瓶中,在反应体系中加入溶有底物外消旋2-羟酸20mM,辅助底物葡萄糖30mM的pH7.5的100mM的磷酸盐缓冲液10ml,氧化反应和还原反应同时进行,于35℃,150rpm水浴摇床中转化2-6h。
反应结束后,转化液离心去除菌体,上清液采用实施例7中的检测方法进行检测分析。检测分析如下表:
反应结果表明,大多数2-羟酸(1a-1c,1e-1m和1s),经过2h的反应,(R)-2-羟酸的收率达到92.7-98.5%,e.e值大于99%,1d经过4h的反应,(R)-2-羟酸的收率达到95.9%,e.e值大于99%。对于1p-1q,经过6h的反应,e.e值也大于99.9%,但是(R)-对映体的收率不高,酮酸得到大量的积累,表明反应过程中重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH中KAR对1p-1q对应的酮酸酶活不高,不能把酮酸转化成(R)-对映体,另外1q的(R)-2-羟酸的收率低于50%,酮酸的含量大于50%,表明HADH4对它的选择性氧化也较差。对于1n-1o,经过6h的反应,e.e值不高,反应体系中还有(S)-2-羟酸残留,同时(R)-对映体的收率只有35.5%和34.6%,反应结束后酮酸含量大于50%,这表明重组工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH中HADH4对1n-1o的选择性较差,氧化(s)-对映体的同时也在氧化(R)-对映体,但是对(s)-对映体的酶活大于对(R)-对映体的酶活。
单菌双质粒多酶级联体系的建立创新的成功实现外消旋的2-羟酸通过一个工程菌E.coli BL21(DE3)/pET28b-HADH4/pCDFDuet-KAR-GDH转化为单一构型的(R)-2-羟酸,尽管没有对所有的底物都表现出高收率和高选择性,但是对绝大多数2-羟酸都表现了较高的e.e值和(R)-对映体收率(大于90%),远大于对外消旋的2-羟酸拆分的最大50%的理论收率。特别是对邻氯扁桃酸(1f,收率98.2%,e.e大于99%,(R)-邻氯扁桃酸全球销售额第二药物氯吡格雷合成的重要手性砌块),4-氯扁桃酸(1h,收率97.7%,e.e大于99%,(R)-4-氯扁桃酸是新型卵菌纲病害杀菌剂双炔酰菌胺合成的重要原料),扁桃酸(1a,收率95.2%,e.e大于99%,用于光学纯氨基酸的不对称合成)等表现了较高的收率和e.e值,实现了单菌双质粒多酶级联体系把外消旋2-羟酸转化为(R)-2-羟酸的途径。
- 还没有人留言评论。精彩留言会获得点赞!